利用分子信标检测CHO核酸残留的方法及引物和试剂盒
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及分子生物学技术领域,具体指利用分子信标检测CHO核酸残留的方法及引物和试剂盒。
背景技术
生物制品中宿主细胞残留DNA具有潜在致瘤和传染风险,所以各国药品监管部门对DNA杂质的限量要求非常严格。美国药典在General Chapter<1130>介绍了三种常用技术,但将在2015年颁布的新版(USP38-NF33)中增加全新章节(General Chapter<30>)来进一步规范残留DNA检测的方法和标准物质。与1000号以上的章节不同的是,USP编号1000以内的章节详细规定了检测技术、系统适应性标准和标准物质。新版USP中将唯一推荐qPCR法作为生物制品中宿主残留DNA的标准方法。qPCR法的技术优势在于序列特异性高、灵敏度高、重现性好,可以为生物制药工业在工艺研究和成品质量控制方面提供可靠的检测手段。
CHO细胞是目前生物制品工程中广泛使用的细胞。全世界批准正式应用于人类疾病治疗或疾病预防的基因工程产品约有三十多种,根据产品需要使用不同种表达系统表达。其中CHO表达系统能准确的转录、修饰表达的蛋白,使得修饰后的蛋白在分子结构、理化特性和生物学功能上最接近于天然蛋白分子;其次,CHO细胞既可贴壁生长,又可以悬浮培养,有较高的耐受剪切力和渗透压的能力,培养体积能达到1000L以上;再次,CHO细胞具有重组基因的高效扩增和表达能力;而且CHO具有产物胞外分泌功能,并且很少分泌自身的内源蛋白,便于下游产物分离纯化。因此,CHO成为表达复杂生物大分子的理想宿主,而生物制品中残留的CHO会造成产品不合格或对人体造成危害。
为了保证生物制品的质量,对于生物制品生产中各流程进行CHO检测和监控尤为重要,这种监测一般通过检测CHO DNA残留来实现。高灵敏度的检测方法可以更好的保障生物制品的质量。
目前,常用的检测都是根据药典提供的引物进行检测,但是对于要求极低残留的环节,尤其是放行检测和重要过程检测,对于CHO DNA的检测灵敏度提出了更高的需求。为了满足以上检测需求,故急需开发一种更灵敏的检测引物探针组和检测试剂盒。
发明内容
本发明的目的是提供利用分子信标检测CHO核酸残留的方法及引物和试剂盒,以克服现有技术中的不足。
为实现上述目的,本发明采取以下技术方案:
一种检测CHO核酸残留的引物组,包括第一引物和第二引物,所述第一引物序列如SEQ ID NO.1和SEQ ID NO.2所示,所述第二引物序列如SEQ ID NO.3和SEQ ID NO.4所示。
一种检测CHO核酸残留的探针组,包括第一探针和第二探针,所述第一探针的序列如SEQ ID NO.5所示,所述第二探针的序列如SEQ ID NO.6所示。
一种检测CHO核酸残留的试剂盒,包括第一引物、第二引物、第一探针和第二探针,所述第一引物序列如EQ ID NO.1和SEQ ID NO.2所示,所述第二引物序列如SEQ ID NO.3和SEQ ID NO.4所示,所述第一探针的序列如SEQ ID NO.5所示,所述第二探针的序列如SEQID NO.6所示。
所述的试剂盒,优选地,所述第一引物和所述第二引物的加入比例为1:1。
利用分子信标检测CHO核酸残留的方法,包括如下步骤:
第一步,稀释标准品作为标准品样本DNA;
第二步,利用权利要求3所述的试剂盒对所述第一步中的标准品样本DNA进行PCR检测,得到用于CHO核酸检测的标准曲线;
第三步,对待检测的DNA样本或阳性样本,进行荧光定量PCR扩增;
第四步,对PCR扩增产物的荧光强度进行实时检测,并与所述第二步获得的所述标准曲线对照,从而测得待检测的DNA样本中CHO核酸的残留量。
所述的方法,优选地,所述第一步中PCR的扩增条件为:所述第一步中,所述标准品的稀释为10倍梯度稀释,分别为300pg、30pg、3pg、300fg、30fg和3fg。
所述的方法,优选地,所述第一步中PCR的扩增条件为:
所述的方法,优选地,所述第一步中PCR的反应体系为:反应酶混合液为12-14μL,引物组和探针组的混合物的加入量为1-3μL,DNA模板的加入量为4-6μL。
所述的方法,优选地,所述引物组的浓度200nM、所述探针组的浓度为200nM、Taq酶的浓度为1U、Mg离子浓度为3mM和dNTP的浓度为200μM。
本发明由于采取以上技术方案,其具有以下优点:组合了两套引物和探针共同进行检测,通过组合设计,提高了检测灵敏度。同时,通过研发优化的试剂配方和一体化检测试剂,对生物制品中CHO核酸残留DNA检测具有准确性强、灵敏度高、可重复性好,特异性高的特点。
附图说明
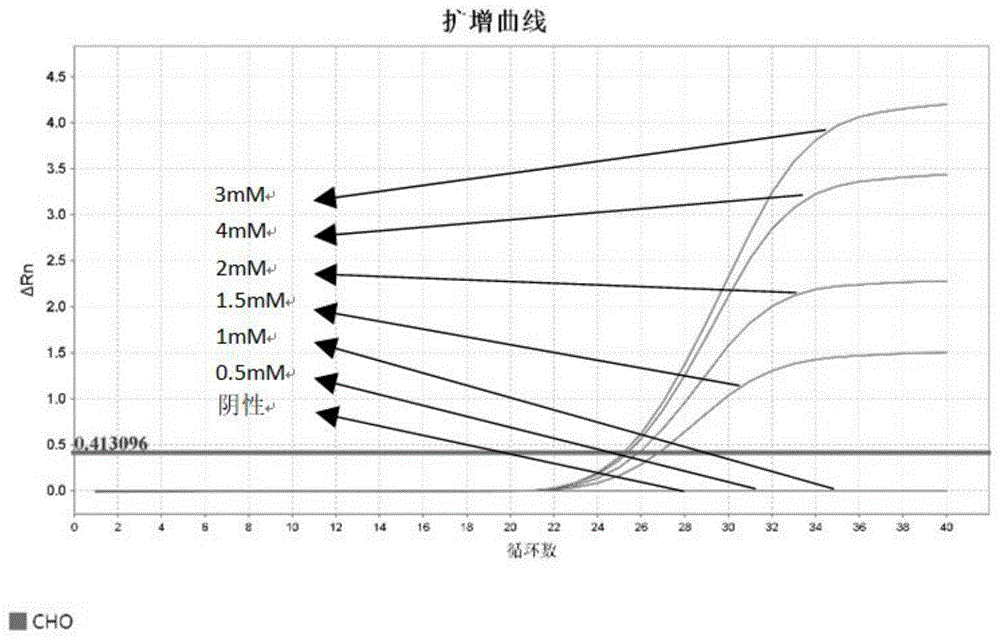
图1为不同Mg
图2为不同酶浓度对应的扩增曲线;
图3为不同dNTP浓度对应的扩增曲线;
图4为不同引物浓度对应的扩增曲线;
图5为不同探针浓度对应的扩增曲线;
图6为不同退火温度对应的扩增曲线;
图7为灵敏度检测扩增曲线;
图8为最低检出限扩增曲线;
图9为特异性检测扩增曲线;
图10为与中检院体系对比扩增曲线。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实验材料和方法:
1.特异性验证
针对此PCR反应体系,采用毕赤酵母、大肠杆菌、NS0细胞和VERO细胞残留DNA进行体系特异性验证。
2.DNA模板的准备
对检测靶标CHO细胞和其他用于特异性验证的细胞,均采用天根生化科技(北京)有限公司的通用型磁珠DNA提取试剂盒(DP307)提取,提取方法完全按照试剂盒说明书进行。提取后的基因组DNA保存在-20℃。
3.引物设计
采用CHO保守区域设计特异引物探针,靶标DNA序列见SEQ ID NO.7,引物组的序列见SEQ ID NO.1、SEQ ID NO.2和SEQ ID NO.3、SEQ ID NO.4,两组引物等比例加入,探针组的序列见SEQ ID NO.5和SEQ ID NO.6。
扩增体系为13μL反应酶混合液、2μL的引物混合液和5μL DNA模版。
4.荧光定量的条件优化
4.1荧光定量PCR的条件:
针对PCR体系和反应中以下条件进行优化,包括试剂各个组份的调整,具体包括MgCl
4.2反应体系优化:
4.2.1使用上述引物探针组进行扩增,模板为300fg,调节Mg离子浓度,测试范围分别为0.5mM、1mM、1.5mM、2mM、3mM和4mM,测试结果见图1和表1。
图1为不同Mg
表1不同Mg
使用上述引物探针组进行扩增,模板为300fg,调节酶浓度,测试范围分别为0.2U、0.4U、0.6U、1U、1.5U和2U,测试结果见图2和表2。
为不同酶浓度与荧光信号关系图,不同酶浓度ct值接近,但荧光高度有差异,我们采用了较低的浓度作为最优浓度,也就是说酶最优反应浓度选为1U。
表2不同酶浓度对应的CT值
使用上述引物探针组进行扩增,模板为300fg,调节dNTP浓度,测试范围分别为40μM、80μM、100μM、200μM、300μM和400μM,测试结果见图3和表3。
为不同dNTP浓度与荧光信号关系图,不同dNTP浓度ct值接近,但荧光高度有差异,我们采用了较低的浓度作为最优浓度,也就是说dNTP最优反应浓度选为200μM。
表3不同dNTP浓度对应的CT值
使用上述引物探针组进行扩增,模板为300fg,调节引物浓度,测试范围分别为40nM、60nM、100nM、200nM、300nMM和400nM,测试结果见图4和表4。
为不同引物浓度与荧光信号关系图,在引物浓度为200nM和300nM时ct值最小,我们采用了较低的浓度作为最优浓度,也就是说引物最优反应浓度选为200nM。
表4不同引物浓度对应的CT值
使用上述引物探针组进行扩增,模板为300fg,调节探针浓度,测试范围分别为40nM、60nM、100nM、200nM、300nM和400nM,测试结果见图5和表5。
为不同探针浓度与荧光信号关系图,不同探针浓度ct值接近,但荧光高度有差异,我们采用了较低的浓度作为最优浓度,也就是说探针的最优反应浓度选为200nM。
表5不同探针浓度对应的CT值
使用上述引物探针组进行扩增,模板为300fg,调节退火温度,测试范围分别为50℃、53℃、55℃、58℃、60℃和65℃,测试结果见图6和表6。
为不同退火温度与荧光信号关系图,不同退火温度ct值接近,但荧光高度有差异,最适退火温度选为60℃。
表6不同退火温度对应的CT值
4.2最优反应条件
引物组的浓度为200nM和探针的浓度为200nM、Mg离子浓度3mM、dNTP浓度200μM、Taq酶1U,扩增程序为预变性95℃120s,扩增95℃10s,60℃30s,40个循环,在此反应条件下,能出现最高的荧光值,最小的Ct值,阴性对照不扩增。
5.实验结果
如图7、图8、图9和图10所示,通过结果显示在测试同样浓度样本时,本发明中的CT值小于中检院序列结果,且荧光强度也明显高于,所以本发明的体系有更高的灵敏度。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 一种检测CHO细胞中Vesivirus 2117病毒污染的引物、试剂盒及方法
- 一种用于检测副猪嗜血杆菌的RPA引物、RPA探针、试剂盒及核酸检测方法
- 用于检测控制玉米茎秆强度主效QTL连锁的分子标记的引物、试剂盒、检测方法及应用
- 检测CHO核酸残留的引物、探针、试剂盒及检测方法
- 基于分子信标的2019-nCoV核酸恒温扩增引物和分子信标、试剂盒及检测方法
