一种靶向GSK3β的纳米抗体及其制备方法
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物技术领域,具体涉及一种靶向GSK3β的纳米抗体及其制备方法。
背景技术
GSK3是一种进化保守的丝氨酸-苏氨酸激酶,分为两种亚型:GSK3α、GSK3β,是葡萄糖代谢中的调节酶。GSK3功能异常与多种神经系统疾病有关,主要包括帕金森病(PD)、阿尔茨海默病(AD)、双相情感障碍(BPD)和脑卒中。GSK3β在细胞生长、发育、炎症和细胞凋亡过程中起重要作用,抑制GSK3β表现出明显的神经保护作用,是治疗神经退行性等疾病的潜在靶点。抑制GSK3β在治疗神经退行性疾病方面具有重要意义,但针对GSK3的抑制剂要么特异性不够高,要么难以区分GSK3α和GSK3β这两种同工酶,为GSK3β抑制剂的开发和应用带来了巨大的挑战。开发特异性靶向GSK3β的调控剂,从而进一步精准调控GSK3β的激酶活性,是神经退行性疾病相关机制研究和临床治疗的关键。
GSK3β底物需要预磷酸化(引发基序)或脯氨酸定向,但如何区分这两种不同的底物特征却知之甚少。本申请人前期研究发现eIF4E2通过保守基序(RLLFQNLWKPRL)与GSK3β相互作用,以激活其脯氨酸定向的激酶活性。eIF4E2的GSK3β结合基序只存在于哺乳动物中,eIF4E2/GSK3β信号通路可通过抑制细胞衰老来抵抗缺氧对组织的损伤。eIF4E2-GSK3β信号通路直接调控RNA结合蛋白Rbm38的Ser195(pro196)磷酸化和p53的多点S/T-P磷酸化。缺氧显著抑制eIF4E2和GSK3β互作,抑制GSK3βS/T-P激酶活性,继而抑制Rbm38Ser195的磷酸化和p53的多点S/T-P磷酸化。本申请人进一步发现S/T-P磷酸化可以保护肝脏免受缺氧损伤。缺氧条件下抑制该通路导致明显的衰老相关分泌表型(SASP),介导促炎因子IL-1β和IL-6的分泌增加。探究GSK3βS/T-P激酶活性在神经退行性疾病中的相关机制,并进一步开发特异性靶向GSK3βS/T-P激酶活性的调控剂,对于神经退行性疾病的治疗和预后具有重要义,且为靶向性药物开发奠定基础。
纳米抗体(Nanobody,Nb)由骆驼重链抗体的抗原结合区组成。由于纳米抗体只有常规抗体的十分之一大小,并且通常带有正电荷,纳米抗体能够与带负电荷的细胞膜融合,从而被大脑摄取。纳米抗体具有一个长且凸的抗原结合表位(CDR3),因此能更有效地通过干预蛋白互作拮抗参与信号转导的受体和中和促炎介质。纳米抗体的这些优点使其适用于干预神经退行性疾病中的氧化应激和神经炎症过程。利用纳米抗体特异性调控GSK3βS/T-P激酶活性,并进一步探究应用纳米抗体治疗神经退行性疾病的科学方案。
发明内容
本发明的目的在于克服上述技术不足,提供一种靶向GSK3β的纳米抗体及其制备方法,解决现有技术中缺乏靶向GSK3β的纳米抗体的技术问题。
为达到上述技术目的,本发明的技术方案提供一种靶向GSK3β的纳米抗体,所述纳米抗体的核酸序列如Seq ID No.1所示。
进一步地,所述纳米抗体靶向调控GSK3β的S/T-P激酶活性。
此外,本发明还提出一种分子表达载体,所述载体中含有如No.Seq ID No.1所示的核酸序列。
此外,本发明还提出一种含有上述分子表达载体的宿主细胞,所述宿主细胞包括原核细胞、酵母细胞或病毒。
进一步地,所述宿主细胞包括人胚肾细胞或者人宫颈癌细胞。
此外,本发明还提出一种上述纳米抗体的制备方法,包括以下步骤:
S1、通过同源臂引物连续扩增纳米抗体DNA文库以用于酵母转化,将纳米抗体文库序列与Aga2的C端融合,实现纳米抗体在酵母细胞表面的展示,构建多样性为10
S2、将转化后接种于液体培养基的酵母细胞接种于SD-Trp培养基中二次传代培养;
S3、取二次传代的细胞接种于SD-Trp培养基培养至OD=0.5-1,细胞重悬于SG-Trp培养基以诱导纳米抗体的表达,诱导至少36h;以GSK3β的eIF4E2结合域为抗原,偶联羧基磁珠,通过三轮磁珠筛选和三轮流式筛选得到所述纳米抗体。
与现有技术相比,本发明的有益效果包括:本发明提出的纳米抗体能够成功特异性激活GSK3β的S/T-P激酶活性。
附图说明
图1是本发明实施例1靶向调控GSK3βS/T-P激酶活性的纳米抗体筛选的结果,其中图1(a)为结合酵母展示筛选获得识别GSK3β的纳米抗体;图1(b)为筛选到的前十名GSK3β纳米抗体序列。
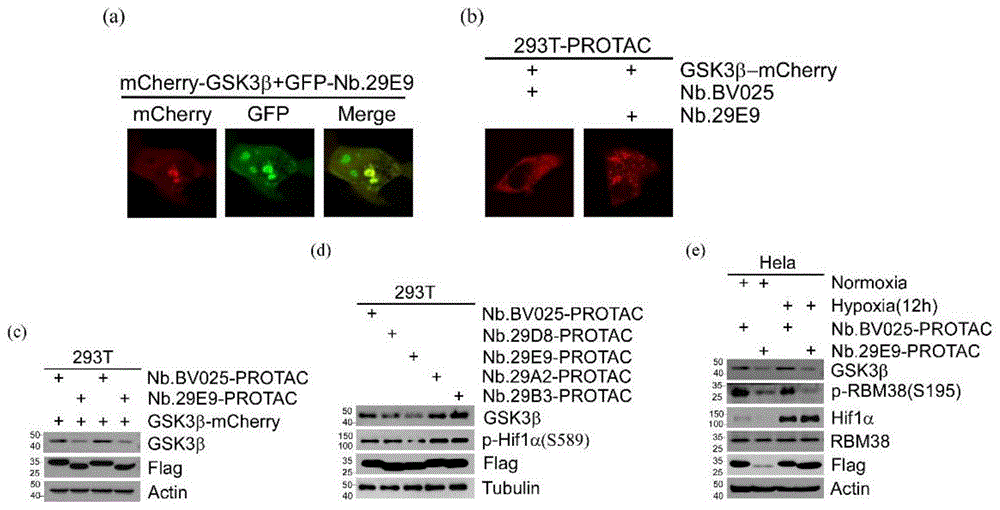
图2是本发明实施例1排列前四的纳米抗体联合bio-PROTAC系统靶向降解GSK3β的结果图;其中,图2(a)、(b)和(c)为基于调控GSK3βS/T-P激酶活性的纳米抗体构建bio-PROTAC系统,可实现细胞过表达mCherry-GSK3β的降解;图2(d)和(e)为基于调控GSK3βS/T-P激酶活性的纳米抗体构建bio-PROTAC系统,可实现内源GSK3β的降解。
图3为靶向调控GSK3βS/T-P激酶活性纳米抗体的功能验证结果图。
具体实施方式
本具体实施方式提供了一种靶向GSK3β的纳米抗体,所述纳米抗体的核酸序列如Seq ID No.1所示;进一步地,所述纳米抗体靶向调控GSK3β的S/T-P激酶活性。
本具体实施方式还提出一种分子表达载体,所述载体中含有如No.Seq ID No.1所示的核酸序列。
本具体实施方式还提出一种含有上述分子表达载体的宿主细胞,所述宿主细胞包括原核细胞、酵母细胞或病毒;进一步地,所述宿主细胞包括人胚肾细胞或者人宫颈癌细胞。
本具体实施方式还提出一种上述纳米抗体的制备方法,包括以下步骤:
S1、通过同源臂引物连续扩增纳米抗体DNA文库以用于酵母转化,将纳米抗体文库序列与Aga2的C端融合,实现纳米抗体在酵母细胞表面的展示,构建多样性为10
S2、将转化后接种于液体培养基的酵母细胞接种于SD-Trp培养基中二次传代培养;
S3、取二次传代的细胞(接种于SD-Trp培养基培养至OD=0.5-1,细胞重悬于SG-Trp培养基以诱导纳米抗体的表达,诱导至少36h;以GSK3的eIF4E2结合域为抗原,偶联羧基磁珠,通过三轮磁珠筛选和三轮流式筛选得到所述纳米抗体。
本发明以GSK3β的S/T-P激酶活性为靶标,成功建立了全合成纳米抗体酵母展示文库,筛选到了靶向GSK3β且特异性调控其S/T-P激酶活性的纳米抗体Nb.29E9。
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1
1)全合成纳米抗体酵母展示文库的构建
三核苷酸诱变技术是基于三联体密码子特性,利用对应20种氨基酸的三核苷酸磷酰胺。根据所需的氨基酸频率与CDR区域的长度,设计不同氨基酸组合的引物(P1_for、P2_rev、……、P10_rev),形成引物池。再通过PCR技术对模板进行扩增,达到连续氨基酸序列突变的目的。
酵母展示系统分为絮凝素系统与凝集素系统。本发明采用凝集素系统的展示技术。酵母的a-凝集素具有两个亚基,核心亚基Aga-1与结合亚基Aga-2。其中核心亚基Aga-1由725个氨基酸组成,其C端与酵母细胞壁葡聚糖共价结合。结合亚基Aga-2由69个氨基酸组成,与Aga1通过二硫键相连。基于此系统,我们将目的蛋白序列即纳米抗体文库序列与Aga2的C端融合,实现纳米抗体在酵母细胞表面的展示。
本发明以已有的纳米抗体基因为模板(美洲驼的IGHV1S1-IGHV1S1S5基因),通过简并引物和三核苷酸诱变技术构建全合成纳米抗体文库,并进一步改造酵母展示载体pNACP,构建多样性为10
2)应用bio-PROTAC验证纳米抗体的功能
靶向嵌合体的蛋白水解酶(PROTAC)有三个主要结构:与靶蛋白结合的配体,与E3泛素连接酶结合的配体以及用于缀合这两个配体的接头。它可以通过泛素-蛋白酶体系统降解目标蛋白。PROTAC可在低水平下促进靶蛋白降解,发挥催化作用。bio-PROTAC与一般的PROTAC不同,bio-PROTAC不是用小分子连接配体和E3连接酶,而是通过用结合目标蛋白(POI)的肽或小蛋白直接替换E3连接酶的底物识别结构域,从而对其进行改造。改造后的融合蛋白bio-PROTAC在细胞中表达,以驱动POI的定向降解。本发明将识别GSK3β的纳米抗体替代结合目标蛋白(POI)的肽或小蛋白,实现细胞内过表达和内源GSK3β的降解。
1)实验菌株
大肠杆菌DH5α和酵母菌株EBY100为实验室保存菌株。
2)细胞系
表1实验用细胞信息表
3)载体与质粒
真核表达载体pcDNA3.1、pcDNA3.1-3×Flag、酵母展示载体pNACP均为实验室保存,其他所用质粒均由本发明构建。
1)引物
表2实验用引物信息表
表3筛选到的部分纳米抗体序列
表3中的序列分别对应序列表中的Seq ID No.1-Seq ID No.10。
详细的纳米抗体的制备方法如下:
1)全合成纳米抗体文库的构建和靶向GSK3βS/T-P激酶活性纳米抗体的筛选
纳米抗体文库的构建:纳米抗体文库的构建如前所述。简而言之,纳米抗体的DNA文库是通过两步重叠延伸PCR构建的。将一组十个引物(见表2)溶解并混合以制备短、中、长三个混合池,其中CDR3区域分别为7、11和15个随机残基。将三个混合池的全长纳米抗体DNA产物以1:2:1的摩尔比混合,即为纳米抗体DNA文库池,通过同源臂引物连续扩增纳米抗体DNA文库以用于酵母转化,将目的蛋白序列即纳米抗体文库序列与Aga2的C端融合,实现纳米抗体在酵母细胞表面的展示,构建多样性为10
将转化后接种于液体培养基的酵母细胞接种于SD-Trp培养基中二次传代培养以去除死细胞,30℃、250rpm培养过夜(约20h)。以初始浓度OD=1接种于1L培养基,30℃、250rpm培养3d。2,500g离心5min收集细胞,分装冻存于-80℃。取冻存的细胞于SD-Trp培养基,30℃、225rpm过夜培养。取二次传代的细胞(初始OD为0.1-0.2,细胞量为文库多样性的10倍)接种于SD-Trp(含2%葡萄糖)培养基,30℃、225rpm培养至OD=0.5-1。2,500g离心5min收集细胞,细胞重悬于SG-Trp(含2%半乳糖)培养基以诱导纳米抗体的表达,在20℃下诱导至少36h。以GSK3β的eIF4E2结合域(G3-I,CSRLLEYTPTARL)为抗原,偶联羧基磁珠,通过三轮磁珠筛选和三轮流式筛选,富集高亲和力纳米抗体,并进行初步功能验证。
2)靶向GSK3βS/T-P激酶活性纳米抗体的功能验证
bio-PROTAC质粒的构建
质粒1:通过BamHⅠ、AgeⅠ将纳米抗体插入bio-PROTAC载体(pCDNA3-Flag-SPOP(E3))。质粒2:通过XholⅠ、EcoRⅠ将靶标(GSK3β)插入过表达载体(pCDNA3-Flag-mCherry-SPOP(E3));
细胞实验(以293T为例)
细胞铺板至12孔板(60%-70%),培养12h后进行转染实验。转染24h后收样,通过WesternBlot和细胞免疫荧光检测纳米抗体降解细胞内过表达和内源GSK3β的能力;
在细胞内过表达纳米抗体,通过检测RBM38S195、HIF1αS589磷酸化检测其对GSK3βS/T-P激酶活性的调控作用;
通过在细胞内过表达纳米抗体,在常氧、缺氧条件下,探究纳米抗体调控GSK3βS/T-P激酶活性对细胞缺氧响应的调控。
靶向调控GSK3βS/T-P激酶活性纳米抗体的筛选
利用全合成纳米抗体酵母展示文库,通过三轮FACS富集,在抗原浓度降低到10nM时,得到了64.7%的阳性率。并通过测序鉴定了纳米抗体的序列多样性,选择亲和力排名第一的纳米抗体进行功能验证。结合图1,靶向调控GSK3βS/T-P激酶活性的纳米抗体筛选结合酵母展示筛选获得识别GSK3β的纳米抗体,第三轮10nM抗原流式细胞仪筛选结果显示获得识别GSK3β的高亲和力纳米抗体,展示了筛选到的前十名GSK3β纳米抗体序列。
纳米抗体联合bio-PROTAC系统靶向降解GSK3β
结合图2,通过纳米抗体(Nb.BV025为对照纳米抗体,Nb.29D8、Nb.29E9、Nb.29A2、Nb.29B3为筛选到的前四名纳米抗体)融合E3蛋白酶构建bio-PROTAC质粒,转染293T、Hela细胞,靶向降解细胞内过表达的mCherry-GSK3β和内源GSK3β,通过细胞免疫荧光和WesternBlot验证纳米抗体靶向降解GSK3β的能力。
靶向调控GSK3βS/T-P激酶活性纳米抗体的功能验证
结合图3,通过在293T、Hela中过表达纳米抗体29E9,Western Blot检测GSK3β下游靶标RBM38的变化,鉴定纳米抗体调控GSK3βS/T-P激酶活性的能力。在常氧、低氧条件下过表达Nb.29E9,Nb.29E9可以充当GSK3β的配体,激活GSK3β的S/T-P激酶活性,从而激活下游靶标RBM38(S195)的磷酸化。
本发明成功构建了库容量约10
总的来说,本发明成功筛选到了特异性激活GSK3β的S/T-P激酶活性的纳米抗体Nb.29E9,可以通过该纳米抗体进一步探究GSK3β的S/T-P激酶活性在神经退行性疾病中功能,为神经退行性疾病的治疗提供科学方案。
以上所述本发明的具体实施方式,并不构成对本发明保护范围的限定。任何根据本发明的技术构思所做出的各种其他相应的改变与变形,均应包含在本发明权利要求的保护范围内。
- 一种载PD1抗体的靶向相变型纳米粒及其制备方法和应用
- 一种具有靶向光热治疗和可控释药的多重作用纳米材料的制备方法及应用
- 一种用作光/声敏剂的靶向纳米颗粒及其制备方法和应用
- 一种基于功能化纳米粒的COX-2抑制剂靶向筛选系统及其制备方法和应用
- 一种纳米抗体介导的双重肿瘤靶向介孔二氧化硅纳米载药制剂及其制备方法
- 一种靶向β2AR的纳米抗体及其制备方法和应用
