一种豆类植物中无机硒含量、总硒含量和有机硒含量的检测方法
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于分析检测技术领域,具体涉及一种豆类植物中无机硒含量、总硒含量和有机硒含量的检测方法。
背景技术
目前检测农产品、食品中无机硒、有机硒的标准,有食品营养强化剂富硒酵母、富硒食用菌粉、硒化卡拉胶检测的国家标准,富硒农产品检测的行业标准,富硒食品中无机硒测定的湖北地方标准,稻米中有机硒、无机硒含量测定的江西地方标准等。
在现行的国家标准及地方标准中无机硒采用纯净水、酸或者磷酸二氢钾-硫酸铜为浸提液在一定的温度下提取、过滤后应用原子荧光光谱仪或高效液相-原子荧光仪检测,检测值为无机硒含量。这些方法中提取液在提取无机硒的同时,也把样品中可溶性小分子有机硒,如硒代氨基酸等一并提取;而部分无机硒包裹或吸附在大分子的样品组分上,不能提取出来;在选择提取液及提取温度时,使用酸、碱或者沸水也易造成硒形态发生改变。这些因素都可造成无机硒检测的干扰,影响分析准确度。比较有效的硒形态分析方法为高效液相色谱-电感耦合等离子质谱法,该法不但设备成本高,操作人员技术要求高,同样也面临样品前期提取过程的干扰问题。
发明内容
本发明的目的在于提供一种豆类植物中无机硒含量、总硒含量和有机硒含量的检测方法,本发明提供的豆类植物中无机硒含量的检测方法准确度高且操作简单。
为了实现上述目的,本发明提供如下技术方案:
本发明提供了一种豆类植物中无机硒含量的检测方法,包括以下步骤:
将豆类植物样品、水和蛋白酶第一混合,进行酶解,得到无机硒提取液;
将所述无机硒提取液依次进行固相萃取柱分离和洗脱,得到无机硒洗脱液;所述固相萃取柱为强阴离子交换固相萃取柱;
将所述无机硒洗脱液浓缩后,和硝酸及过氧化氢进行消解,得到消解液;
将所述消解液和盐酸依次进行还原反应和稀释,得到无机硒待测液;
将所述无机硒待测液进行原子荧光光谱检测,得到所述无机硒待测液的原子荧光光谱;
根据原子荧光强度-硒浓度标准曲线和所述无机硒待测液的原子荧光光谱,得到所述豆类植物样品的无机硒含量。
优选地,所述豆类植物样品和蛋白酶的质量比为1:0.02~0.1;
所述酶解的时间为12~24h,温度为35~39℃。
优选地,所述固相萃取柱分离中所述无机硒提取液注入后的静置时间为10~15min,排出流速为1~3mL/min;
所述洗脱的溶剂为盐酸,洗脱溶剂摩尔浓度为1.5~4mol/L,洗脱流速为1~3mL/min。
优选地,所述消解的温度为120~150℃,时间为20~40min;
所述还原反应的温度为120~150℃。
优选地,所述原子荧光光谱检测的测定条件包括:光电倍增管负高压为270~290V;主电流为60~80mA;辅电流为30~40mA;载气流量为300~400mL/min;屏蔽气流量为700~900mL/min;还原剂为硼氢化钾-氢氧化钠溶液;所述硼氢化钾-氢氧化钠溶液中,硼氢化钾的质量分数为1~2%,氢氧化钠的质量分数为0.5~1%;载流为盐酸;所述载流的体积分数为5~10%。
本发明还提供了一种豆类植物中总硒含量的检测方法,包括以下步骤:
将豆类植物样品、浓硝酸和过氧化氢混合,依次进行消解和稀释,得到总硒待测液;
将所述总硒待测液进行电感耦合等离子体发射光谱检测,得到所述总硒待测液的电感耦合等离子体发射光谱;
根据发射强度-硒浓度标准曲线和所述总硒待测液的电感耦合等离子体发射光谱,得到所述豆类植物样品的总硒含量。
优选地,所述豆类植物样品的质量与所述浓硝酸的体积比为0.5~1g:15~20mL;
所述豆类植物样品的质量与所述过氧化氢的体积比为0.5~1g:1~3mL。
优选地,所述消解的温度为120~150℃,时间为120~150min。
优选地,所述电感耦合等离子体发射光谱检测的测定条件包括:RF功率为900~1000W;冷却气流量为11~13L/min;辅助气流量为0~0.5L/min;雾化器压力为2.5~3bar;蠕动泵泵速为15rpm;提升时间为15s;积分时间为2~5s;观测高度为12~15mm。
本发明还提供了一种豆类植物中有机硒含量的检测方法,包括以下步骤:
将豆类植物样品的总硒含量减去豆类植物样品的无机硒含量,得到豆类植物有机硒含量;
所述豆类植物样品的总硒含量为上述技术方案所述检测方法检测得到的豆类植物样品的总硒含量;
所述豆类植物样品的无机硒含量为上述技术方案所述检测方法检测得到的豆类植物样品的无机硒含量。
本发明提供了一种豆类植物中无机硒含量的检测方法,包括以下步骤:将豆类植物样品、水和蛋白酶第一混合,进行酶解,得到无机硒提取液;将所述无机硒提取液依次进行固相萃取柱分离和洗脱,得到无机硒洗脱液;所述固相萃取柱为强阴离子交换固相萃取柱;将所述无机硒洗脱液浓缩后,和硝酸及过氧化氢进行消解,得到消解液;将所述消解液和盐酸依次进行还原反应和稀释,得到无机硒待测液;将所述无机硒待测液进行原子荧光光谱检测,得到所述无机硒待测液的原子荧光光谱;根据原子荧光强度-硒浓度标准曲线和所述无机硒待测液的原子荧光光谱,得到所述豆类植物样品的无机硒含量。本发明提供的检测方法在无机硒提取过程中,针对性采用蛋白酶温和地酶解豆类植物中的大分子蛋白质,使样品中硒不发生形态变化的情况下较为完全地提取出无机硒;提取液进一步采用强阴离子交换固相萃取柱分离去除提取液中小分子有机硒,从而减少无机硒检测干扰,提高无机硒检测准确度。该方法操作简单,稳定性好,检测准确度高,仪器配置成本低,降低了检测成本。
本发明还提供了一种豆类植物中总硒含量的检测方法,该方法对于高硒含量的豆类植物试样采用电感耦合等离子体发射光谱检测,减少了高浓度样品使用原子荧光光谱法检测中稀释倍数过大造成的误差,能够实现硒含量超过1mg/kg的豆类植物样品的总硒含量高精确度检测。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为电感耦合等离子体发射光谱检测(ICP-OES)法,发射强度-硒浓度标准曲线;
图2为原子荧光光谱检测(AFS)法,原子荧光强度-硒浓度标准曲线一;
图3为原子荧光光谱检测(AFS)法,原子荧光强度-硒浓度标准曲线二。
具体实施方式
本发明提供了一种豆类植物中无机硒含量的检测方法,包括以下步骤:
将豆类植物样品、水和蛋白酶第一混合,进行酶解,得到无机硒提取液;
将所述无机硒提取液依次进行固相萃取柱分离和洗脱,得到无机硒洗脱液;所述固相萃取柱为强阴离子交换固相萃取柱;
将所述无机硒洗脱液浓缩后,和硝酸及过氧化氢进行消解,得到消解液;
将所述消解液和盐酸依次进行还原反应和稀释,得到无机硒待测液;
将所述无机硒待测液进行原子荧光光谱检测,得到所述无机硒待测液的原子荧光光谱;
根据原子荧光强度-硒浓度标准曲线和所述无机硒待测液的原子荧光光谱,得到所述豆类植物样品的无机硒含量。
在本发明中,若无特殊说明,所有原料组分均为本领域技术人员熟知的市售产品。
本发明将豆类植物样品、水和蛋白酶第一混合,进行酶解,得到无机硒提取液。
在本发明中,所述豆类植物样品优选为黄豆或豆芽;所述蛋白酶优选为胰蛋白酶;所述水优选为超纯水。
在本发明中,所述豆类植物样品的质量和水的体积比优选为0.1g:5~10mL,更优选为0.1g:5~8mL;所述豆类植物样品和蛋白酶的质量比优选为1:0.02~0.1,更优选为1:0.05~0.1。
在本发明中,所述第一混合优选为先将豆类植物样品和水混合,再加入蛋白酶;所述豆类植物样品和水混合优选为依次进行的涡旋混合和超声混合;所述超声混合的温度优选为室温;时间优选为15~30min,更优选为20~30min;本发明对所述涡旋混合和超声混合的过程没有任何特殊的限定,采用本领域技术人员熟知的过程使豆类植物样品和水混合均匀即可;所述加入蛋白酶后还优选包括涡旋混合;本发明对所述涡旋混合的过程没有任何特殊的限定,采用本领域技术人员熟知的过程使豆类植物样品、水和蛋白酶混合均匀即可。
在本发明中,所述第一混合前还优选包括对所述豆类植物样品依次进行清洗、烘干和粉碎;本发明对所述清洗、烘干和粉碎的方式没有任何特殊的限定,采用本领域技术人员熟知的方式进行即可。
在本发明中,所述酶解的时间优选为12~24h,更优选为12~18h;温度优选为35~39℃,更优选为35~37℃;所述酶解优选在振荡条件下进行;所述振荡的转速优选为80~110r/min,更优选为90~100r/min。
在本发明中,所述酶解后还优选包括固液分离;所述固液分离优选为离心;所述离心的转速优选为10000~12000r/min,更优选为10000~11000r/min;时间优选为15~40min,更优选为20~30min;所述离心后还优选包括依次进行的洗涤和离心;所述洗涤的溶剂优选为超纯水;所述超纯水的体积优选为2~5mL,更优选为2~3mL;所述洗涤的方式优选为涡旋混合;所述离心的转速优选为10000~12000r/min,更优选为10000~11000r/min;时间优选为15~40min,更优选为20~30min;所述离心后还优选包括上清液合并。
得到所述无机硒提取液后,本发明将所述无机硒提取液依次进行固相萃取柱分离和洗脱,得到无机硒洗脱液。
在本发明中,所述固相萃取柱优选为强阴离子交换固相萃取柱;所述强阴离子交换固相萃取柱优选为强阴离子交换(SAX)固相萃取(SPE)柱。
在本发明中,所述固相萃取柱分离中所述无机硒提取液注入后的静置时间优选为10~15min,更优选为10~12min;排出流速优选为1~3mL/min,更优选为1~2mL/min。
在本发明中,所述固相萃取柱分离前还优选包括对固相萃取柱进行活化;所述活化的过程优选为依次进行的盐酸洗和水洗;所述盐酸洗的盐酸浓度优选为2~3mol/L,更优选为2.5~3mol/L;盐酸体积优选为10~20mL,更优选为10~15mL;排出流速优选为1~3mL/min,更优选为2~3mL/min;所述水洗的水体积优选为10~20mL,更优选为10~15mL;排出流速优选为1~3mL/min,更优选为2~3mL/min;次数优选为2~5次,更优选为2~4次;所述活化的过程优选使固相萃取柱不跑干。
在本发明中,所述固相萃取柱分离后还优选包括水洗;所述水洗的水优选为超纯水,水体积优选为2~5mL,更优选为3~5mL;排出流速优选为1~3mL/min,更优选为1~2mL/min。
在本发明中,所述洗脱的溶剂优选为盐酸,溶剂体积优选为10~15mL,更优选为10~12mL;溶剂摩尔浓度优选为1.5~4mol/L,更优选为3~4mol/L;洗脱流速优选为1~3mL/min,更优选为1~2mL/min。
得到所述无机硒洗脱液后,本发明将所述无机硒洗脱液浓缩后,和硝酸及过氧化氢进行消解,得到消解液。
在本发明中,所述浓缩优选为蒸发浓缩;所述蒸发浓缩的温度优选为120~150℃,更优选为120~130℃;所述浓缩后无机硒洗脱液的体积优选为1~2mL,更优选为1~1.5mL。
在本发明中,所述浓硝酸的浓度优选为65~68wt%;所述过氧化氢的浓度优选为30~35wt%。
在本发明中,所述浓缩所得的无机硒洗脱液和浓硝酸的体积比优选为1:5~10,更优选为1:5~8;所述浓硝酸和过氧化氢的体积比优选为5~10:1,更优选为5~8:1;所述消解的温度优选为120~150℃,更优选为130~150℃;时间优选为20~40min,更优选为30~40min;所述消解后消解液的体积优选为1~2mL,更优选为1~1.5mL;在本发明中,所述消解的作用为除去洗脱液中有机物的干扰。
得到所述消解液后,本发明将所述消解液和盐酸依次进行还原反应和稀释,得到无机硒待测液。
在本发明中,所述盐酸的体积优选为5~10mL,更优选为5~8mL;所述盐酸的浓度优选为5~10mol/L,更优选为6~8mol/L。
在本发明中,所述还原反应的温度优选为120~150℃,更优选为130~150℃;所述还原反应后溶液的体积优选为1~2mL,更优选为2mL;。在本发明中,所述还原反应的作用为将高价态的硒全部还原为四价硒。
在本发明中,所述稀释的稀释倍数优选为5~10倍;所述稀释采用的溶剂优选为质量分数5%的盐酸。
得到所述无机硒待测液后,本发明将所述无机硒待测液进行原子荧光光谱检测,得到所述无机硒待测液的原子荧光光谱;根据原子荧光强度-硒浓度标准曲线和所述无机硒待测液的原子荧光光谱,得到所述豆类植物样品的无机硒含量。
在本发明中,所述原子荧光光谱检测的测定条件优选包括:光电倍增管负高压优选为270~290V,更优选为280~290V;主电流优选为60~80mA,更优选为70~80mA;辅电流优选为30~40mA,更优选为35~40mA;载气流量优选为300~400mL/min,更优选为300~350mL/min;屏蔽气流量优选为700~900mL/min,更优选为700~800mL/min;还原剂优选为硼氢化钾-氢氧化钠溶液;所述硼氢化钾-氢氧化钠溶液中,硼氢化钾的质量分数优选为1~2%,更优选为1~1.5%,氢氧化钠的质量分数优选为0.5~1%,更优选为0.5~0.8%;载流优选为盐酸;所述载流的体积分数优选为5~10%,更优选为5~8%。
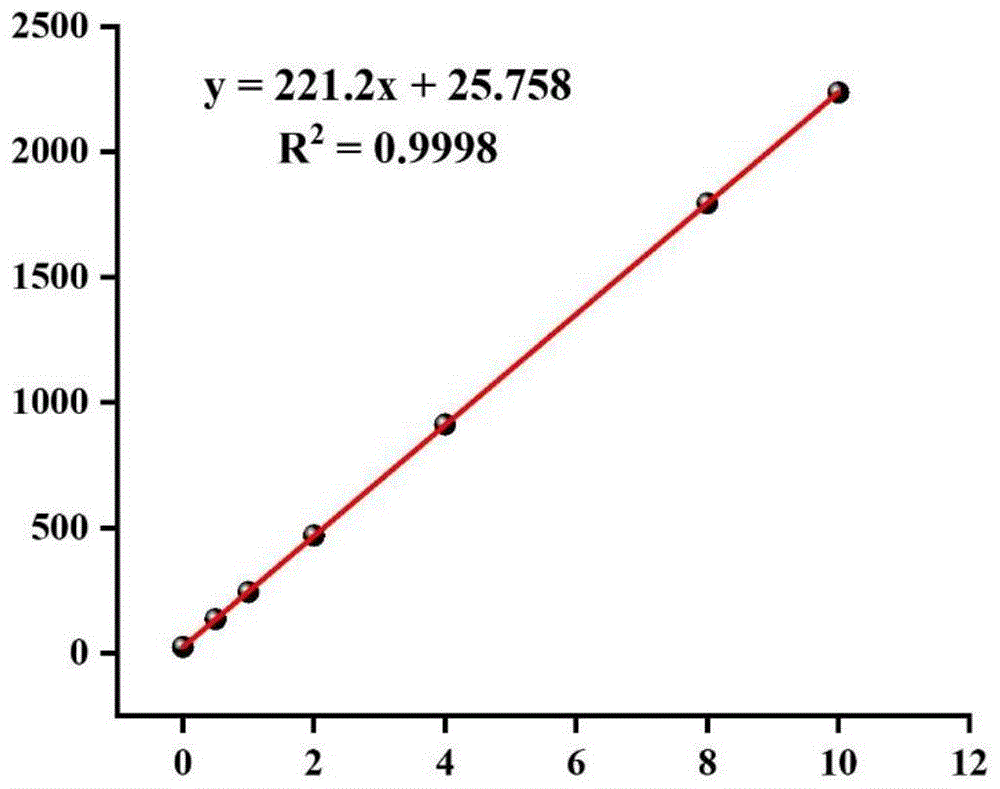
在本发明中,所述原子荧光强度-硒浓度标准曲线的建立方法优选为:将浓度为0、0.5、1.0、2.0、4.0、8.0、10.0ng/mL标准硒单元素溶液进行原子荧光光谱检测法检测,根据检测结果得到所述原子荧光强度-硒浓度标准曲线;所述标准硒单元素溶液的制备方法优选为:以100μg/mL的硒单元素标准物质溶液为母液,用体积分数为5%的盐酸逐级稀释,得到所述标准硒单元素溶液;所述硒单元素标准物质溶液的型号优选为GBW10020(GSB-11);所述原子荧光光谱检测的测定条件优选包括:
光电倍增管负高压优选为270~290V,更优选为280~290V;主电流优选为60~80mA,更优选为70~80mA;辅电流优选为30~40mA,更优选为35~40mA;载气流量优选为300~400mL/min,更优选为300~350mL/min;屏蔽气流量优选为700~900mL/min,更优选为700~800mL/min;还原剂优选为硼氢化钾氢氧化钠溶液;所述硼氢化钾溶液中硼氢化钾的质量分数优选为1~2%,更优选为1~1.5%;所述氢氧化钠溶液中氢氧化钠的质量分数优选为0.5~1%,更优选为0.5%;载流优选为盐酸;所述载流的体积分数优选为5~10%,更优选为5~8%;所述原子荧光光谱检测的测定条件优选与上述原子荧光光谱检测的测定条件相同;所述原子荧光强度-硒浓度标准曲线对应的线性回归方程优选为y=221.2x+25.758,R
本发明提供的检测方法在无机硒提取过程中,针对性采用蛋白酶温和地酶解豆类植物中的大分子蛋白质,使样品中硒不发生形态变化的情况下较为完全地提取出无机硒;提取液进一步采用强阴离子交换固相萃取柱分离去除提取液中小分子有机硒,从而减少无机硒检测干扰,提高无机硒检测准确度。该方法操作简单,稳定性好,检测准确度高,仪器配置成本低,降低了检测成本。
本发明还提供了一种豆类植物中总硒含量的检测方法,包括以下步骤:
将豆类植物样品、浓硝酸和过氧化氢混合,依次进行消解和稀释,得到总硒待测液;
将所述总硒待测液进行电感耦合等离子体发射光谱检测,得到所述总硒待测液的电感耦合等离子体发射光谱;
根据发射强度-硒浓度标准曲线和所述总硒待测液的电感耦合等离子体发射光谱,得到所述豆类植物样品的总硒含量。
本发明将豆类植物样品、浓硝酸和过氧化氢混合,依次进行消解和稀释,得到总硒待测液。
在本发明中,所述豆类植物样品优选为黄豆或豆芽,更优选为豆芽;所述豆类植物样品中有机硒的含量优选为1mg/kg以上。
在本发明中,所述浓硝酸的浓度优选为65~68wt%;所述过氧化氢的浓度优选为30~35wt%。
在本发明中,所述豆类植物样品的质量与所述浓硝酸的体积比优选为0.5~1g:15~20mL,更优选为0.5~1g:18~20mL;所述豆类植物样品的质量与所述过氧化氢的体积比优选为0.5~1g:1~3mL,更优选为0.5~1g:1~2mL。
在本发明中,所述混合优选为将所述豆类植物样品和浓硝酸混合,再加入过氧化氢;本发明对所述混合的方式没有任何特殊的限定,采用本领域技术人员熟知的方式进行即可。
在本发明中,所述混合前还优选包括对所述豆类植物样品依次进行清洗、烘干和粉碎;本发明对所述清洗、烘干和粉碎的方式没有任何特殊的限定,采用本领域技术人员熟知的方式进行即可。
在本发明中,所述消解的温度优选为120~150℃,更优选为130~150℃;时间优选为120~150min,更优选为130~150min;在本发明中,所述消解的作用为分解样品中有机物,使样品中各种形态的硒转化成硒离子。
在本发明中,所述消解前还优选包括预消解;所述预消解的温度优选为常温;时间优选为12~24h,更优选为12~18h。
在本发明中,在本发明中,所述消解后还优选包括浓缩;所述浓缩优选为蒸发浓缩;所述浓缩后消解液的体积优选为1~2mL,更优选为2mL;本发明对所述蒸发浓缩的方式没有任何特殊的限定,采用本领域技术人员熟知的方式使溶液达到上述浓缩比例即可;在本发明中,所述浓缩的作用为去除多余的酸。
在本发明中,所述稀释的稀释倍数优选为5~10倍;所述稀释采用的溶剂优选为超纯水。
得到所述总硒待测液后,本发明将所述总硒待测液进行电感耦合等离子体发射光谱检测,得到所述总硒待测液的电感耦合等离子体发射光谱;根据发射强度-硒浓度标准曲线和所述总硒待测液的电感耦合等离子体发射光谱,得到所述豆类植物样品的总硒含量。
在本发明中,所述电感耦合等离子体发射光谱检测的测定条件优选包括:RF功率优选为900~1000W,更优选为950~1000W;冷却气流量优选为11~13L/min,更优选为12~13L/min;辅助气流量优选为0~0.5L/min,更优选为0.3~0.5L/min;雾化器压力优选为2.5~3bar,更优选为2.7~2.9bar;蠕动泵泵速优选为15rpm;提升时间优选为15s;积分时间优选为2~5s,更优选为3~5s;观测高度优选为12~15mm,更优选为12~14mm。
在本发明中,所述发射强度-硒浓度标准曲线的建立方法优选为:将浓度为0、0.05、0.1、0.5、1.0μg/mL标准硒单元素溶液进行电感耦合等离子体发射光谱检测,根据检测结果得到所述发射强度-硒浓度标准曲线;所述标准硒单元素溶液的制备方法优选为:以100μg/mL的硒单元素标准物质溶液为母液,用体积分数为2%的盐酸逐级稀释,得到所述标准硒单元素溶液;所述硒单元素标准物质溶液的型号为GBW10020(GSB-11);所述电感耦合等离子体发射光谱检测的测定条件优选包括:
RF功率优选为900~1000W,更优选为950~1000W;冷却气流量优选为12~13L/min,更优选为12.4L/min;辅助气流量优选为0~0.5L/min,更优选为0.3~0.5L/min;雾化器压力优选为2.5~3bar,更优选为2.7~2.9bar;蠕动泵泵速优选为15rpm;提升时间优选为15s;积分时间优选为2~5s,更优选为3~5s;观测高度优选为12~15mm,更优选为12~14mm;所述电感耦合等离子体发射光谱检测的测定条件优选与上述电感耦合等离子体发射光谱检测的测定条件相同;所述发射强度-硒浓度标准曲线对应的线性回归方程优选为y=3587.9x+346.02,R
本发明还提供了的豆类植物中总硒含量的检测方法对于高硒含量的豆类植物试样采用电感耦合等离子体发射光谱检测,减少了高浓度样品使用原子荧光光谱法检测中稀释倍数过大造成的误差,能够实现硒含量超过1mg/kg的豆类植物样品的总硒含量高精确度检测。
本发明还提供了一种豆类植物中有机硒含量的检测方法,包括以下步骤:
将豆类植物样品的总硒含量减去豆类植物样品的无机硒含量,得到豆类植物有机硒含量;
所述豆类植物样品的总硒含量为上述技术方案所述检测方法检测得到的豆类植物样品的总硒含量;
所述豆类植物样品的无机硒含量为上述技术方案所述检测方法检测得到的豆类植物样品的无机硒含量。
本发明提供的豆类植物中无机硒含量的检测方法减少了样品制备过程造成的无机硒检测干扰,从而保证有机硒检测准确性,操作简单且成本较低。
为了进一步说明本发明,下面结合附图和实施例对本发明提供的豆类植物中无机硒含量、总硒含量和有机硒含量的检测方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例1
本实施例将富硒豆类植物A、富硒豆类植物B和富硒豆类植物C进行清洗、烘干和粉碎,分别进行总硒含量、无机硒含量和有机硒含量的检测。其中,富硒豆类植物A、富硒豆类植物B为实验室采用豆芽机自制富硒豆芽,富硒豆类植物C为市售富硒黄豆。
总硒含量的检测:
准确称取0.5g(精确至0.0001g)待测试样置于锥形瓶中,加入20mL浓度为65wt%的浓硝酸,加入1mL浓度为30wt%的过氧化氢,控制反应速度,盖上表面皿预消解12h;预消解后,锥形瓶口放一带玻璃珠小漏斗,在电热板上加热至150℃回流消解150min,消解完成后转移至50mL聚四氟乙烯烧杯继续加热浓缩使溶液体积为2mL。
富硒豆类植物A样品消解液冷却后直接用超纯水定容至10.0mL,获得总硒待测液;以100μg/mL的硒单元素标准物质溶液【GBW10020(GSB-11)】为母液,用体积分数为2%的盐酸逐级稀释成浓度为0、0.05、0.1、0.5、1.0μg/mL标准系列使用液,采用电感耦合等离子体发射光谱检测(ICP-OES)法检测,绘制发射强度-硒浓度标准曲线并建立线性回归方程y=3587.9x+346.02,R
富硒豆类植物B、富硒豆类植物C样品消解液冷却后加5mL盐酸(6mol/L),继续加热使溶液有白烟出现,溶液体积剩余2mL,体积分数为5%的盐酸定容至10.0mL,获得总硒待测液;以100μg/mL的硒单元素标准物质溶液【GBW10020(GSB-11)】为母液,用体积分数为5%盐酸逐级稀释成浓度为20.0ng/mL标准使用液,在仪器上设置自动稀释标准浓度溶液浓度为0、2.0、4.0、8.0、12.0、16.0、20.0ng/mL,采用原子荧光光谱检测(AFS)法检测,绘制原子荧光强度-硒浓度标准曲线并建立线性回归方程y=145.29x+33.323,R
无机硒含量的检测:
准确称取0.1g(精确至0.0001g)待测试样至10mL离心管中,加入5mL超纯水,涡旋混匀后,在常温下超声30min,随后加入5mg胰蛋白酶,涡旋混匀后在37℃、100r/min条件下恒温振荡12h,酶解结束后,10000r/min条件下离心30min,收集上清液,再向残渣中加入2mL超纯水,涡旋混匀后,在10000r/min条件下离心30min,收集上清液并合并上清液。
对强阴离子交换(SAX)固相萃取(SPE)柱进行活化,用10mL浓度为3mol/L的盐酸溶液注入固相萃取柱,以3mL/min流速流出,再用水洗2次,每次10mL,不让柱子跑干;将上清液注入活化后SPE柱中,静置10min,使有机硒流出,完全流出后,再向SPE柱中加入约5mL超纯水,控制留出流速为1mL/min,弃去滤液。用10mL浓度为3mol/L的盐酸洗脱液以1mL/min流速洗脱吸附在SPE柱上的无机硒,用聚四氟乙烯烧杯收集洗脱液。将洗脱液放在电热板上120℃低温蒸发至溶液剩余体积1mL,冷却,加入5mL浓度为65wt%的浓硝酸及1mL浓度为30wt%的过氧化氢,加热至150℃消解30min,得到消解液体积为1mL,加入5mL浓度为6mol/L的盐酸,加热至150℃进行还原反应,至溶液剩余体积为2mL,用体积分数为5%的盐酸定容至10.0mL容量瓶中。
以100μg/mL的硒单元素标准物质溶液【GBW10020(GSB-11)】为母液,用体积分数为5%盐酸逐级稀释成浓度为10.0ng/mL标准使用液,在仪器上设置自动稀释标准浓度溶液浓度为0、0.5、1.0、2.0、4.0、8.0、10.0ng/mL,采用原子荧光光谱检测(AFS)法检测,绘制原子荧光强度-硒浓度标准曲线并建立线性回归方程y=221.2x+25.758,R
有机硒含量的检测:
将总硒含量减去无机硒含量,得到有机硒含量,测定结果如表1所示。
表1实施例1有机硒含量检测结果
对比例1
按照实施例1提供的检测方法进行硒含量检测,区别仅在于,无机硒含量检测中的酶解步骤替换为:准确称取0.1g(精确至0.0001g)待测试样至10mL离心管中,加入10mL超纯水,涡旋混匀后,在常温下超声30min,在37℃、100r/min条件下恒温振荡12h,并在10000r/min条件下离心30min,收集上清液,再向残渣中加入2mL超纯水,涡旋混匀后,在10000r/min条件下离心30min,收集上清液并合并上清液。得到富硒植物A、富硒植物B和富硒植物C无机硒含量分别为2.59mg/kg、0.17mg/kg和0.05mg/kg。
有机硒含量的测定结果如表2所示。
表2对比例1有机硒含量检测结果
对比例2
按照实施例1提供的检测方法进行硒含量检测,区别仅在于,无机硒含量检测中的酶解步骤替换为:准确称取0.1g(精确至0.0001g)待测试样至10mL离心管中,加入10mL浓度为0.1mol/L盐酸,涡旋混匀后,在常温下超声30min,在37℃、100r/min条件下恒温振荡12h,并在10000r/min条件下离心30min,收集上清液,再向残渣中加入2mL超纯水,涡旋混匀后,在10000r/min条件下离心30min,收集上清液并合并上清液。得到富硒植物A、富硒植物B和富硒植物C无机硒含量分别为3.03mg/kg、0.18mg/kg和0.07mg/kg。
有机硒含量的测定结果如表3所示。
表3对比例2有机硒含量检测结果
由表1~3可见,在豆芽、黄豆等豆类植物无机硒检测过程中,不同的无机硒提取过程检测结果不同;通过添加无机硒进行的回收率检测结果表明,通过酶解提取、超纯水提取、酸提取三种不同提取方式,酶解提取法无机硒提取回收率最高;酸提取法次之;超纯水提取法最低。并且酶解法实验重现性也比酸提取法及超纯水提取法要好。
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
- 一种测定富硒酵母中无机硒和有机硒含量的方法
- 一种测定富硒酵母中无机硒和有机硒含量的方法
