一种肾上腺素受体功能活性的别构调节剂及其制备方法和应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及药物化学技术领域,具体涉及一种肾上腺素受体功能活性的别构调节剂及其制备方法和应用。
背景技术
G蛋白偶联受体(G-protein-coupled receptors,GPCRs)作为当前研究最多、最重要的药物靶点,参与了人类几乎全部的生理病理和药理过程。迄今为止,市场上绝大部分GPCRs药物都是其正构配体,该类药物不良反应多,特异性较差。而GPCRs别构调节剂由于巨大的潜在优势已成为近几年来的研究热点。β2AR拮抗剂是非常经典的GPCRs药物,在心力衰竭、高血压、冠心病、心律失常、心绞痛等疾病的治疗中扮演着重要的角色,是治疗心血管类疾病的基石。因而β2AR别构拮抗剂的开发和设计对各类心血管类疾病的治疗具有重要的意义。
然而现有技术中,负向别构调节剂化合物通常具有水溶性差和生物活性低的缺点,且由于稳定性差而影响成药性。同时,这些化合物的结构较为复杂,合成较为困难。
发明内容
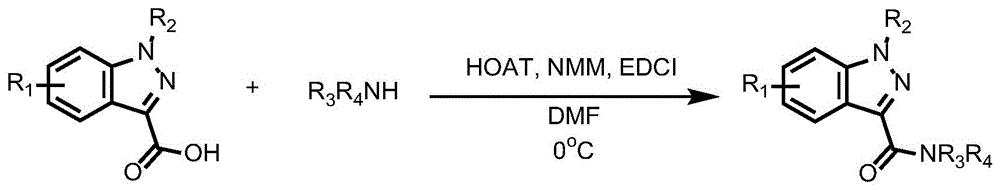
本发明的目的是开发一种肾上腺素受体功能活性的别构调节剂及其制备方法和应用,以各种取代的3-羧酸苯并吡唑和各种胺为原料,通过酰胺偶联反应合成了一系列各种取代的苯并吡唑酰胺化合物,是β2AR的别构拮抗剂,且生物活性高、结构稳定性好,可为创制心血管、哮喘和癌症疾病的新药提供坚实的基础。
本发明的上述技术目的是通过以下技术方案得以实现的:
本发明提供的一种肾上腺素受体功能活性的别构调节剂,别构调节剂为苯并吡唑酰胺类化合物,分子结构式如下:
其中,R
R
R
R
进一步的,R
进一步的,R
进一步的,R
进一步的,R
本发明还提供了一种肾上腺素受体功能活性的别构调节剂的制备方法,具体如下:
其中,R
R
R
R
进一步的,制备方法为:室温下,将3-羧酸苯并吡唑的衍生物加入到溶剂中,再加入胺和HOAT,搅拌;降温,加入NMM,搅拌;加入EDCI,持续反应,反应结束后,萃取,分离得到所述别构调节剂。
进一步的,在加入NMM时,反应体系温度保持在0℃~10℃。
进一步的,在加入EDCI时,体系温度保持在0℃~10℃。
本发明还提供了一种肾上腺素受体功能活性的别构调节剂的应用,具体为将别构调节剂用于负向调节β2AR内源性配体ISO的功能活性。
综上所述,本发明具有以下有益效果:
本发明提供了一种新型的β2AR的别构拮抗剂,是苯并吡唑酰胺类化合物,具有生物活性高、结构简单、合成路线简单的优点,可以作为创制心血管、哮喘和癌症疾病的新药提供基础。
附图说明
图1是本发明提供的苯并吡唑酰胺类化合物的合成路线;
图2是本发明提供的苯并吡唑酰胺类化合物的结构通式;
图3是化合物W8介导的ISO别构调节曲线;
具体实施方式
为更进一步阐述本发明为达成预定发明目的所采取的技术手段及功效,对依据本发明提出的一种肾上腺素受体功能活性的别构调节剂及其制备方法和应用,其具体实施方式、特征及其功效,详细说明如后。
本具体实施方式以各种取代的3-羧酸苯并吡唑和各种胺为原料,通过酰胺偶联反应合成了一系列各种取代的苯并吡唑酰胺化合物,其结构式如图2所示。本具体实施方式是通过GloSensor cAMP的累积实验证实了所合成的化合物都是β2AR的别构拮抗剂,且生物活性较高。
如图1所示,本具体实施方式提供的苯并吡唑酰胺类化合物的通用合成步骤如下:
室温下,将3-羧酸苯并吡唑加入到DMF中,之后再加入胺和HOAT,室温下搅拌10分钟后,在0℃下加入N-甲基吗啉(NMM),0℃下搅拌10分钟后,再加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDCI),之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到苯并吡唑酰胺类化合物。
实施例1:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,(S)-N-(3-(3-溴苯基)-1-(甲胺基)-1-氧代丙酰基)-1-苯基-1氢-吲哚-3-羧酰胺((S)-N-(3-(3-bromophenyl)-1-(methylamino)-1-oxopropan-2-yl)-1-phenyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将47.7mg(0.2mmol,1eq)N-苯基吲唑-3-甲酸加入到N,N-二甲基甲酰胺(2ml)中,之后再加入51.4mg(0.2mmol,1eq)2-氨基-3-(3-溴苯基)-N-甲基丙酰胺和41mg(0.3mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入18μL(0.15mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入58mg(0.3mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W1(14mg),白色固体,产率15%。
其表征数据如下:
1
-7.56(m,2H),7.49-7.43(m,3H),7.38-7.34(m,2H),7.26-7.23(m,2H),7.16(t,J=7.8Hz,1H),4.87(t,J=7.0Hz,1H),3.22(dd,J=6.6,3.4Hz,2H),2.75(s,3H);HRMS(ESI)m/z:calcd for C
实施例2:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-(3-氟苯基)-1-苯基-1H-吲哚-3-羧酰胺,(N-(3-fluorophenyl)-1-phenyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将71.5mg(0.3mmol,1eq)N-苯基吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入29μL(0.3mmol,1eq)间氟苯胺和61mg(0.45mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入26.5μL(0.23mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入87mg(0.45mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W2(77mg),白色固体,产率78%。
其表征数据如下:
1
实施例3:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-(3-氯苯基)-1-苯基-1氢-吲哚-3-羧酰胺,(N-(3-chlorophenyl)-1-phenyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
将71.5mg(0.3mmol,1eq)N-苯基吲唑-3-甲酸加入到N,N-二甲基甲酰胺(2ml)中,之后再加入32μL(0.3mmol,1eq)间氯苯胺和61mg(0.45mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入26.5μL(0.23mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入87mg(0.45mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W3(70mg),白色固体,产率67%。
其表征数据如下:
1
实施例4:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-(3-溴苯基)-1-苯基-1氢-吲哚-3-羧酰胺,(N-(3-bromophenyl)-1-phenyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将36mg(0.15mmol,1eq)N-苯基吲唑-3-甲酸加入到N,N-二甲基甲酰胺(2ml)中,之后再加入17μL(0.22mmol,1eq)间溴苯胺和30mg(0.22mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入14μL(0.12mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入43mg(0.22mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W4(40mg),白色固体,产率68%。
其表征数据如下:
1
实施例5:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-(3-溴苯基)-1-甲基-1氢-吲哚-3-羧酰胺,(N-(3-bromophenyl)-1-methyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将81mg(0.5mmol,1eq)N-甲基-吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入54.4μL(0.5mmol,1eq)间溴苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W5(149mg),白色固体,产率90%。
其表征数据如下:
1
实施例6:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,(S)-N-(3-(3-溴苯基)-1-(甲胺基)-1-氧代丙酰基)-1氢-吲哚-3-羧酰胺,
((S)-N-(3-(3-bromophenyl)-1-(methylamino)-1-oxopropan-2-yl)-1H-indazole-3-carboxa mide),结构式如下:
其制备方法如下:
室温下,将33mg(0.2mmol,1eq)吲唑-3-甲酸加入到N,N-二甲基甲酰胺(2ml)中,之后再加入51.4mg(0.2mmol,1eq)2-氨基-3-(3-溴苯基)-N-甲基丙酰胺和41mg(0.3mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入18μL(0.15mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入58mg(0.3mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W6(57mg),白色固体,产率71%。
其表征数据如下:
1
实施例7:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-(3-氟苯基)-1氢-吲哚-3-羧酰胺,(N-(3-fluorophenyl)-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
将81mg(0.5mmol,1eq)吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入48.1μL(0.5mmol,1eq)间氟苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W7(80mg),白色固体,产率63%。
其表征数据如下:
1
实施例8:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-(3-溴苯基)-1氢-吲哚-3-羧酰胺,(N-(3-bromophenyl)-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将81mg(0.5mmol,1eq)吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入52.9μL(0.5mmol,1eq)间溴苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W8(62mg),白色固体,产率78%。
其表征数据如下:
1
实施例9:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-(3-氯苯基)-1氢-吲哚-3-羧酰胺,(N-(3-chlorophenyl)-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将81mg(0.5mmol,1eq)吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入52.9μL(0.5mmol,1eq)间氯苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W9(49mg),白色固体,产率36%。
其表征数据如下:
1
实施例10:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-(3-甲基苯基)-1氢-吲哚-3-羧酰胺,(N-(m-tolyl)-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将81mg(0.5mmol,1eq)吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入53.6μL(0.5mmol,1eq)3-甲基苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W10(95mg),淡黄色固体,产率76%。
其表征数据如下:
1
实施例11:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-(3,5-二溴苯基)-1氢-吲哚-3-羧酰胺,(N-(3,5-dibromophenyl)-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将81mg(0.5mmol,1eq)吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入125.5mg(0.5mmol,1eq)3,5-二溴苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W11(17mg),白色固体,产率9%。
其表征数据如下:
1
实施例12:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-苄基-1氢-吲哚-3-羧酰胺,(N-benzyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将81mg(0.5mmol,1eq)吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入54.4μL(0.5mmol,1eq)苄胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W12(117mg),白色固体,产率93%。
其表征数据如下:
1
实施例13:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-甲基-1氢-吲哚-3-羧酰胺,(N-methyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将81mg(0.5mmol,1eq)吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入33.8mg(0.5mmol,1eq)甲胺盐酸盐和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入86.5μL(0.75mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W13(75mg),白色固体,产率86%。
其表征数据如下:
1
实施例14:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-异丙基-1氢-吲哚-3-羧酰胺,(N-isopropyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
将81mg(0.5mmol,1eq)吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入42.8μL(0.5mmol,1eq)异丙胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W14(84mg),白色固体,产率83%。
其表征数据如下:
1
实施例15:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,N-异丙基-1氢-吲哚-3-羧酰胺,(N-isopropyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
将81mg(0.5mmol,1eq)吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入52.9μL(0.5mmol,1eq)环己胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W15(98mg),白色固体,产率81%。
其表征数据如下:
实施例16:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,5-溴-N-(3-溴苯基)-1氢-吲哚-3-羧酰胺,(5-bromo-N-(3-bromophenyl)-1H-indazole-3-carboxamide),结构式如下:
/>
其制备方法如下:
室温下,将120.5mg(0.5mmol,1eq)5-溴吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入54.5μL(0.5mmol,1eq)间溴苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W16(70mg),白色固体,产率36%。
其表征数据如下:
1
实施例17:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,5-溴-N-(苯基)-1氢-吲哚-3-羧酰胺,(5-bromo-N-phenyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将120.5mg(0.5mmol,1eq)5-溴吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入45.6μL(0.5mmol,1eq)苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W17(70mg),白色固体,产率44%。
其表征数据如下:
1
实施例18:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,5-甲基-N-苯基-1氢-吲哚-3-羧酰胺,(5-bromo-N-phenyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将88.8mg(0.5mmol,1eq)5-甲基吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入45.6μL(0.5mmol,1eq)苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W18(100mg),黄色固体,产率80%。
其表征数据如下:
1
实施例19:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,6-溴-N-苯基-1氢-吲哚-3-羧酰胺,(6-bromo-N-phenyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将120.5mg(0.5mmol,1eq)6-溴吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入45.6μL(0.5mmol,1eq)苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W19(130mg),白色固体,产率83%。
其表征数据如下:
1
实施例20:一种肾上腺素受体功能活性的别构调节剂及其制备方法
本实施例提供的肾上腺素受体功能活性的别构调节剂,5-氯-N-苯基-1氢-吲哚-3-羧酰胺,(5-chloro-N-phenyl-1H-indazole-3-carboxamide),结构式如下:
其制备方法如下:
室温下,将98.3mg(0.5mmol,1eq)5-氯吲唑-3-甲酸加入到N,N-二甲基甲酰胺(3ml)中,之后再加入45.6μL(0.5mmol,1eq)苯胺和102mg(0.75mmol,1.5eq)N-羟基-7-氮杂苯并三氮唑,室温下搅拌10分钟后,在0℃下加入43μL(0.375mmol,0.75eq)N-甲基吗啉,0℃下搅拌10分钟后,再加入144mg(0.75mmol,1.5eq)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐,之后在0℃下反应9小时,用乙酸乙酯进行萃取,有机相浓缩后经柱层析色谱分离得到化合物W20(101mg),白色固体,产率75%。
其表征数据如下:
1
性能测试
1.生物活性筛选
(1)GloSensor
cAMP是许多G蛋白偶联受体的关键信号分子。cAMP的累积水平主要利用GloSensor-一种基于生物发光的、能直接检测细胞内cAMP生物传感器(Promega)来测试。
其原理是通过基因工程技术在萤火虫荧光素酶的N末端和C末端插入了一个cAMP结合域后使该酶处于未激活态,当cAMP结合在cAMP结合域上后该酶被激活,从而氧化底物荧光素产生生物发光。
cAMP的累积实验被用来测试目标化合物对β2AR的功能活性以及阐明新化合物是否是β2AR的负向别构调节剂(NAM)。
具体方法如下,将HEK293T细胞种入6孔板中,每孔种4×105个细胞。第二天,使用FuGene转染试剂(Promega)将β2AR和pGloSensor-22F cAMP质粒同时转染到HEK293T细胞中。48h后,用CO2独立培养基洗涤转染后的细胞,再和含有2%v/v GloSensor cAMP试剂储备液(溶于含10% FBS的CO
在37℃条件下孵育1h后再室温孵育1h,用多功能酶标仪检测生物发光信号直到获得稳态的基线信号。然后,向细胞中加入不同浓度梯度的新衍生物和对照化合物Cmpd-15,37℃孵育30min后加入阳性对照ISO(最终浓度1nM~100μM)。用酶标仪读取生物荧光的变化。
其中,化合物Cmpd-15的结构式如下:
应用GloSensor cAMP累积实验,以不同浓度梯度的异丙肾上腺素(ISO)为阳性对照(最终浓度1nM~100μM),化合物Cmpd-15(最终浓度为50μM)为参考对照,来比较本发明提供的别构调节剂(最终浓度为50μM)的别构拮抗活性与化合物Cmpd-15的优劣。表1测试结果表明本发明提供的化合物均对β2AR具有别构拮抗活性,其中化合物W8活性最高,为Cmpd-15活性的4.17倍。
表1.所合成化合物相对于Cmpd-15的别构活性比较结果列表
/>
(2)别构拮抗机制研究
本发明还使用cAMP累积试验做了进一步的别构拮抗机制研究,测试了目标化合物能否别构调节β2AR内源性配体ISO的功能活性以确定它们是否是β2AR负向别构调节剂(NAM)。具体的,首先向细胞中加入浓度成倍数关系的本发明提供的W8化合物,浓度为(1nM~100μM),37℃孵育30min后,向细胞中加入不同浓度梯度阳性对照ISO(最终浓度1nM~100μM),测试此时生物荧光的变化是否呈现浓度依赖的有限下移趋势。具体实验步骤同上文Glosensor cAMP的累积试验。实验结果见图3,结果表明目标化合物W8能够负向别构调节β2AR内源性配体ISO的功能活性。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例展示如上,但并非用以限定本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的技术内容做出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 一种生物质焦油制备具有氧还原与氧析出活性的双功能催化剂的方法
- 一种改性活性炭吸附剂的制备方法和应用
- N-取代苄基吡唑衍生物在作为β2肾上腺素受体别构调节剂、拮抗剂和激动剂的应用
- α-肾上腺素受体阻断剂在制备治疗男性性功能障碍之药物中的应用
