阿片受体激动剂及其制备方法和用途
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于药物化学领域,具体涉及一类氧杂螺环类小分子化合物、其制备方法及含有该化合物的药物组合物以及其作为治疗剂,特别是作为MOR受体激动剂和在制备治疗和预防疼痛等相关疾病的药物中的用途。
技术背景
阿片受体是一种G蛋白偶联受体(G Protein-Coupled Receptor,GPCR),是内源性阿片肽及阿片类药物结合的靶点。人体内存在多种阿片受体,主要包括μ阿片受体(Muopioid receptor,MOR)、δ阿片受体(Delta Opioid Receptor,DOR)和κ阿片受体(Kappaopoid receptor,KOR)三类,广泛分布在中枢神经系统、心脏、消化道、血管、肾脏等外周组织(Nature,2016,537(7619):185)。MOR与吗啡肽的结合能力最强,是吗啡、芬太尼等镇痛药主要作用的受体蛋白位点。Zadina等研究发现MOR受体与吗啡肽1的结合能力(360pM)是DOR受体、KOR受体与吗啡肽1结合力的4000倍和15000倍(Science 2001Vol.293No:311-315;BiochemBiophys Res Commun 235:567-570;Life Sci 61:409-415)。
研究发现GPCR介导及调控生理功能主要经由激活G蛋白途径和β-arrestin途径。G蛋白信号途径主要包括钙离子等第二信使系统、腺苷酸环化酶、丝裂原活化蛋白激酶等。β-arrestin途径主要有三个方面:(1)作为负性调控因子与GPCR激酶作用使GPCRs发生受体脱敏反应从而中止G蛋白信号转导;(2)作为支架蛋白募集胞吞蛋白诱导GPCR内吞;(3)作为接头蛋白与GPCR下游信号分子形成复合物,以G蛋白非依赖的方式激活信号转导分子。早期研究显示,内源性脑啡肽和阿片类药物埃托啡可以激动G蛋白并引发受体内吞,而吗啡则不引发受体内吞,这是因为吗啡通过G蛋白信号通路而不是β-arrestin途径来发挥其生理功能(Zhang等,Proc NatlAcad Sci USA,1998,95(12):7157-7162)。研究发现给β-arrestin2基因敲除小鼠注射吗啡后,由G蛋白信号介导的镇痛效果更强且维持时间更长(Bohn等,Science,1999年)。由此可见,配体刺激G蛋白和/或β-arrestin信号的差异决定了GPCR的配体特异性细胞生物学效应,如果此类配体的负性β-arrestin偏爱性更强,甚至可以逃脱β-arrestin介导的受体脱敏,则G蛋白信号传递时间延长,镇痛作用更强。近年来研究发现,β-arrestin通路与MOR激动剂多个副作用相关,如便秘、呼吸抑制和镇痛耐受(Science1999Vol.286:2495-2498:J.Pharmacol.Exp.Ther.2005,314:1195-1201)。因此,研发一种可选择性激活G蛋白信号通路的“偏向性”MOR激动剂药物,即MOR的负性β-arrestin偏爱性配体设计药物,使β-arrestin介导的副作用降低,在镇痛领域具有显著的临床价值和社会意义。
FDA于2020年8月批准了Trevena Inc公司药物Olinvyk(WO2012129495)的上市申请,目前关于G蛋白偏向性MOR激动剂的研发报道的专利有WO2017063509A1、WO2019205983A1、CN10920641A、WO2019072235A1、CN111662284A、WO2019052557A1等,虽然这些专利已经公开了一系列G蛋白偏向性MOR激动剂,但其分子结构与本发明提供的结构具有较大区别,且其药效、安全性暂未得到证实,临床上仍需要开发新的分子结构,以获得具有更好的药效、选择性、药用安全性、药物代谢结果的MOR激动剂。
发明内容
针对现有技术的需求,本发明提供了一种结构新颖的可作为MOR受体激动剂的化合物,该类化合物表现出高活性,Emax也具有明显改善,以及对MOR较高的选择性。
本发明提供了如式(Ⅰ)或(Ⅱ)或(Ⅲ)所示的化合物、其溶剂化物、立体异构体、氘代化合物、或其药学可接受的盐,
其中,
环A选自
环B为取代的或未取代的芳基、取代的或未取代的杂芳基;
Z
X
X
进一步地,每个R
进一步地,R
或者相邻两个C原子上的两个R
更进一步地,R
g选自0、1、2、3、4、5、6;
f选自0、1、2;
m选自0、1、2。
本发明的一些优选实施例中,环A选自:
且进一步被1至4个R
或者,
R
3-6元单杂环基可任选进一步被1至3个R
本发明的一些优选实施例中,每个R
每个R
在本发明提供的一些优选实施例中,每个R
本发明提供的一些优选实施例中,化合物选自:
本发明的另一方面涉及一种药物组合物,其包括上述各通式所示的化合物、其溶剂化物、立体异构体、氘代化合物或其药学可接受的盐,以及药学上可接受的载体。
本发明的另一个方面提供了上述各通式所示的化合物、其溶剂化物、立体异构体、氘代化合物或其药学可接受的盐,或上述药物组合物在制备和/或治疗MOR受体激动剂介导的相关疾病的药物中的用途。
其中,MOR受体激动剂介导的相关疾病选自疼痛、免疫功能障碍、炎症、食管回流、神经和精神疾病、泌尿和生殖疾病、心血管疾病和呼吸疾病;上述疼痛选自术后疼痛、癌症引起的疼痛、神经性疼痛、创伤性疼痛和炎症引起的疼痛。
术语解释
本发明所用术语“C
本发明上述的“环烷基”包括可能形成的所有单环、稠环(包括以并、螺、桥的形式稠合)的情形;例如:“3-12元环烷基”,可以是单环、双环、或者多环环烷基系统(也称为稠环系统)。在不特别指明的情况下,单环系统是含3-8个碳原子的环烃基基团,实例包括但不限于:环丙烷基、环丁烷基、环戊烷基、环己烷基、环庚烷基、环辛烷基等。
稠环环烷基包括并环环烷基、桥环烷基、螺环烷基。
并环环烷基可以为6-11元并环环烷基、7-10元并环环烷基,其代表性例子包括但不限于双环[3.1.1]庚烷、双环[2.2.1]庚烷、双环[2.2.2]辛烷、双环[3.2.2]壬烷、双环[3.3.1]壬烷和双环[4.2.1]壬烷。
螺环烷基可以为7-12元螺环烷基、7-11元螺环烷基,其实例包括但不限于:
上述的桥环烷基可以为6-11元桥环烷基、7-10元桥环烷基,其实例包括但不限于:
本文所用术语“杂环烷基”(或“杂脂环”)是指一价的单环的非芳香族环系,其环原子由碳原子及选自氮、氧、硫和磷的杂原子构成,并且通过一个单键连接至母核或其他基团;常见的杂环烷基包括(但不限于)环氧乙烷基、氧杂环丁烷-3-基、氮杂环丁烷-3-基、四氢呋喃-2-基、吡咯烷-1-基、吡咯烷-2-基、四氢-2氢-吡喃-2-基、四氢-2氢-吡喃-4-基、哌啶-2-基、哌啶-4-基等。
本文所用术语“杂环基”指3-12元的至少一个环碳原子被选自O、S、N的杂原子替代的非芳香性的环状基团,优选1-3个杂原子,同时包括碳原子、氮原子和硫原子可以被氧代。“3-12元杂环基”,是指单环杂环基、双环杂环基系统或多环杂环基系统(也称为稠环系统),包括饱和、部分饱和的杂环基,但不包括芳环。在不特别指明的情况下,包括可能形成的所有单环、稠环(包括以并、螺、桥的形式稠合)、饱和、部分饱和的情形。
单杂环基可以为3-8元单杂环基、3-6元单杂环基、4-7元单杂环基、5-7元单杂环基、5-6元单杂环基、5-6元含氧单杂环基、3-8元含氮单杂环基、5-6元含氮单杂环基、5-6元饱和单杂环基等,其实例包括但不限于:
稠杂环包括并杂环基、螺杂环基、桥杂环基,可以是饱和的、部分饱和的或不饱和的,但不是芳香性的。
并杂环基可以为6-12元并杂环基、7-10元并杂环基、6-10元并杂环基、6-12元饱和并杂环基,代表性实例包括但不限于:
螺杂环基可以为6-12元螺杂环基、7-11元螺杂环基、6-12元饱和螺环基,其实例包括但不限于:
上述的桥杂环基可以为6-12元桥杂环基、7-11元桥杂环基、6-12元饱和桥环基,其实例包括但不限于:
本文所用术语“芳基”(或“芳环”)是指一价的单环或多环(包含稠合形式)的芳香族环系,其仅有碳原子和氢原子构成;常见的芳基包括(但不限于)苯基、萘基、蒽基、菲基、苊基、薁基、芴基、茚基、芘基等。上述芳基也包括杂环基并芳基、环烷基并芳基;
本文所用术语“杂芳基”(或“杂芳环”)是指一价的单环或多环(包含稠合形式)的芳香族环系,其环原子由碳原子及选自氮、氧、硫和磷的杂原子构成;常见的杂芳基包括(但不限于)苯并吡咯基、苯并呋喃基、苯并噻吩基、苯并咪唑基、苯并噁唑基、苯并噻唑基、氮杂环丁烷基、咔唑基、吡咯基、呋喃基、噻吩基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、吲唑基、吲嗪基、吲哚基、喹啉基、异喹啉基、吩嗪基、吩噁嗪基、吩噻嗪基、蝶啶基、嘌呤基、吡嗪基、嘧啶基、哒嗪基、吡啶基、三唑基、四唑基等。上述杂芳基也包括杂环基并杂芳基、环烷基并杂芳基。
本发明所示化合物的“立体异构体”是指当化合物存在不对称碳原子时,会
产生对映异构体;当化合物存在碳碳双键或环状结构时,会产生顺反异构体;当化合物存在酮或肟时,会产生互变异构体,所有化合物的对映异构体、非对映异构体、消旋异构体、顺反异构体、互变异构体、几何异构体、差向异构体及其混合物,均包括在本发明范围中。
附图说明
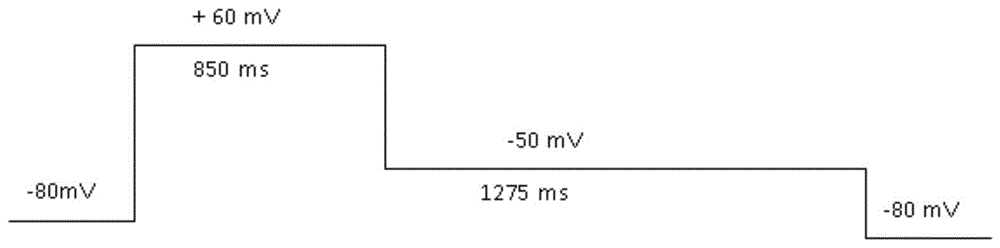
图1为手动膜片钳hERG电流测试指令电压程序
具体实施例
以下实施例详细说明本发明技术方案,但本发明保护范围包括但不限于此。
中间体的合成
中间体2
3-(3-羟基-3-甲基氮杂环丁烷-1-基)噻吩-2-甲醛(中间体2)的合成
步骤1:3-羟基-3-甲基氮杂环丁烷-1-羧酸叔丁酯(2-2)的合成
将2-1(1.71g,10mmol),溶于四氢呋喃(20mL),0℃下加入甲基溴化镁(10mL,30mmol),0℃反应2小时。反应完全后,加入饱和氯化铵(50mL),然后用乙酸乙酯(40mL×2)萃取,有机相用无水硫酸钠干燥,过滤,粗品用柱层析纯化(V
步骤2:3-羟基-3-甲基氮杂环丁烷盐酸盐(2-3)的合成
将中间体2-2(600g,3.2mmol),溶于4M的盐酸乙酸乙酯中(10mL),室温反应3小时。反应完全后,室温浓缩,得到无色透明液状中间体2-3(400mg,产率100%)。
步骤3:3-(3-羟基-3-甲基氮杂环丁烷-1-基)噻吩-2-甲醛(中间体2)的合成
室温下,将2-4(300mg,1.6mmol),中间体2-3(290mg,2.4mmol),醋酸钯(36mg,0.16mmol)、BINAP(100mg,0.16mmol)、碳酸铯(1.3g,4.0mmol),溶于甲苯(15mL),100℃反应16小时。反应完全后,加入水(30mL),然后用二氯甲烷(30mL×2)萃取,有机相用无水硫酸钠干燥,过滤,粗品用柱层析纯化(V
中间体3
1,3,3a,8a-四氢呋喃[3,4-b]噻吩并[3,4-e][1,4]二噁英-5-甲醛(中间体3)的合成
步骤1:1,3,3a,8a-四氢呋喃[3,4-b]噻吩并[3,4-e][1,4]二噁英(3-3)的合成
室温下,将3-1(1.5g,10.40mmol),3-2(2.17g,20.81mmol),甲苯(50mL)依次加入单口瓶,然后缓慢加入对甲基苯磺酸(358.28mg,2.08mmol),在氮气保护下,升温到100℃搅拌48h。反应完全后,降温到室温,反应液用水(100mL)稀释,然后用乙酸乙酯(50mL×3)萃取,合并有机相并用饱和食盐水(50mL×3)洗涤,有机相用无水硫酸钠干燥,过滤,粗品用柱层析纯化(V
步骤2:1,3,3a,8a-四氢呋喃[3,4-b]噻吩并[3,4-e][1,4]二噁英-5-甲醛(中间体3)的合成
将中间体3-3(410mg,2.23mmol),N,N-二甲基甲酰胺(1.63g,22.26mmol),二氯甲烷(20mL)依次加入单口瓶中,在0℃下,分多次滴加三氯氧磷(682.54mg,4.45mmol),加完后在0℃下搅拌1h。反应完后,用饱和碳酸钠水溶液(5mL)淬灭反应,然后加入水(10mL)稀释,二氯甲烷萃取(25mL×2),合并有机相,有机相用饱和食盐水洗涤(10mL×3),合并有机相用无水硫酸钠干燥,过滤,旋干。粗品用柱层析纯化(V
中间体4
2-(3-氧杂-8-氮杂双环[3.2.1]辛烷-8-基)苯甲醛(中间体4)的合成
室温下,将4-1(200mg,1.1mmol),4-2(243mg,1.6mmol),Pd
中间体5
2-(1,4-二氧杂螺[4.5]癸烷-7-烯-8-基)苯甲醛(中间体5)的合成
将4-1(200mg,1.08mmol),5-1(287.69mg,1.08mmol),碳酸钾(448.19mg,3.24mmol)和[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物(87.6mg,108.1μmol)依次加入单口瓶中,加入二氧六环(5mL)和水(1mL)溶解并用氮气置换气体三次,100℃下搅拌6h,反应完后,用硅藻土过滤,滤液减压旋干,粗品用柱层析纯化(洗脱液:V
中间体6
2-(3-氟氮杂环丁烷-1-基)苯甲醛(中间体6)的合成
室温下,将4-1(400mg,2.16mmol)、6-1(289.38mg,2.59mmol),醋酸钯(197.98mg,216.19mmol)、BINAP(269.24mg,0.43mmol)、碳酸铯(2.11g,6.49mmol)溶于甲苯(10mL),100℃反应12小时。反应完全后,加入水(20mL),然后用二氯甲烷(20mL×2)萃取,有机相用无水硫酸钠干燥,过滤,粗品用柱层析纯化(V
中间体7
2-(2-氧-6-氮杂螺[3.3]庚烷-6-基)苯甲醛(中间体7)的合成
将4-1(200mg,1.08mmol),7-1(107.16mg,1.08mmol),1,1'-联萘-2,2'-双二苯膦(67.3mg,108.1μmol),碳酸铯(1.06g,3.24mmol)和醋酸钯(24.27mg,108.1μmol)依次加入单口瓶中,加入甲苯(10mL)溶解并用氮气置换气体三次,加热到100℃搅拌6h,反应完后,用硅藻土过滤,滤液减压旋干,粗品用柱层析(洗脱液:V
中间体8
2-(3-甲氧基氮杂环丁烷-1-基)吡啶-3-基)甲醛(中间体8)的合成
室温下,将8-1(150mg,0.81mmol),8-2(147.05mg,1.21mmol),DIEA(312.68mg,0.24mmol)溶于DMF(6mL),100℃反应16小时。反应完全后,加入H
实施例1
氮-((3-甲氧基噻吩-2-基)甲基)-2-(9-(吡啶-2-基)-6-氧杂螺环[4.5]癸烷-2-烯-9-基)乙胺(化合物83)的合成
氮气保护下,将中间体A(80mg,0.31mmol),中间体1(53mg,0.37mmol),硫酸镁(744mg,6.2mol),二氯甲烷(6mL)依次加入单口瓶中,室温搅拌16h,加入硼氢化钠(35mg,0.93mmol),搅拌10分钟,加入甲醇(0.5mL),搅拌反应2小时。反应完后,加入二氯甲烷(10mL),过滤,室温浓缩,粗品柱层析纯化(V
1
实施例2
氮-(2-(3-氧杂-8-氮杂双环[3.2.1]辛烷-8-基)苄基)-2-(9-(吡啶-2-基)-6-氧杂螺[4.5]癸烷-2-烯-9-基)乙胺(化合物84)的合成
制备方法参考实施例1,得黄色稠状化合物84(产率15%),[M+H]
1
实施例3
氮-(2-(3-氟氮杂环丁烷-1-基)苄基)-2-(9-(吡啶-2-基)-6-氧杂螺[4.5]癸烷-2-烯-9-基)乙胺(化合物85)的合成
/>
制备方法参考实施例1,得黄色油状化合物85(产率31%),[M+H]
1
实施例4
氮-((1,3,3a,8a-四氢呋喃[3,4-b]噻吩并[3,4-e][1,4]二噁英-5-基)甲基)-2-(9-(吡啶-2-基)-6-氧杂螺环[4.5]癸烷-2-烯-9-基)乙胺(化合物112)的合成
制备方法参考实施例1,得黄色稠状化合物112(产率29%),[M+H]
1
实施例5
氮-(2-(1,4-二氧杂螺环[4.5]癸-7-烯-8-基)苄基)-2-(9-(吡啶-2-基)-6-氧杂螺[4.5]癸烷-2-烯-9-基)乙胺(化合物113)的合成
制备方法参考实施例1,得黄色稠状化合物113(产率29%),[M+H]
1
实施例6
氮-((3-(3-羟基-3-甲基氮杂环丁烷-1-基)噻吩-2-基)甲基)-2-(9-(吡啶-2-基)-6-氧杂螺[4.5]癸烷-2-烯-9-基)乙胺(化合物114)的合成
制备方法参考实施例1,得黄色稠状化合物114(产率29%),[M+H]
1
实施例7
氮-(2-(2-氧-6-氮杂螺环[3.3]庚烷-6-基)苄基)-2-(9-(吡啶-2-基)-6-氧杂螺[4.5]癸烷-2-烯-9-基)乙胺(化合物115)的合成
制备方法参考实施例1,得黄色稠状化合物115(产率29%),[M+H]
1
实施例8
氮-((2-(3-甲氧基氮杂环丁烷-1-基)吡啶-3-基)甲基)-2-(9-(吡啶-2-基)-6-氧杂螺[4.5]癸烷-2-烯-9-基)乙胺(化合物120)的合成
制备方法参考实施例1,得黄色稠状化合物120(产率29%),[M+H]
1
实施例9
氮-((3-甲氧基噻吩-2-基)甲基)-2-(4'-(吡啶-2-基)四氢氧杂螺[双环[3.1.0]己烷-3,2'-吡喃]-4'-基)乙胺(化合物91)的合成
氮气保护下,将中间体B(100mg,0.37mmol),中间体1(63mg,0.44mmol),硫酸镁(882mg,7.4mol),二氯甲烷(6mL)依次加入单口瓶中,室温搅拌16h,加入硼氢化钠(42mg,1.1mmol),搅拌10分钟,加入甲醇(0.5mL),搅拌反应2小时。反应完后,加入二氯甲烷(10mL),过滤,室温浓缩,粗品柱层析纯化(V
1
实施例10
氮-(2-(3-氧杂-8-氮杂双环[3.2.1]辛烷-8-基)苄基)-2-(4'-(吡啶-2-基)四氢氧杂螺[双环[3.1.0]己烷-3,2'-吡喃]-4'-基)乙胺(化合物92)的合成
制备方法参考实施例9,得黄色油状化合物92(产率23%),[M+H]
1
实施例11
氮-(2-(3-氟氮杂环丁烷-1-基)苄基)-2-(4'-(吡啶-2-基)四氢氧杂螺[双环[3.1.0]己烷-3,2'-吡喃]-4'-基)乙胺(化合物99)的合成
制备方法参考实施例9,得黄色稠状化合物99(产率19%),[M+H]
1
实施例12
氮-((1,3,3a,8a-四氢呋喃[3,4-b]噻吩并[3,4-e][1,4]二噁英-5-基)甲基)-2-(4'-(吡啶-2-基)四氢氧杂螺[双环[3.1.0]己烷-3,2'-吡喃]-4'-基)乙胺(化合物116)的合成
制备方法参考实施例9,得黄色稠状化合物116(产率29%),[M+H]
1
实施例13
氮-(2-(1,4-二氧杂螺环[4.5]癸烷-7-烯-8-基)苄基)-2-(4'-(吡啶-2-基)四氢氧杂螺[双环[3.1.0]己烷-3,2'-吡喃]-4'-基)乙胺(化合物117)的合成
制备方法参考实施例9,得黄色稠状化合物117(产率29%),[M+H]
1
实施例14
氮-((3-(3-羟基-3-甲基氮杂环丁烷-1-基)噻吩-2基)甲基)-2-(4'-(吡啶-2-基)四氢氧杂螺[双环[3.1.0]己烷-3,2'-吡喃]-4'-基)乙胺(化合物118)的合成
制备方法参考实施例9,得黄色稠状化合物118(产率29%),[M+H]
1
实施例15
氮-(2-(2-氧-6-氮杂螺环[3.3]庚烷-6-基)苄基)-2-(4'-(吡啶-2-基)四氢氧杂螺[双环[3.1.0]己烷-3,2'-吡喃]-4'-基)乙胺(化合物119)的合成
制备方法参考实施例9,得黄色稠状化合物119(产率29%),[M+H]
1
实施例16
氮-((2-(3-甲氧基氮杂环丁烷-1-基)吡啶-3-基)甲基)-2-(4'-(吡啶-2-基)四氢氧杂螺[双环[3.1.0]己烷-3,2'-吡喃]-4'-基)乙胺(化合物121)的合成
制备方法参考实施例9,得黄色稠状化合物121(产率29%),[M+H]
1
实施例17
氮-((3-(1,4-二氧杂-8-氮杂螺[4.5]癸烷-8-基)噻吩-2-基)甲基)-2-(9-(吡啶-2-基)-2,6-二氧杂螺[4.5]癸烷-9-基)乙胺(化合物15)的合成
室温下将15-1(87mg,0.343mmol)和C(95mg,0.362mmol)加入到二氯甲烷(2mL)中,再加入无水硫酸钠(150mg,1.029mmol),体系在25℃下搅拌16h,TLC(V
1
实施例18
氮-((4a,5,6,7,8,8a-六氢苯并[b]噻吩[3,4-e][1,4]二噁英-1-基)甲基)-2-(9-(吡啶-2-基)-2,6-二氧杂螺[4.5]癸烷-9-基)乙胺(化合物18)的合成
氮气保护下,将C(100mg,381.17μmol),18-1(85.49mg,381.17μmol),硫酸钠(100mg),二氯甲烷(3mL)依次加入单口瓶中,室温搅拌12h,加入硼氢化钠(43.26mg,1.143mmol),搅拌30分钟,加入甲醇(1mL),搅拌反应3.5小时。反应完后,加入水(5mL),过滤旋干,粗品用反相中压制备得到无色稠状油18(15mg,产率8.36%,纯度95%),[M+H]
1
实施例19
2-(9-(吡啶-2-基)-2,6-二氧杂螺[4.5]癸烷-9-基)-氮-((1,3,3a,8a-四氢呋喃并[3,4-b]噻吩并[3,4-e][1,4]二噁英-5-基)甲基)乙胺(化合物20)的合成
氮气保护下,将C(100mg,381.17μmol),3(88.98mg,419.42μmol),硫酸钠(181.50mg,1.52mmol),二氯甲烷(5mL)依次加入单口瓶中,室温搅拌12h,加入硼氢化钠(28.84mg,62.33μmol),搅拌10分钟,加入甲醇(0.3mL),搅拌反应1小时。反应完后,加入水(4mL),二氯甲烷萃取(5mL×2),合并有机相,有机相用饱和食盐水洗涤(8mL×1)。无水硫酸钠干燥,过滤,旋干。粗品用柱层析纯化(V
1
实施例20
氮-((3-甲氧基-[2,3'-联噻吩]-2'-基)甲基)-2-(9-(吡啶-2-基)-2,6-二氧杂螺[4.5]癸烷-9-基)乙胺(化合物27)的合成
氮气保护下,将27-1(100mg,445.83
1
实施例21
氮-((3-甲氧基噻吩-2-基)甲基)-2-(9-(吡啶-2-基)-2,6-二氧杂螺[4.5]癸烷-9-基)乙胺(化合物31)的合成
室温下,将C(50mg,0.162mmol)用二氯甲烷(3mL)溶解,然后依次加入硫酸钠(136mg,0.96mmol)和1(41mg,0.288mmol)。反应在氮气保护下室温过夜。反应16h后,加入硼氢化钠继续搅拌30分钟。反应完全后,用15mL水进行淬灭,加入乙酸乙酯(15×2mL)进行萃取然后用饱和碳酸钠溶液(10mL×2)洗涤,有机相用无水硫酸钠干燥,过滤,粗品用柱层析纯化(V
1
实施例22
氮-(2-(3-氟氮杂环丁烷-1-基)苄基)-2-(9-(吡啶-2-基)-6-双氧杂螺[4.5]癸烷-9-基)乙胺(化合物113)的合成
氮气保护下,将化合物6(80mg,446.45μmol),C(117.13mg,446.45μmol)和硫酸钠(80mg)依次加入到1,2-二氯乙烷(5mL)中溶解,60℃搅拌12h,加入硼氢化钠(50.67,1.34mmol),25℃搅拌30分钟,加入甲醇(1mL),搅拌反应3.5小时。反应完后,加入水(1mL),过滤旋干,粗品用反相中压制备得到淡黄色稠状油113(15mg,产率7.89%,纯度95%),[M+H]
1
实施例23
氮-(2-(3-氧-8-氮杂双环[3.2.1]辛-8-基)苄基)-2-(9-(吡啶-2-基)-6-双氧杂螺[4.5]癸烷-9-基)乙胺(化合物114)的合成
氮气保护下,将4(80mg,368.22μmol),C(96.60mg,368.22μmol)和硫酸钠(80mg)依次加入到1,2-二氯乙烷(5mL)中溶解,60℃搅拌12h,加入硼氢化钠(41.79mg,1.10mmol),25℃搅拌30分钟,加入甲醇(1mL),搅拌反应3.5小时。反应完后,加入水(1mL),过滤旋干,粗品用反相中压制备得到淡黄色稠状物114(20mg,产率11.7%,纯度95%),[M+H]
1
生物学评价
Op-Mu激动剂cAMP测试实验
本发明的化合物可以激活μ-阿片受体(MOR)。激活的MOR可以调节细胞内cAMP的水平,cAMP进入细胞核与报告基因荧光素酶(Luciferase)的CRE区结合,启动报告基因的表达。荧光素酶与其底物反应可发出荧光,通过测定荧光信号反映化合物的激动活性。
实验方法
实施例化合物激动MOR影响下游cAMP水平变化的活性通过以下的方法进行测试。
1.材料与试剂
2.实验操作步骤
检测缓冲液:1×stimulation buffer,500μM IBMX,ddH
化合物配制:化合物用DMSO溶解后配制为终浓度为10mM的母液,稀释成0.08mM的工作浓度,用Echo对化合物进行4倍梯度稀释,初始浓度为0.08mM,10个浓度梯度,并分别加50nL到384细胞板中,双复孔,终浓度为0.4μM,然后将细胞板1000rpm离心1min。用Echo转移50nLForskolin(终浓度是1μM)至384细胞板中。
细胞铺板:将冻存的细胞融化,1000转离心5min,弃掉上清液,用HBSS缓冲液清洗两次细胞后,用检测缓冲液重悬细胞,将细胞密度调整到5.0×10
标准曲线的配制:用检测缓冲液对标准品cAMP进行4倍梯度稀释,共8个浓度点,最高浓度是800nM,按照微孔板布局图每孔加入10μL。
检测试剂配制:用裂解缓冲液将Anti cAMP-Cryptate和AMP-d2稀释至1×,按照微孔板布局图,每孔加入10μL检测试剂,震荡20s,1000rpm离心1min,将细胞板放入23℃孵箱中培养60min;在Envision上读板。
3.结果分析
运用MicrosoftExcel软件计算活性百分比,对于激动剂使用公式%Effect=100×(Sample Raw Value-Low ControlAverage)/(High ControlAverage-Low ControlAverage),运用GraphPad Prism 5数据分析软件,对于激动剂选用Dose-response-Stimulation—log[agonist]vs.response--Variable slope模式进行拟合分析,得出各检测样品的EC
本发明的化合物激动MOR影响下游cAMP水平的变化通过以上的试验进行测定,实验结果表明此系列化合物表现出较强的Op-Mu激动效应,其中测得的具有典型代表的化合物的EC
表一:受试化合物对MOR受体影响cAMP水平的EC
Op-Kappa激动剂cAMP测试实验
ForsKolin(毛喉素)能够刺激人K阿片受体高表达细胞株-OPRKI细胞(DiscoveRx)cAMP的释放,而K阿片受体激动剂能够抑制forsKolin刺激的cAMP释放。通过检测受试化合物对forsKolin刺激的cAMP释放的抑制作用,能够测定化合物对人K片受体的激动活性。首先用一定浓度的forsKolin和不同浓度的受试化合物与人高表达K阿片受体细胞株一起孵育。使用基于时间分辨荧光共振能量转移(TR-FRET)的cAMP免疫测试法(LANCEPerKinElmer)来确定所激发的OPRK1细胞中的cAMP水平。具体方法如下:
检测缓冲液:1×stimulation buffer,500μM IBMX,ddH
细胞铺板:将冻存的细胞融化,1000转离心5min,弃掉上清液,用HBSS缓冲液清洗两次细胞后,用检测缓冲液重悬细胞,将细胞密度调整到3.0×10
运用Microsoft Excel软件计算活性百分比,对于激动剂使用公式%Effect=100×(Sample Raw Value-Low Control Average)/(High Control Average-Low ControlAverage)。运用GraphPad Prism 5数据分析软件,对于激动剂选用Dose-response-Stimulation—log[agonist]vs.response--Variable slope模式进行拟合分析,得出各检测样品的EC
表二:受试化合物对K阿片受体影响
本发明实施例化合物对激动K阿片受体的活性相比对照组明显较弱;表现出本发明化合物对MOR受体有高的选择性,推测本发明实施例化合物具有更低的副作用。
Mμ阿片受体的β-arrestin信号通路的活性测试实验
本研究旨在通过CHO-K1/Arrestin/hMOR的EC
表三:受试化合物对β-arrestin信号通路的影响
本发明实施例化合物对β-arrestin信号通路几乎无激活作用,以及本发明化合物和对照组相比有更好的偏向性(cAMP与β-arrestin信号通路),推测本发明化合物相比对照组具有更低的副作用。
测试本发明化合物对hERG钾电流的阻断作用
试验系统
细胞:中国仓鼠卵巢(CHO)细胞系,CHO-hERG细胞用于本试验。
细胞培养液及培养条件:完全培养基为F12培养基,补充加入10%胎牛血清,1%
细胞外液及内液成分:
试验方法
(1)将处于指数生长期的CHO-hERG细胞收集并重悬在ECS中备用。
(2)手动膜片钳试验
全细胞膜片钳技术下记录hERG电流,记录温度为室温。膜片钳放大器输出信号通过数模转换以及2.9KHz低通滤波。数据记录用Patchmaster Pro软件采集。
细胞种在细胞记录槽中放置在倒置显微镜载物台上,随机选择记录槽中的一个细胞进行试验。灌流系统固定在倒置显微镜载物台上用ECS持续灌流细胞。
用毛细玻璃管制备手动膜片钳试验记录微电极,其中充灌细胞內液。在膜片钳试验当天,使用硼硅酸盐玻璃管(BF150-117-10,SUTTER INSTRUMENT USA)制备电极。电极充灌ICS后电阻在2-5MΩ之间。钳制电压为-80mV,第一步去极化至+60mV并维持850ms开放hERG通道。然后,电压设置为-50mV并维持1275ms,产生反弹电流或者称为尾电流,尾电流的峰值将被测量并用于分析。最后,电压恢复到钳制电压(-80mV)。试验过程中,这个指令电压程序每间隔15s重复一次。手动膜片钳hERG电流测试指令电压程序如图1所示。
在溶媒对照工作溶液灌流的记录开始阶段,监测尾电流峰值直至稳定3条以上扫描曲线后则可以灌流待测试的供试品/阳性对照工作溶液,直到供试品/阳性对照工作溶液对hERG电流峰值的抑制作用达到稳定状态。一般以最近的连续3个电流曲线峰值基本重合作为判断是否稳定状态的标准。达到稳定态势以后继续灌流下一浓度供试品。一个细胞上可以测试一个或多个供试品/阳性对照,或者同一种药物的多个浓度,不同供试品/阳性对照之间需用溶媒对照工作液冲洗直到hERG电流回复到加药物之前80%以上的大小。同一浓度下各记录细胞抑制率的标准差不超过15%。
阳性对照西沙必利的测试浓度为0.1μM,重复测定两个细胞。根据科学文献报道,0.1μM的西沙必利抑制hERG电流超过50%。(Milnes,J.T.,etal.)。
(3)手动膜片钳数据接受标准
封接标准:全细胞模式形成后,施加钳制电压(-80mV),可以记录到细胞膜相关参数(Cm,Rm以及Ra)。一个好的的全细胞记录应该满足以下条件:路径电阻(Rs)小于10MΩ;膜电阻(Rm)大于500MΩ和膜电容(Cm)小于100pF。
电流大小:供试品/阳性对照品作用前峰电流幅度在400pA和5000pA之间。否则,放弃该细胞。
漏电流:在-80mV的钳制电压下,漏电流绝对值应该小于200pA。电流幅度将会用-80mV下的漏电流校正。漏电流绝对值大于200pA的扫描曲线不能用于分析。
数据分析
对于每个细胞,每一个浓度的供试品及阳性对照的抑制百分比由记录到的电流反应用以下公式算出:(1–供试品/阳性对照灌流后记录到的尾峰值电流/溶媒对照灌流记录到的尾峰值电流(起始电流))×100%。
对于每一个浓度记录到所有的细胞抑制百分比取均值,IC
试验结果
本发明部分化合物对hERG电流的抑制结果,具体见下表四;
表四:受试化合物对hERG电流的抑制结果
注:IC
本发明实施例化合物相比对照组具有较高的hERG IC
药代动力学实验
被研究化合物单次口服或者静脉给药(溶媒5%DMSO+10%Solutol(HS-15)+85%saline)于动物(例如小鼠、大鼠、犬或者猴子),在固定的时间点取血。血样采集后,立即温和地颠倒试管至少5次,保证混合充分后放置于冰上。血液用肝素抗凝,然后8000rpm离心5分钟,将血清与红细胞分离。用移液器吸岀血清转移至2mL的聚丙烯管,标明化合物的名称和时间点,在进行LC-MS分析前保存在-40℃冰箱,待测。髙浓度样品用空白血浆稀释测定时。样品处理后,用LCMS/MS对血浆中的物质进行定量分析。通过进行了验证的药动学计算机程序,用以这种方式获得的血浆浓度/时曲线来计算药动学参数。实验发现本发明化合物均具有较好的药代动力学性质。
SD雄性大鼠以表五组别剂量静脉给药后(各组为等摩尔剂量给药,溶媒为5%DMSO+10%Solutol(HS-15)+85%saline,每组3只),在固定的时间点取血检测。本发明的部分化合物的在大鼠血浆中的原型化合物药代动力学参数如下表五;
表五:受试化合物药代动力学参数
本发明实施例化合物在大鼠体内展现出良好的药代动力学性质;与对照组相比,本发明化合物在血浆中游离碱的AUC(h*ng/mL)均有显著提高。
大鼠热板法镇痛药效实验
雌性SD大鼠,将大鼠开始训练日期记为D0。于D0,将测痛仪温度设定为52℃(52.0±0.5℃),大鼠置于热板同时计时,记录大鼠出现舔后足或跳跃时痛阈值所用的时间(s)。若大鼠于热板上超过30s没有出现热痛反应,立即取出大鼠,痛阈值记为30s。淘汰反应敏感和反应迟钝大鼠。于D1,取预筛后的大鼠,将测痛仪温度设定为52℃(52.0±0.5℃),大鼠置于热板并计时,记录大鼠出现舔后足或跳跃时痛阈值所用的时间(s),共测三次。以三次平均值作为大鼠baseline痛阈值。于D1,大鼠根据baseline痛阈值随机分组,每组8只动物。于D2,按照表中各剂量组,通过尾静脉注射方式给予溶媒或化合物(各组等摩尔剂量给药,溶媒为5%DMSO+10%Solutol(HS-15)+85%saline)。于D2,各组大鼠给药后0.5min、0.5h、1h、3h,将测痛仪温度设定为52℃(52.0±0.5℃),大鼠置于热板并计时,记录大鼠出现舔后足或跳跃时痛阈值所用的时间(s),每个时间点测1次。若大鼠于热板上超过30s没有出现热痛反应,立即取出大鼠,痛阈值记为30s。计算各组各个时间点痛阈%MPE,评价各受试样品体内镇痛药效。实验数据以Mean±SEM表示,各组间数据采用GraphPad Prism进行方差分析(ANOVA)检验(Two WayANOVA或One-Way ANOVA),P<0.05认为是有显著性差异。
本发明实施例的化合物展现出更好的镇痛效果,在大鼠热板法镇痛药效研究中表现出痛阈更高,持续时间更长久的镇痛作用。
急性毒性实验
化合物单次静脉给药(溶媒5%DMSO+10%Solutol(HS-15)+85%saline)于SD大鼠(每个化合物设置4-6剂量组,每剂量组10只,雌性各半),给药后后进行临床观察。临床观察第一天两次,第二天开始一天一次,连续14天。包括行为学观察、自主活动和神经系统行为和死亡情况等,得到化合物的最大耐受量(MTD值)和半数致死量(LD
