一种靶向CD19的嵌合抗原受体及其用途
文献发布时间:2024-04-18 19:58:53
本申请是申请日为2020年12月14日、申请号为2020800153320、发明名称为“一种靶向CD19的嵌合抗原受体及其用途”的中国专利申请的分案申请。
技术领域
本申请涉及生物医药领域,具体的涉及一种靶向CD19的嵌合抗原受体及其用途。
背景技术
急性淋巴细胞白血病(ALL)、慢性淋巴细胞白血病(CLL)以及B细胞淋巴瘤的临床治疗,目前以化疗、干细胞移植及生物治疗等为主,虽然可以取得一定的疗效,但复发难治仍然是难以攻克的重点,肿瘤的细胞免疫治疗作为一种新的治疗策略,成为当今研究的热点。CD19几乎表达于所有的B细胞肿瘤细胞表面,而其他实质细胞和造血干细胞几乎不表达。
肿瘤细胞通过下调参与T细胞识别及抗原反应的分子表达、降低免疫原性等途径产生免疫逃逸,从而使机体的免疫系统不能很好的清除肿瘤。研究发现,嵌合抗原受体T细胞(CAR-T细胞)能够识别肿瘤细胞表面的抗原,特异性杀伤肿瘤细胞,用于肿瘤的治疗。
发明内容
本申请提供了一种嵌合抗原受体,所述嵌合抗原受体包含SEQ ID NO.1所示的氨基酸序列,本申请还提供编码所述嵌合抗原受体的核酸、包含所述核酸的载体、包含所述嵌合抗原受体、所述核酸分子和/或所述载体的免疫效应细胞、制备所述免疫效应细胞的方法、包含所述免疫效应细胞的组合物以及所述嵌合抗原受体的用途。
本申请所述的嵌合抗原受体至少包含以下一种有益效果:(1)在免疫细胞(例如,T细胞)表面稳定表达,表达量高;(2)具有较强的杀伤CD19阳性靶细胞的能力;(3)促进免疫细胞分泌细胞因子,例如,使T细胞分泌细胞因子(INF-γ或IL-6)的能力增强至少1倍、2倍或3倍以上;(4)无溶血性,不引起红细胞溶血或凝聚;(5)无血管刺激性,给药后不引起给药局部或全身异常;(6)无致瘤性,体内或体外不致瘤;(7)延长肿瘤患者的生存时间;(8)有效缓解肿瘤(例如,成人急性淋巴细胞白血病、儿童急性淋巴细胞白血病和/或非霍奇金淋巴瘤)病情;和,(9)安全性高,引起副作用(例如,细胞因子释放综合征或CAR-T细胞相关性脑病综合征)的风险较低。
一方面,本申请提供一种嵌合抗原受体,其包含SEQ ID NO.1所示的氨基酸序列。
另一方面,本申请还提供一种分离的核酸分子,其编码本申请所述的嵌合抗原受体。
另一方面,本申请还提供编码嵌合抗原受体的分离的核酸分子,其包含SEQ IDNO.2所述的核酸序列。
另一方面,本申请还提供一种载体,其包含本申请所述的核酸分子。
另一方面,本申请还提供一种免疫效应细胞,其包含本申请所述的嵌合抗原受体、所述的核酸分子和/或所述的载体。
在某些实施方式中,所述免疫效应细胞选自以下组:T淋巴细胞和自然杀伤细胞。
在某些实施方式中,所述免疫效应细胞的表面表达本申请所述的嵌合抗原受体。
另一方面,本申请还提供制备免疫效应细胞的方法,其包括以下的步骤:向免疫效应细胞中转导本申请所述的载体。
在某些实施方式中,所述免疫效应细胞选自以下组:T淋巴细胞和自然杀伤细胞。
另一方面,本申请还提供一种组合物,其包含本申请所述的免疫效应细胞。
另一方面,本申请还提供所述的嵌合抗原受体、所述的核酸分子、所述的载体和/或所述的免疫效应细胞用于制备药物的用途,其中所述药物用于治疗与CD19的表达相关的疾病或病症。
另一方面,本申请还提供治疗与CD19的表达相关的疾病或病症的方法,所述方法包括施用所述的嵌合抗原受体、所述的核酸分子、所述的载体和/或所述的免疫效应细胞。
另一方面,本申请还提供所述的嵌合抗原受体、所述的核酸分子、所述的载体和/或所述的免疫效应细胞,其用于治疗与CD19的表达相关的疾病或病症。
在某些实施方式中,所述与CD19的表达相关的疾病或病症包括非实体瘤。
在某些实施方式中,所述非实体瘤包括白血病和/或淋巴瘤。
在某些实施方式中,所述与CD19的表达相关的疾病或病症包括急性淋巴细胞白血病和/或B细胞淋巴瘤。
在某些实施方式中,所述急性淋巴细胞白血病包括成人急性淋巴细胞白血病和/或儿童急性淋巴细胞白血病。
在某些实施方式中,用于治疗急性淋巴细胞白血病的所述药物的剂量为0.25×10
在某些实施方式中,所述B细胞淋巴瘤包括非霍奇金淋巴瘤。
在某些实施方式中,用于治疗非霍奇金淋巴瘤的所述药物的剂量为1×10
本领域技术人员能够从下文的详细描述中容易地洞察到本申请的其它方面和优势。下文的详细描述中仅显示和描述了本申请的示例性实施方式。如本领域技术人员将认识到的,本申请的内容使得本领域技术人员能够对所公开的具体实施方式进行改动而不脱离本申请所涉及发明的精神和范围。相应地,本申请的附图和说明书中的描述仅仅是示例性的,而非为限制性的。
附图说明
本申请所涉及的发明的具体特征如所附权利要求书所显示。通过参考下文中详细描述的示例性实施方式和附图能够更好地理解本申请所涉及发明的特点和优势。对附图简要说明书如下:
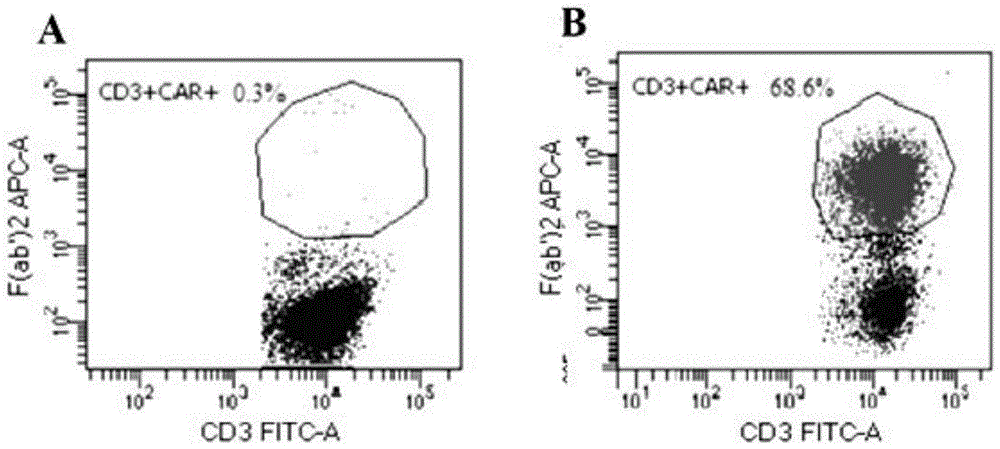
图1A和1B显示CAR分子在CNCT19细胞表面表达的检测结果。
图2显示不同共培养条件下的肿瘤细胞残留率。
图3显示RTCADP系统实时监测CNCT19细胞对靶细胞(CHO-CD19)的杀伤情况。
图4A显示不同共培养条件上清中INF-γ浓度的变化。
图4B显示不同共培养条件上清中IL-6浓度的变化。
图5A显示各试管3小时振摇前的观察结果。
图5B显示各试管3小时振摇后的观察结果。
图6A显示给予CAR-T细胞后给药局部的显微镜照片(HE染色,10倍物镜)。
图6B显示给予氯化钠注射液后给药局部的显微镜照片(HE染色,10倍物镜)。
图7显示各组细胞接种3周后的软琼脂克隆形成情况。
图8为不同细胞治疗Nalm-6移植瘤NCG小鼠的生存曲线。
图9显示CNCT19细胞单次给药后的组织分布情况。
图10为CNCT19细胞在荷瘤与未荷瘤动物体内分布的比较。
图11显示CNCT19细胞单次给药后在动物体内各组织分布的变化。
具体实施方式
以下由特定的具体实施例说明本申请发明的实施方式,熟悉此技术的人士可由本说明书所公开的内容容易地了解本申请发明的其他优点及效果。
以下对本申请做进一步描述:在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的蛋白质和核酸化学、分子生物学、细胞和组织培养、微生物学、免疫学相关术语和实验室操作步骤均为相应领域内广泛使用的术语和常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
在本申请中,术语“嵌合抗原受体”(Chimeric Antigen Receptor,CAR)通常是指包含能够结合抗原的胞外结构域和至少一个胞内结构域的融合蛋白。CAR是嵌合抗原受体T细胞(CAR-T)的核心部件,其可包括靶向部分(例如,结合肿瘤相关抗原(tumor-associatedantigen,TAA)的部分)、铰链区、跨膜区和细胞内结构域。在本申请中,所述CAR可以基于抗体的抗原特异性与T细胞受体活化胞内结构域组合在一起。表达CAR的T细胞可以特异地识别和消除表达靶抗原的恶性细胞。
在本申请中,术语“分离的”通常指从天然状态下经人工手段获得的。如果自然界中出现某一种“分离”的物质或成分,那么可能是其所处的天然环境发生了改变,或从天然环境下分离出该物质,或二者情况均有发生。例如,某一活体动物体内天然存在某种未被分离的多聚核苷酸或多肽,而从这种天然状态下分离出来的高纯度的相同的多聚核苷酸或多肽即称之为分离的。术语“分离的”不排除混有人工或合成的物质,也不排除存在不影响物质活性的其它不纯物质。
在本申请中,术语“免疫效应细胞”通常是指参与免疫应答,例如促进免疫效应应答的细胞。在本申请中,免疫效应细胞可以选自以下组:T淋巴细胞和自然杀伤细胞。
在本申请中,术语“特异性结合和/或识别”通常是指可测量的和可再现的相互作用,比如靶标和抗体(或CAR结构片段)之间的结合,可在分子(包括生物分子)的异质群体存在的情况可决定靶标的存在。例如,特异性结合靶标(其可以为表位)的抗体(或CAR结构片段)是以比它结合其它靶标更大的亲和性、亲合力、更容易、和/或以更大的持续时间结合该靶标的抗体(或CAR结构片段)。
在本申请中,术语“分离的核酸分子”通常指任何长度的分离形式的核苷酸、脱氧核糖核苷酸或核糖核苷酸,或从其天然环境分离的或人工合成的类似物。
在本申请中,术语“载体”通常指可将编码某蛋白的多聚核苷酸插入其中并使蛋白获得表达的一种核酸运载工具。载体可通过转化、转导或转染宿主细胞,使其携带的遗传物质元件在宿主细胞内表达得以表达。举例来说,载体包括:质粒;噬菌粒;柯斯质粒;人工染色体如酵母人工染色体(YAC)、细菌人工染色体(BAC)或P1来源的人工染色体(PAC);噬菌体如λ噬菌体或M13噬菌体及动物病毒等。用作载体的动物病毒种类有逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如SV40)。一种载体可能含有多种控制表达的元件,包括启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。载体还有可能包括有协助其进入细胞的成分,如病毒颗粒、脂质体或蛋白外壳,但不仅仅只有这些物质。
在本申请中,术语“组合物”通常指涉及适合施用于患者的组合物。例如,本申请所述的组合物,其可以包含本申请所述的免疫效应细胞。此外,所述组合物还可以包含一种或多种(药学上有效的)载剂、稳定剂、赋形剂、稀释剂、增溶剂、表面活性剂、乳化剂和/或防腐剂的合适的制剂。组合物的可接受成分在所用剂量和浓度下对接受者无毒。本申请的组合物包括但不限于液体、冷冻和冻干组合物。
在本申请中,术语“CD19”通常是指分化抗原簇19蛋白,是白血病前体细胞上可检出的抗原决定簇。可以在公共数据库(如GenBank、UniProt和Swiss-Prot)中找到人和鼠的CD19的氨基酸序列和核酸序列。例如,人CD19的氨基酸序列可以按UniProt/Swiss-Prot登录号P15391找到,编码人CD19的核苷酸序列可以按登录号NM_001178098找到。在本申请中,“CD19”可以包括突变(例如,全长野生型CD19的点突变、片段、插入、缺失和剪接变体)的蛋白质。
在本申请中,术语“受试者”通常指人类或非人类动物,包括但不限于猫、狗、马、猪、奶牛、羊、兔、小鼠、大鼠或猴。
在本申请中,术语“包含”通常是指包括明确指定的特征,但不排除其他要素。
在本申请中,术语“约”通常是指在指定数值以上或以下0.5%-10%的范围内变动,例如在指定数值以上或以下0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%或10%的范围内变动。
嵌合抗原受体、核酸、载体、免疫效应细胞、组合物
一方面,本申请提供一种嵌合抗原受体,其包含如SEQ ID NO.1所示的氨基酸序列。本申请还提供了包含与SEQ ID NO.1所示的氨基酸序列具有至少80%(如至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%)同一性的氨基酸序列。
在某些实施方式中,本申请所述的嵌合抗原受体可以特异性结合和/或识别肿瘤抗原。例如,本申请所述的嵌合抗原受体可以特异性结合和/或识别抗原CD19。
在某些实施方式中,本申请所述的嵌合抗原受体能够促进免疫效应细胞分泌细胞因子。所述免疫效应细胞可以选自以下组:T淋巴细胞和自然杀伤细胞。所述细胞因子可以选自下组:IFN-γ和IL-6。所述免疫效应细胞可以为哺乳动物的免疫效应细胞。所述T淋巴细胞可以为哺乳动物的T淋巴细胞,所述自然杀伤细胞也可以为哺乳动物的自然杀伤细胞。所述T淋巴细胞可以为人的T淋巴细胞,所述自然杀伤细胞也可以为人的自然杀伤细胞。
在某些实施方式中,本申请所述的嵌合抗原受体无溶血及血管刺激性。
在某些实施方式中,本申请所述的嵌合抗原受体无体外致瘤性。
在某些实施方式中,本申请所述的嵌合抗原受体无体内致瘤性。
在某些实施方式中,本申请所述的嵌合抗原受体可以有效治疗肿瘤。所述肿瘤可以为CD19阳性的肿瘤。例如,本申请所述的嵌合抗原受体可以有效延长CD19阳性肿瘤患者的生存时间。例如,本申请所述的嵌合抗原受体可以有效延长非实体瘤患者的生存时间。例如,本申请所述的嵌合抗原受体可以有效延长淋巴瘤和/或白血病的生存时间。又例如,本申请所述的嵌合抗原受体可以有效延长成人急性淋巴细胞白血病患者的生存时间。又例如,本申请所述的嵌合抗原受体可以有效延长儿童急性淋巴细胞白血病患者的生存时间。又例如,本申请所述的嵌合抗原受体可以有效延长B细胞淋巴瘤(例如,非霍奇金淋巴瘤)患者的生存时间。
在某些实施方式中,本申请所述的嵌合抗原受体可以有效治疗成人急性淋巴细胞白血病。
在某些实施方式中,本申请所述的嵌合抗原受体可以有效治疗儿童急性淋巴细胞白血病。
在某些实施方式中,本申请所述的嵌合抗原受体可以有效治疗非霍奇金淋巴瘤。
另一方面,本申请提供一种分离的核酸分子,其编码本申请所述的嵌合抗原受体。
另一方面,本申请提供一种编码嵌合抗原受体的分离的核酸分子,其包含SEQ IDNO.2所述的核酸序列。
另一方面,本申请提供一种编码嵌合抗原受体的分离的核酸分子,其包含如SEQID NO.2所示的核酸序列类似并且编码所述嵌合抗原受体的核酸分子。
在某些实施方式中,所述跟SEQ ID NO.2的核酸序列类似是指如SEQ ID NO.2所示的核酸序列具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%序列同一性的核酸序列。
在某些实施方式中,所述跟SEQ ID NO.2的核酸序列类似是指由于核酸密码子第三位碱基的摆动性(简并性)而跟SEQ ID NO.2的核酸不同,但是却编码所述嵌合抗原受体的核酸分子。
本申请包括基因和蛋白质的变体(例如,本文所述的如SEQ ID NO.1所述的氨基酸序列的变体,或如SEQ ID NO.2所述的核酸序列的变体),其保留一种或多种生物活性。蛋白质或多肽的此类变体包括已经或可以使用重组DNA技术进行修饰的蛋白质或多肽,使得该蛋白质或多肽具有改变的或附加的属性,例如,变体赋予蛋白质在血浆中增强的蛋白质稳定性或赋予蛋白质增强的活性。变体可以不同于参照序列,如不同于天然存在的多核苷酸、蛋白质或肽。在核苷酸序列水平,天然存在的变体基因和非天然存在的变体基因与参照基因将典型地至少约50%相同,更典型地至少约70%相同,甚至更典型地至少约80%相同(90%或更高同一性)。在氨基酸序列水平上,天然存在的变异蛋白质和非天然存在的变异蛋白质与参照蛋白质将典型地至少约70%相同,更典型地至少约80%相同,甚至更典型地至少约90%或者有更高的同一性,但在非保守区域允许有大部分非同一性的区域(例如,相同部分小于70%,诸如小于60%,小于50%或者甚至小于40%)。在其他实施方式中,所述序列与参照序列具有至少60%,70%,75%或更高的同一性(例如,80%,85%,90%,95%,96%,97%,98%,99%或更高的同一性)。对于本领域技术人员而言,在多核苷酸、蛋白或多肽中导入核苷酸和氨基酸的变化的程序是已知的(参见,例如,Sambrook et al.(1989))。
在本申请中,术语“同一性”、“同源性”及其语法变体通常指两个或更多个实体是“对齐”的序列时,它们是相同的。因此,例如,当两个多肽序列是相同的时,它们至少所参照的区域或部分之内具有相同的氨基酸序列。如果两个多核苷酸序列是相同的,则它们至少在所参照的区域或部分之内具有相同的多核苷酸序列。同一性可以是序列的所限定的区(区域或结构域)。同一性的“区”或“区域”是指两个或两个以上所参照的实体的相同的部分。因此,如果两个蛋白质或核酸序列在一个或多个序列区或区域内是相同的,则它们在该区域内有同一性。“对齐”的序列是指多个多核苷酸或蛋白质(氨基酸)序列,相比于参照序列,常含补正缺失或附加的碱基或氨基酸(间隙)。两个序列之间的同一性(同源性)的程度可以使用计算机程序和数学算法确定。计算百分比序列同一性(同源性)的这样的算法一般计算比较区域或区的序列间隙和不匹配。例如,BLAST(例如,BLAST 2.0)搜索算法(参见,例如,Altschul et al.,J.Mol.Biol.215:403(1990),公众可通过NCBI获得)具有示范性的搜索参数如下:不匹配-2,间隙打开5,间隙延伸2。
在本申请中,所述核酸分子可以为任何长度的分离形式的核苷酸、脱氧核糖核苷酸或核糖核苷酸,或从其天然环境分离的或人工合成的类似物,但可以编码本申请所述的嵌合抗原受体。
另一方面,本申请提供一种载体,其包含本申请所述的核酸分子。
在本申请中,所述载体可通过转化、转导或转染宿主细胞,使其携带的遗传物质元件在宿主细胞内表达得以表达。例如,载体可以包括:质粒;噬菌粒;柯斯质粒;人工染色体如酵母人工染色体(YAC)、细菌人工染色体(BAC)或P1来源的人工染色体(PAC);噬菌体如λ噬菌体或M13噬菌体及动物病毒等。用作载体的动物病毒种类有逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如SV40)。又例如,所述载体可以含有多种控制表达的元件,包括启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,所述载体还可以含有复制起始位点。此外,所述载体还可以包括有协助其进入细胞的成分,如病毒颗粒、脂质体或蛋白外壳,但不仅仅只有这些物质。
另一方面,本申请提供一种免疫效应细胞,其包含本申请所述的嵌合抗原受体、所述的核酸分子和/或所述的载体。
在本申请中,所述免疫效应细胞可以选自以下组:T淋巴细胞和自然杀伤细胞。在某些实施方式中,所述免疫效应细胞可以为人的免疫效应细胞。例如,所述免疫效应细胞可以为人的T淋巴细胞。又例如,所述免疫效应细胞可以为人的自然杀伤细胞。
在本申请中,所述免疫效应细胞的表面可以表达本申请所述的嵌合抗原受体。
在某些实施方式中,本申请所述的免疫效应细胞可以有效杀伤肿瘤细胞。所述肿瘤细胞可以是CD19阳性细胞。例如,本申请所述的免疫效应细胞可以明显降低CD19阳性人白血病细胞系Nalm-6的残留率。
在某些实施方式中,本申请所述的免疫效应细胞与CD19阳性细胞接触后,能够有效促进细胞因子的分泌。所述细胞因子可以选自下组:IFN-γ和IL-6。例如,本申请所述的免疫效应细胞与CD19阳性人白血病细胞系Nalm-6共培养后,其IFN-γ和IL-6细胞因子的分泌明显增加。
在某些实施方式中,本申请所述的免疫效应细胞无溶血性及血管刺激性。例如,在体外溶血试验中,本申请所述的免疫效应细胞不会导致溶血和血液凝聚。又例如,本申请所述的免疫效应细胞无血管刺激性。
在某些实施方式中,本申请所述的免疫效应细胞无体外致瘤性。
在某些实施方式中,本申请所述的免疫效应细胞无体内致瘤性。
在某些实施方式中,本申请所述的免疫效应细胞可以有效治疗肿瘤。所述肿瘤可以为CD19阳性的肿瘤。例如,本申请所述的免疫效应细胞可以有效延长CD19阳性肿瘤患者的生存时间。又例如,本申请所述的免疫效应细胞可以有效延长成人急性淋巴细胞白血病患者的生存时间。又例如,本申请所述的免疫效应细胞可以有效延长儿童急性淋巴细胞白血病患者的生存时间。又例如,本申请所述的免疫效应细胞可以有效延长B细胞淋巴瘤(例如,非霍奇金淋巴瘤)患者的生存时间。
在某些实施方式中,本申请所述的免疫效应细胞可以有效治疗成人急性淋巴细胞白血病。
在某些实施方式中,本申请所述的免疫效应细胞可以有效治疗儿童急性淋巴细胞白血病。
在某些实施方式中,本申请所述的免疫效应细胞可以有效治疗B细胞淋巴瘤(例如,非霍奇金淋巴瘤)。
另一方面,本申请提供一种组合物,其包含本申请所述的免疫效应细胞。
在本申请中,所述组合物还可以包含一种或多种(药学上有效的)载剂、稳定剂、赋形剂、稀释剂、增溶剂、表面活性剂、乳化剂和/或防腐剂的合适的制剂。组合物的可接受成分在所用剂量和浓度下对接受者无毒。本申请的组合物包括但不限于液体、冷冻和冻干组合物。
在某些实施方案中,所述组合物可以包含肠胃外、经皮、腔内、动脉内、鞘内和/或鼻内施用或直接注射到组织中。例如,所述组合物可以通过输注或注射施用于患者或者受试者。在另一些实施方案中,所述组合物的施用可以通过不同的方式进行,例如静脉内、腹膜内、皮下、肌肉内、局部或真皮内施用。在其他一些实施方案中,所述组合物可以不间断施用。所述不间断(或连续)施用可以通过患者佩戴的小泵系统来实现,以测量流入患者体内的治疗剂,如WO2015/036583所述。
在本申请中,所述组合物的给药方案可以是施用快速灌注剂,可以随时间推移施用多个分剂量,或者剂量可以随治疗情况的危急程度成比例降低或提高。在某些实施方式中,治疗方案可以是每周施用一次、两周一次、三周一次、四周一次、一个月一次、3个月一次、或3-6个月一次。在某些实施方式中,给药方案包括静脉内施用,施用剂量范围可以是0.1×10
针对不同的适应症,给药剂量可以不同。在某些实施方式中,所述免疫效应细胞治疗复发难治的成人急性淋巴细胞白血病患者的给药剂量可以为0.25×10
在某些实施方式中,所述免疫效应细胞治疗复发难治的儿童急性淋巴细胞白血病患者的给药剂量可以为0.25×10
在另一些实施方式中,所述免疫效应细胞治疗复发难治的非霍奇金淋巴瘤患者的给药剂量可以为1×10
制备方法和用途
另一方面,本申请还提供了制备免疫效应细胞的方法,其包括以下的步骤:向免疫效应细胞中转导本申请所述的载体。
在某些实施方式中,所述免疫效应细胞可以选自以下组:T淋巴细胞和自然杀伤细胞。
另一方面,本申请还提供了本申请所述的嵌合抗原受体、所述的核酸分子、所述的载体和/或所述的免疫效应细胞用于制备药物的用途,其中所述药物用于治疗与CD19的表达相关的疾病或病症。所述药物的给药剂量可以参考上文提到的所述免疫效应细胞的给药剂量。
另一方面,本申请还提供了治疗与CD19的表达相关的疾病或病症的方法,所述方法包括向有需要的受试者施用本申请所述的嵌合抗原受体、所述的核酸分子、所述的载体和/或所述的免疫效应细胞。在本申请中,所述施用可以通过不同的方式进行,例如静脉内、瘤内、腹膜内、皮下、肌肉内、局部或真皮内施用。
另一方面,本申请所述的嵌合抗原受体、所述的核酸分子、所述的载体和/或所述的免疫效应细胞,其可以用于治疗与CD19的表达相关的疾病或病症。
在本申请中,所述药物可以包括T细胞免疫治疗剂。
在本申请中,所述与CD19的表达相关的疾病或病症可以包括非实体瘤。
在本申请中,所述与CD19的表达相关的疾病或病症可以包括白血病和/或淋巴瘤。
在某些实施方式中,所述与CD19的表达相关的疾病或病症可以包括急性淋巴细胞白血病(ALL),例如,可包括成人急性淋巴细胞白血病(ALL)和/或儿童急性淋巴白血病(ALL)。在另一些实施方式中,所述与CD19的表达相关的疾病或病症可以包括成人慢性淋巴细胞白血病(CLL)。在另一些实施方式中,所述与CD19的表达相关的疾病或病症可以包括B细胞淋巴瘤。例如,所述B细胞淋巴瘤可以包括非霍奇金淋巴瘤。
在本申请中,所述受试者可以包括人类和非人类动物。例如,所述受试者可以包括但不限于猫、狗、马、猪、奶牛、羊、兔、小鼠、大鼠或猴。
不欲被任何理论所限,下文中的实施例仅仅是为了阐释本申请的嵌合抗原受体、免疫效应细胞、制备方法和用途等,而不用于限制本申请发明的范围。实施例不包括对传统方法的详细描述,如那些用于构建载体和质粒的方法,将编码蛋白的基因插入到这样的载体和质粒的方法或将质粒引入宿主细胞的方法。这样的方法对于本领域中具有普通技术的人员是众所周知的,并且在许多出版物中都有所描述,包括Sambrook,J.,Fritsch,E.F.andManiais,T.(1989)Molecular Cloning:ALaboratory Manual,2nd edition,Cold springHarbor Laboratory Press。
本申请中引用的所有专利、专利申请和参考文献均通过引用的方式全文纳入本申请,纳入程度就如同每一篇文献单独引用作为参考。如果本申请和本文提供的文献之间存在冲突,应以本申请中的内容为准。
实施例
实施例1.慢病毒载体的构建
人工合成包含本申请所述CAR结构的片段(其氨基酸序列和核苷酸序列分别如SEQID NO.1和SEQ ID NO.2所示),并构建到慢病毒载体(厂家:SBI公司,货号:CD500-CD800),将得到的表达载体命名为CNCT19表达载体,随后依照其说明书记载的方式转染获得慢病毒,并用流式细胞术测定病毒转染滴度,确认得到有功能性的慢病毒载体。
实施例2.慢病毒感染T细胞的制备
感染实验按照本领域技术人员已知的常规方法进行。简述感染步骤如下:
1.分选T细胞
从受试者单采血细胞中分离获得外周血单个核细胞(PBMC),然后从PBMC细胞中分选获得T细胞。
2.对T细胞进行激活处理
将分离的T细胞用完全淋巴细胞培养液(Xvivo15培养基+5% FBS+100IU/ml IL-2或Xvivo15培养基+5% FBS+20ng/ml IL-21+10ng/ml IL-7)进行重悬,使终浓度为(1~2)×10
3.慢病毒感染T细胞
取出激活培养的T细胞,加入终浓度为8μg/ml的聚凝胺(polybrene),混匀,并按MOI=2缓慢加入慢病毒载体,混匀后将其置于离心机中,1500rpm,离心1.5小时。然后将其置于培养箱培养,培养条件为37℃+5%CO
4.感染后T细胞的扩增培养
取出感染后的细胞,监测细胞密度,使细胞维持在(0.5~1)×10
实施例3.CAR分子在CNCT19细胞表面表达的检测
实验步骤如下:
(1)将CNCT19细胞悬液于300g离心5分钟,弃上清,加入鞘液重悬至活细胞密度为0.5~1×10
(2)每份样本取2支流式管,标记为1~2管,第1管为空白对照,不需要加抗体,第2管中加入10倍稀释的Alexa
(3)每管加入100μl细胞悬液,室温避光反应15~20分钟。
(4)每管加入2ml鞘液洗涤,300g离心5分钟。
(5)弃上清,在第2管中加入FITC-CD3(厂家:同生时代,货号:Z6410047-100T)20μl,室温避光孵育15~20分钟。
(6)每管加入2ml鞘液洗涤,300g离心5分钟,弃上清,每管再加入2ml鞘液洗涤,300g离心5分钟。
(7)弃上清,每管加入300μl鞘液重悬后,流式细胞仪检测。
结果如图1A和图1B所示,可以看出,图1A为空白对照管,在右上角CD3+CAR+象限未显示有细胞群,图1B为实验检测管,CART细胞经IgG F(ab’)
实施例4.CNCT19细胞对靶细胞的体外杀伤作用检测
本实施例的实验步骤如下:
1)肿瘤细胞(即靶细胞)分别选用CD19阳性人白血病细胞系Nalm-6(购自上海酶研生物科技有限公司,目录号:CH179)及CD19阴性人白血病细胞系KG-1a(购自上海酶研生物科技有限公司,目录号:CC-Y1305)。效应细胞分别为CD19 CAR-T细胞(即实施例2获得的CNCT19细胞)和未转染的T细胞(用NTD表示);
2)按效靶比1:2和2:1,分别混合上述靶细胞和效应细胞接种于24孔板中。使每孔中共培养的细胞总数约为1×10
3)共培养24小时后,收集各孔细胞悬液移至1.5mL EP管分别标记。此外,离心后吸取各样品管中上清液至新的1.5mL EP管,于-20℃冻存以备后续细胞因子检测使用(详见实施例6);
4)各孔混合细胞中按肿瘤细胞种类分别加入相应检测量的抗体标记,并按抗体说明书操作。使用PE-CD10抗体标记Nalm-6细胞,使用Percp-cy5.5-CD45抗体标记KG-1a细胞;
5)流式细胞仪检测各样品中不同肿瘤靶细胞的比例变化。
结果如图2所示,可以看出,相比于与未转染的T细胞(即NTD)共培养,CD19阳性肿瘤细胞Nalm-6与CAR-T细胞(即CNCT19细胞)共培养后,其残留率明显降低;而CD19阴性肿瘤细胞KG-1a与不同效应细胞共培养后的残留率没有明显差异。具体来说,在效靶比为1:2时,CNCT19细胞与Nalm-6细胞共同孵育后,靶细胞残留率为(2.8±1.3),显著低于未转染的T细胞与Nalm-6细胞共同孵育后的靶细胞残留率(12.1±1.2)%(P<0.01)。同样的,在效靶比为2:1时,CNCT19细胞与Nalm-6细胞共同孵育后的靶细胞残留率为(1.1±0.1)%,显著低于未转染的T细胞与Nalm-6细胞共同孵育后的靶细胞残留率(7.3±1.2)%(P<0.01)。且CNCT19细胞对CD19阳性肿瘤细胞的杀伤效果随着效靶比的增加而增强。
实施例5.实时监测CNCT19细胞的杀伤功能
实验步骤如下:
(1)取出靶细胞CHO-CD19,吸弃培养瓶内培养液,以生理盐水液清洗1次,加入1ml含EDTA的胰蛋白酶溶液,置37℃温箱中温育2-6分钟后终止消化。需要说明的是,CHO细胞采购自上海酶研生物科技有限公司,目录号:CC-Y2110;CD19细胞分子序列来源于NCBI,通过分子生物学的方法将CD19分子序列构建到CHO细胞中,经筛选获得所述靶细胞CHO-CD19细胞株。
(2)加入适量培养基至培养瓶,使所述靶细胞形成细胞悬液,并用移液管将细胞吹打均匀。用计数板计数细胞悬液浓度后,配制成实验需要的细胞浓度1×10
(3)在RTCA DP系统的E-Plate 16的孔中加入50μl培养基。将E-Plate 16放到RTCAStation上。RTCA系统会自动进行扫描(“Scan Plate”),检查是否接触良好(在“Message”页面显示Connection OK)。开始检测基线(Background)确定所选择的孔接触正常。
(4)取出E-Plate 16,在孔中加入100μl混合均匀的靶细胞悬液,使孔中细胞数目为1×10
(5)取出E-Plate 16,在一些孔中加入靶细胞悬液和CNCT19细胞悬液,在另一些孔中加入靶细胞悬液和未转染的T细胞(即NTD)悬液(作为对照),其中效靶比(即效应细胞与靶细胞的比值,即CNCT19细胞∶靶细胞;NTD∶靶细胞)为1:1,靶细胞悬液的体积为50μl,将E-Plate 16检测板置于RTCA DP检测台上实时监测60小时,观察CNCT19细胞对靶细胞的影响。
结果如图3所示,图中线1为NTD对照组曲线,线2为CNCT19处理组曲线。对比线1和线2,可以看出,肿瘤细胞(即靶细胞)随时间的延长,其增殖被CNCT19细胞抑制。具体来说,与未转染的T细胞共同孵育后,靶细胞生长趋势并无明显变化(线1),而与CNCT19细胞共同孵育后,靶细胞生长趋势明显降低,甚至数量开始减少(线2),说明CNCT19对靶细胞具有较强的杀伤能力。
实施例6.CNCT19细胞与靶细胞共培养后分泌细胞因子的检测
本实施例的实验步骤如下:
1)将实施例4中的各孔混合培养上清样品(即步骤3获得的样品)从-20℃冰箱取出,室温融化;
2)使用LEGENDplex
3)流式细胞仪检测各样品中不同细胞因子的水平。
结果如图4A和图4B所示,相比于未转染的T细胞(即NTD),CAR-T细胞(即CNCT19细胞)与Nalm-6细胞(CD19
实施例7.CNCT19细胞的溶血及刺激性检测
7.1.CNCT19细胞体外溶血试验
本实施例的实验步骤如下:
1)使用玻璃试管共7个,编为1~7号,各管中加入2.5mL 2%兔红细胞悬液(取自新西兰兔,生产单位:中国食品药品检定研究院,质量合格证编号:No.11400500032425)。
2)CNCT19细胞以1×10
3)每个试管的总体积为5.0mL,置于37℃±0.5℃恒温箱中温育3小时,放入恒温箱后15分钟、30分钟、45分钟、1小时、2小时和3小时观察红细胞有无溶解或凝聚。
结果如图5A和图5B所示,图5A显示各试管3小时振摇前的观察结果,图5B显示各试管3小时振摇后的观察结果,可以看出,阴性对照管(6号)可见试管上层液体无色澄明,管底红细胞下沉,经振摇后均匀分散,判断为无溶血无凝聚;阳性对照管(7号)可见溶液澄明红色,未见分层,管底无红细胞残留判断为完全溶血。而观察至3小时加入不同剂量CNCT19细胞的各试管均可见试管上层液体为无色澄明,管底红细胞下沉,经振摇后均匀分散,判断为无溶血无凝聚。
7.2.CNCT19细胞静脉输注的血管刺激性试验
本实施例的实验步骤如下:
1)选择检疫合格、注射局部无异常的新西兰兔6只,雌雄各半。采用同体自身对照法,各只动物右、左耳分别静脉输注给予冻存剂型CAR-T细胞(即CNCT19细胞)和阴性对照品(氯化钠注射液)。
2)经右耳缘静脉输注的CAR-T细胞浓度为1×10
3)静脉给药后对动物进行一般观察、给药局部观察及病理学检查。
结果如图6A和图6B所示,图6A显示给予CAR-T细胞后给药局部的显微镜照片(HE染色,10倍物镜),图6B显示给予氯化钠注射液后给药局部的显微镜照片(HE染色,10倍物镜),可以看出,冻存剂型CAR-T细胞经静脉输注后,与阴性对照侧比较,未发现动物全身或局部症状及病理学检查异常。
实施例8.CNCT19细胞的体外致瘤性试验
本实施例的实验步骤如下:
1)以软琼脂培养基分别培养两个供体来源的CAR-T细胞(即CNCT19细胞),两个供体分别是供体1(健康人供者T细胞,批号:TC20180613015)和供体2(健康人供者T细胞,批号:TC20180613016),另设人胚肺成纤维细胞系MRC-5为阴性对照,人宫颈癌细胞系Hela为阳性对照。
2)试验使用6孔培养板,每孔细胞数约为1×10
3)每隔1周取出培养板,用显微镜观察是否有克隆形成、并拍照,以阳性对照组生长出明显克隆为准。
结果如图7所示,可以看出,阳性对照组细胞(Hela)在培养基中形成克隆,且随着时间的延长,克隆明显增大。而观察至23天,不同供体来源的CAR-T细胞及阴性对照组细胞(MRC-5)均未见克隆形成生长,细胞全部死亡,不具有体外永生化增殖特征。
实施例9.CNCT19细胞的体内成瘤性试验
本实施例的实验步骤如下:
1)两个供体来源的冻存剂型CAR-T细胞(即CNCT19细胞)及相应未转染的T细胞(即NTD),分别皮下接种BALB/c裸鼠,其中两个供体分别是供体2(健康人供者T细胞,批号:TC20180613016)和供体3(健康人供者T细胞,批号:TC20180808019)。
2)CAR-T细胞接种量为1×10
3)连续观察16周,检测体重变化、是否发生结节,以及结节是否会诱发成肿瘤性结节,并与阴性及阳性细胞组对照比较。
4)观察结束后,进行大体解剖,取各脏器称重并计算脏器系数。对接种部位及可疑症状的组织或器官进行病理组织学检查。
结果发现CAR-T细胞不具有体内成瘤性。阴性对照组(接种MRC-5细胞)至接种后第9天所有动物液性结节均消失。而阳性对照组(接种HeLa细胞)所有动物皮下结节均缓慢增大,病理检查显示为肿瘤组织生长所致结节,成瘤率达100%,综上,本次试验有效。两个供体来源的CAR-T细胞及未转染的T细胞接种组,所有动物接种后第5天液性结节全部消失,至第114天安乐死时,均未再次生长结节,病理检查显示在接种部位或转移部位均未见肿瘤形成。
实施例10.CNCT19细胞单次静脉注射给予Nalm-6移植瘤NCG小鼠的毒性试验
本实施例的实验步骤如下:
1)使用6-8周龄的NCG小鼠,雌雄各半。于给药前三天尾静脉注射Nalm-6细胞,接种浓度为2.5×10
2)筛选动物分性别区段按照体重随机分为4组(即第2~5组),第2~5组分别为溶媒对照组、T细胞对照组和CAR-T细胞低、高剂量组,每组40只,雌雄各半。未荷瘤对照组(即第1组)和溶媒对照组(即第2组)均给予溶媒对照品(即生理盐水,其中含人血白蛋白含量4%(W/V))。T细胞对照组(即第3组)给予未转染的T细胞(即NTD),剂量为1×10
3)所有动物给药剂量均为25mL/kg,给药方式为单次静脉注射,给药速度约为1mL/min。
4)给药当天药后连续观察4小时,试验期间每天上午和下午各进行1次一般临床观察,每周进行1次详细临床观察、体重和摄食量测定,并在试验期间进行体温、临床病理指标(血细胞计数和血生化指标)和免疫学指标(T淋巴细胞亚群、细胞因子和C反应蛋白)的检测。
5)第1-5组的10只/性别/组于第2天,5只/性别/组于第15天实施安乐死并进行脏器称重和大体解剖观察,1、5组动物主要脏器进行组织病理学检查。
本次试验结果显示,CAR-T细胞(即CNCT19细胞)单次给药的最大耐受剂量大于1×10
实施例11.CNCT19细胞的动物治疗情况
11.1.CNCT19细胞对Nalm-6移植瘤NCG小鼠的治疗作用
本实施例的实验步骤如下:
1)使用6-8周龄的雌性NCG小鼠,于给药前三天,尾静脉注射5x10
2)各实验组注射相应的CAR-T细胞(即CNCT19细胞)、未转染的T细胞(即NTD)或细胞保存液(即生理盐水,其中人血白蛋白含量4%(W/V))。共分5组,分别为CAR-T低剂量组(注射CNCT19细胞,5×10
3)每周两次进行体重检测及一般临床观察。记录小鼠存活情况,绘制生存曲线。
结果如图8所示,CNCT19细胞各剂量组均对生存期有显著的延长作用,且剂量依赖关系明显。具体来说,中位生存时间:生理盐水对照组为24天,NTD对照组为23天,CNCT19低剂量组为40天,而CNCT19中、高剂量组实验动物至观察终点全部存活。与生理盐水及NTD对照组相比,CNCT19各剂量组皆能够延长白血病动物生存时间达16天以上。
11.2.CNCT19细胞在动物体内的分布情况
本实施例的实验步骤如下:
1)用6-8周龄的NCG小鼠,雌雄各半。使用11.1实施例的方法建立Nalm-6移植瘤模型。
2)荷瘤及非荷瘤动物均接受CAR-T细胞(即CNCT19细胞)单次尾静脉注射给药,剂量为5×10
3)荷瘤组动物分别在给药后24小时(即D2)、72小时(即D4)、168小时(即D8)、336小时(即D15)、504小时(即D22)、672小时(即D29),非荷瘤组动物分别在给药后24小时(即D2)、168小时(即D8)、336小时(即D15)按计划安乐死,按顺序采集动物全血(EDTA抗凝)、大脑、脊髓(颈段)、骨骼肌、生殖腺(卵巢、睾丸、附睾)、膀胱、胃、小肠、肠系膜淋巴结、骨髓、肝、肾、脾、心、肺等组织或体液。
4)采用经验证的Q-PCR的方法测定血液及各组织样品中嵌合抗原受体(即CAR)的含量。
结果显示,CNCT19细胞以5×10
结果还显示,CNCT19细胞在荷瘤鼠组织中的含量略高于非荷瘤鼠(见图10),给药后24小时,荷瘤鼠的全血、心和脊髓的CNCT19细胞浓度分别约为非荷瘤鼠的3倍、6倍、5倍以上。
此后,各组织中药物含量逐渐下降,至给药后两周基本降至方法学检测限以下。而当疾病进展时,随着CD19抗原刺激的增强,小鼠体内CNCT19细胞反应性地再次增殖(见图11),其中,脑、肺、肝、全血、脊髓的CNCT19细胞的浓度增加至1200拷贝数/微克DNA以上,甚至达到3500拷贝数/微克DNA。
实施例12.CNCT19细胞对急性淋巴细胞白血病的治疗情况
12.1.CNCT19细胞的临床使用情况
临床应用流程如表1所示,其中某些环节的具体实验步骤请见下文描述。
表1.CNCT19细胞的临床应用流程
1、清淋预处理
在计划CNCT19细胞悬液回输前-5天内进行。
预处理方案:
氟达拉滨:30mg/m
环磷酰胺:500mg/m
预处理化疗的两种药物需在同一天起开始使用。
2、CNCT19细胞悬液回输
(1)细胞制备成功后<-100℃条件下冻存,使用时在同等温度条件下运输至医院,输注前根据试验操作指南复苏;
(2)细胞回输方法:根据试验操作指南复苏细胞,细胞悬液需在复苏后30分钟内完成回输。单次输注,通过输血器经静脉输入受试者体内,若细胞悬液有1袋以上,每袋回输之间可无时间间隔,连续输注。受试者在细胞回输期间需密切观察,若出现严重不良事件则停止输注,并根据不良事件的具体情况进行相应处理。若未发生严重不良事件,可按照访视流程进行随访;
(3)受试者细胞回输后需密切观察24小时,若出现严重不良事件,则根据不良事件的具体情况进行相应处理;若未发生严重不良事件,可按照访视流程进行随访;
(4)细胞回输后,受试者继续住院观察14天或根据研究者对受试者的情况综合评估以决定住院观察时间。
3、CNCT19细胞悬液管理
为了严格管理和使用CNCT19细胞悬液,建立严格的CNCT19细胞悬液专人管理制度,由专人将研究用细胞悬液运输至医院科室,由专人负责研究用细胞悬液的接收、建立登记制度。
输注完毕后,细胞悬液包装由药物管理人员回收保存/销毁。
4、CNCT19细胞悬液治疗复发或难治性急性淋巴细胞白血病的临床疗效和安全性结果
本试验从2016年9月开始,至2020年10月,在探索性和I期临床期间,CNCT共治疗63例复发或难治性急性淋巴细胞白血病(ALL)患者,其中,成人患者23例,儿童患者40例。用于成人ALL摸索给药范围:0.25×10
(a)临床疗效结果数据如表2和表3所示,表2显示的是包括成人和儿童患者在内的63例患者的病情恢复情况,表3显示的是23例成人患者的病情恢复情况。可以看出,在63例复发难治的急性淋巴细胞白血病患者中,绝大部分(93.7%)的患者经所述CNCT19细胞悬液注射回输后,病情得到了完全缓解。且,MRD阴性的患者比例为88.9%。结果显示,CNCT19细胞悬液的注射回输能有效治疗复发或难治性急性淋巴细胞白血病成人患者和儿童患者。
表2.CNCT19细胞悬液对成人和儿童急性淋巴细胞白血病的临床疗效结果
表3.CNCT19细胞悬液对成人急性淋巴细胞白血病的临床疗效结果
注:在表2和表3中,
ORR(Overall remission rate):总体缓解率
MRD(Minimal Residual Disease)阴性:肿瘤细胞检测不到(最灵敏的方法)
CR(Complete Remission):完全缓解
Cri(Complete Remission with incomplete blood count recovery):形态学完全缓解而血细胞计数未完全恢复
b)安全性初步结果数据如表4和表5所示,表4显示的是包括成人和儿童患者在内的63例患者的安全性结果,表5显示的是23例成人患者的安全性结果。在63例ALL患者中,3级及以上CRS和脑病的发生率分别为19%和20.6%。年龄组之间相比,成人组的严重CRS发生率较儿童组高,其中成人为39.1%,儿童为7.5%,成人组严重CRES发生率与儿童组略低或接近,其中,成人为17.4%,儿童为22.6%。考虑可能是由于早期试验中,按体重给予CNCT19,成人体重大,剂量较高。例如,早期46例受试者中,剂量范围为0.71×10
可以看出,所述CNCT19细胞悬液的注射引起严重的CRS或CRES副作用的概率相对较低,总体安全性可控,因此具有良好的安全性能。说明CNCT19的良好的安全性能提升了产品质量,降低了临床风险。
表4.CNCT19细胞悬液对成人和儿童急性淋巴细胞白血病的安全性结果
表5.CNCT19细胞悬液对成人急性淋巴细胞白血病的安全性结果
注:在表4和表5中,
CRS(Cytokine Release Syndrome):细胞因子释放综合征
CRES(CAR-T-cell-related Encephalopathy Syndrome):CAR-T细胞相关脑病综合征
实施例13.CNCT19细胞对复发或难治性非霍奇金淋巴瘤的治疗情况
13.1.CNCT19细胞的临床使用情况
临床应用流程如表6所示,其中某些环节的具体实验步骤请见下文描述。
表6.CNCT19细胞的临床应用流程
1、清淋预处理
在计划CNCT19细胞悬液回输前-5天内进行。
预处理方案:
氟达拉滨:30mg/m
环磷酰胺:500mg/m
预处理化疗的两种药物需在同一天起开始使用。
2、CNCT19细胞悬液回输
(1)细胞制备成功后<-100℃条件下冻存,使用时在同等温度条件下运输至医院,输注前根据试验操作指南复苏;
(2)细胞回输方法:根据试验操作指南复苏细胞,细胞悬液需在复苏后30分钟内完成回输。单次输注,通过输血器经静脉输入受试者体内,若细胞悬液有1袋以上,每袋回输之间可无时间间隔,连续输注。受试者在细胞回输期间需密切观察,若出现严重不良事件则停止输注,并根据不良事件的具体情况进行相应处理。若未发生严重不良事件,可按照访视流程进行随访;
(3)受试者细胞回输后需密切观察24小时,若出现严重不良事件,则根据不良事件的具体情况进行相应处理;若未发生严重不良事件,可按照访视流程进行随访;
(4)细胞回输后,受试者继续住院观察14天或根据研究者对受试者的情况综合评估以决定住院观察时间。
3、CNCT19细胞悬液管理
为了严格管理和使用CNCT19细胞悬液,建立严格的CNCT19细胞悬液专人管理制度,由专人将研究用细胞悬液运输至医院科室,由专人负责研究用细胞悬液的接收、建立登记制度。
输注完毕后,细胞悬液包装由药物管理人员回收保存/销毁。
4、CNCT19细胞悬液治疗复发或难治性非霍奇金淋巴瘤的临床疗效及安全性结果数据
本试验从2016年9月开始,至2020年10月,在探索性和I期临床期间,CNCT19细胞悬液共治疗50例复发或难治性非霍奇金淋巴瘤(NHL)患者。其中,用于NHL(仅成人)摸索给药范围:1×10
(a)临床疗效结果数据如表7,表7显示的是50例患者的病情恢复情况。可以看出,在50例复发难治的非霍奇金淋巴瘤患者中,有约80%的患者经所述CNCT19细胞悬液的注射回输后,病情得到了完全缓解或部分缓解,其中,完全缓解率为54%(27例),部分缓解率为24%(12例)。说明CNCT19细胞悬液能有效治疗复发或难治性非霍奇金淋巴瘤患者。
表7.CNCT19细胞悬液对非霍奇金淋巴瘤的临床疗效结果
注:在表7中,
ORR(Overall remission rate):总体缓解率
CR(Complete Remission):完全缓解
PR(Partial Remission):部分缓解
b)安全性初步结果数据如表8所示,表8显示的是50例患者的安全性结果。可以看出,所述CNCT19细胞悬液注射引起严重的CRS或CRES副作用的概率低,级别在3级以上的副作用概率低于10%,其中,引起3级以上CRS的概率为0%,引起3级以上CRES的概率为6%,因此具有良好的安全性能。
表8.CNCT19细胞悬液对非霍奇金淋巴瘤的安全性结果
注:在表8中,
CRS(Cytokine Release Syndrome):细胞因子释放综合征
CRES(CAR-T-cell-related Encephalopathy Syndrome):CAR-T细胞相关脑病综合征
前述详细说明是以解释和举例的方式提供的,并非要限制所附权利要求的范围。目前本申请所列举的实施方式的多种变化对本领域普通技术人员来说是显而易见的,且保留在所附的权利要求和其等同方案的范围内。
