安丝菌素的两步树脂提纯工艺
文献发布时间:2024-04-18 19:58:53
本发明属于生物制药领域,涉及美登素类化合物安丝菌素的提取和纯化,特别涉及一种从发酵培养中通过两步树脂提纯安丝菌素的方法。
安丝菌素是一种美登素类抗生素,其主要是从微生物比如橙色珍贵束丝放线菌发酵生产的,具有极强的抗肿瘤、抗结核杆菌、抗细菌等多种药理活性。
安丝菌素P-3为主要发酵产物,其通过阻碍微管形成从而阻止细胞的有丝分裂使细胞死亡,在体外及荷瘤动物中具有显著抗肿瘤作用。
安丝菌素的化学结构式为:
通过发酵工艺生产的安丝菌素为在C-3处具有不同酯取代基的安丝菌素类,包括P-3(异丁酰)、P-3’(正定酰)、P-2(丙酰)、P-4(异戊酰)、P-4’(正戊酰)。这些不同酯取代均可以被还原成C-3美登木醇(P-0),该醇是用于合成美登素的前体。另外发酵产生的还有部分无法还原成美登木醇的安丝菌素,这类安丝菌素需要去除。
目前大多数专利和文献均描述发酵配方,对于纯化的工艺介绍较少,主要有以下现有技术述及。
CN108276427A披露了一种提纯安丝菌素的方法,其提纯工艺为,获得发酵液后,用溶剂进行萃取(乙酸乙酯、二氯甲烷、乙腈等),然后浓缩,中性氧化铝柱层析(乙酸乙酯/石油醚洗脱)、浓缩,最终产品纯度为80%。
CN104745655A披露了一种提纯安丝菌素的方法,其提纯过程为,获得 发酵液后,用大孔树脂层析(pH为6-7,溶剂为水和有机溶剂,大孔树脂的筛选型号为:Amberlite XAD-4、XAD-16、Diaion HP20JIP21和Sepabeads SP825.S P850.S P70.S P700)、硅胶/氧化铝柱层析(乙酸乙酯和己烷洗脱)、不良溶剂结晶(庚烷、己烷)。
其余文献有零星描述在制备过程中使用硅胶层析和不良溶剂结晶(正己烷、庚烷等)。
上述的分离提纯的步骤均较为复杂,不适于工业化生产,并且其中的正相填料使用的大部分为混合溶剂回收套用困难,分离得到目标物纯度不高或者收率低。我们需要开发目标物收率高,纯度高并且成本低适合工业化生产的工艺。
发明内容
发明人在研究中发现,依据发酵液中安丝菌素P-3与其类似物及其他杂质之间的极性差异,采用经过筛选的树脂层析和高压制备层析,可以获得含P-3高纯度流分。最后将流分浓缩过滤得到粗品,再次沉淀并烘干,可以得到纯度较高的产品。此外该提纯过程使用溶剂单一,成本低,适合工业化生产。该提纯方法使用的是树脂层析和C8/C18修饰的硅胶层析,其中C8/C18修饰的硅胶层析可循环使用,可以解决常规工艺中使用大量纯硅胶层析(纯硅胶层析只能一次性使用)的固废量大的问题。此外,该提纯方法使用的C1~C5的有机溶剂相比于常规工艺中使用的庚烷等沸点更高,安全性更高。
本发明提供一种安丝菌素P-3的提纯方法,具体通过多步树脂提取和解析、合并浓缩后处理得到目标产品。
本发明涉及的安丝菌素可以是发酵合成的,也可以是天然存在的安丝菌素。本发明涉及的安丝菌素液为通过常规发酵技术获取的,可以是安丝菌素发酵液,也可以是安丝菌素的水溶液,也可以是经过过滤得到的安丝菌素滤液,也可以是经过离心得到的安丝菌素上清液。
本发明使用大孔树脂,其孔径与安丝菌素的分子量相匹配,能够保证吸附的效率;且树脂不仅可以大批量使用,还可以回收利用,有助于整个提取工艺的大规模生产并节约成本。
针对现有技术提纯技术中使用正相填料的大部分为混合溶剂,其回收 套用困难,分离得到目标物纯度不高或者收率低的现状,本发明使用反相填料,制备高压层析,并在填料中选取C18填料及制备方法,使得本发明的提纯方法分离效果好,纯度高,操作安全,填料可回收使用。
使用本发明提供的方法来提纯的安丝菌素P-3的收率可达到70%以上,纯度可稳定达到85%以上。
本发明提供一种安丝菌素P-3的提纯方法,包括树脂提取和解析、合并浓缩后处理得到目标产物安丝菌素P-3。
作为一种具体的实施方式,所述的树脂为大孔树脂。
作为一种具体的实施方式,所述的树脂提取和解析为多步提取和多步解析,包括至少两次的树脂提取和解析。
作为一种具体的实施方式,所述的树脂提取和解析为两步提取和两步解析。
本发明进一步提供一种安丝菌素P-3的提纯方法,其步骤为:
a.第一步树脂提取:使用大孔树脂对安丝菌素发酵液进行树脂吸附;
b.第一步树脂解析:将步骤a中得到的树脂用有机溶剂进行树脂解析,层析洗脱,收集并合并层析液;
c.第二步树脂提取:将步骤b中得到的层析液打入已预装好树脂的树脂柱;
d.第二步树脂解析:将步骤c中得到的树脂用有机溶剂进行树脂解析,层析洗脱,收集并合并层析液;
e.后处理:将步骤d得到的层析液合并浓缩,进行后处理得到目标产物安丝菌素P-3。
作为一种具体的实施方式,所述步骤a中使用的大孔树脂选自LX-316、LX-392、LX-218、LX-30、LX-60、LX-T28、LX-T81、LX-T83、HZ-818、HZ-816、HZ-801、HZ-835。
作为一种具体的实施方式,所述步骤a中使用的大孔树脂优选为LX-60树脂。
作为一种具体的实施方式,所述步骤a中安丝菌素发酵液打入树脂柱的流速为0.5~5BV/h。
作为一种具体的实施方式,所述步骤a中安丝菌素发酵液打入树脂柱的流速优选为1~3BV/h。
作为一种具体的实施方式,所述步骤a中树脂载样量为1~30g/L,优选10~20g/L。
作为一种具体的实施方式,所述步骤a中树脂载样量优选为10~20g/L。
作为一种具体的实施方式,所述步骤b中的有机溶剂选自乙醇、乙腈、甲醇、丙酮、乙酸乙酯中的任一种或两种及以上的混合。
作为一种具体的实施方式,所述步骤b中的有机溶剂优选为乙醇。
作为一种具体的实施方式,所述步骤b中树脂解析的流速为0.5~5BV/h。
作为一种具体的实施方式,所述步骤b中树脂解析的流速优选为1~3BV/h。
作为一种具体的实施方式,所述步骤b中树脂层析洗脱为等度洗脱或梯度洗脱,其中有机相的洗脱范围为10~100%。
作为一种具体的实施方式,所述步骤b中树脂层析洗脱优选先使用20%乙醇洗脱2~4CV,后使用100%乙醇洗脱2~4CV。
作为一种具体的实施方式,所述步骤c中使用的大孔树脂选自LX-316、LX-392、LX-218、LX-30、LX-60、LX-T28、LX-T81、LX-T83、HZ-818、HZ-816、HZ-801、HZ-835。
作为一种具体的实施方式,所述步骤c中使用的大孔树脂优选为HZ-818树脂。
作为一种具体的实施方式,所述步骤c中层析液打入树脂柱的流速为0.5~5BV/h。
作为一种具体的实施方式,所述步骤c中层析液打入树脂柱的流速优选为2BV/h。
作为一种具体的实施方式,所述步骤c中树脂层析载样量为5g/L~10g/L。
作为一种具体的实施方式,所述步骤d中的有机溶剂选自乙醇、乙腈、甲醇、丙酮、乙酸乙酯中的任一种或两种及以上的混合。
作为一种具体的实施方式,所述步骤d中的有机溶剂优选为乙醇。
作为一种具体的实施方式,所述步骤d中树脂解析的流速为0.5~5BV/h。
作为一种具体的实施方式,所述步骤d中树脂解析的流速优选为1~3BV/h。
作为一种具体的实施方式,所述步骤d中树脂层析洗脱为等度洗脱或 梯度洗脱,其中有机相的洗脱范围为10~100%。
作为一种具体的实施方式,所述步骤d中树脂层析洗脱优选先使用30%乙醇洗脱2~4CV,后使用80%乙醇洗脱2~10CV。
作为一种具体的实施方式,所述步骤d中树脂层析洗脱更优选先使用30%乙醇洗脱3CV,后使用80%乙醇洗脱6CV。
作为一种具体的实施方式,所述的洗脱为梯度洗脱,其中有机相的洗脱梯度为10~100%,其中水相选自醋酸、磷酸、三氟乙酸的水溶液。
作为一种具体的实施方式,梯度洗脱的水相中酸浓度范围为0~5%;作为一种具体的实施方式,梯度洗脱的水相中酸浓度范围优选为0.05~0.2%。
本发明的有益效果为:
1.本发明使用了两步树脂提取,使用两种不同的大孔树脂即可完成85%以上纯度产品的纯化,突出优点是树脂原料价格便宜,设备要求低,且产品质量控制符合GMP标准,既可应用小规模实验室也适用于工业化生产。相比于现有技术记载的80%左右的提纯水平,本发明的方法尚未使用重结晶,且步骤简便,易回收,无需引入氧化铝或硅胶层析等步骤,避免了固废污染。
2.本发明工艺中的溶剂单一,各步骤间的溶剂适配,将由溶剂引入杂质的可能性最小化,且成本低,操作简便,对环境友好,在发酵液回收率达到70%的基础上,可以保证提纯的安丝菌素P-3纯度在85%以上,同时P系列同系物纯度达到95%以上。
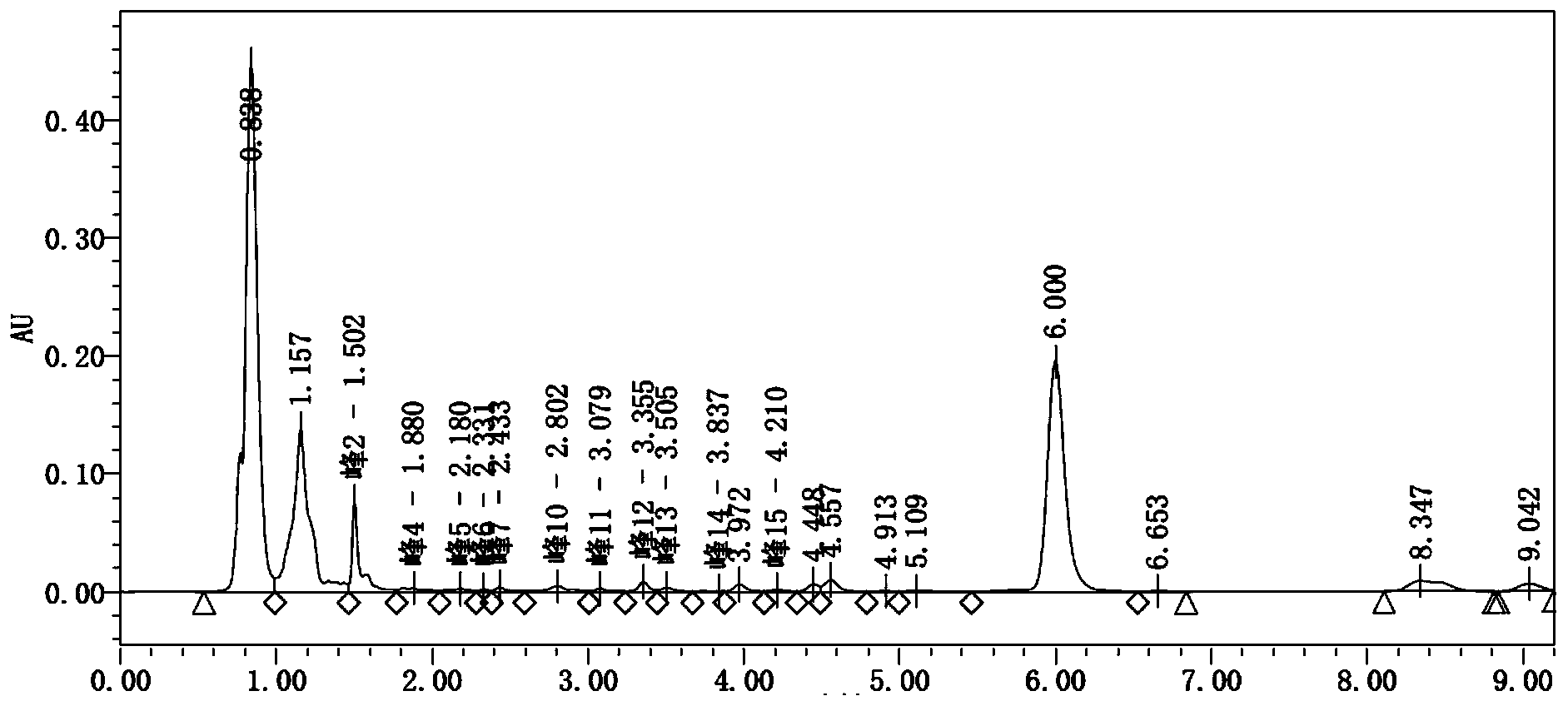
图1-发酵液的HPLC图;
图2-第一步树脂解析液的HPLC图;
图3-第二步树脂解析液的HPLC图;
图4-干燥后成品的HPLC图。
本发明实施例中未注明具体条件的实验方法,通常为常规条件,或按照原料或商品制造厂商所建议的条件;未注明来源的试剂,通常为通过商业途径可购得的常规试剂或者可以由已知的试剂通过常规方法制备得到。
下面结合具体实施例对本发明作进一步的详细说明。
实施例1
由生物发酵法得到安丝菌素发酵液后,用板框进行固液分离,发酵液中产品归一化峰面积百分比为42.81%。将板框滤液打入第一根树脂柱(树脂柱预先装填LX-60树脂),上柱流速2BV/h,载量10g/L。上柱完成后,用20%食用乙醇冲洗3BV,洗去部分色素和杂蛋白,再用食用乙醇解析,解析液0.5BV开始收集,直接打入配置罐,共收集2BV,收集液中产品归一化峰面积百分比为55.74%;
上一步得到的树脂层析合并液,加入等体积的水,搅拌10分钟。然后打入第二步的树脂层析柱(树脂柱预先装填HZ-818树脂),流速2BV/h,载量10g/L。上柱完成后,用30%食用乙醇冲洗3BV,洗去剩余色素和杂蛋白,再用80%乙醇解析,解析0.5BV后开始收集,检测,主峰纯度85.18%。
合并所有树脂层析液,真空浓缩至干,用乙醇溶解,然后用水沉淀、真空干燥(25℃,12h)。即得目标产物安丝菌素P-3,检测得到主峰归一化峰面积百分比为91.82%。
实施例2
板框滤液的获得同实施例1,将板框滤液打入第一根树脂柱(树脂柱预先装填HZ-801树脂),上柱流速2BV/h,载量10g/L。上柱完成后,用20%食用乙醇冲洗3BV,洗去部分色素和杂蛋白,再用食用乙醇解析,解析液0.5BV开始收集,直接打入配置罐,共收集2BV,收集液中产品归一化峰面积百分比为50.10%;
上一步得到的树脂层析合并液,加入等体积的水,搅拌10分钟。然后打入第二步的树脂层析柱(树脂柱预先装填HZ-835树脂),流速2BV/h,载量10g/L。上柱完成后,用30%食用乙醇冲洗3BV,洗去剩余色素和杂蛋白,再用80%乙醇解析,解析0.5BV后开始收集,检测,主峰纯度65.46%。
合并所有树脂层析液,真空浓缩至干,用乙醇溶解,然后用水沉淀、烘干(真空干燥,25℃,12h)。即得目标产物安丝菌素P-3,检测得到主峰归一化峰面积百分比为75.54%。
实施例3
板框滤液的获得同实施例1,将板框滤液打入第一根树脂柱(树脂柱预先装填LX-60树脂),上柱流速2BV/h,载量20g/L。上柱完成后,用20%食用乙醇冲洗3BV,洗去部分色素和杂蛋白,再用食用乙醇解析,解析液0.5BV开始收集,直接打入配置罐,共收集2BV,收集液中产品归一化峰面积百分比为44.48%;
上一步得到的树脂层析合并液,加入等体积的水,搅拌10分钟。然后打入第二步的树脂层析柱(树脂柱预先装填HZ-818树脂),流速2BV/h,载量20g/L。上柱完成后,用30%食用乙醇冲洗3BV,洗去剩余色素和杂蛋白,再用80%乙醇解析,解析0.5BV后开始收集,检测,主峰纯度为55.13%。
合并所有树脂层析液,真空浓缩至干,用乙醇溶解,然后用水沉淀、烘干(真空干燥,25℃,12h)。即得目标产物安丝菌素P-3,检测得到主峰归一化峰面积百分比为65.75%。
实施例4
板框滤液的获得同实施例1,将板框滤液打入第一根树脂柱(树脂柱预先装填LX-60树脂),上柱流速3BV/h,载量10g/L。上柱完成后,用20%食用乙醇冲洗3BV,洗去部分色素和杂蛋白,再用食用乙醇解析,解析液0.5BV开始收集,直接打入配置罐,共收集2BV,收集液中产品归一化峰面积百分比为52.90%;
上一步得到的树脂层析合并液,加入等体积的水,搅拌10分钟。然后打入第二步的树脂层析柱(树脂柱预先装填HZ-818树脂),流速3BV/h,载量10g/L。上柱完成后,用30%食用乙醇冲洗3BV,洗去剩余色素和杂蛋白,再用80%乙醇解析,解析0.5BV后开始收集,检测,主峰纯度68.87%。
合并所有树脂层析液,真空浓缩至干,用乙醇溶解,然后用水沉淀、烘干(真空干燥,25℃,12h)。即得目标产物安丝菌素P-3,检测得到主峰归一化峰面积百分比为82.25%。
实施例5
板框滤液的获得同实施例1,将板框滤液打入第一根树脂柱(树脂柱预先装填LX-60树脂),上柱流速2BV/h,载量10g/L。上柱完成后,用15% 食用乙醇冲洗3BV,洗去部分色素和杂蛋白,再用80%乙腈解析,解析液0.5BV开始收集,直接打入配置罐,共收集2BV,收集液中产品归一化峰面积百分比为54.13%;
上一步得到的树脂层析合并液,加入等体积的水,搅拌10分钟。然后打入第二步的树脂层析柱(树脂柱预先装填HZ-818树脂),流速2BV/h,载量10g/L。上柱完成后,用20%食用乙醇冲洗3BV,洗去剩余色素和杂蛋白,再用70%乙腈解析,解析0.5BV后开始收集,检测,主峰纯度80.45%。
合并所有树脂层析液,真空浓缩至干,用乙醇溶解,然后用水沉淀、烘干(真空干燥,25℃,12h)。即得目标产物安丝菌素P-3,检测得到主峰归一化峰面积百分比为88.45%。
上述实施例仅用于理解本发明的方法和核心思想,而不是限制本发明的范围。对于本领域技术人员来说,在不脱离本发明构思的前提下,进行任何可能的变化或替换,均属于本发明的保护范围。
