二甲基色胺的新型前药和缀合物
文献发布时间:2024-04-18 19:59:31
相关申请交叉引用
本申请要求2021年6月9日提交的美国临时专利申请第63/208,874号和2021年8月5日提交的美国临时申请第63/229,879号的优先权,所述美国临时专利申请和所述美国临时申请据此以全文引用的方式并入。
背景技术
N,N-二甲基色胺(DMT)是在许多植物物种和植物制剂中发现的天然存在的化合物,如称为死藤水(ayahuasca)的致幻浸剂,并且被分类为在人类中诱导感知、情感和认知的强烈改变的经典血清素能致幻剂。在较高剂量下,DMT具有快速发作、强烈的致幻效应和相对较短的作用持续时间,其所估计的半衰期小于十五分钟。与色胺家族中的其它迷幻剂一样,DMT与血清素受体结合以产生欣快和致幻效应。遗憾的是,DMT在代谢上不稳定,并且容易被单胺氧化酶(MAO)转化为吲哚乙酸和N氧化代谢物,从而导致口服生物利用度差。
血清素能致幻剂也已显示出有前景的抗抑郁、抗焦虑和抗成瘾性质。
仍然需要改善的如N,N-二甲基色胺(DMT)等色胺的前药。
发明内容
一方面,本公开提供了一种式(I)的化合物:
或其药学上可接受的盐;
其中,
R
X、Y和Z独立地是氢、卤素、-O-、-S-、-NR
R'、R
R
R
L和M独立地是烷基或芳基;
W是氧、硫或NR
n是2-7的整数;并且
m是1-4的整数,
其中R'、R
在一些实施例中,所述式(I)的化合物是式(IV)的化合物:
其中R
A是药学上可接受的阴离子,并且
其中R
在一些实施例中,所述式(I)的化合物是下式的化合物:
其中R
在一些实施例中,本公开提供了一种式(III)的化合物:
或其药学上可接受的盐;
其中,
R
X、Y和Z独立地是氢、卤素、-O-、-S-、-NR
R'、R
R
R
L和M独立地是烷基或芳基;
n是2-7的整数;并且
m是1-4的整数,
其中R'、R
在一些实施例中,所述式(V)的化合物是下式的化合物:
其中R
(C=O)(CH
A是药学上可接受的阴离子,
并且其中R
在一些实施例中,本公开提供了一种药物组合物,其包括式(I)的化合物或其药学上可接受的盐和药学上可接受的赋形剂。
在一些实施例中,本公开提供了一种药物组合物,其包括式(II)的化合物或其药学上可接受的盐和药学上可接受的赋形剂。
附图说明
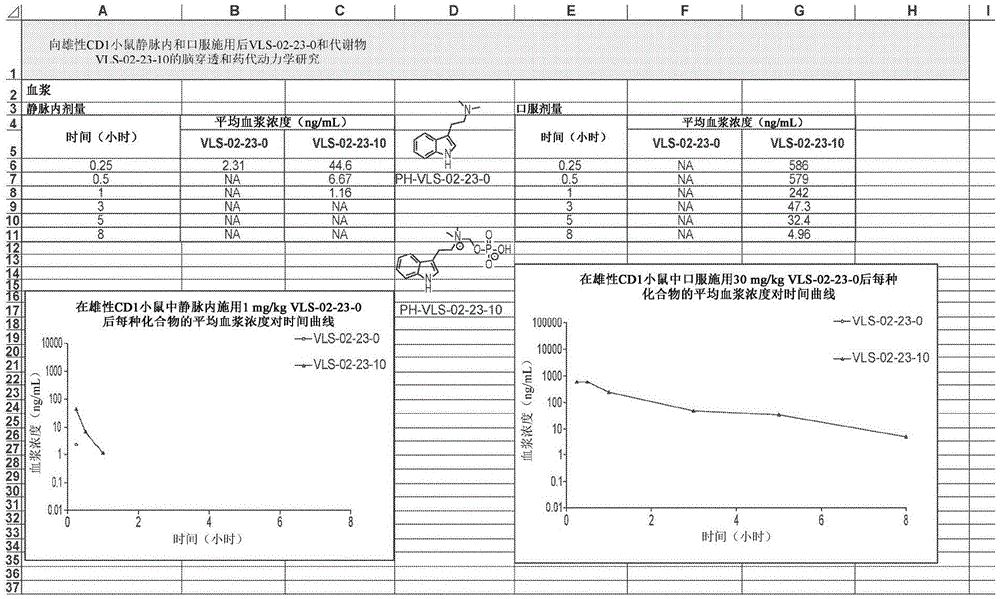
图1示出了在向雄性CD1小鼠(在血浆中)静脉内(1mg/kg)和口服(30mg/kg)施用后N-磷酰氧基甲基前药6-1-2(VLS-02-23-0)和代谢物(VLS-02-023-10)的PK研究。
图2示出了在向雄性CD1小鼠(在脑中)静脉内(1mg/kg)和口服(30mg/kg)施用后N-磷酰氧基甲基前药6-1-2(VLS-02-23-0)和代谢物(VLS-02-023-10)的PK研究。
具体实施方式
贯穿本公开,引用了各种专利、专利申请和出版物。这些专利、专利申请和出版物的公开出于所有目的通过引用以其整体并入本公开,以便更全面地描述自本公开的日期起本领域技术人员已知的现有技术的状态。本公开将在所引用的专利、专利申请和出版物与本公开之间存在任何不一致的情况下进行管理。
定义
为了方便起见,此处集中了在说明书、实例和所附权利要求书中所采用的某些术语。除非另外定义,否则本公开中所使用的所有技术和科学术语具有与本公开所属领域的一般技术人员通常所理解相同的含义。
当紧接在数值之前时,术语“约”意指范围(例如,该值的正负10%)。例如,“约50”可以意指45至55,“约25,000”可以意指22,500至27,500等,除非本公开的上下文另外指示或与此类解释不一致。例如,在如“约49、约50、约55、...”等数字值列表中,“约50”意指延伸到小于先前值与后续值之间的间隔的一半的范围,例如大于49.5至小于50.5。此外,鉴于本文提供的术语“约”的定义,应理解短语“小于约”值或“大于约”值。类似地,当在一系列数值或值范围(例如,“约10、20、30”或“约10-30”)之前时,术语“约”分别指系列中的所有值或范围的端点。
如本文所用,术语“施用(administer)”、“施用(administering)”、“施用(administration)”是指向患者施用化合物或化合物的药学上可接受的盐或包括化合物或化合物的药学上可接受的盐的组合物或调配物。
术语“药学上可接受的盐”包含酸加成盐和碱加成盐两者。药学上可接受的盐包含通过使充当碱的活性化合物与无机或有机酸反应以形成盐而获得的盐,例如盐酸、硫酸、磷酸、甲磺酸、樟脑磺酸、草酸、马来酸、琥珀酸、柠檬酸、甲酸、氢溴酸、苯甲酸、酒石酸、富马酸、水杨酸、扁桃酸、碳酸等的盐。可以用于制备此类碱性化合物的药学上可接受的酸加成盐的酸是形成无毒酸加成盐的酸,即,含有药学上可接受的阴离子的盐,包含但不限于苹果酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、乙酸盐、酒石酸盐、油酸盐、富马酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、苯磺酸盐和对甲苯磺酸盐。碱加成盐包含但不限于乙二胺、N-甲基-葡糖胺、赖氨酸、精氨酸、鸟氨酸、胆碱、N,N'-二苄基乙二胺、氯普鲁卡因、二乙醇胺、普鲁卡因、N-苄基苯乙胺、二乙胺、哌嗪、三(羟甲基)-氨基甲烷、四甲基氢氧化铵、三乙胺、二苄胺、非那明(ephenamine)、脱氢松香胺、N-乙基哌啶、苄胺、四甲基铵、四乙胺、甲胺、二甲胺、三甲胺、乙胺、碱性氨基酸(例如赖氨酸和精氨酸)、二环己胺等。金属盐的实例包含锂、钠、钾、镁、钙盐等。铵盐和烷基化铵盐的实例包含铵、甲基铵、二甲基铵、三甲基铵、乙基铵、羟乙基铵、二乙基铵、丁基铵、四甲基铵盐等。有机碱的实例包含赖氨酸、精氨酸、胍、二乙醇胺、胆碱等。本领域技术人员将进一步认识到,酸加成盐可以通过化合物与适当的无机或有机酸通过多种已知方法中的任一种方法进行反应来制备。
如本文中关于患者使用的术语“治疗”是指改善患者的病症的至少一种症状。在一些实施例中,治疗可以是改善或至少部分地改善病症或病症的一种或多种症状。
如本文中关于患者或受试者使用的术语“预防”是指:如果疾病发展没有发生,则预防疾病的发作;预防可能易患病症或疾病但尚未诊断为患有病症或疾病的受试者或患者发生疾病或病症;和/或如果已经存在,则预防进一步的疾病/病症发展。
应用于剂量或量的术语“治疗有效”是指足以在施用于有需要的患者之后产生期望的临床益处的化合物或药物调配物的量。
在列出一系列值时,意图涵盖范围内的每个值和子范围。例如,“C
“烷基(alkyl/alkylgroup)”是指具有一个至十二个碳原子并且通过单键与分子的其余部分连接的完全饱和的直链或支链烃链。包含包括1至12个任何数量的碳原子的烷基。包括至多12个碳原子的烷基是C
“芳基”是指烃环体系,其包括氢、6至18个碳原子和至少一个芳香族环并且通过单键连接到分子的其余部分。出于本公开的目的,芳基可以是单环、双环、三环或四环体系,其可以包含稠环或桥环体系。芳基包含但不限于衍生自醋蒽烯、苊烯、醋菲烯、蒽、薁、苯、屈、荧蒽、芴、as-引达省、s-引达省、茚满、茚、萘、非那烯(phenalene)、菲、七曜烯(pleiadene)、芘和苯并菲(triphenylene)的芳基。除非在说明书中另有特别说明,否则“芳基”可以任选地被取代。
“环烷基”是指仅由碳原子和氢原子组成的稳定的非芳香族单环或多环完全饱和烃,其可以包含具有三至二十个碳原子(例如,具有三至十个碳原子)的稠环、桥环或螺环体系并且通过单键连接到分子的其余部分。单环环烷基包含,例如,环丙基、环丁基、环戊基、环己基、环庚基和环辛基。多环环烷基包含例如金刚烷基、降冰片基、十氢萘基、7,7-二甲基-双环[2.2.1]庚基等。除非说明书中另有特别说明,否则环烷基可以任选地被取代。
“杂环基”、“杂环(heterocyclic ring/heterocycle)”是指稳定的饱和、不饱和或芳香族3至20元环,其由二至十九个碳原子和一至六个选自由氮、氧和硫组成的组的杂原子组成并且通过单键连接到分子的其余部分。杂环基或杂环包含杂芳基、杂环基烷基、杂环基烯基和杂环基炔基。除非说明书中另外具体说明,否则杂环基可以是单环、双环、三环或四环体系,其可以包含稠环、桥环或螺环体系;并且杂环基中的氮、碳或硫原子可以任选地被氧化;氮原子可以任选地被季铵化;并且杂环基可以是部分或完全饱和的。此类杂环基的实例包含但不限于二氧戊环基、噻吩基[1,3]二噻烷基、十氢异喹啉基、咪唑啉基、咪唑烷基、异噻唑烷基、异噁唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、2-氧代哌嗪基、2-氧代哌啶基、2-氧代吡咯烷基、噁唑烷基、哌啶基、哌嗪基、4-哌啶酮基、吡咯烷基、吡唑烷基、喹宁环酯基、噻唑烷基、四氢呋喃基、三噻吩基、四氢吡喃基、硫代吗啉基、噻吗啉基、1-氧代-硫代吗啉基和1,1-二氧代-硫代吗啉基。除非在说明书中另有特别说明,否则杂环基可以任选地被取代。
“杂芳基”是指包括氢原子、一至十九个碳原子、一至六个选自由氮、氧和硫组成的组的杂原子、至少一个芳香族环并且通过单键连接到分子的其余部分的5至20元环体系。出于本公开的目的,杂芳基可以是单环、双环、三环或四环体系,其可以包含稠环或桥环体系;并且杂芳基中的氮、碳或硫原子可以任选地被氧化;氮原子可以任选地被季铵化。实例包含但不限于氮杂基、吖啶基、苯并咪唑基、苯并噻唑基、苯并吲哚基、苯并二氧杂环戊烯基、苯并呋喃基、苯并噁唑基、苯并噻唑基、苯并噻二唑基、苯并[b][1,4]二氧氮杂基、1,4-苯并二噁烷基、苯并萘并呋喃基、苯并噁唑基、苯并二氧杂环戊烯基、苯并二噁英基、苯并吡喃基、苯并吡喃酮基、苯并呋喃基、苯并呋喃酮基、苯并噻吩基(苯并硫苯基)、苯并三唑基、苯并[4,6]咪唑并[1,2-a]吡啶基、咔唑基、噌啉基、二苯并呋喃基、二苯并噻吩基、呋喃基、呋喃酮基、异噻唑基、咪唑基、吲唑基、吲哚基、吲唑基、异吲哚基、吲哚啉基、异吲哚啉基、异喹啉基、吲哚嗪基、异噁唑基、萘啶基、噁二唑基、2-氧代氮杂基、噁唑基、环氧乙烷基、1-环氧吡啶基、1-环氧嘧啶基、1-环氧吡嗪基、1-环氧哒嗪基、1-苯基-1H-吡咯基、吩嗪基、吩噻嗪基、吩噁嗪基、酞嗪基、蝶啶基、嘌呤基、吡咯基、吡唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、喹唑啉基、喹喔啉基、喹啉基、奎宁环酯基、异喹啉基、四氢喹啉基、噻唑基、噻二唑基、三唑基、四唑基、三嗪基和噻吩基(即,噻吩基)。除非在说明书中另有特别说明,否则杂芳基可以任选地被取代。
本文所用的术语“经取代的”意指本文所述的其中至少一个氢原子被与非氢原子的键替代的任何基团(例如,烷基、烯基、炔基、烷氧基、芳基、环烷基、环烯基、卤代烷基、杂环基和/或杂芳基),所述非氢原子如但不限于:卤素原子,如F、Cl、Br和I;如羟基、烷氧基和酯基团等基团中的氧原子;如硫醇基团、硫代烷基基团、砜基团、磺酰基和亚砜基团等基团中的硫原子;如胺、酰胺、烷基胺、二烷基胺、芳基胺、烷基芳基胺、二甲胺、N氧化物、酰亚胺和烯胺等基团中的氮原子;如三烷基甲硅烷基、二烷基芳基甲硅烷基、烷基二芳基甲硅烷基和三芳基甲硅烷基等基团中的硅原子;和各种其它基团中的其它杂原子。“经取代的”还意指以上基团中的任何基团,其中一个或多个氢原子被与杂原子的更高阶键(例如,双键或三键)替代,所述杂原子如氧代、羰基、羧基和酯基团中的氧;以及如亚胺、肟、腙和腈等基团中的氮。例如,“经取代的”包含以上基团中的任何基团,其中一个或多个氢原子被以下替代:-NR
化合物
本公开提供了作为色胺的前药的化合物,并且涉及支架(例如N,N-二甲基色胺(DMT))以及其药物组合物。
DMT在代谢上不稳定,并且容易被单胺氧化酶(MAO)转化为吲哚乙酸和N氧化代谢物,从而导致口服生物利用度差。在一些实施例中,本公开的化合物允许DMT的受控释放。本公开的化合物的优点可以包含代谢稳定性增加、吸收增加、母体药物DMT随时间推移的最大血浆浓度降低以及给药频率较低。在一些实施例中,本公开的化合物预防或抑制N氧化以促进口服生物利用度和增加的暴露。
在一些实施例中,本公开的化合物包括恩那卡比(enacarbil)部分。在不受理论束缚的情况下,此类化合物可以例如通过高容量营养转运蛋白(包含单羧酸转运蛋白-1(MCT-1))在小肠中主动转运前药来增加生物利用度。DMT-恩那卡比前药还可以通过防止通过嗅吸或吹入而吸收来降低滥用可能性。
在一些实施例中,本公开提供了一种式(I)的化合物:
或其药学上可接受的盐;
其中,
R
X、Y和Z独立地是氢、卤素、-O-、-S-、-NR
R'、R
R
R
L和M独立地是烷基或芳基;
W是氧、硫或NR
n是2-7的整数;并且
m是1-4的整数,
其中R'、R
-(C=O)(CH
在一些实施例中,本文提供了式(II)的化合物:
或其药学上可接受的盐;
其中,
R
X、Y和Z独立地是氢、卤素、-O-、-S-、-NR
R'、R
R
R
L和M独立地是烷基或芳基;
W是氧、硫或NR
n是2-7的整数;并且
m是1-4的整数,
其中R'、R
在一些实施例中,R
在一些实施例中,本文提供了式(III)的化合物:
或其药学上可接受的盐;
其中,
R
X、Y和Z独立地是氢、卤素、-O-、-S-、-NR
R'、R
R
R
L和M独立地是烷基或芳基;
n是2-7的整数;并且
m是1-4的整数,
其中R'、R
-(C=O)(CH
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,X、Y和Z独立地是氢、卤素、-O-、-S-、-NR
在式(I)、式(II)或式(III)的化合物的一些实施例中,X、Y和Z是H。
在式(I)、式(II)或式(III)的化合物的一些实施例中,X、Y和Z中的两者是氢。
在式(I)、式(II)或式(III)的化合物的一些实施例中,X、Y和Z中的两者是氢,并且非氢X、Y或Z是-O-、-S-、-NR
在式(I)、式(II)或式(III)的化合物的一些实施例中,X和Y是氢;并且Z是-O-、-S-、-NR
在式(I)、式(II)或式(III)的化合物的一些实施例中,X和Z是氢;并且Y是-O-、-S-、-NR
在式(I)、式(II)或式(III)的化合物的一些实施例中,Y和Z是氢;并且X是-O-、-S-、-NR
在式(I)、式(II)或式(III)的化合物的一些实施例中,X、Y或Z中的至少一者是-O(P=O)-OR
在式(I)、式(II)或式(III)的化合物的一些实施例中,X是-O(P=O)-OR
在式(I)、式(II)或式(III)的化合物的一些实施例中,Y是-O(P=O)-OR
在式(I)、式(II)或式(III)的化合物的一些实施例中,Z是-O(P=O)-OR
在式(I)、式(II)或式(III)的化合物的一些实施例中,R'是氢或烷基。
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)或式(II)的化合物的一些实施例中,R'、R
其中R'、R
-(C=O)(CH
在式(III)的化合物的一些实施例中,R'、R
其中R'、R
-(C=O)(CH
在式(I)、式(II)或式(III)的化合物的一些实施例中,R'不存在或是氢、烷基、-(C=O)-烷基、-(C=O)CHR
在式(I)、式(II)或式(III)的化合物的一些实施例中,R'是氢或烷基。
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
-(C=O)-烷基、-(C=O)CHR
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
-(C=O)-烷基、-(C=O)CHR
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
-(C=O)-烷基、-(C=O)CHR
在式(I)的化合物的一些实施例中,R
在式(I)的化合物的一些实施例中,X、Y和Z是H;W是NR
-(C=O)CH(NH
在式(I)的化合物的一些实施例中,R'、R
在式(I)的化合物的一些实施例中,R'、R
在式(I)的化合物的一些实施例中,R'、R
在式(I)的化合物的一些实施例中,R'、R
在式(I)的化合物的一些实施例中,R'、R
在式(III)的化合物的一些实施例中,R'、R
在式(III)的化合物的一些实施例中,R'、R
在式(III)的化合物的一些实施例中,R'、R
在式(III)的一些实施例中,R'、R
在式(III)的一些实施例中,R'、R
在式(I)、式(II)或式(III)的化合物的一些实施例中,L和M独立地是烷基或芳基。
在式(I)、式(II)或式(III)的化合物的一些实施例中,L是烷基,并且M是烷基或芳基。
在式(I)、式(II)或式(III)的化合物的一些实施例中,L是甲基或异丙基,并且M是烷基或芳基。
在式(I)或式(II)的化合物的一些实施例中,W是氧、硫或NR
在式(I)或式(II)的化合物的一些实施例中,W是NR
在式(I)或式(II)的化合物的一些实施例中,R
在式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)或式(II)的化合物的一些实施例中,R
在式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,R
在式(I)或式(II)的化合物的一些实施例中,R
在式(III)的化合物的一些实施例中,R
在式(I)、式(II)或式(III)的化合物的一些实施例中,n是2-7的整数(即2、3、4、5、6或7)。在一些实施例中,n是2。在一些实施例中,n是3。在一些实施例中,n是4。在一些实施例中,n是5。在一些实施例中,n是6。在一些实施例中,n是7。
在式(I)、式(II)或式(III)的化合物的一些实施例中,m是1-4的整数(即1、2、3或4)。在一些实施例中,m是1。在一些实施例中,m是2。在一些实施例中,m是3。在一些实施例中,m是4。
在式(I)的化合物的一些实施例中,所述化合物具有式(IV):
其中R
A是药学上可接受的阴离子,
并且其中R
在一些实施例中,式(I)的化合物是式(V)的化合物:
其中R
A是药学上可接受的阴离子,
并且其中R
在一些实施例中,本公开提供了式(VI)的化合物:
其中R
X是碳或氮;
W是碳、氧或氮;并且
Z是氢、氘或氧。
在一些实施例中,式(VII)的化合物是:
在一些实施例中,式(VI)或(VII)的化合物是:
在一些实施例中,本公开提供了式(VIII)的化合物:
其中R
R11和R12独立地是药学上可接受的盐、氢、氘、烷基、经取代的烷基、环烷基,或者R11和R12以及它们所连接的原子一起形成烷基、环烷基、杂环并且是醚、半胺醛缩酮(hemiaminalketal)和氨基酸。
在式(VIII)的化合物的一些实施例中,R11和R12以及它们所连接的原子一起形成杂环。
在式(VIII)的化合物的一些实施例中,药学上可接受的盐是Na
在一些实施例中,本文提供了式(IX)的化合物:
或其药学上可接受的盐;
其中,
R
X、Y和Z各自独立地是氢、卤素、-O-、-S-、-NR
R
R
R
L和M各自独立地是烷基或芳基;
W是氧、硫或NR
n是2-7的整数;并且
m是1-4的整数,
其中R
在式(IX)的化合物的一些实施例中,X、Y和Z各自独立地是氢、卤素、-O-、-S-、-NR
在式(IX)的化合物的一些实施例中,X、Y和Z是氢。
在式(IX)的化合物的一些实施例中,X、Y和Z中的两者是氢。
在式(IX)的化合物的一些实施例中,X、Y和Z中的两者是氢,并且非氢X、Y或Z是-O-、-S-、-NR
在式(IX)的化合物的一些实施例中,X和Y是氢;并且Z是-O-、-S-、-NR
在式(IX)的化合物的一些实施例中,X和Z是氢;并且Y是-O-、-S-、-NR
在式(IX)的化合物的一些实施例中,Y和Z是氢;并且X是-O-、-S-、-NR
在式(IX)的化合物的一些实施例中,X、Y或Z中的至少一者是-O(P=O)-OR
在式(IX)的化合物的一些实施例中,X是-O(P=O)-OR
在式(IX)的化合物的一些实施例中,Y是-O(P=O)-OR
在式(IX)的化合物的一些实施例中,Z是-O(P=O)-OR
在式(IX)的化合物的一些实施例中,R'是氢或烷基。
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
其中R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,L和M各自独立地是烷基或芳基。
在式(IX)的化合物的一些实施例中,L是烷基,并且M是烷基或芳基。
在式(IX)的化合物的一些实施例中,L是甲基或异丙基,并且M是烷基或芳基。
在一些实施例中,R
在一些实施例中,R
在一些实施例中,R
在一些实施例中,R
在一些实施例中,R
在一些实施例中,R
在一些实施例中,R
在一些实施例中,R
在一些实施例中,R
在一些实施例中,R
在一些实施例中,R
在一些实施例中,R
在式(IX)的化合物的一些实施例中,W是氧、硫或NR
在式(IX)的化合物的一些实施例中,W是NR
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,R
在式(IX)的化合物的一些实施例中,n是2-7的整数(即2、3、4、5、6或7)。在一些实施例中,n是2。在一些实施例中,n是3。在一些实施例中,n是4。在一些实施例中,n是5。在一些实施例中,n是6。在一些实施例中,n是7。
在式(IX)的化合物的一些实施例中,m是1-4的整数(即1、2、3或4)。在一些实施例中,m是1。在一些实施例中,m是2。在一些实施例中,m是3。在一些实施例中,m是4。
在一些实施例中,本文提供了式(X)的化合物:
其中
R
X和Y各自独立地是氢、卤素、-O-、-S-、-NR
R'、R
其中R'、R
在一些实施例中,本文提供了一种或多种选自表1的化合物。
在一些实施例中,本文提供了选自表1的化合物的一种或多种药学上可接受的盐。
表1.化合物
/>
/>
在一些实施例中,本文提供了一种或多种选自表2的化合物。
在一些实施例中,本文提供了选自表2的化合物的一种或多种药学上可接受的盐。
表2.化合物
/>
/>
在表2的化合物的一些实施例中,X和Y是氢,并且R
在表2的化合物的一些实施例中,X是氢,R
在表2的化合物的一些实施例中,X是氢,R
在表2的化合物的一些实施例中,X是氢,R
在表2的化合物的一些实施例中,X是O,R
在表2的化合物的一些实施例中,X是O,R
在表2的化合物的一些实施例中,X是O,R
在一些实施例中,本文提供了选自表3的化合物的一种或多种药学上可接受的盐。
表3.化合物
其中X、Y、R
在表3的化合物的一些实施例中,R
在表3的化合物的一些实施例中,R
在表3的化合物的一些实施例中,R
在表3的化合物的一些实施例中,R
在表3的化合物的一些实施例中,R
在表3的化合物的一些实施例中,R
在表3的化合物的一些实施例中,R
在表3的化合物的一些实施例中,R
在表3的化合物的一些实施例中,R
在一些实施例中,本文提供了一种或多种选自表4的化合物。
在一些实施例中,本文提供了选自表4的化合物的一种或多种药学上可接受的盐。
表4.化合物
/>
/>
/>
/>
/>
组合物
在本公开的一些实施例中,药物组合物包括治疗有效量的本公开的一种或多种化合物(例如,式(I)-(X)的化合物或表1-4的化合物)或其药学上可接受的盐和药学上可接受的赋形剂。
出于多种目的,将药学上可接受的赋形剂和佐剂添加到组合物或调配物中。在一些实施例中,包括本文所公开的一种或多种化合物或其药学上可接受的盐的药物组合物进一步包括药学上可接受的载体。在一些实施例中,药学上可接受的载体包含药学上可接受的赋形剂、粘结剂和/或稀释剂。在一些实施例中,合适的药学上可接受的载体包含但不限于惰性固体填料或稀释剂以及无菌水溶液或有机溶液。在一些实施例中,合适的药学上可接受的赋形剂包含但不限于水、盐溶液、醇、聚乙二醇、明胶、乳糖、淀粉酶、硬脂酸镁、滑石、硅酸、粘性石蜡等。
出于本公开的目的,可以将本公开的化合物调配成用于在含有药学上可接受的载体、佐剂和媒剂的调配物中通过多种方式施用,所述方式包含口服、肠胃外、通过吸入喷雾、局部或直肠。如本文所使用的,术语肠胃外包含利用各种输注技术的皮下、静脉内、肌内和动脉内注射。如本文所用的动脉内和静脉内注射包含通过导管施用。
方法
一方面,本公开提供了治疗或预防有需要的受试者的神经障碍的方法,所述方法包括向所述受试者施用治疗有效量的本文公开的化合物(例如,式(I)-(X)的化合物或表1-4的化合物)、其药学上可接受的盐或其药物组合物。
在一些实施例中,神经障碍是情绪障碍。在一些实施例中,情绪障碍是临床抑郁症、出生后抑郁症或产后抑郁症、围产期抑郁症、非典型抑郁症、忧郁型抑郁症、精神病性重性抑郁症、阳离子抑郁症、季节性情感障碍、心境恶劣、双重抑郁症、抑郁型人格障碍、反复发作的短暂性抑郁症、重度抑郁症、轻度抑郁障碍、双相型障碍或躁狂抑郁障碍、由慢性医学病症造成的抑郁症、治疗抗性抑郁症、难治性抑郁症、自杀倾向、自杀观念或自杀行为。在一些实施例中,本文描述的方法为遭受抑郁症(例如,中等或严重抑郁症)的受试者提供了治疗效果。在一些实施例中,情绪障碍与神经内分泌疾病和障碍、神经变性疾病和障碍(例如,癫痫)、运动障碍、震颤(例如,帕金森病(Parkinson's Disease))或女性的健康障碍或病状)有关。在一些实施例中,情绪障碍是抑郁症。在一些实施例中,情绪障碍是治疗抗性抑郁症或重度抑郁症。在一些实施例中,情绪障碍是重度抑郁症。在一些实施例中,情绪障碍是治疗抗性抑郁症。
在一些实施例中,本公开提供了治疗或预防有需要的受试者的PTSD、情绪障碍、一般焦虑障碍、成瘾障碍和/或药物依赖性的方法,所述方法包括向所述受试者施用治疗有效量的本文公开的化合物(例如,式(I)-(X)的化合物或表1-4的化合物)、其药学上可接受的盐或其药物组合物。
在一些实施例中,本公开提供了治疗或预防有需要的受试者的PTSD的方法,所述方法包括向所述受试者施用治疗有效量的本文公开的化合物(例如,式(I)-(X)的化合物或表1-4的化合物)、其药学上可接受的盐或其药物组合物。
在一些实施例中,所述方法包含通过施用本文公开的化合物、其药学上可接受的盐或其药物组合物进行的诱导和维持疗法来治疗PTSD。在一些实施例中,本公开的化合物用于诱导和维持疗法,以当与用单独的增进人际亲密感的、梦呓性精神分裂或致幻化合物(例如,二甲基色胺或相关化合物、裸盖菇素(psilocybin)或MDMA)治疗相比时,以改善的安全性谱治疗PTSD。
在一些实施例中,本公开提供了治疗或预防有需要的受试者的行为或情绪障碍的方法,所述方法包括向所述受试者施用治疗有效量的本文公开的化合物(例如,式(I)-(X)的化合物或表1-4的化合物)、其药学上可接受的盐或其药物组合物。在一些实施例中,行为或情绪障碍包含焦虑,如自闭症受试者(例如,自闭症成人)的社交焦虑和与危及生命的疾病相关的焦虑。在一些实施例中,行为或情绪障碍包含应激(其中例如通过对扁桃体反应的影响来测量其适度)。在一些实施例中,焦虑障碍是惊恐障碍、强迫性障碍和/或一般焦虑障碍。在一些实施例中,受试者缺乏动力、注意力、记忆回忆的准确性、反应速度、毅力和/或认知参与。进一步的实例包含抑郁症(例如,MDD或TRD)、注意力障碍、执行功能和/或认知参与障碍、强迫性障碍、双相情感障碍、惊恐障碍、恐惧症、精神分裂症、精神病、反社会型人格障碍和/或神经认知障碍。
在一些实施例中,本公开提供了用于治疗有需要的受试者的成瘾障碍的方法,所述方法包括向所述受试者施用治疗有效量的本文公开的化合物(例如,式(I)-(X)的化合物或表1-4的化合物)、其药学上可接受的盐或其药物组合物。在一些实施例中,成瘾障碍是酒精滥用、物质滥用、吸烟、肥胖或其混合。在一些实施例中,所述障碍是进食障碍(例如,神经性厌食症、神经性贪食症、暴食障碍等)或听觉障碍。
在一些实施例中,本公开提供了用于治疗有需要的受试者的冲动性障碍的方法,所述方法包括向所述受试者施用治疗有效量的本文公开的化合物(例如,式(I)-(X)的化合物或表1-4的化合物)、其药学上可接受的盐或其药物组合物。在一些实施例中,冲动性障碍是注意力缺陷多动障碍(ADHD)、注意力缺陷障碍(ADD)、Tourette综合征(Tourette'ssyndrome)、自闭症或其组合。
在一些实施例中,本公开提供了用于治疗有需要的受试者的强迫性障碍的方法,所述方法包括向所述受试者施用治疗有效量的本文公开的化合物(例如,式(I)-(X)的化合物或表1-4的化合物)、其药学上可接受的盐或其药物组合物。在一些实施例中,强迫性障碍是强迫症(OCD)、赌博、异常性行为或其组合。
在一些实施例中,本公开提供了用于治疗有需要的受试者的人格障碍的方法,所述方法包括施用治疗有效量的本文公开的化合物(例如,式(I)-(X)的化合物或表1-4的化合物)、其药学上可接受的盐或其药物组合物。在一些实施例中,人格障碍是针对所述受试者的行为障碍、反社会人格、攻击性行为或其组合。
实例
本公开的化合物可以使用以下示例性方法或本领域技术人员已知的其它方法来合成。
提供了一般反应条件,并且反应产物可以通过已知的方法纯化,包含使用如己烷、二氯甲烷、乙酸乙酯、甲醇等各种有机溶剂的硅胶色谱法或制备型反相高压液相色谱法。
化合物的制备可以涉及各种化学基团的保护和脱保护。保护和脱保护的需要以及适当的保护基团的选择可以由本领域技术人员容易地确定。例如,可以在以下中找到保护基团的化学物质:Greene和Wuts,《有机合成中的保护基团(Protective Groups inOrganic Synthesis)》,第44版,约翰威立父子公司(Wiley&Sons),2006;以及Jerry March,《高等有机化学(Advanced Organic Chemistry)》,第4版,约翰威立父子公司出版社,纽约,1992,所述文献以全文引用的方式并入本文。
方案1:本公开的化合物的代表性合成
如方案1所示,可以将2-(1H-吲哚-3-基)-N,N-二甲基乙-1-胺与式(A)的羧酸在酰胺偶联条件下(例如,在1,1'-羰基二咪唑(CDI)、二甲基氨基吡啶(DMAP)和强碱如氢化钠的存在下)偶联,其中PG
方案2:本公开的化合物的代表性合成
如方案2所示,可以使2-(1H-吲哚-3-基)-N-甲基乙-1-胺在酰胺偶联条件下(例如,在CDI、DMAP和碱,如三乙胺等叔胺碱的存在下)与式(A)的羧酸反应,其中PG
方案3:本公开的化合物的代表性合成
如方案3所示,可以在POCl
1.1-2的合成
在氮气气氛下,在40℃下向色醇(6g,37.27mmol,1.0当量)于二甲亚砜(60mL)中的溶液中添加2-碘酰基苯甲酸(12.5g,44.72mmol,1.2当量)。将混合物溶液在40℃下搅拌2小时。将反应溶液用200mL二氯甲烷稀释,分别用2×200mL饱和碳酸氢钠溶液和2×200mL饱和氯化钠水溶液洗涤。将有机层经无水硫酸钠干燥,过滤并在真空下浓缩。将残余物施加到使用石油醚/乙酸乙酯(3:1)的硅胶柱上。获得4g(67%)呈黄色油的1-2。
2.1-2-1的合成
在25℃下,向1-2(100mg,0.63mmol,1.00当量)和1-异丙基哌嗪(241.5mg,1.89mmol,3.00当量)于二氯甲烷(1mL)中的溶液中添加三乙胺(190.9mg,1.89mmol,3.00当量)和SnCl
3.1-2-2的合成
以与针对1-2-1描述的方式类似的方式,由100mg 1-2和189mg 1-甲基哌嗪制备化合物1-2-2。获得5.1mg(3%)呈棕色油的1-2-2。MS m/z[M+H]
4.1-2-3的合成
以与针对1-2-1描述的方式类似的方式,由100mg 1-2和164.4mg吗啉来制备化合物1-2-3。获得25.5mg(17%)呈棕色固体的1-2-3。MS m/z[M+H]
1-2-4的合成
以与针对1-2-1描述的方式类似的方式,由100mg 1-2和168.2mg哌啶来制备化合物1-2-4。获得3.4mg(2%)呈棕色固体的1-2-4。MS m/z[M+H]
1-2-5的合成
以与针对1-2-1描述的方式类似的方式,由100mg 1-2和190.9mg 4-羟基哌啶来制备化合物1-2-5。获得18.9mg(12%)呈棕色固体的1-2-5。MS m/z[M+H]
7.1-2-6的合成
在0℃下,向4-哌啶乙酸甲酯(296.7mg,1.89mmol,3.00当量)和乙酸(0.1mL)于甲醇(1mL)中的溶液中添加氰基硼氢化钠(58.6mg,0.95mmol,1.50当量)。然后在0℃下向混合物中滴加1-2(100mg,0.63mmol,1.00当量)。将混合物在25℃下搅拌2小时。将反应用20mL二氯甲烷稀释。将有机层用2×20mL饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,过滤并在减压下浓缩。将粗产物通过Prep-HPLC在以下条件下纯化:柱:XBridge Prep OBD C18柱,30*150mm,5μm;流动相A:水(10mmol/LNH
8.1-2-7的合成
以与针对1-2-1描述的方式类似的方式,由100mg 1-2和270.2mg哌啶-4-基乙酸来制备化合物1-2-7。获得7.8mg(4%)呈白色固体的1-2-7。MS m/z[M+H]
9.1-2-8的合成
以与针对1-2-7描述的方式类似的方式,由100mg 1-2和270.2mg异哌啶酸甲酯来制备化合物1-2-8。获得26.1mg(14%)呈棕色固体的1-2-8。MS m/z[M+H]
10.1-2-9的合成
以与针对1-2-1描述的方式类似的方式,由100mg 1-2和243.8mg异哌啶酸来制备化合物1-2-9。获得4.3mg(2%)呈白色固体的1-2-9。MS m/z[M+H]
11.1-2-10的合成
以与针对1-2-1描述的方式类似的方式,由100mg 1-2和134.2mg吡咯烷来制备化合物1-2-10。获得8.0mg(6%)呈棕色固体的1-2-10。MS m/z[M+H]
12.1-2-11的合成
以与针对1-2-1描述的方式类似的方式,由100mg 1-2和164.4mg 3-吡咯烷醇来制备化合物1-2-11。获得5.5mg(4%)呈白色固体的1-2-11(外消旋体)。MS m/z[M+H]
13.1-2-12的合成
以与针对1-2-6描述的方式类似的方式,由100mg 1-2和243.8mg 3-吡咯烷甲酸甲酯来制备化合物1-2-12。获得34.1mg(20%)呈棕色固体的1-2-12。MS m/z[M+H]
14 1-2-13的合成
以与针对1-2-1描述的方式类似的方式,由100mg 1-2和217.3mg 3-吡咯啶甲酸甲酯来制备化合物1-2-13。获得24.0mg(15%)呈白色固体的1-2-13。MS m/z[M+H]
15.1-2-14的合成
以与针对1-2-1描述的方式类似的方式,由100mg 1-2和228.7mg N-乙基苯胺来制备化合物1-2-14。获得6.3mg(4%)呈白色固体的1-2-14。MS m/z[M+H]
16.2-1-2的合成
在0℃下,向色胺(200mg,1.25mmol,1.0当量)于3mL甲醇中的溶液中添加含氰基硼氢化钠(196.9mg,3.13mmol,2.50当量)、乙酸(0.15mL)和甲醛(253.8mg,3.13mol,2.5当量,37%于水溶液中)的甲醇(1.5mL)。将混合物溶液在25℃下搅拌过夜,然后在真空下浓缩。将所得溶液用20mL饱和碳酸氢钠稀释,并用3×20mL乙酸乙酯萃取。将合并的有机层用2×20mL盐水洗涤,经无水硫酸钠干燥并在真空下浓缩。将所得混合物溶解于2mL乙腈中,然后在氮气气氛下在25℃下添加磷酸二叔丁基(氯甲基)酯(273.5mg,1.06mmol,2.0当量)、Me
在惰性氩气气氛中在室温下向2-1-1(120mg,0.29mmol,1.0当量)于二氯甲烷(1.2mL)中的溶液中缓慢添加三氟乙酸(0.6mL)。将所得溶液在室温下搅拌1小时。将所得溶液在减压下浓缩。将粗产物通过闪速色谱法在以下条件下纯化:柱,C18硅胶;移动层,水和甲醇(20%甲醇,在15分钟内升至100%,并保持100%持续5分钟);检测器,220nm。将级分在减压下浓缩。获得28.3mg(27.6%产率)呈白色固体的2-1-2。MS m/z[M+H]
19.3-1-4的合成
在冰浴中的250mL烧瓶中,添加12.83g(0.11mol,1.1当量)的亚硫酰氯,然后在搅拌下在0.5小时内滴加8.91g(0.10mol,1当量)的N,N-二甲基乙醇胺。将所得混合物在50℃下搅拌1小时。然后添加150mL乙醇并加热至回流0.5小时,在冷却至室温后,通过过滤收集呈浅黄色固体的3-1-1(6g,42%)。
21.3-1-2的合成
将3-1-1(6g,41.9mmol,1当量)于N,N-二甲基甲酰胺(60mL)中的溶液用KOH(11.75g,209.5mmol,5当量)在25℃下处理1小时。在25℃下将7-甲氧基-1H-吲哚(6.17g,41.9mmol,1当量)添加到混合物中。将所得混合物在50℃下搅拌16小时。将反应用二氯甲烷(200mL)稀释,用水(3×200mL)洗涤。将有机相经无水硫酸钠干燥,过滤并在减压下浓缩。将粗产物通过闪速色谱法在以下条件下纯化:柱,C18硅胶;移动层,水(0.05% NH
22.3-1-3的合成
在0℃下,向3-1-2(600mg,2.75mmol,1当量)于二氯甲烷(20mL)中的溶液中分批添加氯化铝(1.83g,13.75mmol,5当量)。将混合物在25℃下搅拌过夜。将反应用甲醇(20mL)淬灭,过滤并在减压下浓缩。将粗产物通过闪速色谱法在以下条件下纯化:柱,C18硅胶;移动层,水(0.1%NH
23.3-1-4的合成
在25℃下,向3-1-3(100mg,0.49mmol,1当量)于二氯甲烷(1mL)中的溶液中添加戊酸(75mg,0.74mmol,1.5当量)、4-二甲基氨基吡啶(17.9mg,0.15mmol,0.3当量)、N-(3-二甲基氨基丙基)-N'-乙基碳二亚胺盐酸盐(141.2mg,0.74mmol,1.5当量)。将混合物在25℃下搅拌2小时,然后用20mL二氯甲烷稀释,分别用2×10mL饱和碳酸氢钠溶液和2×10mL饱和氯化钠水溶液洗涤。将有机层经无水硫酸钠干燥,过滤并在真空下浓缩。将粗产物通过闪速色谱法在以下条件下纯化:柱,C18硅胶;移动层,水(0.05%NH
24.4-1-2、4-1-3和4-1-4的合成
在0℃下,向色胺(400mg,2.5mmol,1.0当量)于3mL甲醇中的溶液中添加含氰基硼氢化钠(393.8mg,6.26mmol,2.50当量)、乙酸(0.3mL)和甲醛(507.6mg,6.26mol,2.5当量,37%于水溶液中)的甲醇(4mL)。将混合物溶液在25℃下搅拌过夜,然后在真空下浓缩。将所得溶液用20mL饱和碳酸氢钠稀释,并用3×20mL乙酸乙酯萃取。将合并的有机层用2×20mL盐水洗涤,经无水硫酸钠干燥并在真空下浓缩。将所得混合物溶解于3mL二氯甲烷中,然后在0℃下滴加483.5mg三乙胺、氯甲酸1-氯乙酯(340mg,2.39mmol,1.5当量)。将混合物在25℃下搅拌2小时。将反应用二氯甲烷(20mL)稀释,用饱和氯化钠水溶液(2×20mL)洗涤。将有机层经无水硫酸钠干燥,过滤并在真空下浓缩。获得300mg(粗制物)呈黄色固体的4-1-1(中间体)。其在不进行进一步纯化的情况下直接用于下一步骤。
25.4-1-2(外消旋体)的合成
在25℃下,向4-1-1(300mg,1.02mmol,1.0当量)和三乙胺(2.06g,20.40mmol,20当量)于二甲基甲酰胺(6mL)中的溶液中添加异丁酸(449mg,5.10mmol,5当量)。将混合物在60℃下搅拌16小时。将反应用50mL二氯甲烷稀释,用1×50mL饱和氯化钠水溶液洗涤。将有机层经无水硫酸钠干燥,过滤并在减压下浓缩。将粗产物通过Prep-HPLC在以下条件下纯化2次:柱:X Select CSH Fluoro Phenyl,30*150mm,5μm;流动相A:水(0.05%HCl),流动相B:ACN;流量:60毫升/分钟;梯度:在8分钟内从28% B至58% B,58% B;波长:254nm;获得9.0mg呈浅棕色固体的4-1-2。将其它批次合并,获得26mg的4-1-2。MS m/z[M+H]
26.4-1-3(外消旋体)的合成
以与针对4-1-2描述的方式类似的方式,由300mg 4-1-1和306mg乙酸来制备化合物4-1-3。获得5.0mg呈浅棕色固体的4-1-3。将其它批次合并,获得40mg的4-1-3。MS m/z[M+H]
27.4-1-4(外消旋体)的合成
以与针对4-1-2描述的方式类似的方式,由300mg 4-1-1和520mg维酸来制备化合物4-1-4。将粗产物(300mg)通过Prep-HPLC在以下条件下纯化(柱:XBridge Shield RP18OBD柱,30*150mm,5μm;流动相A:水(10mmol/L NH
28.5-1-4的合成
在氮气气氛下,在0℃下向4-甲氧基-1H-吲哚(1.0g,6.80mmol,1.0当量)于乙醚(20.0mL)中的经搅拌溶液中滴加草酰氯(0.9g,6.80mmol,1.0当量)。将所得混合物在室温下再搅拌3小时。将所得混合物5-1-1在不进行进一步纯化的情况下直接用于下一步骤。
在氮气气氛下,在0℃下向盐酸二甲胺(1.7g,21.04mmol,5.0当量)和三乙胺(3.4g,33.66mmol,8.0当量)于四氢呋喃(10.0mL)中的经搅拌溶液中滴加5-1-1(在最后的步骤获得的粗制物)。将混合物在室温下再搅拌0.5小时。通过在0℃下添加水(50mL)来淬灭反应。将所得混合物用乙酸乙酯(3×50mL)萃取。将有机层经无水硫酸钠干燥,过滤并在真空下浓缩。将粗制物通过闪速色谱法在以下条件下纯化:柱,C18硅胶;移动层,水(0.05%NH
在0℃下,向5-1-2(600.0mg,2.44mmol,1.0当量)于四氢呋喃(10.0mL)中的经搅拌溶液中分批添加氢化铝锂(184.9mg,4.87mmol,2.0当量)。将所得混合物在70℃下搅拌1.5天。通过在0℃下添加水(20.0mL)来淬灭反应。将水层用乙酸乙酯(3×30mL)萃取。将有机层经无水硫酸钠干燥,过滤并在真空下浓缩。将粗制物通过闪速色谱法在以下条件下纯化:柱,C18硅胶;移动层,水(0.1% NH
在氮气气氛下,在-78℃下向5-1-3(80.0mg,0.37mmol,1.0当量)于二氯甲烷(1.0mL)中的经搅拌溶液中滴加三溴硼烷(459.0mg,1.83mmol,5.0当量)。将所得混合物在室温下搅拌9小时。将混合物在真空下浓缩。将残余物溶解于二氯甲烷(30.0mL)中,添加50mg KHCO
改善的如N,N-二甲基色胺(DMT)等色胺的前药。
前药3-1-4、4-1-2和4-1-4在调配物中应该是稳定的,并且应该在体内释放母体化合物。
初步研究证实了前药的稳定性(表5-9)。虽然已显示前药的溶液稳定性,但血浆稳定性数据清楚地显示母体药物在小鼠血浆中立即释放。测试了以下前药。
在有和没有胃蛋白酶的情况下在PBS pH 6.5中的前药3-1-4、4-1-2和4-1-4稳定性结果
表5.在PBS pH 6.5、有和没有胃蛋白酶的SGF中检测VLS-03-1母体
/>
表6.在PBS pH 6.5、有和没有胃蛋白酶的SGF中检测VLS-03-10母体
表7.在PBS pH 6.5、有和没有胃蛋白酶的SGF中检测VLS-03-15母体
数据总结
表8.测试化合物在PBS pH 6.5、有和没有胃蛋白酶的SGF中的稳定性结果
小鼠血浆中的前药3-1-4、4-1-2和4-1-4稳定性结果
表9.测试化合物在小鼠血浆中的稳定性结果
N-膦酰氧基甲基前药6-1-2(PH-VLS-02-23-0)
使用Gunda I.George(《药物化学杂志(Journal of Medicinal Chemistry)》,1999,第42卷,3095)中描述的方法制备N-磷酰氧基甲基前药化合物。
前药策略的展示:
合成6-1-2,其作为用于改善含叔胺药物的水溶性的新型前药策略。并且在两步反应中将叔胺DMT转化为非常极性的N-磷酰氧基甲基前药6-1-3。
前药6-1-2通过两步生物回复过程在体内释放母体DMT。速率确定第一步骤是通过酶促方法进行的,其中前药生物回复涉及磷酸酶催化的去磷酸化,以得到所得羟甲基季铵中间体和无机磷酸盐。第二步骤涉及在生理pH下在化学上将羟甲基季铵中间体转化为DMT和甲醛。
6-1-2以3个简单步骤由可商购获得的物质来合成。
评估前药6-1-2(VLS-02-23)的化学稳定性,并将结果列举在表10-11中。还进行了小鼠中前药6-1-2和代谢物(VLS-02-23-10)的PK研究,并且分别如图1-2所示分析血浆暴露和脑暴露。
N-磷酰氧基甲基前药6-1-2(VLS-02-23)的化学稳定性
数据总结
表10.测试化合物在PBS pH 6.5、有和没有胃蛋白酶的SGF中的稳定性结果
N-磷酰氧基甲基前药6-1-2(VLS-02-23)的血浆稳定性
数据总结
表11.测试化合物在小鼠血浆中的稳定性结果
。/>
