转运蛋白TdcC在提高L-肌肽的产量中的应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于生物技术领域,具体涉及转运蛋白TdcC在提高肌肽产量中的应用。
背景技术
L-肌肽(β-丙氨酰-L-组氨酸)及其类似物(如高肌肽和鹅肌肽),是广泛存在于哺乳动物的大脑、肌肉和其他重要组织中的天然活性二肽。自该活性肽发现的一百多年来,已有大量的研究发现或者证明L-肌肽具有显著的抗氧化、消除胞内自由基、抗衰老等活性,并且在临床上用于高血压、心脏病、老年性白内障、溃疡、抗肿瘤、促进伤口愈合等方面的辅助治疗,由于其抗氧化的活性强,毒副作用低并具有多种生理活性,该活性肽及其衍生物在医药、保健、卫生、化妆品等领域已有广泛的应用。
目前已报道的L-肌肽合成工艺主要分为两类:一类是化学法合成,另一类是生物催化法合成。
化学合成方法虽然比较多,但主要有以下两种:一是利用β-丙氨酸参与合成。其主要路线是β-丙氨酸经氨基保护、羧基活化后与保护的L-组氨酸缩合,然后脱掉保护基团得到L-肌肽。该路线比较复杂,收率低,肽键形成过程中易消旋,影响产品纯度,并且溶剂消耗大,易造成环境污染;二是摒弃β-丙氨酸参与的反应。主要原理为L-组氨酸先与不同的β-丙氨酸前体生成肽键,再进一步转换为肌肽。该路线相对简单,省去对不同基团的保护和脱保护的过程,避免消旋反应的发生,但是需要无水操作,要求比较严格。以上的路线随着工艺的差异,产品得率大约在60%-80%左右。
为了避免化学合成法在合成条件上所要求的保护基团的添加与脱除、反应温度变化剧烈、pH调整频繁、反应压力高、多相反应体系复杂、溶剂易燃易爆有毒、中间产物分离过程繁琐等诸多不利因素。
近年来,国内外有研究者开始致力于采用生物法生产L-肌肽,即利用酶或者菌株在温和的条件下合成L-肌肽。主要路线有两种:
(1)基于β氨肽酶的L-肌肽合成:β-氨肽酶是一类功能和结构相似的酶,具有催化含β-氨基酸残基的酰胺键或者肽健发生水解或者氨解反应的活力。其机理是底物与酶形成酰基化的中间物,再与水或者另一个氨基酸发生亲核作用,进而完成水解或氨解反应。因该酶对含β-氨基酸肽底物的特殊催化活力,故具备了合成β肽的潜力,该方法经优化后,L-肌肽的得率达到71%,生产强度为3.3mM/L/h。全菌株经5次重复利用表明,L-肌肽的合成效率没有显著变化。
(2)基于L-肌肽酶的L-肌肽合成:L-肌肽酶是存在于菌株内和菌株外的二肽酶。其中人源血清肌肽酶(CN1)可催化Xaa-His二肽的水解,以维持血清中肌肽的平衡。ChiakiInaba等人利用人源肌肽酶CN1与α-凝集素的菌株壁粘附域连接,构建了基于酿酒酵母菌株表面展示技术的全菌株一步法合成L-肌肽的催化体系。相比Heyland Jan等人开发的大肠杆菌催化体系,该菌株可直接催化廉价的β-丙氨酸和L-组氨酸合成L-肌肽。但是,由于合成L-肌肽是L-肌肽酶催化水解二肽的逆反应,为避免水分子的影响,该合成过程需要在有机溶剂或者疏水离子液体中进行。尽管如此,该菌株展示体系的L-肌肽合成效率仅有5%,距离商业化应用还存在较大的距离。
中国专利申请202211727024.8公开了一种保藏编号为CGMCC NO.25590的苍白杆菌及其在合成L-肌肽中的应用。本申请的菌株可直接利用L-组氨酸和β-丙氨酸合成肌肽,L-肌肽产量可高达约20mg/L。
中国专利申请202211706675.9公开了一种具有肌肽水解酶功能的蛋白酶及其在L-肌肽合成中的应用,该申请采用生物酶法催化合成L-肌肽,转化液中的L-肌肽含量在100-125g/L之间,以L-组氨酸计,转化率>65%,具有转化率高、重复性好、转化时间短的优点。
目前本领域需要更多的提高L-肌肽的产量的生物制备方法。
发明内容
为了实现提高L-肌肽的产量的技术目的,本发明特此提供了以下技术方案:
在一个方面,本发明提供了一种转运蛋白TdcC或其编码基因在提高L-肌肽产量中的应用,所述转运蛋白TdcC的氨基酸序列如SEQ ID NO:1所示。
在一些实施方式中,所述的转运蛋白TdcC用于促进L-肌肽向胞外转运。
在一些实施方式中,所述编码基因的核苷酸序列如SEQ ID NO:2所示。
在一些实施方式中,所述编码基因包含于重组质粒,优选过表达转运蛋白TdcC的重组质粒。
在一些优选的实施方式中,所述重组质粒为pEZ07-tdcC。
在一些实施方式中,所述重组质粒包含于基因工程菌株。
在一些实施方式中,基因工程菌株菌株为大肠埃希氏菌(Escherichia coli),优选大肠埃希氏菌CGMCC No.27382。
在另一个方面,本发明提供了转运蛋白TdcC或其编码基因在生产L-肌肽中的应用所述转运蛋白TdcC的氨基酸序列如SEQ ID NO:1所示。
在一些实施方式中,所述编码基因的核苷酸序列如SEQ ID NO:2所示。
在一些实施方式中,所述编码基因包含于基因工程菌株,或整合于基因工程菌株菌株的基因组中。
在一些实施方式中,所述基因工程菌株为大肠埃希氏菌,优选CGMCC No.27382大肠埃希氏菌。
在又一个方面,本发明提供了一种生产L-肌肽的方法,所述方法包括:
(1)将包含TdcC编码基因的重组质粒导入宿主菌株中;或
(2)将TdcC编码基因整合到宿主菌株的基因组;或
(3)培养具有L-肌肽表达功能的基因工程菌株。
在一些实施方式中,所述基因工程菌株为CGMCC No.27382大肠埃希氏菌。
在一些实施方式中,所述TdcC编码基因的核苷酸序列如SEQ ID NO:2所示。
SEQ ID NO:1:
MSTSDSIVSSQTKQSSWRKSDTTWTLGLFGTAIGAGVLFFPIRAGFGGLIPILLMLVLAYPIAFYCHRALARLCLSGSNPSGNITETVEEHFGKTGGVVITFLYFFAICPLLWIYGVTITNTFMTFWENQLGFAPLNRGFVALFLLLLMAFVIWFGKDLMVKVMSYLVWPFIASLVLISLSLIPYWNSAVIDQVDLGSLSLTGHDGILITVWLGISIMVFSFNFSPIVSSFVVSKREEYEKDFGRDFTERKCSQIISRASMLMVAVVMFFAFSCLFTLSPANMAEAKAQNIPVLSYLANHFASMTGTKTTFAITLEYAASIIALVAIFKSFFGHYLGTLEGLNGLVLKFGYKGDKTKVSLGKLNTISMIFIMGSTWVVAYANPNILDLIEAMGAPIIASLLCLLPMYAIRKAPSLAKYRGRLDNVFVTVIGLLTILNIVYKLF
SEQ ID NO:2:
ATGagtacttcagatagcattgtatccagccagacaaaacaatcgtcctggcgtaaatcagataccacatggacgttaggcttgtttggtacggcaatcggcgccggggtgctgttcttccctatccgcgcaggttttggcggactgatcccgattcttctgatgttggtattggcataccccatcgcgttttattgccaccgggcgctggcgcgtctgtgtctttctggctctaacccttccggcaacattacggaaacggtggaagagcattttggtaaaactggcggcgtggttatcacgttcctgtacttcttcgcgatttgcccactgctgtggatttatggcgttactattaccaatacctttatgacgttctgggaaaaccagctcggctttgcaccgctgaatcgcggctttgtggcgctgttcctgttgctgctgatggctttcgtcatctggtttggtaaggatctgatggttaaagtgatgagctacctggtatggccgtttatcgccagcctggtgctgatttctttgtcgctgatcccttactggaactctgcagttatcgaccaggttgacctcggttcgctgtcgttaaccggtcatgacggtatcctgatcactgtctggctggggatttccatcatggttttctcctttaacttctcgccaatcgtctcttccttcgtggtttctaagcgtgaagagtatgagaaagacttcggtcgcgacttcaccgaacgtaaatgttcccaaatcatttctcgtgccagcatgctgatggttgcagtggtgatgttctttgcctttagctgcctgtttactctgtctccggccaacatggcggaagccaaagcgcagaatattccagt gctttcttatctggctaaccactttgcgtccatgaccggtaccaaaacaacgttcgcgattacactggaatatgcggcttccatcatcgcactcgtggctatcttcaaatctttcttcggtcactatctgggaacgctggaaggtctgaatggcctggtcctgaagtttggttataaaggcgacaaaactaaagtgtcgctgggtaaactgaacactatcagcatgatcttcatcatgggctccacctgggttgttgcctacgccaacccgaacatccttgacctgattgaagccatgggcgcaccgattatcgcatccctgctgtgcctgttgccgatgtatgccatccgtaaagcgccgtctctggcgaaataccgtggtcgtctggataacgtgtttgttaccgtgattggtctgctgaccatcctgaACATCGTATACAAACTGTTTTAA
在又一个方面,本发明提供了一种提高宿主菌株的L-肌肽产量的方法,所述方法包括:
(ⅰ)提高所述宿主菌株中转运蛋白TdcC的表达量;或
(ⅱ)将编码转运蛋白TdcC的重组质粒导入所述宿主菌株。
在一些实施方式中,所述宿主菌株包括真核菌株和原核菌株。
在一些实施方式中,所述原核菌株包括但不限于大肠杆菌、枯草杆菌。
在一些实施方式中,所述宿主菌株为大肠埃希氏菌(即大肠杆菌),优选大肠埃希氏菌W3110。
在一些优选的实施方式中,所述大肠埃希氏菌W3110为遗传工程改造的大肠杆菌W3110,所述大肠杆菌W3110敲除了L-肌肽的降解、摄取基因,整合了解除反馈抑制的L-肌肽合成操纵子。
在一些优选的实施方式中,所述大肠埃希氏菌W3110为CGMCC No.27382大肠埃希氏菌。
在一些实施方式中,所述转运蛋白TdcC具有如SEQ ID NO:1所示的氨基酸序列。
在一些实施方式中,所述转运蛋白TdcC与SEQ ID NO:1所示的氨基酸序列相比具有至少1个氨基酸差异,例如1、2、3、4、5或6个。
在一些实施方式中,所述转运蛋白TdcC与SEQ ID NO:1具有至少约80%、85%、90%、95%、96%、97%、98%或99%序列同一性的氨基酸序列。
在又一个方面,本发明提供了一种基因工程菌株,所述基因工程菌株于2023年5月18日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,保藏编号为CGMCC No.27382,分类命名为大肠埃希氏菌(Escherichiacoli)。
鉴于目前关于利用转运蛋白提高氨基酸产量的各类研究,本发明通过过表达大肠杆菌来源的196个转运蛋白,多轮摇瓶发酵筛选比较验证,最终筛选出转运蛋白TdcC,并将其应用于提高宿主菌株的L-肌肽产量。所述宿主菌株的L-肌肽的产量稳定,在初筛和复筛中L-肌肽的产量均在1.7g/L以上,和对照组相比L-肌肽的产量明显提高,提高了约28.9%。
保藏信息:
生物材料:SHK20C/pHD641;
分类命名:大肠埃希氏菌Escherichia coli;
保藏编号:CGMCC No.27382;
保藏单位:中国微生物菌种保藏管理委员会普通微生物中心;
保藏时间:2023年5月18日;
保藏地址:北京市朝阳区北辰西路1号院3号。
附图说明
图1为HPLC测定发酵液中的L-肌肽的实验结果。
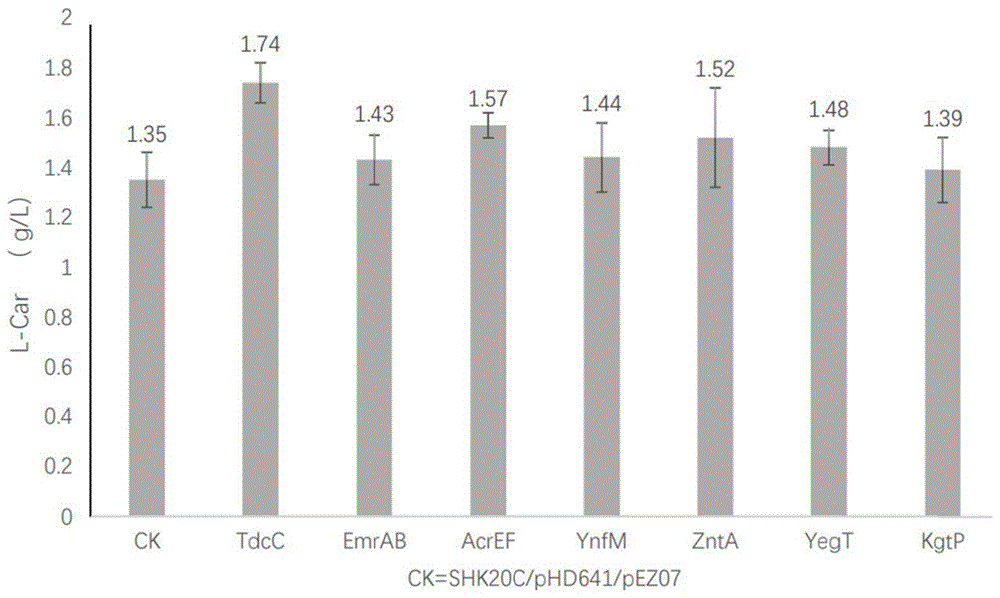
图2为转运蛋白表达库的复筛结果。
具体实施方式
除非另有定义,否则本发明使用的所有技术术语和科技术语都具有如在本发明所属领域中通常使用的相同含义。出于解释本说明书的目的,将应用以下定义,并且在适当时,以单数形式使用的术语也将包括复数形式,反之亦然。
除非上下文另有明确说明,否则本文所用的表述“一种”和“一个”包括复数指代。例如,提及“一个菌株”包括多个这样的菌株及本领域技术人员可知晓的等同物等等。
如本文使用的,术语“包括”或“包含”旨在表示组合物和方法包括所述的元素但不排除其他元素,但根据上下文的理解,也包括“由……组成”的情况。
为使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步的详细说明。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所有试剂或仪器未注明生产厂商者,均为可以通过市购的常规产品。为了更好地说明本发明,在下文的具体实施方式中给出了众多的具体细节。此处所描述的具体实施例仅用于解释本发明,并不用于构成对本发明的任何限制。此外,在以下说明中,省略了对公知结构和技术的描述,以避免不必要地混淆本发明的概念。这样的结构和技术在许多出版物中也进行了描述。
本发明涉及的试剂和仪器:
LB培养基:每升培养基中含酵母粉5g,氯化钠10g,蛋白胨10g,去离子水定容至1L(著[美]J.莎姆布鲁克.黄培堂译,分子克隆指南2002,1595)。上述溶液进行高压蒸汽灭菌,灭菌温度121℃,时间20-30min,即得本发明所用的LB培养基。
发酵培养基(每升):葡萄糖30g,5N-5倍的盐溶液200mL,TM3溶液1mL,柠檬酸铁10mg,七水硫酸镁246mg,氯化钙111mg,硫胺素1μg,以无菌去离子水定容至1L。上述溶液进行高压蒸汽灭菌,灭菌温度121℃,时间20-30min。同时准备空摇瓶,每瓶按照称取0.4g碳酸钙,使碳酸钙最终浓度为20g/L,即得本发明所用的发酵培养基。
其中5N-5倍的盐溶液为十二水合磷酸氢二钠75.6g,磷酸二氢钾15g,氯化钠2.5g,氯化铵25g,以离子水定容至1L;TM3溶液为四水氯化锌2.0g,六水氯化钙2.0g,两水钼酸钠2.0g,五水硫酸铜1.9g,硼酸0.5g,盐酸100mL,去离子水定容至1L。
仪器:恒温摇床培养箱。
实施例1摇瓶发酵验证重组菌株生产L-肌肽的方法
摇瓶发酵过程:
(1)接种重组菌株至含有抗生素的3mL的LB培养基中,置37℃摇床250rpm培养;
(2)取培养16h后的种子200μL转移至2mL含有抗生素的LB液体培养基,于37℃摇床250rpm培养4h;
(3)将2mL二级种子全部转入装有18mL发酵培养基的摇瓶中,置37℃摇床中,250rpm培养4h;(4)添加IPTG使其终浓度1mM,调节摇床温度至34℃,继续培养20h左右,取0.5mL发酵液和0.5mL水混匀离心后(12000rpm,1min),取上清进行HPLC检测。
实施例2HPLC测定发酵液中的L-肌肽
发酵液用灭菌水稀释2倍,离心过0.22μm的滤膜,用高效液相色谱(HPLC)检测。HPLC的参数如下:采用Ultimate AQ-C18,4.6×250×5μm;,流动相为A:乙腈,B:10mM辛烷磺酸钠+50mM磷酸二氢钾溶液pH 3.0,A:B=15:85;柱流量为1mL/min,柱温为30℃;波长为210nm,进样量为5μL(稀释2倍后);检测时间为13min。利用紫外检测器检测波长210nm;初始流动相的流速为1.0mL/min,发酵液的上样量5μL,柱温30℃。结果显示,L-肌肽的出峰时间为10分钟(图1)。
实施例3转运蛋白表达库的构建
发明人通过搜索查询和比对,筛选出196个转运蛋白,分别设计引物通过无缝克隆构建到低拷贝载体pEZ07(载体pEZ07同中国专利申请号:201510093004.3中)上,得到196个转运蛋白表达质粒pTR01-pTR196,以pTR154(即pEZ07-tdcC)构建为例:
1)以大肠杆菌W3110基因组为模板,分别利用引物对pTR154-F/pTR154-R扩增tdcC基因片段(引物对见表1),得到大小为1377bp的片段且电泳无杂带;
2)将片段直接进行过柱回收纯化(捷瑞胶回收纯化试剂盒,上海捷瑞生物工程技术有限公司,货号GK2043),得到的片段以纳摩尔比1:2与NcoI/XhoI酶切回收的pEZ07载体片段进行EZ克隆构建(GBclonart无缝克隆试剂盒,苏州神洲基因有限公司,货号GB2001-48);
3)重组克隆反应液于45℃水浴锅温浴30min,然后转移到冰上放置5min,加入TG1化转感受态菌株,混匀放置5min,42℃热击2min,冰浴2min后加入800μL复苏培养基LB,复苏培养1h后离心(8000rpm,离心1min),涂布含100mg/L壮观霉素的LB平板;
4)次日挑取克隆培养过夜,提取质粒进行酶切验证,最终构建得到质粒pEZ07-tdcC,编号pTR154。其中,转运蛋白tdcC基因序列为SEQ ID NO:2,其编码的L-肌肽转运蛋白的氨基酸序列为SEQ ID NO:1,然后转化宿主大肠杆菌W3110进行摇瓶发酵。
本发明以大肠杆菌W3110(ATCC27325)(基因型:F-mcrAmcrB IN(rrnD-rrnE)1lambda-)为基础出发菌株,对L-肌肽的降解、摄取基因进行敲除,同时整合解除反馈抑制的L-肌肽合成操纵子,改良其反馈抑制和弱化调控等,获得L-肌肽基因工程菌株SHK20C/pHD641,其分类命名为大肠埃希氏菌(Escherichia coli),保藏编号为CGMCC No.27382。
上述构建得到的转运蛋白库相关质粒转化宿主SHK20C/pHD641,分别得到含不同转运蛋白的重组菌株,将这些菌株连同对照菌株SHK20C/pHD641&pEZ07一起进行摇瓶初筛和复筛,筛选有助于提高L-肌肽产量提高的转运蛋白。
表1本实施例涉及的引物
实施例4转运蛋白表达库的初筛
本实施例摇瓶发酵的方法同实施例1。
本实施例摇瓶发酵比较的方式对转运蛋白进行初筛:
·将含不同转运蛋白的重组菌株及对照菌SHK20C/pHD641&pEZ07分别接种克隆到含100mg/L壮观霉素的LB试管,过夜培养;
·取培养过夜的种子200μL转移至2mL含有抗生素的LB液体培养基,于37℃摇床250rpm培养4h后全部转入装有18mL发酵培养基的摇瓶中,置37℃摇床中,250rpm培养4h,加IPTG诱导34℃培养过夜,继续培养20h左右;
·取0.5mL发酵液加0.5mL的离子水稀释2倍,12000rpm离心1min后取上清进行HPLC检测,检测方法同实施例2。
每个菌株挑取3个克隆进行平行发酵,结果取平均值。初筛结果显示60%(118/19)的转运蛋白过表达后L-肌肽的产量明显降低;只有3.5%(7/196)的转运蛋白过表达后L-肌肽的产量提高20%-60%,初筛结果如表2-表14所示。
表2初筛1组的实验结果
表3初筛2组的实验结果
表4初筛3组的实验结果
表5初筛4组的实验结果
表6初筛5组的实验结果
表7初筛6组的实验结果
表8初筛7组的实验结果
表9初筛8组的实验结果
表10初筛9组的实验结果
表11初筛10组的实验结果
表12初筛11组的实验结果
表13初筛12组的实验结果
表14初筛13组的实验结果
/>
实施例5转运蛋白表达库的复筛
将初筛L-肌肽产量明显提高的7个重组菌株按照实施例1的摇瓶发酵方法进行复筛。经过2轮摇瓶复筛发酵后,检测L-Car的的产量。
在初筛的7个重组菌株中L-Car的的产量高于2g/L的有tdcC、kgtP、yegT,而在复筛过程中kgtP的产量仅为1.39g/L,yegT的产量仅为1.48g/L,tdcC的产量则保持在1.74g/L,因此tdcC转运蛋白过表达菌株摇瓶发酵L-肌肽产量较稳定。相对于对照组的产量1.35g/L,L-肌肽的产量与对照相比有明显提升,提升了约28.9%(图2)。
最后应当说明的是,以上内容仅用以说明本发明的技术方案,而非对本发明保护范围的限制,本领域的普通技术人员对本发明的技术方案进行的简单修改或者等同替换,均不脱离本发明技术方案的实质和范围。
