一种滴鼻免疫的结核菌Ag85B-wFc融合蛋白及其制备方法和应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及生物医药技术领域,具体涉及一种滴鼻免疫的结核菌Ag85B-wFc融合蛋白及其制备方法和应用。
背景技术
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,M.tb)感染所致的一种慢性传染病,是世界三大传染性疾病之一。近二十年来,由于世界人口大范围流动,许多地方的结核发病率正逐年递增。《2022年全球结核病报告》数据显示,2021年,全球新发TB患者为1 060万,发病率比2020年上升了3.6%。因此可见,预防及治疗该疾病迫在眉睫。
卡介苗(BCG)是目前临床上唯一用于预防结核病的疫苗,也是预防结核病最有效的疫苗。研究表明卡介苗对于新生儿有较好的免疫保护作用,但对于预防成人肺结核的作用却非常有限。由于BCG的不断传代,免疫保护效果逐渐削弱,同时,在制备BCG的过程中,一些与免疫记忆和保护相关的基因丢失,使其保护期减短,保护性免疫应答也相应减弱。目前,化疗是结核病治疗的主要方式,由于其疗程长,副作用大,费用高昂且极易产生耐药菌株。因此加快研制更加安全、有效的新型疫苗刻不容缓。
目前,国内外研究比较多的结核疫苗有病毒载体疫苗、蛋白/佐剂疫苗、分枝杆菌-全细胞或提取物疫苗和分支杆菌减毒活疫苗。这些疫苗在研发的过程中,主要采取的是皮下或肌肉接种途径。但是侵入式(皮下或肌肉接种)接种需要人体承受一定的痛苦。因此研制一种免疫效果好的非侵入式疫苗意义重大。
发明内容
为研制一种免疫效果好的结核分枝杆菌蛋白,本发明提供了一种滴鼻免疫的结核菌Ag85B-wFc融合蛋白及其制备方法和应用,本发明制备的Ag85B-wFc融合蛋白经滴鼻免疫后能诱导比皮下免疫更强烈的局部黏膜免疫和全身免疫效果,免疫效果高,抗体效价高。
本发明提供了一种Ag85B-wFc融合蛋白,所述Ag85B-wFc融合蛋白的氨基酸序列如SEQ ID NO.1所示,编码该蛋白的核苷酸序列如SEQ ID NO.2所示。
本发明还提供了一种pcDNA-Ag85B-wFc重组质粒,所述pcDNA-Ag85B-wFc重组质粒包含权利要求1中的SEQ ID NO.2序列。
进一步地,所述pcDNA-Ag85B-wFc重组质粒构建步骤为:将质粒pcDNA3.1(+)的HindIII和XhoI酶切位点之间的片段替换为序列表的SEQ ID NO.2所示的DNA序列,得到重组质粒pcDNA-Ag85B-wFc。
本发明还提供了一种所述的Ag85B-wFc融合蛋白的制备方法,包括如下步骤:
构建pcDNA-Ag85B-wFc重组质粒;
将pcDNA-Ag85B-wFc重组质粒转化感受态细胞,转染CHO细胞,筛选稳定表达Ag85B-mFc融合蛋白的单克隆细胞,然后进行融合蛋白的分离、纯化、浓缩获得Ag85B-wFc融合蛋白。
进一步地,所述pcDNA-Ag85B-wFc重组质粒构建步骤为:将质粒pcDNA3.1(+)的HindIII和XhoI酶切位点之间的片段替换为序列表的SEQ ID NO.2所示的DNA序列,得到重组质粒pcDNA-Ag85B-wFc。
本发明还提供了一种所述的Ag85B-wFc融合蛋白或所述的Ag85B-wFc重组质粒在制备预防和/或治疗结核病药物中的应用。
本发明还提供了一种所述的Ag85B-wFc融合蛋白在制备抗结核分枝杆菌疫苗中的应用。
进一步地,所述疫苗为黏膜免疫疫苗。
进一步地,所述黏膜免疫为滴鼻免疫。
进一步地,所述疫苗还包括黏膜佐剂、防腐剂、稳定剂和乳化剂。
进一步地,所述黏膜佐剂为CpG ODN 1826。
进一步地,所述防腐剂为硫柳汞。
进一步地,所述稳定剂包括明胶、山梨糖醇、糖分子蔗糖和乳糖。
进一步地,所述乳化剂包括羊毛脂、Span-80、Arlacel-80和Tween-80。
与现有技术相比,本发明的有益效果在于:
1、本发明制备的Ag85B-wFc融合蛋白经滴鼻免疫后能诱导比皮下免疫更强烈的局部黏膜免疫和全身免疫效果,经鼻作用方式降低了与针头污染等相关病原菌的传播。提供了针对结核分枝杆菌的可以通过鼻黏膜途径给药的疫苗,对于结核分枝杆菌的防控具有重要的临床价值,对于结核分枝杆菌疫苗产业具有重要的应用价值。
2、本发明通过将Ag85B-wFc融合蛋白免疫与Ag85B-mFc和Ag85B经过皮下和滴鼻两种方式免疫发现,Ag85B-wFc融合蛋白滴鼻免疫效果显著高于其他组。具体如下:
细胞免疫效果:第1次免疫后第42d,Ag85B-wFc滴鼻免疫组肺组织及脾脏的CD3+CD4+IFN-γ+细胞比例和CD3+CD8+IFN-γ+细胞比例均明显高于其他5组(p<0.05);Ag85B-wFc滴鼻免疫组肺组织及脾脏的CD3+CD44+CD62L-记忆性T细胞比例均明显高于其他5组(p<0.05)。第1次免疫后第42d分离脾细胞经Ag85B抗原刺激后,Ag85B-wFc滴鼻免疫组淋巴细胞刺激指数明显高于其他5组(p<0.01);第1次免疫后第42d检测到Ag85B-wFc滴鼻免疫组血清中IFN-γ和IL-2含量高于其他5组(p<0.05)。
体液免疫效果:Ag85B-wFc滴鼻免疫组血清中IgG、IgG1和IgG2a抗体效价在第14d、28d和42d明显高于其他5组(p<0.05),且抗体类型以IgG2a为主;第1次免疫后第42d,在Ag85B-wFc滴鼻免疫组小鼠的鼻黏膜冲洗液中特异性IgG抗体最高,且抗体效价明显高于其他5组(p<0.05)。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为重组质粒pcDNA-Ag85B和pcDNA-Ag85B-wFc的构建过程;图中的pcDNA-Ag85B-Fc即为pcDNA-Ag85B-wFc。
图2为pcDNA-Ag85B、pcDNA-Ag85B-wFc和pcDNA-Ag85B-mFc重组质粒的鉴定结果;
图中,A为pcDNA-Ag85B双酶切鉴定结果,M:DNAmarker(DL10000),1:pcDNA3.1+空质粒,2:pcDNA-Ag85B重组质粒,3:pcDNA-Ag85B重组质粒的Hind III/XbaI双酶切产物;
B为pcDNA-Ag85B-wFc双酶切鉴定结果,M:DNAmarker(DL10000),1:pcDNA3.1+空质粒,2:pcDNA-Ag85B-wFc重组质粒,3:pcDNA-Ag85B-wFc重组质粒的Hind III/XbaI双酶切产物;
C为pcDNA-Ag85B-mFc双酶切鉴定结果,M:DNAmarker(DL10000),1:pcDNA3.1+空质粒,2:pcDNA-Ag85B-mFc重组质粒,3:pcDNA-Ag85B-mFc重组质粒的Hind III/XbaI双酶切产物。
图3为重组质粒转染后的表达产物(融合蛋白)Western Blot分析结果,1:pcDNA-Ag85B-wFc重组质粒转染CHO细胞的表达产物,2:pcDNA-Ag85B-mFc重组质粒转染CHO细胞的表达产物,3:pcDNA-Ag85B重组质粒转染CHO细胞的表达产物,4:CHO细胞,M:蛋白marker。
图4为纯化后的融合蛋白的SDS-PAGE及Western Blot检测结果;
图中,A为纯化后的融合蛋白SDS-PAGE检测结果,M:蛋白marker,1:Ag85B融合蛋白纯化产物,2:Ag85B-mFc融合蛋白纯化产物,3:Ag85B-wFc融合蛋白纯化产物;
B为纯化后的融合蛋白的Western Blot检测检测结果,M:蛋白marker,1:Ag85B-mFc融合蛋白纯化产物,2:Ag85B-wFc融合蛋白纯化产物,3:Ag85B融合蛋白纯化产物。
图5为细胞的设门策略,图中,A为淋巴细胞设门策略,B为CD3+T细胞设门策略。
图6为Ag85B、Ag85B-wFc和Ag85B-mFc用不同免疫方式对肺组织FCM的影响;图中,A为肺组织中分泌IFN-γ的CD4+、CD8+T流式图;B为肺组织中分泌IFN-γ的CD4+T细胞比例统计图;C为肺组织中分泌IFN-γ的CD8+T细胞比例统计图。
图7为Ag85B、Ag85B-wFc和Ag85B-mFc用不同免疫方式对脾脏FCM的影响;图中,A为脾脏中分泌IFN-γ的CD4+、CD8+T流式图;B为脾脏中分泌IFN-γ的CD4+T细胞比例统计图;C为脾脏中分泌IFN-γ的CD8+T细胞比例统计图。
图8为肺组织和脾脏中各免疫组记忆性Tem的细胞比例
图9为不同免疫组对淋巴细胞增殖能力的影响,
图10为不同免疫组对小鼠血清中IFN-γ和IL-2含量的影响。
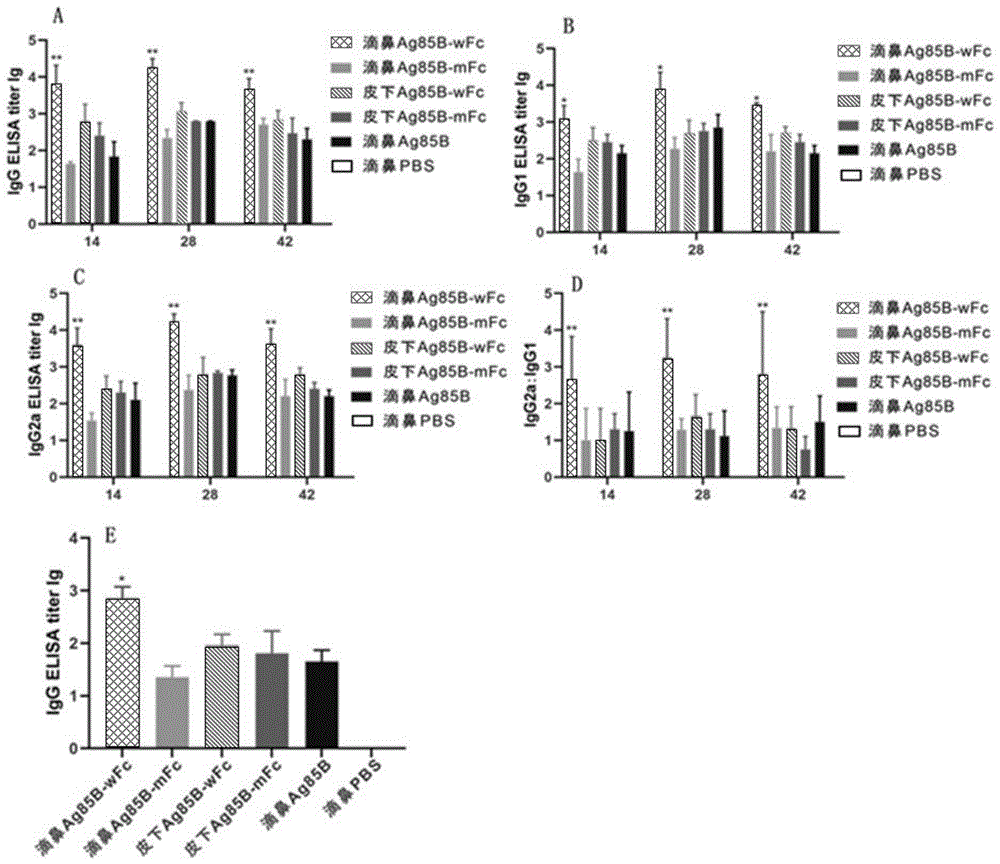
图11为不同免疫组小鼠血清中抗体效价;图中,A为小鼠血清中IgG抗体效价;B为小鼠血清中IgG1抗体效价;C为小鼠血清中IgG2a抗体效价;D为抗体IgG2a/IgG1的比值;E为小鼠鼻黏膜灌洗液中IgG的抗体效价。
图12为Ag85B-wFc融合蛋白攻毒保护实验结果;图中,A为Ag85B-wFc融合蛋白感染小鼠的肺脏中的荷菌数;B为Ag85B-wFc融合蛋白感染小鼠的脾脏中的荷菌数。
图13为Ag85-wFc融合蛋白对H37Ra荷菌数的影响(金胺O荧光染色结果)。
具体实施方式
下面对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明各实施例中所述实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明所用实验材料如下:
1、细胞株:中国仓鼠卵巢细胞CHO购买于中国医学科学院;
2、实验动物:6-8周龄雌性C57BL/6J小鼠若干只,购于宁夏医科大学实验动物中心,许可证号:SCXK(宁)2020-0001,饲养于SPF级环境中。
本发明中制备的Ag85B、Ag85B-wFc和Ag85B-mFc的融合蛋白及相关核苷酸序列如下所示:
1、Ag85B-wFc融合蛋白的氨基酸序列如SEQ ID NO.1所示,编码Ag85B-wFc融合蛋白的核苷酸序列如SEQ ID NO.2所示。
SEQ ID NO.1中第1-25位为信号肽,第26-309位为Ag85B,第310-324位为linker,第325-557位为IgG2a Fc。
SEQ ID NO.2中第1-75位为信号肽编码序列,第76-927位为Ag85B核酸序列,第928-972位为linker编码序列,第973-1674位为IgG2a Fc核酸序列。
2、Ag85B-mFc融合蛋白的氨基酸序列如SEQ ID NO.3所示,编码Ag85B-mFc融合蛋白的核苷酸序列如SEQ ID NO.4所示。
3、Ag85B融合蛋白的氨基酸序列如SEQ ID NO.5所示,编码Ag85B-mFc融合蛋白的核苷酸序列如SEQ ID NO.6所示。
实施例1:Ag85B-wFc融合蛋白及其制备方法。
一、构建重组质粒
1、重组质粒pcDNA-Ag85B-wFc、pcDNA-Ag85B和pcDNA-Ag85B-mFc的构建:
如图1所示,重组质粒pcDNA-Ag85B-wFc:将质粒pcDNA3.1(+)的HindIII和XhoI酶切位点之间的片段替换为SEQ ID NO.2所示的DNA分子,保持其他部分不变,得到重组质粒pcDNA-Ag85B-wFc。
Ag85B是带有信号肽的Ag85B基因,wFc是小鼠IgG2a Fc片段,其中将Fc片段上与补体Clq结合的关键位点氨基酸E(谷氨酸)和K(赖氨酸)均突变为A(丙氨酸),IgG Fc片段上CH2和CH3区域的氨基酸残基His310与His433是与FcRn结合的必需氨基酸,mFc是将wFc上这2个氨基酸(His310与His433)突变为丙氨酸(Ala),以期降低FcRn与IgG的结合力。
重组质粒pcDNA-Ag85B-mFc:将质粒pcDNA3.1(+)的HindIII和XhoI酶切位点之间的小片段替换为序列表的SEQ ID NO.4所示的DNA分子,保持其他部分不变,得到重组质粒pcDNA-Ag85B-mFc。
2、重组质粒pcDNA-Ag85B、pcDNA-Ag85B-wFc和pcDNA-Ag85B-mFc的鉴定
分别将制备得到的重组质粒pcDNA-Ag85B、pcDNA-Ag85B-wFc和pcDNA-Ag85B-mFc转化感受态细胞DH5α,涂布于含Amp的LB固体培养基上,将平板放入37℃恒温箱中,30min后,将平板倒置并过夜培养。挑取生长良好的单个菌落接种于含有Amp的200mL LB液体培养基中,37℃摇床,200rpm震荡培养12-16h。利用无内毒素质粒大提试剂盒(北京天根生化科技有限公司)提取重组质粒。
将提取的重组质粒按表1中的体系加样,混匀后瞬时离心,37℃恒温箱中酶切1h。并将酶切正确的重组质粒送北京睿博兴科生物技术有限公司测序。最后利用琼脂糖凝胶电泳检测。
表1酶切反应体系
二、稳转细胞系的建立
1、细胞转染
(1)取生长状态良好的CHO细胞,用胰酶消化后进行细胞计数,以1.0×10
(2)制备溶液A和溶液B转染试剂,溶液A:25μL Opti-MEM
将溶液A与溶液B混合,室温孵育15min。将24孔板内的培养基弃去,用PBS洗两次,加入1mL不含抗生素的培养基。f.将溶液A与溶液B的混合液逐滴加入孔中,轻轻摇动培养板使其混匀,置细胞培养箱中培养24h,获得转染的细胞。
2、单克隆细胞的筛选
将上述转染的细胞消化后计数,分别取1000、2000、5000个细胞接种到10cm培养皿中,待细胞贴壁后换成含600μg/mL G418的筛选培养基,观察出现的单克隆细胞。把整个单克隆细胞转移到96孔板内,加入适量的筛选培养基继续培养,待细胞长满后收集细胞上清通过Western Blot筛选出表达蛋白的阳性单克隆细胞,然后依次传代到6孔板和T25的培养瓶扩增培养,并且期间不断通过Western Blot鉴定目的蛋白的表达,一直扩增培养到T75的培养瓶,扩增培养过程中换成含300μg/mL G418的完全培养基。最终扩增培养获得稳定表达Ag85B、Ag85B-wFc和Ag85B-mFc的CHO细胞系。
3、融合蛋白的表达与鉴定
当细胞长满整个培养皿的90%左右,收集细胞培养基,500g、4℃离心5分钟,收集细胞上清保存于-80℃备用。然后进行Western Blot鉴定。
三、融合蛋白的分离纯化
1、融合蛋白的分离
a.筛选稳定高表达Ag85B、Ag85B-wFc和Ag85B-mFc的融合蛋白的阳性单克隆细胞系,并扩大培养。待细胞汇合度达到90%左右,加入终浓度为1μM的丁酸钠溶液,置32℃,5%CO
2、融合蛋白的纯化浓缩
a.平衡:取一新的无菌干燥超滤管,加入无菌去离子水,水量完全过膜,冰浴10min,4℃、2000rpm离心5min。b.上样:弃去管底的液体,将超滤管放置冰上,加入上述分离出的目的蛋白,不超过管顶的白线为准,4℃、3000rpm离心10min。c.置换缓冲液体系:将所有的蛋白液浓缩至1mL左右时,沿管壁缓慢加入适量无菌PBS溶液,4℃、3000rpm离心10min,连续三次。d.最后一次离心后,收集管里的蛋白浓缩液,不多于500μL。e.超滤管的清洗及保存:加入适量去离子水,用枪头轻轻吹打,注意不要碰到滤膜,弃去液体并重复3次;加入0.2M的NaOH溶液,室温放置20min后,3000rpm离心10min,倒出液体;将管芯浸没于装满去离子水的烧杯中,放置2-4h,期间重复更换新的去离子水从而稀释NaOH浓度;将50mL管清洗后加满20%的乙醇,取出管芯使之完全浸于50mL离心管中,盖上盖子放于4℃保存。f.检测:将上述收集的浓缩液用BCA测定蛋白的浓度,取出5μg作SDS-PAGE电泳检测和Western Blot鉴定。并将收集到的洗脱液分装小管,冻存于-80℃备用。
四、实验结果
1、重组质粒的鉴定
(1)真核重组表达质粒pcDNA-Ag85B的双酶切(HindⅢ和Xbal)产物经1%琼脂糖凝胶电泳分析,可见大小约1000bp的条带,大小与预期(963bp)相符,见图2的A;将双酶切鉴定正确的pcDNA-Ag85B重组质粒测序,测序结果表明Ag85B基因全长为963bp,与NCBI中收录的M.tb H37Rv的Ag85B(NP_216402.1)基因序列同源性为100%,表明质粒构建正确。
(2)真核重组表达质粒pcDNA-Ag85B-wFc的双酶切(HindⅢ和Xbal)产物经1%琼脂糖凝胶电泳分析,可见大小约1700bp的条带,大小与预期(1689bp)相符,见图2的B,将双酶切鉴定正确的pcDNA-Ag85B-wFc重组质粒测序,测序结果显示Ag85B-wFc基因全长为1689bp。其中信号肽US6基因与NCBI中收录的Envelope glycoprotein D[HumanalpHaherpesvirus2]的US6基因序列(AMB66244.1)同源性为100%,Ag85B基因与NCBI中收录的M.tb H37Rv的Ag85B(NP_216402.1)基因序列同源性为100%,wFc基因(突变位点除外)与NCBI中收录的小鼠IgG2a的重链序列(P01863.1)的同源性为100%,表明质粒构建正确。
(3)真核重组表达质粒pcDNA-Ag85B-mFc的测序鉴定:将双酶切鉴定正确的pcDNA-Ag85B-mFc重组质粒测序,测序结果显示Ag85B及mFc基因均正确,见图2的C。
2、Western Blot分析重组质粒转染后的表达产物(融合蛋白)
将转染后出现的单克隆细胞转移到96孔板后,通过加入筛选培养基继续扩大培养至细胞密度达到90%左右,收集细胞及细胞上清,通过Western Blot筛选出表达蛋白的阳性单克隆细胞,同时设置CHO细胞对照组,见图3。
3、SDS-PAGE及Western Blot检测纯化后的融合蛋白
将Ag85B、Ag85B-mFc和Ag85B-wFc融合蛋白的纯化浓缩产物进行SDS-PAGE检测,结果分别在约35KDa及70KDa处出现一条明显的条带,与预期蛋白大小相符(图4的A)。采用Western Blot分别对Ag85B、Ag85B-mFc和Ag85B-wFc融合蛋白的浓缩液进行了鉴定,结果与预期大小相符,见图4的B。
实施例2:上述制备得到的Ag85B-wFc融合蛋白免疫效果研究。
一、实验方法
1、动物免疫方案
本实验采用prime-boost实验方案:6-8周龄C57BL/6J小鼠(18-20g)随机分组,每组6只,共分6组(记为第一组、第二组…第六组),按表2中的免疫方式和剂量进行免疫。根据本课题组前期的实验摸索,确定蛋白免疫剂量为20μg/只,黏膜佐剂CpG ODN 1826(简写为CpG)的剂量为20μg/只,黏膜免疫组的小鼠根据0.25-0.5mg/g体重阿佛丁麻醉剂的量腹腔麻醉小鼠。保证同体积滴鼻,两次免疫的剂量与体积均相同。具体免疫、采血和取材时间如表3。其中滴鼻免疫组又称黏膜免疫组。滴鼻免疫方式为:免疫前先进行麻醉(阿佛丁麻醉剂腹腔麻醉,用量为0.2mL/10g体重),完全麻醉后,将免疫物逐滴滴入小鼠鼻腔内,过程中左右鼻腔轮流进行。
表2免疫方案
表3免疫时间
二、实验结果
(一)、流式细胞术(FCM)检测小鼠免疫后分泌IFN
初次免疫后42d,取小鼠脾脏,获取淋巴细胞,得到淋巴细胞悬液。初次免疫后42d,取小鼠肺组织,制备单细胞悬液。采用FCM检测分泌IFN-γ的CD4
1、FCM检测的设门策略
在流式细胞图中,以FSC为横坐标,以SSC为纵坐标,分别对分泌IFN-γ的CD4
2、各组肺组织和脾脏中各免疫组分泌IFN-γ的CD4+T、CD8+T细胞比例
如图6所显示,Ag85B-wFc滴鼻免疫组、Ag85B-mFc滴鼻免疫组、Ag85B-wFc皮下免疫组、Ag85B-mFc皮下免疫组、Ag85B和PBS滴鼻免疫组肺组织的CD3
Ag85B-wFc滴鼻免疫组、Ag85B-mFc滴鼻免疫组、Ag85B-wFc皮下免疫组、Ag85B-mFc皮下免疫组、Ag85B和PBS滴鼻免疫组肺组织的CD3
如图7所示,Ag85B-wFc滴鼻免疫组、Ag85B-mFc滴鼻免疫组、Ag85B-wFc皮下免疫组、Ag85B-mFc皮下免疫组、Ag85B和PBS滴鼻免疫组脾脏的CD3
Ag85B-wFc滴鼻免疫组、Ag85B-mFc滴鼻免疫组、Ag85B-wFc皮下免疫组、Ag85B-mFc皮下免疫组、Ag85B和PBS滴鼻免疫组中脾脏的CD3
3、肺组织和脾脏中各免疫组效应型记忆Tem细胞比例
结果如图8所示,Ag85B-wFc滴鼻免疫组、Ag85B-mFc滴鼻免疫组、Ag85B-wFc皮下免疫组、Ag85B-mFc皮下免疫组、Ag85B和PBS滴鼻免疫组肺组织的CD3
结果如图9所示,Ag85B-wFc滴鼻免疫组、Ag85B-mFc滴鼻免疫组、Ag85B-wFc皮下免疫组、Ag85B-mFc皮下免疫组、Ag85B和PBS滴鼻免疫组脾脏的CD3
(二)淋巴细胞增殖实验
不同免疫组的小鼠将其脾脏淋巴细胞在体外通过Ag85B特异性抗原刺激后,能够产生显著的淋巴细胞增殖能力。其中Ag85B-wFc滴鼻免疫组与Ag85B-wFc皮下免疫组及Ag85B-mFc皮下免疫组的刺激指数(SI)分别为2.55、2.04和1.77,Ag85B-wFc滴鼻免疫组高于Ag85B-wFc皮下免疫组及Ag85B-mFc皮下免疫组,差异具有统计学意义(p<0.01)。而Ag85B-mFc、Ag85B和PBS滴鼻免疫组的刺激指数分别为1.74,1.68和0.40,增殖均不及Ag85B-wFc(2.55)滴鼻免疫组,差异具有统计学意义(p<0.001)。
(三)小鼠血清中IFN-γ和IL-2含量
结果如图10所示,第1次免疫后第42d检测到Ag85B-wFc和Ag85B-mFc皮下免疫组血清中IFN-γ含量分别为150和138pg/mL。Ag85B-wFc、Ag85B-mFc、Ag85B和PBS滴鼻免疫组的血清IFN-γ含量分别为484、260、112和86pg/mL,Ag85B-wFc滴鼻免疫组明显高于其他五组,差异具有统计学意义(P<0.001)。
Ag85B-wFc和Ag85B-mFc皮下免疫组血清中IL-2含量分别为56和52pg/mL。Ag85B-wFc、Ag85B-mFc、Ag85B和PBS滴鼻免疫组血清中IL-2含量分别为106、53、48和34pg/mL,Ag85B-wFc滴鼻免疫组显著高于其他五组,差异具有统计学意义(P<0.001)。
(四)体液免疫效果评价
1、小鼠血清中IgG抗体效价
结果如图11的A所示,第1次免疫后第14d,Ag85B-wFc、Ag85B-mFc、Ag85B滴鼻免疫组和Ag85B-wFc、Ag85B-mFc皮下免疫组小鼠的血清中检测到特异性IgG抗体水平开始增加,到第28d时,Ag85B-wFc滴鼻免疫组抗体水平达到最高,到第42d时有所下降,且第14d、28d和42d Ag85B-wFc滴鼻免疫组抗体水平均显著高于其他五组,差异具有统计学意义(P<0.01)。
2、小鼠血清中IgG1抗体效价
结果如图11的B所示,第1次免疫后第14d,Ag85B-wFc、Ag85B-mFc、Ag85B滴鼻免疫组和Ag85B-wFc、Ag85B-mFc皮下免疫组小鼠的血清中检测到特异性IgG1抗体水平开始增加,到第28d时,Ag85B-wFc滴鼻免疫组抗体水平达到最高,到第42d时有所下降,且第14d、28d和42d Ag85B-wFc滴鼻免疫组抗体水平均显著高于其他五组,差异具有统计学意义(P<0.01)。
3、小鼠血清中IgG2a抗体效价
结果如图11的C所示,第1次免疫后第14d,Ag85B-wFc、Ag85B-mFc、Ag85B滴鼻免疫组和Ag85B-wFc、Ag85B-mFc皮下免疫组小鼠的血清中检测到特异性IgG2a抗体水平开始增加,到第28d时,Ag85B-wFc滴鼻免疫组抗体水平达到最高,到第42d时有所下降,且第14d、28d和42d Ag85B-wFc滴鼻免疫组抗体水平均显著高于其他五组,差异具有统计学意义(P<0.01)。
4、抗体IgG2a/IgG1的比值
通过对特异性抗体IgG2a/IgG1的比值分析,Ag85B-wFc滴鼻免疫组第14d、28d和42d的比值均大于1,与PBS组比较差异有统计学意义(
5、小鼠鼻黏膜灌洗液中IgG的抗体效价
第1次免疫后第42d在Ag85B-wFc滴鼻免疫组小鼠的鼻黏膜冲洗液中检测到最高的特异性IgG抗体水平,显著高于其他五组,差异具有统计学意义(P<0.05)。
实施例3:上述制备得到的Ag85B-wFc融合蛋白攻毒保护实验。
将6-8周龄雌性C57BL/6J小鼠随机分成2组,每组6只。
第一组(Ag85-wFc+H37Ra感染组):试验第1天进行第一次免疫,试验第15天进行第二次免疫;两次免疫的免疫方式均为滴鼻免疫;两次免疫的免疫物均为Ag85-wFc免疫物,单次单只免疫体积为40μL(其中Ag85-wFc蛋白的量为20μg);试验第43天,尾静脉注射结核分枝杆菌H37Ra(10
第二组(PBS+H37Ra感染组):试验第1天进行第一次免疫,试验第15天进行第二次免疫;两次免疫的免疫方式均为滴鼻免疫;两次免疫的免疫物均为对照免疫物,单次单只免疫体积为40μL;试验第43天,尾静脉注射结核分枝杆菌H37Ra(10
Ag85-wFc免疫物:将实施例1制备的Ag85-wFc融合蛋白(用PBS调整蛋白浓度)和黏膜佐剂等体积混合获得。对照免疫物:将PBS和黏膜佐剂等体积混合获得。
注射结核分枝杆菌H37Ra的28天后,断颈处死小鼠。无菌分离小鼠肺脏及脾脏。
一、平板法测定脏器荷菌量
1.取一半肺脏(和全部脾脏),置于孔径40μm的细胞筛网中,加入5mL PBS,研磨,收集所有细胞悬液至15mL离心管,混匀后用PBS进行10倍梯度稀释,得到稀释液。
2.取100μL稀释液,涂布7H10培养基平板,用封口膜密封,37℃倒置培养21天,记录平板上的菌落数。每个稀释液设置3个重复平板。
脏器荷菌数(CFU)=(N/稀释度)×40。
N为平板上单个菌落数。
结果见图12,与PBS+H37Ra感染组小鼠相比,Ag85-wFc+H37Ra感染组小鼠的肺及脾脏中的荷菌数明显降低,差异显著(分别为p<0.001,p<0.01)。
二、抗酸及金胺O染色
1.制作石蜡切片
取剩余的一半肺脏,用4%多聚甲醛固定48h,石蜡包埋后进行切片。
2.石蜡切片金胺O荧光染色
将切片依次浸入两缸二甲苯溶液中,每缸静置10分钟脱蜡。然后,将切片浸入两缸无水乙醇,每缸静置5min。然后将切片依次浸入95%乙醇溶液、85%乙醇溶液、75%乙醇溶液中各5min脱水。然后向切片上滴加金胺0染色液,避光染色15min,用蒸馏水冲洗,然后用酸性脱色液脱色2min,用蒸馏水冲洗,然后用复染液染色2min,用蒸馏水冲洗。轻轻吸光水分,自然干燥,荧光显微镜下镜检。
结果见图13,金胺O荧光染色结果显示,M.tb被染成金黄色:与PBS+H37Ra感染组小鼠相比,Ag85-wFc+H37Ra感染组小鼠肺荷菌数明显降低,差异显著(p<0.001)。
综上所述,本发明中制备的Ag85B-wFc融合蛋白经滴鼻免疫小鼠后能诱导比皮下免疫更强烈的局部黏膜免疫和全身免疫反应,对结核分枝杆菌的感染具有良好的保护作用。
本发明还需要说明的是,本发明中wFc是小鼠IgG2a Fc片段,用mFc表示将wFc进行基因突变后的Fc片段,突变指的是将Fc片段上与补体Clq结合的关键位点氨基酸E(谷氨酸)和K(赖氨酸)均突变为A(丙氨酸)。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
