一种KRAS翻译抑制剂及其制备方法和应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于药物化学领域,具体涉及一种KRAS翻译抑制剂及其制备方法和应用。
背景技术
异常活化的KRAS蛋白突变体在癌症发展中起着关键作用,其也是极具吸引力的治疗药物靶点。KRAS G12C的选择性共价抑制剂AMG510和MRTX849已成功用于KRAS G12C型晚期非小细胞肺癌的临床治疗,然而针对KRAS其他突变体的抑制剂研究进展缓慢,急需发展一种新型的强效抑制剂用于治疗KRAS所有突变体的癌症。
G-四链体是一种特殊的二级结构DNA,广泛分布于基因组、转录以及翻译区,参与重要的调控过程。G-四链体的折叠与去折叠在体内处于一个动态平衡。当G-四链体被G-四链体配体稳定时,会阻碍mRNA翻译,从而导致细胞的衰老与凋亡。原癌基因KRAS在癌细胞中常常发生突变,这导致持续激活下游通路,调控着癌细胞的分化、增殖等生命过程。KRASmRNA的5'-UTR区形成的RNA G-四链体(rG4)结构能够阻碍KRAS的翻译。综上所述,特异性稳定KRAS rG4,可抑制KRAS的翻译,诱导癌细胞的凋亡。因此KRAS rG4被认为是开发KRAS翻译抑制剂的潜在靶点。
KRAS是一种无序蛋白,半衰期极其短并且没有与小分子结合的活性口袋。因此开发直接靶向KRAS蛋白的药物一直是极具挑战的。虽然目前已经报道了两种针对KRAS G12C突变体的上市药物,但由于治疗过程中出现严重的耐药问题,导致病人表现出明显的副作用。其次KRAS突变中,G12C位点突变的占比非常小,因此开发广泛地治疗KRAS突变癌症的泛抑制剂是一种有前景的策略。
发明内容
为了克服上述现有技术存在的问题,本发明的目的之一在于提供一种KRAS翻译抑制剂。
本发明的目的之二在于提供一种KRAS翻译抑制剂的制备方法。
本发明的目的之三在于提供一种抗肿瘤药物。
本发明的目的之四在于提供一种KRAS翻译抑制剂在制备抗肿瘤药物或KRAS翻译抑制药物组合物中的应用。
为了实现上述目的,本发明所采取的技术方案是:
本发明的第一个方面提供了一种KRAS翻译抑制剂,具有如式(I)、式(II)、式(III)或式(IV)所示的化合物,或其药学上可接受的盐、酯、水合物、溶剂化物、晶体、对映异构体、立体异构体、醚、代谢物和前药,
其中,R
每个R
每个R
每个R
每个R
每个n各自独立地选自1-10中的自然数。
优选地,所述R
优选地,所述苯并氮杂环选自苯并氮杂五元环、苯并氮杂六元环;进一步优选地,所述苯并氮杂环选自5-氨基-2-甲基苯并咪唑基、苯并咪唑基。
优选地,所述单糖选自六碳糖、五碳糖;进一步优选地,所述单糖选自葡萄糖、半乳糖、甘露糖、氨基葡萄糖。
优选地,所述KRAS翻译抑制剂选自:
R
优选地,所述药学上可接受的盐包括但不仅限于无机酸盐,有机酸盐,烷基磺酸盐和芳基磺酸盐中的至少一种。
优选地,所述无机酸盐包括但不仅限于盐酸盐、氢溴酸盐、硝酸盐、硫酸盐和磷酸盐中的至少一种。
优选地,所述有机酸盐包括但不仅限于甲酸盐、乙酸盐、丙酸盐、苯甲酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐和柠檬酸盐中的至少一种。
优选地,所述烷基磺酸盐包括但不仅限于甲基磺酸盐和乙基磺酸盐中的至少一种。
优选地,所述芳基磺酸盐包括但不仅限于苯磺酸盐和对甲苯磺酸盐中的至少一种。
本发明的第二个方面提供了本发明第一个方面提供的KRAS翻译抑制剂的制备方法,包括以下步骤:
由式(V)所示的化合物和R
或,先由式(V)所示的化合物和1-丙-2-炔基哌嗪反应得到式(VI)所示的化合物,再由式(VI)所示的化合物与R
或,由
或,以
其中,式(V)和式(VI)所示的化合物的结构式如下:
R
优选地,所述
本发明的第三个方面提供了一种抗肿瘤药物,包括本发明第一个方面提供的KRAS翻译抑制剂和药学上可接受的辅料。
优选地,所述肿瘤选自胰腺癌、结直肠癌、肺癌、上皮细胞癌、宫颈癌、前列腺癌、鼻咽癌、卵巢癌、恶性胶质瘤、淋巴瘤、黑色素瘤。
优选地,所述肺癌选自小细胞肺癌或非小细胞肺癌。
优选地,所述药学上可接受的辅料是无毒性、与活性成分相容且其他方面生物学性质上适用于生物体的物质。特定辅料的选择将取决于用于治疗特定患者的给药方式或疾病类型和状态。药学上可接受的辅料其实例包括但不限于药学领域常规的溶剂、稀释剂、分散剂、助悬剂、表面活性剂、等渗剂、增稠剂、乳化剂、粘合剂、润滑剂、稳定剂、水合剂、乳化加速剂、缓冲剂、吸收剂、着色剂、离子交换剂、脱模剂、涂布剂、矫味剂、和抗氧化剂等。必要时,还可以在药物组合物中加入香味剂、防腐剂和甜味剂等。
优选地,所述药物的剂型选自注射剂、片剂、丸剂、胶囊剂、颗粒剂、乳剂或悬浮剂。
本发明的第四个方面提供了本发明第一个方面提供的KRAS翻译抑制剂在制备抗肿瘤药物或KRAS翻译抑制药物组合物中的应用。
优选地,所述肿瘤选自胰腺癌、结直肠癌、肺癌、上皮细胞癌、宫颈癌、前列腺癌、鼻咽癌、卵巢癌、恶性胶质瘤、淋巴瘤、黑色素瘤。
优选地,所述肺癌选自小细胞肺癌或非小细胞肺癌。
本发明的有益效果是:本发明中的KRAS翻译抑制剂作为KRAS RNAG-四链体的特异性配体,其结构中的香豆素-喹啉鎓盐是识别RNA G-四链体必要骨架部分,整个分子的平面结构通过π-π堆叠于G-四链体平面,分子两侧的氨基侧链部分可以与G-四链体的沟槽中的磷酸骨架结合。KRAS翻译抑制剂能够有效地杀死KRAS突变驱动的癌细胞,同时能够抑制原癌基因KRAS mRNA的翻译,从而抑制KRAS驱动的肿瘤细胞株增殖,具有广谱抗肿瘤的活性。另外,本发明中的KRAS翻译抑制剂具有选择性的抑制KRAS驱动的癌细胞的增殖,而对正常细胞无干扰,且可以特异性结合和稳定KRAS RNA G-四链体,并能显著抑制下调KRAS蛋白水平,从而抑制多种KRAS驱动的癌细胞生长,在制备抗肿瘤药物上具有广泛的应用前景。
此外,本发明的制备方法操作简便,产率高,原料来源广,具有良好的工业应用前景。
附图说明
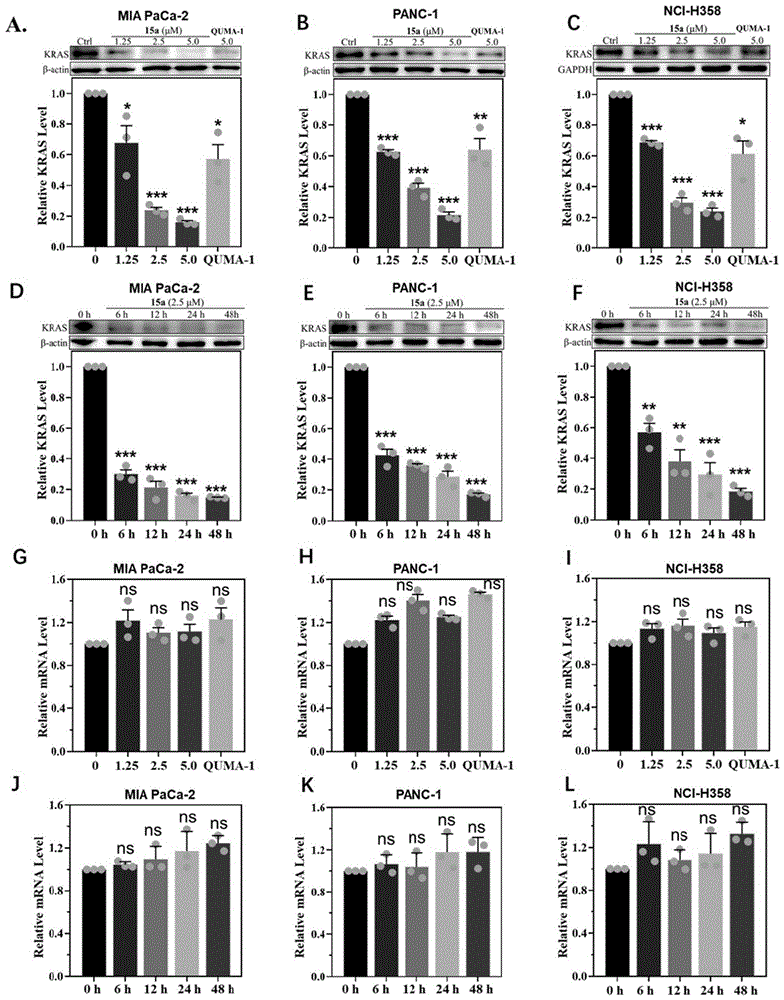
图1为本发明实施例制得的化合物15a、空白对照及QUMA-1对KRAS转录水平的影响效果图。
图2为本发明实施例制得的化合物15a、16a、18a、19a、21a、22a、9b、12b、空白对照及QUMA-1对KRAS蛋白水平的影响效果图。
具体实施方式
以下结合附图和实例对本发明的具体实施作进一步详细说明,但本发明的实施和保护不限于此。需要指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买得到的常规产品。
本发明实施例中的KRAS翻译抑制剂的合成路线如下:
上述反应路线中的使用的反应物和反应条件如下:
(a)乙酰乙酸乙酯,多聚磷酸(PPA),130℃,6小时;(b)POCl
上述实施例中的KRAS翻译抑制剂的合成路线中涉及的具体合成过程如下:
化合物1、2、10、11、12是参照文献Angewandte Chemie International Edition2018,57,4702-4706中报道的方法进行制备。
化合物3通过化合物2与碘甲烷甲基化反应所制备。将化合物3与氨基侧链(包括N-甲基哌嗪、N-甲基异环戊二胺、1-(2-氨乙基)吡咯烷、N-(3-氨丙基)吗啉、N-(3-氨丙基)-咪唑和1-(3-氨丙基)吡咯烷)二取代,分别得到化合物4-9。化合物13是通过化合物12与1-(丙-2-炔-1-基)哌嗪的亲核取代反应在室温下得到的。化合物2与丙炔胺的取代反应生成化合物14,然后用碘甲烷进行甲基化反应得到化合物15。化合物15的10位氯原子被N-甲基哌嗪取代,得到化合物16。化合物16与香豆素醛缩合得到关键的化合物17。化合物12的2位通过各种胺链取代反应得结构通式式(I)的化合物1a-24a,而化合物13与叠氮衍生物的化学反应得到了结构通式式(Ⅱ)的化合物25a-34a。结构通式式(Ⅲ)中化合物1b-10b的制备是利用与化合物25a-34a相同的方法合成,而化合物4-9与7-二乙基氨基香豆素-3-醛通过knoevenagel缩合反应得到结构通式式(Ⅳ)中化合物11b-16b。
制备结构通式式(I)的目标衍生物过程中,若使用化合物12、胺类化合物、碳酸钾进行制备,则化合物12、胺类化合物、碳酸钾的摩尔比例为1:(1.5~2):1;反应温度为0-35℃,反应时间为1h~12h。
制备结构通式式(II)或式(III)的目标衍生物过程中,若使用化合物17与叠氮化合物反应制备,则还需添加无水硫酸铜和抗坏血酸钠,则化合物17、叠氮化合物、无水硫酸铜和抗坏血酸钠的摩尔比例为1:2:(0.05~0.1):(0.15~0.3);反应温度为70~100℃,反应时间为10h~48h。
制备结构通式式(Ⅳ)的目标衍生物过程中,化合物4-9、7-二乙基氨基香豆素-3-醛、哌啶的摩尔比例为1:(1.1~2):0.1,温度为100℃~150℃,时间为24h~48h。
(1)化合物3的制备
将化合物2(2.0g,9.4mmol)和CH
(2)化合物4-9的通用制备步骤
将化合物3(360mg,1.0mmol)和氨基侧链(包括N-甲基哌嗪、N-甲基高哌嗪、1-(2-氨基乙基)吡咯烷、N-(3-氨基丙基)吗啉、N-(-3-氨基丙基)咪唑或1-(3-氨基丙酯)吡咯烷)(6.0mmol)和催化量的K
其中,化合物4-9的结构式如下:
化合物4的产率为88%。
化合物5的产率为86%。
化合物6的产率为53%。
化合物7的产率为55%。
化合物8的产率为38%。
化合物9的产率为51%。
(3)化合物13的制备
将化合物12(1.2g,2.2mmol)、1-(丙-2-炔-1-基)哌嗪(410mg,3.3mmol)和K
(4)化合物14的制备
将化合物2(300mg,1.4mmol)和K
(5)化合物15的制备
将化合物14(300mg,1.2mmol)和CH
(6)化合物16的制备
将化合物15(400mg,1.0mmol)和N-甲基哌嗪(0.4mL,3.6mmol)混溶于乙腈(3.0mL)的溶液中加入K
(7)化合物17的制备
将化合物16(350mg,0.9mmol)、7-二乙氨基香豆素-3-醛(320mg,1.3mmol)在EtOH(8.0mL)中的混合物在回流下搅拌24小时,然后冷却至室温,过滤该混合物并用无水醚彻底洗涤,然后在真空下干燥以获得作为中间体17的暗红色固体,收率:79%。
(8)制备1a-24a通用方法A的步骤
将溶解在乙腈(2.0mL)中的化合物12(280mg,0.5mmol)加入催化量的K
按照上述合成方法合成得到的化合物1a-24a的结构式如下:
化合物1a-24a的表征数据如下:
化合物1a的产率为36%。
化合物2a的产率为31%。
化合物3a的产率为78%。
化合物4a的产率为26%。
化合物5a的产率为72%。
化合物6a的产率为70%。
化合物7a的产率为49%。
化合物8a的产率为33%。
化合物9a的产率为31%。
化合物10a的产率为69%。
化合物11a的产率为44%。
化合物12a的产率为51%。
化合物13a的产率为32%。
化合物14a的产率为72%。
化合物15a的产率为48%。
化合物16a的产率为46%。
化合物17a的产率为21%。
化合物18a的产率为68%。
化合物19a的产率为73%。
化合物20a的产率为28%。
化合物21a的产率为51%。
化合物22a的产率为56%。
化合物23a的产率为69%。
化合物24a的产率为46%。
(9)制备化合物25a-34a和化合物1b–10b的通用方法B的步骤
将化合物13(130mg,0.2mmol)或化合物17(137mg,0.2mol)和叠氮化物(0.4mmol)混溶于叔丁醇/水(2.0mL,2:1)中,依次加入CuSO
按照上述合成方法合成的化合物25a-34a的结构式如下:
化合物25a-34a的表征数据如下:
化合物25a的产率为55%。
化合物26a的产率为76%.
化合物27a的产率为63%。
化合物28a的产率为69%。
化合物29a的产率为66%。
化合物30a的产率为72%。
化合物31a的产率为70%。
化合物32a的产率为76%。
化合物33a的产率为71%。
化合物34a的产率为68%。
按照上述合成方法合成的化合物1b–10b的结构式如下:
化合物1b-10b的表征数据如下:
化合物1b的产率为53%。
化合物2b的产率为63%。
化合物3b的产率为66%。
化合物4b的产率为59%。
化合物5b的产率为51%。
化合物6b的产率为76%。
化合物7b的产率为59%。
化合物8b的产率为63%。
化合物9b的产率为71%。
化合物10b的产率为74%。
(10)制备11b-16b的通用方法C的步骤
将化合物4-9(0.5mmol)、7-N,N-二乙氨基香豆素-3-醛(147mg,0.6mmol)和催化量的哌啶混溶于正丁醇(3.0mL)中,混合物回流搅拌24小时。冷却至室温后,粗产物用CH
按照上述合成方法合成的化合物11b-16b的结构式如下:
化合物11b-16b的表征数据如下:
化合物11b的产率为65%。
化合物12b的产率为57%。
化合物13b的产率为25%。
化合物14b的产率为27%。
化合物15b的产率为21%。
化合物16b的产率为28%。
试验例
本试验例测试了上述化合物1a-34a和化合物1b-16b对KRAS驱动的癌细胞与KRAS野生型的正常细胞生长的抑制作用,以及化合物15a、16a、18a、19a、21a、22a、9b、12b、空白对照及QUMA-1对KRAS蛋白水平的影响,同时测试了化合物15a、空白对照及QUMA-1对KRAS基因的转录水平的影响,其中,QUMA-1的结构式为:
1、对肿瘤细胞生长的抑制作用
选取上述实施例制得的KRAS翻译抑制剂(即化合物1a-34a和化合物1b-16b),并测试其对KRAS驱动的癌细胞(MIA PaCa-2细胞、PANC-1细胞)和KRAS野生型的正常细胞(市购所得,HEK293细胞和NCM460细胞)生长的抑制作用,采用噻唑蓝(MTT)法进行体外细胞毒测定,对数生长期的细胞加入不同浓度的衍生物,作用24h后,加入MTT,测定其吸光度。分别计算出抑制细胞生长50%时的化合物浓度,以IC
表1 KRAS翻译抑制剂的细胞毒性(IC
/>
参照上述化合物对对KRAS驱动的癌细胞和KRAS野生型的正常细胞生长的抑制作用的测试方法,测试化合物15a对不同细胞(HPAF-II细胞、SW620细胞、HCT116细胞、H358细胞、U-87MG细胞、LX2细胞、HFL1细胞)的抑制作用,同时测试化合物QUMA-1对上述细胞的抑制作用作为对照,具体测试结果如表2所示。
表2 15a在KRAS突变型和KRAS野生型细胞系中的细胞毒性(IC
由上表1和表2可知,本发明中的KRAS翻译抑制剂在体外对KRAS驱动的癌细胞有较强的抑制作用,尤其是化合物15a对KRAS驱动的癌细胞具有选择性抑制,可用于制备抗肿瘤药物。
2、对细胞内KRAS基因的转录与表达的影响
取部分代表性化合物测试其对细胞内KRAS基因的转录与表达的影响。具体操作如下:
(1)对转录的影响:
本实验设置实验组和两个对照组:空白对照组(Ctrl)和阳性对照组,细胞培养:将细胞接种到6孔板中,200000个/孔,待24小时细胞贴壁后,实验组加入化合物15a,15a的加入浓度为1.25μmol/L、2.5μmol/L、5μmol/L,空白对照组不加任何物质,阴性对照组加入等量的浓度为5μmol/L的QUMA-1,分别培养0h、6h、12h、24h和48h,收集细胞,提取RNA,检测RNA浓度,然后按照下面体系进行逆转录实验及PCR实验。空白对照组、阳性对照组和实验组除了添加的物质不同之外,其它操作相同。
使用的PCR产物、引物、配制体系如下:10×Dream Taq Green buffer,2.5μL;dNTPmixture(2.5mmol/L),0.5μL;CDNA,1μL;引物(sense),0.5μL;引物(antisense),0.5μL;Dream TaqDNA聚合酶,0.25μL;ddH
程序:95℃变性,5min;95℃变性,30s;58℃退火,30s;72℃延伸,60s(30个循环);72℃,10min;最终降温至10℃。
1.5%琼脂糖电泳120V,0.5h,电泳结束后,凝胶成像。具体测试结果如图1。其中,图1(A)、图1(B)和图1(C)为空白对照组、实验组和阴性对照组三组分别对MIA PaCa-2细胞、PANC-1细胞、NCI-H358细胞的KRAS转录水平的影响效果图。图1(D)、图1(E)、图1(F)为2.5μmol/L的化合物15a在不同培养时间测得对MIA PaCa-2细胞、PANC-1细胞、NCI-H358细胞的KRAS转录水平的影响效果图。图1(G)、图1(H)和图1(I)为QUMA-1在不同培养时间测得对MIAPaCa-2细胞、PANC-1细胞、NCI-H358细胞的KRAS转录水平的影响效果图,图1(J)、图1(K)和图1(L)分别为空白对照组在不同培养时间测得对MIA PaCa-2细胞、PANC-1细胞、NCI-H358细胞的KRAS转录水平的影响效果图。由图1可知,本发明中的KRAS翻译抑制剂15a和QUMA-1均不影响KRAS的转录水平。
(2)对表达的影响:
Western blot实验方法:MIA PaCa-2细胞培养:细胞计数,接种,加入化合物(15a、16a、18a、19a、21a、22a、9b、12b及QUMA-1)2.5μmol/L后,培养在六孔板中,长至500万个细胞后,取出,裂解。细胞被收集后,加入50μL细胞裂解液,提取上清总蛋白液。使用CBA法检测总蛋白浓度,后变性蛋白样品,取相同质量的蛋白上样,SDS-PAGE凝胶电泳分离蛋白条带。根据目标蛋白计算分子量,将相应位置的电泳条带切下,湿转发将蛋白条带转到PVDF膜上。设置两个对照组:空白对照组(Ctrl)和阳性对照组,其中,其他操作相同,仅添加的物质不同,空白对照组不加任何物质,阳性对照组加入QUMA-1 2.5μmol/L。
配制洗涤缓冲液(TBST)缓冲液(25mmol/L NaCl,100Tris缓冲液,0.2% Tween-20,pH7.4):TBST缓冲液溶解的5%脱脂奶粉溶液(w/v)封闭PVDF膜。分别相应用一抗(KRAS)和二抗(山羊抗兔)孵育PVDF膜,TBST缓冲液漂洗适当次数后,使用SuperECL Plus超敏发光试剂盒显色成像。结果如图2所示,本发明中的KRAS翻译抑制剂(15a、16a、18a、19a、21a、22a、9b、12b)能够显著降低c-MYC的表达水平,因此本发明中的KRAS翻译抑制剂是通过抑制KRAS翻译来杀死KRAS驱动的癌细胞。
通过将其应用于靶向KRAS RNA G-四链体,抑制KRAS的翻译,从而抑制癌细胞的增殖的实验,发现本发明实施例方案制得的化合物均具备显著的抗肿瘤效果。
综上所述,本发明设计了一类新的KRAS翻译抑制剂,该类衍生物基于一个特异性RNA G-四链体配体QUMA-1为基础进行结构修饰所制备的,其以香豆素-喹啉嗡化合物作为识别KRAS G-四链体,两侧的氨基链可以识别G-四链体的沟槽。该KRAS翻译抑制剂可以选择性结合和稳定KRAS RNA G-四链体,而对其他RNA G-四链体以及双链DNA几乎没有稳定能力,其中上述所制备的KRAS翻译抑制剂能够明显增加对KRAS-驱动肿瘤细胞的选择性,同时能够下调原癌基因KRAS的蛋白水平。因此,本发明KRAS翻译抑制剂可作为新型泛-KRAS翻译抑制剂,在制备抗肿瘤药物上具有广泛的应用前景。
上面对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下做出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
