一种温敏性低共熔溶剂及其在提取枸杞多糖中的应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于天然活性物质提取技术领域,具体涉及一种温敏性低共熔溶剂及其在提取枸杞多糖中的应用。
背景技术
多糖作为来源丰富且无毒的活性成分,由于其非凡的理化性质及药理活性,被视为探索生命奥秘和治疗复杂疾病的“金钥匙”,也是生物医药领域研究的热点。根据多糖在植物中的位置,植物多糖可分为细胞壁多糖(果胶、纤维素和半纤维素)、细胞内多糖(果糖、葡聚糖和游离多糖)和细胞外多糖(树胶)。不同的提取方法和介质可以通过水解和破坏细胞的不同部位来溶解不同类型的多糖,从而产生具有不同功能特性的各种多糖。遵循相似相溶的原理,在常用的溶剂中,水的极性最大,最容易穿透植物组织,因此水提法是获取枸杞多糖的经典方法,但对细胞的渗透性较弱,只能溶解部分细胞内多糖。在提取过程中,一般采用酸溶液提取和碱溶液提取来改善多糖的释放和溶解,主要是通过破坏植物细胞壁结构来促进多糖的提取。而酶促提取的提取机制是通过酶水解破坏植物细胞壁中的纤维素,促进高选择性水溶性多糖的释放。因此如何能够获得结构更加丰富的多糖,探索新的提取方式势在必行。而在提取溶剂中添加其他物质,进而改变溶剂理化性质或增加溶剂的穿透性,已经成为获得结构更加丰富的多糖的一种策略。
低共熔溶剂(Deep Eutectic Solvents,DES)是近年来发展起来的一种新型绿色溶剂,通常由一定化学计量比的氢键受体和氢键供体组合而成,具有低挥发性、高热稳定性、环境友好、组合灵活和成本低,同时满足绿色化学倡导的无毒或低毒以及高生物降解潜力等特点。DES已被视为一种优良的萃取溶剂,通常与加热辅助萃取、超声波辅助萃取和微波辅助萃取相结合,用于萃取植物中大量的非极性和极性活性物质。随后,为了进一步研究DES提取的基本原理,一些研究发现DES可通过破坏细胞壁来提高提取效率。因此,利用DESs从植物中提取目标生物活性多糖是可能的,也是很有前景的。虽然DESs在提取中具有良好的应用前景,但DES的提取仍存在一些亟待解决的问题。例如,DES的低蒸汽压特性使其很难从目标化合物中分离出来。近年来,刺激敏感性DES受到越来越多的关注,包括pH、CO
枸杞(Lycium barbarum L.)是一种多用途的药食兼用植物,含有丰富的天然活性成分。枸杞多糖(Lycium barbarum polysaccharide,LBPs)是从枸杞子中提取得到的一种水溶性多糖,被认为是枸杞果实中最主要的活性成分之一。因其复杂多样的结构和众多显著的活性,枸杞多糖近年来备受关注,并且在治疗慢性退行性疾病方面表现出巨大的潜力。而如何能够从枸杞中获得更多结构新颖的多糖,也是主要的研究热点之一。
发明内容
本发明提供一种温敏性低共熔溶剂及其在提取枸杞多糖中的应用,从而弥补现有技术的不足。
本发明首先提供一种温敏性低共熔溶剂,其中包含有氢键受体和氢键供体;其中氢键受体为L-薄荷醇,氢键供体为水杨酸苯酯。
更进一步的,所述的L-薄荷醇和水杨酸苯酯的摩尔比为1:1;
本发明所提供的温敏性低共熔溶剂用于从植物中提供多糖;
所述的植物,作为实施例的具体记载,为枸杞、大枣或黄芪。
本发明还提供一种提取枸杞多糖的方法,是使用上述的温敏性低共熔溶剂进行提取;
所述的方法,是将枸杞粉末放入到温敏性低共熔溶剂的水溶液中,进行高速剪切提取,然后提取液进行离心,离心液取出在低温条件下放置直至下相凝固形成固体。取出上清液,进行过滤,过滤液脱蛋白得到脱蛋白后的多糖溶液,用截留分子量为3000Da的超滤膜过滤,截留液冷冻干燥,得到枸杞多糖。
更进一步的,所述的水溶液中DES的体积分数为16.7%-50%,枸杞粉末与提取液的液料比mL/g为15-25,提取时间为20-40min;
作为一种优选,所述的DES体积分数为33.959%,料液比为19.06mL/g,提取时间为31.195min;
所述的过滤液用Sevage试剂脱蛋白。
本发明基于低共熔溶剂开发了一种基于温敏性低共熔溶剂辅助提取枸杞多糖的方法,本发明的方法不仅提取效率高,而且能够获得更多大分子量的多糖,并且应用于从其他植物种提取多糖,也表现出更高的提取率。
附图说明
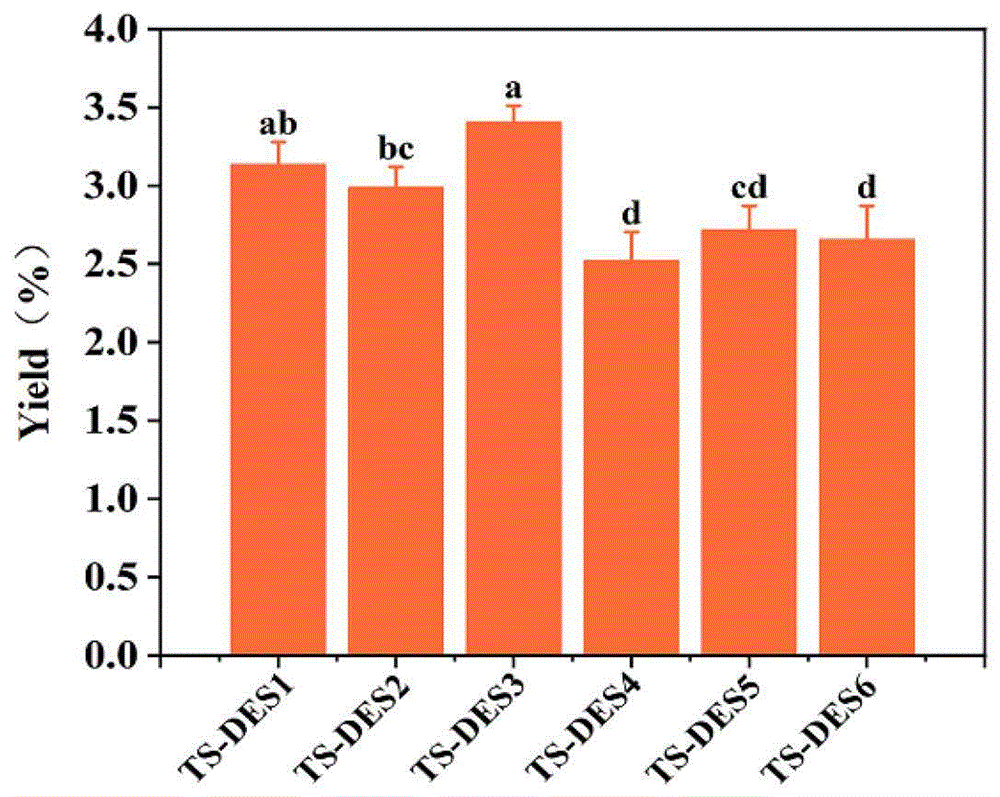
图1不同类型的TS-DES对多糖产量的影响图,不同字母表示差异显著(p<0.05);
图2:三维响应面图,其中A:DES的体积分数和提取时间;B:DES的体积分数和液料比;C:提取时间和液料比;
图3:枸杞多糖的单糖组成液相色谱图,其中A.单糖标准品液相色谱图;B.枸杞多糖LBPs-W单糖液相色谱图;C.枸杞多糖LBPs-DES单糖液相色谱图;
图4:DES辅助提取和常规水提取后的残渣的扫面电镜图,其中A和B:常规水提取后的残渣在放大倍数为500×和2000×的微观结构;C和D:DES辅助提取后的残渣在放大倍数为500×和2000×的微观结构。
图5:回收试验中枸杞多糖的产量和TS-DES的回收率。
具体实施方式
下面结合实施例和附图对本发明进行详细的描述。
实施例1:构建温敏性低共熔溶剂辅助提取枸杞多糖方法
(1)仪器、试剂与材料:
枸杞子干果、单糖标准品(阿拉伯糖、核糖、木糖、葡萄糖、甘露糖、半乳糖、岩藻糖、鼠李糖、半乳糖醛酸、葡萄糖醛酸)、L-薄荷醇、水杨酸苯酯,所有其他化学物质都至少为分析级,高效液相色谱的溶剂为色谱纯度。真空冷冻干燥机、紫外分光光度计、电子分析天平、离心机、高剪切分散乳化、超滤膜元件、蠕动泵、多角度激光光散射仪与尺寸排阻色谱法联用系统。
(2)低共熔溶剂DES的合成
通过加热方法制备六个TS-DES。将氢键供体(HBD)和氢键受体(HBA)混合以形成不同的混合物。将不同的混合物在70℃下搅拌,直到形成无结晶沉积物的均匀透明液体(表1)。
表1:使用的低共熔溶剂DES的配方表。
(3)构建温敏性DES辅助提取枸杞多糖方法
在烧杯中,将160mL水加入到80mL TS-DES中。称取16.0克枸杞子加入溶液中,并在70℃下提取20分钟。然后通过HSDE机器(10000rpm)辅助提取。将粗溶液离心(8000rpm,10min)并储存(10℃,10min)。随后,溶液变成两相。除去水相,并通过布氏漏斗过滤。上清液用Sevage试剂(氯仿:正丁醇=4:1,v/v)脱蛋白。将得到的脱蛋白后的多糖溶液定容至200mL。用截留分子量为3000Da的超滤膜过滤,待截留液的体积不足100mL时,再次加入100mL的纯化水过滤,待截留液的体积为50mL时,停止过滤,将截留液冷冻干燥,得到枸杞多糖LBPs-DES。用LBPs-DES的质量比枸杞粉末质量表示多糖的得率,采用苯酚-硫酸法测定多糖的总糖含量,采用二喹啉甲酸(Bicinchoninic acid,BCA)法测定蛋白质含量,采用硫酸-咔唑法测定糖醛酸含量。
对六种TS-DES进行了分析,以选择最适合枸杞多糖提取的TS-DES。使用六种枸杞多糖的多糖产量如图1所示。多糖的产率结果表明,不同的HBA大致按照L-薄荷醇(TS-DES1-3)>乙醇胺(TS-DES 4-6)的顺序排列,证明HBA比HBD对TS-DES提取性能的影响更为重要。TS-DES3(L-薄荷醇:水杨酸苯酯=1:1)的多糖产量最高,为3.40%,而TS-DES4的产量最低(2.52%)。因此,TS-DES3(L-薄荷醇:水杨酸苯酯的摩尔比为1:1)被选为后续实验的萃取系统。
实施例2:优化温敏性DES辅助提取枸杞多糖方法
采用Design Expert 12软件设计3变量3水平BBD实验,以枸杞多糖提取率为响应值。三个变量的取值范围为:X
每次提取结束后,利用得到的枸杞多糖粉末计算多糖得率。然后使用以下式(1)计算多糖得率(%)。将实验结果拟合到式(2)所描述的二次模型中,并进行方差分析(ANOVA),以确定模型的统计显著性、拟合缺失以及模型中各项的回归系数。
多糖得率(%)=m
m
拟合多元二次回归模型,其中Y为响应值(多糖提取率);β
表2:基于Box-Behnken设计的LBPs-DES的实验值和预测值表
设计及结果见表2。利用Design-Expert软件对数据进行多元非线性回归分析,根据下列式子计算出三个因素与枸杞多糖提取率的二次多元回归方程:
Y=-8.38338+0.190685×X
-0.00015×X
式中,X
表3:响应面模型方差分析
*表示P<0.05(显著性);**表示P<0.01(极显著性);※表示不具有显著性。
因变量和响应值(Y)之间相互作用的可视化解释可以在3D响应面曲线中显示(图2)。陡峭的斜面显示了变量之间影响的显著性,响应面曲线比较陡峭,表明随着各因素值的增加,各因素对枸杞多糖提取率的影响先增加后减少。图1中的A显示出比其它三维图更陡峭的响应面,表明DES体积分数和提取时间之间的相互作用对枸杞多糖得率的影响存在差异。这与表3中的结果一致。
经分析,模拟后的最佳提取条件为:DES体积分数为33.959%,提取时间为31.195min,料液比为19.06mL/g。在此条件下,枸杞多糖的最大理论预测提取率为4.12%。为避免结果与实际值偏差,方便实际操作,调整最佳工艺参数,DES体积分数为34%,提取时间为31min,料液比为19mL/g,进行了实验提取,得到枸杞多糖LBPs-DES。在此条件下,枸杞多糖的提取率为4.35%±0.11(n=3),接近理论预测值,可用于最优提取,表明响应模型充分反映了预期的优化结果。用LBPs-DES的质量比枸杞粉末质量表示多糖的得率,采用苯酚-硫酸法测定多糖的总糖含量,采用二喹啉甲酸(Bicinchoninic acid,BCA)法测定蛋白质含量,采用硫酸-咔唑法测定糖醛酸含量。
实施例3:经典水提取法提取枸杞多糖
将12.0g的干燥枸杞粉末置入229mL的纯化水中,在70℃水浴条件下,开启高速剪切机以10000r·min
表4:温敏性DES辅助提取和水提取枸杞多糖得率及化学组成比较表
由表4可知,温敏性DES辅助提取获得的枸杞多糖,其多糖得率是常规水提取方法得率的2.4倍,同时多糖含量也显著高于常规水提取法;蛋白质含量方面,温敏性DES辅助提取法得到的枸杞多糖含量显著低于水提取方法,有利于多糖的进一步纯化。
实施例4:温敏性DES辅助提取的LBPs-DES和常规水提取法提取的LBPs-W理化性质比较
(1)分子量分布测定
多角度激光光散射仪与尺寸排阻色谱法联用系统(HPSEC-MALLS-RI)测定LBPs-DES和LBPs-W的分子量分布。称取LBPs-DES和LBPs-W样品各5.0mg,定容至1.0mL,配成5.0mg·mL
表5:LBPs-W和LBPs-D的分子量和分子量分布表
多糖的分子量分布受提取介质和方法的影响较大,DES辅助提取的枸杞多糖LBPs-DES和常规水提取的枸杞多糖LBPs-W分子量分布结果见表5,结果可知LBPs-DES的分子量明显高于LBPs-W。说明DES辅助提取法可以从植物中提取更多的大分子多糖。
(2)单糖组成分析
采用高效液相色谱(HPLC)柱前衍生化1-苯基-3-甲基-5-吡唑啉酮(PMP)法测定枸杞多糖LBPs-DES和常规水提取的枸杞多糖LBPs-W的单糖组成,具体实验操作如下。
1)单糖标准溶液制备依次称取单糖对照品D-甘露糖(Man)、L-鼠李糖(Rha)、D-葡萄糖醛酸(GlcA)、D-半乳糖醛酸(GalA)、D-葡萄糖(Glc)、D-半乳糖(Gal)、L-阿拉伯糖(Ara)标准溶液作为储备液。取各单糖标准溶液储备液,精密配置为1.0mg·L
2)多糖的水解依次称取5.0mg枸杞多糖,置于安瓿瓶中,加入5
mL三氟乙酸(TFA),110℃密封避光水解8.0h。将水解后的溶液转移至EP管中,氮吹除去TFA,加入300μL去离子水涡旋混匀,吸取100.0μL置于1.0mL容量瓶中,用去离子水定容至刻度。
3)多糖的PMP衍生化精密量取100μL各单糖标准品混合溶液及多糖水解液,加100μL 0.5mol·L
4)色谱条件Zorbax Eclipse XDB-C18色谱柱(5μm,4.6mm×250mm),柱温30℃,流动相A为82%50mM磷酸盐缓冲液(pH=6.7)和流动相B18%乙腈,流速为1mL·min
由图3可知,DES辅助提取的枸杞多糖LBPs-DES和常规水提取的枸杞多糖LBPs-W均有甘露糖、鼠李糖、半乳糖、葡萄糖、阿拉伯糖、葡萄糖醛酸和半乳糖醛酸7种单糖组成,并且单糖的摩尔比也相近,都是葡萄糖、半乳糖和阿拉伯糖的占比最大。说明DES辅助提取获得的枸杞多糖和常规水提取得到的枸杞多糖的单糖组成基本一致,DES辅助提取能够获得分子量更大的多糖。
(3)扫描电镜分析
取利用DES辅助提取和常规水提取得到的枸杞残渣粉末少许,干燥后通过导电胶将其固定在载样台上,真空喷金,然后置于场发射扫描电子显微镜下,在20kV的高真空加速电压和放大倍数为500×及2000×下依次观察样品表面形态。
DES还可以与植物细胞壁相互作用,破坏或溶解细胞壁。如图4所示,传统水提取的枸杞残渣细胞壁没有被完全打开,说明水提取法提取多糖不充分,多糖大部分是细胞质多糖,结果与其多糖得率和含量低的结果一致;而在最佳提取条件下,DES提取的枸杞残渣细胞壁被完全打开,具有更典型的导管样和更大的孔隙,促进了内容物的溶出,表明DES提取程度更高、更彻底。
实施例5:温敏性DES辅助提取大枣多糖与经典水提取法提取大枣多糖
将大枣去核,冷冻粉碎后置于干燥器保存待用。将79mL温敏性DES加入150mL的纯化水中,再加入12.0g的干燥大枣粉末,在70℃水浴条件下,开启高速剪切机以10000r·min
将12.0g的干燥大枣粉末置入229mL的纯化水中,在70℃水浴条件下,开启高速剪切机以10000r·min
实施例6:温敏性DES辅助提取黄芪多糖与经典水提取法提取黄芪多糖
将79mL温敏性DES加入150mL的纯化水中,再加入12.0g的干燥黄芪粉末,在70℃水浴条件下,开启高速剪切机以10000r·min
将12.0g的干燥黄芪粉末置入229mL的纯化水中,在70℃水浴条件下,开启高速剪切机以10000r·min
表6:温敏性DES和水从大枣和黄芪中提取大枣多糖和黄芩多糖的比较数据表
由表6可以看出,温敏性DES作为添加剂辅助提取得到的大枣多糖和黄芪多糖,其多糖得率和多糖含量都显著高于相同条件下水提取得到的大枣多糖和黄芪多糖,温敏性DES辅助提取得到的大枣多糖和黄芪多糖,其糖醛酸含量略高于水提取的大枣多糖和黄芪多糖,而蛋白质含量,温敏性DES辅助提取得到的多糖均低于水提取的多糖,说明温敏性DES辅助提取植物多糖的方法,具有更高的提取率和明显的除杂作用,是一种具有潜力的提取植物多糖的方法。
实施例7:温敏性DES的回收与再利用
萃取结束后,对TS-DES的回收和再利用能力进行了研究。在最高临界温度(UCST)条件下,TS-DES相从萃取溶剂中分离出来。然后将其回收并用于进一步提取枸杞多糖。同样的提取过程重复了5次。
TS-DES可以从提取液中回收,并重新用于枸杞提取。用TS-DES萃取后,在UCST(T=18℃)下冷冻溶剂系统。TS-DES在溶剂系统中的分散度降低,导致由L-薄荷醇和水杨酸苯酯形成的TS-DES分离出来。TS-DES用于循环枸杞多糖萃取。TS-DES循环0-5次,分别表示为TS-DES和TS-DES-1C~TS-DES-5C。如图5所示,枸杞多糖的产量和TS-DES的回收率随着循环时间的增加而降低。第一至第五次循环提取的枸杞多糖产量分别为4.11%和3.68%;第一至第五次循环TS-DES的回收率分别为86.3%和77.7%。回收研究表明,这种TS-DES具有良好的回收和再利用特性。
- 一种主治骨刺的敷膏及其制备方法
- 一种用于急慢性胃肠炎腹痛腹泻的贴敷外用中药组合物、敷膏及制备方法和应用
