抗CGRP抗体及用途
文献发布时间:2024-04-18 20:00:50
技术领域
本发明提供了与人类降钙素基因相关肽(Calcitonin Gene Related Peptide,下文为“CGRP”)特异性结合的抗体或其抗原结合片段和包含其的组合物。还提供了编码本发明抗体或其抗原结合片段的核酸分子,用于表达本发明抗体或其抗原结合片段的载体和宿主细胞,以及本发明抗体或其抗原结合片段的治疗和诊断方法和用途。
背景技术
降钙素基因相关肽是一种神经肽,它由37个氨基酸残基组成,且广泛分布于外周和中枢神经系统,在心血管、疼痛、神经系统等功能调节中具有重要的作用。CGRP属于降钙素基因相关肽家族,这个家族中包括两种CGRP,肾上腺髓质素,胰淀粉样多肽,降钙素和降钙素受体刺激肽。两种形式的CGRP,即CGRP-α和CGRP-β形式,存在于人类中并且具有类似的活性。两种形式的CGRP相差3个氨基酸,并显示不同的分布。
CGRP参与机体的许多生理功能的调节。CGRP具有强大的舒张血管的作用,是已知的最强大的外周微血管扩张剂之一。CGRP通过激活细胞膜上的CGRP受体参与调节各种生理活动,特别是CGRP在血管舒张以及偏头痛中发挥重要的作用。许多研究表明,CGRP参与中枢神经系统学习和记忆过程。另一方面,有报道表面集体在发生糖尿病时,CGRP参与相关代谢的调节。最近研究表明,CGRP对几种心血管系统的疾病具有保护作用。
偏头痛是一种常见的三叉神经血管性头痛,严重影响患者日常生活功能。曲谱坦作为偏头痛发作期特异性止痛药,但由于其血管收缩作用限制了在心血管疾病患者中的运用,并且部分患者对曲谱坦存在抵抗,亟需开辟新的有效药物。通过临床研究发现,CGRP在偏头痛急性发作时起着重要作用,理论上可以通过阻止CGRP的合成和释放,降低CGRP释放后的浓度,阻止CGRP激活其受体几方面来减少CGRP的活性。
虽然目前已经存在用于治疗偏头痛和用于治疗炎症疼痛的CGRP抗体,且CGRP单克隆抗体具有分子量大,半衰期长,难以通过血脑屏障,不产生毒性代谢物,选择性强且耐受性好的优势。但是仍需要开发更多的新型抗CGRP抗体。
发明内容
本申请的目的在于提供一种能够与CGRP特异性结合的抗体(即抗CGRP抗体)或其抗原结合片段,编码本申请的抗体或其抗原结合片段的多核苷酸分子,用于表达本申请的抗体或其抗原结合片段的表达载体和宿主细胞,以及本申请的抗体或其抗原结合片段的用途。
在一个方面,本发明提供了一种抗CGRP抗体或其抗原结合片段,其包含如下定义的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3:
HCDR1:DX
HCDR2:X
HCDR3:EGLGGY(SEQ ID NO:39)或ELDSGFDY(SEQ ID NO:45);
LCDR1:X
DYDGYT(SEQ ID NO:119)或DYGGYS(SEQ ID NO:120),X
LCDR2:
LCDR3:X
在一些实施方式中,所述的抗体或其抗原结合片段包含:氨基酸序列如SEQ IDNO:2,11,19,26,31,37或43所示的HCDR1;氨基酸序列如SEQ ID NO:3,110,12,111,20,112,27,32,38或44所示的HCDR2;氨基酸序列如SEQ ID NO:4,13,21,28,33,39或45所示的HCDR3;氨基酸序列如SEQ ID NO:51,59,67,73,113,81或86所示的LCDR1;氨基酸序列如SEQID NO:52,60,68,74,82或87所示的LCDR2;和氨基酸序列如SEQ ID NO:53,61,69,75,83或88所示的LCDR3。
在一个方面,本发明提供了一种抗CGRP抗体或其抗原结合片段,其包含重链可变区和/或轻链可变区:
所述重链可变区包含:
(I)氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ ID NO:4所示的HCDR1、HCDR2和HCDR3;或与SEQ ID NO:2、SEQ ID NO:3和SEQ ID NO:4所示氨基酸序列分别具有1、2或3个氨基酸差异的HCDR1、HCDR2和HCDR3;或
(II)氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:110和SEQ ID NO:4所示的HCDR1、HCDR2和HCDR3;或与SEQ ID NO:2、SEQ ID NO:110和SEQ ID NO:4所示氨基酸序列分别具有1、2或3个氨基酸差异的HCDR1、HCDR2和HCDR3;或
(III)氨基酸序列分别如SEQ ID NO:11、SEQ ID NO:12和SEQ ID NO:13所示的HCDR1、HCDR2和HCDR3;或与SEQ ID NO:11、SEQ ID NO:12和SEQ ID NO:13所示氨基酸序列分别具有1、2或3个氨基酸差异的HCDR1、HCDR2和HCDR3;或
(IV)氨基酸序列分别如SEQ ID NO:11、SEQ ID NO:111和SEQ ID NO:13所示的HCDR1、HCDR2和HCDR3;或与SEQ ID NO:11、SEQ ID NO:111和SEQ ID NO:13所示氨基酸序列分别具有1、2或3个氨基酸差异的HCDR1、HCDR2和HCDR3;
(V)氨基酸序列分别如SEQ ID NO:19、SEQ ID NO:20和SEQ ID NO:21所示的HCDR1、HCDR2和HCDR3;或与SEQ ID NO:19、SEQ ID NO:20和SEQ ID NO:21所示氨基酸序列分别具有1、2或3个氨基酸差异的HCDR1、HCDR2和HCDR3;或
(VI)氨基酸序列分别如SEQ ID NO:19、SEQ ID NO:112和SEQ ID NO:21所示的HCDR1、HCDR2和HCDR3;或与SEQ ID NO:19、SEQ ID NO:112和SEQ ID NO:21所示氨基酸序列分别具有1、2或3个氨基酸差异的HCDR1、HCDR2和HCDR3;
或
(VII)氨基酸序列分别如SEQ ID NO:26、SEQ ID NO:27和SEQ ID NO:28所示的HCDR1、HCDR2和HCDR3;或与SEQ ID NO:26、SEQ ID NO:27和SEQ ID NO:28所示氨基酸序列分别具有1、2或3个氨基酸差异的HCDR1、HCDR2和HCDR3;或
(VIII)氨基酸序列分别如SEQ ID NO:31、SEQ ID NO:32和SEQ ID NO:33所示的HCDR1、HCDR2和HCDR3;或与SEQ ID NO:31、SEQ ID NO:32和SEQ ID NO:33所示氨基酸序列分别具有1、2或3个氨基酸差异的HCDR1、HCDR2和HCDR3;或
(IX)氨基酸序列分别如SEQ ID NO:37、SEQ ID NO:38和SEQ ID NO:39所示的HCDR1、HCDR2和HCDR3;或与SEQ ID NO:37、SEQ ID NO:38和SEQ ID NO:39所示氨基酸序列分别具有1、2或3个氨基酸差异的HCDR1、HCDR2和HCDR3;或
(X)氨基酸序列分别如SEQ ID NO:43、SEQ ID NO:44和SEQ ID NO:45所示的HCDR1、HCDR2和HCDR3;或与SEQ ID NO:43、SEQ ID NO:44和SEQ ID NO:45所示氨基酸序列分别具有1、2或3个氨基酸差异的HCDR1、HCDR2和HCDR3;
所述轻链可变区包含:
(Ⅰ)氨基酸序列分别如SEQ ID NO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或与SEQ ID NO:51、SEQ ID NO:52和SEQ ID NO:53所示氨基酸序列分别具有1、2或3个氨基酸差异的LCDR1、LCDR2和LCDR3;或
(Ⅱ)氨基酸序列分别如SEQ ID NO:59、SEQ ID NO:60和SEQ ID NO:61所示的LCDR1、LCDR2和LCDR3;或与SEQ ID NO:59、SEQ ID NO:60和SEQ ID NO:61所示氨基酸序列分别具有1、2或3个氨基酸差异的LCDR1、LCDR2和LCDR3;或
(Ⅲ)氨基酸序列分别如SEQ ID NO:67、SEQ ID NO:68和SEQ ID NO:69所示的LCDR1、LCDR2和LCDR3;或与SEQ ID NO:67、SEQ ID NO:68和SEQ ID NO:69所示氨基酸序列分别具有1、2或3个氨基酸差异的LCDR1、LCDR2和LCDR3;或
(Ⅳ)氨基酸序列分别如SEQ ID NO:73、SEQ ID NO:74和SEQ ID NO:75所示的LCDR1、LCDR2和LCDR3;或与SEQ ID NO:73、SEQ ID NO:74和SEQ ID NO:75所示氨基酸序列分别具有1、2或3个氨基酸差异的LCDR1、LCDR2和LCDR3;或
(V)氨基酸序列分别如SEQ ID NO:113、SEQ ID NO:74和SEQ ID NO:75所示的LCDR1、LCDR2和LCDR3;或与SEQ ID NO:113、SEQ ID NO:74和SEQ ID NO:75所示氨基酸序列分别具有1、2或3个氨基酸差异的LCDR1、LCDR2和LCDR3;或
(ⅤI)氨基酸序列分别如SEQ ID NO:81、SEQ ID NO:82和SEQ ID NO:83所示的LCDR1、LCDR2和LCDR3;或与SEQ ID NO:81、SEQ ID NO:82和SEQ ID NO:83所示氨基酸序列分别具有1、2或3个氨基酸差异的LCDR1、LCDR2和LCDR3;或
(ⅥI)氨基酸序列分别如SEQ ID NO:86、SEQ ID NO:87和SEQ ID NO:88所示的LCDR1、LCDR2和LCDR3;或与SEQ ID NO:86、SEQ ID NO:87和SEQ ID NO:88所示氨基酸序列分别具有1、2或3个氨基酸差异的LCDR1、LCDR2和LCDR3。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含:
(Ⅰ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:31、SEQ ID NO:32和SEQ IDNO:33所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(Ⅱ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ IDNO:4所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(Ⅲ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ IDNO:4所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:59、SEQ ID NO:60和SEQ ID NO:61所示的LCDR1、LCDR2和LCDR3;或
(Ⅳ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ IDNO:4所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:67、SEQ ID NO:68和SEQ ID NO:69所示的LCDR1、LCDR2和LCDR3;或
(Ⅴ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ IDNO:4所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:81、SEQ ID NO:82和SEQ ID NO:83所示的LCDR1、LCDR2和LCDR3;或
(Ⅵ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ IDNO:4所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:86、SEQ ID NO:87和SEQ ID NO:88所示的LCDR1、LCDR2和LCDR3;或
(Ⅶ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:26、SEQ ID NO:27和SEQID NO:28所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:59、SEQ ID NO:60和SEQ ID NO:61所示的LCDR1、LCDR2和LCDR3;或
(Ⅷ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:19、SEQ ID NO:20和SEQID NO:21所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(Ⅸ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:19、SEQ ID NO:20和SEQID NO:21所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:67、SEQ ID NO:68和SEQ ID NO:69所示的LCDR1、LCDR2和LCDR3;或
(Ⅹ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:43、SEQ ID NO:44和SEQID NO:45所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:73、SEQ ID NO:74和SEQ ID NO:75所示的LCDR1、LCDR2和LCDR3;或
(Ⅺ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:11、SEQ ID NO:12和SEQID NO:13所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(Ⅻ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:11、SEQ ID NO:12和SEQID NO:13所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:59、SEQ ID NO:60和SEQ ID NO:61所示的LCDR1、LCDR2和LCDR3;或
(XIII)重链可变区,其包含氨基酸序列分别如SEQ ID NO:37、SEQ ID NO:38和SEQID NO:39所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(XIV)重链可变区,其包含氨基酸序列分别如SEQ ID NO:19、SEQ ID NO:112和SEQID NO:21所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3。
在一些实施方式中,本发明所述抗体为鼠源抗体或嵌合抗体。在一些实施方式中,本发明所述抗体进一步包含源自鼠源抗体的重链框架区和/或轻链框架区。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含重链可变区和轻链可变区:
(Ⅰ)所述重链可变区包含如SEQ ID NO:30所示的氨基酸序列,或包含与SEQ IDNO:30所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:50所示的氨基酸序列,或包含与SEQ ID NO:50所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅱ)所述重链可变区包含如SEQ ID NO:1所示的氨基酸序列,或包含与SEQ IDNO:1所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:50所示的氨基酸序列,或包含与SEQ ID NO:50所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅲ)所述重链可变区包含如SEQ ID NO:1所示的氨基酸序列,或包含与SEQ IDNO:1所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:58所示的氨基酸序列,或包含与SEQ ID NO:58所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅳ)所述重链可变区包含如SEQ ID NO:1所示的氨基酸序列,或包含与SEQ IDNO:1所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:66所示的氨基酸序列,或包含与SEQ ID NO:66所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅴ)所述重链可变区包含如SEQ ID NO:1所示的氨基酸序列,或包含与SEQ IDNO:1所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:80所示的氨基酸序列,或包含与SEQ ID NO:80所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅵ)所述重链可变区包含如SEQ ID NO:1所示的氨基酸序列,或包含与SEQ IDNO:1所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:85所示的氨基酸序列,或包含与SEQ ID NO:85所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅶ)所述重链可变区包含如SEQ ID NO:25所示的氨基酸序列,或包含与SEQ IDNO:25所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:58所示的氨基酸序列,或包含与SEQ ID NO:58所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅷ)所述重链可变区包含如SEQ ID NO:18所示的氨基酸序列,或包含与SEQ IDNO:18所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:50所示的氨基酸序列,或包含与SEQ ID NO:50所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅸ)所述重链可变区包含如SEQ ID NO:18所示的氨基酸序列,或包含与SEQ IDNO:18所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:66所示的氨基酸序列,或包含与SEQ ID NO:66所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅹ)所述重链可变区包含如SEQ ID NO:42所示的氨基酸序列,或包含与SEQ IDNO:42所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:72所示的氨基酸序列,或包含与SEQ ID NO:72所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅺ)所述重链可变区包含如SEQ ID NO:10所示的氨基酸序列,或包含与SEQ IDNO:10所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:50所示的氨基酸序列,或包含与SEQ ID NO:50所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅻ)所述重链可变区包含如SEQ ID NO:10所示的氨基酸序列,或包含与SEQ IDNO:10所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:58所示的氨基酸序列,或包含与SEQ ID NO:58所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(XIII)所述重链可变区包含如SEQ ID NO:36所示的氨基酸序列,或包含与SEQ IDNO:36所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:50所示的氨基酸序列,或包含与SEQ ID NO:50所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列。
在一些实施方式中,本发明所述抗体为人源化抗体。在一些实施方式中,本发明所述抗体包含源自人免疫球蛋白的重链框架区(例如,人重链胚系基因所编码的氨基酸序列中所包含的重链框架区),和/或轻链框架区(例如,人轻链胚系基因所编码的氨基酸序列中所包含的轻链框架区)。所述重链框架区和/或轻链框架区任选地包含一个或多个(例如,1个、2个、3个、4个、5个、6个、7个、8个、9个或10个)从人源残基至鼠源残基的回复突变。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含:
(Ⅰ)重链可变区,其包含如SEQ ID NO:5、6、7、8、9、14、15、16、17、22、23、24、29、34、35、40、41、46、47、48或49中任一项所示的氨基酸序列;和
轻链可变区,其包含如SEQ ID NO:54、55、56、57、62、63、64、65、70、71、76、77、78、79、84、89或90中任一项所示的氨基酸序列;或
(Ⅱ)重链可变区,其包含如SEQ ID NO:5、6、7、8、9、14、15、16、17、22、23、24、29、34、35、40、41、46、47、48或49中任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和
轻链可变区,其包含如SEQ ID NO:54、55、56、57、62、63、64、65、70、71、76、77、78、79、84、89或90中任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅲ)氨基酸序列如SEQ ID NO:46所示的重链可变区和氨基酸序列如SEQ ID NO:78所示的轻链可变区;或
氨基酸序列如SEQ ID NO:47所示的重链可变区和氨基酸序列如SEQ ID NO:78所示的轻链可变区;或
氨基酸序列如SEQ ID NO:48所示的重链可变区和氨基酸序列如SEQ ID NO:77所示的轻链可变区;或
氨基酸序列如SEQ ID NO:8所示的重链可变区和氨基酸序列如SEQ ID NO:63所示的轻链可变区;或
氨基酸序列如SEQ ID NO:24所示的重链可变区和氨基酸序列如SEQ ID NO:54所示的轻链可变区;或
氨基酸序列如SEQ ID NO:8所示的重链可变区和氨基酸序列如SEQ ID NO:54所示的轻链可变区。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含:
(Ⅰ)重链,其包含如SEQ ID NO:92、94或96中任一项所示的氨基酸序列,和
轻链,其包含如SEQ ID NO:91、93或95中任一项所示的氨基酸序列;或
(Ⅱ)重链,其包含如SEQ ID NO:92、94或96中任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列,和
轻链,其包含如SEQ ID NO:91、93或95中任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(III)氨基酸序列如SEQ ID NO:92所示的重链和氨基酸序列如SEQ ID NO:91所示的轻链,或
氨基酸序列如SEQ ID NO:94所示的重链和氨基酸序列如SEQ ID NO:93所示的轻链,或
氨基酸序列如SEQ ID NO:96所示的重链和氨基酸序列如SEQ ID NO:95所示的轻链。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其为鼠源抗体、嵌合抗体、人源化抗体、或全人抗体,或其抗原结合片段。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其中所述抗原结合片段为Fab、Fab'、F(ab')2、Fv、scFv或sdAb。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其中抗体或其抗原结合片段是任何IgG亚型,如IgG1、IgG2、IgG3或IgG4,优选为IgG1亚型或IgG4亚型。
在另一个方面,本发明提供了一种分离的抗CGRP抗体或其抗原结合片段,其具有以下特性中的一种或多种:
(1)所结合的人CGRP蛋白的表位与本文所述的抗CGRP抗体或其抗原结合片段结合相同、完全重叠或部分重叠;
(2)与本文所述的抗CGRP抗体或其抗原结合片段竞争结合人CGRP蛋白的表位。
在一些实施方式中,所述表位包含人CGRP蛋白的第8-19位氨基酸。在一些实施方式中,所述CGRP包含α-CGRP和/或β-CGRP。在一些实施方式中,所述CGRP具有SEQ ID NO:97所示的氨基酸序列。
在一些实施方式中,本发明所述的抗体是单克隆抗体。
本发明还提供了一种多特异性抗体,包含本文所述抗体或其抗原结合片段的轻链可变区和重链可变区。
本发明还提供了一种单链抗体,包含本文所述抗体或其抗原结合片段的轻链可变区和重链可变区。
在又一个方面,本发明提供了多核苷酸分子,其编码本文所述的抗CGRP抗体或其抗原结合片段。
在又一个方面,本发明提供了表达载体,其包含本文所述的多核苷酸分子,优选地,所述载体为真核表达载体。
在又一个方面,本发明提供了宿主细胞,其包含本文所述的多核苷酸分子或本文所述的表达载体,优选地,所述宿主细胞是真核细胞,更优选哺乳动物细胞。
在又一个方面,本发明提供了制备本文所述的抗CGRP抗体或其抗原结合片段的方法,所述方法包括在适合于所述抗体或其抗原结合片段表达的条件下在本文所述的宿主细胞中表达所述抗体或其抗原结合片段,并从所述宿主细胞回收所表达的抗体或其抗原结合片段。
在又一个方面,本发明提供了药物组合物,其包含本文所述的抗CGRP抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、本文所述的多特异性抗体、或本文所述的单链抗体,和药学上可接受的载体或赋形剂。
在又一个方面,本发明提供了一种药物组合,其包含本文所述的抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、本文所述的多特异性抗体、本文所述的单链抗体、或本文所述的药物组合物,以及一种或多种另外的治疗剂。
在又一个方面,本发明提供了本文所述的抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、本文所述的多特异性抗体、本文所述的单链抗体、本文所述的药物组合物或本文所述的药物组合在制备用于治疗和/或预防CGRP介导的疾病或病症的药物中的用途。优选所述疾病或病症为具有CGRP相关疼痛的病状;更优选地,所述疼痛选自有先兆的偏头痛、无先兆的偏头痛、高频发作性偏头痛、月经性偏头痛、偏瘫性偏头痛、丛集性头痛、偏头痛性神经痛、慢性头痛、紧张性头痛、一般性头痛、潮热、慢性阵发性半侧颅痛、由于头中的潜在结构问题而致的继发性头痛、由于颈中的潜在结构问题而致的继发性头痛、脑神经痛、窦性头痛、过敏症诱发的头痛、三叉神经痛、纤维肌痛、坐骨神经痛。
在又一个方面,本发明提供了本文所述的抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、本文所述的多特异性抗体、本文所述的单链抗体、本文所述的药物组合物或本文所述的药物组合用于治疗和/或预防CGRP介导的疾病或病症。优选所述疾病或病症为具有CGRP相关疼痛的病状;更优选地,所述疼痛选自有先兆的偏头痛、无先兆的偏头痛、高频发作性偏头痛、月经性偏头痛、偏瘫性偏头痛、丛集性头痛、偏头痛性神经痛、慢性头痛、紧张性头痛、一般性头痛、潮热、慢性阵发性半侧颅痛、由于头中的潜在结构问题而致的继发性头痛、由于颈中的潜在结构问题而致的继发性头痛、脑神经痛、窦性头痛、过敏症诱发的头痛、三叉神经痛、纤维肌痛、坐骨神经痛。
在又一个方面,本发明提供了一种治疗和/或预防CGRP介导的疾病或病症的方法,其包括向有需要的受试者施用治疗或预防有效量的本文所述的抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、本文所述的多特异性抗体、本文所述的单链抗体、本文所述的药物组合物或本文所述的药物组合。优选所述疾病或病症为具有CGRP相关疼痛的病状;更优选地,所述疼痛选自有先兆的偏头痛、无先兆的偏头痛、高频发作性偏头痛、月经性偏头痛、偏瘫性偏头痛、丛集性头痛、偏头痛性神经痛、慢性头痛、紧张性头痛、一般性头痛、潮热、慢性阵发性半侧颅痛、由于头中的潜在结构问题而致的继发性头痛、由于颈中的潜在结构问题而致的继发性头痛、脑神经痛、窦性头痛、过敏症诱发的头痛、三叉神经痛、纤维肌痛、坐骨神经痛。
在又一个方面,本发明提供了一种试剂盒,其包括本文所述的抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、本文所述的多特异性抗体、本文所述的单链抗体、本文所述的药物组合物或本文所述的药物组合,优选其进一步包括给药装置。
在又一个方面,本发明提供了一种使用本文所述的抗体或其抗原结合片段或含有所述抗体或其抗原结合片段的检测组合物检测CGRP在样品中的存在的方法。在一些实施方式中,所述方法包括使本文所述的抗体或其抗原结合片段或者含有所述抗体或其抗原结合片段的检测组合物与所述样品接触的步骤。
附图说明
图1至图3荧光素酶法检测嵌合抗体阻断CGRP与CALCRL-RAMP1结合活性。
图4至图6荧光素酶法检测人源化抗体阻断CGRP与CALCRL-RAMP1结合活性。
图7-1至图7-4抗CGRP嵌合抗体对大鼠辣椒素血管扩张的抑制。
图8-1至图8-4抗CGRP人源化抗体对大鼠辣椒素血管扩张的抑制。
图9抗体对平均动脉压影响实验。
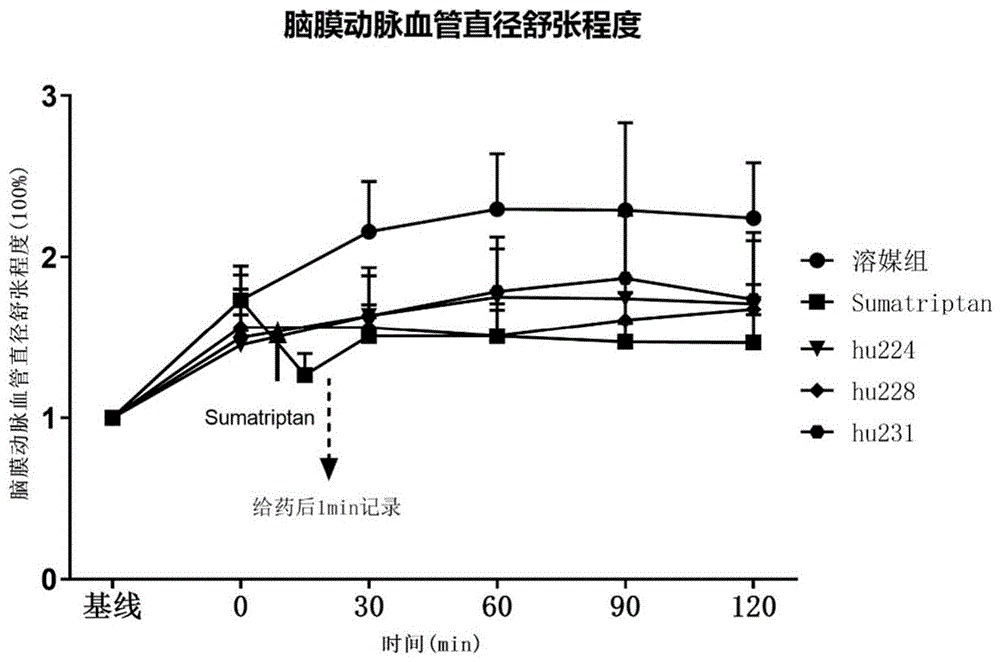
图10抗体对脑膜中动脉(MMA)血管直径扩张影响实验。
图11 C245 Fab和人CGRP多肽片段结合的动力学特征参数检测结果。
图12 hu224 Fab和人CGRP多肽片段结合的动力学特征参数检测结果。
图13抗体与抗原人α-CGRP在不同pH条件下的结合解离曲线。
发明详述
定义
除非另有说明,本发明的实施将采用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术,这些都在本领域的技术范围内。
为了可以更容易地理解本发明,某些科技术语具体定义如下。除非本文其它部分另有明确定义,否则本文所用的科技术语都具有本发明所属领域普通技术人员通常理解的含义。关于本领域的定义及术语,专业人员具体可参考Current Protocols in MolecularBiology(Ausubel)。氨基酸残基的缩写是本领域中所用的指代20个常用L-氨基酸之一的标准3字母和/或1字母代码。本文(包括权利要求书)所用单数形式包括其相应的复数形式,除非文中另有明确规定。
术语“约”在与数字数值联合使用时意为涵盖具有比指定数字数值小5%的下限和比指定数字数值大5%的上限的范围内的数字数值,包括但不限于±5%、±2%、±1%和±0.1%,因为这些变化适于进行所公开的方法。
术语“和/或”应理解为意指可选项中的任一项或可选项中的任意两项或更多项的组合。
如本文所用,术语“或”应被理解为与如上定义的“和/或”具有相同的含义。例如,当分离列表中的项目时,“或”或“和/或”应被解释为包容性的,即,包括数量或元素列表中的至少一个,但也包括多于一个,以及任选地,额外的未列出的项目。只有明确指出相反的术语下,例如“只有一个”或“的确一个”或者在权利要求中使用“由...组成”时,将指的是仅列出的一个数字或列表的一个元素。
除非明确指出相反的情况,否则如本文所用,词“一”和“一个”应理解为“至少一个”。
本文使用的术语“降钙素基因相关肽”和“CGRP”是指维持至少部分CGRP活性的任何形式的降钙素基因相关肽及其变体。例如,CGRP可以是α-CGRP或β-CGRP。本文使用CGRP包括所有哺乳动物种类的天然序列CGRP,例如人、犬、猫、马和牛。
术语“百分比(%)氨基酸序列同一性”或简称“同一性”定义为在将氨基酸序列进行比对(并在必要时导入空位)以获取最大百分比序列同一性,且不将任何保守取代视为序列同一性的部分之后,候选氨基酸序列中的氨基酸残基与参比氨基酸序列中的相同氨基酸残基的百分比。可使用本领域各种方法进行序列比对以便测定百分比氨基酸序列同一性,例如,使用公众可得到的计算机软件如BLAST、BLAST-2、ALIGN或MEGALIGN(DNASTAR)软件。本领域技术人员可以决定测量比对的适宜参数,包括对所比较的序列全长获得最大比对所需的任何算法。
术语“活性”或“生物活性”,或术语“生物性质”或“生物特征”此处可互换使用,包括但不限于表位/抗原亲和力和特异性、在体内或体外中和或拮抗CGRP活性的能力、IC
术语“抗体”是指具有所需生物活性的任何形式的抗体。因此,其以最广义使用,具体包括但不限于单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如双特异性抗体)、人源化抗体、全人抗体、嵌合抗体和骆驼源化单结构域抗体。
术语“分离的抗体”是指结合化合物的纯化状态,且在这种情况下意指该分子基本不含其它生物分子,例如核酸、蛋白质、脂质、糖或其它物质例如细胞碎片和生长培养基。术语“分离(的)”并非意指完全不存在这类物质或不存在水、缓冲液或盐,除非它们以明显干扰本文所述结合化合物的实验或治疗应用的量存在。
术语“单克隆抗体”是指获自基本均质抗体群的抗体,即组成该群的各个抗体除可少量存在的可能天然存在的突变之外是相同的。单克隆抗体是高度特异性的,针对单一抗原表位。相比之下,常规(多克隆)抗体制备物通常包括大量针对不同表位(或对不同表位有特异性)的抗体。修饰语“单克隆”表明获自基本均质抗体群的抗体的特征,且不得解释为需要通过任何特定方法产生抗体。
术语“全长抗体”,是指在天然存在时包含至少四条肽链的免疫球蛋白分子:两条重(H)链和两条轻(L)链通过二硫键互相连接。每一条重链由重链可变区(在本文中缩写为VH)和重链恒定区(在本文中缩写为CH)组成。重链恒定区由3个结构域CH1、CH2和CH3组成。每一条轻链由轻链可变区(在本文中缩写为VL)和轻链恒定区组成。轻链恒定区由一个结构域CL组成。VH和VL区可被进一步细分为具有高可变性的互补决定区(CDR)和其间隔以更保守的称为框架区(FR)的区域。每一个VH或VL区由按下列顺序:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4从氨基末端至羧基末端排列的3个CDR和4个FR组成。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可介导免疫球蛋白对宿主组织或因子(包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(Clq))的结合。
术语抗体(“亲代抗体”)的“抗原结合片段”包括抗体的片段或衍生物,通常包括亲代抗体的抗原结合区或可变区(例如一个或多个CDR)的至少一个片段,其保持亲代抗体的至少一些结合特异性。抗体结合片段的实例包括但不限于Fab,Fab',F(ab')
术语“单链Fv”或“scFv”抗体是指包含抗体的VH和VL结构域的抗体片段,其中这些结构域存在于单条多肽链中。Fv多肽一般还包含VH和VL结构域之间的多肽接头,其使scFv能够形成用于抗原结合的所需结构。
术语“结构域抗体”是只含有重链可变区或轻链可变区的免疫功能性免疫球蛋白片段。在某些情况下,两个或更多个VH区与肽接头共价连接形成二价结构域抗体。二价结构域抗体的2个VH区可靶向相同或不同的抗原。
术语“二价抗体”包含2个抗原结合部位。在某些情况下,2个结合部位具有相同的抗原特异性。然而,二价抗体可以是双特异性的。
术语“双抗体”是指具有两个抗原结合部位的小抗体片段,所述片段包含在同一多肽链(VH-VL或VL-VH)中与轻链可变结构域(VL)连接的重链可变结构域(VH)。通过使用短得不允许在同一链的两个结构域之间配对的接头,迫使该结构域与另一链的互补结构域配对并产生两个抗原结合部位。
术语“鼠源抗体”或“杂交瘤抗体”在本公开中为根据本领域知识和技能制备的抗人CGRP的单克隆抗体。制备时用CGRP抗原注射试验对象,然后分离表达具有所需序列或功能特性的抗体的杂交瘤。
术语“嵌合抗体”是具有第一抗体的可变结构域和第二抗体的恒定结构域的抗体,其中第一抗体和第二抗体来自不同物种。通常,可变结构域获自啮齿动物等的抗体(“亲代抗体”),而恒定结构域序列获自人抗体,使得与亲代啮齿动物抗体相比,所得嵌合抗体在人受试者中诱导不良免疫应答的可能性较低。
术语“人源化抗体”是指含有来自人和非人(例如小鼠、大鼠)抗体的序列的抗体形式。一般而言,人源化抗体包含基本所有的至少一个、通常两个可变结构域,其中所有或基本所有的超变环相当于非人免疫球蛋白的超变环,而所有或基本所有的构架(FR)区是人免疫球蛋白序列的构架区。人源化抗体任选可包含至少一部分的人免疫球蛋白恒定区(Fc)。
术语“全人抗体”是指只包含人免疫球蛋白蛋白质序列的抗体。如在小鼠中、在小鼠细胞中或在来源于小鼠细胞的杂交瘤中产生,则全人抗体可含有鼠糖链。同样,“小鼠抗体”是指仅包含小鼠免疫球蛋白序列的抗体。或者,如果在大鼠中、在大鼠细胞中或在来源于大鼠细胞的杂交瘤中产生,则全人抗体可含有大鼠糖链。同样,“大鼠抗体”是指仅包含大鼠免疫球蛋白序列的抗体。
“同种型”抗体是指由重链恒定区基因提供的抗体种类(例如,IgM、IgE、IgG诸如IgGl、IgG2或IgG4)。同种型还包括这些种类之一的修饰形式,其中修饰已被产生来改变Fc功能,例如以增强或减弱效应子功能或对Fc受体的结合。
本文术语“Fc区”用于定义包含至少一部分恒定区的免疫球蛋白重链的C端区域。该术语包括天然序列Fc区和变异Fc区。在一些实施方案中,人IgG重链Fc区从Cys226或Pro230延伸至重链的羧基末端。但是,Fc区的C端赖氨酸(Lys447)可能存在或不存在(此段中的编号是根据EU编号系统,也称为EU索引,如Rabat等人,Sequences of Proteins ofImmunological Interest,5th Ed.Public Health Service,National Institutes ofHealth,Bethesda,MD,1991)。
术语“表位”指能够与抗体特异性结合的蛋白质决定簇。表位通常由各种化学活性表面分子诸如氨基酸或糖侧链组成,并且通常具有特定三维结构特征以及特定电荷特征。构象性表位和非构象性表位的区别在于在变性溶剂存在下,与前者而非与后者的结合丧失。
本文中所描述的术语“交叉反应”指的是对人类、猴、和/或鼠源(小鼠或大鼠)相同靶分子的抗原片段的结合。因此,“交叉反应”应被理解为与在不同物种中表达的相同分子X的种属间反应。识别人CGRP、猴、和/或鼠CGRP(小鼠或大鼠)的单克隆抗体的交叉反应特异性可通过FACS分析确定。
“亲和力”或“结合亲和力”指反映结合对子的成员之间相互作用的固有结合亲和力。分子X对其配偶物Y的亲和力可以通常由平衡解离常数(K
术语“不结合”蛋白或细胞是指,不与蛋白或细胞结合,或者不以高亲和力与其结合,即结合蛋白或细胞的K
术语“高亲和性”对于IgG抗体而言,是指对于抗原的K
术语“核酸”、“多核苷酸”、“核酸分子”以及“多核苷酸分子”是指脱氧核糖核酸(DNA)或核糖核酸(RNA)及其呈单链或双链形式的聚合物。除非明确地限制,否则术语包括具有与参照核酸相似的结合性质并且以与天然存在的核苷酸相似的方式被代谢的含有已知的天然核苷酸的类似物的核酸(参见,属于Kariko等人的美国专利No.8,278,036,其公开了尿苷被假尿苷替代的mRNA分子,合成所述mRNA分子的方法以及用于在体内递送治疗性蛋白的方法)。除非另有所指,否则特定核酸序列还隐含地包括其保守修饰的变体(例如,简并密码子取代)、等位基因、直系同源物、SNP和互补序列以及明确指出的序列。具体地,简并密码子取代可通过生成其中一个或多个选择的(或全部)密码子的第三位被混合碱基和/或脱氧肌苷残基取代的序列来实现(Batzer等人,Nucleic Acid Res.19:5081(1991);Ohtsuka等人,J.Biol.Chem.260:2605-2608(1985);和Rossolini等人,Mol.Cell.Probes 8:91-98(1994))。
“构建体”是指任何重组多核苷酸分子(诸如质粒、粘粒、病毒、自主复制多核苷酸分子、噬菌体或线性或环状单链或双链DNA或RNA多核苷酸分子),衍生自任何来源,能够与基因组整合或自主复制,构成如下多核苷酸分子,其中已经以功能操作的方式连接(即,可操作地连接)一或多个多核苷酸分子。重组构建体通常会包含可操作地连接至转录起始调节序列的本发明的多核苷酸,这些序列会导引多核苷酸在宿主细胞中的转录。可使用异源及非异源(即,内源)启动子两者导引本发明的核酸的表达。
“载体”是指任何重组多核苷酸构建体,该构建体可用于转化的目的(即将异源DNA引入到宿主细胞中)。一种类型的载体为“质粒”,是指环状双链DNA环,可将额外DNA区段连接至该环中。另一类型的载体为病毒载体,其中可将额外DNA区段连接至病毒基因组中。某些载体能够在被引入到的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体及游离型哺乳动物载体)。在引入到宿主细胞中后,其他载体(例如,非游离型哺乳动物载体)整合至宿主细胞的基因组中,且因此与宿主基因组一起复制。此外,某些载体能够导引被操作性连接的基因的表达。本文将此类载体称为“表达载体”。
本文所用术语“表达载体”是指能够在转化、转染或转导至宿主细胞中时复制及表达目的基因的核酸分子。表达载体包含一或多个表型选择标记及复制起点,以确保维护载体及以在需要的情况下于宿主内提供扩增。
用于细胞或受体的“活化”、“刺激”和“处理”可具有相同含义,例如细胞或受体用配体活化、刺激或处理,除非上下文另外或明确规定。“配体”包括天然和合成配体,例如细胞因子、细胞因子变体、类似物、突变蛋白和来源于抗体的结合化合物。“配体”还包括小分子,例如细胞因子的肽模拟物和抗体的肽模拟物。“活化”可指通过内部机制以及外部或环境因素调节的细胞活化。“应答/反应”,例如细胞、组织、器官或生物体的应答,包括生化或生理行为(例如生物区室内的浓度、密度、粘附或迁移、基因表达速率或分化状态)的改变,其中改变与活化、刺激或处理有关,或者与例如遗传编程等内部机制有关。
如本文中所用,术语任何疾病或病症的“治疗”或“医治”在一个实施方式中是指改善疾病或病症(即,减缓或阻止或减少疾病的进展或其临床症状的至少一个)。在另一个实施方式中,“治疗”或“医治”是指缓解或改善至少一个身体参数,包括可能不能被患者辨别出的那些物理参数。在另一个实施方式中,“治疗”或“医治”是指在身体上(例如,可辨别的症状的稳定)、生理上(例如,身体参数的稳定)或在这两方面调节疾病或病症。除非在本文中明确描述,否则用于评估疾病的治疗和/或预防的方法在本领域中通常是已知的。
“受试者”包括任何人或非人动物。术语“非人动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,诸如非人灵长类动物、绵羊、狗、猫、马、牛、鸡、两栖动物、爬行动物等。如本文中所用,术语“cyno”或“食蟹猴”是指食蟹猴。
“联合”一种或多种其它治疗剂的施用包括同时(共同)施用和任意次序的连续施用。
“治疗有效量”、“治疗有效剂量”和“有效量”是指本发明的CGRP抗体或其抗原结合片段当单独或与其它治疗药物组合给予细胞、组织或受试者时,有效预防或改善一种或多种疾病或病况的症状或该疾病或病况的发展的量。治疗有效剂量还指足以导致症状改善的抗体或其抗原结合片段的量,例如治疗、治愈、预防或改善相关医学病况或者提高这类病况的治疗、治愈、预防或改善的速度的量。当对个体施用单独给予的活性成分时,治疗有效剂量仅是指该成分。当组合施用时,治疗有效剂量是指引起治疗效果的活性成分的综合量,不论是组合、依次给予还是同时给予。治疗剂的有效量将导致诊断标准或参数提高至少10%,通常至少20%,优选至少约30%,更优选至少40%,最优选至少50%。
“药学上可接受的载体”是指药物制剂或组合物中除活性成分以外的对受试者无毒的成分。药学上可接受的载体包括但不限于缓冲剂,赋形剂,稳定剂或防腐剂。
术语“癌症”在本文中用于指表现出异常高水平的增殖和生长的一组细胞。癌症可能是良性的(也称为良性肿瘤),恶性前或恶性。癌细胞可以是实体癌细胞或白血病癌细胞。本文使用的术语“肿瘤”是指包含癌症的一个或多个细胞。术语“肿瘤生长”在本文中用于指代包含癌症的一种或多种细胞的增殖或生长,其导致癌症的大小或程度的相应增加。
抗CGRP抗体
在一个方面,本发明提供了特异性结合CGRP的抗体或其抗原结合片段。术语“抗CGRP抗体”、“抗CGRP”、“CGRP抗体”或“结合CGRP的抗体”是指能够以足够的亲合力结合CGRP蛋白或其片段以致所述抗体可以用作靶向CGRP的诊断剂和/或治疗剂。
在一些实施方案中,本发明提供了结合CGRP蛋白(例如α-CGRP和/或β-CGRP)的抗体。
在一些实施方案中,本发明抗体结合人CGRP蛋白。在一些实施方式中,本发明抗体结合人CGRP蛋白的包含第8-19位氨基酸的表位。
在一些实施方案中,本发明抗CGRP抗体包含:
(Ⅰ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:31、SEQ ID NO:32和SEQ IDNO:33所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(Ⅱ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ IDNO:4所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(Ⅲ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ IDNO:4所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:59、SEQ ID NO:60和SEQ ID NO:61所示的LCDR1、LCDR2和LCDR3;或
(Ⅳ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ IDNO:4所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:67、SEQ ID NO:68和SEQ ID NO:69所示的LCDR1、LCDR2和LCDR3;或
(Ⅴ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ IDNO:4所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:81、SEQ ID NO:82和SEQ ID NO:83所示的LCDR1、LCDR2和LCDR3;或
(Ⅵ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ IDNO:4所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ ID NO:86、SEQ ID NO:87和SEQ ID NO:88所示的LCDR1、LCDR2和LCDR3;或
(Ⅶ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:26、SEQ ID NO:27和SEQID NO:28所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:59、SEQ ID NO:60和SEQ ID NO:61所示的LCDR1、LCDR2和LCDR3;或
(Ⅷ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:19、SEQ ID NO:20和SEQID NO:21所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(Ⅸ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:19、SEQ ID NO:20和SEQID NO:21所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:67、SEQ ID NO:68和SEQ ID NO:69所示的LCDR1、LCDR2和LCDR3;或
(Ⅹ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:43、SEQ ID NO:44和SEQID NO:45所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:73、SEQ ID NO:74和SEQ ID NO:75所示的LCDR1、LCDR2和LCDR3;或
(Ⅺ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:11、SEQ ID NO:12和SEQID NO:13所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(Ⅻ)重链可变区,其包含氨基酸序列分别如SEQ ID NO:11、SEQ ID NO:12和SEQID NO:13所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:59、SEQ ID NO:60和SEQ ID NO:61所示的LCDR1、LCDR2和LCDR3;或
(XIII)重链可变区,其包含氨基酸序列分别如SEQ ID NO:37、SEQ ID NO:38和SEQID NO:39所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(XIV)重链可变区,其包含氨基酸序列分别如SEQ ID NO:19、SEQ ID NO:112和SEQID NO:21所示的HCDR1、HCDR2和HCDR3;和轻链可变区,其包含氨基酸序列分别如SEQ IDNO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3。
在一些实施方式中,本发明所述的抗体或其抗原结合片段包含重链可变区和/或轻链可变区:
所述重链可变区包含:
(Ⅰ)氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:3和SEQ ID NO:4所示的HCDR1、HCDR2和HCDR3;或
(II)氨基酸序列分别如SEQ ID NO:2、SEQ ID NO:110和SEQ ID NO:4所示的HCDR1、HCDR2和HCDR3;或
(ⅡI)氨基酸序列分别如SEQ ID NO:11、SEQ ID NO:12和SEQ ID NO:13所示的HCDR1、HCDR2和HCDR3;或
(IV)氨基酸序列分别如SEQ ID NO:11、SEQ ID NO:111和SEQ ID NO:13所示的HCDR1、HCDR2和HCDR3;或
(V)氨基酸序列分别如SEQ ID NO:19、SEQ ID NO:20和SEQ ID NO:21所示的HCDR1、HCDR2和HCDR3;或
(VI)氨基酸序列分别如SEQ ID NO:19、SEQ ID NO:112和SEQ ID NO:21所示的HCDR1、HCDR2和HCDR3;或
(VII)氨基酸序列分别如SEQ ID NO:26、SEQ ID NO:27和SEQ ID NO:28所示的HCDR1、HCDR2和HCDR3;或
(VIII)氨基酸序列分别如SEQ ID NO:31、SEQ ID NO:32和SEQ ID NO:33所示的HCDR1、HCDR2和HCDR3;或
(IX)氨基酸序列分别如SEQ ID NO:37、SEQ ID NO:38和SEQ ID NO:39所示的HCDR1、HCDR2和HCDR3;或
(X)氨基酸序列分别如SEQ ID NO:43、SEQ ID NO:44和SEQ ID NO:45所示的HCDR1、HCDR2和HCDR3;
所述轻链可变区包含:
(Ⅰ)氨基酸序列分别如SEQ ID NO:51、SEQ ID NO:52和SEQ ID NO:53所示的LCDR1、LCDR2和LCDR3;或
(Ⅱ)氨基酸序列分别如SEQ ID NO:59、SEQ ID NO:60和SEQ ID NO:61所示的LCDR1、LCDR2和LCDR3;或
(Ⅲ)氨基酸序列分别如SEQ ID NO:67、SEQ ID NO:68和SEQ ID NO:69所示的LCDR1、LCDR2和LCDR3;或
(Ⅳ)氨基酸序列分别如SEQ ID NO:73、SEQ ID NO:74和SEQ ID NO:75所示的LCDR1、LCDR2和LCDR3;或
(V)氨基酸序列分别如SEQ ID NO:113、SEQ ID NO:74和SEQ ID NO:75所示的LCDR1、LCDR2和LCDR3;或
(ⅤI)氨基酸序列分别如SEQ ID NO:81、SEQ ID NO:82和SEQ ID NO:83所示的LCDR1、LCDR2和LCDR3;或
(ⅥI)氨基酸序列分别如SEQ ID NO:86、SEQ ID NO:87和SEQ ID NO:88所示的LCDR1、LCDR2和LCDR3。
在一些实施方式中,本发明所述的抗体或其抗原结合片段包含:
(1)如SEQ ID NO:46所示重链可变区的HCDR1、HCDR2和HCDR3,和如SEQ ID NO:78所示轻链可变区的LCDR1、LCDR2和LCDR3;或
(2)如SEQ ID NO:47所示重链可变区的HCDR1、HCDR2和HCDR3,和如SEQ ID NO:78所示轻链可变区的LCDR1、LCDR2和LCDR3;或
(3)如SEQ ID NO:48所示重链可变区的HCDR1、HCDR2和HCDR3,和如SEQ ID NO:77所示轻链可变区的LCDR1、LCDR2和LCDR3;或
(4)如SEQ ID NO:8所示重链可变区的HCDR1、HCDR2和HCDR3,和如SEQ ID NO:63所示轻链可变区的LCDR1、LCDR2和LCDR3;或
(5)如SEQ ID NO:24所示重链可变区的HCDR1、HCDR2和HCDR3,和如SEQ ID NO:54所示轻链可变区的LCDR1、LCDR2和LCDR3;或
(6)如SEQ ID NO:8所示重链可变区的HCDR1、HCDR2和HCDR3,和如SEQ ID NO:54所示轻链可变区的LCDR1、LCDR2和LCDR3。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含重链可变区和轻链可变区:
(Ⅰ)所述重链可变区包含如SEQ ID NO:30所示的氨基酸序列,或包含与SEQ IDNO:30所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:50所示的氨基酸序列,或包含与SEQ ID NO:50所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅱ)所述重链可变区包含如SEQ ID NO:1所示的氨基酸序列,或包含与SEQ IDNO:1所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:50所示的氨基酸序列,或包含与SEQ ID NO:50所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅲ)所述重链可变区包含如SEQ ID NO:1所示的氨基酸序列,或包含与SEQ IDNO:1所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:58所示的氨基酸序列,或包含与SEQ ID NO:58所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅳ)所述重链可变区包含如SEQ ID NO:1所示的氨基酸序列,或包含与SEQ IDNO:1所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:66所示的氨基酸序列,或包含与SEQ ID NO:66所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅴ)所述重链可变区包含如SEQ ID NO:1所示的氨基酸序列,或包含与SEQ IDNO:1所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:80所示的氨基酸序列,或包含与SEQ ID NO:80所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅵ)所述重链可变区包含如SEQ ID NO:1所示的氨基酸序列,或包含与SEQ IDNO:1所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:85所示的氨基酸序列,或包含与SEQ ID NO:85所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅶ)所述重链可变区包含如SEQ ID NO:25所示的氨基酸序列,或包含与SEQ IDNO:25所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:58所示的氨基酸序列,或包含与SEQ ID NO:58所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅷ)所述重链可变区包含如SEQ ID NO:18所示的氨基酸序列,或包含与SEQ IDNO:18所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:50所示的氨基酸序列,或包含与SEQ ID NO:50所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅸ)所述重链可变区包含如SEQ ID NO:18所示的氨基酸序列,或包含与SEQ IDNO:18所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:66所示的氨基酸序列,或包含与SEQ ID NO:66所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅹ)所述重链可变区包含如SEQ ID NO:42所示的氨基酸序列,或包含与SEQ IDNO:42所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:72所示的氨基酸序列,或包含与SEQ ID NO:72所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅺ)所述重链可变区包含如SEQ ID NO:10所示的氨基酸序列,或包含与SEQ IDNO:10所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:50所示的氨基酸序列,或包含与SEQ ID NO:50所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(Ⅻ)所述重链可变区包含如SEQ ID NO:10所示的氨基酸序列,或包含与SEQ IDNO:10所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:58所示的氨基酸序列,或包含与SEQ ID NO:58所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(XIII)所述重链可变区包含如SEQ ID NO:36所示的氨基酸序列,或包含与SEQ IDNO:36所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:50所示的氨基酸序列,或包含与SEQ ID NO:50所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列。
在一些实施方案中,本发明所述的抗体或其抗原结合片段包含的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3分别为:
HCDR1:DX
HCDR2:X
HCDR3:EGLGGY(SEQ ID NO:39)或ELDSGFDY(SEQ ID NO:45);
LCDR1:X
LCDR2:
LCDR3:X
在一些实施方案中,所述的抗体或其抗原结合片段包含:氨基酸序列如SEQ IDNO:2,11,19,26,31,37或43所示的HCDR1;氨基酸序列如SEQ ID NO:3,110,12,111,20,112,27,32,38或44所示的HCDR2;氨基酸序列如SEQ ID NO:4,13,21,28,33,39或45所示的HCDR3;氨基酸序列如SEQ ID NO:51,59,67,73,113,81或86所示的LCDR1;氨基酸序列如SEQID NO:52,60,68,74,82或87所示的LCDR2;和氨基酸序列如SEQ ID NO:53,61,69,75,83或88所示的LCDR3。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含:
(Ⅰ)重链可变区,其包含如SEQ ID NO:5、6、7、8、9、14、15、16、17、22、23、24、29、34、35、40、41、46、47、48或49中任一项所示的氨基酸序列;和
轻链可变区,其包含如SEQ ID NO:54、55、56、57、62、63、64、65、70、71、76、77、78、79、84、89或90中任一项所示的氨基酸序列;或
(Ⅱ)重链可变区,其包含如SEQ ID NO:5、6、7、8、9、14、15、16、17、22、23、24、29、34、35、40、41、46、47、48或49中任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和
轻链可变区,其包含如SEQ ID NO:54、55、56、57、62、63、64、65、70、71、76、77、78、79、84、89或90中任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列。
在一些实施方案中,本发明所述的抗体或其抗原结合片段包含的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3分别为:
HCDR1:DX
HCDR2:X
HCDR3:EGLGGY或ELDSGFDY;
LCDR1:X
LCDR2:SX
LCDR3:X
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含重链可变区和轻链可变区:所述重链可变区包含如SEQ ID NO:46、47、48、8、24任一项所示的氨基酸序列,或包含与SEQ ID NO:46、47、48、8、24任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和/或,所述轻链可变区包含如SEQ ID NO:77、78、54、63任一项所示的氨基酸序列,或包含与SEQ ID NO:77、78、54、63任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列。
在一些实施方案中,本发明所述的抗体或其抗原结合片段包含氨基酸序列分别如SEQID NO:43、SEQ ID NO:44和SEQ ID NO:45所示的HCDR1、HCDR2和HCDR3、以及氨基酸序列分别如SEQ ID NO:73、SEQ ID NO:74和SEQ ID NO:75所示的LCDR1、LCDR2和LCDR3。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含重链可变区和轻链可变区:所述重链可变区包含如SEQ ID NO:42、46、47、48、49任一项(优选SEQ ID NO:46、47、48任一项)所示的氨基酸序列,或包含与前述任一序列相比具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和/或,所述轻链可变区包含如SEQ ID NO:72、76、77、78、79任一项(优选SEQ ID NO:77、78任一项)所示的氨基酸序列,或包含与前述任一序列相比具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列。
在一些实施方案中,本发明所述的抗体或其抗原结合片段包含的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3分别为:
HCDR1:DX
HCDR2:X
HCDR3:EGLGGY;
LCDR1:X
LCDR2:SX
LCDR3:X
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含重链可变区和轻链可变区:所述重链可变区包含如SEQ ID NO:8、24任一项所示的氨基酸序列,或包含与SEQ ID NO:8、24任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和/或,所述轻链可变区包含如SEQ ID NO:54、63任一项所示的氨基酸序列,或包含与SEQ ID NO:54、63任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含重链可变区和轻链可变区:
(I)所述重链可变区包含如SEQ ID NO:46所示的氨基酸序列,或包含与SEQ IDNO:46所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:78所示的氨基酸序列,或包含与SEQ ID NO:78所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(II)所述重链可变区包含如SEQ ID NO:47所示的氨基酸序列,或包含与SEQ IDNO:47所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:78所示的氨基酸序列,或包含与SEQ ID NO:78所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(III)所述重链可变区包含如SEQ ID NO:48所示的氨基酸序列,或包含与SEQ IDNO:48所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:77所示的氨基酸序列,或包含与SEQ ID NO:77所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(IV)所述重链可变区包含如SEQ ID NO:8所示的氨基酸序列,或包含与SEQ IDNO:8所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:63所示的氨基酸序列,或包含与SEQ ID NO:63所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(V)所述重链可变区包含如SEQ ID NO:24所示的氨基酸序列,或包含与SEQ IDNO:24所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:54所示的氨基酸序列,或包含与SEQ ID NO:54所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(VI)所述重链可变区包含如SEQ ID NO:8所示的氨基酸序列,或包含与SEQ IDNO:8所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;和所述轻链可变区包含如SEQ ID NO:54所示的氨基酸序列,或包含与SEQ ID NO:54所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含:氨基酸序列如SEQID NO:46所示的重链可变区和氨基酸序列如SEQ ID NO:78所示的轻链可变区;或
氨基酸序列如SEQ ID NO:47所示的重链可变区和氨基酸序列如SEQ ID NO:78所示的轻链可变区;或
氨基酸序列如SEQ ID NO:48所示的重链可变区和氨基酸序列如SEQ ID NO:77所示的轻链可变区;或
氨基酸序列如SEQ ID NO:8所示的重链可变区和氨基酸序列如SEQ ID NO:63所示的轻链可变区;或
氨基酸序列如SEQ ID NO:24所示的重链可变区和氨基酸序列如SEQ ID NO:54所示的轻链可变区;或
氨基酸序列如SEQ ID NO:8所示的重链可变区和氨基酸序列如SEQ ID NO:54所示的轻链可变区。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含源自人免疫球蛋白的恒定区。在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含SEQ IDNO:108所示的重链恒定区和/或SEQ ID NO:109所示的轻链恒定区。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其包含:
(Ⅰ)重链,其包含如SEQ ID NO:92、94或96中任一项所示的氨基酸序列,和
轻链,其包含如SEQ ID NO:91、93或95中任一项所示的氨基酸序列;或
(Ⅱ)重链,其包含如SEQ ID NO:92、94或96中任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列,和
轻链,其包含如SEQ ID NO:91、93或95中任一项所示的氨基酸序列具有至少95%,96%,97%,98%或99%序列同一性的氨基酸序列;或
(III)氨基酸序列如SEQ ID NO:92所示的重链和氨基酸序列如SEQ ID NO:91所示的轻链,或
氨基酸序列如SEQ ID NO:94所示的重链和氨基酸序列如SEQ ID NO:93所示的轻链,或
氨基酸序列如SEQ ID NO:96所示的重链和氨基酸序列如SEQ ID NO:95所示的轻链。
在一些实施方式中,本发明所述的抗体或其抗原结合片段,其为鼠源抗体、嵌合抗体、人源化抗体、或全人抗体,或其抗原结合片段。
可采用用于产生抗体的任何合适方法来产生本发明的抗体。任何合适形式的CGRP都可用作产生抗体的免疫原(抗原)。通过举例而非限制,任何CGRP变体或其片段都可用作免疫原。在一些实施方式中,产生鼠源的单克隆抗人CGRP抗体的杂交瘤细胞可通过本领域公知的方法产生。
来源于啮齿动物(如小鼠)的抗体在体内用作治疗药物时可能引起不需要的抗体免疫原性,重复使用导致人体产生针对治疗性抗体的免疫应答,这类免疫应答至少导致丧失治疗功效,而严重的则导致潜在致死过敏反应。降低啮齿动物抗体的免疫原性的一种方法包括嵌合抗体的产生,其中将小鼠可变区与人恒定区融合(Liu等(1987)Proc.Natl.Acad.Sci.USA 84:3439-43)。然而,嵌合抗体中的完整啮齿动物可变区的保留仍可能在患者中引起有害的免疫原性。将啮齿动物可变结构域的互补决定区(CDR)环移植到人构架上(即人源化)已被用于进一步将啮齿动物序列减至最低(Jones等(1986)Nature321:522;Verhoeyen等(1988)Science 239:1534)。
在一些实施方式中,本发明的嵌合或人源化抗体可基于所述制备的鼠单克隆杂交瘤抗体的序列来制备。编码重链和轻链免疫球蛋白的DNA可以从目标鼠杂交瘤中获得,并且使用标准分子生物学技术进行工程改造以包含非鼠(例如人)免疫球蛋白序列。
在一些实施方式中,本发明所述的嵌合CGRP抗体,可使用本领域已知的方法将杂交瘤来源的免疫球蛋白重链和轻链可变区与人IgG恒定区有效连接(参见例如属于Cabilly等人的美国专利No.4,816,567),获得嵌合型重链和嵌合型轻链来制备。在一些实施方式中,本发明的嵌合抗体包含的恒定区可选自任何人IgG亚型,如IgG1、IgG2、IgG3、IgG4,优选IgG4。
在一些实施方式中,本发明的嵌合CGRP抗体可由嵌合型轻链与嵌合型重链表达质粒“混合和匹配”转染表达细胞获得,此类“混合和匹配”的抗体的CGRP结合可使用上述结合测定和其它常规结合测定(例如,ELISA)来进行测试。
本发明的所述抗体的可变区CDR的精确氨基酸序列边界可使用许多公知的方案的任何方案来确定,包括基于抗体的三维结构和CDR环的拓扑学的Chothia(Chothia等人.(1989)Nature 342:877-883;Al-Lazikani等人,“Standard conformations for thecanonical structures of immunoglobulins”,Journal of Molecular Biology,273,927-948(1997))、基于抗体序列可变性的Kabat(Kabat等人,Sequences of Proteins ofImmunological Interest,第4版,U.S.Department of Health and Human Services,National Institutes of Health(1987)),AbM(University of Bath),Contact(University College London),国际ImMunoGeneTics database(IMGT)(1999NucleicAcids Research,27,209-212),以及基于利用大量晶体结构的近邻传播聚类(affinitypropagation clustering)的North CDR定义。
除非另有说明,否则本发明抗体的CDR可以由本领域的技术人员根据本领域的任何方案(例如不同的指派系统或组合)确定边界。在一些实施方式中,本发明抗体的CDR由Kabat、Chothia、AbM、Contact、North或IMGT定义。在一些实施方式中,本发明抗体的CDR由Kabat定义。
应该注意,基于不同的指派系统获得的同一抗体的可变区的CDR的边界可能有所差异。即不同指派系统下定义的同一抗体可变区的CDR序列有所不同。因此,在涉及用本发明定义的具体CDR序列限定抗体时,所述抗体的范围还涵盖了这样的抗体,其可变区序列包含所述的具体CDR序列,但是由于应用了不同的方案(例如不同的指派系统或组合)而导致其所声称的CDR边界与本发明所定义的具体CDR边界不同。
具有不同特异性(即,针对不同抗原的不同结合位点)的抗体具有不同的CDR。然而,尽管CDR在抗体与抗体之间是不同的,但是CDR内只有有限数量的氨基酸位置直接参与抗原结合。使用Kabat,Chothia、AbM、Contact和North方法中的至少两种,可以确定最小重叠区域,从而提供用于抗原结合的“最小结合单位”。最小结合单位可以是CDR的一个子部分。正如本领域技术人员明了,通过抗体的结构和蛋白折叠,可以确定CDR序列其余部分的残基。因此,本发明也考虑本文所给出的任何CDR的变体。例如,在一个CDR的变体中,最小结合单位的氨基酸残基可以保持不变,而根据Kabat或Chothia定义的其余CDR残基可以被保守氨基酸残基替代。
本发明所述的人源化抗体,可以使用本领域已知的方法将鼠源CDR区插入人种系框架区。参见Winter等人的美国专利No.5,225,539及Queen等人的美国专利No.5,530,101;5,585,089;5,693,762和6,180,370。
在一些实施方式中,氨基酸差异包括氨基酸缺失、插入或置换。在一些实施方式中,本发明的抗CGRP抗体或其抗原结合片段包括具有已通过氨基酸缺失、插入或置换突变的,但仍与上述抗体(特别地在上述序列中描绘的CDR区中)有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列的那些抗体。在一些实施方式中,本发明的抗体与具体序列中描绘的CDR区相比较时,在CDR区中已通过氨基酸缺失、插入或置换的氨基酸突变不超过1、2、3、4或5个。在一些实施方式中,本发明的抗体与具体序列中框架区相比较时,在框架区中已通过氨基酸缺失、插入或置换的氨基酸突变不超过1、2、3、4或5个。
在一些实施方式中,编码本发明抗体的多核苷酸分子包括已通过核苷酸缺失、插入或置换突变的,但仍然与上文中所述的序列中描绘的CDR对应编码区具有至少约60、70、80、90、95或100%同一性的多核苷酸分子。
在一些实施方案中,CGRP抗体是IgG抗体,例如IgG1,IgG2,IgG3或IgG4抗体或其修饰形式,如以下部分所述。
在一些实施方式中,可在本文中所提供抗体的Fc区中引入一个或多个氨基酸修饰,以此产生Fc区变体。Fc区变体可包含在一或多个氨基酸位置处包含氨基酸修饰(例如置换)的人Fc区序列(例如人IgG1、IgG2、IgG3或IgG4 Fc区)。
在一些实施方式中,可能需要产生经半胱氨酸工程改造的抗体,例如“硫代MAb”,其中抗体的一或多个残基经半胱氨酸残基置换。
在一些实施方式中,本文中所提供的抗体可进一步经修饰为含有本领域中已知且轻易获得的其他非蛋白质部分。适合抗体衍生作用的部分包括,但不限于,水溶性聚合物。水溶性聚合物的非限制性实例包括,但不限于,聚乙二醇(PEG)、乙二醇/丙二醇共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二烷、聚-1,3,6-三烷、乙烯/马来酸酐共聚物、聚氨基酸(均聚物或无规共聚物)、及葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇、丙二醇均聚物、聚环氧丙烷/氧化乙烯共聚物、聚氧乙基化多元醇(例如甘油)、聚乙烯醇、及其混合物。
在一些实施方式中,本文中所提供的抗体可进一步用于制备多特异性抗体。所述多特异性抗体包含具有不同于本文中所提供的抗体的结合特异性的第二功能模块(例如第二抗体),从而能够结合至少两个不同的结合位点和/或靶分子。因此,本发明还提供了一种包含本文所述抗体或其抗原结合片段的轻链可变区和重链可变区的多特异性抗体。
在一些实施方式中,本文中所提供的抗体可进一步用于制备单链抗体。因此,本发明还提供了一种包含本文所述抗体或其抗原结合片段的轻链可变区和重链可变区的单链抗体。
抗体表达
在又一个方面,本发明提供了一种多核苷酸分子,其编码本文所述的抗CGRP抗体或其抗原结合片段。所述多核苷酸分子可以包含编码抗体的轻链可变区和/或重链可变区的氨基酸序列的多核苷酸分子,或包含编码抗体的轻链和/或重链的氨基酸序列的多核苷酸分子。
在又一个方面,本发明提供了一种表达载体,其包含如本文所述的多核苷酸分子,优选地,所述载体为真核表达载体。在一些实施方式中,如本文所述的多核苷酸分子包含在一个或多个表达载体中。
在又一个方面,本发明提供了一种宿主细胞,其包含如本文所述的多核苷酸分子或如本文所述的表达载体,优选地,所述宿主细胞是真核细胞,更优选哺乳动物细胞。
在又一个方面,本发明提供了一种用于制备如本文所述的抗CGRP抗体或其抗原结合片段的方法,所述方法包括在适合于所述抗体或其抗原结合片段表达的条件下在本文所述的宿主细胞中表达所述抗体或其抗原结合片段,并从所述宿主细胞回收所表达的抗体或其抗原结合片段。
本发明提供用于表达本发明的重组抗体的哺乳动物宿主细胞,包括可获自美国典型培养物保藏中心(ATCC)的许多永生化细胞系。这些尤其包括中国仓鼠卵巢(CHO)细胞、NS0、SP2/0细胞、HeLa细胞、幼仓鼠肾(BHK)细胞、猴肾细胞(COS)、人肝细胞癌细胞、A549细胞、293T细胞和许多其它细胞系。哺乳动物宿主细胞包括人、小鼠、大鼠、狗、猴、猪、山羊、牛、马和仓鼠细胞。通过测定哪种细胞系具有高表达水平来选择特别优选的细胞系。
在一个实施方式中,本发明提供制备抗CGRP抗体的方法,其中所述方法包括,将表达载体导入哺乳动物宿主细胞中时,通过将宿主细胞培养足够的一段时间,以允许抗体在宿主细胞中表达,或者更优选抗体分泌到宿主细胞生长的培养基中,来产生抗体。可采用标准蛋白质纯化方法从培养基中回收抗体。
很可能由不同细胞系表达或在转基因动物中表达的抗体彼此具有不同的糖基化。然而,由本文提供的核酸分子编码的或包含本文提供的氨基酸序列的所有抗体是本发明的组成部分,而不论抗体的糖基化如何。同样,在某些实施方式中,非岩藻糖基化抗体是有利的,因为它们通常在体外和体内具有比其岩藻糖基化对应物更强力的功效,并且不可能是免疫原性的,因为它们的糖结构是天然人血清IgG的正常组分。
药物组合物和药物制剂
在又一个方面,本发明提供了一种药物组合物,其包含如本文所述的抗CGRP抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、或本文所述的多特异性抗体或单链抗体,和药学上可接受的载体或赋形剂。应理解,本发明提供的抗CGRP抗体或其药物组合物可以整合制剂中合适的运载体、赋形剂和其他试剂以联合给药,从而提供改善的转移、递送、耐受等。
术语“药物组合物”指这样的制剂,其允许包含在其中的活性成分的生物学活性有效的形式存在,并且不包含对施用所述制剂的受试者具有不可接受的毒性的另外的成分。
可以通过将具有所需纯度的本发明的抗CGRP抗体与一种或多种任选的药用辅料(Remington's Pharmaceutical Sciences,第16版,Osol,A.编辑(1980))混合来制备包含本文所述的抗CGRP抗体的药物制剂,优选地以水溶液或冻干制剂的形式。
本发明的药物组合物或制剂还可以包含一种或多种其它活性成分,所述活性成分是被治疗的特定适应症所需的,优选具有不会不利地影响彼此的互补活性的那些活性成分。在一些实施方式中,其它的活性成分为化疗剂、免疫检查点抑制剂、生长抑制剂、抗生素或已知的各种抗肿瘤或抗癌剂,所述活性成分以对于目的用途有效的量合适地组合存在。在一些实施方式中,本发明的药物组合物还包含编码抗CGRP抗体的多核苷酸分子的组合物。
在又一个方面,本发明提供了一种药物组合,其包含本文所述的抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、本文所述的多特异性抗体或单链抗体、或本文所述的药物组合物,以及一种或多种另外的治疗剂。
在又一个方面,本发明提供了一种试剂盒,其包括本文所述的抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、或本文所述的多特异性抗体或单链抗体、或本文所述的药物组合物或药物组合。
医药用途及治疗方法
本文提供的任何抗CGRP抗体均可用于治疗方法。还应当理解,在讨论“抗体”时,也包括包含抗体的组合物。本发明的抗CGRP抗体可以治疗有效量或预防有效量用于本发明任一实施方案所述的治疗或预防方法中。
在又一个方面,本发明提供了本文所述的抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、或本文所述的多特异性抗体或单链抗体、或本文所述的药物组合物或药物组合在制备用于治疗和/或预防CGRP介导的疾病或病症的药物中的用途。优选所述疾病或病症为具有CGRP相关疼痛的病状;更优选地,所述疼痛选自有先兆的偏头痛、无先兆的偏头痛、高频发作性偏头痛、月经性偏头痛、偏瘫性偏头痛、丛集性头痛、偏头痛性神经痛、慢性头痛、紧张性头痛、一般性头痛、潮热、慢性阵发性半侧颅痛、由于头中的潜在结构问题而致的继发性头痛、由于颈中的潜在结构问题而致的继发性头痛、脑神经痛、窦性头痛、过敏症诱发的头痛、三叉神经痛、纤维肌痛、坐骨神经痛。
在又一个方面,本发明提供了本文所述的抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、或本文所述的多特异性抗体或单链抗体、或本文所述的药物组合物或药物组合,其用于治疗和/或预防CGRP介导的疾病或病症。优选所述疾病或病症为具有CGRP相关疼痛的病状;更优选地,所述疼痛选自有先兆的偏头痛、无先兆的偏头痛、高频发作性偏头痛、月经性偏头痛、偏瘫性偏头痛、丛集性头痛、偏头痛性神经痛、慢性头痛、紧张性头痛、一般性头痛、潮热、慢性阵发性半侧颅痛、由于头中的潜在结构问题而致的继发性头痛、由于颈中的潜在结构问题而致的继发性头痛、脑神经痛、窦性头痛、过敏症诱发的头痛、三叉神经痛、纤维肌痛、坐骨神经痛。
在又一个方面,本发明提供了一种治疗和/或预防CGRP介导的疾病或病症的方法,其包括向有需要的受试者施用本文所述的抗体或其抗原结合片段、本文所述的多核苷酸分子、本文所述的表达载体、本文所述的宿主细胞、或本文所述的多特异性抗体或单链抗体、或本文所述的药物组合物或药物组合。优选所述疾病或病症为具有CGRP相关疼痛的病状;更优选地,所述疼痛选自有先兆的偏头痛、无先兆的偏头痛、高频发作性偏头痛、月经性偏头痛、偏瘫性偏头痛、丛集性头痛、偏头痛性神经痛、慢性头痛、紧张性头痛、一般性头痛、潮热、慢性阵发性半侧颅痛、由于头中的潜在结构问题而致的继发性头痛、由于颈中的潜在结构问题而致的继发性头痛、脑神经痛、窦性头痛、过敏症诱发的头痛、三叉神经痛、纤维肌痛、坐骨神经痛。
在一些实施方式中,本文所述疼痛选自有先兆的偏头痛、无先兆的偏头痛、高频发作性偏头痛、月经性偏头痛、偏瘫性偏头痛、丛集性头痛、偏头痛性神经痛、慢性头痛、紧张性头痛、一般性头痛、潮热、慢性阵发性半侧颅痛、由于头中的潜在结构问题而致的继发性头痛、由于颈中的潜在结构问题而致的继发性头痛、脑神经痛、窦性头痛、过敏症诱发的头痛、三叉神经痛、纤维肌痛、坐骨神经痛。
在一些实施方式中,本发明给药方式包括但不限于口服、静脉内、皮下、肌内、动脉内、关节内(例如在关节炎关节中)、通过吸入、气雾剂递送或肿瘤内给予等。
用于诊断和检测的方法
在又一个方面,本发明提供了一种使用本文所述的抗体或其抗原结合片段检测CGRP在样品中的存在的方法。术语“检测”用于本文中时,包括定量或定性检测。在一些实施方式中,所述样品是生物样品。在某些实施方式中,生物样品是血、血清或生物来源的其他液体样品。在某些实施方式中,生物样品包含细胞或组织。所述方法包括使本文所述的抗体或其抗原结合片段或含有所述抗体或其抗原结合片段的检测组合物与样品接触的步骤,以及检测是否存在所述抗体或其抗原结合片段与CGRP结合产生的结合物或结合信号的步骤。用于检测用途时,本文所述的抗体或其抗原结合片段可被标记,以指示是否形成了所述结合物。在某些实施方式中,所述方法可以用于诊断目的,或者非诊断目的。
在又一个方面,本发明提供了本文所述的抗体或其抗原结合片段或者含有所述抗体或其抗原结合片段的检测组合物用于制备检测CGRP在样品中的存在的检测试剂的用途。
本发明包括所述特定实施方式的所有组合。本发明的进一步实施方式及可应用性的完整范畴将自下文所提供的详细描述变得显而易见。然而,应理解,尽管详细描述及特定实施例指示本发明的优选实施方式,但仅以说明的方式提供这些描述及实施例,因为本发明的精神及范畴内的各种改变及修改将自此详细描述对熟悉此项技术者变得显而易见。出于所有目的,包括引文在内的本文所引用的所有公开物、专利及专利申请将以引用的方式全部并入本文。
本发明的抗体可以通过本领域技术人员所熟知的多种方法来制备,包括下面列举的具体实施方式、其与其他方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。
本发明采用下述缩略词:
KLH代表血蓝蛋白;
PBS代表磷酸缓冲盐溶液;
FBS代表胎牛血清;
HRP代表辣根过氧化物酶;
BSA代表牛血清白蛋白;
MMA代表脑膜中动脉。
实施例
通过以下实施例对本发明进行说明,但并不旨在对本发明作出任何限制。本文已经详细描述了本发明,其中也公开了其具体实施方式。对本领域的技术人员而言,在不脱离本发明精神和范围的情况下针对本发明具体实施方式进行各种变化和改进将是显而易见的。
实施例1、用于抗CGRP抗体制备和测试的重组蛋白的制备
1.1人片段(7-37)α-CGRP多肽的制备(用于免疫老鼠和杂交瘤筛选)
用于免疫小鼠的人α-CGRP(7-37)多肽是由Anaspec化学合成并偶联KLH蛋白。多肽与KLH载体蛋白的分子量比为1:4.
1.2人全长(1-37)α-CGRP多肽的制备(用于杂交瘤筛选)
用于杂交瘤筛选的人α-CGRP(1-37)多肽由Anaspec化学合成并偶联生物素蛋白制备,以及购自Abcam公司的全长多肽。
1.3人全长(1-37)β-CGRP多肽的制备(用于杂交瘤筛选)
购自Anaspec公司。
1.4大鼠片段(7-37)α-CGRP多肽的制备(用于杂交瘤筛选)
购自Tocris公司。
实施例2、小鼠杂交瘤细胞的制备
2.1、免疫动物
1.5将溶解于磷酸缓冲盐溶液(PBS)的人α-CGRP(7-37)-KLH偶联蛋白作为抗原免疫5只BALB/c小鼠(购自Simonsen Laboratories of Gilroy,雌性BALB/c,8周龄)。在初次免疫(20ug多肽/只)后,每隔1周或2周进行一次加强免疫(10ug多肽/只),共进行6次免疫。
2.2、细胞融合
在最后一针加强免疫后第四天,取小鼠腹股沟淋巴结,腘窝淋巴结和脾脏,在含EDTA的生理盐水中碾磨后取富含淋巴细胞的悬浮液,按常规电转方法将其与小鼠骨髓瘤细胞Sp2/0融合。将融合产物在含1:50HAT(次黄嘌呤H、氨甲蝶呤A和胸腺嘧啶核苷T)的DMEM完全培养基中培养5天以筛选成功融合的细胞(杂交瘤细胞)。然后换成含1:50HT(次黄嘌呤H和胸腺嘧啶核苷T)的DMEM完全培养基直至筛选结束。
DMEM完全培养基配比为:15%FBS(胎牛血清)+1:50L-谷氨酰胺+100U/mL青链霉素+1:100OPI(草酰乙酸、丙酮酸和胰岛素),培养箱条件是8%CO
实施例3、小鼠杂交瘤细胞的筛选和所得抗CGRP鼠源抗体的性能检测
在7680株多克隆杂交瘤细胞中,通过ELISA筛选出273株可分泌与人α-CGRP结合的抗体的杂交瘤细胞。在这273株杂交瘤细胞中,有29株杂交瘤细胞表达可与大鼠α-CGRP结合的抗体的杂交瘤细胞。最后利用ELISA方法从29株中筛选到13株杂交瘤细胞表达可与人β-CGRP结合的抗体的杂交瘤细胞,并将它们各自分泌的抗体分别进行了纯化和分析。另外从这13株杂交瘤细胞分别提取mRNA,对它们的抗体可变区编码序列进行了测序。由此初步筛选出的13种杂交瘤抗体分别编号为1A2、1B2、1F5、2A2、2B8、2C2、2E4、3B1、3C1、3C5、3E5、3F7和3H10。
实验方法和结果如下所示。
3.1 ELISA检测杂交瘤抗体与与人α-CGRP的结合
384孔或96孔MaxiSorp板(赛默飞世尔Nunc),包被1ug/mL人α-CGRP(Abcam)后以1%BSA封闭。再将杂交瘤细胞培养上清液转移至MaxiSorp板上孵育30分钟。用辣根过氧化物酶HRP标记的羊抗鼠二抗检测。
用间接ELISA方法验证抗体与人α-CGRP的结合。96孔MaxiSorp板(赛默飞世尔Nunc),包被2ug/mL中性亲和素NeutrAvidin后以1%BSA封闭。再分别用1ug/mL生物素化人α-CGRP(Anaspec)和杂交瘤细胞培养上清液在96孔板上孵育30分钟。用辣根过氧化物酶HRP标记的羊抗鼠二抗检测。
3.2 ELISA检测杂交瘤抗体与与大鼠α-CGRP的结合
96孔MaxiSorp板(赛默飞世尔Nunc),包被1ug/mL大鼠α-CGRP(Tocris)后以1%BSA封闭。再将杂交瘤细胞培养上清液转移至MaxiSorp板上孵育30分钟。用辣根过氧化物酶HRP标记的羊抗鼠二抗检测。
3.3 ELISA检测杂交瘤抗体与人β-CGRP的结合
96孔MaxiSorp板(赛默飞世尔Nunc),包被1ug/mL人β-CGRP(Anaspec)后以1%BSA封闭。再将杂交瘤细胞培养上清液转移至MaxiSorp板上孵育30分钟。用辣根过氧化物酶HRP标记的羊抗鼠二抗检测。
实施例4、抗CGRP鼠源抗体的可变区序列的测定(根据Kabat或IMGT表示)
用基于简并引物PCR的方法,测定抗CGRP鼠源抗体的可变区对应的DNA编码序列。简言之,将13株杂交瘤细胞株分别放大培养,1000rpm离心收集细胞,并以Trizol提取总RNA。以此为模板合成第一链cDNA,之后以第一链cDNA作为后续模板,PCR扩增可变区DNA编码序列。所用PCR引物是基于Ig-引物组。回收并纯化PCR产物。对扩增产物测序,得到抗CGRP鼠源抗体的重链可变区和轻链可变区氨基酸序列。每株杂交瘤的重轻链数目如表1所示
表1每种杂交瘤抗体的重链和氢链数目
实施例5、抗CGRP嵌合抗体的构建
根据实施例3的评估结果,选取抗CGRP鼠源抗体1A2、1B2、1F5、2A2、2B8、2C2、2E4、3B1、3C1、3C5、3E5、3F7和3H10的轻链和重链可变区构建抗CGRP嵌合抗体。
从人B淋巴细胞(来自北京血液研究所)中克隆重链恒定区Fc和轻链恒定区κ的编码序列,引入pCDNA3.1质粒和pCDNA3.1质粒中,分别形成载体HXT4S和HXT2。前述抗CGRP鼠源抗体的重链和轻链可变区编码序列由tsingke公司合成,通过BSPQI酶切,分别亚克隆至HXT4S和HXT2。将各种嵌合型重链和轻链表达质粒混合配对转染表达细胞(CHOK1 18,苏州君盟),获得368种嵌合抗体,其编号和相应可变区氨基酸序列具体见表2。
表2嵌合抗体的编号及其重链和轻链可变区的来源
/>
实施例6、嵌合抗体的筛选
根据表3中的嵌合抗体与全长(1-37)CGRP和截短(1-19)CGRP结合的能力以及阻断CGRP与CALCRL-RAMP1结合的细胞生物学活性,筛选最佳嵌合抗体。实验方法和结果如下所示。
6.1 ELISA法检测嵌合抗体与全长(1-37)CGRP的结合(细胞液上清)
使用PBS(Hyclone)稀释链霉亲和素(Streptavidin)至0.5μg/ml,以100μl/孔加入酶标板,37℃恒温培养箱中静置包被90min;洗板;加入200μl/孔2%牛血清白蛋白(BSA)至板内,置于37℃恒温培养箱内孵育90min;洗板;用2%BSA稀释Biotin-huCGRPaSA至2.0μg/ml,以100μl/孔加入酶标板,37℃恒温培养箱中孵育60min。将对照抗体(47-RM)用稀释液(2%BSA)稀释至2500ng/ml,以4倍梯度依次稀释至0.15ng/ml,嵌合抗体使用细胞上清原液。所有嵌合抗体及对照抗体溶液以80μl/孔加入酶标板中,置37℃恒温培养箱内孵育60min;洗板;将辣根过氧化物酶(HRP)偶联的鼠抗人抗体IgG4(厂家:Southern Biotech,货号:9200-05)(Fc特异性)用2%BSA稀释5000倍,以100μl/孔加入酶标板,置37℃恒温培养箱内孵育60min;洗板;加入显色液TMB 0.1mg/ml,100μl/孔,避免气泡,37℃避光显色10min;最后加2M的盐酸溶液终止反应,100μl/孔,避免气泡,10min内完成酶标仪读数(检测波长450nm;参比波长620nm)。
表3中显示瞬转表达上清液与全长CGRP结合OD>1.6,且蛋白浓度大于10ug/ml的抗体分子,共60个。
表3瞬转表达上清与全长CGRP结合
6.2 ELISA法检测嵌合抗体与片段CGRP(1-19)的结合(细胞液上清)
使用PBS(Hyclone)稀释Streptavidin至0.5μg/ml,以100μl/孔加入酶标板,37℃恒温培养箱中静置包被90min;洗板;加入200μl/孔2%BSA至板内,置37℃恒温培养箱内孵育90min;洗板;用2%BSA稀释Biotin-1-19多肽至2.0μg/ml,以100μl/孔加入酶标板,37℃恒温培养箱中孵育60min。将对照抗体(Lily)用稀释液(2%BSA)稀释至2500ng/ml,以4倍梯度依次稀释至0.15ng/ml,嵌合抗体使用原液。所有嵌合抗体及对照抗体溶液以80μl/孔加入酶标板中,置37℃恒温培养箱内孵育60min;洗板;将辣根过氧化物酶(HRP)偶联的鼠抗人抗体IgG4(厂家:Southern Biotech,货号:9200-05)(Fc特异性)用2%BSA稀释5000倍,以100μl/孔加入酶标板,置37℃恒温培养箱内孵育60min;洗板;加入显色液TMB 0.1mg/ml,100μl/孔,避免气泡,37℃避光显色10min;最后加2M的盐酸溶液终止反应,100μl/孔,避免气泡,10min内完成酶标仪读数(检测波长450nm;参比波长620nm)。
表4中显示瞬转表达上清液与片段CGRP(1-19)结合OD>0.65,且蛋白浓度大于10ug/ml的抗体分子,共14个分子,其中粗体标注的5个分子能与全长CGRP(1-37)结合。
表4瞬转表达上清与片段CGRP结合
6.3 ELISA法检测纯化嵌合抗体与全长(1-37)CGRP的结合(纯抗体)
使用PBS(Hyclone)稀释Streptavidin至0.5μg/mL,以100μl/孔加入酶标板,37℃恒温培养箱中静置包被90min;洗板;加入200μl/孔2%BSA至板内,置37℃恒温培养箱内孵育90min;洗板;用2%BSA稀释Biotin-huCGRPaSA至2.0μg/ml,以100μl/孔加入酶标板,37℃恒温培养箱中孵育60min。将表3中的嵌合抗体及对照抗体(47-RM-20190815)用稀释液(2%BSA)稀释至1000ng/ml,以10倍梯度稀释至1ng/ml。所有嵌合抗体及对照抗体溶液以100μl/孔加入酶标板中,置37℃恒温培养箱内孵育60min;洗板;将辣根过氧化物酶(HRP)偶联的鼠抗人抗体IgG4(厂家:Southern Biotech,货号:9200-05)(Fc特异性)用2%BSA稀释5000倍,以100μl/孔加入酶标板,置37℃恒温培养箱内孵育60min;洗板;加入显色液TMB 0.1mg/ml,100μl/孔,避免气泡,37℃避光显色5min;最后加2M的盐酸溶液终止反应,100μl/孔,避免气泡,10min内完成酶标仪读数(检测波长450nm;参比波长620nm),使用四参数对数回归(4PL)模型拟合EC50。
利用瞬转方法表达表3(6.1)和表4(6.2)筛选出的抗体分子并进行纯化,再利用Elisa方法检测这些抗体分子与全长CGRP的结合活性,表5显示有结合活性的抗体分子以及相对结合活性,参照品为对照抗体(47-RM-20190815),共45个。
表5瞬转纯化抗体分子与全长CGRP结合
6.4荧光素酶法检测嵌合抗体阻断CGRP与CALCRL-RAMP1结合的细胞生物学活性
SK-N-MC CRE 2E9细胞(来源于ATCC的SK-N-MC细胞,公司内部进一步改造以用于荧光素酶法检测)用含10%FBS的MEM完全培养基(Gibco,11095-080)培养,每隔3天传代一次。实验第一天以每孔5×10
利用细胞功能实验检测表4(6.2)和表5(6.3)筛选出的抗体分子阻断CGRP与CALCRL-RAMP1(CGRP受体二聚物)结合的细胞生物学活性,参考品为Teva公司的Fremanezumab,详细结果见表6-1/6-2/6-3和图1/2/3,共13个嵌合抗体相对活性大于70%。
表6-1嵌合抗体阻断CGRP与CALCRL-RAMP1结合的细胞生物学活性(板1)
表6-2嵌合抗体阻断CGRP与CALCRL-RAMP1结合的细胞生物学活性(板2)
表6-3嵌合抗体阻断CGRP与CALCRL-RAMP1结合的细胞生物学活性(板3)
用NCBI Ig-Blast(http://www.ncbi.nlm.nih.gov/projects/igblast/)在种系和重排Ig可变区序列数据库中搜索共有序列。基于Kabat(Wu,T.T及Kabat,E.A.1970J.Exp.Med.,132:211-250)及IMGT系统(Lefranc M.-P.等人,1999Nucleic AcidsResearch,27,209-212),藉由序列批注及藉由基于因特网的序列分析(http://www.imgt.org/IMGT_vquest/vquest和http://www.ncbi.nlm.nih.gov/igblast/)鉴定互补决定区(CDR)氨基酸序列。经选择的抗CGRP鼠源抗体C245的轻链和重链可变区及CDR的氨基酸序列如表7所示。
表7抗CGRP鼠源抗体C245的可变区和CDR氨基酸序列(KABAT方案)
实施例7、抗体可变区的人源化改造
根据实施例6.4的评估结果,分析13个抗CGRP嵌合抗体C258、C245、C85、C92、C71、C97、C48、C347、C125、C74、C255、C177和C79的轻链和重链信息,共选取6条轻链(1A2-LC2、1F5-LC1、2B8-LC2、3C1-LC、3E5-LC和3H10-LC2)和7条重链(1B2-HC、1F5-HC、2A2-HC、2B8-HC1、3C1-HC、3E5-HC和3H10-HC)构建人源化抗体。
对于抗体可变区的人源化改造,首先在NCBI(http://www.ncbi.nlm.nih.gov/igblast/)网站中的人类免疫球蛋白基因数据库搜寻与鼠源抗体可变区的cDNA序列同源的人类种系IgG基因。再由Kabat编号系统定义可变区CDR的氨基酸序列及其精确边界。原则上将与鼠源抗体可变区具有高同源性的人类IGHV及IGKV选为人源化模板,由CDR嫁接实施抗体可变区的人源化。
根据前文获得的杂交瘤细胞分泌的抗体的可变区序列,进行人源化改造。简言之,人源化改造过程涉及以下步骤:
A、将各杂交瘤细胞分泌的抗体的基因序列与人胚胎系抗体基因序列进行比对,找出同源性高的序列;
B、分析考察HLA-DR亲和性,选出亲和力低的人胚胎系框架区序列;
C、利用计算机模拟技术,应用分子对接分析可变区及其周边的框架区氨基酸序列,考察其空间立体结合方式。通过计算静电力、范德华力、亲疏水性和熵值,分析各杂交瘤细胞分泌的抗体的基因序列中可与CGRP作用以及维护空间架构的关键氨基酸个体,将其嫁接到所选择的人胚胎系基因框架区中,并在此基础上标示必须保留的框架区氨基酸位点;
D、以鼠源抗体的三维结构为基础,对包埋残基、与CDR区有直接相互作用的残基,以及对VL和VH的构象有重要影响的残基进行回复突变,并优化导致抗体CDR区化学不稳定的氨基酸残基。优化结果如下,下划线为CDR区域(KABAT方案):
抗CGRP-1F5HC(嵌合):
EVQLQQSGPELVKPGASVKISCKTSGYTFI
CDR1:DFNMH(SEQ ID NO:2)
CDR2-1:YIYPYNGDVVYNQNFTN(SEQ ID NO:3)
CDR2-2:YIYPYNADVVYNQDFTN(SEQ ID NO:110)
CDR3:EGLGGY(SEQ ID NO:4)
抗CGRP-1F5HC-1(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFI
抗CGRP-1F5HC-2(人源化):QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-1F5HC-3(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-1F5HC-4(人源化):
QVQLVQSGSELKKPGASVKVSCKASGYTFT
抗CGRP-1F5HC-5(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFI
抗CGRP-3E5HC(嵌合):
EVQLQQSGPELVKPGASVKISCKTSGYTFT
CDR1:DYNMH(SEQ ID NO:11)
CDR2-1:YISPYNGGTAYNQKFKF(SEQ ID NO:12)
CDR2-2:YISPYNAGTAYNQKFKF(SEQ ID NO:111)
CDR3:EGLGGY(SEQ ID NO:13)
抗CGRP-3E5HC-1(人源化):
QVQLVQSGAEVKKPGASVKVSCKTSGYTFT
抗CGRP-3E5HC-2(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-3E5HC-3(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-3E5HC-4(人源化):
QVQLVQSGAEVKKPGASVKVSCKTSGYTFT
抗CGRP-2B8HC1(嵌合):
EVQLQQSGPELVKPGASVKISCKASGYTFT
CDR1:DYNMH(SEQ ID NO:19)
CDR2-1:NIYPYNGGTVYNQKFNN(SEQ ID NO:20)
CDR2-2:NIYPYNAGTVYNQKFNN(SEQ ID NO:112)
CDR3:EGLGGY(SEQ ID NO:21)
抗CGRP-2B8HC1-1(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-2B8HC1-2(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-2B8HC1-3(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-2A2HC(嵌合):
EVQLQQSGPELVKPGASVKISCKASGYTFT
CDR1:DYNMH(SEQ ID NO:26)
CDR2:YVYPYNGGSAYNQKFKS(SEQ ID NO:27)
CDR3:EGLGGY(SEQ ID NO:28)
抗CGRP-2A2HC-1(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-1B2HC(嵌合):
EVQLQQSGPEVVKPGASVRISCQASGYTFT
CDR1:DYNMH(SEQ ID NO:31)
CDR2:YIFPYNGVAVYNRKFRS(SEQ ID NO:32)
CDR3:EGLGGY(SEQ ID NO:33)
抗CGRP-1B2HC-1(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-1B2HC-2(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-3H10HC(嵌合):
EVQLQQSGPELVQPGASVKISCKASGYTFT
CDR1:DYNMH(SEQ ID NO:37)
CDR2:YIYPYNGHTVYNQKFRN(SEQ ID NO:38)
CDR3:EGLGGY(SEQ ID NO:39)
抗CGRP-3H10HC-1(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-3H10HC-2(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-3C1HC(嵌合):
EVQLQQSGPELVKPGASMKISCKASGYSFT
CDR1:GYTMN(SEQ ID NO:43)
CDR2:LINPYIGNTHYNQKFKD(SEQ ID NO:44)
CDR3:ELDSGFDY(SEQ ID NO:45)
抗CGRP-3C1HC-1(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYSFT
抗CGRP-3C1HC-2(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-3C1HC-3(人源化):
QVQLVQSGSELKKPGASVKVSCKASGYTFT
抗CGRP-3C1HC-4(人源化):
QVQLVQSGAEVKKPGASVKVSCKASGYTFT
抗CGRP-1A2LC2(嵌合):
DIVLTQSPASLAVSLGQRATISC
CDR1:KASQNIDYDGYAYLN(SEQ ID NO:51)
CDR2:SVFNLES(SEQ ID NO:52)
CDR3:QQSNEFPYT(SEQ ID NO:53)
抗CGRP-1A2LC2-1(人源化):
DIVLTQSPASLAVSPGQRATITC
抗CGRP-1A2LC2-2(人源化):
DIVLTQSPASLAVSPGQRATITC
抗CGRP-1A2LC2-3(人源化):
EIVLTQSPATLSLSPGERATLSC
DIQLTQSPSFLSASVGDRVTITC
抗CGRP-1F5LC1(嵌合):
DIVLTQSPASLAVSLGQRATISC
CDR1:KASQNIDFDGYAYMN(SEQ ID NO:59)
CDR2:SVFNLES(SEQ ID NO:60)
CDR3:QQSHEVPYT(SEQ ID NO:61)
抗CGRP-1F5LC1-1(人源化):
EIVLTQSPATLSLSPGERATLSC
抗CGRP-1F5LC1-2(人源化):
EIVLTQSPATLSLSPGERATLSC
抗CGRP-1F5LC1-3(人源化):
DIVLTQSPASLAVSPGQRATITC
抗CGRP-1F5LC1-4(人源化):
DIVLTQSPDSLAVSLGERATINC
抗CGRP-2B8LC2(嵌合):
DVVLTQSPTSLAVSLGQRATISC
CDR2:SIFNLES(SEQ ID NO:68)
CDR3:QQSNDYPYT(SEQ ID NO:69)
抗CGRP-2B8LC2-1(人源化):
DIVLTQSPDSLAVSLGERATINC
抗CGRP-2B8LC2-2(人源化):
DVQLTQSPSFLSASVGDRVTITC
抗CGRP-3C1LC(嵌合):
DVLMTQTPLSLPVSLGDQASLSC
CDR1-1:RSSQNIVHSNGDTYLE(SEQ ID NO:73)
CDR1-2:
CDR2:KVSNRFS(SEQ ID NO:74)
CDR3:YQGSHVPWT(SEQ ID NO:75)
抗CGRP-3C1LC-1(人源化):
DVVMTQSPLSLPVTLGQPASISC
抗CGRP-3C1LC-2(人源化):
DVVMTQTPLSLSVTPGQPASISC
抗CGRP-3C1LC-3(人源化):
DVVMTQSPDSLAVSLGERATINC
抗CGRP-3C1LC-4(人源化):
DVVMTQSPDSLAVSLGERATINC
抗CGRP-3E5LC(嵌合):
DIVLTQSPASLAVSLGQRATISC
CDR1:KASQNIDYDGYTYLN(SEQ ID NO:81)
CDR2:SIFNLES(SEQ ID NO:82)
CDR3:QQSNEVPYT(SEQ ID NO:83)
抗CGRP-3E5LC-1(人源化):
DIVLTQSPDSLAVSLGERATINC
抗CGRP-3H10LC2(嵌合):
DIVLTQSPDSLAVSLGQRATISC
CDR1:KASQNIDYGGYSYMN(SEQ ID NO:86)
CDR2:SVFNLES(SEQ ID NO:87)
CDR3:QQSNEAPYT(SEQ ID NO:88)
抗CGRP-3H10LC2-1(人源化):
DIVLTQSPDSLAVSLGERATINC
抗CGRP-3H10LC2-2(人源化):
DIQLTQSPSSLSASVGDRVTITC
Hu224 LC:
DVVMTQSPDSLAVSLGERATINCRSSQNIVHSNGDTYLEWYQQKPGQPPKLLIYKVSNRFSGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCYQGSHVPWTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(SEQ ID NO:91)
Hu224HC:
QVQLVQSGAEVKKPGASVKVSCKASGYSFTGYTMNWVRQAPGQRLEWMGLINPYIGNTHYNQKFKDRVTFTVDRSSSTAYMELSSLRSEDTAVYYCARELDSGFDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQID NO:92)
Hu228LC:
DVVMTQSPDSLAVSLGERATINCRSSQNIVHSNGDTYLEWYQQKPGQPPKLLIYKVSNRFSGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCYQGSHVPWTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(SEQ ID NO:93)
Hu228HC:
QVQLVQSGAEVKKPGASVKVSCKASGYTFTGYTMNWVRQAPGQRLEWMGLINPYIGNTHYNQKFKDRVTFTVDRSSSTAYMELSSLRSEDTAVYYCARELDSGFDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQID NO:94)
Hu231LC:
DVVMTQTPLSLSVTPGQPASISCRSSQNIVHSNGDTYLEWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCYQGSHVPWTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(SEQ ID NO:95)
Hu231HC:
QVQLVQSGSELKKPGASVKVSCKASGYTFTGYTMNWVRQAPGQGLEWMGLINPYIGNTHYNQKFKDRFVFSVDRSSSTAYLQISSLKAEDTAVYYCARELDSGFDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQID NO:96)
将上文设计的人源化抗CTLA-4抗体可变区进行各种组合,其中来自于嵌合抗体C245的四条人源化轻链(3C1LC)和四条人源化重链(3C1HC)内部组合,获得237种人源化抗CGRP抗体,其编号和氨基酸序列具体见表8。将上述人源化后的可变区与恒定区序列连接以制备全长抗体。
重链恒定区:
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:108)
轻链恒定区:
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(SEQ ID NO:109)
实施例8、人源化抗CGRP抗体的筛选
根据表8(实施例7)中的人源化抗体与全长(1-37)CGRP结合的能力以及阻断CGRP与CALCRL-RAMP1结合的细胞生物学活性,筛选最佳人源化抗体。实验方法和结果如下所示。
8.1 ELISA法检测人源化抗体与全长CGRP(1-37)的结合(细胞液上清)
使用PBS(Hyclone)稀释Biotin CGRPaSA至1.0μg/mL,以100μl/孔加入酶标板,37℃恒温培养箱中静置包被90min;洗板;加入200μl/孔2%BSA至板内,置37℃恒温培养箱内孵育90min;洗板。将表8中的人源化抗体及对照抗体(嵌合抗体C245)用稀释液(2%BSA)稀释至1000ng/ml,每次稀释倍数不高于10倍。然后,在样品稀释板上以2.5倍梯度依次稀释嵌合抗体及对照抗体。所有嵌合抗体及对照抗体溶液以100μl/孔加入酶标板中,置37℃恒温培养箱内孵育60min;洗板;将辣根过氧化物酶(HRP)偶联的羊抗人抗体IgG(厂家:Sigma,货号:A0170)(Fc特异性)用2%BSA稀释5000倍,以100μl/孔加入酶标板,置37℃恒温培养箱内孵育60min;洗板;加入显色液TMB,100μl/孔,避免气泡,37℃避光显色15min;最后加2M的盐酸溶液终止反应,100μl/孔,避免气泡,10min内完成酶标仪读数(波长:450/620nm)。
以嵌合抗体C245为参考品,表9中显示与瞬转表达上清液与全长CGRP(1-37)结合活性。
8.2荧光素酶法检测人源化抗体阻断CGRP与CALCRL-RAMP1结合的细胞生物学活性
SK-N-MC CRE 2E9细胞用含10%FBS的MEM完全培养基(Gibco,11095-080)培养,每隔3天传代一次。实验第一天以每孔5×10
在保证轻重链的多样性前提下,从表9(8.1)中选择44个抗体分子,利用细胞功能实验检测抗体分子阻断CGRP与CALCRL-RAMP1结合的细胞生物学活性,对照抗体为Teva公司的Fremanezumab以及嵌合抗体C245,以筛选出阻断活性较好的人源化抗体,详细结果见表10和图4/5/6。综合评价,人源化抗体分子hu66、hu71、hu131、hu224、hu228和hu231具有较好的抑制活性。人源化抗体分子hu66、hu71、hu131、hu224、hu228和hu231的可变区和CDR氨基酸序列编号见表11。
表10嵌合抗体阻断CGRP与CALCRL-RAMP1结合的细胞生物学活性
/>
表11抗人CGRP人源化抗体的可变区和CDR氨基酸序列(KABAT方案)
/>
实施例9、嵌合抗CGRP抗体对大鼠辣椒素血管扩张的抑制
实施例6.4中筛选到13体外药效大于70%的嵌合抗体分子,经过分析这些抗体包含的轻重链,选择C48、C85、C97、C125、C245、C258和C347等7个嵌合抗体分子进行体内药效实验。利用大鼠辣椒素血管扩张模型评估其体内药效,发现C245具有优于Teva参考品的能抑制辣椒素诱导皮肤血管扩张的作用,且该作用在SD大鼠中能够持续至少5天。
选择72只雄性SD大鼠(斯贝福(北京)生物技术有限公司),通过经皮给予辣椒素构建大鼠局部血流增加模型,根据动物体重随机分为9个组,每组8只动物,分别为模型对照组、Ref(Teva,Fremanezumab)组、C48组、C85组、C97组、C125组、C245组、C258组、C347组进行皮下给药;各组的给药剂量均为10mg/kg,给药体积为10mL/kg模型对照组给予等体积的生理盐水,各组均只给药1次;在给药2天和4天后,各组动物采用戊巴比妥钠进行麻醉后,在腹部中线两侧用记号笔画一直径约为8mm的O-型圈,O-型圈避开明显可见血管的区域,在一侧圈内给以4μL辣椒素(1mg)溶液,并涂抹均匀,另一侧不进行处理,分别在给予辣椒素前及给予辣椒素后5min、10min和20min分别采集O型圈内的皮肤血流量数据,根据各时间点血流量数据计算血流综合变化率和血流增长抑制率。
给药2天后,模型对照组动物在接受辣椒素处理,血流出现明显上升,在辣椒素处理20min后其血流综合变化率达到46.0±5.4%;C258组和C347动物在辣椒素处理,其血流综合变化率相对于模型对照组出现一定的上升趋势;Ref(Teva,Fremanezumab)组、C48组、C85组、C97组和C125组动物在整个辣椒素处理后的20min观察期内血流综合变化率相对于模型对照组有较小幅度的降低;C245组动物血流综合变化率相对于模型对照组有较大程度的降低,在辣椒素处理5min后,C245组动物血流综合变化率为21.97±3.46%,血流增长抑制率达到45.72±8.54%,随着观察时间的延长,C245组动物的血流进一步降低。至辣椒素处理20min后,C245组动物血流综合变化率为17.81±5.80%,血流增长抑制率达到61.25±12.63%。
给药4天后,模型对照组动物在接受辣椒素处理后血流综合变化率在50%左右;C347组动物在接受辣椒素处理后其血流相对于模型对照组有一定的升高的趋势;C48组、C85组动物血流、C97组和C125组动物血流相对于模型对照组有较小幅度的降低趋势,但是其血流抑制率相对于给药2天后整体有不同程度的降低;C258组动物血流综合变化率相对于模型对照组也出现较小幅度的降低,其血流增长抑制率相对于给药2天后有一定的升高;C245组动物血流综合变化率相对于模型对照组有较大程度的降低,在辣椒素处理5min后,C245组动物血流综合变化率为26.75±4.41%,血流增长抑制率达到45.88±8.92%。C245组动物血流随着观察时间的延长有一定上升的趋势,至辣椒素处理20min后,该组动物的血流增长抑制率为36.40±5.10%。详细实验结果见图7-1至图7-4。C245和对照抗体Ref(Teva,Fremanezumab)血流综合变化率和血流增长抑制率结果见表12。
表12 C245和对照抗体血流综合变化率和血流增长抑制率结果
实施例10、人源化抗CGRP抗体对大鼠辣椒素血管扩张的抑制
实施例8.2中筛选到6个具有良好体外药效的人源化抗体分子,利用大鼠辣椒素血管扩张模型进一步评估其体内药效,发现hu224、hu228和hu231具有抑制辣椒素诱导的皮肤血管扩张作用,且该作用在SD大鼠中能够持续至少4天。
选择64只雄性SD大鼠(斯贝福(北京)生物技术有限公司,Sprague Dawley),通过经皮给以辣椒素构建大鼠局部血流增加模型,根据动物体重随机分为8个组,每组8只动物,分别为模型对照组、Ref(Teva,Fremanezumab)组、hu66组、hu71组、hu131组、hu231组、hu224组和hu228组进行皮下给药;各组的给药剂量均为10mg/kg,给药体积为10mL/kg,模型对照组给予等体积的生理盐水,各组均只给药1次;在给药2天和4天后,各组动物采用戊巴比妥钠进行麻醉后,在腹部中线两侧用记号笔画一直径约为8mm的O-型圈,O-型圈避开明显可见血管的区域,在一侧圈内给以4μL辣椒素(1mg)溶液,并涂抹均匀,另一侧不进行处理,分别在给以辣椒素前及给以辣椒素后5min、10min和20min分别采集O型圈内的皮肤血流量数据,根据各时间点血流量数据计算血流综合变化率和血流增长抑制率。
给药2天后,模型对照组动物在接受辣椒素处理5min后血流综合变化率达到47.55±8.14%,随着时间的延长该组动物血流出现一定上升的趋势,在20min后其血流综合变化率达到57.00±4.71%;hu71组和hu131组动物在辣椒素处理后,其血流综合变化率相对于模型对照组出现一定的上升趋势;hu66组动物在整个20min观察期内血流综合变化率相对于模型对照组有较小幅度的降低;Ref(Teva,Fremanezumab)组、hu231组、hu224和hu228组动物血流综合变化率相对于模型对照组有较大程度的降低,在辣椒素处理5min后,Ref(Teva,Fremanezumab)组、hu231组、hu224组和hu228组动物血流综合变化率分别为30.86±8.35%、25.91±5.97%、23.1±6.38%和28.94±7.58%,血流增长抑制率分别达到35.09±17.56%、45.52±12.55%、51.43±13.43%和39.14±15.94%,随着观察时间的延长,以上各组动物的血流进一步降低。至辣椒素处理20min后,Ref(Teva,Fremanezumab)组、hu231组、hu224和hu228组动物血流综合变化率分别24.61±9.68%、9.94±8.17%、9.37±8.43%和14.84±10.1%,其中hu231组、hu224和hu228血流综合变化率显著低于模型对照组(P≤0.05)。
给药4天后,模型对照组动物在接受辣椒素处理后血流综合变化率始终在50%以上;hu66、hu71组和hu131组动物在接受辣椒素处理后其血流相对于模型对照组有一定的升高的趋势;与D2相似,Ref(Teva,Fremanezumab)组、hu231组、hu224组和hu228组动物血流综合变化率相对于模型对照组有较大程度的降低,且随着时间的延长,血流综合变化率的降低幅度逐渐增大。详细实验结果见图8-1至图8-4。hu231,hu224,hu228和对照抗体Ref(Teva,Fremanezumab)血流综合变化率和血流增长抑制率结果见表13。
表13 hu231,hu228,hu224和对照抗体血流综合变化率和血流增长抑制率结果
实施例11、人源化抗CGRP抗体对大鼠电刺激闭合颅窗诱导的脑膜中动脉(MMA)血管扩张的抑制
实施例12中筛选到3个具有良好体外药效的人源化抗体分子hu224、hu228和hu231,利用电刺激闭合颅窗诱导偏头痛SD大鼠中脑膜动脉直径(middle meningealartery,MMA)及平均动脉压进一步评估其体内药效,发现hu224、hu228和hu231具有抑制电刺激闭合颅窗诱导的脑膜动脉血管扩张作用,且该作用在SD大鼠中能够持续至少120min。
选择40只雄性SD大鼠(维通利华实验动物技术有限公司),给药前一天,根据动物体重随机分为5个组,每组8只动物,分别为溶媒组组、舒马曲坦组、hu224组、hu228组、hu231组进行皮下给药;各组的给药剂量均为10mg/kg,给药体积为10mL/kg,溶媒组给予等体积的生理盐水,曲马舒坦组于第一次电刺激后5min给药,各组均只给药1次;在给药24h后,动物由舒泰/噻拉秦复合腹腔注射深度麻醉后,置于恒温毯;动物行气管插管连接小动物呼吸机以保证造模及记录过程中呼吸平稳,行股动脉插管记录平均动脉压;将动物固定于脑立体定位仪,暴露颅骨,并用牙科钻打薄脑膜中动脉上方颅骨至可见脑膜中动脉,建立闭合颅窗(10X7mm2);术后恢复45-60min,MMA直径稳定后,经双极电极于闭合颅窗(脑膜中动脉旁约200μm)给予电刺激,溶媒、阳性化合物组及化合物组刺激条件为:刺激强度为20V,10HZ,波宽0.5ms,刺激30s。于电刺激前,测量MMA直径并记录5min平稳股动脉压力;电刺激结束后,分别记录30min,60min,90min,120min(4个时间点)的股动脉压力变化及MMA直径。
电刺激30min、60min、90min、120min后,溶媒组动物脑膜中动脉(MMA)直径显著性扩张,表明电刺激闭合颅窗诱发偏头痛模型成功;溶媒组、舒马曲坦和待测抗体组中动物的平均动脉压均未见显著变化。舒马曲坦和待测抗体对电刺激诱导MMA血管扩张均有明显抑制作用。详细结果见图9/10。
实施例12、嵌合抗体以及人源化抗体与CGRP结合表位鉴定
使用Octet RBD 96e仪器检测C245 Fab(来源于C245抗体的Fab单体片断)与六种人CGRP alpha合成多肽片段(多肽1-13,多肽1-19,多肽1-37,多肽8-19,多肽8-26,多肽13-24)的结合动力学参数。分别在SA生物探针(Sartorius公司,货号18-5019)表面上固化不同浓度的人CGRP合成多肽片段,其使用浓度如下:hCGRP(1-13)为46.5nM,CGRP(1-19)为8.5nM,hCGRP(1-37)为15.5nM,hCGRP(8-19)为8.5nM,hCGRP(8-26)为15.5nM,hCGRP(13-24)为46.5nM。将固化后的人CGRP合成多肽片段与45nM的C245 Fab结合,使用分析软件拟合结合解离曲线。
使用Octet RBD 96e仪器检测hu224 Fab(来源于hu224人源化抗体的Fab单体片断)与四种人CGRP alpha合成多肽片段(多肽1-13,多肽1-19,多肽1-37,多肽8-19)的结合动力学参数。分别在SA生物探针(Sartorius公司,货号18-5019)表面上固化不同浓度的人CGRP合成多肽片段,其使用浓度如下:CGRP(1-19)为8.5nM,hCGRP(1-37)为15.5nM,hCGRP(8-19)为10nM,hCGRP(8-26)为15.5nM。将固化后的人CGRP合成多肽片段与45nM的hu224Fab结合,使用分析软件拟合结合解离曲线。
人CGRP alpha合成多肽片段的分子序列如下:
hCGRP(1-13)合成多肽片段分子序列为Biotin-Linker(G
hCGRP(1-19)合成多肽片段分子序列为Biotin-Linker(G
hCGRP(1-37)合成多肽片段分子序列为Biotin-Linker(G
hCGRP(8-19)合成多肽片段分子序列为Biotin-Linker(G
hCGRP(8-26)合成多肽片段分子序列为Biotin-Linker(G
hCGRP(13-24)合成多肽片段分子序列为Biotin-Linker(G
上述人CGRP片段的氨基酸序列汇总在表15。
C245 Fab和六种人CGRP合成多肽片段结合的动力学参数见表14,动力学特征参数检测结果见图11。
hu224 Fab和四种人CGRP合成多肽片段结合的动力学参数见表14,动力学特征参数检测结果见图12。
对于C245 Fab,使用的四种多肽片断hCGRP(1-19)、hCGRP(1-37)、hCGRP(8-19)、hCGRP(8-26)皆有结合活性,其中全长的hCGRP(1-37)多肽与最短的hCGRP(8-19)多肽片段的亲和力KD分别为2.487E-10M和2.523E-10M,两者亲和力相似,推测人CGRP中8-19位氨基酸是C245抗体与人CGRP抗原的主要结合表位。将人CGRP中8-19位氨基酸的中心,选取13位氨基进行拆分而合成得到hCGRP(1-13)和hCGRP(13-24)多肽片段后检测亲和力,分别表现为亲和力下降100倍和结合活性完全消失的特性,从而推测人CGRP中8-19位氨基酸的完整性对于C245抗体结合有重要作用。
对于来源于人源化抗体的hu224 Fab,使用的四种多肽片段hCGRP(1-19)、hCGRP(1-37)、hCGRP(8-19)、hCGRP(8-26)皆有结合活性,其中全长的hCGRP(1-37)多肽与最短的hCGRP(8-19)多肽片段的亲和力KD分别为2.882E-10M和4.447E-10M,两者亲和力相似,推测人CGRP中8-19位氨基酸是抗体与人CGRP抗原的主要结合表位。
表14 C245 Fab和六种人CGRP合成多肽片段的结合的动力学参数
备注:KD为亲和力常数;Kon为抗原抗体结合速率;Kdis为抗原抗体解离速率;KD=Kdis/Kon
表15人α-CGRP片段和相关肽的氨基酸序列
实施例13、pH依赖性抗原结合检测
使用Octet RBD96e仪器检测三种抗体Hu224、Galcanezumab Analogue和Fremanezumab Analogue在不同pH(7.4和5.5)溶液中与抗原人α-CGRP的结合解离性质。pH7.4缓冲液包含10mM HEPES(pH 7.4),150mM氯化钠,3mM EDTA和0.05%P20。pH 5.5缓冲液包含10mM NaAc(pH 5.5)、150mM氯化钠和0.05%P20。在AHC2生物探针(Sartorius公司,货号18-5142)表面上分别固化10μg/mL的三种抗体Hu224、Galcanezumab Analogue和Fremanezumab Analogue,在0~200s的抗原结合阶段使用稀释在不同pH(7.4和5.5)缓冲液中的50nM人α-CGRP与抗体结合,在0~200s的抗原解离阶段使用不同pH(7.4和5.5)缓冲液进行冲洗。条件分别为pH7.4结合且pH7.4解离、pH7.4结合且pH5.5解离、pH5.5结合且pH5.5解离。使用分析软件计算抗原在进样200s时的结合信号,并拟合解离常数kd。人α-CGRP合成多肽片段氨基酸序列为ACDTATCVTHRLAGLLSRSGGVVKNNFVPTNVGSKAF(SEQ ID NO:97)-NH2。C端末尾(F-NH2是指Phenylalanine Amide,即在末尾形成CONH2结构)。第7位与第12位的CYS理论上形成1个链内二硫键。
从图13和表16数据可以看出,在pH5.5条件下,Hu224抗体相对于Galcanezumab和Fremanezumab显示出明显的解离现象。在胞内低pH条件下,Hu224抗体与CGRP亲和力低,高解离率可以加速抗体的再循环,即解离的抗体被FcRn捕获循环到细胞外,在胞外中性pH环境下抗体被释放,由此增加抗体在血液中的停留时间,延长抗体半衰期。食蟹猴的PK数据也显示本发明的抗CGRP抗体相对于Galcanezumab具有更长的半衰期,可以预测本发明的抗CGRP抗体在体内药效持续时间会更长。
表16:抗体与抗原人α-CGRP在不同pH条件下的结合解离性质总结表
/>
