结合CD206的笼状蛋白及其应用
文献发布时间:2024-04-18 20:00:50
技术领域
本公开属于具有主动靶向性的蛋白载体领域。具体地,本公开涉及一种结合CD206的笼状蛋白及其应用,涉及用于CD206靶点相关的示踪、诊断和治疗。
背景技术
肿瘤相关巨噬细胞(TAMs)几乎存在于所有肿瘤中,是肿瘤微环境的重要组成部分。TAMs分为两种:抑制肿瘤的M1型和促进肿瘤的M2型。M1型TAM较多地发现于肿瘤形成的早期,在1型辅助T细胞(Th1)和自然杀伤细胞(NK cells)分泌的IFNγ及IL-12的刺激下,肿瘤组织浸润的巨噬细胞主要向M1型TAM分化,并分泌多种促炎细胞因子(proinflammatorycytokines)如TNFα,IFNγ等,抑制肿瘤的生长。而在肿瘤形成晚期,肿瘤组织中浸润的巨噬细胞主要以M2型TAM为主,它促进肿瘤生长,血管的新生,在肿瘤的侵袭、转移和免疫逃逸中发挥重要作用。临床研究发现,实体瘤包括乳腺癌,胰腺癌,肺癌等在内,癌症组织中M1型TAM的数目或M1/M2TAM的比例越大,肿瘤的预后效果越好。因此,提高M1型TAM的数目或M1/M2TAM的比例成为肿瘤免疫治疗的新兴研发热点之一。此外,除了肿瘤,巨噬细胞还与II型糖尿病、炎症反应等多种其它疾病相关,
在此背景下,开发一种能够靶向和调节炎症部位巨噬细胞功能的高效递送平台将对巨噬细胞相关的多种疾病的治疗、诊断带来巨大裨益。而开发靶向M2型TAM递送平台是通过示踪、调节M2型TAM来实现对肿瘤及多种疾病中的诊断或治疗,在巨噬细胞机制相关的药物开发中具有巨大的潜力。目前,主要借助靶向M2型TAM的表面标志物来达到治疗和诊断的目的。M2型TAM的表面标志物主要有CD206、CD68、CD163等,其中CD206为甘露糖受体,识别病原微生物表达的蛋白多糖,清除外来有害物质。与常用标志物CD68相比,CD206对巨噬细胞选择性更强,故其可作为M2型巨噬细胞高特异性标志物。CD206具有高度特异性,与肿瘤细胞的增殖和转移密不可分。已有研究表明CD206与乳腺癌、卵巢癌、胰腺癌、前列腺癌等恶性肿瘤密切相关,CD206被报道在M2型TAMs转化为M1型TAMs中发挥重要作用,可通过调节CD206通路将M2型TAMs转化为M1型TAMs。Rudloff等人用合成肽RP-182结合CD206受体,从而引起这种受体结构的变化,激活了信号通路,将M2巨噬细胞转化为M1巨噬细胞,这些重编程的M2巨噬细胞吞噬了肿瘤细胞,同时也激活一系列其他的免疫细胞来帮助抵抗癌症。而由于小肽分子量小,半衰期和有效浓度均存在劣势,而可解决该问题的靶向载体系统的开发还是本领域的空白。因此,本领域迫切需要开发一种能够高效靶向巨噬细胞的靶向载体系统,从而对巨噬细胞进行诊断和/或递送药物。
目前的靶向载体系统中,纳米载体系统越来越引发关注,其中铁蛋白(Ferritin)即为具备巨大潜力的纳米载体系统。铁蛋白是一种约450kDa的大蛋白,由24个亚基自组装成球形笼状蛋白结构,其内部和外部尺寸分别为大约8nm和大约12nm。铁蛋白本身具有主动靶向性,可与转铁蛋白受体(TfR1)结合。同时,铁蛋白也具有被动靶向性,即它的小粒径赋予其在实体瘤中更好的通透性和滞留效应(EPR),可到达肿瘤组织深处。基于上述两种特性,目前已有研究将铁蛋白在肿瘤领域中用作各种生物活性分子的运送载体,发挥诊断,影像示踪及治疗作用。不仅如此,通过对铁蛋白进行突变、改造、修饰等,可以进一步拓宽其作为载体系统的用途,如通过偶联、重组融合表达、内包等方法,均可赋予铁蛋白以更多的生物功能,包括靶向功能。其中,通过将功能性蛋白(如抗体片段、能够与受体结合的配体肽、小分子肽药物、细胞凋亡前肽、荧光蛋白等)以重组的方式表达于铁蛋白笼状结构外部,可赋予铁蛋白以主动靶向性、示踪性或治疗性(融合方式构建的文献参见:WO2017039382A1,WO2016122259A1,KR-2018008349,WO2013055058A2,WO2018012952A1,CN104017088A,“Khoshnejad M,et al.Ferritin nanocages with biologically orthogonalconjugation for vascular targeting and imaging.Bioconjug Chem.2018;29(4):1209-1218.”等)。与抗体相比,通过重组表达的方式获得铁蛋白融合蛋白,具有经济、快捷、稳定、多价、等优势,具有良好的运送载体开发潜力和成药性。目前,还未见有关于靶向M2型TAM的铁蛋白融合蛋白的研究报道。
发明概述
本公开利用铁蛋白作为运送载体的独特优势,将具有结合CD206活性的肽段的编码序列与重链铁蛋白单体亚基或其变体的编码序列连接,或插入重链铁蛋白单体亚基或其变体编码序列中间,从而表达获得多个具有结合CD206活性的融合蛋白,所述的融合蛋白能够自组装成为24聚体,从而形成在铁蛋白表面能展示多个具有结合CD206活性的肽段的多价笼状蛋白,该笼状蛋白对CD206有主动靶向性,可靶向CD206阳性细胞,发挥诊断、示踪和治疗作用。本公开的笼状蛋白比靶向CD206的小肽更稳定,半衰期延长,单分子结合位点更多,且可以作为多种功能分子的载运平台系统,包载、偶联不同种类和数目的生物活性部分,满足更高诊断、治疗要求。
本公开提供了若干与CD206具有结合亲和力的肽段或其变体,其具有与CD206结合的活性。
本公开用于构建融合蛋白的重链铁蛋白单体亚基序列或其变体,指可以选自铁蛋白野生型序列,也可选自突变体序列,所述突变体能够减少聚集体生成、提高蛋白可溶性表达和组装成功率。
本公开提供了若干连接方式,将CD206结合肽段序列与重链铁蛋白的单体亚基或其变体序列重组表达为融合蛋白,该融合蛋白自组装成为笼状蛋白后,所述CD206结合肽段能够展示在铁蛋白外表面。
具体来说,本公开提出了如下技术方案:
在第一方面,本公开提供一种融合蛋白,所述融合蛋白包含:
(1)具有结合CD206活性的肽段;
(2)重链铁蛋白单体亚基或其变体;
在某些实施方式中,其中所述融合蛋白包含选自SEQ ID NO:14-17之一所示的氨基酸序列。
在第二方面,本公开提供一种多肽缀合物,其包含第一方面所述的融合蛋白,和与融合蛋白缀合的生物活性部分。
在第三方面,本公开提供一种笼状蛋白,其包含至少一个第一方面所述的融合蛋白,和/或至少一个第二方面所述的多肽缀合物,和/或铁蛋白单体亚基或其变体,且其中所述笼状蛋白在其表面上展示所述具有结合CD206活性的肽段,所述具有结合CD206活性的肽段能够结合CD206,使得该笼状蛋白具有结合CD206的活性。
在第四方面,本公开提供一种生产第一方面所述的融合蛋白、或第三方面所述的笼状蛋白的方法。
在第五方面,本公开提供一种第二方面所述的多肽缀合物的制备方法。
在第六方面,本公开提供一种笼状蛋白-API复合物,所述笼状蛋白-API复合物包含第三方面所述的笼状蛋白,以及装载在所述笼状蛋白内部的活性药物成分(activepharmaceutical ingredient,简称API)。
在第七方面,本公开提供包含第一方面的所述融合蛋白、或第二方面所述的多肽缀合物、或第三方面所述的笼状蛋白和/或第六方面所述的笼状蛋白-API复合物的组合物。
在第八方面,本公开提供了一种核酸分子。
在第九方面,本公开提供了一种重组细胞。
在第十方面,本公开提供了前述融合蛋白、多肽缀合物、笼状蛋白、笼状蛋白-API复合物、组合物或核酸分子和/或重组细胞在制备药物、诊断试剂、示踪试剂中的用途。
与现有技术相比,本公开具有如下有益效果:
(1)本公开构建的融合蛋白能够自组装形成笼状蛋白,具有结合CD206活性的肽段负载于铁蛋白笼状蛋白外表面,能够主动靶向细胞表面表达CD206的细胞,包括M2型巨噬细胞、树突细胞等。笼状蛋白单独或联合其他治疗分子后,在肿瘤治疗领域,具备将M2型TAM转化为M1型细胞,从而杀伤肿瘤细胞的潜力;加载诊断标签或示踪分子后,在诊断示踪领域,可诊断、示踪肿瘤前哨淋巴结所在位置,用于外科手术中准确定位前哨淋巴结。
(2)赋予铁蛋白新的主动靶向功能,同时比目前的CD206靶向肽更稳定,体内半衰期延长。
一个笼状蛋白上能够载带多个具有结合CD206活性的肽段,同时还可以进一步通过化学偶联方式加载治疗、诊断、示踪分子,提供了单分子多价的综合治疗、诊断、示踪方案。
(3)本公开构建的融合蛋白中的铁蛋白来自于人体自身的蛋白,因此药物自身免疫原性低,减小对免疫系统刺激。
(4)本公开用大肠杆菌表达系统获得的融合蛋白,能够简单、高产量的自组装形成具有结合活性的笼状蛋白,制备方法比抗体制备简单,成本大幅降低,易操作,具有高成药价值和产业化价值。
附图说明
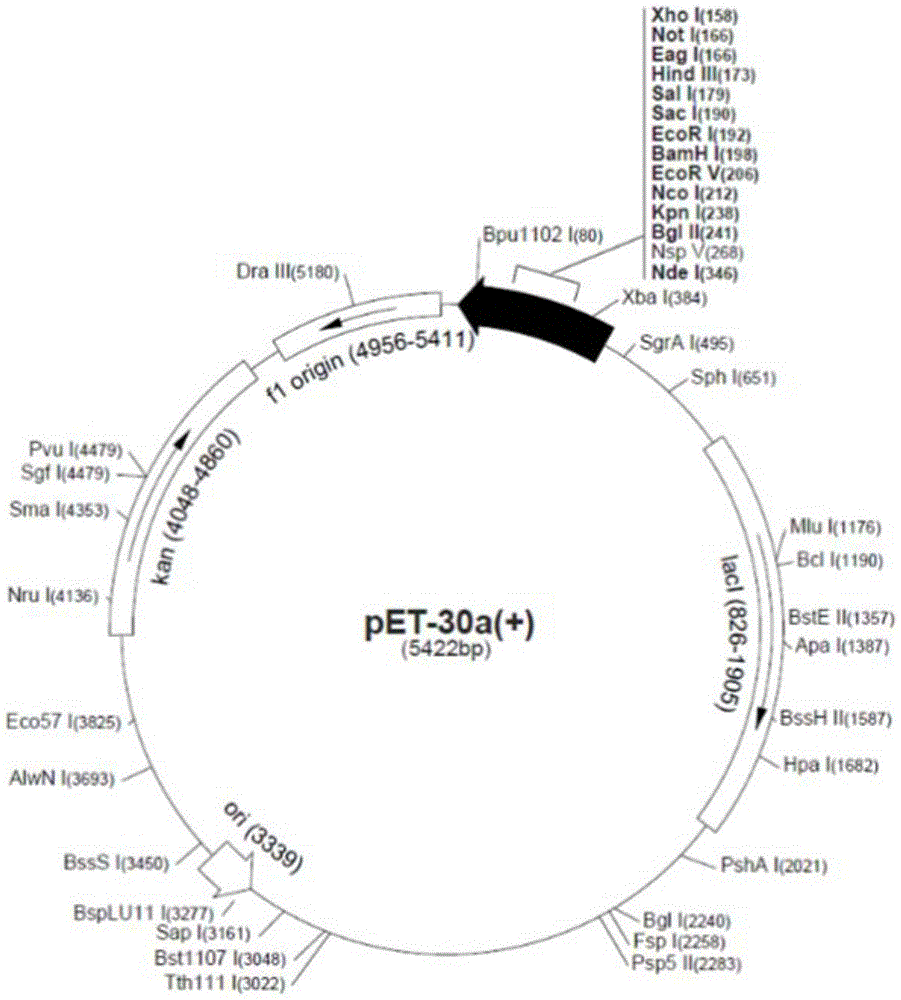
图1.示出用于融合蛋白表达的pET-30a的质粒图。
图2.示出载带融合蛋白编码基因质粒的酶切图谱。
图3.示出HFn-CD206-1表达的SDS-PAGE结果。
图4.示出HFn-CD206-2、HFn-CD206-3表达的SDS-PAGE结果。
图5.示出HFn-CD206-4表达的SDS-PAGE结果。
图6.示出HFn-CD206-4的SEC结果。
图7.示出HFn-CD206-1的SEC结果。
具体实施方式
术语
在本公开中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的蛋白质和核酸化学、分子生物学、细胞和组织培养、微生物学、免疫学相关术语和实验室操作步骤均为相应领域内广泛使用的术语和常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
“包含”一词在本文中用于描述蛋白质或核酸的序列时,所述蛋白质或核酸可以是由所述序列组成,或者在所述蛋白质或核酸的一端或两端可以具有额外的氨基酸或核苷酸,但仍然具有本公开所述的活性。此外,本领域技术人员清楚多肽N端由起始密码子编码的甲硫氨酸在某些实际情况下(例如在特定表达系统表达时)会被保留,但不实质影响多肽的功能。因此,本申请说明书和权利要求书中在描述具体的多肽氨基酸序列时,尽管其可能不包含N端由起始密码子编码的甲硫氨酸,然而此时也涵盖包含该甲硫氨酸的序列。相应地,其编码核苷酸序列也可以包含起始密码子。
术语“融合蛋白”是指由上述一种或多种分子组成的天然或合成分子,其中具有不同特异性的两种或多种基于肽或蛋白质(包括糖蛋白)的分子任选的通过化学的或基于氨基酸的接头分子融合在一起。该连接可通过C-N融合或N-C融合(以5′→3′方向)而实现。
术语“CD206”为人甘露糖受体,是在巨噬细胞和某些其它类型的细胞表面上发现的C型凝集素蛋白。CD206蛋白是一非糖基化的跨膜磷蛋白抗原,分子量35kD,术语“结合CD206活性的肽段”指具备CD206结合亲和力的肽段。
术语“M2型TAM”是指M2型巨噬细胞。M2型巨噬细胞表达一种或多种细胞表面标记,包括但不限于CD11b、CD14、CD15、CD23、CD64、CD68、CD163、CD204、CD206和/或其它在本领域内已知的M2巨噬细胞标记。本公开的M2型TAM包括存在于受试者的肿瘤内的M2巨噬细胞和/或在受试者外周中循环的M2单核细胞。
术语“铁蛋白”是指由蛋白外壳和铁内核两部分构成的储铁结构。天然情况下,铁蛋白的蛋白外壳是通常由24个“铁蛋白单体亚基”自组装形成的笼状蛋白结构(外径12nm,内径8nm),而铁内核的主要成分为水铁矿。不含铁内核的铁蛋白的蛋白外壳也称为“去铁蛋白”。本文所述“铁蛋白”包括真核生物铁蛋白和原核生物铁蛋白,优选真核生物铁蛋白,更优选哺乳动物铁蛋白,例如人铁蛋白。真核生物铁蛋白通常包括重链铁蛋白H亚基和轻链铁蛋白L亚基。在机体不同组织和器官中,铁蛋白分子中含有H和L亚基的比例有所不同。然而,通过重组方式,也可以获得仅由H亚基组装成的“H铁蛋白(HFn)”或仅由L亚基组装成的“L铁蛋白(LFn)”。
本公开所述铁蛋白H亚基包括但不限于哺乳动物铁蛋白H亚基,例如人铁蛋白H亚基或马铁蛋白H亚基,优选人铁蛋白H亚基。示例性的野生型人铁蛋白H亚基包含SEQ ID NO:8所示氨基酸序列。
术语“变体”应理解指包含实质上具有与本公开的铁蛋白单体亚基或其片段相同的功效者,即使在氨基端、羧基端或其内部氨基酸序列被切割或取代。根据本发明的铁蛋白单体亚基或其片段的变体亦指包含在特定氨基酸残基位置的氨基酸残基经保守取代(conservatively substituted)的变体。
术语“肽段”、“肽”、和“蛋白质”在本公开中可互换使用,指氨基酸的聚合物。该术语适用于其中一个或多个氨基酸是相应的天然氨基酸的人工化学类似物的氨基酸聚合物,以及适用于天然氨基酸的聚合物。术语“多肽”、“肽”、“氨基酸序列”和“蛋白质”还可包括修饰形式,包括但不限于糖基化、脂质连接、硫酸盐化、谷氨酸的γ羧化、羟化和ADP-核糖基化。
术语“连接肽”是指连接两个活性分子间的肽段,其可作为融合蛋白的一部分,为两个待融合蛋白提供一定的空间间隔,以达到趋向于正确折叠而不相互干扰连接两个蛋白活性分子,不会影响活性分子的功能及稳定性。
术语“笼状蛋白”,也称作“纳米笼”,是指由多个能够自组装的多肽(亚基)形成的具有内部中央空腔的三维蛋白结构,即笼状结构。组装成笼状蛋白的多肽(亚基)数目没有特别限制,只要其能够形成所述笼状结构。笼状蛋白可以具有对称结构,也可以具有非对称结构,取决于其亚基组成。笼状蛋白可以包含天然铁蛋白单体亚基或其变体,也可以包含插入、顺序连接了外源氨基酸序列的铁蛋白单体亚基或其变体的融合蛋白,还可以包含通过化学方式缀合了其它生物活性部分的铁蛋白单体亚基或其变体。
术语“自组装”蛋白质是指能够不借助特定诱导剂,在表达的同时通过规则排列形成多聚体而形成笼状蛋白的蛋白质。
术语“生物活性部分”指的是在生物体内能发挥治疗、诊断、示踪、预防等生物功能的分子,其可以是蛋白质、多肽、激素、寡肽、核酸等有机大分子,也可以是染料分子、荧光分子、笼状蛋白、金属络合物、放射性同位素等无机分子。通常而言,“生物活性部分”并不包含药物载体或赋形剂。
“治疗性分子”指对对生物体内的病症具有治愈、缓解、减轻等积极作用的分子,这些分子可以是蛋白、肽段、抗体、mRNA、DNA、寡核苷酸等生物成分,也可以是放射性分子、化学小分子等。
“可检测分子”指原子、同位素或者化学结构,其:(1)能够连接至所述载体分子;(2)对于人或者其它哺乳动物个体是无毒性的;以及(3)直接或间接提供可检测信号,特别是不仅可以被测量,而且其强度与可检测基团的量相关(例如成比例)的信号。所述信号可通过任意适合的方法(包括光谱学、电学、光学、磁、听觉、无线电信号或者触诊检测方法)检测。
适合的可检测基团包括但不限于放射性同位素(放射性核素)、荧光团、化学发光剂、生物发光剂、磁性基团(包括顺磁性基团)、金属(例如用作造影剂)、RFID基团、酶促反应物、色度释放剂、染料和颗粒形成剂。
作为具体实例,适合的可检测基团包括但不限于:适合用于磁共振成像(MRI)的造影剂(诸如钆(Gd3+))、顺磁性和超顺磁性材料(诸如超顺磁性氧化铁);适合用于计算机断层(CT)成像的造影剂,诸如碘化分子、镱和镝;适合用于闪烁成像(或者闪烁显像)的放射性同位素,诸如锝-99m、
术语“接头”是指一端与铁蛋白单体亚基连接而另一端与生物活性部分相连的化学结构片段或键,所述接头也可以连接其它功能性结构后再与所述铁蛋白单体亚基或所述生物活性部分相连。本发明的接头结构可以通过本领域已知方法合成。
术语“核酸分子”是指多个核苷酸通过磷酸二酯键连接而成的大分子,其中所述核苷酸包括核糖核苷酸和脱氧核糖核苷酸。本公开的多核苷酸的序列可以针对不同的宿主细胞(如大肠杆菌)进行密码子优化,从而改善多肽的表达。进行密码子优化的方法是本领域已知的。
本文使用的“辅料”或“可接受的赋形剂”是指在配制组合物产品,包括药物组合物、检测组合物、示踪组合物过程中所用的没有生物学活性且无毒的任意成分,包括但不限于崩解剂、粘合剂、填充剂、缓冲剂、张力剂、稳定剂、抗氧化剂、表面活性剂或润滑剂。
融合蛋白
在第一方面,本公开提供了一种融合蛋白,其中所述融合蛋白包含:
(1)具有结合CD206活性的肽段;
(2)重链铁蛋白单体亚基或其变体;
在一些实施方案中,所述具有结合CD206活性的肽段(1)和重链铁蛋白单体亚基或其变体(2)顺序连接,即(1)可连接于(2)的C末端,也可连接于(2)的N末端,且可选地,(1)和(2)两者之间可通过连接肽连接。
在一些实施方案中,所述的连接肽为(GGGGS)
在一些实施方案中,(1)直接连接于(2)的N末端。
在一些实施方案中,具有结合CD206活性的肽段(1)的氨基酸的长度为3-10个氨基酸;更优选地长度为4-7个氨基酸。
在一些实施方案中,所述具有结合CD206活性的肽段(1)插入到重链铁蛋白单体亚基或其变体(2)的序列中。
具体地,所述具有结合CD206活性的肽段(1),插入到重链铁蛋白单体亚基或其变体的第161位脯氨酸(P)和第162位谷氨酸(E)之间。该位点所在的loop区域为一柔性区域,且在铁蛋白单体亚基自组装成为24聚体组成的笼状蛋白后,可使得插入的肽段全部暴露于笼状蛋白的表面,赋予肽段足够的与目的靶点相互作用的空间,同时最大程度为插入的肽段提供柔性空间,保证插入肽段的生物学活性和功能。同时,该插入方式不会影响重链铁蛋白单体亚基组装成为笼状蛋白,且不会影响笼状蛋白的稳定性。
在一些实施方案中,CD206活性的肽段来源于能结合人CD206的小肽,所述的小肽可选自现有技术中已知的CD206结合肽段,包括但不限于WO2020/046835中公开的RC182及其类似物,以及WO2019067984A2中公开的可结合小鼠CD206和人CD206的mUNO多肽等。
在一些实施方案中,结合CD206活性的肽段序列至少包含SEQ ID NO:1-3之一所示的氨基酸序列。
在具体实施方案中,所述铁蛋白的来源包括天然提取产物、人工合成产物或基因工程技术产物中的任一种或至少两种的组合。
在一些实施方案中,重链铁蛋白单体亚基为野生型人重链铁蛋白亚基,其包含SEQID NO:8所示的氨基酸序列。
在另一些实施方案中,所述铁蛋白单体亚基变体是经氨基酸突变后的变体序列;优选地,所述突变氨基酸为半胱氨酸(Cys);更优选地,所述半胱氨酸突变为谷氨酸(Glu)、丝氨酸(Ser)或丙氨酸(Ala)。
在一些具体实施方案中,所述铁蛋白单体亚基变体还可以是经保守取代获得的变体。
在一些具体实施方案中,所述铁蛋白单体亚基变体是截短突变体;在其中一个实施方案中,所述截短突变体是重链铁蛋白单体亚基(H)C端的α-螺旋截短突变体;在其中一个实施方案中,所述截短突变体是轻链铁蛋白单体亚基(L)C端的ε螺旋截短突变体。
在一些实施方案中,重链铁蛋白单体亚基变体包含选自SEQ ID NO:9-13之一所示的氨基酸序列。
在一些实施方案中,所述的融合蛋白包含与SEQ ID NO:14-17所示氨基酸序列具有80%或以上同一性的氨基酸序列,优选具有85%、90%、95%、96%、97%、98%、99%以上同一性的氨基酸序列,更优选具有98%或99%以上同一性的氨基酸序列;优选地,所述融合蛋白的氨基酸序列如SEQ ID NO:14-17所示。
多肽缀合物
在第二方面,本公开提供一种多肽缀合物,其包含本公开第一方面的融合蛋白和与所述融合蛋白缀合的生物活性部分。
在一些实施方案中,所述生物活性部分选自治疗性分子、可检测分子和靶向性分子。
所述治疗性分子包括但不限于小分子药物、治疗性多肽、治疗性抗体等。示例性的治疗性分子包括但不限于毒素、免疫调节剂、拮抗剂、细胞凋亡诱导剂、激素、放射性药物、抗血管生成剂、单克隆抗体、siRNA、细胞因子、趋化因子、前药、化疗药物等。
所述可检测分子包括但不限于染料分子、发光化学物质、酶、同位素、标签。在一些具体实施方案中,所述发光化学物质为荧光分子。
在一些具体实施方案中,所述的染料分子选自美蓝、伊文思蓝、异硫蓝、亚甲蓝和专利蓝。
在一些具体实施方式中,所述的荧光分子选自近红外荧光染料,包括但不限于菁染料类、罗丹明类、芳酸类、卟啉类,示例性的荧光染料为吲哚菁绿、Cy3、Cy3.5、Cy5、Cy5.5、Cy7、IR-782、IR820和IR-783。
在一些具体实施方案中,所述的荧光染料分子为吲哚菁绿。
在一些具体实施方式中,所述的同位素包括但不限于99m Tc。
所述靶向性分子包括但不限于靶向性抗体、特异性受体配体等。例如,所述靶向性分子可以是特异性靶向肿瘤抗原的抗体。
在一些实施方案中,所述的生物活性部分与所述融合蛋白的巯基缀合,更优选地巯基位点对应于重链铁蛋白单体亚基的第90位、第102位或第130位的半胱氨酸位点,这些位点在铁蛋白自组装成为笼状蛋白后,位于笼状蛋白的外侧,可为与其缀合的生物活性部分提供与靶点相互作用的机会、或者提供足够空间使得与其缀合的生物活性部分折叠成为活性构象、或者为与其缀合的生物活性部分提供机会激活成为活性形式。
在一些实施方案中,所述的生物活性部分通过接头与所述融合蛋白缀合,所述接头优选能与铁蛋白巯基反应的分子,如顺丁烯二酰亚胺部分(马来酰亚胺)。
在一些实施方案中,所述多肽缀合物能够组装成笼状蛋白和/或能够在组装成笼状蛋白后赋予所述笼状蛋白结合、治疗、诊断、示踪的能力。
在一些实施方案中,所述多肽缀合物是分离的多肽缀合物,例如,其没有组装成笼状蛋白。在一些实施方案中,所述多肽缀合物组装成为笼状蛋白。
笼状蛋白
在第三方面,本公开提供了一种笼状蛋白,其由(a)、(b)和/或(c)自组装而形成,所述笼状蛋白包含至少一个(a)或(b);其中(a)为第一方面所述的融合蛋白;(b)为第二方面所述的多肽缀合物;(c)为铁蛋白单体亚基或其变体;且(a)或(b)中所述的具有结合CD206活性的肽段展示在所述笼状蛋白的表面,使得所述笼状蛋白具有结合CD206的活性。
在其中一些实施方案中,所述的(c)选自重链铁蛋白单体亚基或其变体、轻链铁蛋白单体亚基或其变体以及重链和轻链铁蛋白单体亚基或其变体的混合物。
在其中一些实施方案中,所述(c)是重链铁蛋白单体亚基或其变体。
在其中一些实施方案中,所述(c)是轻链铁蛋白单体亚基或其变体。
在其中一些实施方案中,所述重链铁蛋白单体亚基或轻链铁蛋白单体亚基是来源于哺乳动物来源的铁蛋白,包括人源性铁蛋白、鼠源性铁蛋白或马脾脏铁蛋白中的任意一种或至少两种的组合。
在一些实施方案中,所述重链铁蛋白单体亚基或轻链铁蛋白单体亚基来源于人源性铁蛋白。
在一些实施方案中,所述重链铁蛋白单体亚基或其变体是人重链铁蛋白单体亚基或其变体。
在一些实施方案中,所述轻链铁蛋白单体亚基或其变体是轻链铁蛋白单体亚基或其变体。
在其中一些实施方案中,所述轻链铁蛋白单体亚基或其变体是人轻链铁蛋白单体亚基或其变体。
在具体实施方案中,所述铁蛋白的来源包括天然提取产物、人工合成产物或基因工程技术产物中的任一种或至少两种的组合。
在具体实施方案中,所述(c)是经氨基酸突变后的变体序列;优选地,所述突变氨基酸为半胱氨酸(Cys);更优选地,所述半胱氨酸突变为谷氨酸(Glu)、丝氨酸(Ser)或丙氨酸(Ala)。
在具体实施方案中,所述铁蛋白单体亚基变体还可以是经保守取代获得的变体。
在具体实施方案中,所述铁蛋白单体亚基变体是截短突变体;在其中一个实施方案中,所述截短突变体是重链铁蛋白单体亚基(H)C端的α-螺旋截短突变体;在其中一个实施方案中,所述截短突变体是轻链铁蛋白单体亚基(L)C端的ε螺旋截短突变体。
在其中一些实施方案中,所述重链铁蛋白单体亚基或其变体包含选自SEQ ID NO:8-13之一所示的氨基酸序列。
在其中一些实施方案中,所述轻链铁蛋白单体亚基或其变体包含选自SEQ ID NO:18-21之一所示的氨基酸序列。
在其中一些实施方案中,所述笼状蛋白为24聚体,所述笼状蛋白在其表面上展示(a)或(b)包含的具有结合CD206活性的肽段,该肽段能够与体内CD206结合从而调节该受体信号通路。在所述笼状蛋白中,(a)或(b)的数量可以为1-24,即(a)或(b)与其它亚基的比例可以为24:0-1:23。笼状蛋白中(a)或(b)的数量决定了所述笼状蛋白中活性分子的数量,根据(a)或(b)的数量可以形成1-24价的CD206结合活性的笼状蛋白。
在其中一些实施方案中,所述的笼状蛋白由(a)和(b)自组装而形成,不包含铁蛋白单体亚基或其变体。
在其中一些实施方案中,所述的笼状蛋白由单独由(a)或单独由(b)自组装而形成,不包含铁蛋白单体亚基或其变体。
在其中一个实施方案中,所述笼状蛋白与CD206结合的EC
在第四方面,本公开提供一种生产第一方面所述的融合蛋白、或第三方面所述的笼状蛋白的方法,所述方法为生物学方法,包括将编码所述融合蛋白的一个或多个核酸分子导入细胞中,并在适合于表达编码的融合蛋白或形成笼状蛋白的条件下培养所述细胞。
在一些实施方案中,所述融合蛋白或笼状蛋白可以通过原核表达的方式生产获得,此时培养的细胞为原核细胞,包括但不限于大肠杆菌。
在一些实施方案中,所述融合蛋白或笼状蛋白可以通过真核表达的方式生产获得,此时培养的细胞为真核细胞,包括但不限于酵母。
在一些实施方案中,所述融合蛋白或笼状蛋白也可以通过非重组表达的方式,如化学合成的方式制备获得。
在第五方面,本公开提供一种第二方面所述的多肽缀合物的制备方法,其包括如下步骤:
(1)制备第一方面所述的融合蛋白,获得融合蛋白;
(2)将(1)获得的融合蛋白在适合偶联反应的条件下与生物活性部分发生偶联反应,获得所述多肽缀合物。
在一些实施方案中,所述生物活性部分通过接头缀合至本公开第一方面的融合蛋白的重链铁蛋白单体亚基或其变体上。
在一些实施方案中,所述生物活性部分是吲哚菁绿(ICG)。ICG可以通过先与马来酰亚胺分子(接头)缩合为式(I)所示的ICG-mal,然后再与重链铁蛋白单体亚基或其变体上的巯基偶联。优选的缀合位点的巯基位于第90位、第102位和第130位,如分别对应于SEQ IDNO:8-13的第90位、第102位和第130位的半胱氨酸。
在一些实施方案中,其中步骤(2)包括使式(I)所示化合物(带有接头的ICG)与步骤(1)的本公开第一方面所述融合蛋白的重链铁蛋白单体亚基或其变体接触。
在第六方面,本公开提供一种笼状蛋白-API复合物,其包含第三方面所述的笼状蛋白,以及装载在所述笼状蛋白内部的活性药物成分(API)。
装载在所述笼状蛋白内部的所述活性药物成分(API)并没有特别限制,只要其适合于装载于本发明的所述笼状蛋白中,例如,所述API不会破坏笼状蛋白的笼状结构和/或其大小适合于被所述笼状结构容纳。所述API的实例包括但不限于烷基化剂、铂类、抗代谢类、肿瘤抗生素类药物、天然提取物、激素类、放射性药物、神经递质类药物、多巴胺受体激动剂、神经中枢抗胆碱药、胆碱受体激动剂类药物、γ分泌酶抑制剂、抗氧剂、麻醉剂。
在一些实施方案中,所述复合物中的笼状蛋白包含第一方面所述的融合蛋白、和/或第二方面所述的多肽缀合物,融合蛋白或多肽缀合物具有结合生物体内CD206的亲和活性,从而赋予笼状蛋白主动靶向CD206的生物活性。同时,由于多肽缀合物包含具备不同功能的生物活性部分,如治疗性分子、可检测分子和/或靶向分子,可赋予笼状蛋白在生物体内发挥治疗、诊断、示踪等不同的功能。
在一些实施方案中,笼状蛋白中的多肽缀合物可包含相同的生物活性部分,也可包含不同的生物活性部分。
在一些实施方案中,装载于笼状蛋白内部的API与多肽缀合物包含的生物活性部分相同,也可以不同。
在第七方面,本公开提供一种组合物,其包含第一方面所述的融合蛋白、第二方面所述的多肽缀合物、第三方面所述的笼状蛋白和/或第六方面所述的笼状蛋白-API复合物,以及合适的辅料,或可接受的赋形剂。
在一些实施方案中,药物组合物包含的融合蛋白、多肽缀合物以未组装成笼状蛋白的形式提供。所述的融合蛋白或多肽缀合物,可以在体外或在递送至体内后,在适合条件下,自组装为笼状蛋白。
在一些实施方案中,在多肽缀合物缀合可检测分子的情况下,包含本公开的多肽缀合物的药物组合物还可以包含额外的API。
在一些实施方案中,所述药物组合物可以用于预防或治疗与CD206相关的疾病,且由于其中包含的融合蛋白、多肽缀合物、笼状蛋白缀合或装载了不同功能的生物活性部分,赋予所述组合物至少一种诊断、示踪、预防和/或诊断的用途。
在第八方面,本公开还提供一种核酸分子,其包含编码第一方面所述的融合蛋白、第三方面所述的笼状蛋白或第四方面的方法生产的融合蛋白或笼状蛋白的核酸序列。
在其中一些实施方案中,所述核酸序列包含与SEQ ID NO:4-7所示核苷酸序列具有80%或以上同一性的核苷酸序列,优选具有85%、90%、95%、96%、97%、98%、99%以上同一性的核苷酸序列,更优选具有98%或99%以上同一性的核苷酸序列;更优选地,所述核酸序列如SEQ ID NO:4-7所示。
在其中一个实施例中,所述核酸分子是密码子优化的核酸分子。
第九方面,本公开提供一种重组细胞,其包含第八方面所述的核酸分子。可用于表达本公开的融合蛋白、笼状蛋白的重组细胞包括原核生物、酵母和高等真核细胞。示例性的原核宿主包括埃希氏菌属(Escherichia)、芽孢杆菌属(Bacillus)、沙门氏菌属(Salmonella)以及假单胞菌属(Pseudomonas)和链霉菌属(Streptomyces)的细菌。在优选的实施方案中,宿主细胞是埃希氏菌属细胞,优选是大肠杆菌。在本公开的一个具体实施方案中,所使用的宿主细胞为大肠杆菌BL21(DE3)菌株细胞。
可以通过许多已熟知的技术之一将本公开的重组表达构建体导入宿主细胞,这样的技术包括但不限于:热激转化,电穿孔,DEAE-葡聚糖转染,显微注射,脂质体介导的转染,磷酸钙沉淀,原生质融合,微粒轰击,病毒转化及类似技术。
第十方面,本公开提供第一方面所述的融合蛋白、第二方面所述的多肽缀合物、第三方面所述的笼状蛋白、第六方面所述的笼状蛋白-API复合物、第七方面所述的组合物、第八方面所述的核酸分子、第九方面所述的重组细胞在制备药物、诊断试剂、示踪试剂中的用途;
在其中一些实施方案中,所述的药物为CD206阳性相关的药物,包括但不限于自身免疫病药物和抗肿瘤药物。在其中一些实施方案中,所述药物用于治疗自身免疫病,自身免疫病包括但不限于:获得性免疫缺陷综合征(AI DS)、急性播散性脑脊髓炎(ADEM)、艾迪生病、丙种球蛋白缺乏血症、过敏性疾病、斑秃、阿尔茨海默病、肌萎缩侧索硬化、强直性脊柱炎、抗磷脂综合征、抗合成酶综合征、动脉斑块病症、哮喘症、动脉粥样硬化、特应性变态反应、特应性皮炎、自身免疫性再生障碍性贫血、自身免疫性心肌病、自身免疫性肠病、自身免疫性溶血性贫血、自身免疫性肝炎、自身免疫性甲状腺功能减退、自身免疫性内耳病、自身免疫性淋巴组织增生综合征、自身免疫性周围神经病变、自身免疫性胰腺炎、自身免疫性多内分泌腺病综合征、自身免疫性孕酮皮炎、自身免疫性血小板减少性紫癜、自身免疫性荨麻疹、自身免疫性葡萄膜炎、贝罗病/贝罗同心圆性硬化、贝西氏病(disease)、Berger病、Bickerstaff氏脑炎、布劳综合征(Blau syndrome)、大疱性类天疱疮、心血管易损斑块(vulnerable plaque)、卡斯尔曼病、乳糜泻、美洲锥虫病、慢性炎症性脱髓鞘性多发性神经病、慢性复发性多病灶性骨髓炎、慢性阻塞性肺疾病、慢性静脉淤积性溃疡、变应性肉芽肿性血管炎(Churg-Strauss syndrome)、瘢痕性类天疱疮、寇甘综合征、冷凝集素疾病、补体成分2缺乏、接触性皮炎、颅动脉炎、CREST综合征、局限性肠炎、库欣综合征、皮肤白细胞破碎性血管炎、德戈氏病(Dego's disease)、德尔肯氏病、疱疹样皮炎、皮肌炎、I型糖尿病、II型糖尿病、弥漫性皮肤系统性硬化症、德雷斯勒综合征、药物性狼疮、盘状红斑狼疮、湿疹、肺气肿、子宫内膜异位症、与附著点炎症相关的关节炎、嗜酸细胞性筋膜炎、嗜酸细胞性胃肠炎、嗜酸细胞性肺炎、获得性大疱性表皮松解症、结节性红斑、胎儿红血球母细胞增多症、特发性混合性冷球蛋白血症、埃文斯综合征、进行性骨化性纤维发育不良(fibrodysplasiaossificans progressive)、纤维化肺泡炎(或者特发性肺纤维化)、胃炎、胃肠道类天疱疮、戈谢病(Gaucher’s disease)、肾小球肾炎、肺出血-肾炎综合征、格雷夫斯病、格-巴二氏综合征(GBS)、桥本脑病、桥本甲状腺炎、心脏病、过敏性紫癜、妊娠疱疹(又称作妊娠性类天疱疮)、化脓性汗腺炎、HIV感染、休-斯二氏综合征、低丙球蛋白血症、感染性疾病(包括细菌感染性疾病)、特发性炎性脱髓鞘疾病、特发性肺纤维化、特发性血小板减少性紫癜、IgA肾病、包涵体肌炎、炎症性关节炎、炎性肠病、炎性痴呆、间质性膀胱炎、间质性肺炎、青少年特发性关节炎(又称作幼年型类风湿关节炎)、川崎病、兰伯特肌无力综合征、白细胞碎裂性血管炎、扁平苔藓、硬化性苔癣、线状IgA病(LAD)、类狼疮性肝炎(又称作自身免疫性肝炎)、红斑狼疮、淋巴瘤样肉芽肿病、马吉德综合征(Majeed syndrome)、恶性肿瘤(包括癌症(例如肉瘤、卡波西肉瘤、淋巴瘤、白血病、癌和黑色素瘤)、美尼尔氏病、显微镜下多血管炎、米勒·费希尔综合征、混合性结缔组织病、硬斑病、Mucha-Habermann病(又称作急性苔藓痘疮样糠疹)、多发性硬化、重症肌无力、肌炎、发作性睡病、视神经脊髓炎(又称作德维克病)、神经性肌强直、眼瘢痕性类天疱疮、眼阵挛-肌阵挛综合征、奥德氏甲状腺炎(Ord'sthyroiditis)、复发性风湿病、PANDAS(儿童链球菌感染相关性自身免疫性神经精神障碍)、副肿瘤性小脑变性、帕金森病症、阵发性睡眠性血红蛋白尿症(PNH)、帕-罗二氏综合征、Parsonage-Turner综合征、睫状体扁平部炎、寻常型天疱疮、外周动脉疾病、恶性贫血、静脉周脑脊髓炎、POEMS综合征、结节性多动脉炎、风湿性多肌痛、多肌炎、原发性胆汁性肝硬变、原发性硬化性胆管炎、进展性炎症性神经病、银屑病、银屑病关节炎、坏疽性脓皮病、纯红细胞再生障碍、罗斯默森氏症、雷诺现象、复发性多软骨炎、莱特尔综合征、再狭窄、下肢不宁综合征、腹膜后纤维化、类风湿性关节炎、风湿热、结节病、精神分裂症、施密特综合征、Schnitzler综合征、巩膜炎、硬皮病、败血症、血清病、干燥综合征、脊椎关节病、斯提耳病(成人期发病)、僵人综合征、中风、亚急性细菌性心内膜炎(SBE)、Susac综合征、Sweet综合征、西德纳姆舞蹈病、交感性眼炎、系统性红斑狼疮、全身风湿性疾病、高安动脉炎、颞动脉炎(又称作“巨细胞动脉炎”)、薄帽纤维粥样斑、血小板减少、痛性眼肌麻痹综合征、移植(例如心/肺移植)排斥反应、横贯性脊髓炎、结核病、溃疡性结肠炎、未分化结缔组织病、未分化脊柱关节病、荨麻疹性血管炎、脉管炎、白癜风以及韦格纳肉芽肿病。
在其中一些实施方案中,所述示踪试剂为肿瘤示踪试剂,优选地,所述的肿瘤示踪试剂为肿瘤前哨淋巴结示踪试剂;更优选地,所述的肿瘤示踪试剂为乳腺癌肿瘤前哨淋巴结示踪试剂。
在另一方面,本公开提供一种在对象中诊断疾病的方法,所述方法包括给所述对象施用有效量的本公开的铁蛋白H亚基突变体多肽、多肽缀合物、笼状蛋白、笼状蛋白-API复合物和/或药物组合物。所述疾病如上文所定义,优选是肿瘤。
本公开的多肽、本公开的铁蛋白H亚基突变体多肽、多肽缀合物、笼状蛋白、笼状蛋白-API复合物和/或药物组合物可通过本领域普通技术人员已知的任何适当方法进行施用(参见例如,Remington:The Science and Practice of Pharmacy,第21版,2005)。药物组合物例如可通过静脉内、肌肉内、腹腔内、脑脊髓内、皮下、关节内、滑膜腔内、鞘内、口服、局部或吸入途径施用。
实施例
通过参考在此给出的一些具体实施例可获得对本公开的进一步的理解,这些实施例仅用于说明本公开,其无意于对本公开的范围做出任何限制。显然,可以对本公开作出多种改动和变化而不脱离本公开的实质,因此,这些改动和变化同样在本申请要求保护的范围内。
融合蛋白的设计
1.1结合CD206肽段的选择
根据模拟短肽结合CD206的亲和力强弱并参考现有技术,确定采用以下肽段作为与铁蛋白连接的结合CD206肽段:
SSPGAK(SEQ ID NO:1);
KFRKAFKRFF(SEQ ID NO:2);
KARKAAKRAF(SEQ ID NO:3)。
1.2重链铁蛋白单体亚基突变的设计
根据人重链铁蛋白单体亚基的野生型氨基酸序列(SEQ ID NO:8;参见PDB:3AJO_A)设计若干重链铁蛋白亚基突变体的氨基酸序列,突变涉及的位点有:
(1)第62位的谷氨酸(E62)和第65位的组氨酸(H65)的铁氧中心位点;
(2)为增加铁蛋白的亲水性,减少聚集,将第108位的带氨基侧链的赖氨酸(K108)用带羧基侧链的氨基酸取代;
(3)将第98位的天冬酰胺(N98)用带羧基侧链的氨基酸取代;
(4)将第156位的带氨基侧链的精氨酸(R156)用带羧基侧链的氨基酸取代;
和/或(5)为增加铁蛋白偶联药物的均一性,将H亚基的三个活性巯基位点(第90位、第102位和第130位)中的两个突变成为其它氨基酸,仅保留一个半胱氨酸作为供生物活性部分偶联的作用位点。所有的氨基酸位置均参考SEQ ID NO:7。
突变体的具体设计见表1。所得亚基突变体分别命名为Mut-HFn-212(SEQ ID NO:9)、Mut-HFn-240(SEQ ID NO:10)、Mut-HFn-241(SEQ ID NO:11)、Mut-HFn-242(SEQ ID NO:12)和Mut-HFn-243(SEQ ID NO:13)。
表1、重链铁蛋白亚基突变体的设计
1.3融合蛋白结构的设计
将1.1节所述的结合CD206的肽段的氨基酸序列分别与1.2节所述的重链铁蛋白单体亚基序列顺序连接,或插入其序列中,构建具有CD206主动靶向性的融合蛋白。
其中插入的具体方案为:将结合CD206肽段的氨基酸序列,可以通过连接肽或直接与重链铁蛋白单体亚基氨基酸序列在N端连接,或将结合CD206肽段的氨基酸序列插入到重链铁蛋白单体亚基氨基酸序列的DE loop(P161/E162)之间。插入时,根据计算机模拟的肽段折叠情况在插入片段两侧加入连接肽GGGGS。以插入Mut-HFn-212的序列为例,构建的融合蛋白的氨基酸序列如下:
HFn-CD206-1(SEQ ID NO:14)
SSPGAKTTASTSQVRQNYHQDSEAAINRQINLELYASYVYLSMSYYFDRDDVALKNFAKYFLHQSHEEREHAEK
LMKLQNQRGGRIFLQDIKKPDCDDWESGLNAMESALHLEKNVNQSLLELHKLATDKNDPHLSDFIETHYLNEQV
KAIKELGDHVTNLRKMGAPESGLAEYLFDKHTLGDSDNES
HFn-CD206-2(SEQ ID NO:15)
SSPGAKGGGGSTTASTSQVRQNYHQDSEAAINRQINLELYASYVYLSMSYYFDRDDVALKNFAKYFLHQSHEER
EHAEKLMKLQNQRGGRIFLQDIKKPDCDDWESGLNAMESALHLEKNVNQSLLELHKLATDKNDPHLSDFIETHY
LNEQVKAIKELGDHVTNLRKMGAPESGLAEYLFDKHTLGDSDNES
HFn-CD206-3(SEQ ID NO:16)
SSPGAKGSGGGSGTTASTSQVRQNYHQDSEAAINRQINLELYASYVYLSMSYYFDRDDVALKNFAKYFLHQSHE
EREHAEKLMKLQNQRGGRIFLQDIKKPDCDDWESGLNAMESALHLEKNVNQSLLELHKLATDKNDPHLSDFIET
HYLNEQVKAIKELGDHVTNLRKMGAPESGLAEYLFDKHTLGDSDNES
HFn-CD206-4(SEQ ID NO:17)
TTASTSQVRQNYHQDSEAAINRQINLELYASYVYLSMSYYFDRDDVALKNFAKYFLHQSHEEREHAEKLMKLQN
QRGGRIFLQDIKKPDCDDWESGLNAMESALHLEKNVNQSLLELHKLATDKNDPHLSDFIETHYLNEQVKAIKEL
GDHVTNLRKMGAPGGGGSSPGAKGGGGSESGLAEYLFDKHTLGDSDNES
HFn-CD206-1优化的基因序列(SEQ ID NO:4)
AGCAGCCCGGGCGCGAAAACCACCGCGAGCACGAGCCAAGTGCGTCAGAACTATCATCAAGATAGCGAAGCGGCG
ATTAACCGTCAGATTAACCTGGAACTGTATGCGAGCTATGTGTATCTGAGCATGAGCTATTATTTTGATCGCGAT
GATGTGGCGCTGAAAAACTTTGCGAAATATTTTCTGCATCAGAGCCATGAAGAACGCGAACATGCGGAAAAACTG
ATGAAACTGCAGAATCAGCGCGGCGGCCGCATTTTTCTGCAAGATATTAAAAAACCGGATTGCGATGATTGGGAA
AGCGGTCTGAACGCGATGGAAAGCGCGCTGCATCTGGAAAAAAACGTGAATCAGAGCCTGCTGGAACTGCATAAA
CTGGCGACCGATAAAAACGATCCGCATCTGAGCGATTTTATTGAAACCCATTATCTGAACGAACAAGTGAAAGCG
ATTAAAGAACTGGGCGATCATGTGACCAACCTGCGCAAAATGGGCGCGCCGGAAAGCGGCCTGGCGGAATATCTG
TTTGATAAACATACCCTGGGCGATAGCGATAACGAAAGC
HFn-CD206-2优化的基因序列(SEQ ID NO:5)
AGCAGCCCGGGCGCGAAAGGCGGTGGCGGCAGCACCACCGCGAGCACGAGCCAAGTGCGTCAGAACTATCATCAA
GATAGCGAAGCGGCGATTAACCGTCAGATTAACCTGGAACTGTATGCGAGCTATGTGTATCTGAGCATGAGCTAT
TATTTTGATCGCGATGATGTGGCGCTGAAAAACTTTGCGAAATATTTTCTGCATCAGAGCCATGAAGAACGCGAA
CATGCGGAAAAACTGATGAAACTGCAGAATCAGCGCGGCGGCCGCATTTTTCTGCAAGATATTAAAAAACCGGAT
TGCGATGATTGGGAAAGCGGCCTGAACGCGATGGAAAGCGCGCTGCATCTGGAAAAAAACGTGAATCAGAGCCTG
CTGGAACTGCATAAACTGGCGACCGATAAAAACGATCCGCATCTGAGCGATTTTATTGAAACCCATTATCTGAAC
GAACAAGTGAAAGCGATTAAAGAACTGGGCGATCATGTGACCAACCTGCGCAAAATGGGCGCGCCGGAAAGCGGT
CTGGCGGAATATCTGTTTGATAAACATACCCTGGGCGATAGCGATAACGAAAGC
HFn-CD206-3优化的基因序列(SEQ ID NO:6)
AGCAGCCCGGGCGCGAAAGGCAGCGGCGGTGGCAGCGGCACCACCGCGAGCACGAGCCAAGTGCGTCAGAACTAT
CATCAAGATAGCGAAGCGGCGATTAACCGTCAGATTAACCTGGAACTGTATGCGAGCTATGTGTATCTGAGCATG
AGCTATTATTTTGATCGCGATGATGTGGCGCTGAAAAACTTTGCGAAATATTTTCTGCATCAGAGCCATGAAGAA
CGCGAACATGCGGAAAAACTGATGAAACTGCAGAATCAGCGCGGCGGCCGCATTTTTCTGCAAGATATTAAAAAA
CCGGATTGCGATGATTGGGAAAGCGGCCTGAATGCGATGGAAAGCGCGCTGCATCTGGAAAAAAACGTGAATCAG
AGCCTGCTGGAACTGCATAAACTGGCGACCGATAAAAACGATCCGCATCTGAGCGATTTTATTGAAACCCATTAT
CTGAACGAACAAGTGAAAGCGATTAAAGAACTGGGCGATCATGTGACCAACCTGCGCAAAATGGGCGCGCCGGAA
AGCGGCTTAGCGGAGTATCTGTTTGATAAACATACCCTGGGCGATAGCGATAACGAAAGC
HFn-CD206-4优化的基因序列(SEQ ID NO:7)
ACCACCGCGAGCACGAGCCAAGTGCGTCAGAACTATCATCAAGATAGCGAAGCGGCGATTAACCGTCAGATTAA
CCTGGAACTGTATGCGAGCTATGTGTATCTGAGCATGAGCTATTATTTTGATCGCGATGATGTGGCGCTGAAAA
ACTTTGCGAAATATTTTCTGCATCAGAGCCATGAAGAACGCGAACATGCGGAAAAACTGATGAAACTGCAGAAT
CAGCGCGGCGGCCGCATTTTTCTGCAAGATATTAAAAAACCGGATTGCGATGATTGGGAGAGCGGCCTGAACGC
GATGGAAAGCGCGCTGCATCTGGAAAAAAACGTGAATCAGAGCCTGCTGGAACTGCATAAACTGGCGACCGATA
AAAACGATCCGCATCTGAGCGATTTTATTGAAACCCATTATCTGAACGAACAAGTGAAAGCGATTAAAGAACTG
GGCGATCATGTGACCAATCTGCGTAAGATGGGCGCGCCGGGCGGCGGTGGTAGCAGCCCGGGTGCGAAAGGCGG
CGGTGGCAGCGAAAGCGGCCTGGCGGAATATCTGTTTGATAAACATACCCTGGGCGATAGCGATAACGAAAGC
根据宿主菌的密码子偏爱性合成上述融合蛋白的编码基因。蛋白表达使用原核表达系统,故在基因5’端添加起始密码子ATG,在3’端添加终止密码子TAA(上述序列中未标出)。
实施例1融合蛋白的制备和纯化
1.基因合成
基因合成和载体构建工作委托苏州君跻生物科技有限公司进行,构建的重组质粒经确认序列正确。
2.表达菌株构建
选择大肠杆菌表达外源蛋白的常用载体pET-30a(+),抗性为卡那霉素抗性(Kan+),选择Nde I和Hind III酶切位点,按照上述的融合蛋白设计方案分别构建融合蛋白(HFn-CD206-1~HFn-CD206-4)的编码基因,获得重组pET-30a(+)-HFn-CD206-1~pET-30a(+)-HFn-CD206-4。经酶切图谱和基因测序确证表达载体构建成功。其中,pET-30a(+)的质粒图谱如图1所示,酶切结果如图2所示。经双酶切后,电泳图中有两条基因条带,第二条带分别是各基因的目的条带,大小在理论值附近,表明目的基因已构建至表达质粒中。
选择E.coli BL21(DE3)作为宿主菌,将含有目的基因的重组质粒转化至宿主菌感受态细胞中,通过含50μg/mL卡那霉素的抗性平板筛选阳性克隆,确定重组菌株,具体过程如下。
3.重组菌株构建
i.重组质粒重悬
取两个重组质粒冻干粉10μg,分别用200μL TE缓冲液重悬均匀,10μL/管分装,冻存于-80℃冰箱备用。
ii.转化
(1)从-80℃冰箱中取出感受态细胞,放置在冰上融化后(约5min左右),在冰浴中,取一定量质粒重悬液加入到20μL感受态细胞中充分混匀,在冰上静置孵育30min。
(2)将上述样品于42℃水浴热激90s后,立即放置到冰上,静置2min。
(3)取280μL无菌LB液体培养基,加入到热激后的样品中,在37℃,220rpm活化1h。
(4)分别取上述转化后的菌液涂布于LB抗性平板上,37℃培养箱培养过夜,观察菌落生长情况,筛选出阳性克隆。
4.蛋白表达
i.摇瓶培养
上述第3节筛选的阳性菌种接种到40mL LB培养基的培养瓶中,培养基使用前添加相应抗生素(卡那霉素,简称Kan)。于37℃培养至OD
ii.蛋白表达情况样品制备
菌体裂解:取上述30mL菌液,5000r/min离心15min,弃上清,加入25mL 20mM Tris-HCl缓冲液重悬均匀,于高压均质机1000bar破碎3次,获得菌体裂解液。
SDS-PAGE样品制备:取上述菌体裂解液1000μL,10000rpm离心10min,取20μL上清液至另一离心管中,加入5μL 5×上样缓冲液(Loading buffer)混匀,95℃孵育5min,此为裂解液上清样品;将剩余的沉淀,加入1000μL 20mM Tris-HCl,pH8.0缓冲液重悬沉淀,获得重悬液,取20μL重悬液加入5μL 5×上样缓冲液(Loading buffer)混匀,95℃孵育5min,此为裂解液沉淀样品。
将裂解液上清样本和裂解液沉淀样品分别经SDS-PAGE,检测目的蛋白的表达情况(图3-5)。图中s代表上清样本,c代表沉淀样品,数字代表不同摇瓶平行样本。图3示出了HFn-CD206-1表达的SDS-PAGE结果。图4示出了HFn-CD206-2、HFn-CD206-3表达的SDS-PAGE结果。图5示出了HFn-CD206-4表达的SDS-PAGE结果。由结果来看,所有融合蛋白均可以被诱导表达,且均表达于上清液中。但不同的是,HFn-CD206-4表达最稳定,在所有平行样本中均可表达,且表达量更多。
实施例2融合蛋白纯化及纯度检测
对实施例1中诱导表达获得的融合蛋白进行纯化,步骤如下:
(1)菌体重悬:取发酵菌体20克,以缓冲液200mL 50mM Tris-HClmL重悬,获得终体积约200mL的菌悬液。
(2)菌体破碎:将上述菌悬液,在1000bar条件下破碎3次。
(3)热沉:破碎后,上清用升温至75℃水浴锅水浴加热,料液升温至70℃开始计时5分钟,取出立刻放入冰水浴中冷却,降温至4℃,12000rpm离心20min,取上清。
(4)用疏水层析(HiTrap Phenyl HP,CV=10mL)捕获处理上清液,流速:5mL/min(150cm/h)。
(5)用离子交换层析(默克尔
(6)取疏水洗脱后样品,用分子筛(GE Superdex-200,CV=120mL),流速:2mL/min(60cm/h)100kD超滤管浓缩至2mg/mL,获得纯化蛋白。
纯化后的蛋白用SEC检测,SEC-HPLC检测仪器:Agilent 1260LC,色谱柱:TOSOHTskgel G4000swxl CH-SEC-004,流动相:50mM Tris-HCl pH7.0,流速:0.5mL/min,上样量:10μL。检测结果发现融合蛋白均组装成为笼状蛋白,粒径在12-15nm之间,在4个样本中,HFn-CD206-4单体比例最高,不发生聚集(图6),而其它样本均会产生一定比例的聚体,如HFn-CD206-1(图7)。
实施例3融合蛋白活性检测
使用间接ELISA法检测纯化后的蛋白与CD206的结合活性,由此证明是否存在具有结合活性的目的蛋白。
实验操作流程如下:
(1)包被样品:将实施例2纯化好的各组融合蛋白样品分别稀释至2000μg/mL、666.7μg/mL和222.2μg/mL,混匀后加入到酶标板中,100μL/孔,每个浓度3个复孔,放入湿盒中,放至4℃冰箱,过夜。
(2)取出酶标板洗板:用1×PBST(取300μL Tween-20加入PBS 100mL中混匀使用),每孔300μL洗3次。
(3)封闭:取1%BSA,分别加入300μL/孔,覆上封板膜,37℃培养箱中孵育2h。
(4)洗板:用1×PBST洗3次。
(5)用1%BSA将CD206抗原(北京百普赛斯生物科技有限公司)稀释成6μg/mL,每孔100μL,室温混匀孵育2h。
(6)洗板:用1×PBST洗3次。
(7)孵育抗体:用1%BSA将一抗(Anti-His Tag Antibody,Boster)稀释成1:1000,按照孔板设计100μL/孔加至酶标板,覆上封板膜,室温圆周混匀孵育1.5h。
(8)洗板:1×PBST洗3次。
(9)孵育二抗:将二抗(Anti-mouse HRP,Boster)用1%BSA稀释成1:2000,混匀,100μL/孔加至酶标板,覆上封板膜,37℃孵育1.5h。
(10)洗板:1×PBST洗3次。
(11)显色:每孔加入TMB 100μL/孔,盖上覆膜放入37℃恒温箱温育30min。
(12)终止:显色完成后,每孔依次加入50μL终止液(1M H
结果表明,4个融合蛋白组装的笼状蛋白样本中,均与CD206抗原具有一定的亲和力,其中亲和力大小为:HFn-CD206-4>HFn-CD206-1>HFn-CD206-2>HFn-CD206-3(表2)。
表2、笼状蛋白与CD206抗原的亲和力
