一种纳米抗体、包含该纳米抗体的多肽及其应用
文献发布时间:2024-04-18 20:01:23
本申请是申请号为“202310699491.2”,申请日为“2023.06.13”,名称为“一种纳米抗体、包含该纳米抗体的多肽及其应用”的发明专利的分案申请。
技术领域
本发明属于生物技术领域,具体涉及一种纳米抗体、包含该纳米抗体的多肽及其应用。
背景技术
腺相关病毒(adeno-associated virus,AAV),属于微小病毒科依赖病毒属,具有二十面体结构,是目前发现的一类结构最简单的单链DNA缺陷型病毒,需要辅助病毒(通常为腺病毒)参与复制。该病毒颗粒的直径在20~26nm之间,含有大小在4.7~6kb之间的线状单链DNA基因组。AAV对人类不致病,研究表明,约80%人群AAV血清检测阳性。
重组腺相关病毒(recombinant adeno-associated virus,rAAV)源于非致病的野生型腺相关病毒,由于其安全性好、宿主细胞范围广(分裂和非分裂细胞)、免疫源性低,在体内表达外源基因时间长等特点,被视为最有前途的基因转移载体之一,在世界范围内的基因治疗和疫苗研究中得到广泛应用。包括体内、体外实验的基因功能研究、构建疾病模型、基因敲除、基因治疗和疫苗研究等方面。
由于rAAV的上游生产是在细胞中完成的,因此其裂解产物中有核酸、培养基残留杂质、宿主细胞蛋白质等杂质,残留的DNA可以用核酸酶处理,但HCP的去除是一个复杂的过程,通常多个步骤,而这些步骤可能降低收率,延迟工艺开发,给下游纯化工艺带来极大的挑战。尤其是AAV有多种不同的血清型(AAV1-AAV10),其具有不同的衣壳蛋白空间结构、序列和组织特异性,对不同组织和细胞具有不同的感染效率,识别与结合不同的细胞表面受体,因此,通用型的亲和层析方案很难实现。
传统的下游工艺需要多个不同的处理步骤,包括氯化铯或碘克沙醇梯度离心以及多个层析步骤。这类工艺效果并不理想,因为当需要多步操作时,即使单步收率很高也会导致最终整体收率的显着降低。并且该方法主要缺点是不适合从大体积裂解液中直接纯化病毒,只适用于科研级。
为了解决这一挑战,最新的亲和层析法减少了纯化AAV所需的步骤数,提高了收率并缩短了工艺时间。例如,肝素-亲和层析柱可用于纯化rAAV3和rAAV6;粘蛋白-亲和层析柱可用于纯化rAAV1、rAAV4、rAAV5和rVVA6;抗体-亲和柱用于检测和纯化rAAV,如识别和结合AAVXL32.1的单克隆抗体(专利文献1)、特异识别AAV9衣壳蛋白的多克隆抗体(专利文献2)等。
然而,传统抗体制备成本高昂,抗体尺寸较大导致在载体上偶联量低等缺陷限制了其工业化应用。驼源纳米抗体具有高度特异性和稳定性,基于纳米抗体的AVBSepharose
专利文献1:CN113583112B
专利文献2:CN114685651A
非专利文献1:OrjanaTerova,et.al,Overcoming Downstream PurificationChallenges for Viral Vector Manufacturing:Enabling Advancement of GeneTherapies in the Clinic,Cell Gene Therapy Insights 2018;4(2),101-111.
发明内容
本发明的目的是提供具有特定结构的氨基酸序列的纳米抗体、包含该纳米抗体的多肽及其应用,以解决现有AAV富集、纯化、检测等方面面临的抗体制备工艺复杂、成本高,以及抗体亲和力、稳定性、结合谱差的问题。
为达到以上技术目的,本申请采用的技术方案如下:
第一方面,本发明提供一种纳米抗体,所述纳米抗体氨基酸序列中的可变区包括互补决定区CDR和框架区FR,所述互补决定区CDR包括互补决定区CDR1、互补决定区CDR2和互补决定区CDR3,其中,
所述互补决定区CDR1为包括下述式(I):
Ser-Gly-Xaa
所述互补决定区CDR2为包括下述式(II):
Xaa
所述互补决定区CDR3为包括下述式(III):
His-Val-Asp-Glu-Val-Arg-Xaa
其中,
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
优选地,所述互补决定区CDR1中,
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
优选地,所述互补决定区CDR2中,
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
所述Xaa
优选地,所述互补决定区CDR3中,
所述Xaa
Xaa
Xaa
优选地,所述框架区FR包括:框架区FR1、框架区FR2、框架区FR3和框架区FR4,框架区FR1、框架区FR2、框架区FR3和框架区FR4为同源性50%以上的氨基酸序列,优选为同源性70%以上的氨基酸序列,进一步优选为同源性95%以上的氨基酸序列;
更为优选地,所述框架区FR1为下述式(Ⅳ):
ValGlnLeuGlnGluSerGlyGlyGlyXaa
所述框架区FR2为下述式(Ⅴ):
Xaa
所述框架区FR3为下述式(Ⅵ):
Xaa
所述框架区FR4为下述式(Ⅶ):
TrpGlyGlnGlyThrGlnValThrValSerSer式(Ⅶ)(SEQ ID No:102);其中,
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
Xaa
优选地,所述框架区FR和所述互补决定区CDR按照先后顺序交错排布。
优选地,所述纳米抗体的氨基酸序列包括:SEQ ID No:1、SEQ ID No:2、SEQ IDNo:3、SEQ ID No:4、SEQ ID No:5、SEQ ID No:6、SEQ ID No:7、SEQ ID No:8、SEQ ID No:9、SEQ ID No:10、SEQ ID No:11、SEQ ID No:12、SEQ ID No:13、SEQ ID No:14、SEQ ID No:15、SEQ ID No:16、SEQ ID No:17、SEQ ID No:18、SEQ ID No:19、SEQ ID No:20、SEQ IDNo:21、SEQ ID No:22、SEQ ID No:23、SEQ ID No:24、SEQ ID No:25、SEQ ID No:26、SEQ IDNo:27、SEQ ID No:28、SEQ ID No:29、SEQ ID No:30、SEQ ID No:31、SEQ ID No:32、SEQ IDNo:33、SEQ ID No:34、SEQ ID No:35、SEQ ID No:36、SEQ ID No:37、SEQ ID No:38、SEQ IDNo:39、SEQ ID No:40、SEQ ID No:41、SEQ ID No:42、SEQ ID No:43、SEQ ID No:44、SEQ IDNo:45、SEQ ID No:46、SEQ ID No:47、SEQ ID No:48、SEQ ID No:49、SEQ ID No:50、SEQ IDNo:51、SEQ ID No:52、SEQ ID No:53、SEQ ID No:54、SEQ ID No:55、SEQ ID No:56、SEQ IDNo:57、SEQ ID No:58、SEQ ID No:59、SEQ ID No:60、SEQ ID No:61、SEQ ID No:62、SEQ IDNo:63、SEQ ID No:64、SEQ ID No:65、SEQ ID No:66、SEQ ID No:67、SEQ ID No:68、SEQ IDNo:69、SEQ ID No:70、SEQ ID No:71、SEQ ID No:72、SEQ ID No:73、SEQ ID No:74、SEQ IDNo:75、SEQ ID No:76、SEQ ID No:77、SEQ ID No:78、SEQ ID No:79、SEQ ID No:80、SEQ IDNo:81、SEQ ID No:82、SEQ ID No:83、SEQ ID No:84、SEQ ID No:85、SEQ ID No:86、SEQ IDNo:87、SEQ ID No:88、SEQ ID No:89、SEQ ID No:90、SEQ ID No:91、SEQ ID No:92、SEQ IDNo:93、SEQ ID No:94、SEQ ID No:95、SEQ ID No:96、SEQ ID No:97、SEQ ID No:98、SEQ IDNo:99、SEQ ID No:100、SEQ ID No:101、SEQ ID No:102、SEQ ID No:103、SEQ ID No:104、SEQ ID No:105、SEQ ID No:106、SEQ ID No:107、SEQ ID No:108、SEQ ID No:109、SEQ IDNo:110、SEQ ID No:111、SEQ ID No:112、SEQ ID No:113、SEQ ID No:114。
优选地,所述纳米抗体是人源化纳米抗体,优选地,所述人源化纳米抗体包括SEQID No:115、SEQ ID No:116、SEQ ID No:117、SEQ ID No:118、SEQ ID No:119、SEQ ID No:120。
第二方面,本发明提供一种多肽,是通过在上述的纳米抗体N-端和/或C-端氨基酸改造获得。
优选地,所述纳米抗体N-端和/或C-端氨基酸改造的方式包括:
方式一,在所述纳米抗体N-端和/或C-端氨基酸加标签;
方式二,在所述纳米抗体N-端和/或C-端氨基酸加铰链;
方式三,在所述纳米抗体N-端和/或C-端氨基酸加标签后,所述标签进一步连接保护氨基酸;
优选地,所述标签包括His-tag、GST-tag、Myc-tag、SUMO-tag、Strep-tag、Flag-tag中的至少一种,所述铰链包括GS铰链、IgG铰链、IgA铰链、PEG中的至少一种,所述保护氨基酸包括Ala、Gln、Glu、Met或者前述氨基酸的任意两种以上组合。
优选地,所述多肽的氨基酸序列包括:SEQ ID No:147、SEQ ID No:148、SEQ IDNo:149、SEQ ID No:150、SEQ ID No:151。
第三方面,本发明提供一种多肽,是通过上述的纳米抗体经多价合成获得。
优选地,所述多价合成包括二价、三价或四价合成;
优选地,所述二价合成的氨基酸序列包括:SEQ ID No:121、SEQ ID No:122;
优选地,所述二价合成的氨基酸是人源化二价多肽,进一步优选地,所述人源化二价多肽的氨基酸序列包括:SEQ ID No:123、SEQ ID No:124;
优选地,所述三价多肽的氨基酸序列包括:SEQ ID No:125、SEQ ID No:126、SEQID No:127、SEQ ID No:128、SEQ ID No:129、SEQ ID No:130、SEQ ID No:131、SEQ ID No:132、SEQ ID No:133;
优选地,所述四价多肽的氨基酸序列包括:SEQ ID No:134、SEQ ID No:135、SEQID No:136、SEQ ID No:137、SEQ ID No:138、SEQ ID No:139、SEQ ID No:140、SEQ ID No:141、SEQ ID No:142、SEQ ID No:143、SEQ ID No:144、SEQ ID No:145、SEQ ID No:146。
第四方面,本发明提供一种核酸,所述核酸编码上述的纳米抗体或上述的多肽。
第五方面,本发明提供一种表达载体,包含权利要求上述核酸的表达框。
第六方面,本发明提供一种宿主细胞,含有权利要求上述的表达载体。
第七方面,本发明提供所述的纳米抗体和/或所述的多肽在免疫检测、富集和或纯化上的应用。
优选地,所述纳米抗体和/或所述多肽在制备病毒吸附剂、病毒纯化试剂盒、病毒检测试剂盒上的应用;进一步优选地,所述病毒为AAV。
第八方面,本发明提供一种病毒吸附剂,包括载体基质和上述的纳米抗体和/或上述的多肽。
第九方面,本发明提供一种病毒纯化试剂盒,包括载体基质和上述的纳米抗体和/或上述的多肽。
第十方面,本发明提供一种病毒检测试剂盒,其特征在于,包括载体基质和上述的纳米抗体和/或上述的多肽。
第十一方面,本发明提供一种基于非诊断目的的AAV检测方法,将上述的纳米抗体和/或上述的多肽通过HRP偶联,然后采用直接酶免疫吸附测定法或者夹心酶免疫吸附测定法检测。
本发明的纳米抗体,是筛选发现的具有新的氨基酸序列的抗AAV的纳米抗体,该纳米抗体及其多肽具有很高的亲和力和活性,能够特异性地识别并结合AAV,通过该纳米抗体及其多肽制备的吸附剂对AAV的吸附能力极强,可应用于AAV亲和层析,有利于AAV亲和层析柱的工业化应用。此外还可以应用于AAV检测领域,并且可以将空衣壳和病毒粒子一并检出。
附图说明
图1是本发明实施例1中纯化后的纳米抗体;
图2是本发明实施例5中纳米抗体动力学传感图;
图3是本发明实施例7中二价纳米抗体示意图;
图4是本发明实施例11中直接法ELISA检测的标准曲线;
图5是本发明实施例11中夹心法ELISA检测的标准曲线。
具体实施方式
本发明的上述内容及其他方面将通过下文进一步描述清楚,其中:
(1)除非另外指明,术语“序列”用于本文时(如在类似“抗体序列”“可变区序列”“V
(2)除非另外指明,所有没有具体描述的方法、步骤、技术和操作为已知的并如本领域技术人员所熟知的。例如,参考仍旧参照上文所引用的综合背景技术以及其中所引用的其他参考文献。
(3)术语“特异性”是指特定的抗原结合分子(如本发明的纳米抗体或多肽)可以结合的不同类型的抗原或抗原决定簇的能力。一种抗原结合分子的特异性可以根据其亲和力和/或活性而确定。亲和力表示为抗原与抗原结合分子的解离平衡常数(K
(4)单域抗体(即纳米抗体)的氨基酸残基按照Kabat等“Serequence of proteinsof immunological interest[(免疫学目的的蛋白的序列),US Public Health Services(美国公众健康服务),Publication No.91]”给出的关于V
(5)术语“固载量”是指单位体积亲和介质(吸附剂)所偶联的配基的总量。
(6)术语“同族”是指结合相同抗原、具有相同氨基酸数且氨基酸序列同一性大于70%的纳米抗体序列族。
本发明的纳米抗体的氨基酸序列基本上包括互补决定区CDR和框架区FR。
上述互补决定区CDR包括互补决定区CDR1、互补决定区CDR2和互补决定区CDR3,上述框架区FR包括框架区FR1、框架区FR2、框架区FR3和框架区FR4。
上述互补决定区CDR1为包括下述式(I):
Ser-Gly-Xaa
上述互补决定区CDR2为包括下述式(II):
Xaa
上述互补决定区CDR3为包括下述式(III):
His-Val-Asp-Glu-Val-Arg-Xaa
其中,Xaa
和/或,Xaa
和/或,Xaa
其中,氨基酸取代通常可以描述为,其中氨基酸残基可以被具有相似化学结构的氨基酸取代,也可以被与其不相似化学结构的氨基酸取代,只要对其多肽的功能、活性或其他生物学特性几乎没有或基本上没有影响即可。优选为氨基酸残基可以被具有相似化学结构的氨基酸取代。
对于上述的取代方式,例如,可以列举文献WO04/037999,WO 98/49185,WO 00/46383和WO 01/09300中公开的情形,但并不限于此,此外,还可以列举基于WO 04/037999和WO 06/122786中所引用的其他参考文献的相关信息而选择所述取代的(优选)类型和/或结合。
本发明的氨基酸取代,可列举但不限于如下这样的取代方式,即,下列组(a)~(e)内的一个氨基酸被同组内另一个氨基酸取代:(a)Ala、Ser、Thr、Pro和Gly;(b)Asp、Asn、Glu和Gln;(c)His、Lys和Arg;(d)Met、Leu、Ile、Val和Cys;(e)Phe、Tyr和Trp。
优选的氨基酸取代可列举但不限于如下方式:Ala被取代成Gly或Ser;Arg被取代成Lys;Asn被取代成Gln或His;Asp被取代成Glu;Cys被取代成Ser或Thr;Gln被取代成Asn;Glu被取代成Asp;Gly被取代成Ala或Pro;His被取代成Asn或Gln;Ile被取代成Leu或Val;Leu被取代成Ile或Val;Lys被取代成Arg、Glu或Gln;Met被取代成Leu、Tyr或Ile;Phe被取代成Met、Tyr或Leu;Ser被取代成Thr;Thr被取代成Ser;Tyr被取代成Trp;Trp被取代成Tyr。
上述纳米抗体的氨基酸序列和结构除了3个互补决定区(CDR1~CDR3)以外,还包括框架区。
对于框架区,其与互补决定区相比更保守。本领域技术人员会根据纳米抗体的实际用途和功能对框架区的序列结构进行合理的筛选。作为框架区的氨基酸序列,优选同源性为50%以上的氨基酸序列,进而优选同源性为70%以上的氨基酸序列,进而优选为同源性为95%以上的氨基酸序列。
框架区对于亲和力的贡献较小,因此框架区的氨基酸取代一般不影响纳米抗体的亲和力,只要能以可溶形式存在,框架区氨基酸也适用上述氨基酸取代方式。其中,人源化是框架区氨基酸取代的一个典型例子,在本发明中A4-H1与A4-003的框架区氨基酸同源性为82%,A4-H3与A4-015的框架区氨基酸同源性为85%,均未影响原序列的亲和力。
作为框架区,可列举例为框架区FR1、框架区FR2、框架区FR3和框架区FR4,但可以认为不限于此。
作为上述框架区的具体例子,可列举如下:
上述框架区FR1为下述式(Ⅳ):
ValGlnLeuGlnGluSerGlyGlyGlyXaa
上述框架区FR2为下述式(Ⅴ):
Xaa
上述框架区FR3为下述式(Ⅵ):
Xaa
上述框架区FR4为下述式(Ⅶ):
TrpGlyGlnGlyThrGlnValThrValSerSer,(Ⅶ);其中,
Xaa
对于上述CDR区和FR区的氨基酸取代,可举例本发明的序列表中的SEQ ID No:1~SEQ ID No:114。
此外,纳米抗体的残基总数可以在110-120个区间。然而,纳米抗体的部分、片段或类似物不特别局限于它们的长度和/或大小,只要这样的部分、片段或类似物满足下文列出的进一步要求且还适于本文所述的目的。
本发明中的纳米抗体抗体属于同族纳米抗体,其氨基酸序列总长度相同,各个框架区FR和抗原结合区CDR长度相同且序列同一性高,结构相似,并具有基本相当的抗原结合能力。框架区FR和互补决定区CDR按照先后顺序交错排布,比如FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4。
作为“纳米抗体”的制备方法,在其最广泛意义上不限于具体的生物资源或具体的制备方法。例如,本发明的纳米抗体可以这样获得:(1)通过分离天然存在的重链抗体的V
此外,基于本发明纳米抗体的一种变型,还包括具有与天然存在的V
作为人源化的氨基酸序列的纳米抗体的具体例子,可列举SEQ ID No:115(记为“A4-H1”)、SEQ ID No:116(记为“A4-H2”)、SEQ ID No:117(记为“A4-H3”)、SEQ ID No:118(记为“A4-H4”)、SEQ ID No:119(记为“A4-H5”)、SEQ ID No:120(记为“A4-H6”),但并不限于此。
此外,本发明还涉及包含至少一个V
按照本发明的一个非限制性的实施方案,上述多肽基本上由纳米抗体组成。“基本上由……组成”指本发明的多肽的氨基酸序列与纳米抗体的氨基酸序列完全相同或相对应,其中有限数目的氨基酸残基,如1~10个氨基酸残基,并且优选的1~6个氨基酸残基,如1、2、3、4、5或6个氨基酸残基,加到所述纳米抗体或多肽的氨基末端(N-端)和/或羧基末端(C-端)。
上述氨基酸残基可以不改变纳米抗体的生物学特性,并且可以给所述纳米抗体加入其他官能性。例如,所述氨基酸残基可以:
a是纯化标签,即利于所述纳米抗体的纯化的氨基酸序列或残基,例如,使用针对所述序列或残基的亲和技术进行纯化。这种残基的一些优选的但非限定的实例是多组His-tag(His
b是可溶标签,即利于增加纳米抗体可溶性的标签,例如SUMO;
c是N-端氨基酸残基,例如,Met、Ala、Gln或MetAlaGln、AlaGln,借此可以在异源宿主细胞或宿主生物体内表达;
d是C-端Cys残基,例如,借此可以与配基上的-SH反应或与Au表面反应;
e是铰链,以提供纳米抗体与其他基团的链接或间隔,例如,GlySer的组合、IgG铰链、IgA铰链,或其他人工合成的铰链;
f是以已知的方式可以提供有官能团和/或已经被官能化的一个或多个氨基酸残基,例如,如本领域已知,氨基酸残基如赖氨酸或半胱氨酸允许PEG基团附着。
本发明的多肽还可以包括2个或多个所述纳米抗体,也称为多价多肽。
本发明的二价多肽包括2个纳米抗体,任选地通过一个铰链序列连接,本发明的三价多肽包括3个纳米抗体,任选地通过两个铰链序列连接,本发明的四价多肽包括4个纳米抗体,任选地通过三个铰链序列连接。
在本发明的多价多肽中,所述2个或多个纳米抗体可以是相同的或不同的。例如,本发明的多价多肽中的2个或多个纳米抗体:可以针对同一抗原,即针对所述抗原的相同表位或者针对所述抗原的2个或多个不同表位;可以针对不同抗原;或其组合。
例如,本发明的二价多肽AA或AB,可以包括2个相同的纳米抗体A,也可以包括两个不同的纳米抗体A和纳米抗体B,其中,纳米抗体A和B中至少一条选自本发明的纳米抗体;可以包括针对第一抗原的某一表位的第一纳米抗体和针对所述抗原同一表位或不同表位的第二纳米抗体;可以包括针对第一抗原的第一纳米抗体和针对与所述第一抗原不同的第二抗原的第二纳米抗体。作为二价多肽的氨基酸序列的具体例子,可列举例如SEQ ID No:121(记为“A4-B1”)、SEQ ID No:122(记为“A4-B2”)但不限于此。此外,作为人源化的二价多肽的具体例子,可列举SEQ ID No:123(记为“A4-B3”)、SEQ ID No:124(记为“A4-B4”),但并不限于此。
例如,本发明的三价多肽AAA、AAB、ABC,可以包括3个相同的纳米抗体A,可以包括2个相同的纳米抗体A和另一纳米抗体B,可以包括三个不同的纳米抗体A、纳米抗体B和纳米抗体C,其中,纳米抗体A、B、C中至少一条选自本发明的纳米抗体,三者顺序不限;可以包括针对同一抗原的相同的或不同的纳米抗体;可以包括针对第一抗原的相同的或不同的表位的2个相同或不同的纳米抗体和针对与所述第一抗原不同的第二抗原的第三纳米抗体;可以包括针对第一抗原的第一纳米抗体,针对与所述第一抗原不同的第二抗原的第二纳米抗体,和针对于所述第一和第二抗原不同的第三抗原的第三纳米抗体。
例如,本发明的四价多肽AAAA、AAAB、AABC、ABCD(顺序不限),可以包括4个相同的纳米抗体A,可以包括3个相同的纳米抗体A和另一纳米抗体B,可以包括2个相同的纳米抗体A和另外2个不同的纳米抗体B、纳米抗体C,可以包括4个不同的纳米抗体A、纳米抗体B、纳米抗体C和纳米抗体D,其中纳米抗体A、B、C、D中至少一条选自本发明的纳米抗体,四者顺序不限;可以包括针对同一抗原的相同的或不同的纳米抗体;可以包括针对第一抗原的相同的或不同的表位的2个相同或不同的纳米抗体和针对与所述第一抗原不同的第二抗原的第三纳米抗体;可以包括针对第一抗原的第一纳米抗体,针对与所述第一抗原不同的第二抗原的第二纳米抗体,和针对于所述第一和第二抗原不同的第三抗原的第三纳米抗体;可以包括针对第一抗原的第一纳米抗体,针对与所述第一抗原不同的第二抗原的第二纳米抗体,针对于所述第一和第二抗原不同的第三抗原的第三纳米抗体,和针对于所述第一和第二抗原不同和第三抗原不同的第四抗原的第四纳米抗体。
包含至少2个纳米抗体的本发明的多肽,其中至少1个纳米抗体针对第一抗原,并且至少1个纳米抗体针对不同于所述的第一抗原的第二纳米抗体(或针对第一抗原的不同表位的第二纳米抗体),还叫做“多特异性”抗体。因此,双特异性抗体是包括至少1个针对第一抗原的纳米抗体和至少1个针对第二抗原的其他纳米抗体,而三特异性抗体是包括至少1个针对第一抗原的纳米抗体,至少1个针对第二抗原的其他纳米抗体,和至少1个针对第三抗原的其他纳米抗体;等等。
作为多价多肽的氨基酸序列的具体例子,可列举三价多肽,其氨基酸序列为SEQID No:125(记为“A4-C1”)、SEQ ID No:126(记为“A4-C2”)、SEQ ID No:127(记为“A4-C3”)、SEQ ID No:128(记为“A4-C4”)、SEQ ID No:129(记为“A4-C5”)、SEQ ID No:130(记为“A4-C6”)、SEQ ID No:131(记为“A4-C7”)、SEQ ID No:132(记为“A4-C8”)、,SEQ ID No:133(记为“A4-C9”),可举例四价多肽,其氨基酸序列为SEQ ID No:134(记为“A4-D1”)、SEQ ID No:135(记为“A4-D2”)、SEQ ID No:136(记为“A4-D3”)、SEQ ID No:137(记为“A4-D4”)、SEQ IDNo:138(记为“A4-D5”)、SEQ ID No:139(记为“A4-D6”)、SEQ ID No:140(记为“A4-D7”)、SEQID No:141(记为“A4-D8”)、SEQ ID No:142(记为“A4-D9”)、SEQ ID No:143(记为“A4-D10”)、SEQ ID No:144(记为“A4-D11”)、SEQ ID No:145(记为“A4-D12”)、SEQ ID No:146(记为“A4-D13”),但不限于此。
关于包含一个或多个V
用于多价和多特异性多肽的铰链应该是本领域技术人员所熟知的,例如包括Gly-Ser,如在WO 99/42077中记载的(Gly
此外,除了所述1个或多个纳米抗体之外,本发明的多肽还可以包含官能团、部分或残基,如治疗活性物质,和/或标签,如荧光素标记、同位素标记、生物素标记和酶催化标签等。
此外,本发明的纳米抗体或多肽与AAV结合的解离平衡常数(K
上述抗原与抗原结合分子之间的特异性结合可以用已知的任何适当的方法确定,其包括,斯卡查德分析(Sercatchard Analysis)和/或竞争结合检测如放射性免疫分析(RIA)和酶联免疫分析(ELISA),以及本领域已知的其他新方法,如等离子共振技术(SPR)和/或生物膜干涉(BLI)技术等。
本发明的纳米抗体、多肽、及编码其的核酸,可以以已知的方式制备,本领域技术人员可有本文进一步描述而清楚。关于制备所述纳米抗体、多肽和核酸的一种特别有用的方法通常包括如下步骤:
(1)在适宜的宿主细胞或宿主生物体中或在另一种适宜的表达体系中,表达编码所述本发明的纳米抗体或多肽的核酸,任选地接着进行;
(2)分离和/或纯化这样获得的本发明的纳米抗体或多肽。
也可以是,采用其他方法包括如下步骤:
(3)在某种条件下培养和/或维持本发明的宿主,使本发明的宿主表达和/或生产一种本发明的纳米抗体和/或多肽;任选地接着进行;
(4)分离和/或纯化这样获得的本发明的纳米抗体或多肽。
本发明的核酸可以是单链或双链DNA或RNA的形式,并且优选的是双链DNA形式。例如,本发明的核酸序列可以是基因组DNA、cDNA或合成的DNA(如具有特别适用于在要用的宿主细胞或宿主生物体中表达的密码子应用的DNA,即,密码子优化)。
本发明的核酸可以以本质上已知的方法制备或获得,其基于本文给出的本发明的纳米抗体或多肽的氨基酸序列的信息,和/或可以从适当的天然来源分离。例如,对天然存在的V
本发明的核酸还可以是这样的形式,存在于和/或是遗传构建体的部分,这是本领域技术人员所熟知的。这样的遗传构建体通常包括至少一种本发明的核酸,可以是载体形式,如质粒、YAC、病毒载体或转座子。特别地,所述载体可以是表达载体,即,可以提供体外和体内表达的载体(如在适宜的宿主细胞、宿主生物体和/或表达系统中)。
本发明的核酸和/或本发明的遗传构建体可以用于转化宿主细胞或宿主生物体,即用于表达和/或生产本发明的纳米抗体或多肽。适宜的宿主或宿主细胞为本领域技术人员所熟知,例如可以是任何适当的真菌、原核或真核的细胞或细胞器或者生物体,例如:细菌菌株,其包括但不限于大肠杆菌(Escherichia coli)菌属和枯草芽孢杆菌杆菌(Bacillus subtilis)菌属;真菌细胞,其包括但不限于木霉属(Thrrichoderma)、曲霉属(Aspergillus)或其他丝状真菌;酵母细胞,其包括但不限于酵母属(Seraccharomyces)和毕赤酵母属(Pichia);两栖类细胞或细胞系,例如爪蟾卵母细胞(Xenopus oocytes);来源于昆虫的细胞或细胞系,如贪夜蛾(Serpodoptera)Serf9和Serf21细胞或果蝇属(Drosophila)的细胞系Serchneider和Kc细胞;植物或植物细胞,如烟草(tobacco)植物;哺乳动物细胞或细胞系,例如来源于人、和/或其他哺乳动物的细胞或细胞系,包括但不限于CHO-细胞、BHK-细胞、Hela细胞和CHS细胞等;以及本质上已知的用于表达和生产抗体和抗体片段(包括但不限于单一结构域抗体和ScFv片段)的所有其他宿主或宿主细胞,为本领域技术人员所熟知。
对于生产,本发明的纳米抗体和多肽可以在转基因哺乳动物的乳中产生,例如在兔、母牛、山羊或绵羊的乳中,也可在植物中或植物的部分中产生,所述植物部分包括但不限于它们的叶、花、果、根或种子。
如上文提及,应用纳米抗体的一个优点在于,基于此的多肽可以在原核系统中表达和制备,并且适宜的原核表达系统、载体、宿主细胞等为本领域技术人员所熟知,如上文所引用的参考文献。然而应该注意,本发明在其最广泛意义上并不限于在细菌系统中表达。
优选地,在本发明中,所述纳米抗体或多肽在细菌细胞中产生,特别是在适于大规模药物生产的细菌细胞中产生,如上文所述。
当在细胞中表达用来生产的本发明的纳米抗体或多肽时,本发明的纳米抗体或多肽可以在细胞内(如,细胞质或周质空间)产生,然后从宿主细胞分离,并且任选地进一步纯化;或者可以在细胞外产生(即分泌表达),然后从培养基分离,并且任选地进一步纯化。
与这些宿主细胞一起使用的一些优选的但非限制性的载体包括用于在哺乳动物细胞中表达的载体——pMANneo(Clonetech)、pUCTtag(ATCC37460)和pMClneo(Stratagene);用于在细菌细胞中表达的载体——pET载体(Novagen)和pQE载体(Qiagen);用于在酵母或其他真菌细胞中的表达载体——pYES2(Invitrogen)和毕赤表达载体(Pichaexpression vector)(Invitrogen);用于在昆虫细胞中的表达载体——pBlueBacⅡ(Invitrogen)和其他杆状病毒载体;等等。
用于转化本发明的宿主或宿主细胞的相应技术为本领域技术人员所熟知。
转化后,可以进行检测并选择已经成功转化本发明的核苷酸序列/遗传构建体的那些宿主。转化的宿主细胞(其可以是稳定的细胞系的形式)或宿主生物体(其可以是稳定的突变系或株系的形式)形成本发明的另一方面。
然后本发明的氨基酸序列可以从宿主细胞/宿主生物体和/或从培养所述宿主细胞或宿主生物体的培养基中分离,可以通过本质上已知的蛋白分离和/或纯化技术,诸如(制备)层析和/或电泳技术、差别沉淀技术、亲和技术(例如,使用与本发明的氨基酸序列融合的特异性的/可切割的氨基酸序列)和/或制备性免疫学技术(即使用针对要被分离的氨基酸序列的抗体)。
本发明的纳米抗体或多肽可以特异性结合所述抗原AAV,因此本发明的一个优选但非限制性的应用为AAV吸附剂,前述吸附剂包括载体基质和所述纳米抗体或多肽。
前述AAV包括按血清型分类的AAV1至AAV10,本发明的纳米抗体对不同血清型AAV具备广谱吸附能力。
前述载体基质可以为多孔材料,例如,琼脂糖凝胶微球、纤维素球、磁珠、硅胶微球、活性炭或树脂微球等。
用于前述吸附剂的载体可以通过商业购买来获得,作为具体例产品,例如,琼脂糖凝胶Sepharose CL-6B(GE Healthcare,US),树脂微球Nanomicro系列(苏州纳微科技有限公司),但并不限于这些产品。
在使用上述载体时,优选地,可以将上述载体活化。该活化方式例如可以使用但不限于如下方法:首先进行环氧活化,其次再进行二胺丙基亚胺(DADPA)活化,最后进行碘乙酸活化,等。
前述吸附剂通过将纳米抗体或多肽偶联到经过活化的载体上而得到,具体的方法没有特别限定,例如,可通过将纯化的纳米抗体或多肽溶液与载体混合,并通过离心分离,最终通过对凝胶进行清洗/过滤而得到最终的吸附剂。
本发明的吸附剂可以用来特异性识别AAV。
本发明的纳米抗体或多肽或吸附剂可用于纯化AAV,还可用于制备检测AAV的试剂盒。
实施例
以下,举出实施例来说明本发明的具体实施方式,但本发明的实施方式不受如下这些实施例的限制,可在不影响本发明所要达到的技术效果的范围内做出任意选择和变更。
A.筛选特异性结合AAV的纳米抗体
实施例1
抗AAV纳米抗体文库的构建。
本发明使用的噬菌体展示库是以T7噬菌体为载体的免疫库,建立步骤如下:
(1)用AAV免疫羊驼(编号为1139和462),免疫四次后采取两只羊驼的颈静脉血,分离外周血淋巴细胞,并提取总RNA(PuerLink
(3)将总RNA反转录为cDNA,并用采用两轮巢式PCR扩增V
其中第一轮PCR以cDNA为模版,以UP primer1和DOWN primer1分别为上游和下游引物,扩增后回收大小为650~750bp的条带,并以此为第二轮PCR的模板,上、下游引物分别为UP primer2,DOWN primer2,回收450~500bp的PCR产物;
UP primer1:CTTGGTGGTCCTGGCTGCTCT(SEQ ID No:152),
DOWN primer1:GGTACGTGCTGTTGAACTGTTCC(SEQ ID No:153),
UP primer2:TATCTAGTCGAATTCCGCCCAGGTGCAGCTC(SEQ ID No:154),
DOWN primer2:AGCGACTAAGCTT TTGTGGTTTTGGTGTC(SEQ ID No:155);
(3)用EcoRΙ和HindⅢ双酶切PCR产物,并进行琼脂糖电泳,回收350~500bp的基因条带,即为V
(4)用T4连接酶连接T7载体(
(5)将连接产物与包装蛋白混合,组成完整的T7噬菌体,将混合物进行扩增,得到噬菌体原始文库;
(6)经检测,该原始库的滴度为3.14×10
实施例2
纳米抗体的筛选。
首先将抗原(AAV2)用TBS稀释为10μg/mL,取100μL加入96孔板中,4℃孵育12h。将孔中的抗原稀释液吸出,用TBS洗板3次,拍干,加入1%无蛋白封闭液(购自生工生物工程有限公司),300μL/孔,室温孵育2h(筛选时1%无蛋白封闭液和1%BSA交替使用)。将孔中封闭剂吸出,用TBST洗板6次,拍干,加入扩增的噬菌体,100μL/孔,室温孵育30min。用TBST洗板10次,加入T7洗脱缓冲液(1%SDS)洗脱噬菌体,室温孵育30min,并将洗脱液扩增,用于下一轮筛选。
再将抗原(AAV5)按同样的方法稀释、包被,将上述洗脱液再次孵育、淘选、扩增,用于下一轮筛选。
将抗原(AAV8)按同样的方法稀释、包被,将上述洗脱液再次孵育、淘选、扩增,用于下一轮筛选。
将抗原(AAV9)按同样的方法稀释、包被,将上述洗脱液再次孵育、淘选、扩增。
实施例3
基因工程菌的构建
(1)经过四轮筛选之后,将筛选洗脱液进行固体扩增,挑取噬菌斑,以噬菌斑扩增液为模板,以UP primer3和DOWN primer3为上、下游引物,进行PCR扩增;
UP primer3:TTCCTTAACATATGGCCCAGGTGCAGCTCGT(SEQ ID No:156),DOWNprimer3:TTAAGGAACTCGAGCACGGTGACCAGGGTC(SEQ ID No:157);
(2)将一部分PCR产物委外测序,即得到所述纳米抗体序列信息,序列信息如表1所示。
(3)将另一部分PCR产物用NdeΙ和XhoΙ进行双酶切,并回收酶切产物。同时用相同的方法进行酶切并回收载体,用T4连接酶连接酶切产物及载体,将连接产物转入大肠杆菌,得到表达AAV特异性纳米抗体的基因工程菌。
表1纳米抗体序列信息
/>
实施例4
AAV纳米抗体的制备
(1)纳米抗体的基础培养基为TB培养基,按照5%接种量接种,37℃培养3~5h,加入诱导剂半乳糖苷(IPTG)(终浓度0.25mM,下同)进行过夜诱导;
(2)诱导结束后,在4000rpm的条件下离心20min,获得含有纳米抗体的湿菌。
(3)向所得的湿菌中按照1:10的比例加入裂解液(10mM咪唑,500mM NaCl,pH7.40.02M PB),使用700bar高压匀浆机进行细胞破碎;
(4)在4℃、10000rpm的条件下离心20min,取上清;
(5)将上清液通过0.45μm滤器过滤,然后经过亲和层析柱(GE Healthcare,US)进行AAV纳米抗体的分离纯化,其中亲和层析柱的填料为Ni Sepharose High Perfomance;
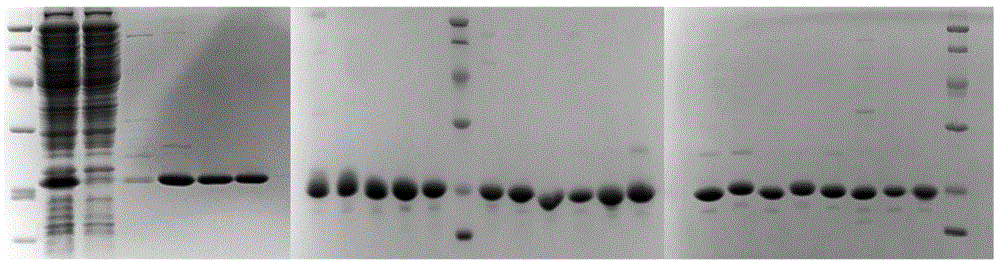
(6)将经过亲和层析纯化后的纳米抗体进行SDS-PAGE电泳以判断纯度,选取纯度较高的蛋白溶液使用BCA法进行蛋白浓度的测定。纯化的纳米抗体的SDS-PAGE显示在图1中,纳米抗体条带正确,一次纯化后纯度较高。由于本发明的纳米抗体属于同一族,其分子量和带电量近似,因此其电泳条带位置也大致相同,为了简明仅列出A4-001(SEQ ID No:1)~A4-022(SEQ ID No:22)的电泳图。图一从左到右,依次为:
左图:蛋白marker、A4-001(SEQ ID No:1)全菌破碎后的上清、沉淀、纯化过程中的流穿、纯化后的A4-001~A4-003(SEQ ID No:1~3)(按照左图中从左到右的顺序),
中图:纯化后的A4-004~A4-008(SEQ ID No:4~8)、蛋白marker、纯化后的A4-009-A4-014(SEQ ID No:9~14)(按照左图中从左到右的顺序),
右图:纯化后的A4-015-A4-022(SEQ ID No:15~22)、蛋白marker(按照左图中从左到右的顺序)。
实施例5
应用SPR技术分析纳米抗体对AAV的结合能力。将AAV以500~800RU的密度氨基偶联到CM5传感器芯片上,以1~100nM范围内的7个不同浓度注射纳米抗体,在所有实验中流速为45μL/min。芯片再生条件为甘氨酸-HCl pH1.5。使用在不同纳米抗体浓度下获得的结合曲线来计算动力学参数K
表2纳米抗体对不同AAV的亲和力
/>
/>
/>
B.抗AAV纳米抗体的序列优化
实施例6:纳米抗体人源化改造及亲和力测定
人源化方法1
将纳米抗体A4-015、A4-036的蛋白序列与人种系进行比对,在框架区标记出差异氨基酸,然后用定点突变的方式将二者部分具有差异的氨基酸替换为人源氨基酸,产生人源化的纳米抗体A4-H3、A4-H4、A4-H5、A4-H6。随后进行人源化纳米抗体的表达与纯化。
人源化方法2
将纳米抗体的蛋白序列与人种系进行比对,将A4-003的互补决定区序列移植到人种系抗体框架区,通过基因合成方式产生人源化的纳米抗体序列A4-H1和A4-H2。随后进行人源化纳米抗体的表达与纯化。
(1)人源化纳米抗体的基础培养基为TB培养基,按照5%接种量接种,37℃培养3~5h,加入诱导剂半乳糖苷(IPTG)进行过夜诱导;
(2)诱导结束后,在4000rpm条件下离心20min,获得含有人源化纳米抗体的湿菌;
(3)向所得的湿菌中按照1:10的比例加入裂解液(10mM咪唑,500mM NaCl,pH7.40.02M PB),使用700bar高压匀浆机进行细胞破碎;
(4)在4℃、10000rpm的条件下离心20min,取上清;
(5)将上清液通过0.45μm滤器过滤,然后经过亲和层析柱(GE Healthcare,US)进行人源化纳米抗体的分离纯化,其中亲和层析柱的填料为Ni Sepharose HighPerfomance;
(6)将经过亲和层析纯化后的纳米抗体进行SDS-PAGE电泳判断纯度,选取纯度较高的蛋白溶液使用BCA法进行蛋白浓度的测定。
应用SPR技术分析人源化纳米抗体对AAV的结合能力
将AAV以500~800RU的密度氨基偶联到CM5传感器芯片上,以1~100nM范围内的6个不同浓度注射纳米抗体,在所有实验中流速为45μL/min。芯片再生条件为甘氨酸-HClpH1.5。使用在不同纳米抗体浓度下获得的结合曲线来计算动力学参数K
与原序列相比,人源化后的纳米抗体与抗原AAV的亲和力没有显著降低,对相关抗原的亲和力仍维持在相同的数量级。例如,A4-003对AAV8、AAV2、AAV9、AAV5的亲和力大小分别为1.2×10
表3人源化纳米抗体的动力学参数
实施例7:序列优化策略2
多价抗体改造及亲和力测定
1.二价抗体制备
设计特异性结合AAV的二价多肽序列的氨基酸序列,如A4-B1、A4-B2、A4-B3和A4-B4所示。其由C-末端纳米抗体A、15氨基酸Gly/Ser接头和C-末端纳米抗体B组成(如图3所示)。其中,纳米抗体A和纳米抗体B可以相同,也可以不同。A4-B1的纳米抗体A为A4-015,纳米抗体B与A相同;A4-B2的纳米抗体A为A4-014,纳米抗体B为A4-012;A4-B3的纳米抗体A为A4-H1,纳米抗体B与A相同;A4-B4的纳米抗体A为A4-H1,纳米抗体B为A4-H4。
人工合成这些二价多肽的DNA序列,并将DNA片段连接到pET23a载体上,构建二价多肽质粒,并转化进入大肠杆菌,得到二价多肽工程菌。
随后进行二价多肽的表达与纯化:
(1)二价多肽的基础培养基为TB培养基,按照体积比为5%的接种量进行接种,37℃培养3~5h,加入诱导剂半乳糖苷(IPTG)(终浓度0.25mM)进行过夜诱导;
(2)诱导结束后,在4000rpm的条件下离心20min,获得含有二价多肽的湿菌。
(3)向所得的湿菌中按照1:10的比例加入裂解液(10mM咪唑,500mM NaCl,pH7.40.02M PB),使用700bar高压匀浆机进行细胞破碎;
(4)在4℃、10000rpm的条件下离心20min,取上清;
(5)将上清液通过0.45μm滤器过滤,然后经过亲和层析柱(GE Healthcare,US)进行二价多肽的分离纯化,其中亲和层析柱的填料为Ni Sepharose High Perfomance;
(6)将经过亲和层析纯化后的纳米抗体进行SDS-PAGE电泳判断纯度,选取纯度较高的蛋白溶液使用BCA法进行蛋白浓度的测定。
2.三价抗体制备
设计特异性结合AAV的三价多肽序列的氨基酸序列,如A4-C1、A4-C2、A4-C3、A4-C4、A4-C5、A4-C6、A4-C7、A4-C8、A4-C9所示。其由纳米抗体A-(GGGGS)
人工合成这些三价多肽的DNA序列,并将DNA片段连接到pET23a载体上,构建三价多肽质粒,并转化进入大肠杆菌,得到三价多肽工程菌。
随后进行三价多肽的表达与纯化,表达纯化过程同上。
3.四价抗体制备
设计特异性结合AAV的四价多肽序列的氨基酸序列,如A4-D1、A4-D2、A4-D3、A4-D4、A4-D5、A4-D6、A4-D7、A4-D8、A4-D9、A4-D10、A4-D11、A4-D12和A4-D13所示。其由纳米抗体A-(GGGGS)
人工合成这些四价多肽的DNA序列,并将DNA片段连接到pET23a载体上,构建四价多肽质粒,并转化进入大肠杆菌,得到四价多肽工程菌。
随后进行四价多肽的表达与纯化,表达纯化过程同上。
应用SPR技术分析多价多肽对AAV的结合能力。
将AAV以500-800RU的密度氨基偶联到CM5传感器芯片上,以1-50nM范围内的5个不同浓度注射纳米抗体,在所有实验中流速为45μL/min。芯片再生条件为甘氨酸-HCl pH1.5。使用在不同纳米抗体浓度下获得的结合曲线来计算动力学参数K
由此可知,与单价纳米抗体相比,多价形式的纳米抗体与抗原AAV的亲和力有不同程度的提高。主要表现为解离常数K
表4多价纳米抗体的动力学参数
实施例8:序列优化策略3
纳米抗体N-端、C-端氨基酸改造及亲和力测定。可以通过基因工程改造、翻译后修饰以及蛋白质工程等技术,在纳米抗体或多价纳米抗体的N-端、C-端分别或同时增加一个或多个氨基酸标签(如组氨酸标签、生物素连接酶标签、HA标签、sumo标签、GST标签、巯基标签、聚赖氨酸标签、凝血酶标签、肠激酶标签等),必要时可以在氨基酸标签上增加氨基酸接头,以实现纳米抗体高效表达、修饰、纯化、功能化等目的,而不影响纳米抗体的抗原结合能力。
设计纳米抗体C-端修饰的氨基酸序列,如A4-T1(SEQ ID No:147)、A4-T2(SEQ IDNo:148)和A4-L1(SEQ ID No:149)所示。A4-T1由A4-017与C-端6×His-tag组成;A4-T2由A4-017与C-端GGGGS和6×His-tag组成;A4-L1由A4-017与C-端IgA铰链(SerThrProProThrProSerProSerThrProPro)和6×His-tag组成。
设计纳米抗体N-端修饰的氨基酸序列,如A4-M1(SEQ ID No:150)和如A4-M2(SEQID No:151)所示。A4-M1由A4-017与N-端氨基酸MetAlaGln组成;A4-M2由A4-017与N-端氨基酸Met组成。
人工合成上述纳米抗体的DNA序列,并将DNA片段连接到pET23a载体上,构建质粒,并转化进入大肠杆菌,得到改造后的纳米抗体工程菌。
随后进行改造纳米抗体的表达与纯化:
(1)基础培养基为TB培养基,按照5%接种量接种,37℃培养3~5h,加入诱导剂半乳糖苷(IPTG)进行过夜诱导;
(2)诱导结束后,在4000rpm条件下离心20min,获得含有目的序列的湿菌。
(3)向所得的湿菌中按照1:10的比例加入裂解液(10mM咪唑,500mM NaCl,pH7.40.02M PB),使用700bar高压匀浆机进行细胞破碎;
(4)在4℃、10000rpm的条件下离心20min,取上清;
(5)将上清液通过0.45μm滤器过滤,然后经过亲和层析柱(GE Healthcare,US)进行分离纯化,其中亲和层析柱的填料为Ni Sepharose High Perfomance;
(6)将经过亲和层析纯化后的纳米抗体进行SDS-PAGE电泳判断纯度,选取纯度较高的蛋白溶液使用BCA法进行蛋白浓度的测定。
应用SPR技术分析改造纳米抗体对AAV的结合能力
将AAV以500-800RU的密度氨基偶联到CM5传感器芯片上,以1-50nM范围内(50nM、25nM、12.5nM、6.25nM、1.5625nM)的5个不同浓度注射纳米抗体,在所有实验中流速为45μL/min。芯片再生条件为甘氨酸-HCl pH1.5。使用在不同纳米抗体浓度下获得的结合曲线来计算动力学参数K
表5C-端修饰纳米抗体的动力学参数
C.AAV吸附剂的制备
实施例9AAV吸附剂制备
琼脂糖凝胶的活化。取琼脂糖微球2g,加入2mol/L NaOH,1,4-丁二醇二缩水甘油醚0.8mL,按该比例混合后,反应60min以上。反应结束后,用大量去离子水洗涤凝胶后将其抽滤成湿饼。
AAV纳米抗体的固载。取活化后的琼脂糖凝胶载体材料,加入2mL纳米抗体溶液(本实施例配制纳米抗体溶液采用PBS,还可以采用生理盐水或是纯水),于37℃、250rpm偶联反应24h。反应结束后加入3倍体积的乙醇胺(体积比6%,pH 9.0)过夜封闭,得到AAV吸附剂。
①纳米抗体为A4-002,浓度为10.38mg/mL,胶水比为1:3,胶上环氧密度为3μmol/g,最终纳米抗体偶联量为11.58mg/g吸附剂。记为吸附剂A。
②纳米抗体为A4-008,浓度为6.75mg/mL,胶水比为1:5,胶上环氧密度为3μmol/g,最终纳米抗体偶联量为9.77mg/g吸附剂。记为吸附剂B。
③纳米抗体为A4-008,浓度为6.75mg/mL,胶水比为1:7,胶上环氧密度为3μmol/g,最终纳米抗体偶联量为10.74mg/g吸附剂。记为吸附剂C。
④纳米抗体为A4-014,浓度为3.19mg/mL,胶水比为1:8,胶上环氧密度为2μmol/g,最终纳米抗体偶联量为3.12mg/g吸附剂。记为吸附剂D。
⑤纳米抗体为A4-024,浓度为5.14mg/mL,胶水比为1:6,胶上环氧密度为2μmol/g,最终纳米抗体偶联量为6.36mg/g吸附剂。记为吸附剂E。
实施例10AAV制备
培养HEK293T细胞,在转染前一天更换为无抗生素培养基,培养12-24h,使细胞密度达到80%。
准备EZ-Trans-DNA复合物。A管:pAAV-hrGFP、pAAV-RC、pHelper三者摩尔比为1:1:1三个质粒总共为36μg/15mL细胞,用DMEM补足;B管:108μL EZ Trans转染试剂稀释,用DMEM。混匀。室温静置10-15min。
转染细胞。将配置好的转染体系分别缓慢滴加到培养皿中,3mL/皿;缓慢摇晃培养皿以混匀,置于培养箱中培养。培养24h后换液,换新的培养基,同时使用荧光显微镜观察转染效率。
病毒收集。转染后48-72h可以收取病毒,用细胞刮铲将细胞刮下,收集于50mL离心管中,200×g离心5min收集细胞沉淀。用PBS重悬细胞并超声破碎。
实施例11AAV吸附剂的吸附性能评价
将1mL制备的AAV吸附剂装进色谱柱,柱高2厘米。装柱后首先使用平衡缓冲液冲洗;随后进行上样,上样后再使用平衡缓冲液冲洗;随后以洗脱缓冲液进行洗脱。测定上样、流穿、平衡液及洗脱液中AAV的总量,计算AAV收率。其中,VP表示病毒衣壳粒子数。
AAV收率=AAV洗脱量(VP)÷AAV结合量(VP)×100%
平衡缓冲液:10mM Tris-300mM NaCl,pH 7.6;洗脱缓冲液:0.1M NaAc、0.5MNaCl,pH1.5。
吸附剂A对AAV2的结合量为9.40×10
吸附剂B对AAV2的结合量为9.10×10
吸附剂C对AAV2的结合量为1.21×10
吸附剂D对AAV2的结合量为4.93×10
吸附剂E对AAV2的结合量为7.65×10
综上,本发明所制备的AAV吸附剂对不同血清型的AAV均有结合能力,且收率高,是一种新型广谱性AAV吸附剂,可用于不同血清型AAV的纯化。
实施例11AAV检测试剂盒制备
将纳米抗体A4-021换液至PBS(pH7.4)浓度约10mg/mL,使用HRP偶联试剂盒(abcam,
直接法ELISA检测方法:
在高疏水96孔板上加入AAV标准品或待测样品,水平摇床上孵育2小时,使用PBS洗板;使用1%~3%脱脂奶粉进行封闭,使用PBS洗板;加入用HRP偶联的纳米抗体A4-021,水平摇床上孵育2小时,使用PBS洗板;加入TMB工作液,室温避光孵育30min,加入2M硫酸终止液终止反应,测定OD
夹心法ELISA检测方法:
在高疏水96孔板上包被捕获配体,4℃避光过夜孵育,使用PBS洗板;使用1%~3%脱脂奶粉进行封闭,使用PBS洗板;加入AAV标准品或待测样品,水平摇床上孵育2小时,使用PBS洗板;加入用HRP偶联的纳米抗体A4-021,水平摇床上孵育2小时,使用PBS洗板;加入TMB工作液,室温避光孵育30min,加入2M硫酸终止液终止反应,测定OD
捕获配体可以是纳米抗体A4-021或本发明中其他纳米抗体,也可以是抗AAV抗体,也可以是其他能结合AAV的配体分子。本实施例所用的捕获抗体为A4-040。
本发明的试剂盒测AAV8的标准曲线如图4和图5所示,其中图4为直接法ELISA检测的标准曲线,图5为夹心法ELISA检测的标准曲线,二者R
现有技术是使用实时定量PCR检测技术检测包含DNA的病毒粒子,无法检测空衣壳,本发明可以将空衣壳和病毒粒子一并检出。空衣壳的检出非常重要,因为空衣壳对治疗无益,甚至可能增加免疫原性。因此,定量检出空衣壳并控制其含量,是AAV制备中的关键一环。
产业上的可利用性
本发明的纳米抗体是通过噬菌体库的筛选发现的具有新的氨基酸序列的抗AAV纳米抗体,该纳米抗体及其多肽具有很高的亲和力和活性,能够特异性地识别并结合AAV,制备的亲和层析柱对AAV的吸附能力极强,可用于AAV纯化,制备的检测试剂盒可用于检测AAV并定量分析。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
