一种菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂及其应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及生物大分子技术领域,具体涉及一种菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂及其应用。
背景技术
丝氨酸蛋白酶抑制剂是一类分布广泛于植物、动物、微生物等中,是丝氨酸蛋白酶活性的调节剂。根据其序列的同源性、半光氨酸残基和分子中二硫键的数目,丝氨酸蛋白酶抑制剂可分为Kunitz、Kazal、Bowman-Birk、Serpin、TIL(Trypsin Inhibitor LikeCysteine Rich Domain)等几个家族。Serpin类丝氨酸蛋白酶抑制剂作为最大的丝氨酸蛋白酶抑制剂家族,存在于植物、动物、细菌及微生物等几乎所有的生命形式中。Serpin在多种生理和生化途径中发挥关键作用,包括炎症、免疫调节、肿瘤发生、血淋巴凝固、PPO激活、抗菌活性和癌症转移、精子发育、对糖脂代谢的调控等。有研究已有报道Serpin在人类代谢疾病中有良好的应用前景。
小菜蛾(Plutellaxylostella)是十字花科作物的重要害虫,每年造成严重的经济损失。由于其繁殖能力强、寄主范围广、环境适应力强等特点,普通的化学农药难以对其进行根治且极易产生抗药性,因此小菜蛾的生物防治尤为重要。
菜蛾盘绒茧蜂(Cotesia vestalis)是小菜蛾幼虫的容性内寄生蜂,具有田间分布广、寄生率高等特点,是小菜蛾的优势天敌,在小菜蛾的生物防治中起着重要的作用。畸形细胞(teratocytes)是菜蛾盘绒茧蜂(Cotesia vestalis)-小菜蛾(Plutella xylostella)寄生体系中重要寄生因子之一,在蜂卵孵化时由胚胎浆膜层裂解并释放、分散到寄主血淋巴中,通过分泌包括serpin在内的多种蛋白调控寄主的生长发育、免疫及营养代谢等生理过程。
比如,公开号为CN107523572A的专利申请公开了一种菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT SPI基因及应用。该基因的核苷酸序列如SEQ ID NO.1所示,由该基因编码的蛋白,其氨基酸序列如SEQ ID NO.2所示。由该基因体外原核表达获得的重组蛋白能够有效抑制其寄主小菜蛾血淋巴酚氧化酶原的激活,从而抑制寄主血淋巴的黑化作用,减弱寄主的免疫反应,为获得新型转基因抗虫作物提供了序列参考。该重组蛋白能够抑制枯草杆菌蛋白酶A,胰蛋白酶和猪胰腺弹性蛋白酶的活性,对于开发丝氨酸蛋白酶抑制剂类药物具有重要的意义。然而,目前还没有昆虫来源的serpin应用于抗菌药物的报道。
发明内容
本发明针对现有技术中存在的不足,提供了一种菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat。
本发明提供了菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat,氨基酸序列如SEQ ID No.2所示。
本发明还提供了编码所述菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制CvT-SPN-bacteriostat的基因。优选的,所述基因的核苷酸序列如SEQ ID No.1所示。
本发明还提供了包含所述基因的重组表达载体。
本发明还提供了包含所述重组表达载体的重组表达细胞,其中,宿主细胞为大肠杆菌BL21。
本发明还提供了所述菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制CvT-SPN-bacteriostat在制备丝氨酸蛋白酶抑制剂中的应用。
本发明还提供了所述菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制CvT-SPN-bacteriostat在制备抗菌药物中的应用。所述抗菌药物用于针对的病原菌为大肠杆菌或金黄色葡萄球菌。
本发明还提供了所述菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制CvT-SPN-bacteriostat在制备食品防腐剂中的应用。
与现有技术相比,本发明的有益效果在于:
1、本发明的菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因序列经基因数据库比对分析,未发现任何相同基因。本发明的菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因所编码的氨基酸序列进行蛋白数据库比对分析,未发现任何相同蛋白。
2、本发明通过提取菜蛾盘绒茧蜂总RNA,经反转录得到cDNA为模板,构建cDNA文库,测序获得菜蛾盘绒茧蜂以及畸形细胞转录组,筛选畸形细胞表达特异的丝氨酸蛋白酶抑制剂的EST序列标签,并通过RACE方法得到CvT-SPN-bacteriostat的cDNA全长序列。得到CvT-SPN-bacteriostat的cDNA核苷酸序列后,利用原核表达的方法进行诱导表达蛋白,利用GST-tag能够在较短的时间内获得大量的可溶性CvT-SPN-bacteriostat重组蛋白,为进行CvT-SPN-bacteriostat的活性实验提供了便利。
3、本发明克隆了一个菜蛾盘绒茧蜂丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因的cDNA的序列,该基因编码的氨基酸序列比对结果显示,CvT-SPN-bacteriostat含有一个serpin结构域,该菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶CvT-SPN-bacteriostat基因体外原核表达获得的重组蛋白能够有效抑制病原菌大肠杆菌和金黄色葡萄球菌的生长,保护寄主体内的幼蜂免受病原菌的侵染,从而有利于寄生蜂幼虫在小菜蛾体内的生长发育,为提高寄生蜂的生物防治效率,也为研发食品防腐剂以及抗菌药物提供了科学依据。同时,该重组蛋白能够抑制枯草芽孢杆菌蛋白酶和胰蛋白酶的活性,对于研制新型serpin类抑制剂类药物具有重要的参考价值。
附图说明
图1为菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat的基因编码序列验证结果图。
图2为菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat与其他已知功能的物种的的反应中心环(reactive center site,RCL)氨基酸多重序列比对分析结果图,其中下划线标注CvT-SPN-bacteriostat的serpin保守氨基酸序列;P 1位点的氨基酸是精氨酸(Arg)。
图3为菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因诱导原核表达和纯化的蛋白电泳图,其中泳道1-5分别代表:未添加诱导剂IPTG的蛋白样品;加入终浓度0.5mM的IPTG诱导的蛋白样品;加入终浓度0.5mM的IPTG诱导的超声破碎可溶性蛋白样品;加入终浓度0.5mM的IPTG诱导的超声破碎包涵体蛋白样品:纯化浓缩后的蛋白样品。泳道M代表:蛋白Marker。
图4为菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因原核表达获得的重组蛋白对胰蛋白酶和枯草芽孢杆菌蛋白酶的抑制效果检测图。GST为阴性对照。
图5为添加100ng/μL菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因原核表达获得的重组蛋白对病原菌大肠杆菌的生长抑制作用检测结果图;其中空白对照是等体积的PBS,阴性对照是等量的GST,阳性对照是1mg/ml氨苄青霉素。
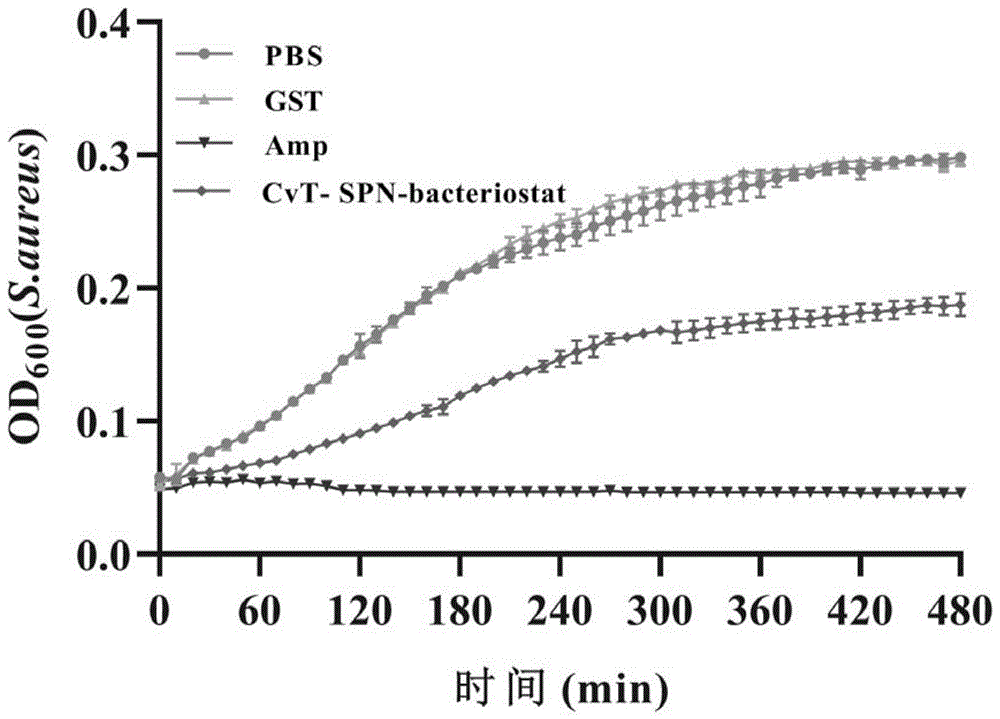
图6为添加100ng/μL菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因原核表达获得的重组蛋白对病原菌金黄色葡萄球菌的生长抑制作用检测结果图;其中空白对照是等体积的PBS,阴性对照是等量的GST,阳性对照是1mg/ml氨苄青霉素。
具体实施方式
本发明菜蛾盘绒茧蜂丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因,该基因的开放阅读框(ORF)是1011bp,其序列如SEQ ID NO.1所示,编码336个氨基酸,其氨基酸序列为SEQ ID NO.2所示的氨基酸组成的蛋白质。
本发明中菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因cDNA的克隆方法是通过将菜蛾盘绒茧蜂总RNA进行反转录得到cDNA文库,结合菜蛾盘绒茧蜂基因组和转录组,筛选得到含有serpin结构域的序列,然后通过RACE方法扩增得到基因全长。
本发明中菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat重组蛋白的表达载体是PGEX-6P-1,本发明也提供了含有菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制CvT-SPN-bacteriostat基因的表达载体PGEX-6P-1的表达菌株大肠杆菌BL21。
本发明进一步提供了所述重组蛋白的制备方法,本发明提供了一种菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因重组蛋白制备方法,流程包括:将菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因的第1到1011位之间的序列连接到PGEX-6P-1,获得重组表达质粒,利用大肠杆菌BL21原核表达系统诱导表达,用GST纯化柱柱纯化超声波裂解获得的可溶性重组蛋白,然后使用超滤离心管进行去溶液替换并浓缩得到CvT-SPN-bacteriostat蛋白的水溶液。
本发明进一步提供了所得丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因的用途:用于制备菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂蛋白,该蛋白酶抑制剂能够有效抑制入侵寄主小菜蛾的病原菌大肠杆菌和金黄色葡萄球菌的生长,该蛋白酶抑制剂在控制有害生物和开发抗菌药物和食品防腐剂等方面具有潜在的应用价值。
本发明中丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因体外获得的重组蛋白可以有效抑制胰蛋白酶和枯草芽孢杆菌蛋白酶的活性,为开发在蛋白酶抑制剂类药物提供了序列支持。
实施例1
菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因的cDNA克隆和序列分析。
1.1畸形细胞的收集
本发明中使用的小菜蛾(Plutella xylostella)和菜蛾盘绒茧蜂(Cotesiavestalis)均于2012年2月20日采自杭州郊区蔬菜地,并在实验室维持种群。实验研究时采用个体繁殖法获得寄生后小菜蛾,向指形管内吹入5头经交配后的雌蜂,然后把指形管倒扣在桌面上。将1头3龄中期的小菜蛾幼虫放入指形管,等到寄生蜂寄生该小菜蛾后,立刻用毛笔刷将寄主从指形管中移出,并换另一头小菜蛾重复。寄生后的小菜蛾幼虫放回培养箱培养,用于后续实验。取100头寄生后7天的小菜蛾用75%的乙醇洗涤虫体表面,然后用滤纸吸干虫体表面的水分待用。在1×PBS与昆虫细胞培养基中(体积比1∶1),用镊子将虫体从头至尾全部撕开,注意不要撕破中肠,让幼蜂进入培养皿,并尽可能让小菜蛾的血淋巴流出。解剖完之后,将PBS-培养基-血淋巴混合液静置20min,使血细胞贴壁,避免血细胞的污染。均匀晃动培养皿,让畸形细胞聚集,用枪头吸取畸形细胞用10μl的枪头将畸形细胞吸入到含有新的培养基的培养皿中,反复清洗3次。最后,将收集到的畸形细胞置于研磨机上研磨。
1.2TRIzol法提取总RNA
(1)畸形细胞中加入1ml TRIzol充分匀浆,室温静置5min,使其充分裂解。
(2)加入200μl氯仿,轻柔振荡15s,室温静置2min。
(3)4℃离心,12000g,离心15min,可见明显的液体分层,小心吸取上层液体于新的灭过菌的1.5ml离心管中。
(4)加入500μl异丙醇,将离心管中的液体轻轻混匀,室温静置10min;
(5)4℃离心,12000g,离心10min,弃上清,此时在离心管的底部可见一小块半透明的白色固体,即为总RNA;
(6)加入1ml 75%的乙醇,轻轻洗涤沉淀,4℃,7500g离心5min,弃上清;
(7)室温晾干或真空干燥6-7min,加入20-30μl DEPC水溶解RNA样品,测OD值定量RNA浓度(此方法提取RNA A
1.3长片段cDNA文库的构建(用于普通PCR实验)
(1)在灭过菌的PCR管中配置以下预反应液:1μg的总RNA,1μl Oligo(dT)20,1μl10mM dNTP Mix,加入适量的DEPC水将总体积补足到13μl。
(2)上述混合液65℃变性5min后,迅速置于冰上冷却1min。
(3)迅速配置反应液,按顺序向预反应液中加入以下试剂:4μl First StrandBuffer,1μl 0.1M DTT,1μl RNaseOUTTM,1μl SuperScriptTM III RT。
(4)上述反应体系轻柔混匀,50℃反应60min,70℃反应15min,反应结束后存于-20℃冰箱备用。
1.4PCR反应
(1)在灭过菌的PCR管中配置以下预反应液:10μl 2×KOD One TM PCR MasterMix,0.6μl上游引物,0.6μl下游引物,0.2μl长片段cDNA模板,8.6μl双蒸水。
上游引物CvT-SPN-bacteriostat-F:CTGACATCTTCGACTTAGATGGAT,
下游引物CvT-SPN-bacteriostat-R:TTATGTTTCTATGGGATTATACAC。
(2)将上述反应体系轻轻混匀,随后进行以下的PCR反应:98℃预变性5s进行一个循环;98℃变性10s,58℃退火5s,68℃延伸10s,进行35个循环;72℃尾延伸2min进行一个循环,最后降温至12℃。
(3)12℃反应中止后,及时取出PCR反应产物跑胶检测或置于-4℃保存。
1.5琼脂糖凝胶电泳及目的基因片段回收
(1)配置1.2%的琼脂糖凝胶置于电泳槽中,取3-5μl的样品与6×凝胶加样缓冲液混合后上样到电泳孔,电泳缓冲液为1×TAE,电压为140V,电泳时间为25-30min(可根据片段大小适当调整),电泳后于紫外透视仪中观察结果并拍照,得到如图1所示的条带。
(2)在紫外灯下切下含目的片段的DNA凝胶块,SPN-bacteriostat采用FastPureGel DNA Extration Mini Kit(Vazyme)将目的核酸片段回收。
1.6TA连接及转化。
(1)采用pGEM-T easy载体(Promega,USA)进行连接反应。在200μl的离心管中配制下列反应溶液(具体方法按照使用的试剂盒):1μL pGEM-T easy Vector,1μL T4 DNAligase,3μl Insert DNA,5μl 2×Rapid Ligation buffer,4℃PCR仪中孵育12小时。
(2)采取热激法进行转化。取出感受态大肠杆菌置于冰上,在感受态刚刚开始溶解的时候,将质粒或连接产物10μl加入到100μl的感受态大肠杆菌中,轻弹混匀,并进行15min冰浴;然后进行42℃水浴热激45-60s,随后立即置于冰上,进行5-10min的冰浴后加入600μl已提前预热到37℃、无抗生素的LB液体培养基;在37℃摇床进行温育45-60min进行活化,取100μl涂在含有相应抗生素的LB固体平板培养基上,37℃倒置培养10-12h后出现菌落。
(3)采用2×TSINGKE Master Mix(red)进行菌液检测以判断连接反应是否成功。在PCR管中配置如下反应:10μl 2×TSINGKE Master Mix,0.2μl正向引物以及0.2μl反向引物,随后进行PCR反应。
(4)将大小符合预期的条带切下,送至测序公司进行一代测序,测序结果与SEQ IDNO.1所示的1011bp CvT-SPN-bacteriostat基因开放阅读框(ORF)的序列一致。
(5)采用Promega公司生产的
1.7CvT-SPN-bacteriostat基因的序列分析
(1)克隆得到目的CvT-SPN-bacteriostat基因的ORF后,利用Editseq软件将开放阅读框ORF碱基序列翻译成氨基酸序列,并计算出氨基酸残基数、分子质量。
(2)在MEROPS多肽数据库(https://www.ebi.ac.uk/merops/)预测CvT-SPN-bacteriostat的反应中心环(reactive center site,RCL)和P1位点等信息,利用MEGA软件将CvT-serpin的RCL序列与其他物种已报道的序列进行多重序列比对,结果如图2所示,其反应中心环的氨基酸序列为:EVGSQAAAVTAARLSLRFNVE,P1位点的氨基酸是精氨酸(Arg),已有的研究中P1位点为Arg时,该serpin能够抑制胰蛋白酶(trypsin)、凝血酶(thrombin)、凝血因子Xa(Factor Xa)、组织型纤溶酶原激活剂(tPA)和尿激酶纤溶酶原激活剂(uPA)的活性,为后续CvT-SPN-bacteriostat基因的重组蛋白抑制活性检测提供了参考。
实施例2
菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因原核表达和纯化。
2.1CvT-SPN-bacteriostat的原核表达载体的构建与蛋白表达
(1)根据获得的CvT-SPN-bacteriostat序列的开放阅读框设计引物,正反向引物分别带有BamH I和Xho I酶切位点的序列,引物序列如下:
CvT-SPN-bacteriostatF-BamHI:CAGGGGCCCCTGGGATCCATGCTTTATTTTGGAGCAAGAG,
CvT-SPN-bacteriostatR-XhoI:ACGATGCGGCCGCTCGAGTTATGTTTCTATGGGATTATACACTTG,
以上述CvT-SPN-bacteriostat质粒为模板,用20μl的KOD One酶体系做PCR扩增,将扩增的PCR产物进行琼脂糖凝胶电泳,电泳后于紫外透视仪中观察结果并拍照,观察到目的条带后切下目的条带进行DNA凝胶回收。
(2)按照以下体积配制50μl双酶切体系以制备线性化表达载体:加入5μl 10×Cutsmart Buffer,两个限制性内切酶各加0.5μl,加入1μg PGEX-6P-1原核表达载体,最后加入ddH
(3)用移液枪轻吹混匀,37℃水浴孵育1-2h完成酶切反应。
(4)将酶切反应完成的线性化特定载体质粒进行片段切胶回收。
(5)利用同源重组的方式将目的片段插入特定载体中,采用ClonExpress UltraOne Step Cloning Kit(Vazyme)并配制以下实验体系:5μl 2×ClonExpress Mix,100ng线性化载体,40.5ng含有载体核酸片段的目标基因片段,最后加入ddH
(6)将连接产物转化到感受态中,涂布于含有抗生素的固体LB培养板中,37℃过夜,挑取单斑,摇菌培养,用通用引物pGEX5′引物(GGGCTGGCAAGCCACGTTTGGTG)和pGEX3′引物(CCGGGAGCTGCATGTGTCAGAGG),按照实施例1中1.4的方法进行菌液检测,选取阳性克隆,进行测序,确认正确后,得到的结果与目标系列SEQ ID No.2一致的序列,保存菌液备用。
(7)上述保存的菌液在50ml的锥形瓶中扩大培养,用于抽提质粒。
(8)取1μl稀释10倍的重组质粒,转化到大肠杆菌BL21(DE3)感受态菌株中,涂布于含有氨苄青霉素抗性的LB培养基平板上,37℃培养过夜,进行菌液检测,选取阳性克隆。
(9)上述的阳性克隆菌株取2μl加入到含有15ml的含抗生素的LB液体培养基的50ml的锥形瓶中,180rpm在37℃摇床上过夜活化,活化的菌液与含抗生素的LB液体培养基1:100的比例在250ml的锥形瓶中进行扩大培养约100ml,37℃,250rpm的摇床上培养约3h,可至对数期,OD值0.6~0.8。
(10)取3个15ml的无菌培养瓶,每瓶中加入5ml对数期的菌液,加入0M、0.5M和1.0M的IPTG各5μl,使IPTG的终浓度分别为0mM、0.5mM和1.0mM。
(11)将上述培养瓶放入16℃摇床100rpm培养过夜,诱导表达蛋白。
(12)将培养瓶中的菌液离心收集,得到的菌块用PBS洗涤后采用
(13)对诱导的菌液蛋白表达情况进行SDS-PAGE凝胶检测并扫描拍照,CvT-SPN-bacteriostat可在0.5mM IPTG浓度,在16℃,100rpm的条件下在上清液中大量表达。后续选择此条件对CvT-SPN-bacteriostat进行扩大培养和大量表达。
2.2菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因原核表达蛋白的纯化
(1)按照Sepharose
(2)纯化的蛋白使用10kDa的超滤离心管进行浓缩脱盐,然后分装存于-80℃备用。
(3)用SDS-PAGE胶检测纯化蛋白CvT-SPN-bacteriostat的结果。实验结果如图3所示,结果表明:如泳道1所示,在16℃,100rpm的摇床中培养条件下,未添加诱导剂时CvT-SPN-bacteriostat没有表达;泳道2,3,4所示,在16℃,100rpm的摇床中培养条件下,加入终浓度0.5mM的IPTG可以获得可溶性蛋白样品;泳道5所示,本实验的蛋白表达及纯化方法在短时间内快速可以获得大量纯度较高的可溶性CvT-SPN-bacteriostat蛋白样品。
实施例3
菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因的原核表达重组蛋白的活性检测。
3.1菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因的原核表达重组蛋白对商业化的丝氨酸蛋白酶的抑制活性
本实验检测的蛋白酶为枯草芽孢杆菌蛋白酶(Bacillus licheniformissubtilisin A,Sigma)和牛胰蛋白酶(bovine pancreatic trypsin,Sigma)其对应的底物分别是Z-Gly-Gly-Leu p-nitroanilide(Sigma C3022),Nα-Benzoyl-L-arginine 4-nitroanilide hydrochloride(Sigma B-3133)。于50mM Tris-HCl(50mM NaCl,pH=8.0)缓冲液中,分别加入不同体积的CvT-SPN-bacteriostat(2.0mg/ml)的重组蛋白,采用与CvT-SPN-bacteriostat相同浓度梯度的GST作为阴性对照,采用与CvT-SPN-bacteriostat相同体积的PBS作为空白对照,使得CvT-SPN-bacteriostat或GST与蛋白酶的摩尔比达到0-3.0,室温反应15分钟,加入1mM的发色底物起始反应,在室温条件下,再反应10min,用酶标仪(Thermo Fisher Scientific,USA)测定OD
试验结果如图4所示:阴性对照组GST对两种丝氨酸蛋白酶没有抑制作用,而随着重组丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat与相应蛋白酶的摩尔比的升高,枯草芽孢杆菌蛋白酶的剩余酶活性不断减少,当CvT-SPN-bacteriostat与枯草芽孢杆菌蛋白酶的摩尔比达到3:1时,枯草芽孢杆菌蛋白酶的活性被抑制了71.4%。而0.5倍物质的量的CvT-SPN-bacteriostat即可对胰蛋白酶产生33.4%的抑制效率。结果表明,重组丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat对枯草芽孢杆菌蛋白酶和胰蛋白酶具有较强的抑制效果,而枯草芽孢杆菌蛋白酶是革兰氏阳性细菌枯草芽孢杆菌分泌的蛋白酶,胰蛋白酶和糜蛋白酶既是昆虫中最重要的消化酶又是调控人类代谢的关键丝氨酸蛋白酶;因此,该重组丝氨酸蛋白酶抑制剂具有作为有害生物防治药剂和人类抗菌以及代谢调控类药物的潜在应用价值。
3.2菜蛾盘绒茧蜂畸形细胞丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat基因原核表达获得的重组蛋白对病原菌大肠杆菌和金黄色葡萄球菌的生长抑制作用
(1)采用LB培养基分别将革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌摇至对数期,再用新鲜培养基稀释至OD
(2)具体实验结果如图5和6所示,结果表明:与阴性对照相比,添加重组丝氨酸蛋白酶抑制剂CvT-SPN-bacteriostat后大肠杆菌和金黄色葡萄球菌的生长都受到了显著的抑制,其OD
