腺相关病毒突变体及其应用
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及生物医药技术领域,具体涉及一种腺相关病毒突变体及其应用。
背景技术
腺相关病毒(A deno-associated virus,AAV)是一类包裹着线性单链DNA基因组的无包膜小病毒,属于微小病毒科(Parvoviridae)依赖病毒属(Dependovirus),需要辅助病毒(通常为腺病毒)参与复制。AAV基因组为单链DNA片段,包含于非包膜病毒衣壳中,可分成三个功能区域:两个开放阅读框(Rep基因、Cap基因)和末端反向重复序列(ITR)。重组腺相关病毒载体(rAAV)源于非致病的野生型腺相关病毒,由于其具有宿主范围广、非致病性、低免疫原性、长期稳定表达外源基因、良好的扩散性能和物理性质稳定等优点,作为基因转移载体在基因治疗和疫苗研究中得到广泛应用。在医学研究中,rAAV被用于多种疾病的基因治疗的研究(包括体内、体外实验),如基因功能研究、构建疾病模型、制备基因敲除鼠等方面。
近年来,基因治疗已成为治疗肌肉类疾病的一种新型方法,其中AAV作为一种有效的基因载体得到了广泛应用。以杜氏肌营养不良(DMD)为例,全世界每3500-5000名男性中就有一人发生。DMD是由编码肌营养不良蛋白的基因中的改变或突变引起的。DMD的症状通常会经历发育迟缓,如行走、爬楼梯或从坐姿站立困难。SRP-9001利用MHCK7启动子与AAVrh74载体结合,以递送微型抗肌营养不良蛋白转基因,是DMD患者缺乏的功能性蛋白。2023年6月22日,Sarepta Therapeutics宣布其AAV基因疗法Delandistrogenemoxeparvovec(SRP-9001)获得FDA批准上市,用于治疗杜氏肌营养不良(DMD),商品名为Elevidys。该物疗效良好,患者肌肉功能得到显著改善。尽管当前的AAV治疗展示出巨大的优势潜力,但包括预存中和抗体,大剂量导致的肝毒性问题的出现,并且治疗费用高昂等也限制着该技术的发展和应用。
综上所述,基于当前AAV载体的优势和缺点,如何快速的获得靶向功能良好,副作用低的AAV载体成为一个重要的研究方向。现有技术中,应用现成的AAV血清型类型及已知功能的靶向肽进行不同组合是一个快速的方案,但前期的研究发现,简单的插入往往会导致功能肽的减弱甚至丧失靶向能力,原载体骨架的一些特性可能会导致“非特异”的靶向,例如肝嗜性的保留等问题。因此,亟需开发出能够保持功能肽靶向性的同时,能加强其特异性、降低毒性,特别是减少肝脏嗜性的新型血清型,以期为广大患者提供更好的、有临床应用价值的药物递送工具载体。
发明内容
本发明的目的在于克服现有技术的不足之处而提供一种低肝脏嗜性、靶向特异性更好的腺相关病毒突变体及其应用。
为实现上述目的,本发明采取的技术方案如下:
第一方面,本发明提供了一种低肝嗜性的AAV衣壳蛋白突变体,包括如SEQ IDNo.1所示的序列;所述序列位于所述突变体氨基酸465至478或464至477之间。
本发明的AAV衣壳蛋白突变体具有低肝嗜性,并进一步提高了肌肉靶向性。在肝脏中的mRNA水平分别降低了49倍和3.77倍,且在不同类型肌肉(股四头肌、肱二头肌、腹肌)的靶向中,mRNA和蛋白水平均有不同程度的提升。
作为本发明所述的AAV衣壳蛋白突变体的优选实施方式,包括如SEQ ID No.2所示的序列;所述序列位于所述突变体氨基酸448至478之间;或
如SEQ ID No.3所示的序列;所述序列位于所述突变体氨基酸448至477之间。
作为本发明所述的AAV衣壳蛋白突变体的优选实施方式,其氨基酸序列如SEQ IDNo.5所示或其氨基酸序列如SEQ ID No.7所示。
第二方面,本发明提供了一种AAV衣壳蛋白突变体,其氨基酸序列如SEQ ID No.4、SEQ ID No.6、SEQ ID No.8中任一种所示。
第三方面,本发明提供了一种重组腺相关病毒,包括上述的AAV衣壳蛋白突变体。
本发明AAV衣壳蛋白突变体构建得到的重组腺相关病毒载体不但大大降低了肝脏嗜性,而且具有更良好的肌肉靶向性,安全性更好,应用范围广。
作为本发明所述的重组腺相关病毒的优选实施方式,还包括异源目的基因。
优选的,所述异源目的基因编码干扰RNA、适配体、内切核酸酶、指导RNA中任一种基因产物。
第四方面,本发明提供了一种编码AAV衣壳蛋白突变体的核酸,其核苷酸序列为如SEQ ID No.9~SEQ ID No.13中任一所示的序列。
第五方面,本发明将所述的AAV衣壳蛋白突变体、所述的重组腺相关病毒、所述的核酸在以下任一领域中应用:
i、制备用于将基因产物递送至受试者肌肉和/或心脏的药物;
ii、制备体内靶向肌肉和/或心脏的递送工具;
iii、制备治疗肌肉和/或心脏疾病的递送药剂。
优选的,所述肌肉疾病包括肌营养不良、重症肌无力、多发性肌炎和皮肌炎、横纹肌溶解症;所述心脏疾病包括心肌梗死、心肌缺血损伤、冠心病、心肌肥厚和心肌纤维化。
与现有技术相比,本发明的有益效果为:
本发明AAV衣壳蛋白突变体具有明显的降低肝脏嗜性的功能,在提高AAV不同靶向特异性中具有巨大作用,例如插入RGD肽后在提升肌肉靶向性的同时,显著降低肝嗜性,特异性更好,能规避潜在的临床应用风险,特别是剂量过大引发的肝毒性问题,为患者或科研人员提供更好的基因治疗工具,具有巨大的社会价值和经济效益。
附图说明
图1为活体成像观察不同血清型的组织嗜性分布;
图2为不同血清型对小鼠肝脏嗜性分析(3周);
图3为不同血清型对小鼠肌肉(股四头肌)靶向性分析(3周);
图4为不同血清型对小鼠肌肉(肱二头肌)靶向性分析(3周);
图5为不同血清型对小鼠肌肉(腹肌)靶向性分析(3周);
图6为不同血清型对小鼠心脏靶向性分析(3周);
图7为不同血清型对小鼠大脑、肺脏靶向性分析(3周)。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。本领域技术人员应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
实施例中所用的试验方法如无特殊说明,均为常规方法;所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
AAV DJ序列参照科研文献《In vitro and in vivo gene therapy vectorevolution via multispecies interbreeding and retargeting of adeno-associatedviruses》。
MyoAAV 4A序列参照科研文献《Directed evolution of a family of AAVcapsid variants enabling potent muscle-directed gene delivery acrossspecies》。
实施例1:AAV突变体的设计、构建和病毒生产
(1)AAV突变体的设计
基于结构分析,并利用片段替换的方法对潜在位点进行替换,以降低肝嗜性,提高肌肉的靶向性。通过不同区域片段的组合,设计了突变体2,3,4,5,并与直接插入RGD肽(Arg精氨酸-Gly甘氨酸-Asp天冬氨酸)的突变体1、AAV9,AAV DJ以及MyoAAV 4A进行对比测试。与突变体1(直接插入RGD肽)相比,其它突变体的区段设计如表1所示:
表1突变体的区段设计
备注:上表氨基酸位置根据构建完整衣壳蛋白VP1后在VP1中的定位;突变体2区段1及区段2均来源于AAV2;突变体3区段1来源于AAV2,区段2保留AAV DJ源序列;突变体4区段1来源于AAV9,区段2来源于AAV2;突变体4区段1来源于AAV9,区段2保留AAV DJ源序列;上述突变体2、3、4、5的区段1序列对应替换AAV DJ或突变体1中的区段1序列,上述突变体2、3、4、5的区段2序列对应替换AAV DJ或突变体1中的区段2序列。突变体1~5VP1氨基酸序列依次如SEQ ID No.4~8所示。突变体1~5VP1核苷酸序列依次如SEQ ID No.9~13所示。
(2)突变体血清型载体的构建和质粒提取
将Rep-CAP质粒用SmiI和BshTI双酶切,凝胶电泳并切下5000bp左右的片段条带进行凝胶回收,得到酶切的骨架片段。
根据突变体1的Cap序列,设计以下引物,具体步骤为:以AAV DJ Rep-CAP质粒为模板使用Cap-f+YJ125-R引物进行扩增并胶回收得到目的产物突变体1产物-1,以AAV DJ的Rep-CAP质粒为模板使用YJ125-F+cap-r引物进行扩增并胶回收得到目的产物突变体1产物-2。通过以下步骤和比例混合骨架片段、突变体1产物-1、-2,即可重组构建突变体1的Rep-CAP质粒;
根据突变体2的Cap序列,设计以下引物,具体步骤为:以AAV DJ的Rep-CAP质粒为模板使用Cap-f+YJ121-R引物进行扩增并胶回收得到目的产物突变体2产物-1,以AAV DJ的Rep-CAP质粒为模板使用YJ121-F+J125-R引物进行扩增并胶回收得到目的产物突变体2产物-2,以AAV DJ的Rep-CAP质粒为模板使用YJ125-F+cap-r引物进行扩增并胶回收得到目的产物突变体2产物-3。通过以下步骤和比例混合骨架片段、突变体2产物-1、-2、-3即可重组构建突变体2的Rep-CAP质粒;
根据突变体3的Cap序列,设计以下引物,具体步骤为:以AAV DJ的Rep-CAP质粒为模板使用Cap-f+YJ122-R引物进行扩增并胶回收得到目的产物突变体3产物-1,以AAV DJ的Rep-CAP质粒为模板使用YJ122-F+YJ125-R引物进行扩增并胶回收得到目的产物突变体3产物-2,以AAV DJ的Rep-CAP质粒为模板使用YJ125-F+cap-r引物进行扩增并胶回收得到目的产物突变体3产物-3。通过以下步骤和比例混合骨架片段、突变体3产物-1、-2、-3,即可重组构建突变体3的Rep-CAP质粒;
根据突变体4的Cap序列,设计以下引物,具体步骤为:以AAV DJ的Rep-CAP质粒为模板使用Cap-f+YJ123-R引物进行扩增并胶回收得到目的产物突变体4产物-1,以AAV DJ的Rep-CAP质粒为模板使用YJ123-F+YJ125-R引物进行扩增并胶回收得到目的产物突变体4产物-2,以AAV DJ的Rep-CAP质粒为模板使用YJ125-F+cap-r引物进行扩增并胶回收得到目的产物突变体4产物-3。通过以下步骤和比例混合骨架片段、突变体4产物-1、-2、-3,即可重组构建突变体4的Rep-CAP质粒;
根据突变体5的Cap序列,设计以下引物,具体步骤为:以AAV DJ的Rep-CAP质粒为模板使用Cap-f+YJ124-R引物进行扩增并胶回收得到目的产物突变体5产物-1,以AAV DJ的Rep-CAP质粒为模板使用YJ124-F+YJ125-R引物进行扩增并胶回收得到目的产物突变体5产物-2,以AAV DJ的Rep-CAP质粒为模板使用YJ125-F+cap-r引物进行扩增并胶回收得到目的产物突变体5产物-3。通过以下步骤和比例混合骨架片段、突变体5产物-1、-2、-3,即可重组构建突变体5的Rep-CAP质粒;
上述AAV衣壳蛋白突变体1~5的Rep-CAP载体构建中涉及的引物如表2所示:
表2引物序列
以上骨架与片段,片段与片段间具有同源臂序列,可通过Gisbon进行多片段组装成完整载体。取1个干净的200uL PCR管做好标记并放在冰盒上,将上述酶切骨架、各个目的片段,按骨架:片段摩尔比为1:3配制反应液,PCR仪中50℃反应30min进行重组连接。取50μL感受态细胞在冰上解冻,10μL的连接产物与DH5α感受态细胞混合,冰上放置20-30分钟;42℃热激45秒;快速置于冰上冰浴2分钟,加入400μL复苏SOC培养基(不含抗生素),37℃,200rpm培养1h;均匀涂于Amp抗性平板(50μg/ml),37℃培养14个小时。挑选单克隆菌,在4ml液体LB培养基(Amp+抗性)中扩大培养,37℃培养14小时。
菌液经过12000rpm离心1分钟,倒掉上清培养基;加入250μL的buffer P1/RNaseA混合液,高速涡旋重悬细菌;加入250μL的buffer P2,上下颠倒8-10次;加入350μL的bufferP3,立即颠倒混匀8-10次让溶液彻底中和;13000rpm离心10分钟,取上清过柱;12000离心1分钟,倒掉废液,加入500μL的PW1,12000离心1分钟,倒掉废液;加入600μL的PW2,12000离心1分钟,倒掉上清;加入600μL的PW2,12000离心1分钟,倒掉上清;12000rpm空转2分钟;加入55℃预热洗脱液30-50μL,静置2分钟,12000rpm离心1分钟。使用微量核酸定量仪进行浓度检测。
获得质粒经过浓度检测,经过酶切鉴定的阳性质粒取10μL送测序,阳性质粒保存在-20℃。测序结果表明,获得质粒能够编码变异型衣壳蛋白VP1。最后根据后期测试需要的病毒量提取相关的Helper质粒,各组Rep-Cap质粒(AAV9,AAV DJ,MyoAAV 4A及本发明突变体)质粒以及GOI质粒(ssAAV.CAG.Fluc-2a-eGFP.WPRE.SV40pA)。
(3)突变体血清型病毒的包装和纯化
将得到各组(AAV9,AAV DJ,MyoAAV 4A和本发明AAV突变体)的Rep-Cap质粒,表达萤火虫荧光素酶(Fluc)和绿色荧光蛋白(EGFP)的质粒,pHelper质粒以合适的量共转于HEK-293T细胞中,采用碘克沙醇梯度超高速离心纯化AAV病毒,测量病毒滴度在1E+12GC/mL-1E+13GC/mL为合适滴度,放置-80℃备用。
实施例2:突变体血清型各指标的对比测试
(1)动物注射及解剖
小鼠实验:实验使用6-8周龄的Balb/C雄性小鼠,按照设计好的实验组和对照组配制相关病毒,每组按每只小鼠注射2E11GC病毒,分别在2周、3周这2个时间进行活体成像,在注射3周后进行动物解剖及各器官取材,样本取材后立即进行液氮速冻,并分别用于后续RNA提取和WB检测等实验。
(2)活体成像
成像前先对小鼠进行称重,提前开启动物活体成像系统(广州博鹭腾生物科技有限公司,AniView100)并调试小动物麻醉系统。设置图像保存路径,拍摄参数等信息。每只小鼠按照150mg/kg,即10uL/g的剂量进行腹腔注射luciferin(15mg/ml,Promega,E1605),每组注射后10min开始成像。按照仰卧,左侧卧,俯卧,右侧卧的顺序依次完成每批鼠的拍摄。拍摄完成后将小鼠放回鼠笼等待醒麻醉,观察小鼠状态有无异常。
(3)目的基因mRNA表达水平检测
1)组织总RNA提取及反转录
样品的研磨:提前10min预冷研磨仪并设置好研磨参数。将保存于-80℃冰箱动物组织样品取出,取约50-100mg组织,于无菌培养皿内剪成黄豆粒大小后,转移至1.5mlRNase-free EP管内。按照每50-100mg组织:1ml TransZol Up的比例加入适量的TransZolUp,然后加入干净无菌的3mm研磨钢珠两颗,缠上封口膜。将样品置于24孔研磨适配器内并配平,拧紧螺旋,按下关盖按钮。启动研磨程序,待仪器运行结束后取出样品,观察样品研磨粒度,如无大块组织残留,即可进行后续提取操作。研磨后的样品在4℃,12,000×g转速离心2min,吸取上清转移至新的做好相应标记的1.5ml RNase-free EP管内。
样品总RNA的提取:具体参照TransZol Up Plus RNA Kit(北京全式金,货号:ER501)说明书。每使用1ml TranZol up,加0.2ml RNA Extraction Agent,剧烈震荡5min;12,000×g,4℃离心10min。此时样品分为三层,转移无色的水相于新的1.5ml RNase-freeEP管中,加入等体积的无水乙醇(此时可能会出现沉淀),轻轻颠倒混匀;将得到的溶液和沉淀一起加入离心柱中,12,000×g室温离心30s,弃滤液;加500μL CB9,12,000×g室温离心30s,弃滤液;重复上步骤一次;加入500μL WB9,12,000×g室温离心30s,弃滤液;重复上步骤一次;12,000×g室温离心2min,彻底去除残留的乙醇;将离心柱放入1.5ml RNase-freeEP管中,加入30-50μL(视组织大小而定)RNase-free Water在离心柱的中央,室温静置1min;12,000×g室温离心1min,洗脱RNA;
样品核酸浓度测定:使用微量核酸定量仪检测器检测RNA浓度,记录浓度、OD260/280、OD260/230,把RNA保存于-80℃。
反转录:每组RNA样品使用
2)定量PCR(qPCR)实验
取上述每组DNA或cDNA作为模板,按照2x SYBR Green qPCR Master Mix(Bimake,货号:B21203)说明书进行qPCR体系配置:
表3 qPCR体系
表4引物序列
表5 qPCR程序设置
3)数据分析
根据每组的Ct值,按公式2^-ΔΔct计算相对表达量。
4)WB检测目的蛋白的表达水平
样品预处理:把组织剪切成细小的碎片,称量并且记录重量后,放置1.5ml或者2ml离心管中,标记管子,在-80℃中冷冻待用,预冷冷冻研磨仪;溶解RIPA(碧云天,P0013B)裂解液(在使用前数分钟内加入PMSF,使PMSF终浓度为1mM);
按照每20mg组织加入150-250μL裂解液的比例加入上述完全裂解液,然后加入两颗已灭菌的氧化锆研磨珠,直接在裂解液中研磨样品(脑、脊髓等组织样品:温度-20℃,频率70Hz,时间每震荡50s停顿10s,循环3-4次;肌肉、肝脏等样品:温度-20℃,频率70Hz,时间每震荡50s停顿10s,5-7次)。样品研磨完后,将样品在冷冻离心机中,4℃,12,000×g离心5-10min,后取上清转移至新的灭菌EP管中,-20℃或-80℃保存;
蛋白浓度测定:按照改良型BCA法蛋白质浓度测定试剂盒(生工,货号C503051)中的方法测定蛋白浓度后,根据所需用量取适量的蛋白匀浆样品,与相应量的5X SDS-PAGE蛋白上样缓冲液混合,沸水浴10min,冷却后低速离心片刻,等待上样。
WB(Western Blot)检测:
SDS-PAGE电泳:根据蛋白浓度及表达水平确定适当的上样量,小于20μL/孔,组织匀浆蛋白上样量约为20-50μg,电泳具体操作流程如下:将预制胶上的梳子拔出,将凝胶安装到电泳槽,内、外槽均加入电泳缓冲液,其中内槽加入新配制的缓冲液,并检漏,若无漏则可在外槽加入电泳缓冲液;取适量处理好的蛋白样品上样,用预染的标准蛋白作为参照,在天能电泳装置上进行100V恒压电泳,电泳时间为100min,直到溴酚蓝到达胶底部。关闭电源,小心卸下预制胶板,取下凝胶,置于转膜缓冲液中等待后续操作;
转膜:据胶面积剪取6张滤纸和1张PVDF膜。PVDF膜在甲醇中浸泡5-10sec,然后转移至转膜缓冲液浸泡5min,滤纸也在转膜缓冲液中预湿润;安装转移装置:负极(黑板)-海绵-3层润湿的滤纸-凝胶-PVDF膜-3层润湿的滤纸-海绵-正极(透明板)。赶走每层气泡以避免影响转移效果,夹紧支架,放入电转槽内;使用100V恒压冰浴转膜100min;根据预染蛋白质分子量标准条带是否完全转至PVDF膜来判断转膜成功与否;将转好的PVDF膜浸泡在PBST溶液中室温洗涤5min,按照需求裁剪PVDF膜,裁膜过程中注意勿让PVDF膜变干;
封闭及抗体孵育:用封闭液(5%脱脂奶粉)孵育PVDF膜,室温2h或4℃过夜;将封闭好的PVDF膜转入一抗杂交液(Luciferase Rabbit Polyclonal antibody(Proteintech,27986-1-AP)按1:2000;GADPH Rabbit Polyclonal antibody(Proteintech,10494-1-AP)按1:2000;Rabbit GFP tag Polyclonal antibody(Proteintech,50430-2-AP)按1:2000,分别加入至4ml QuickBlock
显色:将ECL化学发光试剂盒的A液与B液等体积混合,震荡混匀后,将发光液滴在PVDF膜上以使PVDF膜上全都覆盖有发光液,调整不同的曝光时间使蛋白条带清晰,仪器拍照。
为了规避预存抗体的风险以及开发多种特性的血清型载体供患者使用,使用靶向肽“移植”的方法是一种相对简单和快速的策略方案。但是插入已知功能靶向肽的方法可能由于肽结构的改变、血清型差异等因素,导致靶向性的降低甚至丢失,或者整体特异性的改变。上述实施例中通过在AAV DJ中插入已知RGD靶向肽,拟使其获得更好的肌肉靶向性。但实验中发现简单的将RGD靶向肽插入AAV DJ中,不仅肌肉靶向性有所降低,而且其仍具有较高的肝脏嗜性。因此本发明通过结构分析找到引发肝嗜性的潜在区段,并利用不同血清型氨基酸区段替换的技术方案,结合小鼠体内实验的方法,开发了具有良好特异性的突变血清型。
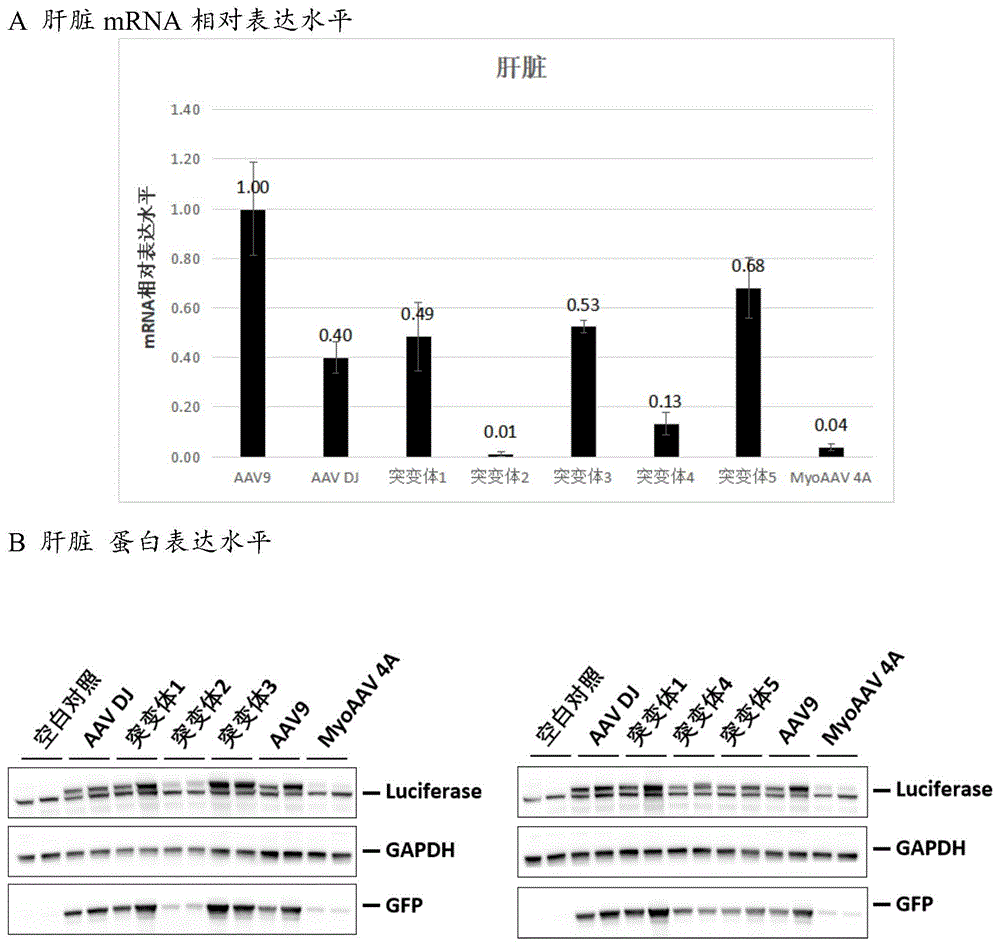
在小鼠实验中,经设计的血清型突变体2和突变体4具有显著的降低肝嗜性和提高肌肉靶向性的特点。从图1的活体成像结果中可以很直观的看到每种血清型的组织嗜性分布情况,不管是直接插入RGD肽的突变体1,还是设计的突变体3、突变体5,虽然有一定的肌肉靶向能力,但均保留较强的肝嗜性,而设计的突变体2、突变体4则大大降低了肝嗜性,并在一定程度提高了肌肉靶向性。且从分子实验检测结果看(如图2),相较于直接插入RGD肽的突变体1,经设计优化的突变体2和突变体4,在肝脏中的mRNA水平分别降低了49倍和3.77倍,蛋白水平也具有显著水平的降低。而突变体3的mRNA和蛋白水平则均略强于突变体1和AAV DJ,突变体5则存在mRNA高、蛋白水平低的差异,尚不清楚其中机理。综合多种突变体的区段替换结果,说明将区段2中S465-QGGPNTMANQAK-N478序列进行替换是降低AAV DJ骨架肝嗜性的核心,其次区段1序列也在不同程度影响着最终效果。
进一步实施例中使用插入包含RGD基序的多肽,使突变体血清型被赋予肌肉靶向的能力,观察不同突变体靶向各部位肌肉(股四头肌、肱二头肌、腹肌)以及心脏的程度。如图3所示,突变体2、突变体4在mRNA和蛋白水平均要强于突变体1,蛋白表达水平与MyoAAV4A(插入同样RGD肽的AAV9骨架)比较接近。突变体3、5虽然mRNA高于突变体1,但是蛋白水平则与突变体1接近。对于肱二头肌(图4),突变体2和突变体4更明显强于突变体1、突变体3和突变体5,突变体2和突变体4的mRNA分别是突变体1的3.22倍和6.97倍,蛋白水平甚至好于MyoAAV 4A。对于腹肌(图5),蛋白水平最高的仍是突变体2和突变体4,综合3种肌肉的结果,说明本发明设计优化的突变体2和突变体4不但能够降低肝嗜性,而且能够加强靶向的效果,从而整体的提高血清型的特异性。对于心脏(图6),虽然突变体2在mRNA水平比突变体1高约1.78倍,但是蛋白水平则反而略低于突变体1。
此外,对大脑和肺脏做了mRNA水平的检测,以初步观察血清型额外的一些特性。从结果看(图7),大脑中,突变体2mRNA最低,而突变体4则略高于其它突变体。肺脏中,优化的突变体2,3,4,5均要低于突变体1,其中仍以突变体2和突变体4最低,说明设计突变体不但降低了肝嗜性,在肺脏器官仍有不同程度的削弱作用,进一步加强了体内的特异性。
综上所述,本发明通过结构分析方法发现原血清型潜在的肝嗜性位点,然后利用不同血清型的片段替换技术,应用实验动物技术手段验证,得到了可以降低肝脏嗜性的新血清型突变体,它们在体内具有优良的特异性。通过简单的靶向肽插入方法,可以快速嫁接到本发明突变体骨架,从而实现在不需要大规模筛选的条件下,可以快速获得不同的血清型变体,从而规避体内预存抗体或者根据骨架特性进一步展开不同的应用。本发明利用包含RGD基序的多肽,展示了本发明突变体的肌肉靶向特异性,使用本发明的设计方法可以有效降低原骨架的肝嗜性,增强肌肉的靶向效果,可以规避临床应用中的肝毒性问题,以及降低肌肉靶向所需的剂量,为基因治疗有效应用于临床提供更强有力的运载工具,且为血清型改造及应用,提供新的思路。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 一种具有远程调控智能主动发热保温箱
- 一种远程智能调控通讯防护箱
- 一种配变台区智能化调控系统及调控方法
- 一种智能家居远程控制系统及智能家居服务器
- 一种远程调控的智能平衡阀
- 一种远程调控的智能平衡阀
