一种抑制α-突触核蛋白聚集的多肽功能化的复合胶束的制备方法及应用
文献发布时间:2023-06-19 11:09:54
技术领域
本发明属于纳米生物医药材料领域,涉及一种抑制α-突触核蛋白聚集的多肽功能化的复合胶束的制备方法和应用。
背景技术
帕金森病(PD),是一种多发于老年人的神经退行性疾病,其临床表现主要包括静止性震颤、肌强直、运动迟缓和姿势平衡障碍,并且患者可能伴有抑郁、嗅觉障碍以及睡眠障碍等症状,严重影响患者及家人的生活。PD的主要病理特征为中脑黑质多巴胺能神经元受损及路易小体的出现。其中α-突触核蛋白是路易小体的重要组成部分。目前的治疗策略多以多巴胺为靶点,通过左旋多巴类药物进行治疗,但这类药物不能从根本上治疗PD,且带有一定的副作用。而越来越多的研究证明α-突触核蛋白的异常聚集与PD的发病机理密切相关。以α-突触核蛋白为靶点,为根治PD提供了可行思路。
生理状态的α-突触核蛋白是无序单体,参与调节囊泡释放、抗细胞凋亡、参与学习记忆并具有伴侣蛋白的作用。而病理性的α-突触核蛋白是聚集体状态,不仅丧失了正常功能而且对神经元细胞产生毒性作用,沉积形成路易小体,诱发PD。因此通过在早期抑制α-突触核蛋白聚集来治疗PD是一种可行的治疗策略。目前用于体外抑制α-突触核蛋白聚集的多为小分子和多肽类抑制剂,小分子抑制效果虽然较好但是无特异性,易受到其他蛋白的干扰,也容易干扰其他蛋白内稳态。对于多肽抑制剂而言,它们本身生物相容性好,免疫原性低且具有特异结合的能力,但它们结构稳定性不足,且抑制聚集的效率较低。
纳米胶束具有多变的表面结构和高度可修饰性,使得其在药物递送方面发挥重要作用。如生理条件下可具有疏水区的复合壳层纳米胶束,本身生物相容性好,结构稳定,在生物体内可降解,可依靠疏水区吸附蛋白聚集体,但其本身不具有特异性,且远程吸附效果较差。
发明内容
本发明目的是客服现有技术存在的上述问题,设计发明了一种专门针对α-突触核蛋白发挥作用的多肽功能化的复合胶束,用于特异性的抑制α-突触核蛋白自身的异常聚集,以及由α-突触核蛋白原纤维所诱发产生的聚集,保护神经元细胞免受α-突触核蛋白聚集体产生的毒害作用,为帕金森症(PD)的早期治疗提供了可行的思路。
本发明的技术方案
一种抑制α-突触核蛋白聚集的多肽功能化的复合胶束,所述多肽功能化复合胶束由两种两亲性嵌段共聚物组成的粒径均匀分布在50-200nm的球形颗粒构成,包括一种亲水端修饰有功能化多肽的非生理环境响应性的两亲性嵌段共聚物和一种亲水端具有生理环境响应性的两亲性嵌段共聚物,该复合胶束在生理条件下形成核-壳-冠的三层结构。
所述多肽能特异性识别α-突触核蛋白,多肽序列包括但不限于GVLYVGSKTR(简称:βsyn36)、VAQKTmV、RGGAVVTGR。
所述亲水端具有生理环境响应性的两亲性嵌段共聚物,在生理环境条件下,例如37℃或pH 7.4条件下链段塌缩产生疏水壳,其亲水生理环境响应性链段为pH响应性的聚(β-氨基酯)(PAE)、聚(2-(二乙氨基)甲基丙烯酸乙酯)(PDEA),或者温敏性的聚N-叔丁基丙烯酰胺(P-NIPAM),或者同时具有pH响应性和温敏性的聚甲基丙烯酸N,N-二甲氨基乙酯(PDMAEMA);其疏水链段为聚已内酯(poly(ε-caprolactone),PCL)或者聚乳酸(PLA)。
所述亲水端非生理环境响应性的两亲性嵌段共聚物为聚乙二醇-b-聚己内脂(PEG-b-PCL)。
一种抑制α-突触核蛋白聚集的多肽功能化的复合胶束的制备方法,包括如下步骤:
1)在四氢呋喃中分别彻底溶解两种两亲性嵌段聚合物,两种聚合物质量浓度相同,均为5-10mg/ml;
2)按照亲水端修饰有功能化多肽的非生理环境响应性的两亲性嵌段共聚物与亲水端为生理环境响应性链段的两亲性嵌段聚合物的体积比1:2进行混合,取聚合物混合液在超声条件下逐滴滴加入7倍体积的超纯水中,超声持续20-60分钟;
3)将所得混合液最终透析在PBS缓冲溶液中,定容得到聚合物质量浓度为0.5-1.0mg/ml的多肽功能化复合胶束溶液。
本发明提供的抑制α-突触核蛋白聚集的多肽功能化的复合胶束可用于制备治疗早期帕金森病的药物中,用于抑制α-突触核蛋白的自聚集及由α-突触核蛋白原纤维诱导的聚集,保护神经元细胞免受α-突触核蛋白聚集体的毒害作用。
该多肽功能化复合胶束抑制α-突触核蛋白聚集的原理:
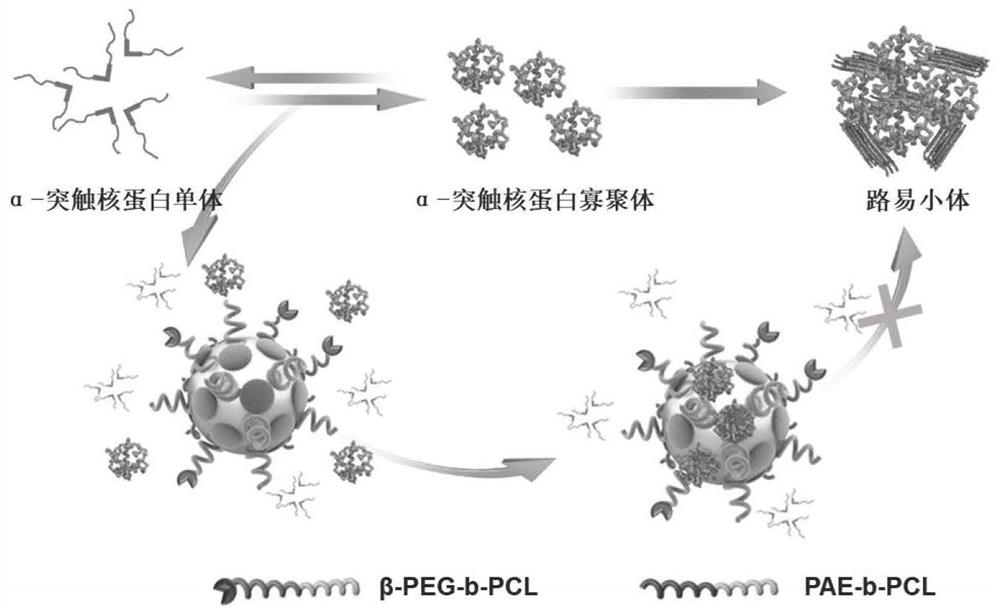
在生理条件下生理环境响应性链段会塌缩在核层形成疏水区域,使得复合胶束呈现核-壳-冠的表面相分离结构。冠层的多肽可以特异性识别α-突触核蛋白,并拉近α-突触核蛋白聚集体与疏水微区的距离,促使疏水区承接并吸附多肽拉近的α-突触核蛋白聚集体。通过多肽自身的特异性识别能力和与复合胶束的协同作用有效抑制α-突触核蛋白聚集(原理同图1)。
本发明的优点和有益效果:
本发明提供了一种制备工艺简单,生物可降解且生物相容性较好的多肽功能化的复合胶束用于高效抑制α-突触核蛋白聚集。本发明结合了多肽和纳米复合胶束的优势,多肽的修饰解决了复合胶束本身无特异性的问题,以复合胶束为支架,改善了多肽稳定性差且抑制效果低的问题,在多肽和复合胶束的协同作用下,增强了抑制α-突触核蛋白的聚集作用。实验结果证明,所制备的多肽功能化的复合胶束结构稳定,生物毒性很低,可有效抑制α-突触核蛋白的自聚集以及由α-突触核蛋白诱发的聚集,减少α-突触核蛋白聚集体的形成,抑制由α-突触核蛋白聚集体介导的细胞毒性,保护神经元细胞免受凋亡,此外,复合胶束和聚集体形成的复合物可促进α-突触核蛋白聚集体的降解,作为治疗早期帕金森病的药物有广阔的应用前景。
附图说明
图1为多肽功能化复合胶束抑制α-突触核蛋白聚集的原理图。
图2为37℃孵育144h过程,多肽功能化复合胶束的光强变化图。
图3为多肽功能化复合胶束的粒径分布及透射电镜图。
图4为硫黄素T探针检测α-突触核蛋白自聚集动力学图。
图5为α-突触核蛋白单独培养7天后的透射电镜图(A)和多肽功能化的复合胶束与α-突触核蛋白共培养7天后的透射电镜图(B)。
图6多肽功能化的复合胶束与α-突触核蛋白共培养7天过程中光强监测。
图7硫黄素T探针检测α-突触核蛋白在其原纤维诱导作用下聚集动力学图
图8多肽功能化的复合胶束的细胞毒评估。
图9多肽功能化的复合胶束抑制α-突触核蛋白聚集体介导的细胞毒性。
具体实施方式
以下通过非限定性实例进一步详细说明本发明。
实施例1:一种抑制α-突触核蛋白聚集的多肽功能化的复合胶束的制备。
1)βsyn36-PEG-b-PCL的合成
选用βsyn36(多肽序列为:GVLYVGSKTR)为特异性识别肽,将90mgMAL-PEG-PCL与20mg多肽(C-GG-GVLYVGSKTR)溶解在减压蒸馏处理过的DMF中,加入50ul三乙胺,在室温搅拌下反应24h,反应结束后,将反应液转移至透析袋进行透析,冻干得到βsyn36-PEG-PCL。
2)PCL-b-PAE的合成
称取80mg丙烯酸羟乙酯(HMA)与4gε-CL,加入到茄形瓶中,加入10ml甲苯溶解,加入2滴辛酸亚锡作为催化剂,经液氮冷冻—充氮气—解冻循环三次,反应于110℃油浴条件下反应12h,反应液用冰乙醚处理,经抽滤烘干得到白色固体粉末,即PCL-A。
将0.6g PCL-A和0.462g 4,4’-三亚甲基-二哌啶(TDP)以及0.452g己烷-1,6-二醇-二丙烯酸酯(HDD)溶解在常压蒸馏除水的三氯甲烷中,通氮气10分钟,在氮气球的保护作用下,55℃油浴反应72h,反应结束后,通过冰乙醚沉淀,抽滤干燥后进行透析,冻干得到PCL-b-PAE。
3)多肽功能化的复合胶束的制备
将10mg步骤1)得到的βsyn36-PEG-b-PCL与步骤2)得到的10mg PCL-b-PAE分别过夜溶解在1ml超干的四氢呋喃中,制备得两种聚合物质量浓度均为10mg/ml的储备液;取400μLβsyn36-PEG-b-PCL聚合物溶液与800μLPCL-b-PAE进行混合,在超声条件下逐滴滴加入8.4ml超纯水中,超声持续20分钟;将所得混合液最终透析在PBS缓冲溶液中,定容得到聚合物质量浓度为1.0mg/ml的多肽功能化复合胶束溶液。
实施例2:一种抑制α-突触核蛋白聚集的多肽功能化的复合胶束的制备。
1)βsyn36-PEG-b-PCL的合成
选用βsyn36(多肽序列为:GVLYVGSKTR)为特异性识别肽,将90mgMAL-PEG-PCL与20mg多肽(C-GG-GVLYVGSKTR)溶解在减压蒸馏处理过的DMF中,加入50ul三乙胺,在室温搅拌下反应24h,反应结束后,将反应液转移至透析袋进行透析,冻干得到βsyn36-PEG-PCL。
2)PCL-b-PAE的合成
称取80mg丙烯酸羟乙酯(HMA)与4gε-CL,加入到茄形瓶中,加入10ml甲苯溶解,加入2滴辛酸亚锡作为催化剂,经液氮冷冻—充氮气—解冻循环三次,反应于110℃油浴条件下反应12h,反应液用冰乙醚处理,经抽滤烘干得到白色固体粉末,即PCL-A。
将0.6g PCL-A和0.462g 4,4’-三亚甲基-二哌啶(TDP)以及0.452g己烷-1,6-二醇-二丙烯酸酯(HDD)溶解在常压蒸馏除水的三氯甲烷中,通氮气10分钟,在氮气球的保护作用下,55℃油浴反应72h,反应结束后,通过冰乙醚沉淀,抽滤干燥后进行透析,冻干得到PCL-b-PAE。
3)多肽功能化的复合胶束的制备
将8mg步骤1)得到的βsyn36-PEG-b-PCL与步骤2)得到的8mg PCL-b-PAE分别过夜溶解在1ml超干的四氢呋喃中,制备得两种聚合物质量浓度均为8mg/ml的储备液;取400μLβsyn36-PEG-b-PCL聚合物溶液与800μLPCL-b-PAE进行混合,在超声条件下逐滴滴加入8.4ml超纯水中,超声持续60分钟;将所得混合液最终透析在PBS缓冲溶液中,定容得到聚合物质量浓度为0.8mg/ml的多肽功能化复合胶束溶液。
实施例3:一种抑制α-突触核蛋白聚集的多肽功能化的复合胶束的制备。
1)βsyn36-PEG-b-PCL的合成
选用βsyn36(多肽序列为:GVLYVGSKTR)为特异性识别肽,将90mgMAL-PEG-PCL与20mg多肽(C-GG-GVLYVGSKTR)溶解在减压蒸馏处理过的DMF中,加入50ul三乙胺,在室温搅拌下反应24h,反应结束后,将反应液转移至透析袋进行透析,冻干得到βsyn36-PEG-PCL。
2)PCL-b-PAE的合成
称取80mg丙烯酸羟乙酯(HMA)与4gε-CL,加入到茄形瓶中,加入10ml甲苯溶解,加入2滴辛酸亚锡作为催化剂,经液氮冷冻—充氮气—解冻循环三次,反应于110℃油浴条件下反应12h,反应液用冰乙醚处理,经抽滤烘干得到白色固体粉末,即PCL-A。
将0.6g PCL-A和0.462g 4,4’-三亚甲基-二哌啶(TDP)以及0.452g己烷-1,6-二醇-二丙烯酸酯(HDD)溶解在常压蒸馏除水的三氯甲烷中,通氮气10分钟,在氮气球的保护作用下,55℃油浴反应72h,反应结束后,通过冰乙醚沉淀,抽滤干燥后进行透析,冻干得到PCL-b-PAE。
3)多肽功能化的复合胶束的制备
将6mg步骤1)得到的βsyn36-PEG-b-PCL与步骤2)得到的6mg PCL-b-PAE分别过夜溶解在1ml超干的四氢呋喃中,制备得两种聚合物质量浓度均为6mg/ml的储备液;取400μLβsyn36-PEG-b-PCL聚合物溶液与800μLPCL-b-PAE进行混合,在超声条件下逐滴滴加入8.4ml超纯水中,超声持续20分钟;将所得混合液最终透析在PBS缓冲溶液中,定容得到聚合物质量浓度为0.6mg/ml的多肽功能化复合胶束溶液。
实施例4:一种抑制α-突触核蛋白聚集的多肽功能化的复合胶束的制备。
1)βsyn36-PEG-b-PCL的合成
选用βsyn36(多肽序列为:GVLYVGSKTR)为特异性识别肽,将90mgMAL-PEG-PCL与20mg多肽(C-GG-GVLYVGSKTR)溶解在减压蒸馏处理过的DMF中,加入50ul三乙胺,在室温搅拌下反应24h,反应结束后,将反应液转移至透析袋进行透析,冻干得到βsyn36-PEG-PCL。
2)PCL-b-PAE的合成
称取80mg丙烯酸羟乙酯(HMA)与4gε-CL,加入到茄形瓶中,加入10ml甲苯溶解,加入2滴辛酸亚锡作为催化剂,经液氮冷冻—充氮气—解冻循环三次,反应于110℃油浴条件下反应12h,反应液用冰乙醚处理,经抽滤烘干得到白色固体粉末,即PCL-A。
将0.6g PCL-A和0.462g 4,4’-三亚甲基-二哌啶(TDP)以及0.452g己烷-1,6-二醇-二丙烯酸酯(HDD)溶解在常压蒸馏除水的三氯甲烷中,通氮气10分钟,在氮气球的保护作用下,55℃油浴反应72h,反应结束后,通过冰乙醚沉淀,抽滤干燥后进行透析,冻干得到PCL-b-PAE。
3)多肽功能化的复合胶束的制备
将6mg步骤1)得到的βsyn36-PEG-b-PCL与步骤2)得到的6mg PCL-b-PAE分别过夜溶解在1ml超干的四氢呋喃中,制备得两种聚合物质量浓度均为6mg/ml的储备液;取400μLβsyn36-PEG-b-PCL聚合物溶液与800μLPCL-b-PAE进行混合,在超声条件下逐滴滴加入8.4ml超纯水中,超声持续60分钟;将所得混合液最终透析在PBS缓冲溶液中,定容得到聚合物质量浓度为0.6mg/ml的多肽功能化复合胶束溶液,将此胶束用于其他表征及应用实例。
实施例5:多肽功能化复合胶束的粒径分布、形貌与稳定性表征
在37℃条件下孵育胶束,以0时刻光强为1,监测不同时间点光强的变化。孵育结束后用动态光散射仪测量复合胶束的粒径大小,并用透射电子显微镜(TEM)表征其表面形貌。如图2所示,各个时间点的光强变化不大,表明这种多肽功能化复合胶束本身结构稳定。图3结果显示,所得到的复合胶束呈球形,粒径约为60nm。
实施例6:多肽功能化复合胶束用于抑制α-突触核蛋白自聚集
将200μM的α-突触核蛋白与等体积的0.6mg/ml的多条功能化复合胶束混合,在37℃,800rpm的震荡条件下进行孵育。在不同时间点取样进行检测,每次取80μl样品,加入720μl25μM提前配好的硫黄素T(ThT)溶液,震荡混均后用荧光分光光度计记录在446nm的激发波长下485nm处的荧光发射强度,其中激发狭缝宽为5nm,发射狭缝宽度为10nm。每个时间点取3次样测试取平均值,结果如图4。单独孵育100μM的α-突触核蛋白,同等条件下测试其ThT荧光强度变化作为对照实验。孵育结束后取最后一个时间点的样品进行磷钨酸负染,通过TEM观察样品的形貌,结果如图5A、B。此外,制备相同的样品,封口后在上述孵育条件下进行孵育,每天利用动态光散射仪检测样品光强的变化,结果见图6。
图4结果显示,单独孵育的α-突触核蛋白在72h时达到平台期,意味着成熟淀粉样纤维的形成,以对照组最大荧光值为1进行归一化,结果显示和复合胶束共孵育的α-突触核蛋白组的最大荧光约12%,表明实验组所形成的纤维很少。图5A与5B的结果显示孵育结束后,单独孵育的α-突触核蛋白形成了明显的纤维聚集体,而实验组的蛋白并没有形成明显的纤维聚集体。图6的结果显示在孵育过程中,单独孵育的α-突触核蛋白组的光强增强约53倍,而和复合胶束共孵育组的光强比0时刻只增加了2倍。这些实验结果表明多肽功能化的复合胶束成功抑制了α-突触核蛋白的聚集。
实施例7:多肽功能化复合胶束用于抑制α-突触核蛋白由其原纤维诱发的聚集
将200μM的α-突触核蛋白与等体积的0.6mg/ml的多条功能化复合胶束混合,在37℃,800rpm的震荡条件下进行孵育,在孵育起始时刻加入20μM的α-突触核蛋白原纤维诱发α-突触核蛋白单体聚集。在不同时间点取样进行检测,每次取80μl样品,加入720μl 25μM提前配好的硫黄素T(ThT)溶液,震荡混均后用荧光分光光度计记录在446nm的激发波长下485nm处的荧光发射强度,其中激发狭缝宽为5nm,发射狭缝宽度为10nm。每个时间点取3次样测试取平均值,结果如图7。单独孵育100μM的α-突触核蛋白,同等条件下测试其ThT荧光强度变化作为对照实验。结果显示对照组α-突触核蛋白单体在原纤维诱导作用下很快聚集,并在10h就达到了平台期,以对照组的最大ThT荧光强度为1,测得加入多肽功能化复合胶束组的最大ThT荧光值只有约20%,显著抑制了由原纤维诱导产生的聚集。
实施例8:多肽功能化复合胶束的生物相容性表征
首先对复合胶束本身的毒性进行了评估,以人神经母瘤细胞(SH-SY5Y)为神经元细胞模型进行测试。在96孔板中以每孔7000的标准接种细胞,待细胞贴壁完全后不同孔中分别用含不同浓度复合胶束(62.5~1000μg/ml)的培养基孵育,24h后加入CCK-8试剂检测细胞毒。结果如图8所示,复合胶束本身几乎无细胞毒性,细胞活性整体在88%以上,展示了复合胶束良好的生物相容性。
实施例9:多肽功能化复合胶束在保护神经元细胞免受α-突触核蛋白聚集体毒害方面的应用
采用“种子”诱导模型,可诱导SH-SY5Y细胞内过表达α-突触核蛋白发生病理性变化。在体外孵育α-突触核蛋白聚集体作为“种子”储备液,以每孔8000的密度在96孔板接种细胞,利用lipo3000试剂在每孔中转染0.1μg的pcdna3.1-HA-α-Syn质粒,随后将质粒液更换为含复合胶束(0.6mg/ml)的完全培养基进行培养,继续培养12h后更换为含“种子”的培养基,将“种子”导入细胞后,更换为含复合胶束的完全培养基继续培养48h,然后通过CCK-8试剂盒检测细胞活性。未加入复合胶束进行培养,但过表达了α-突触核蛋白且导入“种子”的SH-SY5Y细胞作为对照组,普通的SH-SY5Y细胞作为空白对照组。结果如图9所示,没有加入复合胶束的组细胞活性约52%,而加入胶束的细胞组活性约94%。结果表明,多肽功能化的复合胶束明显抑制了α-突触核蛋白病理性变化诱发的毒害作用。
- 一种抑制α-突触核蛋白聚集的多肽功能化的复合胶束的制备方法及应用
- 用于抑制β淀粉样蛋白聚集的多肽和多肽功能化的金纳米粒子及制备和应用
