一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
文献发布时间:2023-06-19 11:24:21
技术领域
本发明属于有机合成技术领域,涉及一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法,特别涉及一种水相单端基保护法制备羟烷基哌嗪类衍生物的方法。
背景技术
哌嗪及其衍生物是重要的化工中间体,可用来合成医药、染料和表面活性剂等多种精细化工产品,用途十分广泛,具有非常重要的药学价值及经济价值。例如,一些哌嗪衍生物在癌症和疟疾治疗的多药、耐药性方面具有很高的生物活性。在哌嗪的羟烷基取代反应中因其结构上含有两个对称的反应活性位点,易形成对称性的双羟烷基哌嗪副产品,使得N-单羟烷基哌嗪的收率很低,进而导致后续合成非对称性哌嗪衍生物的成本增大。因此以哌嗪和环氧烷烃为原料合成非对称性羟烷基哌嗪的关键在于提高中间体N-单羟烷基哌嗪的收率,抑制二取代物的生成。目前,羟烷基哌嗪作为有机二元胺,在脱除烟气中二氧化硫方面也表现出了良好的脱硫性能,具有对称结构的1,4-二(2-羟丙基)哌嗪已经工业化运用,但高熔点使其在实际运用过程中存在一定缺陷。因此,制备非对称性羟烷基哌嗪1-(2-羟乙基)-4-(2-羟丙基)哌嗪,可以在保证其脱硫性能的同时有效降低熔点,减少产品和溶剂损耗,具有广阔的工业应用前景。
专利201710732356.8、201710732357.2、201710732358.7、201710732359.1、201310199797.8、201610443468.7采用哌嗪和哌嗪二盐酸盐反应制备哌嗪单盐酸盐,或直接采用哌嗪单盐酸盐为原料与不同试剂反应合成了含有不同单取代基的哌嗪盐酸盐。这些方法所用起始原料哌嗪单盐酸盐或哌嗪二盐酸盐来源复杂,成本较高。
专利201711416091.7公开了一种单BOC保护双氨基化合物的的合成方法。该方法先以酸性化合物与双氨基反应进行络合反应,再加入适量的BOC酸酐进行反应,得到产品N-BOC哌嗪。该方法反应步骤简单,但由无机酸/有机酸与双氨基化合物生成中间体单铵盐的温度可调控区间小,不易控制;且专利中并未提及如何对N-BOC哌嗪铵盐中间体进行脱保护工艺处理的问题。
专利201310673132.6公开了一种以N-(2-羟乙基)哌嗪原料合成1-(2-羟乙基)-4-(2-羟丙基)哌嗪方法。该方法选用N-(2-羟乙基)哌嗪直接环氧丙烷反应,无需溶剂参与,但是高纯度的N-(2-羟乙基)哌嗪价格昂贵,生产成本较高。
文献《羟烷基哌嗪水相法合成及脱硫性能的研究报道》公开:采用不同有机酸、无机酸提供氢离子作为氮端基保护剂,调节哌嗪溶液pH至7.5,以哌嗪和环氧丙烷为原料反应合成N(-2-羟丙基)哌嗪。该制备方法绿色环保,工艺简单,但是对后续脱保护、提纯分离未做深入研究,分离方法单一,产品损失较大。
发明内容
本发明的目的在于提供一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法。
为实现上述目的及其他相关目的,本发明提供的技术方案是:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法,包括下列步骤:
步骤1:将第一反应原料哌嗪加入水中,然后加入单端基保护剂,反应得到第一反应体系;所述单端基保护剂为无机酸和有机酸中的至少一种;
步骤2:向第一反应体系中加入第二反应原料,反应得到第二反应体系;
步骤3:向所述第二反应体系中加入萃取剂,然后在搅拌条件下,调节pH值至9~14,静置后再过滤分离得到水相;
步骤4:将水相转移到一反应釜中,密封反应釜后将反应釜内的空气以氮气置换并抽真空,然后向所述反应釜内通入氮气;将反应釜内的温度升高至28-32℃,然后在搅拌条件下向反应釜通入第二反应原料的气体,在温度20~80℃的条件下进行反应,反应终止后,将反应液减压浓缩除去溶剂,将残余液用有机溶剂萃取,并进行二次减压蒸馏除去有机溶剂,将残余物经柱层析分离得到目标产物1-(2-羟乙基)4-(2-羟丙基)哌嗪;
所述第二反应原料为环氧乙烷和环氧丙烷。
优选的技术方案为:所述无机酸为硫酸、盐酸和磷酸中的至少一种;所述有机酸为碳原子数小于10的一元酸和多元酸中的至少一种。
优选的技术方案为:所述哌嗪与单端基保护剂中氢离子的摩尔比为1:0.5-2.5;哌嗪与水质量比为1:0.5-100;步骤1的反应条件为:温度为85-95℃,反应时间为0.5-2h。
优选的技术方案为:步骤1的反应产物哌嗪单铵盐与第二反应原料的摩尔比为1:0.5-2.5;步骤2的反应条件为:反应温度为25~60℃,反应时间为2~8h。
优选的技术方案为:萃取剂为六元环有机溶剂中的一种,萃取剂与环氧丙烷的质量比1~10:1。
优选的技术方案为:步骤4中,将反应釜内的空气以氮气置换并抽真空至反应釜内的压力-0.09MPa,然后向所述反应釜内通入氮气至所述反应釜内的压力为0.05Mpa。
优选的技术方案为:所述水相中的中间体与第二反应原料的摩尔比为1:0.5~1.5。
优选的技术方案为:所述有机溶剂为二氯甲烷、乙醇、丙醇、乙醚和甲苯中的至少一种;有机溶剂与第二反应原料的质量比为1-10:1。
由于上述技术方案运用,本发明与现有技术相比具有的优点是:
1、本发明以水相单端基保护法制备1-(2-羟乙基)4-(2-羟丙基)哌嗪。在不同的无机酸或有机酸端基保护剂作用下,哌嗪首先与环氧丙烷/环氧乙烷反应,生成中间化合物体N-(2-羟丙基)哌嗪/N-(2-羟乙基)哌嗪,经分离、脱保护工艺后,与环氧乙烷/环氧丙烷反应,反应产物经分离、纯化工艺后,制得1-(2-羟乙基)4-(2-羟丙基)哌嗪。该方法改变了哌嗪反应位点的活性,具有简单高效、绿色经济的优点。与已知方法相比优势明显,具有潜在广泛的应用前景。
2、本发明以哌嗪、环氧丙烷、环氧乙烷原料,原料价廉易得、来源广泛。反应简单,易于操作,目标产物收率高。同时本发明也为以哌嗪为原料合成非对称结构哌嗪衍生物提供一种绿色、经济的新思路,拓展了其应用范围。
附图说明
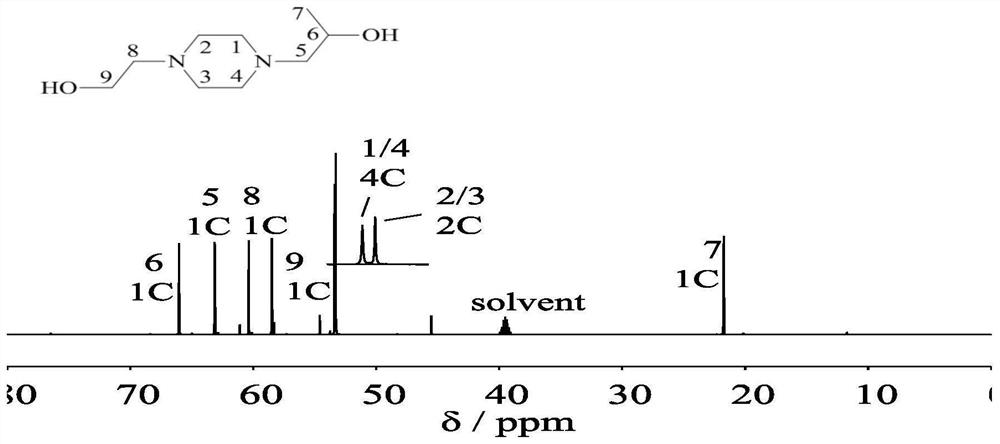
图1为实施例1所得最终产物的气相色谱图。
图2为实施例1所得最终产物的MS图。
图3为实施例1所得最终产物的
图4为实施例1所得最终产物的
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
请参阅图1-4。须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。同时,本说明书中所引用的如“上”、“下”、“左”、“右”、“中间”及“一”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
本发明所述制备方法以哌嗪、环氧丙烷/环氧乙烷为主要原料,以水为溶剂,以无机酸/有机酸为单端基保护剂;在无机酸/有机酸单端基保护剂作用下,哌嗪与溶液中的氢离子反应生成哌嗪铵盐;哌嗪铵盐首先与环氧丙烷/环氧乙烷反应,生成中间体N-(2-羟丙基)哌嗪/N-(2-羟乙基)哌嗪,经分离、脱保护工艺后,与环氧乙烷/环氧丙烷反应,反应产物经分离、纯化工艺后,制得1-(2-羟乙基)4-(2-羟丙基)哌嗪。
气相色谱检测条件为:进样口温度为200℃,柱箱温度为160℃,检测器温度为200℃。
实施例1:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
(1)将7.50g(0.0871mol)哌嗪溶解于100ml水中,在回流冷凝搅拌下,加入6.10g(0.0290mol)柠檬酸,加入过程中温度控制在85~95℃,加入完毕后保持温度与90℃,反应1h;
(2)向步骤(1)所得溶液中继续滴加5.06g(0.0871mol)环氧丙烷,滴加过程中温度控制在28~32℃,滴加完毕后保持温度于30℃,继续反应3h;
(3)向步骤(2)所得溶液中,加入萃取剂苯,在充分搅拌下加入氢氧化钡调节pH至9~14,静置过滤分离得到水相;
(4)将步骤(3)所得溶液转移到反应釜中,密封反应釜,将反应釜内的空气以氮气置换并抽真空至-0.09MPa,重复两次后向釜内通入氮气至0.05MPa。体系达到30℃后在搅拌状态下缓慢向釜内通入3.84g(0.0871mol)环氧乙烷气体,控制反应温度25~35℃,通过控制环氧乙烷气体通入速率保持反应压力稳定,恒温30℃反应3h。反应终止后,将反应液减压浓缩除去溶剂,将残余液用二氯甲烷萃取,并进行二次减压蒸馏除去二氯甲烷,将残余物经柱层析分离得到目标产物1-(2-羟乙基)4-(2-羟丙基)哌嗪,其收率为96.32%。
实施例2:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
将实施例1中端基保护剂柠檬酸替换成乳酸(9.42g,0.1045mol),同时实施例1步骤(2)中环氧丙烷加入量为4.50g(0.0523mol),反应温度调节为60℃,其余条件同实施例1,得到目标产物1-(2-羟乙基)4-(2-羟丙基)哌嗪,其收率为95.68%。
实施例3:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
将实施例1中端基保护剂柠檬酸替换为乙酸(4.18g,0.0697mol),同时实施例1步骤(4)中环氧乙烷加入量为2.69g(0.0610mol),反应温度降低至20℃,得到目标产物1-(2-羟乙基)4-(2-羟丙基)哌嗪,其收率为97.45%。
实施例4:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
将实施例1中端基保护剂柠檬酸替换为浓硫酸2.18g(0.0218mol),反应温度控制为45℃,其余条件同实施例1,得到目标产物1-(2-羟乙基)4-(2-羟丙基)哌嗪,其收率为96.52%。
实施例5:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
(1)将7.50g(0.0871mol)哌嗪溶解于100ml水中,在回流冷凝搅拌下,加入浓硫酸2.18g(0.0218mol),加入过程中温度控制在50~60℃,加入完毕后保持温度与55℃,反应1.5h。
(2)将步骤(1)所得溶液转移到反应釜中,密封反应釜,将反应釜内的空气以氮气置换并抽真空至-0.09MPa,重复两次后向釜内通入氮气至0.05MPa。体系达到40℃后在搅拌状态下缓慢向釜内通入4.42g(0.1002mol)环氧乙烷气体,控制反应温度35~45℃,通过控制环氧乙烷气体通入速率保持反应压力稳定,恒温40℃反应4h。
(3)反应终止后,将步骤(2)所得含N-(2-羟乙基)哌嗪胺盐的溶液中,加入100ml苯,在充分搅拌下加入氢氧化钠调节pH至9~14,反应3h,静置过滤分离得到水相。
(4)在回流冷凝搅拌下,向步骤(3)所得水相中继续滴加4.55g(0.0784mol)环氧丙烷,滴加过程中温度控制在20~30℃,滴加完毕后保持温度于25℃,继续反应5h。反应结束后,将反应液减压浓缩除去溶剂,将残余液用二氯甲烷萃取,并进行二次减压蒸馏除去二氯甲烷,将残余物经柱层析分离得到目标产物1-(2-羟乙基)4-(2-羟丙基)哌嗪,其收率为97.62%。
实施例6:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
将实施例5中端基保护剂浓硫酸替换为丁二酸(5.14g,0.0436mol),其余条件同实施例5,得到目标产物1-(2-羟乙基)4-(2-羟丙基)哌嗪,其收率为95.58%。
实施例7:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
水相单端基保护法制备1-(2-羟乙基)4-(2-羟丙基)哌嗪:以哌嗪、环氧丙烷/环氧乙烷为主要原料,以水为溶剂,以无机酸/有机酸为单端基保护剂;在无机酸/有机酸单端基保护剂作用下,哌嗪与溶液中的氢离子反应生成哌嗪铵盐;哌嗪铵盐首先与环氧丙烷/环氧乙烷反应,生成中间体N-(2-羟丙基)哌嗪盐/N-(2-羟乙基)哌嗪盐,经分离、脱保护工艺后,与环氧乙烷/环氧丙烷反应,反应产物经分离、纯化工艺后,经气相-质谱联用、核磁共振氢谱以及核磁共振碳谱可确定所得最终产物为1-(2-羟乙基)4-(2-羟丙基)哌嗪。该方法的化学反应方程式如下:
优选的实施方式为:所述无机酸包括硫酸、盐酸、磷酸,有机酸包括甲酸、乙酸、乙二酸及其他碳分子数目十以内的一元酸和多元酸。优选的无机酸选用硫酸,有机酸选用乙酸。
优选的实施方式为:所述哌嗪与有机酸或无机酸中氢离子的摩尔比为1:2~2.5;水的加入量以重量体积比g/ml算,是哌嗪的0.8~2倍,反应温度为30~90℃,反应时间为0.5~2h;哌嗪二铵盐与哌嗪的摩尔比为1~20:1,水的加入量以重量体积比g/ml算,是哌嗪二铵盐0.8~2倍,反应温度为95~120℃,反应时间为1~3h。
优选的实施方式为:所述步骤(1)中无机酸/有机酸与哌嗪摩尔比为n(H+):n(哌嗪)=1.1:1,水的加入量以重量体积比g/ml算,是哌嗪二铵盐的1.8倍,反应温度为60℃,反应时间为1h。
优选的实施方式为:所述的哌嗪单铵盐与环氧丙烷/环氧乙烷反应工艺中,哌嗪单铵盐与环氧丙烷/环氧乙烷的摩尔比为1.6~2.2:1;反应温度为25~60℃,反应时间为2~8h。
优选的实施方式为:所述步骤(2)中哌嗪单铵盐与环氧丙烷/环氧乙烷的摩尔比为1.8:1,反应温度为30℃,反应时间为5h。
优选的实施方式为:所述N-(2-羟丙基)哌嗪/N-(2-羟乙基)哌嗪中间体的脱保护、分离工艺为:是指哌嗪单铵盐与环氧丙烷反应后,萃取、调pH值、过滤,回收哌嗪二铵盐。向反应体系中加入苯、环己烷等六元环有机溶剂中的一种,其加入量按重量比g/g算,是环氧丙烷的1~10倍;再加入碱液调节溶液pH值至9~14,其质量分数为10%~35%,静置过滤分离得到水相。
优选的实施方式为:所述脱保护工艺中有机溶剂选用苯,苯的加入量按重量比g/g算,是环氧丙烷的2倍;所述碱液优选为质量分数为30%的氢氧化钠溶液。
优选的实施方式为:所述含中间体的混合液与环氧乙烷/环氧丙烷反应工艺为中间体N-(2-羟丙基)哌嗪/N-(2-羟乙基)哌嗪与环氧乙烷/环氧丙烷的摩尔比为1:0.5~1.5;反应温度为20~80℃,反应时间为1~10h。
优选的实施方式为:所述最终产物1-(2-羟乙基)4-(2-羟丙基)哌嗪的分离、纯化工艺为将反应完成后的反应液减压浓缩除去溶剂水,将残余液用二氯甲烷、乙醇、丙醇、乙醚、甲苯中的一种及以上,其加入量以重量比g/g算,是环氧丙烷的1~10倍;抽滤,滤液在真空减压下精馏,收集馏分即可得到1-(2-羟乙基)4-(2-羟丙基)哌嗪。
优选的实施方式为:所述分离、纯化工艺中,有机溶剂优选为二氯甲烷,其加入量以重量比g/g算,是环氧丙烷的2倍。
优选的实施方式为:所述分离、纯化工艺中,减压精馏的温度为125~165℃,真空度为450~675mmHg。
实施例8:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法,包括下列步骤:
步骤1:将第一反应原料哌嗪加入水中,然后加入单端基保护剂,反应得到第一反应体系;所述单端基保护剂为无机酸;
步骤2:向第一反应体系中加入第二反应原料,反应得到第二反应体系;
步骤3:向所述第二反应体系中加入萃取剂,然后在搅拌条件下,调节pH值至9,静置后再过滤分离得到水相;
步骤4:将水相转移到一反应釜中,密封反应釜后将反应釜内的空气以氮气置换并抽真空,然后向所述反应釜内通入氮气;将反应釜内的温度升高至28℃,然后在搅拌条件下向反应釜通入第二反应原料的气体,在温度20℃的条件下进行反应,反应终止后,将反应液减压浓缩除去溶剂,将残余液用有机溶剂萃取,并进行二次减压蒸馏除去有机溶剂,将残余物经柱层析分离得到目标产物1-(2-羟乙基)4-(2-羟丙基)哌嗪;
所述第二反应原料为环氧乙烷和环氧丙烷。
优选的实施方式为:所述无机酸为硫酸。
优选的实施方式为:所述哌嗪与单端基保护剂中氢离子的摩尔比为1:0.5;哌嗪与水质量比为1:0.5;步骤1的反应条件为:温度为85℃,反应时间为0.5h。
优选的实施方式为:步骤1的反应产物哌嗪单铵盐与第二反应原料的摩尔比为1:0.5;步骤2的反应条件为:反应温度为25℃,反应时间为2h。
优选的实施方式为:萃取剂为六元环有机溶剂中的一种,萃取剂与环氧丙烷的质量比1:1。
优选的实施方式为:步骤4中,将反应釜内的空气以氮气置换并抽真空至反应釜内的压力-0.09MPa,然后向所述反应釜内通入氮气至所述反应釜内的压力为0.05Mpa。
优选的实施方式为:所述水相中的中间体与第二反应原料的摩尔比为1:0.5。
优选的实施方式为:所述有机溶剂为二氯甲烷;有机溶剂与第二反应原料的质量比为1:1。
实施例9:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法,包括下列步骤:
步骤1:将第一反应原料哌嗪加入水中,然后加入单端基保护剂,反应得到第一反应体系;所述单端基保护剂为有机酸;
步骤2:向第一反应体系中加入第二反应原料,反应得到第二反应体系;
步骤3:向所述第二反应体系中加入萃取剂,然后在搅拌条件下,调节pH值至14,静置后再过滤分离得到水相;
步骤4:将水相转移到一反应釜中,密封反应釜后将反应釜内的空气以氮气置换并抽真空,然后向所述反应釜内通入氮气;将反应釜内的温度升高至32℃,然后在搅拌条件下向反应釜通入第二反应原料的气体,在温度80℃的条件下进行反应,反应终止后,将反应液减压浓缩除去溶剂,将残余液用有机溶剂萃取,并进行二次减压蒸馏除去有机溶剂,将残余物经柱层析分离得到目标产物1-(2-羟乙基)4-(2-羟丙基)哌嗪;
所述第二反应原料为环氧乙烷和环氧丙烷。
优选的实施方式为:所述有机酸为一元酸。
优选的实施方式为:所述哌嗪与单端基保护剂中氢离子的摩尔比为1:2.5;哌嗪与水质量比为1:100;步骤1的反应条件为:温度为95℃,反应时间为2h。
优选的实施方式为:步骤1的反应产物哌嗪单铵盐与第二反应原料的摩尔比为1:2.5;步骤2的反应条件为:反应温度为60℃,反应时间为8h。
优选的实施方式为:萃取剂为六元环有机溶剂中的一种,萃取剂与环氧丙烷的质量比10:1。
优选的实施方式为:步骤4中,将反应釜内的空气以氮气置换并抽真空至反应釜内的压力-0.09MPa,然后向所述反应釜内通入氮气至所述反应釜内的压力为0.05Mpa。
优选的实施方式为:所述水相中的中间体与第二反应原料的摩尔比为1:1.5。
优选的实施方式为:所述有机溶剂为乙醇;有机溶剂与第二反应原料的质量比为10:1。
实施例10:一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法,包括下列步骤:
步骤1:将第一反应原料哌嗪加入水中,然后加入单端基保护剂,反应得到第一反应体系;所述单端基保护剂为无机酸;
步骤2:向第一反应体系中加入第二反应原料,反应得到第二反应体系;
步骤3:向所述第二反应体系中加入萃取剂,然后在搅拌条件下,调节pH值至12,静置后再过滤分离得到水相;
步骤4:将水相转移到一反应釜中,密封反应釜后将反应釜内的空气以氮气置换并抽真空,然后向所述反应釜内通入氮气;将反应釜内的温度升高至30℃,然后在搅拌条件下向反应釜通入第二反应原料的气体,在温度50℃的条件下进行反应,反应终止后,将反应液减压浓缩除去溶剂,将残余液用有机溶剂萃取,并进行二次减压蒸馏除去有机溶剂,将残余物经柱层析分离得到目标产物1-(2-羟乙基)4-(2-羟丙基)哌嗪;
所述第二反应原料为环氧乙烷和环氧丙烷。
优选的实施方式为:所述无机酸为盐酸。
优选的实施方式为:所述哌嗪与单端基保护剂中氢离子的摩尔比为1:1.5;哌嗪与水质量比为1:50;步骤1的反应条件为:温度为90℃,反应时间为1h。
优选的实施方式为:步骤1的反应产物哌嗪单铵盐与第二反应原料的摩尔比为1:1.5;步骤2的反应条件为:反应温度为40℃,反应时间为5h。
优选的实施方式为:萃取剂为六元环有机溶剂中的一种,萃取剂与环氧丙烷的质量比5:1。
优选的实施方式为:步骤4中,将反应釜内的空气以氮气置换并抽真空至反应釜内的压力-0.09MPa,然后向所述反应釜内通入氮气至所述反应釜内的压力为0.05Mpa。
优选的实施方式为:所述水相中的中间体与第二反应原料的摩尔比为1:1。
优选的实施方式为:所述有机溶剂为二氯甲烷、乙醇、丙醇、乙醚和甲苯中的至少一种;有机溶剂与第二反应原料的质量比为5:1。
以上所述者仅为用以解释本发明之较佳实施例,并非企图具以对本发明做任何形式上之限制,是以,凡有在相同之发明精神下所作有关本发明之任何修饰或变更,皆仍应包括在本发明意图保护之范畴。
- 一种1-(2-羟乙基)-4-(2-羟丙基)哌嗪的水相制备方法
- 最纯净的RAC-1-{ 4-2-羟基-3-(5-喹啉基氧基)丙基-哌嗪-1-基}-2, 2-二苯基乙烷-1-酮富马酸盐的制备方法和最纯净的RAC-1-{4-2-羟基-3-(5-喹啉基氧基)丙基哌嗪-1-基}-2 , 2-二苯基乙烷-1-酮富马酸盐
