检测生殖道常见病原体的核酸探针组合、试剂盒及方法
文献发布时间:2023-06-19 11:40:48
技术领域
本发明属于生物诊断检测技术领域。更具体地,涉及一种快速检测生殖道常见病原体的核酸探针组合、试剂盒及方法;具体涉及人型支原体/奈瑟淋球菌/沙眼衣原体/解脲脲原体/生殖支原体/人巨细胞病毒/单纯疱疹病毒Ⅱ型的鉴定方法、引物、探针和试剂盒。
背景技术
生殖道感染(Reproductive Tract Infection,RTI)是妇女的常见病和多发病,是由于受细菌、病毒、支原体、霉菌、滴虫等多种病原体的侵袭而引起女性生殖道感染的一大类传染病的总称,包括阴道炎、外阴炎、盆腔炎等感染。女性生殖道感染是全球性的社会及公共卫生问题,具有发病率高、复发率高、流行范围广的特点。生殖道感染是多种疾病的源头,如果得不到及时诊断和正确治疗,可使艾滋病和宫颈癌的发生风险增加,以及引起不孕症,异位妊娠、流产、死胎、死产、早产、先天感染及新生儿感染、慢性腹痛等并发症,严重影响健康。世界卫生组织发布的数据表明,中国每年至少有2亿女性患生殖道感染及相关疾病。另据统计表明,妇产科门诊患者中,生殖道感染占55%以上。
生殖道病原体是引起生殖道感染性疾病的主要病因,常见的病原体主要有人型支原体(Mycoplasma hominis,MH)、奈瑟淋球菌(Neisseria gonorrhoeae,NG)、沙眼衣原体(Chlamydia trachomatis,CT)、解脲脲原体(Ureaplasma urealyticum,UU)、生殖支原体(Mycoplasma genitalium,MG)、人巨细胞病毒(Human Cytomegalovirus,HCMV)、单纯疱疹病毒Ⅱ型(Herpes Simplex VirusⅡ,HSVⅡ)等。流行病学调查显示,各地病原体检出率均不相同,并且不同年龄段患者容易感染的病原体也不同,另外混合型感染越来越常见,已成为医院妇科、皮肤性病科、泌尿生殖科的常见疾病,为我国重点防治的对象。
核酸杂交技术根据检测目的和方法的不同,可分为液相杂交、固相杂交及细胞内定位(原位)杂交。其中,固相杂交又可分为斑点杂交、印迹转移杂交。这类杂交技术的特点是将酶切产物或PCR扩增片断直接点膜或经电泳后Southern转移固定至膜上,再与液相中标记的特异探针杂交,这种杂交模式称为正向分子杂交。但是,应用该法检测待检样品时,一次反应仅能与一种探针杂交,多用于检测样品中所扩增的靶基因有无;如要对多个基因或多个突变位点同时进行鉴定,则需与多种探针一一杂交反应,繁琐而费时,难以满足检测要求。而反向分子杂交是将一系列包括属、群、种特异的寡核苷酸探针固定于膜或微孔板上,再与液相中待检标记的PCR产物杂交。反向斑点杂交(reverse dot blot,RDB)的技术原理是:预先将特定的寡核苷酸探针排列固定于固相载体上,采集待检标本,提取基因组DNA或RNA,应用生物素修饰的特异引物扩增DNA或反转录扩增RNA,使PCR产物带有生物素标记,将PCR产物变性后与固定在膜上的特异寡核苷酸探针杂交,通过酶免疫显色法检测和判读杂交结果。1989年Saiki等首次结合PCR扩增并应用反向斑点杂交(RDB)方法,即采用PCR-反向斑点杂交(PCR-RDB)技术同时检测全血中β地中海贫血多种基因突变位点,使β地中海贫血基因突变诊断取得了飞跃式进展。由于PCR-反向斑点杂交技术操作相对简便、快速、且价格相对低廉,因而已经在各种检测中应用于基因分型、基因突变检测和病原微生物菌种鉴定等领域。
目前,由于生殖道微生物菌群种类繁多,环境复杂,传统的细菌检测方法特异性不高,且灵敏度较低。现有技术中针对病原体的检测方法主要是微生物培养法、血清学方法、定性PCR、实时荧光定量PCR(qPCR)法等,均有相应的不足。其中,微生物分离培养鉴定是细菌和病毒检测的金标准,但是整个过程耗时约2~3天甚至更长,且操作繁琐,假阴性率高,培养结果易受外界环境影响;血清学方法用于检测血清中的抗体,适用于潜伏期、无症状病人及流行病学调查,包括型特异性血清抗体检测、免疫印迹法、ELISA等方法,该方法操作简单,但由于抗体形成较晚,血清学方法敏感性和特异性欠佳;定性PCR用于检测微生物中靶基因序列,一般采用凝胶电泳分析,耗时短,但具有一定的局限性,只能检测到10ng以上的DNA条带,因此在目的片段产量较低时无法检测到,灵敏度较低;而实时荧光定量PCR通过检测荧光信号的强弱从而实时检测PCR产物扩增量,可以对微生物中靶基因进行定量分析,检测结果准确,重复性高,但是只能做单重或最高3~4重,无法提高其通量,并且需要昂贵的专门仪器和专业操作人员,无法大规模推广应用。
反向斑点杂交技术(RDB)能够并行处理生物样本中的多个信息,因其检测高通量、高灵敏度,操作相对简便、快速、且价格相对低廉已广泛用于多个科研和领域,包括地中海贫血、HPV分型、HBV分型、差异表达基因、病原微生物菌种鉴定等,在病原微生物物种鉴定中具有极大的应用前景。与目前常规的实验室鉴定方法和其它分子鉴定方法相比,反向斑点杂交技术可以一次实验同时对病原微生物的多种基因进行快速基因型别鉴定,具有检测信息量大的特点,实验室常规的病原微生物检测时间可以从目前的3~10天缩短至4小时。另外,与DNA序列测定和最近几年发展的DNA芯片技术相比,反向系列探针杂交技术不需昂贵的仪器设备,试剂价格相对低廉,所以更具有广泛应用的潜力,尤其适合在发展中国家开展使用。该技术对引物和探针的灵敏度和特异性要求很高,合理的引物和探针设置是关键。
公开号为CN 107630097 A的中国专利文献公开了一种可用于同时检测包括沙眼衣原体、解脲脲原体、微小脲原体、淋球菌、生殖支原体、人型支原体、单纯疱疹病毒Ⅰ型、单纯疱疹病毒Ⅱ型的多重PCR引物组及方法。另外,公开号为CN 107099618 A的中国专利文献公开了一种用于检测泌尿生殖道致病微生物的LAMP引物组合物及其相关应用,将LAMP法的微流控芯片技术应用于性传播泌尿生殖道致病微生物的检测,利用微流控芯片提高生殖道致病微生物的检测速度,能够在1h内获得8种致病微生物指标的检测结果,而且提供的8个引物组对沙眼衣原体DNA、淋球菌DNA、解脲脲原体DNA、人型支原体DNA、生殖支原体DNA、单纯疱疹病毒2型DNA的最低检测限均为5×10
出于这种考虑,本发明的发明人进行了研究,目的是解决相关领域现有技术所暴露出来的问题,期望提供一种特异性高、耗时短、易操作的高灵敏度生殖道常见病原体检测方法。
发明内容
本发明要解决的技术问题是克服上述现有技术的缺陷和不足,提供一种快速检测生殖道常见病原体的核酸探针组合。该核酸探针组合可以针对人型支原体、奈瑟淋球菌、单纯疱疹病毒Ⅱ型、人巨细胞病毒、沙眼衣原体、解脲脲原体和生殖支原体等病原体进行检测,具有检测快速、操作方便、准确度和灵敏度高、特异性好、检测结果可视、结果准确等优点。
本发明的第一个目的是提供一种检测生殖道常见病原体的核酸探针组合。
本发明的第二个目的是提供上述核酸探针组合在制备检测生殖道常见病原体的试剂或试剂盒中的应用。
本发明的第三个目的是提供含有上述核酸探针组合的多重PCR联合反向斑点杂交的生殖道常见病原体检测试剂盒。
本发明的第四个目的是提供采用上述核酸探针组合和/或上述试剂盒来检测生殖道常见病原体的方法。
本发明上述目的通过以下技术方案实现:
一种检测生殖道常见病原体的核酸探针组合,包括:一组或多组多重特异性引物组合,和/或顺序固定于膜芯片表面的一条或多条探针组合;所述引物组合包括生殖道常见病原体的引物和内源对照GAPDH基因的引物;所述探针组合包括生殖道常见病原体特异性探针、阳性杂交点探针和内源对照GAPDH基因的探针;所述生殖道常见病原体包括人型支原体、奈瑟淋球菌、沙眼衣原体、解脲脲原体、生殖支原体、人巨细胞病毒和单纯疱疹病毒Ⅱ型;
其中,人型支原体的正向引物序列如SEQ ID No.1所示、反向引物序列如SEQ IDNo.2所示;探针序列如SEQ ID No.3所示;奈瑟淋球菌的正向引物序列如SEQ ID No.4所示、反向引物序列如SEQ ID No.5所示;探针序列如SEQ ID No.6所示;单纯疱疹病毒Ⅱ型的正向引物序列如SEQ ID No.7所示、反向引物序列如SEQ ID No.8所示;探针序列如SEQ IDNo.9所示;人巨细胞病毒的正向引物序列如SEQ ID No.10所示、反向引物序列如SEQ IDNo.11所示;探针序列如SEQ ID No.12所示;沙眼衣原体的正向引物序列如SEQ ID No.13所示、反向引物序列如SEQ ID No.14所示;探针序列如SEQ ID No.15所示;解脲脲原体的正向引物序列如SEQ ID No.16所示、反向引物序列如SEQ ID No.17所示;探针序列如SEQ IDNo.18所示;生殖支原体的正向引物序列如SEQ ID No.19所示、反向引物序列如SEQ IDNo.20所示;探针序列如SEQ ID No.21所示;
所述内源对照GAPDH基因的正向引物序列如SEQ ID No.22所示、反向引物序列如SEQ ID No.23所示;所述阳性杂交点探针序列如SEQ ID No.24所示;所述内源对照GAPDH基因的探针序列如SEQ ID No.25所示。
本发明通过设计多重特异性引物组合和探针组合,同时设计人GAPDH基因内源对照、阳性对照和阴性对照,采用多重PCR与反向斑点杂交结合技术,解决常规引物和探针对生殖道病原体检测准确率低的问题,解决7种以上生殖道病原体单反应体系平行检测的问题,同时解决多重引物和探针之间非特异性交叉反应的问题,克服现有技术多重反应体系容易交叉污染出现假阳性的缺陷,提高检测的准确性。
上述8种引物对可同时在同一体系中进行多重PCR扩增,避免非特异性扩增,具有较高的特异性和灵敏度。此外,在多重PCR的基础上本发明提供的核酸组合还可以通过在PCR扩增过程中采用不等量的正向引物和反向引物(修饰引物更多),使PCR扩增后产生大量的带修饰的产物,这些带修饰的产物可以有效提高检测的灵敏度。
进一步地,在本发明的一些实施方案中,上述探针的5′端标记有用于固定至基因芯片上的连接基团。
进一步地,在本发明的一些实施方案中,所述连接基团为氨基。本发明采用5′端带氨基(NH
进一步地,在本发明的一些实施方案中,各病原体的正向引物或反向引物5′端带生物素标志。PCR产物链上的生物素信号通过杂交的探针固定在芯片上。
本发明还提供了上述的核酸探针组合在制备检测生殖道常见病原体的试剂或试剂盒中的应用。其中,所述生殖道常见病原体包括人型支原体、奈瑟淋球菌、单纯疱疹病毒Ⅱ型、人巨细胞病毒、沙眼衣原体、解脲脲原体或生殖支原体中的一种或多种。
本发明还提供了一种检测生殖道常见病原体的试剂盒,由包含上述引物组合的多重PCR反应液、表面固定有上述探针组合的膜芯片、ddH
所述多重PCR反应液包括Taq聚合酶、UNG酶、MgCl
所述杂交试剂包括杂交液、杂交清洗液、酶标液、酶标清洗液I、酶标清洗液II和显色液;
所述C-PC为与所述阳性杂交点探针反向互补的寡核苷酸链,该寡核苷酸链的碱基序列如SEQ ID No.26所示。
进一步地,上述MgCl
本发明采用基于反向斑点杂交的可视化膜芯片技术进行病原体的分子杂交检测,其工作原理是首先将针对各个基因序列的单链探针按顺序排列固定于支持膜表面的特定区域,再将待测的多重PCR产物与其杂交,这样PCR产物中的基因序列单链DNA就会和支持膜上的探针杂交,经洗涤去除未结合的DNA样品,由于待测PCR产物的DNA上带有生物素标志,结合了待测DNA的探针点就偶联上了生物素标志物,再经过相应的显色反应就能读取对应的杂交信号,这样一张膜芯片上就可以同时检测多个病原体目标序列。本发明操作简便,只需要相对较短的寡核苷酸探针就能提供明显的杂交信号,在膜上添加针对不同病原体的探针,通过调整杂交条件可以在一张膜上同时检测多个样品,甚至可以鉴别出模板中一个碱基的差异,膜芯片同待测样本杂交后经底物显色可形成肉眼可视化的检测结果,有利于提高准确率,降低成本,节省时间。
进一步地,在本发明的一些实施方案中,所述杂交液为1~6倍浓度的SSPE溶液(即1×SSPE~6×SSPE)、重量百分比为0.1%~1%的十二烷基磺酸钠(SDS),优选为2×SSPE、0.1%SDS;
所述杂交清洗液为1×SSPE~6×SSPE溶液、重量百分比为0.1%~1%的十二烷基磺酸钠SDS,优选为2×SSPE、0.5%SDS;
所述酶标液为1×SSPE~6×SSPE溶液、重量百分比为0.1%~1%的十二烷基磺酸钠SDS、重量百分比为0.01%~0.05%的碱磷酶标记链亲和素,优选为2×SSPE、0.5%SDS、0.02%碱磷酶标记链亲和素;
所述酶标清洗液Ⅰ为1×SSPE~6×SSPE溶液、重量百分比为0.1%~1%的十二烷基磺酸钠SDS,优选为2×SSPE和0.5%SDS;
所述酶标清洗液Ⅱ为0.1~2M Tris-HCl、2~6M NaCl和0.1~2M MgCl
所述显色液为BCIP/NBT显色液,包括0.1~0.2mg/mL BCIP、0.1~0.5mg/mL NBT、10~100mmol/L Tris-HCl、5~50mmol/L MgCl
进一步地,在本发明的一些实施方案中,所述固相支持介质为尼龙膜或硝酸纤维素膜。
进一步地,在本发明的一些实施方案中,上述各探针的终浓度为20μM。
优选地,上述人型支原体正向引物和反向引物的终浓度分别为7.5μM和15μM;上述奈瑟淋球菌正向引物和反向引物的终浓度分别为3.75μM和7.5μM;上述单纯疱疹病毒Ⅱ型正向引物和反向引物的终浓度分别为3.75μM和7.5μM;上述人巨细胞病毒正向引物和反向引物的终浓度分别为3.75μM和7.5μM;沙眼衣原体正向引物和反向引物的终浓度均为7.5μM;解脲脲原体正向引物和反向引物的终浓度分别为7.5μM和15μM;生殖支原体正向引物和反向引物的终浓度分别为7.5μM和15μM;内源对照GAPDH基因正向引物和反向引物的终浓度均为3.75μM。
本发明还提供了一种检测生殖道常见病原体的方法,采用上述的试剂盒进行检测;具体包括如下步骤:
S1.提取待测样品的DNA;
S2.以待测样品DNA作为模板,采用权利要求7中所述的多重PCR反应液,进行多重PCR扩增,得到PCR扩增产物;
S3.将PCR扩增产物放入核酸分子杂交仪,加入权利要求7中所述的杂交试剂进行膜芯片反向斑点杂交反应,根据杂交结果直接肉眼判断其中是否含有生殖道常见病原体。
本方法和试剂盒的检测原理是物种特异性多重PCR结合膜芯片杂交技术。检测过程分三个步骤:1、多重PCR扩增;2、PCR产物同芯片杂交;3、杂交后芯片结果的判读。首先,物种特异性多重PCR系指以待测样品DNA为模板,使用各病原体引物,在热启动DNA聚合酶的作用下进行扩增。对于每一个病原体,均在其相对特异的区域上设计针对每个病原体检测的特异引物。由于使用的DNA聚合酶不具有3′-5′外切活性,所以当针对各病原体的特异性引物与模板不匹配时,引物不会扩增,只有当引物与模板完全匹配时,才能得到有效的扩增;同时针对每个病原体的下游引物5′标记生物素。通过对样品进行PCR扩增,理论上会获得大量的5′生物素标记反向互补的单链产物。其次,PCR产物同芯片杂交:扩增产物芯片杂交是指通过多重PCR扩增获得的带有同芯片上点制的探针序列反向互补的片段的单链PCR产物,通过杂交反应同芯片上点制的各探针进行结合,同时将PCR产物链上的生物素信号通过杂交的探针固定在芯片上。最后,杂交后芯片结果的判读:芯片结果的扫描和判读是指通过酶联显色的方式确定样品中病原体感染的情况。
与现有技术相比,本发明具有以下有益效果:
(1)本发明的8对引物和探针的碱基序列,是经过精心研究和大量实验得到的,其特点是引物之间不易形成二级结构,多重扩增的特异性强,与模板的错配概率小,只要有3个碱基以上的错配就不会成功扩增,既可以显著提高多重PCR扩增的特异性,又可以提高目标序列的扩增效率。
(2)本发明通过多重PCR与反向斑点杂交的结合,能一次性检测7种常见生殖道病原体,并以GAPDH作为内对照监控核酸提取、PCR过程,保证检测结果的特异性和准确性,避免了交叉污染和假阳性结果的出现,检测灵敏度和准确度高,而且最少能在4个小时内完成从样本到检测结果的过程,且杂交结果直接呈现在膜芯片上,肉眼可见,无须借额外的仪器。
(3)本发明操作简单,经过一次样本前处理,单管PCR扩增,单芯片杂交就可以同步检测样本中多种生殖道病原体基因序列,具有平行分析和多重判断的特点,克服了现有技术费时费力、成本高、需要大量模板的缺陷,具有快速灵敏,检测通量大,检测结果可视化,成本低廉的优点。
附图说明
图1为实施例3的检测结果膜芯片图。
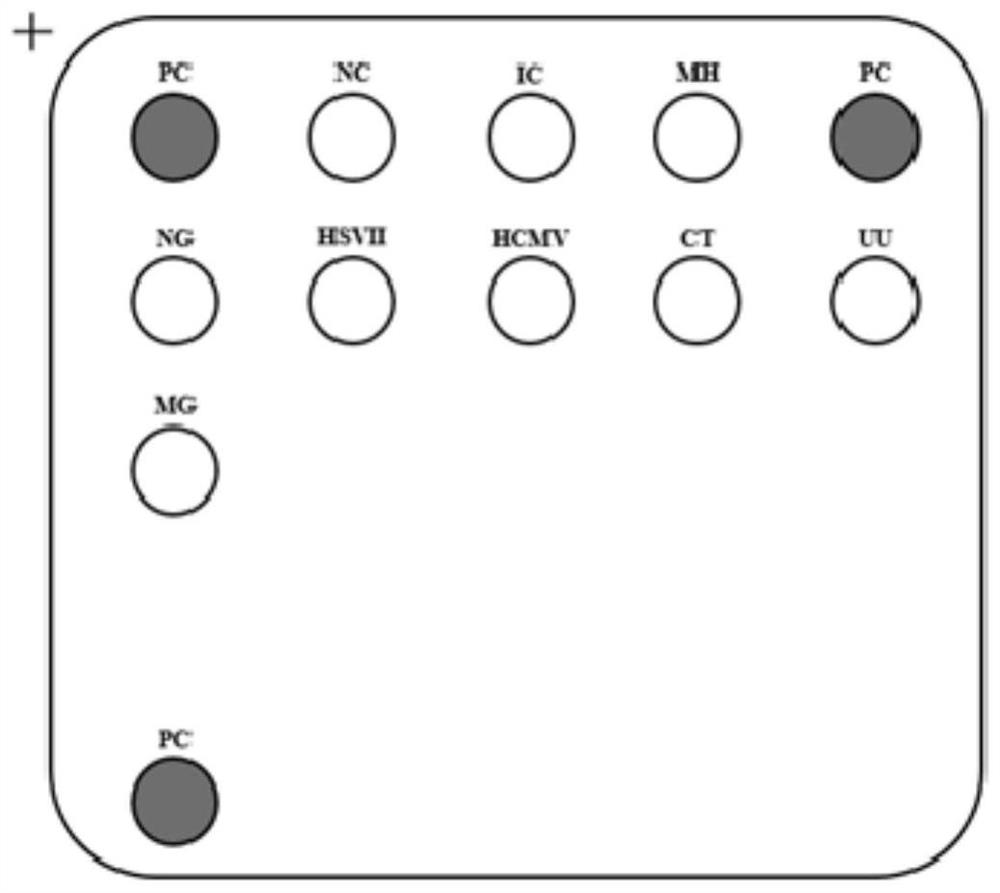
图2为本发明膜芯片点阵图。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1用于检测生殖道病原体的引物和探针的设计与制备
1、多重PCR试验设计
多重PCR(multiplex PCR),又称多重引物PCR或复合PCR,是指在同一PCR反应体系里加上2对以上引物,同时扩增出多个核酸片段的PCR反应。其难点主要是在同一体系中保证引物的特异性扩增以及避免不同引物之间的相互作用。
(1)序列分析及引物设计
于NCBI查询各病原体全基因组序列,确定各自保守性高的基因后,在各病原体的特异序列区段进行各病原体特异检测引物的设计,包括上游引物和下游引物;对设计的引物采用PCR扩增进行扩增效率的初步检测;对初步检测可行的引物进行非目标病原体模板的PCR扩增检测,测试引物的特异性,根据实验结果选择扩增效率高、特异性好的引物;对扩增效率高、特异性好的引物对中下游引物进行生物素标记,进行多重PCR体系构建,并设计探针进行膜芯片杂交检测,根据实验结果选择适合于多重PCR体系的引物;对选择得到的引物进行多样品验证后确认,最终得到各病原体的引物序列。
(2)内对照IC引物的设计
选择人看家基因GAPDH基因作为内对照IC,针对GAPDH基因序列设计检测的上游引物和下游引物,对引物进行PCR单重扩增验证,再对初步验证合格的下游引物加上生物素标记,与病原体检测引物一起进行多重PCR体系的构建,对扩增产物进行芯片杂交检测,测试引物的扩增效率和特异性,再决定是否采用该对引物。
(3)试验结果
1)PCR体系配制
2)PCR程序设定
通过实验,最终获得7种生殖道常见病原体检测引物和人GAPDH基因引物,序列见表1和表2,表中“F”代表正向引物、“R”代表反向引物。
表1 7种生殖道常见病原体引物序列
表2人GAPDH基因检测引物序列
2、反向斑点杂交
(1)序列分析及杂交探针设计
先在各病原体的检测序列内筛选合适的区段,再合成各探针序列;然后利用各探针点样制备芯片,再用实际样品进行多重PCR,将产物中带生物素的检测序列与芯片杂交进行探针的特异性和杂交效率筛选;选择与其它病原体检测序列无交叉、特异性较好、杂交效率高的探针,最终得到各病原体的检测探针。
(2)质控探针的设计和筛选
质控探针分为两大类:一是与检测位点无关的外对照质控探针;二是与检测目标物有关的内对照质控探针。
芯片上的外对照质控探针为阳性杂交点探针(Positive control,PC)。阳性杂交点探针为与检测序列无关的一段寡核苷酸片段。阳性杂交点探针印制于芯片上,与PCR预混液中末端标记生物素的互补的寡核苷酸片段C-PC杂交,用于质控杂交反应过程是否正常。
为了监测从取样、提取、扩增及杂交过程中各反应是否正常,本发明在监测体系中设置了人基因组DNA对照指标,在芯片上相应的名称为IC,即内对照质控探针。在试剂盒研制过程中,选择了人基因组中GAPDH基因作为检测的对象,质控取样中是否取到足量的上皮细胞样品。人GAPDH基因的检测过程同生殖道病原体检测的原理和流程相同,因此在设计GAPDH基因的检测体系时设计了GAPDH基因的检测引物和相应的探针序列,在检测结果中起着质控整个过程的内对照的作用。
另外,在芯片点阵上还设置了点样的空白对照,即阴性杂交点对照(Negativecontrol,NC)。阴性杂交点中不含有寡核苷酸片段,只有点样缓冲液,如果芯片点阵上阴性杂交点出现了显色,则提示点样过程和杂交过程中存在污染。
(3)试验结果
1)膜活化处理
取负电尼龙膜裁切成20×24cm大小,并用打印机打印出1cm见方的小方格,室温下将膜浸泡在含10%DCCD(二环己基碳二亚胺)的亚甲氯溶液中30min,用亚甲氯溶液洗膜4次,每次5min,最后将膜放置于空气中干燥。
2)探针点制
合成的探针干粉用PBS和丽春红溶解至20~40μM/μL(优选为30μM/μL),取0.2μL点至活化好的尼龙膜上,最后紫外交联20min。
3)膜去活化处理
将点有探针的尼龙膜浸泡于0.1M的NaOH溶液中,10min后取出放置于空气中干燥,最后将膜按小方格裁切后真空干燥保存。
4)杂交液配制
杂交液:2×SSPE和0.1%SDS。
杂交清洗液:2×SSPE和0.5%SDS。
酶标液:2×SSPE,0.5%SDS,0.02%碱磷酶标记链亲和素。
酶标清洗液Ⅰ:2×SSPE和0.5%SDS。
酶标清洗液Ⅱ:1M Tris-HCl,5M NaCl,1M MgCl
显色液:0.15mg/mL BCIP,0.30mg/mL NBT,100mmol/L Tris-HCl,5mmol/LMgCl
本例中所用辅料和配液为外购或自配,百分比为重量百分比。
5)膜芯片杂交
将PCR产物放入PCR仪,95℃热变性5min,放于冰上备用;取冷却后的PCR产物50μL加入杂交液中,同时将已活化处理并固定有相应探针的膜芯片装入杂交卡盒或离心管,使用相应的试剂按照表3中的温度和时间手动进行膜芯片斑点杂交检测。
表3膜芯片斑点杂交检测过程
实验完成后,根据杂交点显色情况参照图1进行结果判读,或用膜芯片成像仪自动判读。检测结果中,阳性对照即PC点应显色,阴性对照即NC点应不显色。
6)引物探针的筛选
用含目标片段的质粒进行单重PCR,将产物中带生物素的检测序列与芯片杂交,观察各质粒的产物同相对应的探针的反应情况。选择与各特异产物特异杂交,检测有信号的探针。筛选出了所需的各病原体探针和质控探针,具体序列见表4和表5。
表4各病原体探针序列
表5质控探针序列
注:“PC”代表阳性杂交点探针,“IC”代表内对照杂交探针。
3、多重体系优化调整
在多重体系的构建中关键是引物的组合。初期计划将所有的检测引物组合成一管体系,在一管体系工作不正常的情况下进行引物比例调试,直到所有引物对在多重PCR体系中均能达到预期的扩增效率。所有引物调试后的终浓度见表6。
表6引物终浓度
实施例2用于检测生殖道病原体的膜芯片试剂盒的制备
本例,用于检测生殖道病原体的膜芯片试剂盒,包括多重PCR反应液、样本提取液、阳性对照品、阴性对照品、说明书、膜芯片、杂交管、杂交反应液、盒体等。膜芯片为顺序固定在支持膜表面的7组探针序列(SEQ ID No.3、6、9、12、15、18、21)、一组阳性对照探针序列(SEQ ID No.24)和一组内源对照探针序列(SEQ ID No.25),各探针的5’端做氨基标记(NH
其中,多重PCR反应液,含有实施例1的8对上下游引物,PCR缓冲液、MgCl
MgCl
其中引物终浓度见上表6,探针终浓度为20μM;样本提取液含有Chelex 100、Triton X-100和TE缓冲液;阳性对照品为含有人GAPDH和生殖支原体片段的大肠杆菌工程菌菌液;阴性对照品为生理盐水;膜芯片为尼龙膜经处理后点制探针裁切制成。
其余同实施例1。
实施例3生殖道病原体核酸检测试剂盒(膜芯片法)的检测方法
1、利用实施例2的试剂盒检测人生殖道分泌物中的人型支原体/奈瑟淋球菌/沙眼衣原体/解脲脲原体/生殖支原体/人巨细胞病毒/单纯疱疹病毒Ⅱ型,具体步骤如下:
(1)核酸提取:取女性生殖道分泌物拭子10份,分别于1mL生理盐水中充分洗涤,然后挤干拭子丢弃,将500μL液体转移至1.5mL的离心管中,13000rpm离心5min,弃上清,向沉淀中加入50μL样本提取液,涡旋混匀后56℃水浴10min,然后95℃水浴2min,13000rpm离心5min,取上清液用于PCR反应;
(2)多重PCR扩增:取步骤(1)中核酸提取物5μL作为样品DNA,25μL多重PCR反应液,补水至50μL进行多重PCR扩增;
(3)膜芯片杂交:将PCR扩增产物放入PCR仪,95℃热变性5min,放于冰上备用;取冷却后的PCR产物50μL加入杂交液中,将装有膜芯片的卡盒和杂交试剂放入仪器中,点击程序开始自动杂交和结果判定。
(4)试验结果:
检测结果如图1所示。具体指标统计信息见表7。点阵示意图如图2所示,检测结果中,阳性对照即PC点应显色,阴性对照即NC点应不显色;内对照即IC点应显色;如果IC未显色同时无其它靶点显色,应重新提取检测或考虑取样时未取到足够多的上皮细胞;如果IC未显色同时有靶点显色,则认为结果正常。
表7实施例3的检测结果统计
现有技术即荧光PCR鉴定的方法为:取本例上述步骤(1)中剩余的500μL液体按照荧光PCR检测试剂盒的说明书进行提取、检测和结果判读。
结果如图1、图2和表7所示,检测结果与现有技术即荧光PCR鉴定结果一致,准确率达100%。
实施例4特异性、检出限、重复性、长期稳定性试验分析
1、特异性试验
(1)分别以1×10
(2)以常见微生物如表皮葡萄球菌、无乳链球菌、白色念珠菌、人乳头瘤病毒、阴道加德纳菌、大肠埃希菌等培养液为模板,按照实施例3中方法使用试剂盒进行多重PCR和反向斑点杂交,结果均为除PC点阳性外,其它靶点阴性。以人基因组为模板,按照实施例3中方法使用试剂盒进行多重PCR和反向斑点杂交,结果均为除PC和IC点阳性外,其它靶点阴性。
由仪器自动判读的结果见下表8。
表8特异性试验结果
结果表明本发明能特异性的检测人型支原体、奈瑟淋球菌、沙眼衣原体、解脲脲原体、生殖支原体、人巨细胞病毒、单纯疱疹病毒Ⅱ型,而与其它病原微生物或人基因组无交叉反应,如表皮葡萄球菌、无乳链球菌、白色念珠菌、人乳头瘤病毒、阴道加德纳菌、大肠埃希菌等。
2、检出限试验
分别以1×10
3、重复性试验
将人型支原体/奈瑟淋球菌/沙眼衣原体/解脲脲原体/生殖支原体/人巨细胞病毒/单纯疱疹病毒Ⅱ型培养液以及含人GAPDH基因片段大肠杆菌工程菌菌液混合均匀,使得各培养液终浓度为1×10
结果均为人型支原体、奈瑟淋球菌、沙眼衣原体、解脲脲原体、生殖支原体、人巨细胞病毒、单纯疱疹病毒Ⅱ型、IC阳性。
由此证明,本发明对人型支原体、奈瑟淋球菌、沙眼衣原体、解脲脲原体、生殖支原体、人巨细胞病毒、单纯疱疹病毒Ⅱ型以及人GAPDH基因检测的重复性良好。
4、长期稳定性试验
将上述实施例二的试剂盒放置于-20℃保存0个月、4个月、8个月、12个月、13个月后取出,观察在整个保存期各组分的性状,并以上述检出限测试中使用的1×10
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 检测生殖道常见病原体的核酸探针组合、试剂盒及方法
- 生殖道病原体核酸检测引物、探针、试剂盒及检测方法
