AZD3355(Lesogaberan)用于治疗和预防非酒精性脂肪性肝炎(NASH)、肝纤维化及其他肝脏病症
文献发布时间:2023-06-19 12:16:29
相关申请的交叉引用
本申请要求2018年10月12日提交的美国专利申请序列号62/744,927的优先权,其通过引用整体并入本文,如同明确阐述一般。
技术领域
本公开涉及通过施用治疗有效量的Lesogaberan(AZD3355)或相关化合物来治疗或预防非酒精性脂肪性肝炎(NASH)以及其他肝病因的肝纤维化的方法。
背景技术
非酒精性脂肪性肝炎(NASH)是一种在肝脏中引起炎症、脂肪堆积和组织纤维化(瘢痕)的疾病。NASH已成为全球慢性肝病的主要原因。血液中的肝酶水平可能比非酒精性脂肪性肝病(NAFLD)所表现的轻度升高更高。尽管酗酒的人群也会发生类似的情况,但是NASH会在喝酒很少或不喝酒的人群中发生。NASH的确切原因尚不清楚。但是,在某些医疗状况(例如糖尿病、肥胖症和胰岛素抵抗)的人中更常见。这种疾病的组合通常称为代谢综合症。
目前尚不清楚有多少人患有NASH,因为症状在发展为肝硬化前通常都是难以注意到或者症状比较轻微。但是,在美国约有3-5%的人通过肝活检诊断出NASH。大多数患有NASH的受试者年龄在40至60岁之间,但是这种情况也可能发生在10岁以上的儿童中。相比男性,女性发生NASH更为常见。
尽管仍在进行研究以寻找有效的治疗方法,但NASH的起因尚不清楚。目前,NASH的治疗重点在于控制与之相关的某些医疗状况(例如糖尿病和肥胖症)并监测其进展。目前尚没有NASH和相关肝脏疾病的有效治疗方法,并且迫切需要新的治疗方法。
除NASH之外,肝纤维化还可以由许多其他原因引起,这包括感染(病毒、细菌或寄生虫感染),药物引起的肝损伤、酶缺乏症、贮积症、脂质异常和酗酒。如果已知的、可能的和损伤引起的重塑(remodeling)不是太严重的话,治疗的重点是消除这些因素。由于这些疗法并非经常成功,因此需要防止肝纤维化进展和/或促使其得到解决的新疗法。
发明内容
在某些实施方案中,本公开提供了一种在有需要的受试者中治疗或预防肝脏疾病或病症的方法,包括向受试者施用治疗有效量的外周作用的GABA
在某些实施方案中,肝脏病症包括但不限于脂肪性肝病、非酒精性脂肪性肝病(NAFLD)、肥胖症、肝纤维化、肝硬化、肝细胞癌及其组合。
在某些实施方案中,非酒精性脂肪性肝病是非酒精性脂肪型肝炎(nonalcoholicsteatosis hepatitis)或非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)。在某些实施方案中,脂肪性肝病是脂肪型肝炎(steatosis hepatitis)或脂肪性肝炎(steatohepatitis)。
在某些实施方案中,受试者具有包括但不限于以下的一种或多种症状:肝炎、肝细胞损伤或死亡、胰岛素抵抗、体重增加、血脂异常和纤维化。
在一些实施方案中,施用外周作用的GABA
在某些实施方案中,肝纤维化或肝硬化与脂肪性肝病、非酒精性脂肪性肝病、肝炎、肝细胞损伤或死亡、肥胖症、肝细胞癌及其任何组合有关或由它们所引起。
在某些实施方案中,肝纤维化是由饮酒、感染(包括病毒性感染、细菌性感染和寄生虫感染),或免疫介导的疾病所引起。
在某些实施方案中,外周作用的GABA
在某些实施方案中,受试者是哺乳动物。在某些实施方案中,受试者是人类患者。
在进一步的实施方案中,本公开提供了一种在有需要的受试者中抑制肝纤维化的方法,包括向受试者施用治疗有效量的GABA
在某些实施方案中,肝纤维化与非酒精性脂肪型肝炎或非酒精性脂肪性肝炎(NASH)有关。在某些实施方案中,肝纤维化与脂肪型肝炎或脂肪性肝炎有关。在某些实施方案中,肝纤维化与脂肪性肝病、肥胖症、肝炎、肝细胞损伤或死亡、肝细胞癌及其组合相关或由它们所引起。
在某些实施方案中,受试者具有包括但不限于以下的一种或多种症状:肝炎、肝细胞损伤或死亡、胰岛素抵抗、体重增加、血脂异常和纤维化。
在一些实施方案中,施用外周作用的GABA
在某些实施方案中,GABA
在某些实施方案中,组合物每天施用两次。
在某些实施方案中,受试者是哺乳动物。在某些实施方案中,受试者是人类患者。
在某些实施方案中,本公开涉及一种增加肝细胞中GABA
附图说明
为了说明本发明,在附图中描绘了本发明的某些实施方案。然而,本发明不限于附图中所描述实施例的精确布置和手段。
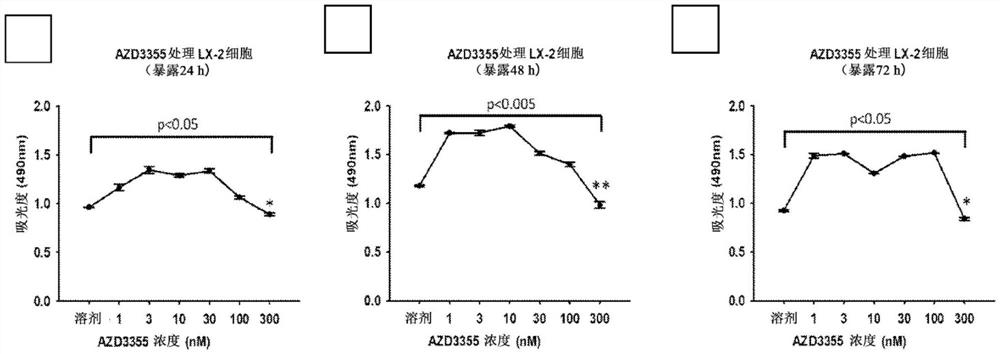
图1显示了用溶剂(vehicle)对照或AZD3355处理LX-2细胞的细胞毒性的MTS法测定结果。图1A显示了用0-300nM处理24小时的LX-2细胞。图1B显示了用0-300nM处理48小时的LX-2细胞。图1C显示了用0-300nM处理72小时的LX-2细胞。
图2显示了用溶剂对照或者30nM或100nM AZD3355处理48小时(图2A)或72小时(图2B)的phHSC细胞中细胞毒性的MTS法测定结果。
图3显示了暴露于溶剂对照或0-100nM的AZD3355中24小时(图3A和3D),48小时(图3B和3E)或72小时(图3C和3F)后的LX-2细胞增殖情况。图3A、3B和3C显示吸光度,图3D、3E和3F显示细胞增殖情况(占溶剂对照的百分比)。
图4显示了在暴露于溶剂对照或者30nM或100nM的AZD3355中48小时(图4A和4C)或72小时(图4B和4D)后的phHSC细胞增殖情况。图4A和4B显示吸光度,图4C和4D显示细胞增殖情况(占溶剂对照的百分比)。
图5显示了暴露于溶剂对照或者30nM或100nM AZD3355中72小时后通过半胱天冬酶(caspase)-3/7活性测定的对LX-2细胞的凋亡作用。DMSO(3%)用作为凋亡阳性对照。
图6显示了暴露于溶剂对照或者30nM或100nM AZD3355中72小时后通过半胱天冬酶-3/7活性测定的对phHSC细胞的凋亡作用。DMSO(3%)用作为凋亡阳性对照。
图7显示了用溶剂对照或者30nM或100nM的AZD3355处理48小时或72小时后,通过qPCR检测的LX-2细胞中基因的mRNA表达水平。图7A显示了GAPDH的表达。图7B显示了RPII的表达。图7C显示了微管蛋白的表达。图7D显示了β-肌动蛋白的表达。
图8显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼(Sorafenib)处理48小时后,通过qPCR检测的LX-2细胞中促纤维化基因的相对mRNA表达水平。黑色条显示了处理后的表达下调,灰色条显示了在停药48小时后基因的拯救情况以及另外48小时后无药培养基中细胞的维持情况,表明药物诱导是无毒的(*=p<0.05)。图8A显示了Col1α1的表达。图8B显示了αSMA的表达。图8C显示了βPDGF-R的表达。图8D显示了TGFβ-R1的表达。图8E显示了TIMP1的表达。图8F显示了TIMP2的表达。图8G显示了MMP2的表达。
图9显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理72小时后,通过qPCR检测的LX-2细胞中促纤维化基因的相对mRNA表达水平。黑色条显示了处理后的表达下调,灰色条显示了在停药72小时后基因的拯救情况以及另外72小时后无药培养基中细胞的维持情况,表明药物诱导是无毒的(*=p<0.05)。图9A显示了Col1α1的表达。图9B显示了αSMA的表达。图9C显示了βPDGF-R的表达。图9D显示了TGFβ-R1的表达。图9E显示了TIMP1的表达。图9F显示了TIMP2的表达。图9G显示了MMP2的表达。
图10显示了在用溶剂对照或者30nM或100nM的AZD3355处理48或72小时后,通过qPCR检测的phHSC细胞中的基因mRNA表达水平。图10A显示了GAPDH的mRNA表达。图10B显示了RPII的表达。图10C显示了微管蛋白的表达。图10D显示了β-肌动蛋白的表达。图10E显示了RPL13A。
图11显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理48小时后,通过qPCR检测的phHSC细胞中促纤维化基因的相对mRNA表达水平,表明与30nM的AZD3355处理对照组相比,βPDGF-R、TGFβ-R1和TIMP1的表达被下调。图11A显示了Col1α1的表达。图11B显示了αSMA的表达。图11C显示了βPDGF-R的表达。图11D显示了TGFβ-R1的表达。图11E显示了TIMP1的表达。图11F显示了TIMP2的表达。图11G显示了MMP2的表达。
图12显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理72小时后,通过qPCR检测的phHSC细胞中的促纤维化基因的相对mRNA表达水平,表明与30nM的AZD3355对照相比,除TIMP1和TIMP2以外的基因表达均被下调。图12A显示了Col1α1的表达。图12B显示了αSMA的表达。图12C显示了βPDGF-R的表达。图12D显示了TGFβ-R1的表达。图12E显示了TIMP1的表达。图12F显示了TIMP2的表达。图12G显示了MMP2的表达。
图13显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理48小时后,LX-2细胞中Col1α1蛋白的表达水平。图13A显示总细胞裂解物的代表性蛋白质印迹图。图13B显示蛋白质的相对表达图(相对于溶剂对照的百分比)。图13C显示通过ELISA检测的培养基中分泌蛋白的相对表达图。
图14显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理48小时后,LX-2细胞中MMP和αSMA蛋白的表达水平。图14A显示总细胞裂解物的代表性蛋白质印迹图。图14B显示MMP2的相对表达图(相对于溶剂对照的百分比)。图14C显示αSMA的相对表达图(相对于溶剂对照的百分比)。
图15显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理72小时后,LX-2细胞中Col1α1蛋白的表达水平。图15A显示总细胞裂解物的代表性蛋白质印迹图。图15B显示蛋白质的相对表达图(相对于溶剂对照的百分比)。图15C显示通过ELISA检测的培养基中分泌蛋白的相对表达图。
图16显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理72小时后,LX-2细胞中MMP和αSMA蛋白的表达水平。图16A显示总细胞裂解物的代表性蛋白质印迹图。图16B显示MMP2的相对表达图(相对于溶剂对照的百分比)。图16C显示αSMA的相对表达图(相对于溶剂对照的百分比)。
图17显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理48小时后,phHSC细胞中Col1α1蛋白的表达水平。图17A显示总细胞裂解物的代表性蛋白质印迹图。图17B显示蛋白质的相对表达图(相对于溶剂对照的百分比)。图17C显示通过ELISA检测的培养基中分泌蛋白的相对表达图。
图18显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理48小时后,phHSC细胞中MMP和αSMA蛋白的表达水平。图18A显示总细胞裂解物的代表性蛋白质印迹图。图18B显示MMP2的相对表达图(相对于溶剂对照的百分比)。图18C显示αSMA的相对表达图(相对于溶剂对照的百分比)。
图19显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理72小时后,phHSC细胞中Col1α1蛋白的表达水平。图19A显示总细胞裂解物的代表性蛋白质印迹图。图19B显示蛋白质的相对表达图(相对于溶剂对照的百分比)。图19C显示通过ELISA检测的培养基中分泌蛋白的相对表达图。
图20显示了在用溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼处理72小时后,phHSC细胞中MMP和αSMA蛋白的表达水平。图20A显示总细胞裂解物的代表性蛋白质印迹图。图20B显示MMP2的相对表达图(相对于溶剂对照的百分比)。图20C显示αSMA的相对表达图(相对于溶剂对照的百分比)。
图21显示了LX-2细胞中αSMA蛋白表达的免疫细胞化学。将细胞暴露于溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼中48小时(图21A)或72小时(图21B),并用αSMA抗体进行免疫染色。与溶剂对照相比,用AZD3355处理后观察到αSMA蛋白表达下降。
图22显示了phHSC细胞中αSMA蛋白表达的免疫细胞化学。将细胞暴露于溶剂对照或者30nM或100nM的AZD3355或7.5μM的索拉非尼48小时(图22A)或72小时(图22B),并用αSMA抗体进行免疫染色。与溶剂对照相比,用AZD3355处理后观察到αSMA蛋白表达下降。
图23显示了在用不同浓度的AZD3355或索拉非尼处理24小时后,用苏木精-伊红(H&E)染色的人肝切片的代表性图像,表明在AZD3355或索拉非尼处理过程中,肝细胞活力没有变化。
图24显示了在用所示浓度的AZD3355和索拉非尼处理24小时后,通过qPCR检测的人肝切片的各种样品中的相对基因表达。图24A显示了样品AZ1中Col1α1的表达。图24B显示了样品AZ1中TNF-α的表达。图24C显示了样品AZ1中IL-6的表达。图24D显示了样品AZ2中Col1α1的表达。图24E显示了样品AZ2中TNF-α的表达。图24F显示了样品AZ2中的IL-6表达。图24G显示了样品AZ3中Col1α1的表达。图24H显示了样品AZ3中TNF-α的表达。图24I显示了样品AZ3中的IL-6表达。图24J显示了样品AZ4中Col1α1的表达。图24K显示了样品AZ4中TNF-α的表达。图24L显示了样品AZ4中的IL-6表达。图24M显示了样品AZ5中Col1α1的表达。图24N显示了样品AZ5中TNF-α的表达。图24O显示了样品AZ5中IL-6的表达。图24P显示了样品AZ6中Col1α1的表达。图24Q显示了样品AZ6中TNF-α的表达。图24R显示了样品AZ6中的IL-6表达。图24S显示了样品AZ7中Col1α1的表达。图24T显示了样品AZ7中TNF-α的表达。图24U显示了样品AZ7中的IL-6表达。*=p<0.05。
图25显示了在用所示浓度的AZD3355处理24小时后,通过qPCR检测的人肝切片的其他样品中的相对基因表达。图25A显示了样品ev417中Col1α1的表达。图25B显示了样品ev417中TNF-α的表达。图25C显示了样品ev417中的IL-6表达。图25D显示了样品ev422中Col1α1的表达。图25E显示了样品ev422中TNF-α的表达。图25F显示了样品ev422中的IL-6表达。图25G显示了样品ev430中Col1α1的表达。图25H显示了样品ev430中TNF-α的表达。图25I显示了样品ev430中的IL-6表达。*=p<0.05。
图26显示了在未经处理、经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理的小鼠中,雄性NASH模型小鼠的西方饮食(Western diet)摄入量(小鼠/天)(图26A),雌性NASH模型小鼠的西方饮食摄入量(小鼠/天)(图26B),雄性NASH模型小鼠的糖摄入量(小鼠/天)(图26C)和雌性NASH模型小鼠的糖摄入量(小鼠/天)(图26D)。
图27显示了未经处理、经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理的小鼠中,雄性NASH模型小鼠(图27A)和雌性NASH模型小鼠(图27B)的体重,*=p<0.05。
图28显示了未经处理、经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理的小鼠中,雄性NASH模型小鼠(图28A)和雌性NASH模型小鼠(图28B)的肿瘤数量(百分比/组)。
图29显示了未经处理、经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理的雄性NASH模型小鼠的肝重和肝重/体重比。图29A显示了在第12和24周时未经处理的雄性NASH模型小鼠的肝重。图29B显示了经过指定处理后的雄性NASH模型小鼠的肝重。图29C显示了未经处理的雄性NASH模型小鼠在12和24周时的肝重/体重比。图29D显示了经过指定处理后的雄性NASH模型小鼠的肝重/体重比。
图30显示了未经处理、经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理的雄性NASH模型小鼠的脾重和脾重/肝重比。图30A显示了在第12和24周时未经处理的雄性NASH模型小鼠的脾重。图30B显示了经过指定处理的雄性NASH模型小鼠的脾重。图30C显示了未经处理的雄性NASH模型小鼠在12和24周时的脾重/肝重比。图30D显示了经过指定处理的雄性NASH模型小鼠的脾重/肝重比。
图31显示了未经处理、经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理的雌性NASH模型小鼠的肝重和肝重/体重比。图31A显示了在第12和24周时未经处理的雌性NASH模型小鼠的肝重。图31B显示了经过指定处理的雌性NASH模型小鼠的肝重。图31C显示了在12周和24周时未经处理的雌性NASH模型小鼠的肝重/体重比。图31D显示了经过指定处理的雌性NASH模型小鼠的肝重/体重比。
图32显示了未经处理、经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理的雌性NASH模型小鼠的脾重和脾重/肝重比。图32A显示了在第12和24周时未经处理的雌性NASH模型小鼠的脾重。图32B显示了经过指定处理方法的雌性NASH模型小鼠的脾重。图32C显示了在12和24周时未经处理的雌性NASH模型小鼠的脾重/肝重比。图32D显示了经过指定处理的雌性NASH模型小鼠的脾重/肝重比。
图33显示了与12周相比,在24周时NASH模型小鼠的肝酶水平的图。图33A显示了雄性的丙氨酸转氨酶(SGPT)水平。图33B显示了雄性的天冬氨酸转氨酶(SGOT)水平。图33C显示了雄性的总胆固醇水平。图33D显示了雄性的的总甘油三酯水平。图33E显示了雌性的丙氨酸转氨酶(SGPT)水平。图33F显示了雌性的天冬氨酸转氨酶(SGOT)水平。图33G显示了雌性的总胆固醇水平。图33H显示了雌性的总甘油三酯水平。
图34显示了经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理12周后的NASH模型小鼠的肝酶水平的图。图34A显示了经过指定处理后雄性的丙氨酸转氨酶水平(SGPT)。图34B显示了经过指定处理后雄性的天冬氨酸转氨酶(SGOT)水平。图34C显示了经过指定处理后雄性的总胆固醇水平。图34D显示了经过指定处理后雄性的总甘油三酯水平。图34E显示了经过指定处理后雌性的丙氨酸转氨酶(SGPT)水平。图34F显示了经过指定处理后雌性的天冬氨酸转氨酶(SGOT)水平。图34G显示了经过指定处理后雌性的总胆固醇水平。图34H显示了经过指定处理后雌性的总甘油三酯水平。
图34显示了经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理后的NASH小鼠的GADPH表达图。
图36显示了与12周相比,在24周时雄性NASH小鼠的纤维化基因表达情况。图36A显示了Col1α1的表达。图36B显示了αSMA的表达。图36C显示了βPDGF-R的表达。图36D显示了TGFβ-R1的表达。图36E显示了TIMP1的表达。图36F显示了TIMP2的表达。图37G显示了MMP2的表达。
图37显示了经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理12周后的雄性NASH小鼠的促纤维化基因表达情况。图37A显示了Col1α1的表达。图37B显示了αSMA的表达。图37C显示了βPDGF-R的表达。图37D显示了TGFβ-R1的表达。图37E显示了TIMP1的表达。图37F显示了TIMP2的表达。图37G显示了MMP2的表达。
图38显示了与12周相比,在24周时雌性NASH小鼠的促纤维化基因表达情况。图38A显示了Col1α1的表达。图38B显示了αSMA的表达。图38C显示了βPDGF-R的表达。图38D显示了TGFβ-R1的表达。图38E显示了TIMP1的表达。图38F显示了TIMP2的表达。图38G显示了MMP2的表达。
图39显示了经溶剂处理、经10mg/kg和30mg/kg的AZD3355处理和经30mg/kg的OCA处理12周后的雌性NASH小鼠的促纤维化基因表达情况。图39A显示了Col1α1的表达。图39B显示了αSMA的表达。图39C显示了βPDGF-R的表达。图39D显示了TGFβ-R1的表达。图39E显示了TIMP1的表达。图39F显示了TIMP2的表达。图39G显示了MMP2的表达。
图40显示了在12周和24周时未经处理的雄性NASH小鼠全肝中促纤维化蛋白表达的蛋白质印迹图。图40A显示12周时的雄性NASH小鼠的情况。图40B显示24周时的雄性NASH小鼠的情况。图40C显示12周时的雌性NASH小鼠的情况。图40D显示24周时的雌性NASH小鼠的情况。
图41显示了相对于GADPH的纤维化蛋白表达的蛋白质印迹的光密度分析图。图41A显示了雄性NASH小鼠的Col1α1蛋白表达图。图41B显示了雄性NASH小鼠的αSMA蛋白表达图。图41C显示了雌性NASH小鼠的Col1α1蛋白表达图。图41D显示了雌性NASH小鼠的αSMA蛋白表达图。
图42显示了使用溶剂对照(0.5%甲基纤维素)(图42A)、10mg/kg AZD3355(图42B)、30mg/kg AZD3355(图42C)或30mg/kg OCA(图42D)处理后的雄性NASH小鼠全肝中Col1α1和αSMA的促纤维化蛋白表达的代表性蛋白质印迹图。
图43显示了使用溶剂对照(0.5%甲基纤维素)、10mg/kg AZD3355、30mg/kgAZD3355或30mg/kg OCA处理后的雄性NASH小鼠中相对GADPH的纤维化蛋白表达的光密度分析图。图43A显示了Col1α1的蛋白表达情况。图43B显示了αSMA的蛋白表达情况。
图44显示了使用溶剂对照(0.5%甲基纤维素)(图44A)、10mg/kg AZD3355(图44B)、30mg/kg AZD3355(图44C)或30mg/kg OCA(图44D)处理后的雌性NASH小鼠全肝中Col1α1和αSMA的促纤维化蛋白表达的代表性蛋白质印迹图。
图45显示了使用溶剂对照(0.5%甲基纤维素)、10mg/kg AZD3355、30mg/kgAZD3355或30mg/kg OCA处理后的雌性NASH小鼠相对GADPH的纤维化蛋白表达的光密度分析图。图45A显示了Col1α1的蛋白表达情况。图45B显示了αSMA的蛋白表达情况。
图46显示了使用天狼星红/固绿染色液染色后,NASH小鼠肝切片上的总纤维化百分数和胶原蛋白积累的形态计量图。图46A显示了在12周和24周时,未经处理的雄性NASH小鼠的总纤维化情况。图46B显示了在12周和24周时,未经处理的雌性NASH小鼠的总纤维化情况。
图47显示了使用溶剂对照(0.5%甲基纤维素)、10mg/kg AZD3355、30mg/kgAZD3355或30mg/kg OCA处理后,经过天狼星红/固绿染色液染色后的雄性NASH小鼠肝切片上的总纤维化百分数和胶原蛋白积累的形态计量图。图47A显示了经过指定处理的雄性NASH小鼠的总纤维化情况。图47B显示了经过指定处理的雄性NASH小鼠中的胶原沉积情况。
图48显示了使用溶剂对照(0.5%甲基纤维素)、10mg/kg AZD3355、30mg/kgAZD3355或30mg/kg OCA处理后,经过天狼星红/固绿染色液染色后的雌性NASH小鼠肝切片上的总纤维化百分数和胶原蛋白积累的形态计量图。图48A显示了经过指定处理的雌性NASH小鼠的总纤维化情况。图48B显示了经过指定处理的雌性NASH小鼠中的胶原沉积情况。
图49显示了根据Brunt标准使用脂肪变性、肝细胞气球样变和小叶内炎症评分之和计算的肝脏中NAFLD活性评分(NAS)图,评分范围为0-8,表明NASH模型小鼠在第12周达到NASH并维持长达24周。图49A显示了雄性NASH小鼠的NAS分数。图49B显示了雌性NASH小鼠的NAS分数。
图50显示了NASH小鼠经过溶剂对照(0.5%甲基纤维素)、10mg/kg AZD3355、30mg/kg AZD3355或30mg/kg OCA处理后,根据Brunt标准使用脂肪变性、肝细胞气球样变和小叶内炎症评分之和计算的肝脏中NAFLD活性评分(NAS)图,评分范围为0-8。图50A显示了经过指定处理的雄性NASH小鼠的NAS分数。图50B显示了经过指定处理的雌性NASH小鼠的NAS分数。
图51显示了用于评估12周和24周时未经处理的小鼠肝中的纤维化阶段和脂肪性肝炎等级的汇管区炎症的组织病理学评分(Brunt标准)图。相比12周时,纤维化阶段在24周时增加,表明存在明显的肝损伤。图51A显示了雄性NASH小鼠中的汇管区炎症。图51B显示了雄性NASH小鼠的纤维化。图51C显示了雄性NASH小鼠中的脂肪性肝炎等级。图51D显示了雌性NASH小鼠中的汇管区炎症。图51E显示了雌性NASH小鼠的纤维化。图51F显示了雌性NASH小鼠中的脂肪性肝炎等级。
图52显示了NASH小鼠经过溶剂对照(0.5%甲基纤维素)、10mg/kg AZD3355、30mg/kg AZD3355或30mg/kg OCA处理后,用于评估纤维化阶段和脂肪性肝炎等级的汇管区炎症的组织病理学评分(Brunt标准)图。图52A显示了经过指定处理的雄性NASH小鼠的汇管区炎症。图52B显示了经过指定处理的雄性NASH小鼠的纤维化。图52C显示了经过指定处理的雄性NASH小鼠的脂肪性肝炎等级。图52D显示了经过指定处理的雌性NASH小鼠的汇管区炎症。图52E显示了经过指定处理的雌性NASH小鼠的纤维化。图52F显示了经过指定处理的雌性NASH小鼠中的脂肪性肝炎等级。
具体实施方式
本公开部分基于以下发现:可以用GABA
在某些实施方案中,本公开涉及任何原因引起的肝纤维化的治疗和/或预防,包括NASH、脂肪性肝病、非酒精性脂肪性肝病、肥胖症和肝细胞癌。在某些实施方案中,肝纤维化是由饮酒、感染(包括病毒性感染、细菌性感染和寄生虫感染)或免疫介导的疾病所引起。
在某些实施方案中,本公开涉及AZD3355化合物及其盐、溶剂化物和生理功能衍生物作为新疗法的用途,尤其是在NASH、NAFLD、HCC、肝纤维化、HCC和相关的肝脏疾病和病症中的治疗用途。
在进一步的实施方案中,本公开内容涉及减轻、调节或抑制NASH、NAFLD、HCC以及相关肝脏疾病和病症的发展或进展的方法。
在进一步的实施方案中,本公开提供了一种治疗和/或预防患有诸如NASH、NAFLD、HCC以及相关肝脏疾病或病症等疾病的患者的方法,该方法包括向所述患者施用治疗有效量的GABA
在进一步的实施方案中,本公开提供了GABA
在本发明的上下文中以及在使用每个术语的特定上下文中,在本说明书中使用的术语通常具有本领域的普通含义。某些术语在下文或说明书中的其他地方进行了讨论,以描述本发明的方法以及如何使用其,从而为从业人员提供指导。而且,将认识到,可以以一种以上的方式描述同一个事物。因此,替代的语言和同义词可以用于本文所讨论的任何一个或多个术语,无论本文是否阐述或讨论该术语也不具有任何特殊意义。本文提供了某些术语的同义词。使用一个或多个同义词进行描述并不排除使用其他同义词。说明书中任何地方使用的示例,包括本文讨论的任何术语示例,仅是说明性的,而绝不限定本发明或任何示例性术语的范围和含义。同样,本发明不限于其优选实施例。
本申请中使用的术语“受试者”是指具有免疫系统的动物,例如禽类和哺乳动物类。哺乳动物包括犬、猫、啮齿动物、牛、马、猪、绵羊和灵长类动物。禽类包括但不限于家禽、鸣禽和猛禽。因此,本发明可用于兽医学,例如治疗伴侣动物,农场动物,动物园中的实验动物以及野生动物。本发明尤其可满足人类医学应用的需要。
本申请中使用的术语“患者”是指人类受试者。在本发明的一些实施方案中,“患者”患有肝脏疾病,包括但不限于:脂肪性肝病、非酒精性脂肪性肝病、肥胖症、肝纤维化、肝硬化、肝细胞癌,及其组合。
术语“治疗”、“治疗方法”等是指减慢、减轻、改善或缓解疾病的至少一种症状或在疾病发作后逆转疾病的手段。
术语“预防”、“防止”等是指在疾病明显发作之前起作用,以防止疾病发展或使疾病程度最小化或减慢其发展进程。
术语“有需要”是指已知或怀疑患有肝病或病症或有患病风险的受试者。
有需要治疗的受试者是已经发展出该疾病或病症的受试者。需要预防的受试者是具有该疾病或病症的风险因素的受试者。
本文使用的短语“治疗有效量”是指足以引起受试者临床显著状况改善,或延迟或最小化或减轻与该疾病有关的一种或多种症状,或引起所需的有益的生理机能改变的量。
如本文所用的术语“药剂”是指产生或能够产生效果的物质,并且将包括但不限于化学药品、药物、生物制剂、小的有机分子、抗体、核酸、肽和蛋白质。
术语“大约”或“近似”是指在特定值的可接受误差范围内,如本领域普通技术人员所确定的那样,该值将部分取决于如何测量或测定该数值,即,测量系统的限制,即,特定目的(例如药物制剂)所需的精确度。例如,根据本领域的实践,“约”可以表示在1个或多于1个标准偏差之内。或者,“约”可以意指给定值的至多20%,优选地至多10%,更优选地至多5%,并且还更优选地至多1%的范围。或者,特别是关于生物系统或过程,该术语可以意指数值的一个数量级内,优选地在数值的5倍之内,更优选地在数值的2倍之内。在本申请和权利要求书中描述了特定值的情况下,除非另有说明,否则应假设术语“约”是指在该特定值的可接受误差范围内。
根据本发明,可以使用许多本领域技术范围内的工具和技术,例如在分子免疫学、细胞免疫学、药理学和微生物学中通常使用的那些工具和技术。参见,例如,Sambrook etal.(2001)Molecular Cloning:A Laboratory Manual.3rd ed.Cold Spring HarborLaboratory Press:Cold Spring Harbor,N.Y.;Ausubel et al.eds.(2005)CurrentProtocols in Molecular Biology.John Wiley and Sons,Inc.:Hoboken,N.J.;Bonifacino et al.eds.(2005)Current Protocols in Cell Biology.John Wiley andSons,Inc.:Hoboken,N.J.;Coligan et al.eds.(2005)Current Protocols inImmunology,John Wiley and Sons,Inc.:Hoboken,N.J.;Coico et al.eds.(2005)Current Protocols in Microbiology,John Wiley and Sons,Inc.:Hoboken,N.J.;Coligan et al.eds.(2005)Current Protocols in Protein Science,John Wiley andSons,Inc.:Hoboken,N.J.;and Enna et al.eds.(2005)Current Protocols inPharmacology,John Wiley and Sons,Inc.:Hoboken,N.J.
AZD3355:商品名为Lesogaberan;
[(2R)-3-氨基-2-氟丙基]次膦酸344413-67-8
分子式:C
分子量:140.073285g/mol
[(2R)-3-氨基-2-氟丙基]次膦酸
AZD-3355
NASH:Nonalcoholic steatohepatitis,非酒精性脂肪性肝炎
NAFLD:Nonalcoholic fatty liver disease,非酒精性脂肪性肝病
HCC:Hepatocellular carcinoma,肝细胞癌
A549:Adenocarcinomic human alveolar basal epithelial cell,人腺癌肺泡基底上皮细胞。
MCF7:Breast cancer cell line,乳腺癌细胞系。
LX-2:Immortalized human hepatic stellate cell,永生化人肝星状细胞
phHPSC:Primary human hepatic stellate cell,人原代肝星状细胞
ALT:Alanine aminotransferase,丙氨酸转氨酶
AST:Aspartate aminotransferase,天冬氨酸转氨酶
大多数患有NASH的人都没有症状。有时,NASH与疲劳、一般的不适感以及右上腹部的模糊不适症状有关。尽管NASH的病因尚不清楚,但最常见于患有以下一种或多种疾病或病症的人。
肥胖–超过70%的NASH患者肥胖。大多数患有NASH的肥胖者比理想体重重10%至40%。
糖尿病–高达75%的NASH患者患有2型糖尿病。
高脂血症–大约20%至80%的NASH患者患有高脂血症(血液中甘油三酸酯水平高和/或血液中胆固醇水平高)。
胰岛素抵抗–胰岛素抵抗是指人体对胰岛素没有充分反应的状态。胰岛素抵抗通常发生在肥胖的高脂血症患者中。这组症状称为代谢综合症,在NASH患者中较常见。
药物和毒素–几种用于治疗医疗状况的药物与NASH相关,包括胺碘酮(商品名:Corderone,Pacerone)、他莫昔芬(商品名:Nolvadex,Tamone)、马来酸哌克昔林(商品名:Pexhid)、类固醇(例如,泼尼松、氢化可的松)和合成雌激素。对细胞有毒的农药也与NASH有关。
NASH最常在常规实验室检查中发现。其他检查有助于确认NASH的存在,并排除其他类型的肝脏疾病。影像学检查(例如超声、CT扫描或核磁共振成像[MRI])可显示肝脏中的脂肪沉积,但无法将NASH与其他外观相似的肝脏疾病病因区分开。如果不能排除其他肝脏疾病病因,可能需要进行肝活检以确认NASH。
通过血液检查来测量肝功能,可以测量由肝脏所产生或代谢的物质的水平,从而可以帮助诊断NASH并将NASH与酒精性肝炎进行区分。大约90%的NASH患者的两种肝酶(天冬氨酸转氨酶[AST]和丙氨酸转氨酶[ALT])的水平会升高。其他血液检查可用于排除其他肝脏疾病病因,这些检查通常包括病毒性肝炎(甲肝、乙肝或丙肝)的检查。
尽管其他检查可能提示诊断为NASH,但有时需要进行肝活检以确认。如果无法通过标准血液和影像学检查排除其他肝脏疾病病因,则可能需要进行肝活检。肝活检还可以帮助确定炎症的严重程度,检测肝瘢痕形成(纤维化或严重时肝硬化),并可以提供有关疾病未来病程的线索。该检查涉及收集少量肝组织样品,然后将其送至实验室进行显微镜检查和生化检查。肝纤维化扫描是一种非侵入性检查,其使用超声来确定肝脏的“硬化”程度。然后,可以使用这种硬度来评估肝脏中有多少疤痕,并确定是否已经发展为肝硬化。在可行的情况下,肝纤维化扫描是检测肝瘢痕形成的理想的可替代肝活检的方法。
NASH没有治愈方法。治疗旨在控制与NASH相关的病症,例如肥胖症、糖尿病和高脂血症。减轻体重可以帮助降低肝脏酶、胰岛素的水平,并可以改善生活质量。体重减轻应是循序渐进的(每周不超过3.5磅或1.6千克),这是因为体重快速减轻与肝脏疾病的恶化有关。有几种药物可用于胰岛素抵抗患者,并且这些药物正在NASH患者中进行研究。
NASH通常是一种慢性疾病(即,可以持续多年)。很难预测一个人的NASH病程。尽管肝活检中的特征可能会有所帮助,但很少有因素可用于预测疾病的病程。
但是,NASH可以在某些人中会有所进展。随时间推移跟踪肝脏损害的初步研究表明,大约3%的人的病情有所改善,54%的人病情稳定,而43%的人病情恶化。
NASH最严重的并发症是肝硬化,这发生在肝脏严重瘢痕化时。据估计,有8%至26%的NASH患者会发展为肝硬化。老年糖尿病妇女的风险可能更高。
NASH患者经常患有代谢综合征(胰岛素抵抗、肥胖症和高脂血症)。代谢综合症使人们患心脏病的风险增加。可以预期,NASH的治疗(尤其是减轻体重)也将有助于治疗代谢综合征中的其他问题。
GABA
评估GABA
本文提出的发现,即这些作用不依赖于中央活性以及巴氯芬的辅助(非GABA
如本文所述,计算的化学基因组学药物分析表明AZD3355既可以减少与NASH相关的肝损伤,也可以抑制胶原蛋白和其他疤痕成分的产生,甚至可以减轻肝癌发生的风险,而肝癌是NASH进展带来危及生命的后果。
肝细胞癌(HCC)占大多数原发性肝癌。众所周知,HCC可以在NASH肝硬化的环境中发生(Ascha等,2010)。在NASH背景下对HCC进行的多项回顾性研究支持将糖尿病和肥胖与HCC风险相关联的观点,并表明晚期纤维化具有重大风险。与NASH的发展有关的胰岛素抵抗及其随后的炎症级联似乎在HCC的癌变过程中起着重要的作用。鉴于NASH和HCC之间的相似性和紧密联系以及AZD3355与NASH和HCC之间的计算化学基因组学联系,可以预期AZD3355可用于HCC的治疗。
本文所述的其他体外和体内结果表明,AZD3355可用于治疗肝脏疾病和病症,这包括NASH和HCC。使用肝细胞和人肝切片进行的体外试验表明,AZD3355治疗可降低促纤维化基因的表达且不含毒性。使用NASH小鼠模型的体内试验的进一步证据显示,用AZD3355治疗可减少肝脏中的肿瘤发展,改善肝脏和脾脏重量,改善坏死性炎症活性,包括肝损伤的生化标志物(AST和ALT),并显著降低所有促纤维化基因的表达水平,而且对小鼠没有任何毒性作用。
Lesogaberan(AZD3355)由阿斯利康(AstraZeneca)开发用于治疗胃食管反流病(GERD)(Bredenoord,2009)。作为一种GABA
以下与AZD3355相关的专利通过引用并入本文:7,557,234号美国专利、8,026,384号美国专利、6,664,069号美国专利、6,117,908号美国专利、7,319,095号美国专利、6,841,698号美国专利、7,034,176号美国专利、7,807,658号美国专利和6,576,626号美国专利。
虽然可以将任何治疗性化合物(例如AZD3355及其盐、溶剂化物和生理功能性衍生物)作为化学原料药进行施用用于治疗,但也可以将活性成分制成药物组合物进行给药。因此,本公开进一步提供了一种药物组合物,其包含治疗有效量的AZD3355化合物及其盐、溶剂化物和生理功能衍生物,以及一种或多种药学上可接受的载体。AZD3355化合物及其盐、溶剂化物和生理功能衍生物如本文所述。
本文使用的短语“药学上可接受的”是指当分子实体和组合物向人类施用时,在生理上可耐受并且通常不产生过敏反应或类似的不适反应,例如胃部不适、头昏眼花等,并且由美国联邦或州政府的监管机构批准,或者在美国药典或其他公认的药典中列出可用于动物,尤其是可用于人类。
术语“载体”是指与治疗剂一起施用的稀释剂、佐剂、赋形剂或溶剂。这种药物载体可以是无菌液体,例如溶于水和油的盐溶液,包括石油、动物、植物或合成来源的盐溶液,例如花生油、大豆油、矿物油、芝麻油等。当药物组合物静脉内施用时,盐溶液是优选的载体。盐溶液以及葡萄糖水溶液和甘油溶液也可以用作液体载体,特别是用于注射用溶液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石粉、氯化钠、脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇,等等。如果需要,该组合物还可包含少量的湿润剂或乳化剂或pH缓冲剂。
从与制剂的其他成分相容并且对接受者无害的意义上而言,载体必须是可接受的。
本公开的药物组合物可以适于通过任何合适的途径施用,例如通过口服(包括口腔或舌下)、吸入、经鼻、经眼或经肠胃外(包括静脉内和肌肉内)的途径施用。这种组合物可以通过药学领域已知的任何方法来制备,例如通过将活性成分与载体或赋形剂结合来制备。
在进一步的实施方案中,本公开提供了适合于通过口服途径给药的药物组合物,用于治疗与NASH、NAFLD、肝纤维化、肝细胞癌和相关肝病相关的疾病和病症。
适用于口服给药的本公开药物组合物可以以离散单元存在,例如胶囊或片剂;粉末或颗粒;以水性或非水液体中的溶液或悬浮液存在;以可食用的泡沫或发糕(whip)存在;或以水包油型液体乳剂或油包水型液体乳剂存在。
例如,对于以片剂或胶囊形式的口服给药,可以将活性药物组分与口服的、无毒的药学上可接受的惰性载体例如乙醇、甘油、水等混合。通过将化合物粉碎至合适的细小尺寸并与类似粉碎的药物载体例如可食用的碳水化合物,例如淀粉或甘露醇混合,以制备粉末。也可以存在调味剂、防腐剂、分散剂和着色剂。
通过如上所述制备粉末混合物并填充形成的明胶皮来制备胶囊。在填充操作之前,可以将助流剂和润滑剂(例如胶体二氧化硅、滑石粉、硬脂酸镁、硬脂酸钙或固体聚乙二醇)添加到粉末混合物中。还可以加入崩解剂或增溶剂,例如琼脂、碳酸钙或碳酸钠,以提高胶囊摄入时药物的利用率。
此外,当需要或必要时,也可以将合适的粘合剂、润滑剂、崩解剂和着色剂掺入混合物中。合适的粘合剂包括淀粉、明胶、天然糖类例如葡萄糖或β-乳糖、玉米甜味剂、天然和合成胶例如阿拉伯胶、黄芪胶或海藻酸钠、羧甲基纤维素、聚乙二醇、蜡等。这些剂型中使用的润滑剂包括油酸钠、硬脂酸钠、硬脂酸镁、苯甲酸钠、乙酸钠、氯化钠等。崩解剂包括但不限于淀粉、甲基纤维素、琼脂、膨润土、黄原胶等。例如,片剂可通过以下来配制:制备粉末混合物,制粒或压片,添加润滑剂和崩解剂并压制成片剂。粉末混合物通过以下来制备:将化合物适当地粉碎后,与上述稀释剂或载体混合,任选地与粘合剂(如羧甲基纤维素、海藻酸盐、明胶或聚乙烯吡咯烷酮)、溶液阻滞剂(如石蜡),再吸收促进剂(例如季盐)和/或吸收剂(例如膨润土、高岭土或磷酸二钙)混合。粉末混合物的制粒可以通过用诸如糖浆、淀粉糊、阿卡迪亚粘液、或纤维素或聚合物材料的溶液等粘合剂润湿,并迫使其通过筛网来进行。作为制粒的替代方法,可以将粉末混合物通过压片机,结果是不完全形成的团块破碎成颗粒。可以通过添加硬脂酸、硬脂酸盐、滑石粉或矿物油来润滑颗粒,以防止粘附在片剂成型模具上。然后将润滑的混合物压制成片剂。本发明的化合物也可以与自由流动的惰性载体混合并直接压制成片剂,而无需经过制粒或重压步骤。可以提供由虫胶的密封层、糖或聚合物材料的包衣层以及蜡的抛光层组成的透明或不透明的保护包衣。可以将染料添加到这些包衣中以区分不同的单位剂量。
口服液例如溶液、糖浆和酏剂可以以剂量单位形式制备,以使给定量的口服液包含预定量的化合物。糖浆可以通过将化合物溶解在适当调味的水溶液中来制备,而酏剂可通过使用无毒的醇溶剂来制备。悬浮液可以通过将化合物分散在无毒的载体中来配制。也可以加入增溶剂和乳化剂,例如乙氧基化的异硬脂醇和聚氧乙烯山梨糖醇醚、防腐剂、调味剂,例如薄荷油或天然甜味剂或糖精或其他人造甜味剂等。
应当理解,除了上述特别提及的成分之外,所述组合物还可以包括本领域中有关所讨论的制剂类型的其他常规试剂,例如适合于口服给药的那些制剂可以包括调味剂。
用于本发明方法中的化合物的治疗有效量将取决于许多因素,包括例如动物的年龄和体重,需要治疗的确切病症及其严重程度,制剂的性质,以及给药途径,并且最终将由巡诊医师或兽医判定。然而,可用于治疗与NASH、NAFLD、HCC和相关肝病相关的疾病或病症的有效量的AZD3355化合物将通常在每天约5μg至100mg/kg接受者(哺乳动物)体重的范围内,更通常在每天约50μg至50mg/kg体重的范围内,更通常在每天约1mg至100mg/kg体重的范围内,更通常在每天约5mg至75mg/kg体重的范围内,更通常在每天约20mg至60mg/kg体重的范围内。该量可以每天单剂量给药或更通常以每天多次(例如两、三、四、五或六)亚剂量给药,使得每日总剂量相同。其盐或溶剂化物的有效量可以确定为AZD3355化合物本身的有效量的比例。
可以进行剂量调整以优化受试者的效果。例如,可以以低剂量开始服用AZD3355,然后随着时间的推移逐渐增加剂量,具体取决于受试者的反应。可以先监测受试者的病情改善情况,再改变(即增加或减少)剂量。在改变(即增加或减少)剂量之前,还可以监测受试者的不良反应。
药物组合物可以以单位剂量形式存在,每单位剂量包含预定量的活性成分。根据所治疗的病症,给药途径和年龄,体重以及患者的状况,单位剂量可包含例如5μg至1g,优选1mg至700mg,更优选10mg至240mg的AZD3355化合物。因此,这种单位剂量可以每天多次给药。优选的单位剂量组合物包含如上文所述的每日剂量或亚剂量(用于每天给药一次以上)或其适当的一部分活性成分。此外,可以通过药学领域公知的任何方法来制备这种药物组合物。
本公开的化合物及其盐、溶剂化物和生理功能衍生物可以单独使用或与其他治疗剂结合使用,其他治疗剂用于治疗与NASH、NAFLD、肝纤维化、肝细胞癌及相关肝病相关的肝脏疾病和病症。因此,根据本公开的组合疗法包括施用至少一种AZD3355化合物、或其药学上可接受的盐或溶剂化物、或其生理功能衍生物。
AZD3355化合物和其他药物活性剂可以一起或分开给药,当分开给药时,其可以同时或以任何顺序依次给药。选择AZD3355化合物和其他药物活性剂的量以及相对的给药时间,以实现所需的组合治疗效果。
这种组合的各种化合物可以在单独或组合的药物组合物中依次或同时给药。优选地,各种化合物将在组合的药物组合物中同时给药。本领域技术人员将容易理解已知治疗剂的适当剂量。
本领域技术人员将清楚的是,在适当的情况下,治疗成分可以以盐的形式使用,例如碱金属盐或胺盐或酸加成盐、或前药、或酯,例如低级烷基酯、或溶剂化物,例如水合物,以优化治疗成分的活性和/或稳定性和/或物理特性,例如溶解性。同样清楚的是,在适当的情况下,治疗成分可以以光学纯净物的形式使用。
上面提到的化合物可以方便地以药物组合物的形式存在,因此药物组合物可以进一步包含代表本发明另一方面的药学上可接受的稀释剂或载体。
这种组合的各种化合物可以在单独或组合的药物组合物中依次或同时给药。优选地,各种化合物将在组合的药物组合物中同时给药。本领域技术人员将容易理解已知治疗剂的适当剂量。
化合物可以通过有机合成领域中已知的方法制备,这些方法部分地在以下合成方案中进行阐述。在下面描述的所有方案中,众所周知,根据一般化学原理,在必要时对敏感或反应性基团采用保护基。根据有机合成的标准方法(T.W.Green和P.G.M.Wuts(1991)《有机合成中的保护基团》,John Wiley&Sons)操纵保护基团。使用本领域技术人员显而易见的方法在化合物合成中方便的阶段除去除这些基团。保护基的选择以及反应条件和反应步骤的顺序应与本发明化合物的制备相一致。本领域技术人员将认识到本发明化合物中是否存在立体中心。因此,本公开包括所有可能的立体异构体,并且不仅包括立体异构体的混合物(例如外消旋化合物),而且还包括各个立体异构体。当需要一种化合物作为单一对映体时,可以通过立体定向合成或者通过拆分最终产物或任何方便的中间体来获得。最终产物,中间体或起始原料的拆分可以通过本领域已知的任何合适方法来进行。参见,例如,E.L.Eliel,S.H.Wilen和L.N.Mander的《有机化合物的立体化学》(Wiley-Interscience,1994)。
用于实施本公开描述的方法的试剂盒也在本公开的范围内。这种试剂盒可以包括在外周激动化GABA
在一些实施方案中,所述试剂盒可包括用于本文所述任何方法的说明书。所包括的说明书可包括将药剂施用于受试者以在受试者中实现预期的药剂活性的描述。试剂盒可进一步包括基于确定受试者是否需要治疗来选择适合于治疗的受试者的描述。
与本文所述药剂的使用有关的说明通常包括有关预期治疗的剂量,给药方案和给药途径的信息。容器可以是单位剂量、散装(例如多剂量包装)或亚单位剂量。在本公开的试剂盒中提供的说明书通常是在标签或包装说明书上的书面说明。标签或包装说明书指示药物组合物用于治疗、延缓发作和/或减轻受试者的疾病或病症。
本文提供的试剂盒具有合适的包装。合适的包装包括但不限于小瓶、瓶子、广口瓶、软包装等。还考虑了与特定装置例如吸入器、鼻腔给药装置或输注装置结合使用的包装。试剂盒可以具有无菌入口(例如,容器可以是静脉输液袋或具有可通过皮下注射针刺穿的瓶塞的小瓶)。该容器还可以具有无菌入口。
任选地,试剂盒可以提供其他组成部分,例如缓冲液和解释性信息。通常,试剂盒包括容器和在容器上或与容器相关的标签或包装说明书。在一些实施方案中,本公开提供了包含上述试剂盒内容物的制品。
通过下面的实验细节将更好地理解本发明。然而,本领域技术人员将容易理解,所讨论的具体方法和结果仅是对如所附权利要求书中所详述的本发明的举例说明。
实施例1-AZD3355新适应症的鉴定
通常使用计算化学基因组学药物分析来鉴定NASH、NAFLD、HCC和肝硬化(肝纤维化)(即,包括其他原因引起的疾病)作为化合物AZD3355的新适应症。用于鉴定AZD3355与这些适应症之间的治疗联系的方法是基于改良的“连通映射(connectivity mapping)”方法(Lamb等,2006),在该方法中药物的转录组学信号,即经处理与未经处理的细胞中测量的mRNA全基因组变化模式通过计算方法,与人类疾病的mRNA信号(疾病与健康对照)进行比较。AZD3355的转录组信号是通过将标准的A549和MCF7细胞系暴露于两种不同浓度的AZD3355以及溶剂对照中而产生的。暴露7小时后获得RNA,并使用单端RNA测序进行定量。
对代表310种不同疾病的适应症的转录谱的AZD3355化学基因组谱进行了系统评估,并进行了排名得到最大的疾病适应症。这些分析在多个实验条件下鉴定了在数百种其他潜在适应症中,NASH和其他肝病(包括HCC和肝硬化)是AZD3355的主要适应症。此外,一旦确定了AZD3355与NASH之间的强匹配性,采用相同的方法就连通映射中所有1,309种化合物与疾病转录组文库中NASH信号的连通性进行了分析,发现在1,309种化合物中该连通性得分排在NASH预测的前1%。因此,通过这些方法,在310种疾病和1,309种化合物中,发现AZD3355与NASH之间的联系在全球范围内是唯一的,并且具有重要意义。
表1:AZD3355信号与NASH及相关肝硬化疾病的显著转录组连通性概述AZD3355剂量
对AZD3355经处理的化学基因组图谱与对照化学基因组图谱的分析揭示了暴露细胞中分子活性的复杂模式。例如,AZD3355和NASH信号之间的负连通性得分所代表的“前沿”基因的功能性分子注释鉴定出了GWAS基因的差异调节,该基因具有与LDL胆固醇和内脏肥胖;脂质代谢、脂肪形成、胰岛素信号传导和自噬相关通路;以及涉及肝细胞、脂肪细胞、单核细胞和巨噬细胞的细胞类型信号的多重连接相关的高风险变体。这些发现表明,AZD3355诱导的分子活性超出了其经典的作用机理,这种药物再利用(repurposing)方法已将这种活性考虑在内。
尽管这种再利用方法是基于“信号”的方法,但其使得对潜在的药物/适应症对的假定分子机制进行了更深入的研究。为了阐明对AZD3355和NASH之间联系的更深入的分子理解,构建了异质患者人群肝活检样品的基因共表达网络模型,包括NASH、脂肪变性、健康肥胖和健康对照的个体(Ahrens等,2013)。这种方法有助于检测在NASH背景下特别受到干扰的基因亚网络,并使得能够将临床因素与那些网络特征相关联。将AZD3355的化学基因组信号投射到这些网络模型上,并鉴定了NASH中失调的几个独特且有趣的基因共表达模块,这些模块与相关的临床特征(例如肝纤维化程度)相关,并且特别会受到AZD3355的干扰。该网络分析进一步为将AZD3355再利用于NASH提供了信息并加强了支持,还鉴定了可能支撑AZD3355在NASH关键网络中分子参与的特定基因模块。
实施例2-AZD3355在治疗和预防包括NASH在内的肝脏病症或疾病中的用途,如细胞培养试验所示
在永生化人肝星状细胞(LX-2)和人原代肝星状细胞(phHSC)中进行细胞培养试验。
细胞用盐水处理作为溶剂对照,用浓度范围从1nM至300nM的AZD3355处理,或用7.5μM的索拉非尼处理作为阳性对照。
在不同的指定时间点,评估细胞的细胞毒性、细胞增殖、凋亡率、纤维化基因和蛋白质的表达。
AZD3355和索拉非尼(Sorafenib)小分子:
AZD3355化合物由阿斯利康(AstraZeneca)提供。由阿斯利康确定分子量和所供应药物的总重量。将AZD3355化合物以2mM浓度的原液溶解于生理盐水(0.9%氯化钠)中,然后加入到补充有0.1%BSA的无抗生素DMEM细胞培养基中,使系列工作浓度分别为1、3、10、30、100和300nM。在进行每个实验之前,新鲜配制储备液和工作液。对于阳性对照,将细胞用溶于DMSO的7.5μM浓度的激酶抑制剂索拉非尼(LC实验室,MA目录号S-8502,批号121952)进行平行处理。
人肝星状细胞:
LX-2细胞:在37℃、5%CO
人原代肝星状细胞(phHSC):实验方案已由Mount Sinai机构审查委员会批准并认证。phHSC是从缺少患者识别符的手术切除的人类肝脏残留物中制备的。将切除的肝碎片先用肝灌注介质(ThermoScientific,Cat#17701),然后用含0.05%胶原酶(Roche,Ref#11459643001)+0.02%链霉蛋白酶(Roche,Ref#11459643001)的肝细胞洗涤介质在存在DNase的情况下,进行两步灌注。灌注后,将肝组织机械破碎,并在相同胶原酶-磷酸酶-DNA酶缓冲溶液中在37℃下消化40分钟。经酶消化的肝细胞悬液通过70μm细胞过滤器过滤。将细胞悬浮液用Percoll(GE Healthcare,Cat#17-0891-01)双密度梯度(52%和35%)在4℃下以2400rpm离心,以纯化HSC。从Percoll梯度的上层收集HSC,在DMEM中洗涤,然后在含有10%胎牛血清和青霉素/链霉素的DMEM培养基中于37℃、5%CO
实验设计概述:
在每个实验开始时,将星状细胞(LX-2细胞或phHSC细胞)在含0.1%BSA(不含抗生素)的DMEM培养基中进行血清饥饿过夜,以同步细胞的代谢活性。然后将细胞暴露于不同工作浓度的AZD3355或者索拉非尼中24、48和72小时。
细胞毒性测定:
将5,000个LX-2细胞或10,000个phHSC细胞接种至96孔板的每个孔中。细胞在含0.1%BSA(不含抗生素)的DMEM培养基中血清饥饿过夜。然后将细胞与不同浓度的AZD3355孵育指定时间,按照制造商的方案使用单溶液96孔细胞增殖测定试剂盒(CellTiter96AQueous One Solution Cell Proliferation Assay kit,Promega,WI)完成MTS测定。
细胞增殖测定:
将5,000个LX-2细胞或10,000个phHSC细胞接种至96孔板的每个孔中。细胞在含0.1%BSA(不含抗生素)的DMEM培养基中进行血清饥饿过夜后,将细胞暴露于指定浓度的AZD3355中。在暴露于药物的第48和72小时,在37℃下用BrdU标记细胞2小时(LX-2细胞)或16小时(phHSC细胞)。按照制造商的说明使用细胞增殖ELISA,BrdU比色试剂盒(Roche,NY)进行细胞增殖测定。
细胞凋亡测定:
将5,000个LX-2细胞或10,000个phHSC细胞接种至96孔透明底部黑色板的每个孔中。细胞在含0.1%BSA(不含抗生素)的DMEM培养基中进行血清饥饿过夜后,将细胞暴露于指定浓度的AZD3355中。对于阳性凋亡对照,细胞用3%的DMSO处理。暴露72小时后,按照制造商的方案,使用Apo-ONE均质半胱天冬酶-3/7检测试剂盒(Promega,WI)在Synergy HT(BioTek Instrument Inc.,VT)分光荧光计中测量半胱天冬酶-3和半胱天冬酶-7活性的荧光信号。
RT-qPCR检测肝星状细胞中纤维化基因的表达:
通过RT-qPCR对以下纤维化基因的表达情况进行了定量:
1.胶原蛋白1α1(Col1α1);
2.α平滑肌肌动蛋白(αSMA);
3.β-PDGF受体(β-PDGFR);
4.转化生长因子-β受体1(TGFβ-R1);
5.金属蛋白酶组织抑制因子-1(TIMP1);
6.金属蛋白酶组织抑制因子-2(TIMP2);和
7.基质金属蛋白酶2(MMP2)。
激酶抑制剂索拉非尼(浓度为7.5μM)用作阳性对照并进行平行测定。在6孔平板中每孔接种150,000个LX-2细胞或200,000个phHSC细胞。将细胞在含有0.1%BSA(不含抗生素)的DMEM培养基中饥饿过夜。然后将细胞与指定浓度的AZD3355或者索拉非尼孵育一定的时间。收获细胞,并使用RNeasy Mini Kit(Qiagen,CA)提取总RNA。使用“RNA-cDNA EcoDry预混液(双引物)试剂盒”(Clontech,CA)将0.5μg总RNA用于逆转录。在LightCycler 480II(Roche Diagnostics Corporation,IN)仪器上,使用定制设计的引物(Sigma-Aldrich,MO)和iQ SYBR Green Supermix(Bio-Rad,CA)进行qPCR,测定纤维化基因的表达。测试了甘油醛-3-磷酸脱氢酶(GAPDH)、核糖体聚合酶II(RPII)、α-微管蛋白和β-肌动蛋白的基因,以确定最适合本研究的管家基因。在这四种管家基因中,GAPDH表达水平(Ct值)在AZD3355处理组中保持恒定,并被选作LX-2细胞和phHSC细胞中的管家基因。纤维化基因的表达相对于GAPDH进行标准化。
通过蛋白质印迹和细胞裂解液的光密度分析测定肝星状细胞中纤维化蛋白的表达:
平行进行蛋白质印迹和RT-qPCR实验。在6孔平板中每孔接种150,000个LX-2细胞或200,000个phHSC细胞。将细胞在含0.1%BSA(不含抗生素)的DMEM中饥饿过夜。然后将细胞与指定浓度的AZD3355或者索拉非尼孵育一定时间。收获细胞并使用RIPA缓冲液(50mMTris-HCl pH8.0,150mM NaCl,1%IGEPAL,0.5%脱氧胆酸钠和0.1%SDS)以及Pierce蛋白酶抑制剂微型片剂(无EDTA)(ThermoScientific,IL)进行裂解。通过使用蛋白质测定染料试剂浓缩物(Bio-Rad,CA)的Bradford比色测定法测定总蛋白。加载10μg蛋白质至NuPAGE4-12%Bis-Tris凝胶(ThermoScientific,IL)。将蛋白条带转移至PVDF膜后,将条带用含5%脱脂牛奶的1×PBS封闭。一抗用于探测相应的蛋白带,分别是兔抗Collagen1(Bioss,MA),兔抗MMP2(abcam,MA),兔抗αSMA(abcam,MA)和鼠抗GAPDH(Millipore,CA)。与HRP偶联的二抗(羊抗兔HRP(Jackson ImmunoResearch Laboratories,PA)或抗小鼠IgG-HRP(CellSignaling Technology,MA))杂交后,将膜用Immobilon Western化学发光HRP底物(Millipore,MA)处理,用Amersham Imager 6000(GE Healthcare,PA)捕获信号,用相应的抗体识别出210kD的Col1α1、72kD的MMP2和42kD的α-SMA条带,并探测到作为上样对照的37kD GAPDH条带。为了对蛋白条带进行光密度测量,将图像导出并使用ImageJ 1.50f软件进行分析,然后将各条带相对上样对照GAPDH进行归一化处理。
ELISA检测分泌的Col1α1蛋白:
收集来自蛋白质印迹试验方案的细胞培养基以评估培养基中分泌的胶原蛋白1α1。将收集的培养基以2,000×g离心10分钟以去除细胞碎片。将样品以1:1000的比例稀释到样品稀释缓冲液中,并根据制造商的方案使用人前胶原蛋白α1SimpleStep ELISA试剂盒(abcam,MA)测量分泌的胶原蛋白1α1。
免疫细胞化学法检测肝星状细胞中αSMA蛋白的表达:
通过免疫染色DAB技术测定在AZD3355小分子存在下LX-2细胞和phHSC细胞中αSMA的蛋白表达。激酶抑制剂索拉非尼(浓度为7.5μM)小分子用作阳性对照做平行处理。将100,000个LX-2细胞或80,000个phHSC细胞接种到玻璃盖玻片上。将细胞在含0.1%BSA(不含抗生素)的DMEM中饥饿过夜。然后将细胞与AZD3355或者索拉非尼小分子以指定的浓度和孵育一定时间。细胞用1×PBS彻底洗涤并固定在4%多聚甲醛中,用含0.5%Tween-20的1×PBS提高通透性,并在Dako过氧化物酶封闭液(0.03%H
实验数据分析:
每个实验至少重复三次。通过使用不同的科学和统计软件(GraphPad Prism,Excel等)来完成数据分析。根据Student t检验计算标准误差(±SE)。除非另有说明,否则将p值小于0.05视为具有统计学意义。
LX-2细胞和phHSC细胞均用AZD3355处理。前者用0-300nM处理24、48或72小时。后者用30nM或100nM处理48或72小时。除了在300nM处理的LX-2细胞中,没有观察到明显的细胞毒性。参见图1和2。在处理的LX-2细胞或phHSC细胞中,细胞增殖也没有显著变化。参见图3和图4。还通过测定半胱天冬酶-3/7的活性评估了AZD3355的凋亡作用。对于任何剂量的AZD3355,在LX-2细胞或phHSC细胞中AZD3355均无凋亡作用。参见图5和6。这些结果表明该药对细胞无毒,即不损害细胞,不引起细胞死亡或抑制细胞生长。
还使用qPCR评估了经AZD3355处理的LX-2和phHSC细胞中的基因表达情况。这些基因包括GADPH、RPII和微管蛋白。经AZD3355处理后,任一种细胞中GADPH的表达水平均未改变。参见图7和10。这些结果进一步表明该药物对细胞无毒。
还在经溶剂处理、经AZD3355或索拉非尼处理的两种细胞系中评估了促纤维化基因的基因表达。这些基因包括Col1α1,αSMA,βPDGF-R,TGFβ-R1,TIMP1,TIMP2和MMP2,在用AZD3355或索拉非尼处理48和72小时后,这些基因在LX-2细胞中下调。具体地,在图8和9中,图中的黑条表示下调。然后将细胞在不含药物的培养基中再维持48或72小时,即可挽救纤维化基因。参见图8和9,具体地,图中的灰色条显示了基因表达的挽救。另参见表2。
用AZD3355或索拉非尼处理phHSC细胞可获得相似的结果。经30nM的AZD3355处理48小时后,βPDGF-R、TGFβ-R1和TIMP1均被下调。参见图11。在处理72小时后,除TIMP1和TIMP2以外的所有促进纤维化基因均被显著下调。参见图12。另参见表3。
这些结果表明,经AZD3355处理降低了已知在肝脏中引起纤维化疾病的基因的表达。
还通过三个独立的蛋白质印迹实验评估了各种基因的蛋白质表达。测量了Col1α1、αSMA和MMP的表达。在用30nM或100nM的AZD3355或索拉非尼处理48小时或72小时后的LX2细胞中,Col1α1的蛋白表达没有变化。参见图13A和13B,图15A和15B。然而,如通过ELISA所测量的,在经处理细胞的培养基中分泌的Col1α1下降了。参见图13C和15C。
在用30nM或100nM的AZD3355或索拉非尼处理48小时和72小时后,测量了αSMA和MMP蛋白的表达。参见图14和16。另请参见表4。
phHSC细胞中Col1α1,αSMA和MMP蛋白的表达获得了相似的结果。在用AZD3355或索拉非尼处理48或72小时后的phHSC细胞中,Col1α1的蛋白表达没有变化。参见图17A、17B、19A和19B。然而,如通过ELISA所测量的,在用100nM AZD3355处理48小时后的细胞中,培养基中分泌的Col1α1减少了。参见图17C。
在用30nM或100nM的AZD3355或索拉非尼处理48小时和72小时后,测量了αSMA和MMP蛋白的表达。参见图18和20。另请参见表5。
对LX-2细胞和phHSC细胞中αSMA蛋白表达的免疫细胞化学分析显示,与溶剂对照相比,用AZD3355处理后的细胞中该蛋白的表达降低了。参见图21和22。
表2:AZD3355处理后LX-2细胞中促纤维化基因的mRNA表达
表3:AZD3355处理后phHSC细胞中促纤维化基因的mRNA表达
表4:AZD3355处理后LX-2细胞中促纤维化蛋白的表达
表5:AZD3355处理后phHSC细胞中促纤维化蛋白的表达
实施例2-AZD3355在治疗和预防包括NASH在内的肝脏病症或疾病中的用途,如肝切片试验所示
从Mount Sinai生物储存库中收集了十个人类肝脏碎片。通过使用8mm圆柱取芯工具对肝脏取芯来制备样品。将肝芯保存在补充有GlutaMAX的冰冷WE培养基中。然后用氰基丙烯酸酯粘合剂将肝芯固定在样品板上。将肝切片(厚度约200μm)在碳合气(carbogen)的存在下置于冰冷的Krebs-Henesleit缓冲液中。然后在湿润的摇臂室中,在95%O
然后肝切片在95%O
24小时后,收获组织切片用于RNA分离和定量PCR,以测定Col1α1、TNFα和IL-6表达,或如实施例3中所述,用于组织病理学和苏木精-伊红(H&E)染色。
组织病理学和H&E染色显示,在AZD3355或索拉非尼处理过程中,肝细胞活力没有改变。参见图23。
qPCR显示,在十个样品的大多数中,至少一个促纤维化基因在AZD3355中培养24小时后被下调。参见图24和25,以及表6。在许多情况下,下调幅度显著。参见图24C、24G、24H、24J、24M、24N、24P、24R、24S、24U、25D、25E、25H和25I。
表6:AZD3355处理后肝切片中促纤维化基因的表达
实施例3-AZD3355在治疗和预防包括NASH在内的肝脏病症或疾病中的用途,如NASH小鼠模型体内试验所示
动物:
实验方案由纽约Mount Sinai伊坎医学院的机构动物护理和使用委员会(IACUC)审查和批准。雄性和雌性C57BL/6J小鼠(年龄:6周;体重:20-25g)购自Jackson实验室(Farmington,CT)。在纽约州Mount Sinai伊坎医学院,将动物圈养在12小时光照-12个小时黑暗周期的动物实验设施中,并按照实验动物护理和使用的指引进行处理。雄性和雌性小鼠分别关在笼子里。
四氯化碳、西方饮食和糖水:
四氯化碳(CCl
含有21.2%脂肪(42%Kcal),41%蔗糖和1.25%胆固醇(按重量计)的西方饮食购于威斯康星州Envigo(Teklad Custom Diet Cat#TD.120528)。含18.9g/L D-(+)-葡萄糖(Sigma-Aldrich,MO)和23.1g/L D-(-)-F-果糖(Sigma-Aldrich,MO)的糖水溶液溶于普通水中并过滤除菌。在每个笼子中每周更换西方饮食和糖水两次,以避免微生物污染。在更换食物和水的过程中,我们已经测量了食物和水的摄入量,并收集了数据。
AZD3355和OCA小分子和甲基纤维素:
AZD3355小分子(FW 141.08)由阿斯利康(AstraZeneca)提供,而溶剂甲基纤维素(Meth.cel,4,000cP)购自密苏里州Sigma-Aldrich。阳性对照药物奥贝胆酸(OCA;FW420.63)购自ApexBio(Houston,TX)。使用超纯水制备0.5%的甲基纤维素,并在整个实验过程中保持在4℃以下。在每次灌胃和丢弃未使用的稀释药物之前,用0.5%的甲基纤维素配制成两种不同浓度的AZD3355溶液(10mg/ml和30mg/ml(w/v))。每周还新鲜配制浓度为30mg/kg的OCA,分装并保存在-20℃的冰箱中。每天取一等份,并丢弃未使用的已稀释的OCA。
无处理(No Tx)-12周组:
在第13周开始时,将小鼠分为五个不同的组。处死无处理12周组的小鼠,并收集血样(通过IVC)用于血清制备。切下动物的全肝,在1×PBS中清洗,记录重量并拍照。通过肉眼检查肝脏以确定纤维化/肿瘤的进展程度,并记录数据。切除脾脏并记录重量。将肝和血清样品保存在-80℃作进一步分析。
0.5%甲基纤维素,AZD3355,OCA剂量和无处理对照-24周组:
在余下12周(第13周至第24周)中,四组小鼠分别通过口服途径给予0.5%甲基纤维素(作为溶剂),10mg/kg小鼠体重(低剂量)AZD3355或30mg/kg小鼠体重(高剂量)AZD3355(每天2次(BID),每周5天)以及30mg/kg小鼠体重的OCA(每天一次(QD),每周5天)小鼠12周。最后一组小鼠未接受任何药物或溶剂处理,作为无处理-24周组,并且与处理/溶剂组保持平行。通常,所有剂量在清晨给与,在晚上给与AZD3355第二次日剂量(间隔10小时)。密切监测所有动物的健康状况和行为。
AZD3355或OCA小分子和溶剂处理组的结束:
在溶剂组(0.5%甲基纤维素)、AZD3355 10mg/kg剂量组、AZD3355 30mg/kg剂量组、OCA 30mg/kg剂量组和无处理对照-24周组中的雄性和雌性小鼠在第24周结束时处死。收集血样(通过IVC)进行血清制备。切下动物的全肝,在1×PBS中清洗,记录重量并拍照。肉眼检查肝脏以确定纤维化/肿瘤的进展程度,并记录数据。切除脾脏并记录重量。将肝和血清样品保存在-80℃作进一步分析。
血清制备:收集的血液样品在室温下放置30分钟以凝结。将血样在4℃条件下以2000×g离心10分钟后收集血清,并在保存在-80℃留待分析。
肝酶和脂类分析:
按照制造商的指示,在Mount Sinai临床化学实验室采用ARCHITECT c16000临床化学分析仪(Abbott Diagnostics,MA)分析血清中的天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、胆固醇和甘油三酯。
肝组织的组织病理学分析:
将一块大肝叶组织固定在石蜡包埋的10%福尔马林缓冲液(Astral DiagnosticsIncorporated NJ)中,并用切片机切片。将含有组织切片的载玻片在60℃下烘烤1小时,然后先用二甲苯进行再水化(re-hydrate),再将梯度乙醇(100%、95%、85%和70%)加到蒸馏水中,并用天狼猩红/固绿进行染色液或者用苏木精-伊红进行染色。
天狼猩红/固绿染色和胶原蛋白的形态测定:
对于胶原蛋白染色,将再水化的载玻片在含有0.1%天狼星红(Direct Red-80;Sigma-Aldrich,MO)的饱和苦味酸中染色1小时,然后用0.01%固绿染色液(Sigma-Aldrich,MO)复染一小时。载玻片去除染色剂,在水中冲洗,并通过梯度乙醇(70%,85%,95%和100%)快速脱水,然后再通过二甲苯进行脱水,最后用中性树脂片Permount(ThermoFisher Scientific,NJ:Cat#SP15-500)封片。在Aperio AT2数字扫描仪(LeicaBiosystems Inc.,IL)中将具有染色切片的整个载玻片进行数字化扫描。每个扫描切片的图像在Aperio ImageScope[v12.4.0.5043](Leica Biosystems Inc.,IL)组织病理学诊断软件中随机保存为5倍缩放级别(每个切片3张图像)。对每只动物的总共6个切片进行了染色,并使用BIOQUANT图像分析软件(Bioquant Image Analysis Corporation,TN)对每个切片的3张图像(总共18张图像/动物)进行了评估,以量化肝脏组织中胶原蛋白的积累。
苏木精-伊红(H&E)染色:
按标准方案对每只动物的总共2个切片进行了H&E染色。
肝切片的组织病理学评分:
根据NASH临床研究网络(NASH CRN)评分系统,由Mount Sinai伊坎医学院的肝脏病理学专家以盲评的方式对天狼星红/固绿染色切片以及H&E染色肝切片的脂肪变性、肝细胞气球样变、小叶内炎症、汇管区炎症和纤维化进行评分。根据Brunt标准计算NAFLD活性评分(NAS),分数范围为0-8。NAS评分由脂肪变性(0-3),肝细胞气球样变(0-2)和小叶内炎症分数(0-3)的总和来计算。NAS评分>5.0与“确定性NASH”密切相关,而<3与“非NASH”相关。纤维化(0-4)或汇管区炎症(0-3)分数是分别评估的,不包括在NAS中。
通过RT-qPCR检测肝组织中纤维化基因的表达:
评估以下纤维化基因的mRNA表达:
1.胶原蛋白1α1(Col1α1);
2.α平滑肌肌动蛋白(αSMA);
3.β型血小板衍生生长因子-受体(βPDGF-R);
4.转化生长因子β-受体1(TGFβ-R1);
5.金属蛋白酶组织抑制因子-1(TIMP-1);
6.金属蛋白酶组织抑制因子-2(TIMP-2);和
7.基质金属蛋白酶-2(MMP-2)。
使用RNeasy微型试剂盒(Qiagen,CA)从大约30mg的肝组织中提取总RNA。使用“RNA-cDNA EcoDry预混液(双引物)试剂盒”(Clontech,CA)将1μg总RNA用于逆转录。在LightCycler 480II(Roche Diagnostics Corporation,IN)仪器上,使用定制设计的引物(Sigma-Aldrich,MO)和iQ SYBR Green Supermix(Bio-Rad,CA),通过qPCR检测纤维化基因的表达。使用甘油醛-3-磷酸脱氢酶(GAPDH)作为管家基因,以确定纤维化基因的相对表达。
蛋白质印迹和光密度分析法分析肝组织中纤维化蛋白的表达:
评估以下纤维化蛋白的表达:
1.胶原蛋白1α1(Col1α1)
2.α平滑肌肌动蛋白(αSMA)
使用RIPA缓冲液(50mM Tris-HCl pH8.0、150mM NaCl、1%IGEPAL、0.5%脱氧胆酸钠和0.1%SDS)以及Pierce蛋白酶抑制剂微型片剂(无EDTA)(Thermo Scientific,IL)和磷酸酶抑制剂Cocktail(Thermo Scientific,IL)从大约30mg肝组织中提取总蛋白。在存在1个5mm不锈钢微珠(Qiagen,Germantown,MD)的情况下,使用TissueLyser LT匀浆器(Qiagen,Germantown,MD)以50Hz/秒的速度将裂解物匀浆2分钟。以14000rpm离心10分钟后,从匀浆(中间水相)中收集总蛋白。使用蛋白定量染料浓缩液(Bio-Rad,CA)通过Bradford比色测定法测定总蛋白质。将15μg蛋白质上样至NuPAGE 4-12%Bis-Tris凝胶(Thermo Scientific,IL)中。将蛋白条带转移到PVDF膜后,并用含5%脱脂牛奶的1×PBS封闭条带。用于探测相应蛋白条带的一抗是兔抗胶原蛋白1(Bioss,MA)和兔抗αSMA(abcam,MA)和鼠抗GAPDH(Millipore,CA)。与HRP偶联的二抗(山羊抗兔HRP(JacksonImmunoResearch Laboratories,PA)或抗小鼠IgG-HRP(Cell Signaling Technology,MA))杂交后,将膜用Immobilon Western化学发光HRP底物(Millipore,MA)处理,并使用Amersham Imager 6000(GE Healthcare,PA)捕获信号。通过相应的抗体清楚地识别出210kD的胶原蛋白1α1带和42kD的αSMA带。探测到GAPDH的37kD条带作为上样对照。为了对蛋白条带进行光密度测量,将图像导出并使用ImageJ 1.50f软件进行分析,然后将各条带相对上样对照GAPDH进行归一化处理。
统计数据分析:
数据分析是通过使用GraphPad Prism v7.4统计软件(GraphPad Software,Inc.,CA)完成的。根据Student t检验或者高斯分布为非参数的非配对两尾Mann-Whitney检验计算标准误均值(±SEM)。除非另有说明,否则将p值<0.05视为具有统计学意义(相对于溶剂组,*=p<0.05)。
在整个12周的处理过程中,对每组NASH模型小鼠进行称重。在使用AZD3355处理期间,所有小鼠的体重均稳定,表明该药物没有毒性作用(图27)。与两组中用溶剂处理的小鼠相比,用30mg/kg AZD3355处理的雄性和雌性NASH模型小鼠的体重均显著降低。在处理第二周观察到雄性小鼠体重下降(参见图27A,*=p<0.05),而在处理第三周观察到雌性小鼠体重下降(参见图27B,*=p<0.05)。
在第12周和第24周,还对未处理、经溶剂处理、经AZD3355处理和OCA处理的每组小鼠评估了NASH模型小鼠中的肿瘤进展。在雄性和雌性NASH模型小鼠中,以任何剂量AZD3355或以OCA进行处理均可减少肝脏中的肿瘤进展(图28)。
另外,经两种剂量AZD3355处理的雄性和雌性NASH模型小鼠中,肝重、肝重/体重比和脾重均得到改善。参见图29-32。
无论是雄性还是雌性,NASH小鼠在NASH诱导第24周时的肝酶均高于第12周。这些酶包括丙氨酸转氨酶(SGPT)和天冬氨酸转氨酶(SGOT)。与第12周相比,NASH小鼠在第24周时的总胆固醇和甘油三酸酯也升高了。参见图33。用AZD3355或OCA处理12周改善了雄性和雌性NASH模型小鼠的坏死性炎症活性。参见图34。
与第12周相比,NASH小鼠在NASH诱导第24周时还表现出纤维化基因表达的上调。上调的基因包括Col1α1、αSMA、βPDGF-R、TGFβ-R1、TIMP1、TIMP2和MMP2。参见图36和38。经两种剂量AZD3355和OCA处理均降低了促纤维化基因的表达。参见图38和40。也参见表7。与溶剂处理的小鼠相比,在AZD335或OCA处理组中,GADPH的表达(对照)没有变化。参见图35。
与第12周相比,NASH小鼠在第24周时肝脏中促纤维化蛋白的表达也上调。参见图40和图41。经AZD3355或OCA处理后,雄性NASH小鼠(图43和44和表8)和雌性NASH小鼠(图44和45和表9)中Col1α1和αSMA的蛋白表达均降低。
将NASH模型小鼠的肝脏用天狼猩红/固绿染色以检查纤维化程度,从而确定肝损伤和胶原蛋白沉积的情况。与第12周相比,在第24周时,雄性NASH模型小鼠和雌性NASH模型小鼠的纤维化均明显增加。参见图46。在雄性NASH小鼠(图47)和雌性NASH小鼠(图48)中,用AZD3355和OCA处理均可降低总纤维化和肝胶原蛋白的积累。雄性小鼠的减少呈现剂量依赖性。另请参见表10。
对NASH小鼠的肝脏进行脂肪变性、肝细胞气球样变和小叶内炎症评估,并将分数总和用于计算NAFLD活性评分(NAS)。NASH小鼠在第12周时的NAS表示模型小鼠已达到NASH,并维持至24周。参见图49。用AZD3355或OCA处理表明NASH模型小鼠的NAFLD活性降低。参见图50。
汇管区炎症的组织病理学评分用于评估NASH小鼠在12和24周时的肝纤维化阶段和脂肪性肝炎。与第12周相比,第24周的纤维化增加,表明在NASH模型小鼠中,无论是雄性还是雌性,肝脏均严重损伤。参见图51。用AZD3355或OCA处理表明,雄性和雌性NASH模型小鼠的纤维化和脂肪性肝炎均减少。参见图52和表11。
表7:AZD3355处理后NASH模型小鼠中促纤维化基因的表达
表8:AZD3355或OCA处理后雄性NASH模型小鼠中促纤维化蛋白的表达
表9:AZD3355或OCA处理后雌性NASH模型小鼠中促纤维化蛋白的表达
表10:AZD3355或OCA处理后NASH模型小鼠中肝胶原蛋白的积累
表11:经溶剂、AZD3355或OCA处理后,NASH模型小鼠肝脏的NAS和纤维化阶段
Ascha et al.(2010)Hepatology 51(6):1972–1978
Ahrens,et al.(2013)DNA methylation analysis in nonalcoholic fattyliver disease suggests distinct disease-specific and remodeling signaturesafter bariatric surgery.Cell Metab.2013;18(2):296-302.
Alstermark,et al.(2008).“Synthesis and Pharmacological Evaluation ofNovelγ-Aminobutyric Acid Type B(GABAB)Receptor Agonists as GastroesophagealReflux Inhibitors”.Journal of Medicinal Chemistry 51(14):4315-4320.
Bettler,et al.(2004)Physiol Rev.84(3):835-67.
Bredenoord(2009).“Lesogaberan,a GABA
Dodds,et al.(1982)N Engl J Med.307(25):1547-52.
Fan,et al.,(2013)γ-Aminobutyric Acid B Receptor Improves CarbonTetrachloride-Induced Liver Fibrosis in Rats."Digestive diseases and sciences58.7:1909-1915.
Hudgson and Weightman(1971)Baclofen in the treatment of spasticity.BrMed J.4(5778):15-7.
Lacy,et al.(2010).“Lesogaberan”.Drugs of the Future 35(12):987-992.
Lamb,et al.(2006)The Connectivity Map:using gene-expressionsignatures to connect small molecules,genes,and disease.Science 313(5795):1929-35.
Lee,et al.(2105)Pathobiology of liver fibrosis:a translationalsuccess story.Gut 64.5(2015):830-841.
Liu,et al.(2011).Upregulation of hemoglobin expression by oxidativestress in hepatocytes and its implication in nonalcoholicsteatohepatitis.PLoS One,6(9),p.e24363.
Marengo,et al.(2015)Liver Cancer:Connections with Obesity,FattyLiver,and Cirrhosis.Annu Rev Med.doi:10.1146/annurev-med-090514-013832.PubMedPMID:26473416.
Wang,et al.,(2008)Baclofen,a GABAB receptor agonist,inhibits humanhepatocellular carcinoma cell growth in vitro and in vivo.Life sciences 82.9:536-541.
本文所引用的所有参考文献均通过引用并入本文,如同每个单独的出版物、数据库(例如Genbank序列或GeneID条目)、专利申请或专利明确且单独地通过引用并入本文。根据37C.F.R.§1.57(b)(1),本参考文献并入声明是申请人旨在涉及每个单独的出版物、数据库(例如Genbank序列或GeneID条目)、专利申请或专利,其中每一项均按照37C.F.R.§1.57(b)(2)进行了明确标识,即使这种引用与通过引用并入的专用声明并不接近。如果说明书中包含通过引用并入的专用声明,也不会以任何方式削弱该通过引用并入的一般性声明。引用本文的参考文献并不意味着承认该参考文献是相关的现有技术,也不构成对这些出版物或文献的内容或日期的任何承认。
本发明不限于本文所述的具体实施方案的范围。实际上,除了本文描述的那些之外,根据前述描述和附图,本发明的各种修改对于本领域技术人员是显而易见的。这样的修改旨在落入所附权利要求的范围内。
上述书面说明足以使本领域技术人员能够实施本发明。根据前面的描述,除了本文中示出和描述的之外,本发明的各种修改对于本领域技术人员而言是显而易见的,并且落入所附权利要求的范围内。
如本领域技术人员将显而易见的,可以在不脱离本发明的精神和范围的情况下对本发明进行各种修改和变型。本发明由所附权利要求书的术语以及这些术语的等同物的全部范围来限定。本文描述的具体实施方式,包括实施例,仅以实施例的方式提供,并不以其具体内容限制本发明的范围。
- AZD3355(Lesogaberan)用于治疗和预防非酒精性脂肪性肝炎(NASH)、肝纤维化及其他肝脏病症
- 用于治疗非酒精性脂肪性肝炎(NASH)的方法的修饰的成纤维细胞生长因子21(FGF-21)
