一种复合后生元固体饮料及其制备方法
文献发布时间:2023-06-19 13:30:50
技术领域
本发明涉及饮料加工技术领域,特别是指一种复合后生元固体饮料及其制备方法。
背景技术
后生元(Postbiotics)是在益生菌发酵过程中于发酵基质产生,是许多不同生物活性成分的总称,包括短链脂肪酸、酶、多肽、内源或外源性聚糖、细胞图面蛋白、有机酸等,其益生功能包括但不限于抗菌、抗氧化、调节肠道屏障功能和免疫反应等。
在申请号为“CN202110225550.3”的专利文件中,提出了一种功能型复合益生菌固体饮料,功能型复合益生菌固体饮料是由蓝莓果粉、辅料、后生元固体粉末、甜味剂和酸味剂组成;辅料包括β-环糊精、麦芽糊精和可溶性淀粉;后生元固体粉末包括双歧杆菌和鼠李糖乳杆菌的裂解提取物及代谢产物等;甜味剂包括山梨糖醇、麦芽糖醇和异麦芽低聚糖;酸味剂包括苹果酸和柠檬酸。其相对于传统的益生菌固体饮料加工过程中活菌损失少,并能够更长、更稳定地保存,但不具备修复肠道屏障、降脂等作用。
发明内容
本发明的一种目的:提供了一种复合后生元固体饮料,除了克服市场上传统益生菌固体饮料加工过程中活菌损失严重、需要经过定植作用发挥功能的弊端,还具有明显的肠道屏障修复、降血脂、改善肝损伤等作用。
本发明的技术方案:一种复合后生元固体饮料,由莱菔硫烷、丁酸钠、后生元固体粉末、粘合剂、甜味剂和酸味剂成分组成;以后生元固体饮料的总质量计,上述各组分的质量含量如下:莱菔硫烷15%-20%,丁酸钠20-25%,后生元固体粉末25%-30%,粘合剂18-22%,甜味剂4.5-6.0%,酸味剂3.5-6.0%;所述的后生元固体粉末包括副干酪乳杆菌G15和Q14粉末、鼠李糖乳杆菌粉末及双歧杆菌粉末,上述的四种杆菌粉末为各自杆菌的上清液干燥后得到的。
优选的,后生元固体粉末中各组分的重量份如下:副干酪乳杆菌G15和Q14粉末各5~15份,鼠李糖乳杆菌粉末5~15份,双歧杆菌粉末5~15份。
优选的,该后生元固体饮料的水分含量≤5%,水分活度在0.15-0.175。
本发明的有益效果:
双歧杆菌(Bifidobacterium),对人体健康具有生物屏障、营养作用、抗肿瘤作用、免疫增强作用、改善胃肠道功能、抗衰老等多种重要的生理功能。
鼠李糖乳杆菌(Lactobacillus rhamnosus,LGG),不仅可以肠道菌群,修复肠道屏障,还可以抑制LPS介导的巨噬细胞炎症反应,从而促进肝细胞代谢及再生;同时LGG可以激活肝脏AMP依赖的蛋白激酶和肝受体α的转录,抑制甾醇调节元件结合蛋白及其下游脂肪酸合成相关基因FAS和ACC的转录,进而抑制脂肪酸的合成。
副干酪乳杆菌(Lactobacillus paracasei subsp paracasei) G15和副干酪乳杆菌(Lactobacillus casei) Q14能改善大鼠的肠道菌群紊乱,增加乙酸产生菌(乳酸菌、双歧杆菌)和丁酸产生菌(柔嫩梭菌、普利沃菌)的含量,并增加短链脂肪酸(short chainfatty acid,SCFA)乙酸和丁酸的含量;并上调肠道紧密连接蛋白图达,改善粘膜通透性,从而减少有害菌及其代谢产物易位至肝脏,改善肝脏炎症;同时G15和Q14能显著促进胰岛素分泌,改善葡萄糖耐量,起到降脂降糖作用。
莱菔硫烷(sulforaphane,SFN),是一种存在于十字花科蔬菜中的有机硫化合物,生物利用度明显高于其他膳食补充剂。能通过抑制过度的内质网应激,增强线粒体功能,增强脂肪细胞的葡萄糖摄取、脂解和脂肪酸氧化能力,并促进GLUT4向肌肉质膜转位,有效改善胰岛素抵抗,明显改善代谢负荷,从而起到降脂降糖作用;同时SFN通过增加肠道中丁酸盐水平,上调紧密连接蛋白和胰高血糖素样肽2(GLP2)的图达使肠道微生物群的组成正常化,保护肠道屏障。
丁酸钠(sodium butyrate,NaB)是丁酸的可溶性钠盐,属于SCFA,由肠道菌发酵膳食纤维而产生。NaB可以促进饥饿因子的图达, 进而降低脂蛋白脂肪酶的活性, 使脂肪细胞中甘油三酯聚集减少,具有改善糖脂代谢、减肥、抗炎、抗氧化、防治肿瘤等有益作用。本团队研究证实丁酸钠可以有效修复自身免疫性肝炎小鼠肠道屏障,从而保护肝损伤。另外,临床研究也证明,富含丁酸的食物能改善人体糖脂代谢。
通过采用上述方案,制成的后生元固体饮料相对于现有技术来说,有较高的安全性、不需要通过活菌的定植作用,
而在医疗中,将莱菔硫烷、丁酸钠及后生元中副干酪乳杆菌G15和Q14粉末,同时用在后生元固体饮料中并应用于人体上,被人体吸收且能发挥相应效果,在目前的医疗技术手段中没有得到相应论证,申请人的通过精确实验验证,本技术方案所制得的后生元固体饮料在维持肠道菌群平衡、治疗肠道紊乱、提高机体免疫功能的同时,还具有调节肥胖、改善肝损伤等功能,能够更加直接、快速地进入人体发挥功效。
后生元固体饮料10.0g,各组份重量如下:莱菔硫烷2.0g,丁酸钠2.0g,粘合剂2.0g,后生元固体粉末3.0g,甜味剂0.5g,酸味剂0.5g,为最佳组分比例,经反复实验所得。
本发明的另一种目的:提供了一种复合后生元固体饮料的制备方法,制备步骤简单、成品效果好。
本发明的技术方案:一种复合后生元固体饮料的制备方法,包括以下步骤:
S1、分别选取经甘油管冻藏的副干酪乳杆菌G15和Q14、鼠李糖乳杆菌和双歧杆菌的单菌株,将各杆菌的单菌株纯化后在对应的发酵罐中高密度培养,活菌数>109CFU/m,然后离心获得菌种并在4-8℃下进行冷藏,得到四种冻菌液备用;
S2、将四种冻菌液各自进行解冻培养并将菌落接种, 具体操作为:将S1冷藏的冻菌液取出并在无菌环境、且温度为18-21℃条件下解冻,以接种环蘸取少量的解冻菌液并在MRS固体平板上划线,后置于37℃培养箱内,在150-160 rpm下培养48-50h,然后挑取单菌落接种于250 mL MRS液体培养基中进行原代培养,培养基pH为 6.0-7.0,并置于37-40℃的培养箱内,在160 rpm下培养18-20h,然后以1.5 %(v/v)的接种量扩增培养24-30h,在4000rpm、4℃条件下离心15min后收集菌体,再将菌体挑取单菌落接种于新的250 mL MRS液体培养基中进行传代培养,培养条件与原代培养的条件相同,经多次传代培养后,在600nm-8 log10 CFU/mL光密度:~0.1)下测量菌体的吸光度,将0D值为0.1-0.4的菌体在-18℃下保存,得到活菌数超过109CFU/m的四种培养物;
S3、将四种培养物各自进行离心过滤,具体操作为:将S2保存的培养物取出并在无菌环境、且温度为18-21℃条件下解冻,将解冻培养物培养8-12h后,在1700g、4℃条件下离心15-20min,然后通过0.22μm的过滤器进行超滤,后在100-120℃条件下加热40-50min对其热杀菌,并间隔10-15min搅拌一次,然后将热杀菌后的培养物在1min/r、50W条件下进行超声处理,在13000g、4℃条件下离心40-50min,得到四种浓缩无细胞上清液;
S4、将四种浓缩无细胞上清液各自进行喷雾干燥, 具体操作为:将S3得到的浓缩无细胞上清液置于喷雾干燥机中,在进风温度为160℃、出风温度为90℃、产品进料温度为60℃、产品进料速度为14L/h的条件下进行喷雾干燥,制得副干酪乳杆菌G15和Q14粉末、鼠李糖乳杆菌粉末及双歧杆菌粉末,将制得的四种固体粉末按每份5~15份的重量份混合,得到后生元固体粉末;
S5、在无菌环境,且温度为4-8℃、水分活度为0.1-0.175条件下,将粘合剂与后生元固体粉末进行混料,再逐步添加莱菔硫烷、丁酸钠、酸味剂、甜味剂进行混料,混料转速为60r/min,混料时长为20-30min,上述各组分的质量含量如下:莱菔硫烷15%-20%,丁酸钠20-25%,后生元固体粉末25%-30%,粘合剂18-22%,甜味剂4.5-6.0%,酸味剂3.5-6.0%,混合料过70目筛网,测得混合料的水分含量≤5%、水分活度在0.1-0.175后,得到复合后生元固体饮料。
本发明的有益效果:
通过步骤S1制得冻菌液,其中杆菌的单菌株纯化培养、且培养的活菌数>109CFU/m,使得在发酵罐中的扩培效果好;在4-8℃下冷藏离心菌种,以有效保持菌种活性;
通过步骤S2制得培养物,冻菌液解冻后、在150-160 rpm下培养48-50h,将刚复苏的菌体低速摇菌,避免破坏菌落;以1.5 %(v/v)的接种量扩增培养24-30h,菌体培养时间适宜,避免导致菌体浓度过低或因过度生长而突变;在4000rpm、4℃条件下离心15min后收集菌体以有效分离菌体与培养基;多次离心培养,取0D值在0.1-0.4之间的菌体,此时菌体的纯度高且活菌数超过109CFU/m,得到的是符合标准的单一菌落的培养物;
通过步骤S3制得浓缩无细胞上清液,培养物解冻后、培养8-12h,可以产生足够量上清液,来进行离心分离;
通过步骤S4制得固体粉末,将四种浓缩无细胞上清液各自进行喷雾干燥制备成固体粉末,便于产品长期保存,并进行包装、运输及携带,将四种固体粉末按每份5~15份的重量份混合,各成分配比合适,制得降脂效果好的后生元固体粉末;
通过步骤S5制得复合后生元固体饮料,将重量份多的粘合剂与后生元固体粉末先进行混料,再逐步添加小份量的莱菔硫烷、丁酸钠、酸味剂、甜味剂进行混料,混料效果好;混合料过70目筛网以去除大的杂质或颗粒,使最终产品粗细度均匀,便于饮料被人体吸收;混合料的水分含量≤5%、水分活度在0.1-0.175,严格控制的水分含量和水分活度能保持后生元产品的正确结构、稳定性和活性。
附图说明
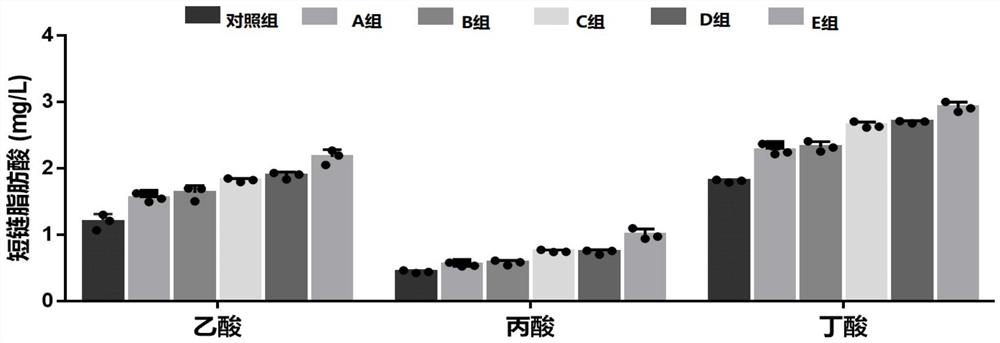
图1为具体实施例1中各后生元液对短链脂肪酸含量影响的对比图;
图2为具体实施例2中各组实验小鼠的血清转氨酶水平对比图;
图3为具体实施例2中各组实验小鼠的血清甘油三酯含量对比图;
图4为具体实施例3中各组实验小鼠的血清转氨酶水平对比图;
图5为具体实施例3中各组实验小鼠的血清甘油三酯水平对比图;
图6为具体实施例3中经复合后生元固体饮料F组的后生元产品治疗后小鼠肝脏H&E染色和油红O染色图;
图7为具体实施例3中经复合后生元固体饮料F组的后生元产品治疗后小鼠肠道H&E染色图;
图8为具体实施例3中各组实验小鼠肝脏炎症指标mRNA水平对比图。
具体实施方式
下面将结合具体实施例对本发明的技术方案作进一步地说明。
实施例1
后生元液制备实施例
不同成分的后生元液配比,采用以下组的原料杆菌
对照组,取原料:鼠李糖乳杆菌5份,双歧杆菌5份。
后生元液A组,取原料:副干酪乳杆菌G15 15份,鼠李糖乳杆菌5份,双歧杆菌5份。
后生元液B组,取原料:副干酪乳杆菌Q14 15份,鼠李糖乳杆菌5份,双歧杆菌5份。
后生元液C组,取原料:副干酪乳杆菌G15 15份,副干酪乳杆菌Q14 5份,鼠李糖乳杆菌5份,双歧杆菌5份。
后生元液D组,取原料:副干酪乳杆菌G15 5份,副干酪乳杆菌Q14 15份,鼠李糖乳杆菌5份,双歧杆菌5份。
后生元液E组,取原料:副干酪乳杆菌G15 8份,副干酪乳杆菌Q14 8份,鼠李糖乳杆菌5份,双歧杆菌5份。
上述不同成分组后生元液的制备方法如下:
S1、菌种的提取以及低温冷藏: 分别选取经甘油管冻藏的各原料杆菌的单菌株,将杆菌的单菌株纯化后在对应的发酵罐中高密度培养,活菌数>109CFU/m,然后离心获得菌种并在4-8℃下进行冷藏,得到冻菌液备用;
S2、菌种的培养及标准化:分别将S1冷藏的冻菌液取出并在无菌环境、且温度为18-21℃条件下解冻,以接种环蘸取少量的解冻菌液并在MRS固体平板上划线,后置于37℃培养箱内,在150-160 rpm下培养48-50h,然后挑取单菌落接种于250 mL MRS液体培养基中进行原代培养,培养基pH为 6.0-7.0,并置于37-40℃的培养箱内,在160 rpm下培养18-20h,然后以1.5 %(v/v)的接种量扩增培养24-30h,在4000rpm、4℃条件下离心15min后收集菌体,再将菌体挑取单菌落接种于新的250 mL MRS液体培养基中进行传代培养,培养条件与原代培养的条件相同,经多次传代培养后,在600nm-8log10CFU/mL (光密度:~0.1)下测量菌体的吸光度,将0D值为0.1-0.4的菌体在-18℃下保存,得到活菌数超过109CFU/m的培养物;
S3、后生元液的制备:分别将S2保存的培养物取出并在无菌环境、且温度为18-21℃条件下解冻,将解冻培养物培养8-12h后,在1700g、4℃条件下离心15-20min,然后通过0.22μm的过滤器进行超滤,后在100-120℃条件下加热40-50min对其热杀菌,并间隔10-15min搅拌一次,然后将热杀菌后的培养物在1min/r、50W条件下进行超声处理,在13000g、4℃条件下离心40-50min,得到浓缩无细胞上清液,分别将不同原料杆菌的上清液按比例混合制得后生元液。
采用上述制备方法,得到1组对照组的后生元液以及5组实验组的后生元液,并利用气相色谱法检测上述不同成分的6组后生元液,对短链脂肪酸含量的影响。
检测结果如图1所示,有副干酪乳杆菌G15和Q14加入的后生元液,对应的短链脂肪酸均明显升高,尤其以丁酸的含量升高最为明显;同时进一步比较副干酪乳杆菌G15和Q14不同重量份比的后生元液,对应短链脂肪酸的改变情况,发现当副干酪乳杆菌G15和Q15重量份比相当,同为8份(后生元液E组)时,后生元液所对应的短链脂肪酸含量最高,相应的降脂效果最好。
实施例2
2后生元液联合丁酸钠、莱菔硫烷组的病理实验
将36只10周龄的健康雄性C57BL/6小鼠随机均分为以下6组。
对照组(Ctrl):
小鼠普通饲料喂养至第12周。从第12周起,灌胃灭菌生理盐水1.0ml,隔天1次,喂养至16周。
模型组(NAFL):
小鼠高脂饲料喂养至第12周造成NAFL模型。从第12周起,灌胃灭菌生理盐水1.0ml,隔天1次,喂养至16周。
后生元治疗组(Postiotics):
小鼠高脂饲料喂养至第12周。从第12周开始,在高脂饮食的基础上加入后生元治疗,每只小鼠的灌胃量为1.0ml,隔天1次,喂养至16周。
后生元联合丁酸钠治疗组(Postiotics+NaB):
小鼠高脂饲料喂养至第12周。从第12周开始,在高脂饮食的基础上,予以溶有300mg/kg.BW的NaB的后生元液1ml治疗(如以小鼠25g体重计,每只小鼠需灌胃含7.5mg NaB的后生元混合液1.0ml,灌胃时根据小鼠实际体重调整NaB质量),隔天1次,喂养至16周。
后生元联合莱菔硫烷治疗组(Postiotics+SFN):
小鼠高脂饲料喂养至第12周。从第12周开始,在高脂饮食的基础上,予以溶有40mg/kg.BW的SFN 的后生元液1ml治疗(如以小鼠25g体重计,每只小鼠需灌胃含1mg的SFN的后生元液体1.0ml,灌胃时根据小鼠实际体重调整SFN质量),隔天1次,喂养至16周。
后生元联合丁酸钠、莱菔硫烷治疗组(Postiotics+NaB+SFN):
小鼠高脂饲料喂养至第12周。从第12周开始,在高脂饮食的基础上,予以溶有300mg/kg.BW NaB和40mg/kg.BW SFN的后生元液体1ml治疗(如以小鼠25g体重计,每只小鼠需灌胃含7.5mg NaB和1mg SFN 的后生元混合液1.0ml,灌胃时根据小鼠实际体重调整NaB和SFN质量),隔天1次,喂养至16周。
分别检测上述各组小鼠的血清转氨酶水平和甘油三酯含量。
检测结果如图2和图3所示,NAFL组的小鼠血清转氨酶水平和甘油三酯含量,相对于Ctrl组明显升高,而经过治疗组治疗后,血清转氨酶和甘油三酯含量均有明显下降,相应的脂肪肝的肝损伤减轻,脂质沉积得到了改善,尤其以后生元联合丁酸钠和莱菔硫烷治疗组(Postiotics+NaB+SFN)的改善肝损伤和降脂效果最为明显。(注:ALT为丙氨酸转氨酶;AST为天冬氨酸转氨酶)。
实施例3
3.1复合后生元固体饮料的制备
每10.0g的复合后生元固体饮料,采用以下组的成分配比。
复合后生元固体饮料A组,取原料:莱菔硫烷1.5g,丁酸钠2.5g,粘合剂2.0g,后生元固体粉末3.0g,甜味剂0.5g,酸味剂0.5g。
复合后生元固体饮料B组,取原料:莱菔硫烷1.8g,丁酸钠2.5g,粘合剂2.0g,后生元固体粉末2.7g,甜味剂0.5g,酸味剂0.5g。
复合后生元固体饮料C组,取原料:莱菔硫烷1.8g,丁酸钠2.2g,粘合剂2.0g,后生元固体粉末3.0g,甜味剂0.5g,酸味剂0.5g。
复合后生元固体饮料D组,取原料:莱菔硫烷2.0g,丁酸钠2.5g,粘合剂2.0g,后生元固体粉末2.5g,甜味剂0.5g,酸味剂0.5g。
复合后生元固体饮料E组,取原料:莱菔硫烷2.0g,丁酸钠2.3g,粘合剂2.0g,后生元固体粉末2.7g,甜味剂0.5g,酸味剂0.5g。
复合后生元固体饮料F组,取原料:莱菔硫烷2.0g,丁酸钠2.0g,粘合剂2.0g,后生元固体粉末3.0g,甜味剂0.5g,酸味剂0.5g。
其中,后生元固体粉末选用:副干酪乳杆菌G15 8份,副干酪乳杆菌Q14 8份,鼠李糖乳杆菌5份,双歧杆菌5份;粘合剂选用麦芽糊精和可溶性淀粉;甜味剂选用山梨糖醇;酸味剂选用苹果酸和柠檬酸。
上述不同成分组的复合后生元固体饮料的制备方法如下:
S1、分别选取经甘油管冻藏的副干酪乳杆菌G15和Q14、鼠李糖乳杆菌和双歧杆菌的单菌株,将各杆菌的单菌株纯化后在对应的发酵罐中高密度培养,活菌数>109CFU/m,然后离心获得菌种并在4-8℃下进行冷藏,得到四种冻菌液备用;
S2、将四种冻菌液各自进行解冻培养并将菌落接种, 具体操作为:将S1冷藏的冻菌液取出并在无菌环境、且温度为18-21℃条件下解冻,以接种环蘸取少量的解冻菌液并在MRS固体平板上划线,后置于37℃培养箱内,在150-160 rpm下培养48-50h,然后挑取单菌落接种于250 mL MRS液体培养基中进行原代培养,培养基pH为 6.0-7.0,并置于37-40℃的培养箱内,在160 rpm下培养18-20h,然后以1.5 %(v/v)的接种量扩增培养24-30h,在4000rpm、4℃条件下离心15min后收集菌体,再将菌体挑取单菌落接种于新的250 mL MRS液体培养基中进行传代培养,培养条件与原代培养的条件相同,经多次传代培养后,在600nm-8log10CFU/mL (光密度:~0.1)下测量菌体的吸光度,将0D值为0.1-0.4的菌体在-18℃下保存,得到活菌数超过109CFU/m的四种培养物;
S3、将四种培养物各自进行离心过滤,具体操作为:将S2保存的培养物取出并在无菌环境、且温度为18-21℃条件下解冻,将解冻培养物培养8-12h后,在1700g、4℃条件下离心15-20min,然后通过0.22μm的过滤器进行超滤,后在100-120℃条件下加热40-50min对其热杀菌,并间隔10-15min搅拌一次,然后将热杀菌后的培养物在1min/r、50W条件下进行超声处理,在13000g、4℃条件下离心40-50min,得到四种浓缩无细胞上清液;
S4、将四种浓缩无细胞上清液各自进行喷雾干燥, 具体操作为:将S3得到的浓缩无细胞上清液置于喷雾干燥机中,在进风温度为160℃、出风温度为90℃、产品进料温度为60℃、产品进料速度为14L/h的条件下进行喷雾干燥,制得副干酪乳杆菌G15和Q14粉末、鼠李糖乳杆菌粉末及双歧杆菌粉末,将制得的四种固体粉末按比例混合,得到后生元固体粉末;
S5、在无菌环境,且温度为4-8℃、水分活度为0.1-0.175条件下,将粘合剂与后生元固体粉末进行混料,再逐步添加莱菔硫烷、丁酸钠、酸味剂、甜味剂进行混料,混料转速为60r/min,混料时长为20-30min,上述各组分按比例混合,混合料过70目筛网,测得混合料的水分含量≤5%、水分活度在0.15-0.17后,得到复合后生元固体饮料。
S6、使用粉末灌装机将大量后生元固体饮料分装成小包固体饮料(每包10.0g),无菌封装;贴上标签后,利用输送装置入库。
采用上述制备方法,得到6组复合后生元固体饮料。
复合后生元固体饮料A-F组的病理实验。
不同组的复合后生元产品治疗后小鼠血清转氨酶水平和甘油三酯含量。
将48只10周龄的健康雄性C57BL/6小鼠随机均分为8组,分别对应对照组、模型组以及上述复合后生元固体饮料A-F组。
其中,对照组和模型组的造模方式与上述“后生元液联合丁酸钠、莱菔硫烷组的病理实验”中的造模方式相同;
复合后生元固体饮料A-F组,即在高脂饮食的基础上予以溶有5mg/ml的后生元固体粉末的灭菌生理盐水1ml治疗(灌胃),隔天1次,喂养至16周,其余处理步骤与“后生元液组联合丁酸钠、莱菔硫烷组的病理实验”相同。
分别检测各组小鼠血清转氨酶水平和甘油三酯含量。
检测结果如图4、图5所示,经上述复合后生元固体饮料A-F组的后生元产品治疗后,小鼠血清ALT与AST水平较脂肪肝组均有明显降低,同时脂肪肝小鼠的血清甘油三酯含量也明显下降,其中以,后生元固体饮料F组的小鼠的转氨酶水平下降及降脂效果最为明显。
利用复合后生元固体饮料F组的后生元产品,治疗后小鼠的肝脏病理改变情况。
肝脏组织学结果如图6所示,显微镜下观察可见对照组小鼠肝脏组织结构完整,肝细胞索以小叶中央静脉为中心向周围放射状排列,肝细胞分界清楚,胞核位于中央;NAFL小鼠肝小叶正常结构破坏,肝索排列紊乱无规则,可见肝细胞点状坏死,汇管区大量炎性细胞浸润,肝细胞肿胀,胞质疏松,中央静脉周围分布少量嗜酸性变,大量大小不等的圆形空泡分布胞质内;
油红O染色可证明多数胞内空泡为小泡性脂肪变性(5μm < d < 25μm) 和大泡性脂肪变性 (d > 25μm);利用复合后生元固体饮料F组的后生元产品治疗后,肝内未见明显炎症,虽仍可见少量小泡性脂肪变性,但体积明显缩小,数量明显减少,肝细胞肿胀显著减轻。
利用复合后生元固体饮料F组的后生元产品治疗后小鼠肠道病理改变情况。
如图7所示,正常对照组的小鼠肠道绒毛排列整齐规则,而脂肪肝组的小鼠肠道绒毛排列紊乱、稀疏,且明显比正常组短,利用复合后生元固体饮料F组的后生元产品治疗后,明显改善脂肪肝小鼠的肠道绒毛破坏,并促进肠道绒毛增生。
利用复合后生元固体饮料F组的后生元产品治疗后小鼠肝脏炎症指标mRNA水平。
检测结果如图8所示:脂肪肝小鼠肝脏IL-1、IL-6、IL-10和MIP-1等炎症因子 mRNA水平较正常组小鼠明显升高,而经复合后生元固体饮料F组的后生元产品治疗后,炎症因子mRNA 水平明显下降,差异有统计学差异 (p<0.01)(注:IL为白介素;MIP-1为巨噬细胞炎症蛋白1;**图示与模型组比较P<0.01)。
综上所述,将莱菔硫烷、丁酸钠及后生元中副干酪乳杆菌G15和Q14粉末,制得复合后生元固体饮料并应用于人体上,被人体吸收且能发挥有效的效果,在维持肠道菌群平衡、治疗肠道紊乱、提高机体免疫功能的同时,还具有调节肥胖、改善肝损伤等功能,能够更加直接、快速地进入人体发挥功效;同时申请人还经过大量的实验验证:以“复合后生元固体饮料F组,莱菔硫烷2.0g,丁酸钠2.0g,粘合剂2.0g,后生元固体粉末3.0g,甜味剂0.5g,酸味剂0.5g,后生元固体粉末选用:副干酪乳杆菌G15 8份,副干酪乳杆菌Q14 8份,鼠李糖乳杆菌5份,双歧杆菌5份;粘合剂选用麦芽糊精和可溶性淀粉;甜味剂选用山梨糖醇;酸味剂选用苹果酸和柠檬酸”的比例为最佳。
- 一种复合后生元固体饮料及其制备方法
- 一种海藻糖复合益生元固体饮料及其制备方法
