一种离子液体提取的枸杞多糖及其在降血糖中的应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明属于天然活性物质制备技术领域,具体涉及一种提取枸杞中潜在的降血糖多糖组分的方法及其不同介质提取枸杞多糖比较研究。
背景技术
糖尿病是一种以高血糖为特征的代谢性疾病,是现代社会最重要的慢性疾病和死亡原因。近几十年来,糖尿病的流行率和发病率有所增加,全球大约有10%的人已经患有或可能患有2型糖尿病(T2DM)。在2型糖尿病患者中,α-糖苷酶和α-淀粉酶可以在分解代谢过程中将淀粉水解为葡萄糖,导致餐后血糖显着增加。过高的血糖会导致组织和细胞的氧化应激失衡,产生过多的活性氧(ROS),这些活性氧会攻击重要的细胞大分子,导致细胞损伤和死亡。因此,通过评估天然植物成分的α-糖苷酶和α-淀粉酶抑制测定筛选出具有治疗糖尿病潜力的有效成分,已成为开发无毒副作用的降血糖药物的常用方法。
枸杞(Lycium barbarum)是一种多用途的药食兼用植物,含有丰富的天然活性成分。枸杞多糖(LBP)是从枸杞子中提取得到的一种水溶性多糖蛋白复合物,被认为是枸杞果实中最主要的活性成分之一,具有许多生物学功效,如有抗衰老作用、神经保护、改善免疫功能、降血糖、抗脂肪肝和抗癌等作用。且越来越多的现代研究表明,枸杞降血糖的主要物质基础是枸杞多糖。而提取溶剂对枸杞多糖的产率、化学结构、理化性质和生物活性都起着重要的作用。传统热水萃取制备多糖相对耗时、耗能且效率低下,导致发挥降血糖作用的枸杞多糖含量偏低。倘若要达到降血糖目的,则需要大量食用枸杞提取物,从而会发生免疫过激,导致过敏等副作用。因此,为了获得降血糖功能的枸杞多糖,有必要了解多糖大分子的加工方式-化学结构-生物活性的关系,对于促进枸杞降血糖组分的高效开发是必要的。
发明内容
本发明提供一种离子液体提取的枸杞多糖及其在降血糖中的应用,体外活性试验表明,同其它几种传统提取方法制备的枸杞多糖比较,本发明所提供的的枸杞多糖的α-葡萄糖苷酶抑制活性、α-淀粉酶抑制活性和醛糖还原酶抑制活性显著优于传统提取方法制备的多糖。因此,所述的多糖具有降血糖的前景,有望用于功能食品、保健食品领域。
本发明所提供的枸杞多糖LBPs-ILs,其多角度激光光散射仪与尺寸排阻色谱法联用(SEC-MALLs)测定的Peak I的数均分子量Mn为990.8×10
更进一步的,所述的枸杞多糖LBPs-ILs中甘露糖、鼠李糖、半乳糖醛酸、葡萄糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖的含量分别为3.16%、4.01%、2.21%、4.04%、15.06%、24.55%、46.54%和0.415%。
更进一步的,所述的枸杞多糖LBPs-ILs的红外特征图谱在3309cm
更进一步的,所述的枸杞多糖LBPs-ILs的甲基化分析中,存在T-Araf、T-Arap、1,2-Rhap、1,5-Araf、T-Glcp、T-Galp、1,2,4-Rhap,1,6-Glcp、1,3-Glcp、1,6-Manp、1,6-Galp、1,3,4-Glcp,1,2,6-Glcp和1,3,6-Glcp糖苷键类型,其组成比例分别为22.14%、5.95%、6.78%、3.82%、1.14%、6.30%、3.19%、12.30%、1.82%、4.22%、1.88%、1.73%、3.08%和25.65%。
本发明所提供的枸杞多糖LBPs-ILs,其一种具体的制备方法如下:
将枸杞干粉加入到含有[C
本发明所提供的枸杞多糖LBPs-ILs在抑制α-葡萄糖苷酶、α-淀粉酶活性和醛糖还原酶中的应用。
本发明所提供的枸杞多糖LBPs-ILs用于制备降血糖的制品,包括但不限于功能食品、保健食品、特殊医学用途食品或新药。
附图说明
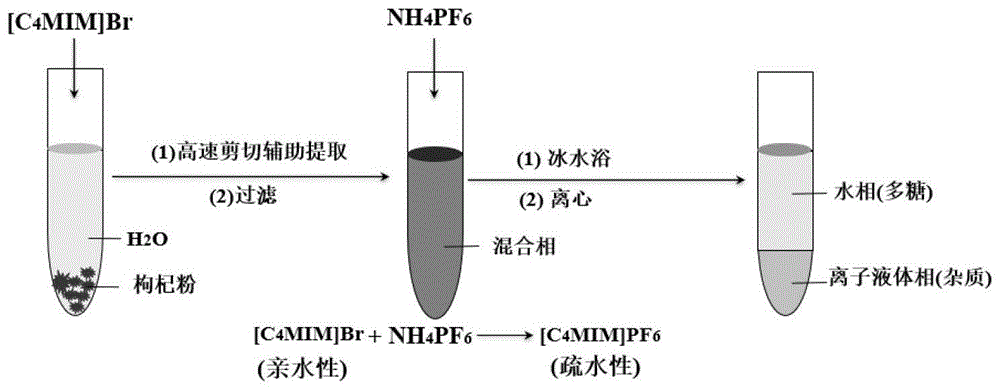
图1:本发明中离子液体从枸杞中提取纯化枸杞多糖LBPs-ILs的流程图。
图2:五种介质提取的枸杞多糖的抑制活性图,其中A:五种介质提取枸杞多糖LBPs-W,LBPs-Ac,LBPs-Al,LBPs-E和LBPs-ILs对α-淀粉酶的抑制活性;B:五种介质提取枸杞多糖LBPs-W,LBPs-Ac,LBPs-Al,LBPs-E和LBPs-ILs对α-葡萄糖苷酶的抑制活性。
图3:A:五种介质提取枸杞多糖LBPs-W,LBPs-Ac,LBPs-Al,LBPs-E和LBPs-ILs对醛糖还原酶的抑制活性;B:五种介质提取枸杞多糖LBPs-W,LBPs-Ac,LBPs-Al,LBPs-E和LBPs-ILs的IC50值;
图4:五种介质提取枸杞多糖的单糖组成图。
图5:五种介质提取枸杞多糖的RID分析图谱。
图6:五种介质提取枸杞多糖的红外光谱图。
图7:五种介质提取枸杞多糖的刚果红测定图。
图8:五种介质提取枸杞多糖的XRD衍射测定图。
图9:五种介质提取枸杞多糖的电镜扫描图和原子力显微镜图。
图10:五种介质提取枸杞多糖的分子构象图。
图11:五种介质提取枸杞多糖的热重分析谱图。
具体实施方式
本发明采用α-葡萄糖苷酶、α-淀粉酶抑制和醛糖还原酶活性筛选评价试验,筛选获得了从枸杞中提取纯化的枸杞多糖LBPs-ILs,确定其具有潜在的良好降血糖作用。并通过与其它方法提取的多糖进行理化性质和活性评价比较,来进一步阐释其降血糖的药效物质基础。
下面结合实施例和附图对本发明进行详细的描述。
实施例1:制备具有潜在降血糖作用的枸杞多糖
1、从枸杞中采用不同方法来提取多糖
1.1、仪器、试剂与材料:
枸杞子干果、单糖标准品(阿拉伯糖、核糖、木糖、葡萄糖、甘露糖、半乳糖、岩藻糖、鼠李糖、半乳糖酸、葡萄糖醛酸)、所有其他化学物质都至少为分析级,高效液相色谱的溶剂为色谱纯度。真空冷冻干燥机、紫外分光光度计、电子分析天平、离心机、高剪切分散乳化、超滤膜元件、蠕动泵、马尔文激光光散射仪与尺寸排阻色谱法联用系统(SEC-MALLs-RID)。
1.2、枸杞粗多糖的制备:
图1是离子液体从枸杞中提取纯化枸杞多糖LBPs-ILs的流程图,其具体的步骤如下:
称取30g枸杞干粉和21.6g[C
1.3、所述的其它几种方法制备方法,包括如下的步骤:
称取30g枸杞干果粉四份,分别加入360mL去离子水、0.1M HCl、0.1MNaOH和0.1%混合酶溶液(纤维素酶:果胶酶=1:1,w/w)分别用高速剪切分散乳化(HSDE)机,转速12000转/分,搅拌5分钟,然后将水浴锅温度控制在60℃搅拌150分钟。酸提取物的pH值用NaOH调至4,碱提取物的pH值用HCl调至中性。上清液用sevage试剂(氯仿:正丁醇=4:1,v/v)脱蛋白,30%双氧水脱色。去离子水透析(MWCO:3500Da)48h,然后收集冷冻干燥得到干燥的多糖粉末制备完成(LBPs-W,LBPs-Ac,LBPs-Al和LBPs-E)。
上述五种多糖采用苯酚-硫酸法测定总糖的含量,采用考马斯亮蓝法测定蛋白质含量,用硫酸-咔唑法测定糖醛酸含量,结果如表1。
表1:五种多糖部位总糖、蛋白和糖醛酸含量表
实施例2:五种枸杞多糖降血糖活性评价(α-葡萄糖苷酶、α-淀粉酶和醛糖还原酶抑制活性筛选评价)。
1、α-淀粉酶抑制活性评价
测定了五种枸杞多糖LBPs-W,LBPs-Ac,LBPs-Al,LBPs-E和LBPs-ILs的α-淀粉酶抑制活性。分别取溶液(1.0,2.5,5.0,10.0和20.0mg/mL)各45μL,加入15μLα-淀粉酶(0.02mg/mL)后在37℃水浴下保温10min,然后加入60μL淀粉溶液(0.08%),于37℃水浴反应15min后加入60μL盐酸溶液(1mol/L),终止反应后再加入20μL碘液(0.01mol/L)得到反应液。同时用15μL的PBS缓冲液替代α-淀粉酶解液作为空白。最后在酶标仪630nm下测吸光度。
其中,Ab表示阴性空白吸光度,Ac表示阴性对照吸光度,Asb表示样品空白吸光度,Asc表示样品对照吸光度。
2、α-葡萄糖苷酶抑制活性评价
测定了5种多糖组分LBPs-W,LBPs-Ac,LBPs-Al,LBPs-E和LBPs-ILs的α-葡萄糖苷酶抑制活性。分别取溶液(0.5-5mg/mL)各50μL,α-葡萄糖苷酶溶液50μL加入到96孔板中,在37℃下孵育15min;再加入50μL1mmol/L的pNPG溶液作为反应底物,在37℃下继续孵育15min;最后加入50μL0.2mol/LNa
其中,Ab表示阴性空白吸光度,Ac表示阴性对照吸光度,Asb表示样品空白吸光度,Asc表示样品对照吸光度。
3、醛糖还原酶抑制活性评价
将100μL 0.1M PBS(pH 7.0)、20μL醛糖还原酶溶液、20μL NADPH(辅助因子,2.4mM)、20μL样品(0.25-1mg/mL)和20μL硫酸铵溶液(4M)移入96孔板中。接下来,通过加入20μL底物(DL-甘油醛二聚体,25mM)开始反应,在340nm波长下进一步测量数值,持续6分钟。槲皮素被用来作为阳性对照。抑制率的计算公式如下。
抑制率=(1-(slopes-slopeb)/(slopec-slopeb))×100%
其中slopes、slopec和slopeb分别是由OD340 nm对反应时间(min)--样品组(含酶和样品)、对照组(不含样品)和空白组(不含酶或样品)的点线面得出的斜率。
4、α-淀粉酶抑制率检测结果
5种枸杞多糖抑制α-淀粉酶活性评价结果如图2A所示,LBPs-ILs对α-淀粉酶的抑制活性最高,在浓度为1-10mg/mL时,LBPs-ILs的抑制率高达55.16±1.85%,LBPs-E的抑制率最低,为17.83±0.73%。实验结果表明离子液体提取多糖LBPs-ILs是最有潜力的降血糖成分。
5、α-葡萄糖苷酶抑制率检测结果
5种枸杞多糖抑制α-葡萄糖苷酶评价结果如图2B所示,随着浓度的增加,5种多糖部位对α-葡萄糖苷酶活性均有一定的抑制作用。在浓度为1-5mg/mL时,α-葡萄糖苷酶抑制作用显著。其中,LBPs-ILs的抑制作用显著高于其他4种多糖。LBPs-ILs的抑制率高达80.37±1.67%,LBPs-W对α-葡萄糖苷酶活性的抑制效果最弱,为35.18±0.44%。该实验数据说明LBPs-ILs具有较强的降血糖活性潜力。
6、醛糖还原酶抑制活性
如图3所示,5种多糖部位的AR抑制作用呈剂量依赖性增加。其中,LBPs-E、LBPs-ILs和LBPs-W在1.0mg/mL时显示出较高的AR抑制活性,分别为90.88±1.31%、85.92±1.59%和63.79±2.08%。尽管LBPs-E对AR抑制率具有最高的活性,但LBPs-ILs显示出最低的IC
实施例3:枸杞多糖LBP-ILs结构分析
1、单糖组成分析
如图4所示,五种LBP由不同摩尔百分比的Man、Rha、GalA、Glc、GlcA、Gal、Ara和Fuc组成。表3结果表明,从LBPs中提取的五种LBPs是具有不同化学成分的杂多糖。特别是Ara和Gal是LBP中的主要单糖。因此,LBPs单糖组成的变化可能是由于不同的原料来源、提取方法和分离程序。同时,考虑多糖的蛋白质含量和单糖组成,发现ILs溶液提取的LBPs中Ara和Gal的含量远高于其他四种多糖,蛋白质含量也较高。比那些用热水、酸和酶提取的。由于阿拉伯半乳聚糖蛋白(AGP)是LBPs中重要的糖缀合物,推测LBPs-ILs中存在糖蛋白,说明ILs溶剂可能更适合提取多糖-蛋白质复合物。
表3:五种枸杞多糖单糖组成表(摩尔比,%)
2、分子量测定
多糖的分子量分布受提取溶剂和提取方法的影响,高低分子量都可能影响多糖的生物活性。图5显示了采用多角度激光光散射仪与尺寸排阻色谱法联用(SEC-MALLs)测定五种多糖的分子量分布,枸杞多糖的分子量分析结果见表2,LBPs-ILs和LBPs-Al多糖明显高于其他三种溶剂提取的多糖,这可能是因为ILs和碱提取的LBP保留了更多与中性糖(Ara和Gal)结合的蛋白质。从酸溶液和酶溶液中提取的多糖分子量低。酸碱萃取可有效破坏糖苷键,切断糖链,然后将部分高分子量馏分转化为低分子量馏分,使其分子量降低。然而,碱溶液可能会破坏多糖的链结构和完整性,同时将多糖从细胞壁释放出来,从而影响多糖的活性。从以上结果可以看出,萃取溶剂对LBPs的分子量分布有重要影响。
表2:五种枸杞多糖的分子量分析结果表
3、傅里叶变换红外光谱分析
傅里叶变换红外光谱分析通常用于部分揭示多糖的特征官能团的存在。如图6所示,五种不同萃取溶剂得到的LBPs的特征函数没有显着差异。3409cm
4、三螺旋结构测定分析
刚果红能与具有三螺旋结构的多糖形成络合物,其最大吸收波长在弱碱性溶液中增大,在强碱性溶液中减小。图7显示了刚果红多糖复合物在浓度范围为0到0.4mol/L(λmax)的NaOH水溶液中的最大吸收波长。在0-0.2M NaOH溶液中,与刚果红空白相比,所有样品均出现明显的红移,表明LBP在低碱浓度下具有三螺旋构象。同时,5种多糖中,LBPs-ILs和LBPs-E在0.15M NaOH溶液中的最大位移比其他3种多糖明显,说明提取溶剂可能显着影响其构象,这可能酸碱处理破坏了LBPs的分子内和分子间氢键,这是维持多糖特定构象的主要动力。
5、XRD测定分析
XRD可以提供多糖是无定形或结晶的构象信息。如图8所示,所有LBPs在2θ≈23°处都呈现出被动的单个面包状峰,表明所有LBPs都是半结晶的。与LBPs-ILs相比,LBPs-Ac和LBPs-Al具有不同的2θ角和微晶。这可能是因为苛刻的酸碱条件对多糖的结晶度有一定的破坏作用。结合FT-IR和刚果红分析结果,萃取溶剂对LBPs的结构有显着影响。
6、3D-形貌分析
通过SEM和AFM分析不同LBP的表面形态。扫描电子显微镜(SEM)是观察材料表面特征的有效工具。图9A显示了5种LBPs(LBPs-W、LBPs-Ac、LBPs-Al、LBPs-E和LBPs-ILs)在2000X放大倍率下的SEM图像。图像显示,用不同溶剂提取的五种LBPs的表面形貌在形状和大小上有显着差异。LBPs-Ac具有相对松散和片状的表面,这表明酸溶液可能会部分破坏LBPs并减小其尺寸。LBPs-Al多糖具有非常不规则的光滑片状或块状结构,其分子大小明显大于LBPs-Ac,这与HPSEC-MALLs-RID分析的结果一致。在LBPs-W中,我们可以看到具有多空片和松散多空棒结构的交联。在LBPs-ILs中,除了不规则的片状和块状结构外,我们还发现存在不均匀的圆柱形聚集体,这可能与多糖的三维结构有关,这与刚果红的实验结果一致。ILs溶剂提取的多糖具有更多的三螺旋结构。这些结果表明多糖的缠结和支化结构可能受到萃取溶剂的影响。
AFM可用于可视化多糖的形态和分子特征。五个LBP的平面和3DAFM图像如图9B和9C所示。所有LBPs主要表现为球形和不规则块,表明多糖链的聚集和缠结。粒度分析表明,LBPs-Al的聚合度最大,颗粒最大,其次是LBPs-ILs。这些结果可归因于这些提取方法引起的结构特征和氢键水平的差异。多糖的酸提取可能是由于提取过程中一些重要的侧链发生降解,导致聚合度低,反映了其较大的异质性。这与分子量和分子构象分析的结果一致。
HPSEC-MALLS-RID可以计算出Mw和rms半径之间的关系,从而得到rms构象(图10),而α值可以用来推断多糖分子链的构象。当α为0~0.3、0.5~0.8和1.0时,表明多糖在溶液中分别为球形、无属性线状体和具有棒状构象。如图10所示,LBPs-Ac的α值为0.55,表明它们在溶液中主要以非归属线型的形式存在,而LBPs-W、LBPs-Al、LBPs-E和LBPs-ILs的α值分别为0.32、0.06、0.12和0.04,表明它们在溶液中为球形分子,α值越小表明球形分子内部越紧凑,这与SEM和AFM得到的结果一致。
7、热重分析
植物多糖的热特性在食品工业中尤为重要。反映多糖质量随时间和温度的变化有助于了解多糖的热行为并分析其成分。如图11所示,在30至800℃加热期间,用不同溶剂提取的五种LBP的热重(TG)和差示热重(DTG)曲线。如图11E所示,发现五种多糖的热分解曲线几乎相同。差示热重(DTG)曲线表明多糖热分解主要分为三个阶段。第一阶段是由结合水的蒸发引起的。天然多糖具有大量的亲水基团,可以吸附一定量的水分。当温度升高时,水分会蒸发,从而降低多糖样品的质量。在水分挥发过程中,LBPs-Al和LBPs-Ac的DTG曲线节点温度分别为90.158℃和86.546℃,显着高于其他三种多糖,说明它们具有不同的水结合能力,并且LBPs-Al和LBPs-Ac具有很强的水结合能力,这可能是由于从酸溶液和碱溶液中提取的多糖分支较多,暴露出更多的亲水基团。第二阶段是结晶水挥发和解聚反应的结果。观察到LBPs-Al和LBPs-Ac在第二阶段有非常明显的变化,这可能与结晶水的存在有关。此外,碱溶液和酸溶液在提取多糖的过程中会破坏多糖内部和多糖之间的大量氢键,导致多糖结构松散,容易发生解聚反应。第三阶段归因于一些更稳定的结构的分解和破裂。5种多糖的DTG曲线节点温度均在300℃左右,说明大量多糖水解成寡糖和单糖后,随着温度的升高,C-O键、糖苷基、多糖骨架会断裂。在此温度范围内,与最经典的热水提取方法相比,亲水性ILs溶液中提取的多糖呈现出相同的变化趋势,说明LBPs-ILs和LBPs-W具有相同的热稳定性能,说明与酸-碱溶液、离子液体和水溶液对多糖的提取都比较温和,多糖的糖苷键断裂较低,最大程度地保留了多糖的原始结构。一般来说,萃取溶剂会影响LBPs的热稳定性。这些结果表明,不同溶剂提取的LBPs热稳定性性质的变化可以为多糖在食品工业中的应用,如多糖的热稳定性、脱水和再水化等提供良好的理论依据。
8、甲基化分析
为了确定不同的提取方法是否会影响提取的LBPs的糖苷键,进行甲基化和GC-MS分析以进一步研究五种LBPs的整体结构。LBPs被甲基化和乙酰化,然后通过GC-MS分析和检测PMAA。如表4所示,所有LBP都被确定为十二个衍生物。主要线性结构为1,6-linked-Glcp和1,5-linked-Araf,分支点为1,3,6-linked-Glcp和1,3,4-linked-Glcp,末端结构为由T-Araf、T-Arap和T-Galp组成,与单糖组成分析基本一致。结果发现LBPs-Al和LBPs-ILs末端结构中T-Araf、T-Arap和t-Galp的含量显着高于其他三种多糖。因此,结合单糖组成和理化性质的结果,可能存在典型的阿拉伯半乳聚糖(AG)I型和II型果胶结构。
表4:五种枸杞多糖的甲基化分析及连接方式表
/>
