治疗银屑病的方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明是关于一种用于治疗银屑病的方法,且特定而言,一种利用来源于灵芝的免疫调节蛋白的方法。
背景技术
银屑病是一种持久的非传染性自体免疫性疾病,其特征为异常皮肤的凸起区域,最通常在膝部、肘部、躯干及头皮上。此等区域在一些具有较暗、干燥、发痒及鳞片状皮肤的人身上通常为红色或紫色。其往往会定期侵袭,突然发作数周或数月,随后消退或进入缓解。银屑病的常见触发因素包括压力、酒精、损伤及药物。
银屑病的严重性可在局部小斑点至全身覆盖之间变化,可能的机制复杂且为全身性的。以安全且经济的方式管理银屑病仍然为一项挑战。
当皮肤大范围受累,例如百分之十的体表面积或更多受累时,使用诸如甲胺喋呤(methotrexate)或生物制剂,诸如依那西普(etanercept)、阿达木单抗(adalimumab)、英利昔单抗(infliximab)等全身性疗法进行治疗。大量罹患银屑病者具有不太深入的作用,且在大多数此等情况下,表面药物视为更安全且更谨慎的替代物。表面疗法有抗炎性皮质类固醇,尤其超有效种类,诸如丙酸卤贝他索(halobetasol propionate);维生素D衍生物,诸如钙泊三醇(calcipotriene);称为他扎罗汀(tazarotene)的类视黄素;及煤焦油(coaltar)。虽然表面疗法中的每一者提供特定程度的有效性,但其对银屑病性斑块的改善程度或产生的不良作用存在限制。
发明内容
本发明意外地发现,来源于灵芝的免疫调节蛋白或其重组体提供治疗或缓解银屑病及/或促进或加速银屑病痊愈的有利功效。因此,本发明提供一种用来源于灵芝的免疫调节蛋白治疗银屑病的方法。
在一个态样中,本发明提供一种用于治疗或缓解银屑病及/或促进或加速银屑病痊愈的方法,其包括向有需要的个体投与医药组合物。所述医药组合物包含有效量的来源于灵芝的免疫调节蛋白或其重组体或片段。
在本发明的一些实施例中,免疫调节蛋白包含SEQ ID NO:3或4的胺基酸序列。在本发明的一些实施例中,免疫调节蛋白的片段包含选自由SEQ ID NO:1至2组成的群的胺基酸序列。
SEQ ID NO:1至4的序列如下。
在本发明的一些实施例中,医药组合物进一步包含胶凝剂。
在本发明的一些实施例中,医药组合物中胶凝剂的量为约0.1%(w/w)至约2%(w/w)、约0.15%(w/w)至约1.95%(w/w)、约0.2%(w/w)至约1.9%(w/w)、约0.25%(w/w)至约1.85%(w/w)、约0.3%(w/w)至约1.8%(w/w)、约0.35%(w/w)至约1.75%(w/w)、约0.4%(w/w)至约1.7%(w/w)、约0.45%(w/w)至约1.65%(w/w)、约0.5%(w/w)至约1.6%(w/w)、约0.55%(w/w)至约1.55%(w/w)、约0.6%(w/w)至约1.5%(w/w)、约0.65%(w/w)至约1.45%(w/w)、约0.7%(w/w)至约1.4%(w/w)、约0.75%(w/w)至约1.35%(w/w)、约0.8%(w/w)至约1.3%(w/w)、约0.85%(w/w)至约1.25%(w/w)、约0.9%(w/w)至约1.2%(w/w)、约0.95%(w/w)至约1.15%(w/w)、约1.0%(w/w)至约1.1%(w/w)。在一些实施例中,胶凝剂的量在约0.5%(w/w)至约2.0%(w/w)、约0.5(w/w)至约1.5%(w/w)、约0.5(w/w)至约1.2%(w/w)、约0.5(w/w)至约1.0%(w/w)、约0.1(w/w)至约1.5%(w/w)、约0.1(w/w)至约1.0%(w/w)、约0.1(w/w)至约0.5%(w/w)、约1.0%(w/w)至约2.0%(w/w)或约1.5%(w/w)至约2%(w/w)范围内。
在本发明的一些实施例中,医药组合物中免疫调节蛋白的量为约0.0001%(w/w)至约0.05%(w/w)、约0.0001%(w/w)至约0.05%(w/w)、约0.0005%(w/w)至约0.045%(w/w)、约0.001%(w/w)至约0.04%(w/w)、约0.005%(w/w)至约0.035%(w/w)、约0.001%(w/w)至约0.03%(w/w)、约0.005%(w/w)至约0.025%(w/w)、约0.01%(w/w)至约0.02%(w/w)、约0.0001%(w/w)至约0.05%(w/w)、约0.0001%(w/w)至约0.05%(w/w)、约0.0001%(w/w)至约0.05%(w/w)、约0.0001%(w/w)至约0.05%(w/w)、约0.0001%(w/w)至约0.05%(w/w)、约0.0001%(w/w)至约0.05%(w/w)、约0.0001%(w/w)至约0.05%(w/w)、约0.0001%(w/w)至约0.05%(w/w)。在一些实施例中,免疫调节蛋白的量在约0.0001%(w/w)至约0.03%(w/w)、约0.0001%(w/w)至约0.01%(w/w)、约0.0001%(w/w)至约0.03%(w/w)、约0.0001%(w/w)至约0.01%(w/w)、约0.0001%(w/w)至约0.005%(w/w)、约0.0001%(w/w)至约0.003%(w/w)、约0.0001%(w/w)至约0.001%(w/w)或约0.0001%(w/w)至约0.0005%(w/w)范围内。
胶凝剂的实例包括但不限于聚乙二醇(PEG)-二丙烯酸酯、PEG-丙烯酸酯、PEG-硫醇、PEG-迭氮化物、PEG-炔、几丁聚醣、玻尿酸、胶原蛋白、纤维蛋白、阿拉伯胶、褐藻酸、纳豆胶、芦荟(aloe vera)、膨润土、卡波姆(carbomer)、羧甲基纤维素、乙基纤维素、明胶、弹性蛋白、羟基聚酰胺、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、硅酸镁铝、甲基纤维素、泊洛沙姆(poloxamer)、聚乙烯醇、褐藻酸钠、黄蓍胶、黄原胶、明胶、羧基乙烯基聚合物、淀粉、水溶胀性亲水胶体、角叉莱胶、玻尿酸盐、琼脂糖、褐藻酸盐、丙烯酸酯及丙烯酰二甲基牛磺酸铵/乙烯吡咯啶酮(VP)共聚物。
在一些实施例中,胶凝剂为黄原胶、甲基纤维素或丙烯酰二甲基牛磺酸铵/VP共聚物。
在一个实施例中,医药组合物具有在约5.5至约7.5范围内的pH值。在一些实施例中,pH在约6.0至约7.5、约6.5至约7.5、约5.5至约7.0、约6.0至约7.0、约6.5至约7.0、约5.5至约6.5或约6.0至约6.5范围内。
在一个实施例中,医药组合物具有在约0.05Pa·s至约200Pa·s范围内的黏度。在一些实施例中,黏度在约0.1Pa·s至约200Pa·s、约0.5Pa·s至约200Pa·s、约1.0Pa·s至约200Pa·s、约5Pa·s至约200Pa·s、约10.0Pa·s至约200Pa·s、约20.0Pa·s至约200Pa·s、约40.0Pa·s至约200Pa·s、约60.0Pa·s至约200Pa·s、约80.0Pa·s至约200Pa·s、约100.0Pa·s至约200Pa·s、约120Pa·s至约200Pa·s、约140Pa·s至约200Pa·s、约160Pa·s至约200Pa·s、约0.05Pa·s至约160Pa·s、0.05Pa·s至约140Pa·s、0.05Pa·s至约120Pa·s、0.05Pa·s至约100Pa·s、0.05Pa·s至约80Pa·s、0.05Pa·s至约60Pa·s、0.05Pa·s至约40Pa·s、0.05Pa·s至约20Pa·s、0.05Pa·s至约10Pa·s、0.05Pa·s至约5.0Pa·s、0.05Pa·s至约3.0Pa·s或0.05Pa·s至约1.0Pa·s范围内。
在一些实施例中,医药组合物表面投与在银屑病区域上。
在一个实施例中,医药组合物表面投与在银屑病区域上,且免疫调节蛋白的有效量在约1mcg/cm
在本发明的一些实施例中,医药组合物经口投与个体。
在本发明的一些实施例中,医药组合物经口投与个体,免疫调节蛋白的有效量在约0.01mg/kg至约5mg/kg范围内。在一些实施例中,有效量在约0.01mg/kg至约4mg/kg、约0.01mg/kg至约4.5mg/kg、约0.01mg/kg至约4mg/kg、约0.01mg/kg至约3.5mg/kg、约0.01mg/kg至约3mg/kg、约0.01mg/kg至约2.5mg/kg、约0.01mg/kg至约2mg/kg、约0.01mg/kg至约1.5mg/kg、约0.01mg/kg至约1mg/kg、约0.01mg/kg至约0.5mg/kg、约0.05mg/kg至约5mg/kg、约0.05mg/kg至约4.5mg/kg、约0.05mg/kg至约4.5mg/kg、约0.05mg/kg至约4mg/kg、约0.05mg/kg至约3.5mg/kg、约0.05mg/kg至约3mg/kg、约0.05mg/kg至约2.5mg/kg、约0.05mg/kg至约2mg/kg、约0.05mg/kg至约1.5mg/kg、约0.05mg/kg至约1mg/kg、约0.05mg/kg至约0.5mg/kg、约0.1mg/kg至约5mg/kg、约0.1mg/kg至约4.5mg/kg、约0.1mg/kg至约4mg/kg、约0.1mg/kg至约3.5mg/kg、约0.1mg/kg至约3mg/kg、约0.1mg/kg至约2.5mg/kg、约0.1mg/kg至约2mg/kg、约0.1mg/kg至约1.5mg/kg、约0.1mg/kg至约1mg/kg、约0.1mg/kg至约0.5mg/kg、约0.5mg/kg至约5mg/kg、约1mg/kg至约5mg/kg、约1.5mg/kg至约5mg/kg、约2mg/kg至约5mg/kg、约2.5mg/kg至约5mg/kg、约3mg/kg至约5mg/kg、约3.5mg/kg至约5mg/kg或约4mg/kg至约5mg/kg范围内。
在一个实施例中,所述方法进一步包含向个体投与一或多种额外治疗剂。在一些实施例中,治疗剂包括表面药物(例如皮质类固醇、维生素D类似物、类视黄素、钙调磷酸酶抑制剂、水杨酸、煤焦油、蒽酚(anthralin))、光(例如日光、UVB宽谱、UVB窄谱、补骨脂素+紫外线A(PUVA)、准分子雷射)或口服或静脉内施加(例如类固醇、类视黄素、甲胺喋呤、环孢霉素、依那西普(Enbrel)、英利昔单抗(Remicade)、阿达木单抗(Humira)、乌司奴单抗(ustekinumab,Stelara)、塞库金单抗(secukinumab,Cosentyx)、伊科奇单抗(ixekizumab,Taltz)、硫鸟嘌呤(thioguanine,Tabloid)、羟基脲(hydroxyurea,Droxia、Hydrea)、阿普司特(Apremilast,Otezla))。
在一些实施例中,银屑病为斑块型银屑病、脓疱性银屑病、反向型银屑病、尿布型银屑病、滴状银屑病、口腔银屑病、红皮病性银屑病、脂溢性皮炎样银屑病、指甲银屑病或银屑病关节炎。
在一些实施例中,银屑病为家族性银屑病。
图式简单说明
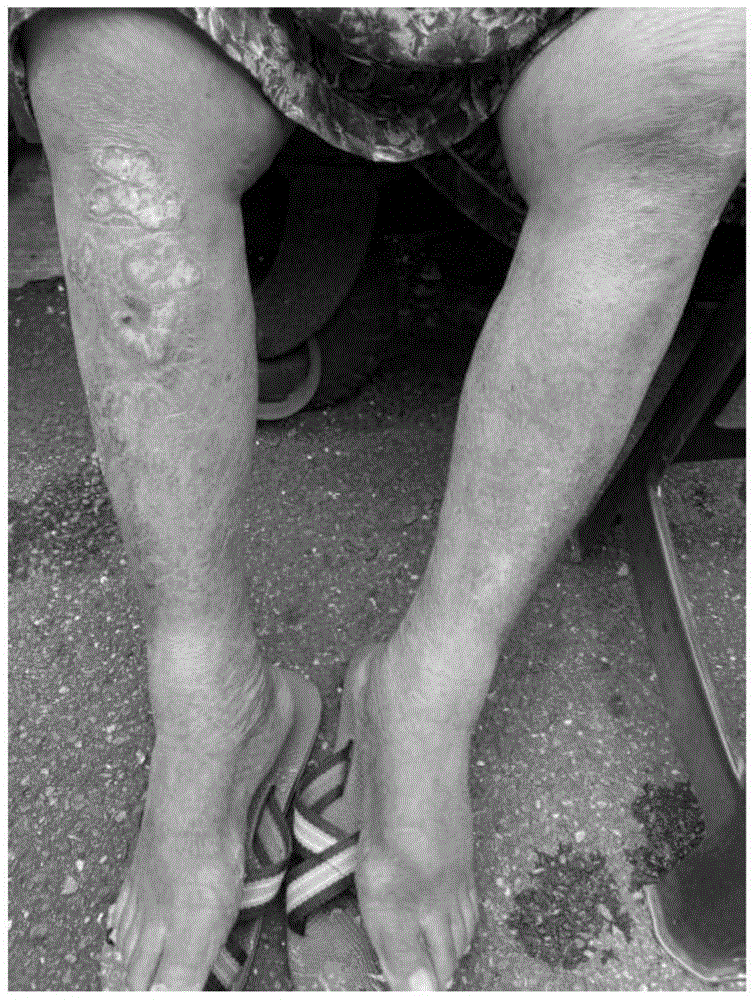
图1(A)及1(B)展示专利1中用本发明的水凝胶治疗银屑病的作用。图1(A):治疗前;图1(B):治疗2个月后。
图2(A)及2(B)展示专利1中用本发明的胶囊治疗银屑病的作用。图2(A):治疗前;图2(B):治疗4个月后。
图3(A)至3(C)展示专利2中用本发明的胶囊治疗银屑病的作用。图3(A):第3周治疗;图3(B):第12周治疗(皮肤);图3(C):第12周治疗(指甲)。
图4(A)至4(C)展示专利3中用本发明的胶囊治疗银屑病的作用。图4(A):治疗前;图4(B):第2周治疗;图4(C):第4周治疗。
具体实施方式
定义
除非另外定义,否则本文中所用的所有技术及科学术语均具有与一般熟习本发明所属技术者通常所理解的含义相同的含义。尽管与本文所述的彼等方法及材料类似或等效的方法及材料可用于实践或测试本发明,但目前描述较佳方法及材料。本文所提及的所有公开案均以引用的方式并入本文中。
在本申请案中,除非另外特定陈述,否则单数的使用包括复数,冠词“一(a/an)”意谓“至少一”,且“或”的使用意谓“及/或”。
术语“表面”指藉由施加化合物至身体部位的表面来投与或递送化合物。
如本文所用,“促进(promote)”或“增加(increase)”或者“促进(promoting)”或“增加(increasing)”可互换使用。此等术语指与未治疗的细胞、组织或个体相比,经治疗的细胞、组织或个体中所量测参数增加。亦可对治疗前后的相同细胞或组织或个体进行比较。在一些实施例中,与未治疗的细胞、组织或个体相比,经治疗的细胞、组织或个体中增加至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、1倍、2倍、3倍、4倍或更多倍。
如本文所用,本文中术语“个体”为脊椎动物,诸如人类或非人类动物,例如哺乳动物。哺乳动物包括(但不限于)人类、灵长类动物、农畜、运动型动物、啮齿动物及宠物。非人类动物个体的非限制性实例包括啮齿动物,诸如小鼠、大鼠、仓鼠及天竺鼠;兔;狗;猫;绵羊;猪;山羊;牛;马;及非人类灵长类动物,诸如猿及猴。
如本文所用,术语“治疗(treating)”或“治疗(treatment)”(及其语法变化形式,诸如“治疗(treat)”)指试图改变所治疗个体或细胞的病程的临床介入,且可出于防治目的或在临床病理学的病程期间进行。治疗的治疗作用包括(但不限于)预防疾病的发生或复发、缓解症状、减轻疾病的任何直接或间接病理性结果、预防癌转移、降低疾病进展速率、改善或缓和疾病状态以及缓解或改善预后。
如本文所提供的活性成分的“有效量”术语意谓所述成分足以提供对所需功能的所需调控的量。如下文将指出,视个体的疾病病况、身体状况、年龄、性别、物种及体重、组合物的特定身分及调配等而定,所需求的确切量将随各个体而变化。可调节给药方案以诱发最优治疗反应。举例而言,可每天投与若干分次剂量,或可如治疗情况的紧急程度所指示按比例减少剂量。因此,不会一直指定确切“有效量”。然而,一般技术者仅利用常规实验便可确定适当有效量。
如本文所用,术语“表面调配物”(或者“表面组合物”)用以指意欲用于表面或局部施加至有需要的个体的患病区域的医药制剂。
如本文所用,术语“医药学上可接受”在本文中定义,指在合理医学判断的范畴内,适合与个体(例如哺乳动物或人类)的组织接触而无过度毒性、刺激过敏性反应及其他问题并发症,与合理益处/风险比相称的彼等化合物、材料、组合物及/或剂型。
本发明提供一种用于治疗或缓解银屑病及/或促进或加速银屑病痊愈的方法,所述方法包含向有需要的个体投与医药组合物,其中所述医药组合物包含有效量的来源于灵芝的免疫调节蛋白或者其重组体或片段。
在一个实施例中,免疫调节蛋白或者其重组体或其片段来源于赤灵芝(Ganodermalucidum)、赤灵芝(Ganoderma lucidum)、松杉灵芝(Ganoderma tsugae)、小孢灵芝(Ganoderma microsporum)或紫灵芝(Ganoderma sinensis)。在一些实施例中,免疫调节蛋白为包含SEQ ID NO:3或4的胺基酸序列的免疫调节蛋白或其重组体。在一些实施例中,免疫调节蛋白的片段包含选自由SEQ ID NO:1至2组成的群的胺基酸序列。免疫调节蛋白或其重组体的制备已描述于US 7,601,808中。
在一些实施例中,治疗或缓解银屑病及/或促进或加速银屑病痊愈可包括减少炎症及鳞屑、减缓皮肤细胞生长及/或移除斑块。
如本文所揭示的免疫调节蛋白或者其重组体或其片段或医药组合物可单独投与个体,或呈医药组合物投与个体,其中其与适合载剂及赋形剂混合。如本文所揭示的免疫调节蛋白或者其重组体或其片段或医药组合物可非经肠,诸如藉由静脉内注射或输注、腹膜内注射、皮下注射或肌肉内注射来投与。如本文所揭示的免疫调节蛋白或者其重组体或其片段或医药组合物可经由与载剂及赋形剂适当调配以形成锭剂、丸剂、胶囊、液体、凝胶、糖浆、浆液、悬浮液及其类似物,经口或经直肠投与。如本文所揭示的免疫调节蛋白或者其重组体或其片段或医药组合物可经表面,诸如藉由皮肤贴片投与。如本文所揭示的免疫调节蛋白或者其重组体或其片段或医药组合物可调配成表面乳膏、皮肤或黏膜贴片或者适合于表面施加至皮肤或黏膜表面的液体或凝胶。如本文所揭示的免疫调节蛋白或者其重组体或其片段或医药组合物可藉由吸入剂投与至呼吸道以局部或全身治疗银屑病。
免疫调节蛋白或者其重组体或其片段或医药组合物的剂量可藉由熟习此项技术者基于本文中的揭示内容确定。药剂将含有有效剂量(视活性剂的投与途径及药物动力学而定)的适合于调配物的特定投与途径(亦即,口服、非经肠、表面或藉由吸入)的适合医药载剂及赋形剂。免疫调节蛋白或者其重组体或其片段藉助于混合、溶解、造粒、糖衣锭制造、乳化、囊封、包覆或冻干制程混合成医药组合物。用于非经肠投与的医药组合物包括呈水溶性形式的本发明多肽的水溶液。另外,可将本发明多肽的悬浮液制备成油性注射悬浮液。适合亲脂性溶剂或媒剂包括脂肪油,诸如芝麻油;或合成脂肪酸酯,诸如油酸乙酯或三酸甘油酯;或脂质体。水性注射悬浮液可含有增加悬浮液黏度的物质,诸如羧甲基纤维素钠、山梨糖醇或葡聚糖。悬浮液可视情况含有稳定剂或增加复合物或组合溶解性以允许浓度更高的溶液的试剂。
在一些实施例中,医药组合物意欲以各种方式表面施用,将进一步描述所述等方式。例如,医药组合物可呈水凝胶提供。在本发明的一些实施例中,医药组合物进一步包含胶凝剂。
在本发明的一些实施例中,医药组合物中胶凝剂的量为约0.1%(w/w)至约2%(w/w)。
在本发明的一些实施例中,医药组合物中免疫调节蛋白的量为约0.0001%(w/w)至约0.05%(w/w)。
本发明的医药组合物亦包含胶凝剂以形成黏度在约0.05Pa·s至约200Pa·s范围内的表面凝胶产品。
本发明的医药组合物调配成具有5.5至7.5的pH值。在一个实施例中,水性介质的pH值可藉助于低浓度的适合生物兼容性缓冲成分调整,非限制性实例为缓血酸胺、碳酸钠及碳酸氢钠以及磷酸二氢钠及磷酸氢二钠。
本发明的医药组合物亦可包括其他添加剂,诸如溶剂、胶凝剂/聚合剂、黏度增加剂、乳化剂、抗氧化剂、防腐剂、pH调节剂、推进剂以及前述的组合。
在本发明的一些实施例中,医药组合物经口投与个体。载剂用作载剂及/或稀释剂及/或佐剂或用于递送治疗剂至个体的媒剂,或添加至调配物中以改善其处置或储存特性或允许或有助于组合物的剂量单元形成离散物品,诸如适合于经口投与的胶囊或锭剂。适合载剂为一般熟习制造医药调配物或食品的技术者所熟知的。藉助于说明而非限制,载剂可包括缓冲剂、稀释剂、崩解剂、结合剂、黏着剂、润湿剂、聚合物、润滑剂、滑动剂、为遮蔽或抵消不好味道或气味而添加的物质、调味剂、染料、芳香剂及为改善组合物外观而添加的物质。可接受的载剂包括柠檬酸盐缓冲液、磷酸盐缓冲液、乙酸盐缓冲液、碳酸氢盐缓冲液、硬脂酸、硬脂酸镁、氧化镁、磷酸及硫酸的钠盐及钙盐、碳酸镁、滑石、明胶、阿拉伯树胶、褐藻酸钠、果胶、糊精、甘露糖醇、山梨糖醇、乳糖、蔗糖、淀粉、明胶、纤维素材料(诸如烷酸纤维素酯及纤维素烷基酯)、低熔点蜡可可脂、胺基酸、尿素、醇、抗坏血酸、磷脂、蛋白质(例如血清白蛋白)、乙二胺四乙酸(EDTA)、二甲亚砜(DMSO)、氯化钠或其他盐、脂质体、甘露糖醇、山梨糖醇、甘油或粉末、聚合物(诸如聚乙烯吡咯啶酮、聚乙烯醇及聚乙二醇)及其他医药学上可接受的材料。载剂不应破坏治疗剂的药理学活性且在以足以递送治疗量的治疗剂的剂量投与时应无毒。
在本发明的一些实施例中,医药组合物经口投与个体,免疫调节蛋白的有效量在约0.01mg/kg至约5mg/kg范围内。在本发明的一些其他实施例中,免疫调节蛋白的有效量在约0.1mg/kg至约3mg/kg范围内。
在一些实施例中,所述方法进一步包含向个体投与一或多种额外治疗剂。治疗剂可为任何已知的用于治疗银屑病的药物,诸如表面药物(例如皮质类固醇、维生素D类似物、类视黄素、钙调磷酸酶抑制剂、水杨酸、煤焦油、蒽酚)、光(例如日光、UVB宽谱、UVB窄谱、补骨脂素+紫外线A(PUVA)、准分子雷射)或口服或注射药物(例如类固醇、类视黄素、甲胺喋呤、环孢霉素、依那西普(Enbrel)、英利昔单抗(Remicade)、阿达木单抗(Humira)、乌司奴单抗(Stelara)、塞库金单抗(Cosentyx)、伊科奇单抗(Taltz)、硫鸟嘌呤(Tabloid)、羟基脲(Droxia、Hydrea)、阿普司特(Otezla)),且可与本发明的医药组合物组合使用或直接并入至本发明的医药组合物中。
根据本发明适合使用的医药组合物的剂量可藉由熟习此项技术者基于本文中的揭示内容确定。药剂将含有有效剂量(视活性剂的投与途径及药物动力学而定)的适合于调配物的表面投与途径的适合医药载剂及赋形剂。
在一个实施例中,给药方案重复,亦即一次、两次、三次或更多次;例如,在有需要的个体的剩余寿命中重复。在另一实施例中,患者用利用根据本发明的医药组合物治疗14天的给药方案治疗。在再一实施例中,患者用利用根据本发明的医药组合物的给药方案一天治疗两次或三次,历时2周、3周、4周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月或12个月。
本发明提供用于治疗银屑病的医药组合物及方法。虽然银屑病的发病机制尚未完全阐明,但大量证据表明,表皮变化作为对浸润皮肤的细胞免疫的二次反应出现。银屑病的特征在于皮肤发炎的离散区域,伴随发红、增厚、密集起鳞屑及在一些情况下发痒。所述疾病在身体及心理方面均对患病个体的生活质量具有显著影响。在一个实施例中,治疗旨在降低银屑病斑块及相关症状的严重性及程度。美国食品药物管理局用于评估治疗银屑病产品的治疗成功的主要量测为基于研究人员整体评估,银屑病严重性的显著总体改善。
仅出于说明的目的,已在本文中使用特定实施例来描述本揭示。然而,一般熟习此项技术者将显而易见,本揭示的原理可以其他方式体现。因此,本揭示不应被视为在范畴上限于特定实施例及申请专利范围。提供以下实例以说明但不限制所主张的发明。
实例
实例1制备本发明的水凝胶
医药组合物可呈水凝胶提供。水凝胶的调配物的实施例如下列出。
表1
将具有SEQ ID NO:4的免疫调节蛋白添加至超纯水且接着充分混合。随后,藉由持续搅拌,将胶凝剂添加至所得混合物,直至形成凝胶。将所得凝胶在冰箱中在4℃下培育至少16小时。将所得凝胶置放于适当容器中以进行储存。
实例2制备本发明的胶囊
医药组合物可呈胶囊提供。各胶囊包含350μg具有SEQ ID NO:3或4的免疫调节蛋白。
实例3银屑病的治疗-患者1
自20岁以来,80岁女性患者1两条腿上患有银屑病已60年。患者1尝试许多习知处方,但病状仍然几乎不受控制。
一天两次将实例1中的水凝胶施加至左腿2个月之后,左腿上银屑病症状得到缓解(图1(A)至图1(B))。
在一天施加三颗实例2中的含有SEQ ID NO:4的胶囊4个月之后,左腿上银屑病症状得到缓解(图2(A)至图2(B))。
实例4银屑病的治疗-患者2
自20岁以来,53岁女性患者2两条腿上患有银屑病已33年。患者2尝试许多习知处方,但病状仍然几乎不受控制。
在一天施加三颗实例2中的含有SEQ ID NO:3的胶囊3周之后,第3周皮肤上的银屑病症状得到缓解(图3(A)),且第12周显著得到改善(图3(B))。此外,第12周指甲上的银屑病症状显著得到改善(图3(C))。
实例5家族性银屑病的治疗-患者3
17岁男性患者3患有家族性银屑病,且银屑病病变出现在皮肤上。
在一天施加三颗实例2中的含有SEQ ID NO:4的胶囊3周之后,第2周(图4(A)至图4(B))及第4周(图4(C))皮肤上的银屑病症状得到显著缓解。此外,症状持续7个月未复发。
序列表
<110> 辛绍祺(HSIN, SHAOCHI)
<120> 治疗银屑病的方法
<130> none
<150> US 63/187,092
<151> 2021-05-11
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 6
<212> PRT
<213> 小孢灵芝
<400> 1
Leu Ala Trp Asn Val Lys
1 5
<210> 2
<211> 10
<212> PRT
<213> 小孢灵芝
<400> 2
Asp Leu Gly Val Arg Pro Ser Tyr Ala Val
1 5 10
<210> 3
<211> 111
<212> PRT
<213> 小孢灵芝
<400> 3
Met Ser Asp Thr Ala Leu Ile Phe Thr Leu Ala Trp Asn Val Lys Gln
1 5 1015
Leu Ala Phe Asp Tyr Thr Pro Asn Trp Gly Arg Gly Arg Pro Ser Ser
202530
Phe Ile Asp Thr Val Thr Phe Pro Thr Val Leu Thr Asp Lys Ala Tyr
354045
Thr Tyr Arg Val Val Val Ser Gly Lys Asp Leu Gly Val Arg Pro Ser
505560
Tyr Ala Val Glu Ser Asp Gly Ser Gln Lys Ile Asn Phe Leu Glu Tyr
65707580
Asn Ser Gly Tyr Gly Ile Ala Asp Thr Asn Thr Ile Gln Val Tyr Val
859095
Ile Asp Pro Asp Thr Gly Asn Asn Phe Ile Val Ala Gln Trp Asn
100 105 110
<210> 4
<211> 140
<212> PRT
<213> 人工序列
<220>
<223> 重组蛋白
<400> 4
Glu Ala Glu Ala Glu Phe Met Ser Asp Thr Ala Leu Ile Phe Thr Leu
1 5 1015
Ala Trp Asn Val Lys Gln Leu Ala Phe Asp Tyr Thr Pro Asn Trp Gly
202530
Arg Gly Arg Pro Ser Ser Phe Ile Asp Thr Val Thr Phe Pro Thr Val
354045
Leu Thr Asp Lys Ala Tyr Thr Tyr Arg Val Val Val Ser Gly Lys Asp
505560
Leu Gly Val Arg Pro Ser Tyr Ala Val Glu Ser Asp Gly Ser Gln Lys
65707580
Ile Asn Phe Leu Glu Tyr Asn Ser Gly Tyr Gly Ile Ala Asp Thr Asn
859095
Thr Ile Gln Val Tyr Val Ile Asp Pro Asp Thr Gly Asn Asn Phe Ile
100 105 110
Val Ala Gln Trp Asn Tyr Leu Glu Gln Lys Leu Ile Ser Glu Glu Asp
115 120 125
Leu Asn Ser Ala Val Asp His His His His His His
130 135 140
- 谷氨酰胺作为活性成分在制备银屑病治疗药物中的应用、银屑病治疗药物及其制备方法
- 磷脂酰乙醇胺作为活性成分在制备银屑病治疗药物中的应用、银屑病治疗药物及其制备方法
