VHPK多肽修饰的荧光纳米脂质体给药系统、其制备方法及应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及纳米生物材料领域,特别涉及一种VHPK多肽修饰的荧光纳米脂质体给药系统、其制备方法及应用。
背景技术
心血管疾病(CVD)是威胁人类生存健康的主要杀手,目前已经成为世界上发病率及致死率最高的疾病之一。最新的流行病学调查研究显示中国心血管病患病率仍然处于持续上升阶段,目前国内患心血管病的总人数约3.3亿,并且心血管病死亡率占居民总体死亡原因的首位,远高于肿瘤及其他疾病。据推测,我国心血管病患病人数在今后10年中仍将快速增长,严重威胁人民生命健康。国内外已有大量研究证实动脉粥样硬化(AS)是脑血管病、冠心病和外周动脉疾病等缺血性心脑血管病的共同病理学基础。因为AS的显著特征是斑块的形成,而斑块的生长或破裂将会引起血管阻塞与血栓形成,最终导致严重的血管病变及受累器官缺血,对患者的生命健康造成严重的危害。虽然高危AS患者的预后十分凶险,但是AS进展缓慢,理论上为诊疗提供了重要的时间窗口。AS的发生最早始于青春期,但是早期AS患者一般不会出现相应的临床症状,这阻碍了对AS患者的早期筛查与预防,并且现阶段筛查CVD的早期指标,如脂蛋白、血糖、血压和体重,都只是监测AS的危险因素,并不能准确反应早期AS的微小病灶,具有一定的滞后性,灵敏度较差。
分子成像通过灵敏地检测易损斑块成分,能够更准确地诊断AS斑块,并且它还提供对药物干预的更全面的跟踪和评估。近红外II区(NIR-II,1100-1700nm)荧光成像因具有背景信号干扰小、空间分辨率和成像灵敏度高等优点,已成为非侵入性的分子影像探针研究领域的最新热点。
近红外荧光成像因灵敏度高、辐射低而且价格低廉,对AS的诊断具有重要意义。NIR-II荧光成像是当前分子影像技术领域的研究热点,由于生物组织对光子的吸收和散射及自发荧光会随着波长的增加而减弱,因此NIR-II区域荧光成像可以实现活体内深层次、高质量的成像,从而大大弥补了可见光和NIR-I区域荧光成像存在的不足。因此,研发具有NIR-II荧光成像功能的分子影像探针是实现早期AS分子检测的有效途径。在众多NIR-II分子影像探针中,苯并双噻二唑(BBTD)类作为一种强效吸电子基团被广泛用于构筑D-A-D型有机小分子NIR-II荧光探针,其中BBT-2FT因具有窄带隙、光声信号强、光热转换效率高、背景信号干扰小和成像灵敏度高等优点,已成为NIR-II分子影像探针研究领域的最新热点。
在AS疾病的进展中存在众多靶点可用于纳米粒的主动靶向设计。其中,血管细胞粘附因子-1(VCAM-1)的高表达是筛查早期AS病变的可靠靶点。大量研究报道已经证实VCAM-1是血管炎症和内皮细胞功能失调的潜在标志,并且在早期AS的单核细胞募集过程中起着不可或缺的作用。与此同时,在早期AS炎症内皮细胞中VCAM-1高度表达,因此,VCAM-1是AS分子成像或药物靶向递送的可靠靶点。然而,VCAM-1的常规血清检测难以判断其组织来源,且无法获得其分子层面的生物学信息,难以真正达到早期精确筛查的目的。因此,寻找有效手段特异性识别追踪体内的VCAM-1,从分子层面监测其信号变化,在发病前检出异常,有望实现AS的早期精确诊断。
纳米脂质体相比其他纳米载体(如胶束和乳剂等)具有更好的生物相容性、更高的细胞亲和性以及同时负载水溶性和脂溶性药物等不可替代的优势,已被广泛应用于药物控制和基因载体等多个领域。因此,搭载BBT-2FT的纳米脂质体是一种理想的具有NIR-II成像功能的分子影像探针。为了提高对VCAM-1的主动靶向效率,靶向多肽具有选择性高、免疫原性低、生物相容性好、穿透性强、合成修饰方法易操作等优点,已被广泛用于构建主动靶向药物传递系统。其中VHPKQHR(VHPK)是研究者们利用噬菌体筛选出的针对VCAM-1的特异性靶向多肽。VHPK作为一种线性多肽亲和配体,它与体内VCAM-1的已知配体VLA-4具有较高的序列同源性。研究报道已经证实,高表达VCAM-1的内皮细胞对VHPK修饰纳米粒的结合和内化率比一般的纳米粒子高20倍。经VHPK修饰的纳米粒能高效检测到人颈动脉AS样本中炎症内皮细胞VCAM-1的高表达。因此利用实时高清晰度的VHPK功能化的近红外荧光纳米脂质体,实现显像剂在AS病灶部位的高度蓄积,以实现对早期AS斑块的实时高精度分子成像,从而获得更全面有效的实时诊断信息,有望真正实现早期AS的精准筛查,但现在未见公开可靠的方案。
发明内容
本发明所要解决的技术问题在于针对上述现有技术中的不足,提供一种VHPK多肽修饰的荧光纳米脂质体给药系统、其制备方法及应用。
为解决上述技术问题,本发明采用的技术方案是:提供一种VHPK多肽修饰的荧光纳米脂质体给药系统,包括:该给药系统为搭载荧光探针且修饰有VHPK多肽的纳米脂质体,其中:
所述荧光探针为近红外一区荧光纳米探针DiR,对应的给药系统记为:VHPK-Lipo@DiR,制备给药系统VHPK-Lipo@DiR的各原料的摩尔比为VHPKQHR:TCEP:DPPC:胆固醇:DSPE-PEG2k:DSPE-PEG2K-MAL:DiR=1~4:1~5:3~9:2~6:0.5~2:0.1~1:0.001~0.1;
或者,所述荧光探针为近红外二区荧光纳米探针BBT-2FT,对应的给药系统记为:VHPK-Lipo@BBT-2FT,制备给药系统VHPK-Lipo@BBT-2FT的各原料的摩尔比为VHPKQHR:TCEP:DPPC:胆固醇:DSPE-PEG2k:DSPE-PEG2K-MAL:BBT-2FT=0.5~2:1~5:3~9:2~6:0.5~2:0.1~1:0.01~1。
优选的是,制备给药系统VHPK-Lipo@DiR的各原料的摩尔比为VHPKQHR:TCEP:DPPC:胆固醇:DSPE-PEG2k:DSPE-PEG2K-MAL:DiR=2:3:6:4:1:0.2:0.01;
给药系统VHPK-Lipo@DiR中,修饰有VHPK多肽的纳米脂质体的质量百分比为99.57%,荧光纳米探针DiR的质量百分比为0.43%。
优选的是,所述给药系统VHPK-Lipo@DiR的制备方法包括以下步骤:
1)采用薄膜分散法制备VHPK-Lipo@DiR脂质体粗产物;
2)对VHPK-Lipo@DiR脂质体粗产物进行柱纯化,得到所述给药系统VHPK-Lipo@DiR。
优选的是,所述给药系统VHPK-Lipo@DiR的制备方法包括以下步骤:
1)采用薄膜分散法制备VHPK-Lipo@DiR脂质体粗产物:
1-1)按摩尔配比将DPPC、胆固醇、DSPE-PEG2k、DSPE-PEG2K-MAL和DiR溶于三氯甲烷中,40℃~50℃搅拌水化10~60分钟,得到脂质体溶液;
1-2)制备TCEP溶液,并用NaHCO
1-3)将VHPK多肽溶解在PBS溶液中,然后按照摩尔比将得到的VHPK多肽溶液与TCEP溶液混合,在室温下反应10~60分钟,得到活化的VHPK多肽溶液;
1-4)将活化的VHPK多肽溶液加入到步骤1-1)制得的脂质体溶液中,室温下反应2-6小时或是4℃下过夜,得到VHPK-Lipo@DiR脂质体粗产物。
2)对VHPK-Lipo@DiR脂质体粗产物进行柱纯化,得到所述给药系统VHPK-Lipo@DiR。
优选的是,所述给药系统VHPK-Lipo@DiR的制备方法包括以下步骤:
1)采用薄膜分散法制备VHPK-Lipo@DiR脂质体粗产物:
1-1)按摩尔配比将DPPC、胆固醇、DSPE-PEG2k、DSPE-PEG2K-MAL和DiR溶于三氯甲烷中,45℃搅拌水化30分钟,得到脂质体溶液;
1-2)制备TCEP溶液,并用NaHCO
1-3)将VHPK多肽溶解在PBS溶液中,然后按照摩尔比将得到的VHPK多肽溶液与TCEP溶液混合,在室温下反应30分钟,得到活化的VHPK多肽溶液;
1-4)将活化的VHPK多肽溶液加入到步骤1-1)制得的脂质体溶液中,4℃过夜,得到VHPK-Lipo@DiR脂质体粗产物。
2)采用G-100sephadex柱对VHPK-Lipo@DiR脂质体粗产物进行纯化,得到所述给药系统VHPK-Lipo@DiR。
优选的是,制备给药系统VHPK-Lipo@BBT-2FT的各原料的摩尔比为VHPKQHR:TCEP:DPPC:胆固醇:DSPE-PEG2k:DSPE-PEG2K-MAL:BBT-2FT=1:2:6:4:1:0.2:0.09;
给药系统VHPK-Lipo@BBT-2FT中,修饰有VHPK多肽的纳米脂质体的质量百分比为99.57%,荧光纳米探针BBT-2FT的质量百分比为0.43%。
优选的是,所述给药系统VHPK-Lipo@BBT-2FT的制备方法包括以下步骤:
1)采用薄膜分散法制备VHPK-Lipo@BBT-2FT脂质体粗产物:
1-1)按摩尔配比将DPPC、胆固醇、DSPE-PEG2k、DSPE-PEG2K-MAL和BBT-2FT溶于三氯甲烷中,40℃~50℃搅拌水化10~60分钟,得到脂质体溶液;
1-2)制备TCEP溶液,并用NaHCO
1-3)将VHPK多肽溶解在PBS溶液中,然后按照摩尔比将得到的VHPK多肽溶液与TCEP溶液混合,在室温下反应10~60分钟,得到活化的VHPK多肽溶液;
1-4)将活化的VHPK多肽溶液加入到步骤1-1)制得的脂质体溶液中,室温下反应2-6小时或是4℃下过夜,得到VHPK-Lipo@BBT-2FT脂质体粗产物。
2)对VHPK-Lipo@BBT-2FT脂质体粗产物进行柱纯化,得到所述给药系统VHPK-Lipo@BBT-2FT。
优选的是,所述给药系统VHPK-Lipo@BBT-2FT的制备方法包括以下步骤:
1)采用薄膜分散法制备VHPK-Lipo@BBT-2FT脂质体粗产物:
1-1)按摩尔配比将DPPC、胆固醇、DSPE-PEG2k、DSPE-PEG2K-MAL和BBT-2FT溶于三氯甲烷中,45℃搅拌水化30分钟,得到脂质体溶液;
1-2)制备TCEP溶液,并用NaHCO
1-3)将VHPK多肽溶解在PBS溶液中,然后按照摩尔比将得到的VHPK多肽溶液与TCEP溶液混合,在室温下反应30分钟,得到活化的VHPK多肽溶液;
1-4)将活化的VHPK多肽溶液加入到步骤1-1)制得的脂质体溶液中,4℃过夜,得到VHPK-Lipo@BBT-2FT脂质体粗产物。
2)采用G-100sephadex柱对VHPK-Lipo@BBT-2FT脂质体粗产物进行纯化,得到所述给药系统VHPK-Lipo@BBT-2FT。
本发明还提供一种如上的给药系统VHPK-Lipo@DiR的应用,其用于分子水平的近红外一区荧光成像。
本发明还提供一种如上的给药系统VHPK-Lipo@BBT-2FT的应用,其用于分子水平的近红外二区荧光成像。
本发明的有益效果是:
本发明采用薄膜分散法分别制备VHPK多肽修饰的近红外一区DiR和近红外二区BBT-2FT荧光探针脂质体。该纳米给药系统通过多肽VHPK,能特异性的靶向动脉粥样硬化血管内皮高表达的VCAM-1。因此可以通过对动脉粥样硬化血管内皮组织高表达的VCAM-1的特异性识别来实现近红外荧光成像探针在靶部位的高度蓄积,从而能分别实现动脉粥样硬化的近红外一区和二区光学成像诊断,进而获得更全面更及时的诊断信息,能为实现动脉粥样硬化的早期精准筛查提供可能。
附图说明
图1是实施例1中的VHPK多肽修饰近红外一区荧光纳米脂质体给药系统VHPK-Lipo@DiR的透射电镜观察结果;
图2是实施例1中的VHPK多肽修饰近红外一区荧光纳米脂质体给药系统VHPK-Lipo@DiR的表面电位结果图;
图3是实施例1中的VHPK多肽修饰近红外一区荧光纳米脂质体给药系统VHPK-Lipo@DiR在NIR-I的成像照片;
图4是实施例2中的VHPK多肽修饰近红外二区荧光纳米脂质体给药系统VHPK-Lipo@BBT-2FT的透射电镜观察结果;
图5是实施例2中的VHPK多肽修饰近红外二区荧光纳米脂质体给药系统VHPK-Lipo@BBT-2FT的表面电位结果图;
图6是实施例2中的VHPK多肽修饰近红外二区荧光纳米脂质体给药系统VHPK-Lipo@BBT-2FT在NIR-II的成像照片。
具体实施方式
下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。
下列实施例中所使用的试验方法如无特殊说明,均为常规方法。下列实施例中所用的材料试剂等,如无特殊说明,均可从商业途径得到。下列实施例中未注明具体条件者,按照常规条件或者制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明提供一种VHPK多肽修饰的荧光纳米脂质体给药系统,包括:该给药系统为搭载荧光探针且修饰有VHPK多肽的纳米脂质体,其中:
所述荧光探针为近红外一区荧光纳米探针DiR,对应的给药系统记为:VHPK-Lipo@DiR,制备给药系统VHPK-Lipo@DiR的各原料的摩尔比为VHPKQHR:TCEP:DPPC:胆固醇:DSPE-PEG2k:DSPE-PEG2K-MAL:DiR=1~4:1~5:3~9:2~6:0.5~2:0.1~1:0.001~0.1;
或者,所述荧光探针为近红外二区荧光纳米探针BBT-2FT,对应的给药系统记为:VHPK-Lipo@BBT-2FT,制备给药系统VHPK-Lipo@BBT-2FT的各原料的摩尔比为VHPKQHR:TCEP:DPPC:胆固醇:DSPE-PEG2k:DSPE-PEG2K-MAL:BBT-2FT=0.5~2:1~5:3~9:2~6:0.5~2:0.1~1:0.01~1。
其中,VHPKQHR是一种精准定位动脉粥硬化斑块的特异性靶向多肽,动脉粥样硬化斑块对VHPKQHR修饰纳米粒的结合和内化率比一般的纳米粒子高20倍。TCEP是一种非常有效的硫醇类还原剂,广泛用作蛋白质化学及蛋白质组学研究中二硫键的定量还原剂,在本发明中TCEP可以很好的保护VHPKQHR中的二硫键以发挥其特异性靶向特性。
其中,DPPC、胆固醇和DSPE-PEG2k是构成脂质体磷脂双分子层的常用配方成分。DPPC是药物制剂领域应用较为广泛的一种合成磷脂,可用于脂质体或温敏脂质体,以及特殊脂微球、药物复合物等药物制剂。胆固醇是脂质体制备的重要成分,在维持脂质体结构方面发挥着重要作用,可影响膜的通透性、流动性以及磷脂之间的相互作用,胆固醇含量与磷脂的紧密包装、疏水空间和磷脂之间的合作程度有关,这可能导致结构的变化。DSPE-PEG2k同样具有稳定脂质体的作用,此外,由于其减少脂质体被网状内皮系统清除的时间,从而延长了血液循环时间。DSPE-PEG2K-MAL是反应性磷脂PEG试剂之一,可以和VHPKQHR的巯基(硫醇,-SH)反应,从而使多肽与脂质体得到稳定的连接修饰。
其中,DiR作为一类环境敏感型荧光染料,主要用于标记细胞膜以及其他脂溶性生物结构,一旦进入细胞后,它们在细胞内质膜中逐步扩散,于最佳浓度条件下可将整个细胞均匀染色。DiR可作为近红外第一区域的生物医学成像,其结构式如下式1所示:
其中,BBT-2FT在近红外第二区域(NIR-Ⅱ,1000~1700nm)的生物医学成像可以充分提高时空分辨率(~20ms和~25mm)和穿透深度(~3cm),因为其具有散射更少、组织吸收可忽略不计和自荧光效应最小化的优点,从而获得更好的图像质量。
在荧光纳米脂质体给药系统的结构体系中,类似于细胞膜的脂质体的磷脂双分子层结构均匀包裹在纳米脂质体外侧,而脂溶性的DiR或BBT-2FT探针嵌顿于疏水性的磷脂双分子层之间,磷脂双分子层包裹的纳米粒内部形成亲水性的腔,有利于负载亲水性的药物。
VHPKQHR:TCEP:DPPC:胆固醇:DSPE-PEG2k:DSPE-PEG2K-MAL:DiR=1~4:1~5:3~9:2~6:0.5~2:0.1~1:0.001~0.1;
本发明还提供所述给药系统VHPK-Lipo@DiR的制备方法,具体包括以下步骤:
1)采用薄膜分散法制备VHPK-Lipo@DiR脂质体粗产物:
1-1)按摩尔配比将DPPC、胆固醇、DSPE-PEG2k、DSPE-PEG2K-MAL和DiR(3~9:2~6:0.5~2:0.1~1:0.001~0.1)溶于1-6mL三氯甲烷中,40℃~50℃搅拌水化10~60分钟,得到脂质体溶液;
1-2)在脂质体水化过程中,制备TCEP溶液(将TCEP溶剂于去离子水中得到),并用NaHCO
1-3)将VHPK多肽溶解在PBS溶液中,然后按照摩尔比(VHPKQHR:TCEP=1~4:1~5)将得到的VHPK多肽溶液与TCEP溶液混合,在室温下反应10~60分钟,以还原VHPK多肽的二硫键,得到活化的VHPK多肽溶液;
其中,TCEP还原二硫键的机理是其中心原子“P”所带的孤电子对能与氧原子形成配位共价结合而具有还原性,生成的产物几乎没有与其它氨基酸的副反应,是被公认的最好的二硫键的还原试剂;
1-4)将活化的VHPK多肽溶液加入到步骤1-1)制得的脂质体溶液中,室温下反应2-6小时或是4℃下过夜,得到VHPK-Lipo@DiR脂质体粗产物,其反应原理是脂质体成分DSPE-PEG2K-MAL中的马来酰亚胺可以和VHPKQHR的巯基(硫醇,-SH)反应形成稳定的巯醚键,从而使多肽与脂质体得到稳定的连接修饰。
2)采用G-100sephadex柱对VHPK-Lipo@DiR脂质体粗产物进行纯化,除去未结合的VHPK多肽、脂质体或DiR等成分,最终得到所述给药系统VHPK-Lipo@DiR。
本发明还提供所述给药系统VHPK-Lipo@BBT-2FT的制备方法,具体包括以下步骤:
1)采用薄膜分散法制备VHPK-Lipo@BBT-2FT脂质体粗产物:
1-1)按摩尔配比将DPPC、胆固醇、DSPE-PEG2k、DSPE-PEG2K-MAL和BBT-2FT(3~9:2~6:0.5~2:0.1~1:0.001~0.1)溶于1-5mL三氯甲烷中,40℃~50℃搅拌水化10~60分钟,得到脂质体溶液;
1-2)制备TCEP溶液,并用NaHCO
1-3)将VHPK多肽溶解在PBS溶液中,然后按照摩尔比将得到的VHPK多肽溶液与TCEP溶液混合,在室温下反应10~60分钟,得到活化的VHPK多肽溶液;
1-4)将活化的VHPK多肽溶液加入到步骤1-1)制得的脂质体溶液中,室温下反应2-6小时或是4℃下过夜,得到VHPK-Lipo@BBT-2FT脂质体粗产物。
2)采用G-100sephadex柱对VHPK-Lipo@BBT-2FT脂质体粗产物进行纯化,除去未结合的VHPK多肽、脂质体或BBT-2FT等成分,最终得到所述给药系统VHPK-Lipo@BBT-2FT。
本发明还提供一种如上的给药系统VHPK-Lipo@DiR的应用,其用于分子水平的近红外一区荧光成像,通过其表面修饰的VHPK与动脉粥样硬化血管内皮高表达的VCAM-1蛋白的特异性结合,能实现对动脉粥样硬化在分子水平的NIR-I荧光成像。
本发明还提供一种如上的给药系统VHPK-Lipo@BBT-2FT的应用,其用于分子水平的近红外二区荧光成像,通过其表面修饰的VHPK与动脉粥样硬化血管内皮高表达的VCAM-1蛋白的特异性结合,实现对动脉粥样硬化在分子水平的NIR-II荧光成像。
本发明采用薄膜分散法分别制备VHPK多肽修饰的近红外一区DiR和近红外二区BBT-2FT荧光探针脂质体。该纳米给药系统通过多肽VHPK,能特异性的靶向动脉粥样硬化血管内皮高表达的VCAM-1。因此可以通过对动脉粥样硬化血管内皮组织高表达的VCAM-1的特异性识别来实现近红外荧光成像探针在靶部位的高度蓄积,从而能分别实现动脉粥样硬化的近红外一区和二区光学成像诊断,进而获得更全面更及时的诊断信息,能为实现动脉粥样硬化的早期精准筛查提供可能。
以上为本发明的总体构思,以下在其基础上提供详细的实施例,以对本发明做进一步说明。
实施例一给药系统VHPK-Lipo@DiR
该给药系统VHPK-Lipo@DiR中,修饰有VHPK多肽的纳米脂质体的质量百分比为99.57%,荧光纳米探针DiR的质量百分比为0.43%;制备给药系统VHPK-Lipo@DiR的各原料的摩尔比为VHPKQHR:TCEP:DPPC:胆固醇:DSPE-PEG2k:DSPE-PEG2K-MAL:DiR=2:3:6:4:1:0.2:0.01;
具体的制备方法包括以下步骤:
1)采用薄膜分散法制备VHPK-Lipo@DiR脂质体粗产物:
1-1)按摩尔配比将DPPC、胆固醇、DSPE-PEG2k、DSPE-PEG2K-MAL和DiR(6:4:1:0.2:0.01)常温下溶于3mL三氯甲烷中,45℃搅拌水化30分钟,得到脂质体溶液;
1-2)在脂质体水化过程中,将TCEP溶于去离子水中制备TCEP溶液,并用NaHCO
1-3)将VHPK多肽溶解在PBS溶液中,然后按照摩尔比将得到的VHPK多肽溶液与TCEP溶液混合(VHPKQHR:TCEP=2:3),在室温下反应30分钟以破坏双硫键,得到活化的VHPK多肽溶液;
1-4)将活化的VHPK多肽溶液加入到步骤1-1)制得的脂质体溶液中,4℃过夜,得到VHPK-Lipo@DiR脂质体粗产物。
2)采用G-100sephadex柱对VHPK-Lipo@DiR脂质体粗产物进行纯化,得到所述给药系统VHPK-Lipo@DiR。
采用薄膜分散法制备对照组Lipo@DiR(即不修饰VHPK但搭载荧光探针的纳米脂质体):将DPPC、胆固醇、DSPE-PEG2k、DSPE-PEG2K-MAL和DiR(摩尔比为6:4:1:0.2:0.01)常温溶于3mL三氯甲烷中,45℃搅拌水化30分钟,4℃过夜;最终采用G-100sephadex柱纯进行纯化,得到对照组Lipo@DiR。
以下进行相关测试实验:
1、采用透射电子显微镜对VHPK-Lipo@DiR纳米粒进行表观形貌观察:
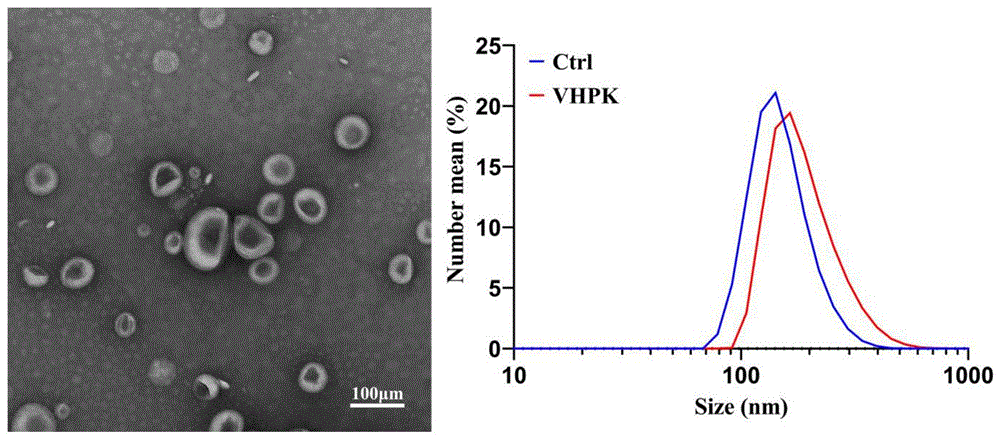
称取一定纳米粒分散于去三氯甲烷中得到浓度为0.1mg/mL的纳米粒溶液,再将样品滴于覆盖有碳膜的铜网上,在室温下晾干后通过透射电镜(80kV)可观察到纳米粒形态呈规则圆形,且粒径大小约为175nm。如图1所示。
2、采用Nano-ZS90型激光纳米粒度仪来测定在常温下VHPK-Lipo@DiR纳米给药系统的Zeta电位大小,每个样品重复测定3次取其平均值。经测定,VHPK-Lipo@DiR(VHPK)和Lipo@DiR(Ctrl)纳米颗粒表面电位约为-0.5mV和-2.9mV。如图2所示。
3、VHPK-Lipo@DiR针对动脉粥样硬化的NIR-I体内靶向性探究,主要分以下四步:
第一步构建早期AS动物模型,采用6周龄雄性SPF级ApoE-/-基因敲除小鼠及C57小鼠,给予高脂饲料(含1%胆固醇,15%猪油,0.25%胆酸钠,5%蛋黄粉,2.5%糖和基础饮食)喂养8周,构建早期AS动物模型。
第二步,分别设置VHPK-Lipo@DiR和Lipo@DiR两个分组,每组采用尾静脉注射方法分别注射上述纳米制剂0.1mL,在不同时间点(0和8h)进行NIR-I光学成像。利用近红外荧光光谱仪明确血管自身生物荧光信号与NIR-I荧光成像信号的吻合程度,重点观察VHPK-Lipo@DiR对AS的早期诊断效能,以ApoE
第三步,采用主动脉离体实验法获取心血管,在每个时间点(0和8h)取造模小鼠,腹腔注射3%戊巴比妥钠(60mg·kg
第四步,采用主动脉离体大体油红染色法,评估血管内动脉粥样硬化斑块的具体位置,油红O(ORO)染色试剂与蒸馏水按3:2的比例混合,用慢滤膜过滤后备用。将主动脉弓至髂血管纵行切开,内膜朝外,样本经ORO溶液染色30分钟,并在室温下80%异丙醇脱色30秒,最后用PBS洗涤5分钟。通过大体ORO染色评估整个主动脉斑块的范围,研究结果显示,主动脉内AS斑块主要发生于冠状动脉(心脏与胸主动脉连接处)和肝腹主动脉分叉处(图3C),这与Lipo@DiR(VHPK)在NIR-Ⅰ荧光成像仪观察下对主动脉AS斑块的主动靶向富集部位高度一致(图3B和C)。此结果进一步为VHPK多肽修饰近红外一区荧光纳米脂质体给药系统的可视化诊疗提供了扎实的实验基础。
实施例二给药系统VHPK-Lipo@BBT-2FT
该给药系统VHPK-Lipo@DiR中,修饰有VHPK多肽的纳米脂质体的质量百分比为99.57%,荧光纳米探针DiR的质量百分比为0.43%;该给药系统VHPK-Lipo@BBT-2FT的各原料的摩尔比为VHPKQHR:TCEP:DPPC:胆固醇:DSPE-PEG2k:DSPE-PEG2K-MAL:BBT-2FT=1:2:6:4:1:0.2:0.09;
该给药系统VHPK-Lipo@BBT-2FT的制备方法包括以下步骤:
1)采用薄膜分散法制备VHPK-Lipo@BBT-2FT脂质体粗产物:
1-1)按摩尔配比将DPPC、胆固醇、DSPE-PEG2k、DSPE-PEG2K-MAL和BBT-2FT(6:4:1:0.2:0.09)常温下溶于3mL三氯甲烷中,45℃搅拌水化30分钟,得到脂质体溶液;
1-2)制备TCEP溶液,并用NaHCO
1-3)将VHPK多肽溶解在PBS溶液中,然后按照摩尔比将得到的VHPK多肽溶液与TCEP溶液混合(VHPKQHR:TCEP=1:2),在室温下反应30分钟,得到活化的VHPK多肽溶液;
1-4)将活化的VHPK多肽溶液加入到步骤1-1)制得的脂质体溶液中,4℃过夜,得到VHPK-Lipo@BBT-2FT脂质体粗产物。
2)采用G-100sephadex柱对VHPK-Lipo@BBT-2FT脂质体粗产物进行纯化,得到所述给药系统VHPK-Lipo@BBT-2FT。
制备对照组Lipo@BBT-2FT:采用薄膜分散法制备Lipo@BBT-2FT。将DPPC、胆固醇、DSPE-PEG2k、DSPE-PEG2K-MAL和BBT-2FT(6:4:1:0.2:0.09)常温溶于3mL三氯甲烷中,45℃搅拌水化30分钟,4℃过夜;采用G-100sephadex柱纯化进行纯化,得到对照组Lipo@BBT-2FT。
以下进行相关测试实验:
1、采用透射电子显微镜对VHPK-Lipo@BBT-2FT纳米粒进行表观形貌观察:
称取一定纳米粒分散于去三氯甲烷中得到浓度为0.1mg/mL的纳米粒溶液,再将样品滴于覆盖有碳膜的铜网上,在室温下晾干后通过透射电镜(80kV)可观察到纳米粒形态呈规则圆形,且粒径大小约为165nm。如图4所示。
2、采用Nano-ZS90型激光纳米粒度仪来测定在常温下VHPK-Lipo@BBT-2FT纳米给药系统的Zeta电位大小,每个样品重复测定3次取其平均值。经测定,VHPK-Lipo@BBT-2FT(VHPK)和Lipo@BBT-2FT(Ctrl)纳米颗粒表面电位约为-2.5mV和-2.2mV。如图5所示。
3、VHPK-Lipo@BBT-2FT针对动脉粥样硬化的NIR-Ⅱ体内靶向性探究,主要分以下四步:
第一步构建早期AS动物模型,采用6周龄雄性SPF级ApoE
第二步,分别设置VHPK-Lipo@BBT-2FT和Lipo@BBT-2FT两个分组,每组采用尾静脉注射方法分别注射上述纳米制剂0.1mL,在不同时间点(0和8h)进行NIR-Ⅱ光学成像。利用近红外荧光光谱仪明确血管自身生物荧光信号与NIR-Ⅱ荧光成像信号的吻合程度,重点观察VHPK-Lipo@BBT-2FT对AS的早期诊断效能,以ApoE
第三步,采用主动脉离体实验法获取心血管,在每个时间点(0和8h)取造模小鼠,腹腔注射3%戊巴比妥钠(60mg·kg
第四步,采用主动脉离体大体油红染色法,评估血管内动脉粥样硬化斑块的具体位置,油红O(ORO)染色试剂与蒸馏水按3:2的比例混合,用慢滤膜过滤后备用。将主动脉弓至髂血管纵行切开,内膜朝外,样本经ORO溶液染色30分钟,并在室温下80%异丙醇脱色30秒,最后用PBS洗涤5分钟。通过大体ORO染色评估整个主动脉斑块的范围,研究结果显示,主动脉内AS斑块主要发生于冠状动脉(心脏与胸主动脉连接处)和肝腹主动脉分叉处(图6C),这与Lipo@BBT-2FT(VHPK)在NIR-Ⅱ荧光成像仪观察下对主动脉AS斑块的主动靶向富集部位高度一致(图6B和C)。此结果进一步为VHPK多肽修饰近红外二区荧光纳米脂质体给药系统的可视化诊疗提供了扎实的实验基础。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节。
