来自枯草芽孢杆菌的裂解性多糖单加氧酶及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于酶学领域,具体涉及一种来自枯草芽孢杆菌的裂解性多糖单加氧酶及其应用。
背景技术
植物木质纤维素是自然界中最丰富的生物质来源,年产量约为10
最近发现,裂解性多糖单加氧酶(LPMOs,EC 1.14.99.53-56)作为一种新型氧化酶,可催化顽固多糖的氧化裂解。LPMO是铜离子依赖性酶家族,可提高传统GHs的生物质解聚效率,并通过氧化和裂解多糖底物促进天然碳循环。根据碳水化合物活性酶数据库(CAZy,http://www.cazy.org/),LPMO被归类为辅助活性家族(AAs)(Levasseur,Drula,Lombard,Coutinho,&Henrissat,2013)。迄今为止,在细菌、真菌、病毒、昆虫和古生菌中发现了大量作用于纤维素、几丁质、淀粉和其他多糖底物的LPMO(Lombard,GolacondaRamulu,Drula,Coutinho,&Henrissat,2014)。根据其序列和底物特异性分为8个家族,AA9-11和AA13-17。大多数LPMO为β-折叠拓扑结构,其中某些LPMO为β-折叠通过可变长度的环状结构连接(Hemsworth,Henrissat,Davies,&Walton,2014;Harris et al.,2010;Leggio etal.,2015)。鉴于其平坦的底物结合表面,这些酶适用于结晶多糖的结合和裂解,为GHs的后续水解提供更多的进攻位点(Hemsworth,Johnston,Davies,&Walton,2015;Johansen,2016;Zhang et al.,2019)。
在过去十年中,人们在挖掘和表征纤维素和几丁质活性LPMO方面做出了巨大努力(Forsberg et al.,2014;Nakagawa et al.,2015;Paspaliari,Loose,Larsen,&Vaaje-Kolstad,2015)。相比之下,作用于植物木质纤维素两种主要半纤维素成分催化木聚糖(Correa et al.,2019;Couturier et al.,2018;
大多数芽孢杆菌属物种是非致病性的,并且一直是异源蛋白质表达的有吸引力的宿主,这主要是因为它们能够分泌功能性酶。在所有芽孢杆菌中,枯草芽孢杆菌被美国食品和药物管理局(FDA)普遍认为是安全的(GRAS)。作为益生菌,枯草芽孢杆菌在人类和动物的胃肠道健康中发挥着重要作用。例如,枯草芽孢杆菌改善了家禽的生长性能、免疫反应、热应激耐受性和抗病性(Wang et al.,2022)。同时,该微生物已被证实可以改善瘤胃发育和新生荷斯坦犊牛的健康状况(Wang et al.,2022)。因此,从枯草芽孢杆菌中挖掘新型LPMO将具有重要意义。
发明内容
本发明所要解决的技术问题为:如何从枯草芽孢杆菌中挖掘新型LPMO。
本发明的技术方案为:一种来自枯草芽孢杆菌的裂解性多糖单加氧酶BsLPMO10A,由455个氨基酸残基构成,其氨基酸序列如SEQ ID No.1所示。
编码上述裂解性多糖单加氧酶BsLPMO10A的基因,由于密码子的简并性,存在多种不同的编码序列。
进一步地,所述基因的核苷酸序列如SEQ ID No.2所示。
一种表达载体,含有上述所述的基因。
一种重组菌,含有上述所述的表达载体。
本发明的裂解性多糖单加氧酶BsLPMO10A在促进半纤维素底物降解上的应用。
进一步地,所述半纤维素底物为地衣多糖、β-葡聚糖、刺槐豆胶、魔芋葡甘露聚糖、山毛榉木木聚糖和甜菜碱阿拉伯糖。
本发明的裂解性多糖单加氧酶BsLPMO10A在促进多糖底物β-1,4糖苷键断裂上的应用。
本发明的裂解性多糖单加氧酶BsLPMO10A在与糖苷水解酶协同促进多糖的分解上的应用。
缩略语和关键术语定义
AA 辅助活性家族
BX 山毛榉木聚糖
CAZy 水化合物活性酶数据库
DNS3,5-二硝基水杨酸
FDA美国食品和药物管理局
FNⅢ 纤连蛋白Ⅲ型
GHs糖苷水解酶
GRAS 普遍认为安全
HPAEC-PAD脉冲安培检测器离子色谱
HRP辣根过氧化物酶(HRP
IPTG 异丙基硫代-β-D-吡喃半乳糖苷
KGM魔芋葡甘露聚糖
LBG刺槐豆胶
MALDI-TOF-MS 基质辅助激光解析电离飞行时间质谱
MCC微晶纤维素
MLG-B大麦β-葡聚糖
MLG-L冰岛苔藓地衣多糖
PASC 磷酸溶胀纤维素
PGA柑橘聚半乳糖醛酸
SBA甜菜阿拉伯聚糖
与现有技术相比,本发明具有以下有益效果:
本发明的源自枯草芽孢杆菌(BsLPMO10A)的新型AA10LPMO,对它进行异源表达和功能特征。重组BsLPMO10A在50℃和pH5.0时具有最佳活性。底物特异性研究表明,该酶表现出广泛的活性底物谱,包括MLG-L、MLG-B、LBG、KGM、BX,特别是对于通过β-1,4糖苷键连接的多糖,包括β-(Glc1→4Glc)、β-(Xyl1→4Xyl)和β-(Man1→4Man)。与此同时BsLPMO10A在本研究中首次显示出对阿拉伯聚糖的活性。HPAEC-PAD和MALDI-TOF-MS分析表明,BsLPMO10A主要从混合连接葡聚糖和山毛榉木聚糖中释放聚合度(DP)为3-5的天然寡糖和从DP3ox到DP6ox的C1氧化寡糖。它与一系列糖苷水解酶的协同作用表明BsLPMO10A显着加速了葡聚糖、木聚糖、纤维素和几丁质的糖化。此外,通过六种天然饲料的降解进一步验证了BsLPMO10A和GHs的协同作用。
附图说明
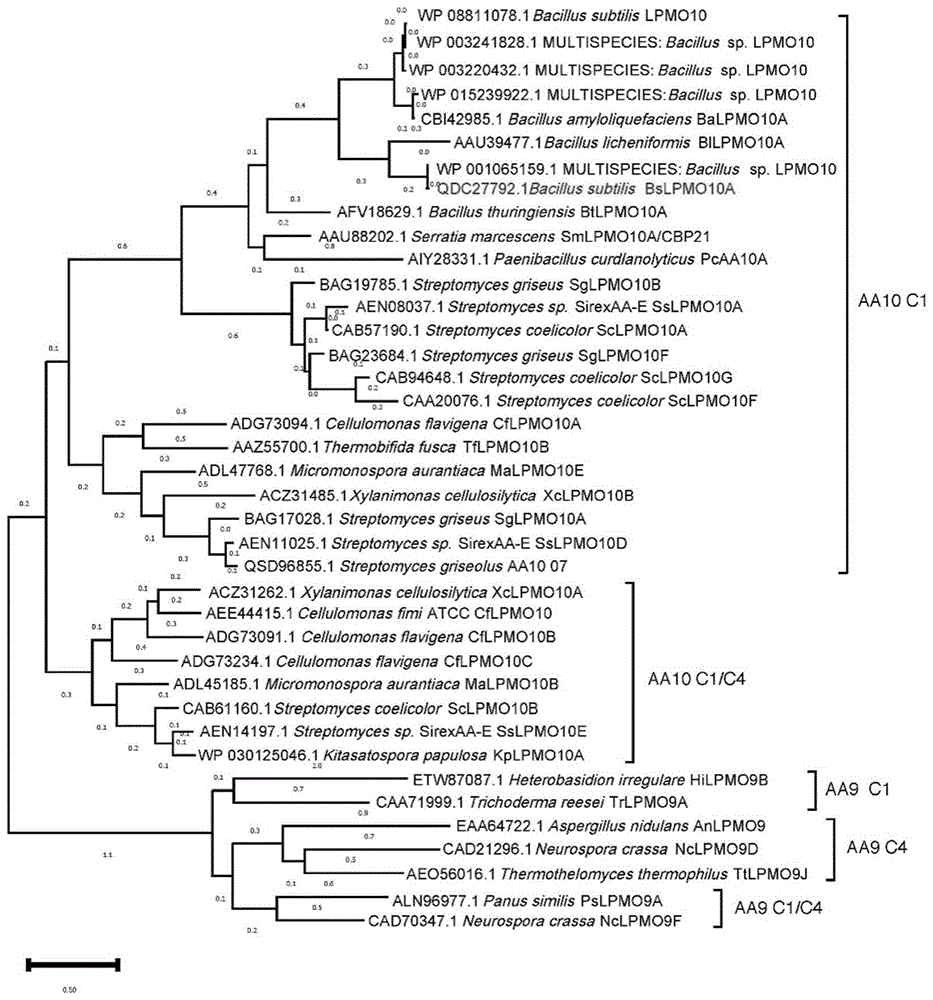
图1.BsLPMO10A和数据库中其他表征的AA10 LPMO的系统发育树。使用MEGA11对功能表征的LPMO进行多序列分析,然后使用构建/测试最大似然法进行系统发育分析。BsLPMO10A(GenBank编号:QDC27792.1)。
图2.SDS-PAGE和酶谱分析。(A)全长BsLPMO10A和(B)BsLPMO10A(CD);泳道M,蛋白Marker。(C)酶谱分析:Ⅰ、MLG-L;Ⅱ、MLG-B;Ⅲ、LBG;Ⅳ、KGM;Ⅴ、BX;Ⅵ、PASC;Ⅶ、胶体几丁质。
图3.BsLPMO10A的生化特征。(A)最适温度和(B)最适pH值。抗坏血酸(C)和H
图4.BsLPMO10A对葡聚糖的降解。(A)BsLPMO10A从MLG-L和MLG-释放的寡糖的HPAEC-PAD色谱图;(B-C)BsLPMO10A对MLG-L(B)和MLG-B(C)释放的寡糖进行MALDI-TOF-MS分析;(D)BsLPMO10A和葡聚糖酶(IDSGLUC5-38)对MLG-L和MLG-B降解产物的HPAEC-PAD色谱图。插图显示了BsLPMO10A和葡聚糖酶(IDSGLUC5-38)从MLG-L和MLG-B得到的天然和C1氧化产物的总和。G1,葡萄糖;G2,纤维二糖;G3,纤维三糖;G4,纤维四糖;G5,纤维五糖;G6,纤维六糖;G1ox,C1-氧化葡萄糖;G2ox。C1-氧化纤维二糖。
图5.BsLPMO10A对BX的降解。(A)BsLPMO10A从BX释放的寡糖的HPAEC-PAD色谱图;(B)BsLPMO10A和木聚糖酶(IDSXYN11-1)对BX降解产物的HPAEC-PAD色谱图。插图显示了由BsLPMO10A和木聚糖酶(IDSXYN11-1)从BX产生的天然产物和C1氧化产物的总和。X1,木糖;X2,木二糖;X3、木三糖;X4,木四糖;X5,木戊糖;X6,木六糖;X1ox,C1-氧化木糖。
图6.BsLPMO10A对其他多糖降解产物的HPAEC-PAD色谱图。(A)KGM和LBG;(B)SBA;(C)果胶和PGA;(D)PASC;(E)几丁质。
图7BsLPMO10A和GHs对多糖降解的协同作用。(A)BsLPMO10A和葡聚糖酶(IDSGLUC5-38)从MLG-L释放的还原糖;(B)BsLPMO10A和木聚糖酶(TfXYN11-1)从BX释放的还原糖;(C)BsLPMO10A和甘露聚糖酶(BsMAN26-3)从LBG释放的还原糖;(D)BsLPMO10A和纤维素酶(IDSGLUC5-11)从PASC释放的还原糖;(E)BsLPMO10A和几丁质酶(BtCHI18-1)从几丁质释放的还原糖。数据代表平均值±SD(n=4)。使用t检验对协同作用和GH单独作用组之间的进行统计分析。*,P<0.05;**,P<0.05;***,P<0.001。
图8.BsLPMO10A和GHs对天然木质纤维素原料降解的协同作用。(A)花生壳;(B)大豆秸秆;(C)羊草秸秆;(D)水稻秸秆;(E)水稻壳;(F)小麦秸秆。数据代表平均值±SD(n=4)。使用Tukey-Kramer检验进行多重比较。大小写字母分别表示纤维素或半纤维素含量差异(P<0.05)。
图9BsLPMO10A的氨基酸比对和结构预测。(A)BsLPMO10A和其他AA10LPMO的氨基酸比对;(B-C)WebLogo分析“组氨酸支架”中涉及的关键残基;(D)BsLPMO10A的同源建模。
具体实施方式
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为从商业渠道购买得到的。
一、菌株、载体和化学品
枯草芽孢杆菌W800N、大肠杆菌BL21(DE3)和pET-30a(+)为常规商品,本实验室保存。冰岛苔藓地衣多糖(MLG-L)、大麦β-葡聚糖(MLG-B)、刺槐豆胶(LBG)、魔芋葡甘露聚糖(KGM)、山毛榉木聚糖(BX)、甜菜阿拉伯聚糖(SBA)、海带多糖、胶体几丁质、约60%的酯化度柑橘果胶、柑橘聚半乳糖醛酸(PGA),寡糖购自Megazyme(Wicklow,Ireland)。磷酸溶胀纤维素(PASC)由微晶纤维素制备(Zhang,Cui,Lynd,&Kuang,2006)。微晶纤维素(MCC)、培养基、卡那霉素和异丙基硫代-β-D-吡喃半乳糖苷(IPTG)购自Sangon(中国上海)。花生壳、大豆秸秆、羊草、水稻秸秆、水稻壳和小麦秸秆采集自当地农场(中国浙江)。
二、实验方法
(1)序列分析
将各枯草芽孢杆菌菌株的全部基因组序列以FASTA格式上传至在线软件dbCANHMMdb v10.0(https://bcb.unl.edu/dbCAN2/blast.php)进行功能注释(Zhang et al.,2018)。然后将从注释结果中获得的候选基因提交到Pfam数据库(http://pfam.xfam.org/search#tabview=tab0),以预测潜在的域和功能。使用Clustal Omega多序列比对程序(http://www.ebi.ac.uk/Tools/msa/clustalo/)对LPMOs进行氨基酸比对。利用I-TASSER服务器(http://zhanglab.ccmb.med.umich.edu/I-TASSER/download/)生成了BsLPMO10A的结构同源模型。利用MEGA 11邻接法构建系统发育树,采用bootstrap法进行系统发育测试,bootstrap复制次数为1000次。取代类型为氨基酸,模型为Jones-Taylor-Thornton(JTT)模型。结果使用ESPript 3.0渲染(Robert&Gouet,2014)。利用WebLogo3对各位点的氨基酸保守序列进行分析(http://weblogo.threeplusone.com/)。
(2)基因克隆、表达、纯化和凝胶电泳
使用快速细菌基因组DNA分离试剂盒(生工,上海,中国)分离来自枯草芽孢杆菌W800N的基因组DNA,并作为BsLPMO10A基因PCR扩增的模板。BsLPMO10A的全长(SEQ IDNo.2)和催化结构域(SEQ ID No.3)均使用BsLPMO10A-SacI和BsLPMO10A-XhoI/BsLPMO10A(CD)-XhoI引物获得(表1)。将所得片段插入到SacI和XhoI之间的pET-30a(+)中,然后通过热激转化到大肠杆菌BL21(DE3)中。重组菌株BL21/pET-30a(+)/BsLPMO10A和BL21/pET-30a(+)/BsLPMO10A(CD)进行IPTG诱导、超声处理和使用配备HisTrap
表1引物列表
注:划线为酶切位点
(3)活性测定
在活性测定之前,BsLPMO10A在冰上于3倍摩尔浓度过量的CuSO
3,5-二硝基水杨酸(DNS)测定:进行了DNS分析(Bailey,Biely,&Poutanen,1992)以确定BsLPMO10A活性。简而言之,将15μL(~1.5μM)纯化酶与60μL 5mg/mL各种多糖底物(MLG-L、MLG-B、LBG、KGM、BX、SBA、海带多糖、PASC、MCC、胶体几丁质、果胶和PGA)溶解在0.05M乙酸钠缓冲液(pH 5.5)中,在37℃和200rpm下反应24h。然后,加入75μL DNS并将溶液煮沸10min。冷却至室温后,使用分光光度法在540nm处测定吸光度。
(4)生化表征
为了估计BsLPMO10A的最适温度,将15μL(~1.5μM)BsLPMO10A与60μL 5mg/mL LBG溶液在不同温度(30-80℃)下孵育24h,并使用DNS方法。BsLPMO10A的最适pH值是通过将酶在各种pH缓冲溶液(pH 2.2-8.0的柠檬酸盐/磷酸盐缓冲液和pH 8.0-9.0的0.2M Tris-HCl缓冲液)中在37℃孵育24h来确定的。最高活性确定为100%。为了研究抗坏血酸和H
(5)BsLPMO10A的催化产物
为了探索BsLPMO10A的产物和氧化活性,将1.5μM蛋白溶液与各种含有1.5mM抗坏血酸的多糖底物(MLG-L、MLG-B、LBG、KGM、BX、SBA、昆布多糖、PASC、胶体几丁质、果胶和PGA)在37℃下孵育24h。然后使用带有脉冲安培检测器离子色谱[HPAEC-PAD、ICS3000,分离柱为CarboPac PA200(3×250mm)以及CarboPac PA200保护柱(3×50mm)](Dionex,Thermo),如文献中所述(Westereng et al.,2013)进行测定。
为了估计总氧化产物,先使用BsLPMO10A催化,再用一种GH将未反应完多糖底物有效地转化为它们的单体和二聚体。简而言之,将150μL(~15μM)BsLPMO10A与600μL 5mg/mL的各种多糖底物溶液在37℃下孵育24h,然后通过煮沸5min使酶失活。然后将溶液以12,000rpm离心15min,并使用50μL(~0.8μM)的IDSGLUC5-38或50μL(~0.5μM)的IDSXYN11-1在37℃下进一步水解上清液24h,然后煮沸5min使酶失活。将溶液以12,000rpm离心15min液用于HPAEC-PAD分析,配备CarboPac PA1(3×250mm)和CarboPac PA1(3×50mm)保护柱(Dionex,Thermo)。对于MALDI-TOF-MS分析,将1μL上述上清液与1μL溶解在含有10mM乙酸钠的50%乙腈溶液中的2,5-二羟基苯甲酸基质混合,并在样品板上干燥。然后在线性正离子模式下在300-1800的m/z范围内进行测量,使用60.0Hz的频率(UltrafleXtreme,Bruker,Germany)进行10次累积200次拍摄。按照(Kobayashi,Kamiya,&Enomoto,1996)的描述制备氧化的单糖和二糖,稍作修改。简而言之,将含有14mg碘的15mL甲醇溶液缓慢加入10mL20mg/mL样品溶液(溶于ddH2O)中,并在40℃下孵育15min。然后,在室温(25℃)下加入5mL含有0.2g KOH的甲醇溶液,然后在40℃下加热1h,直到碘颜色褪去。通过加入20mL冰水将混合物冷却,并在N
(6)BsLPMO10A和GHs对多糖和天然木质纤维素原料降解的协同作用
为了研究BsLPMO10A和GHs对多糖的协同作用,将7.5μL(~0.75μM)BsLPMO10A和7.5μL(~0.05μM)我们小组先前获得的各种GHs进行反应,包括瘤胃微生物葡聚糖酶(IDSGLUC5-38,原称Cel5A-h38)(Cao et al.,2021),Thermobifida fusca木聚糖酶(TfXYN11-1,原称TFX)(Wang et al.,2015a),瘤胃微生物木聚糖酶(IDSXYN11-1,原称XYN-LXY)(Wang et al.,2015b),枯草芽孢杆菌甘露聚糖酶(BsMAN26-3,原称BSM)(Gao et al.,2019),瘤胃微生物纤维素酶(IDSGLUC5-11,原称Cel5A-h11)(He,Jin,Cao,Mi,&Wang,2019)和几丁质酶(BtCHI18-1,原称BtCHI1)(Wu et al.,2022),反应体系中含有1.5mM抗坏血酸,于37℃中进行孵育。在2、4、8、12、24、48和72h取等分试样,并使用DNS方法评估还原糖。
天然底物测定:在活性测定之前,将花生壳、大豆秸秆、羊草、水稻秸秆、水稻壳和小麦秸秆的天然木质纤维素原料研磨并用NaOH如前所述方法(Cao et al.,2021)进行处理。为了研究BsLPMO10A或各种GHs对天然木质纤维素分解的影响,使用500μL(~20μM)BsLPMO10A或(~0.5μM)GHs在3mL柠檬酸盐/磷酸盐缓冲液(pH 6.0)中消解0.1g各种预处理的原料样品,并在25℃下反应96h。为了研究BsLPMO10A和GHs对天然木质纤维素分解的协同作用,使用500μL(~20μM)BsLPMO10A和(~0.5μM)GHs在3mL柠檬酸盐/磷酸盐缓冲液(pH6.0)中消化0.1g各种预处理的原料样品,并在25℃下反应96h。反应结束时,将每种混合物以12,000rpm的转速离心15min,弃去上清液。不溶性材料用ddH
三、结果分析
(1)序列分析
序列分析表明,BsLPMO10A由455个氨基酸残基(SEQ ID No.1)组成,包括一个AA10催化结构域和纤连蛋白Ⅲ型(FNⅢ)模块。SignalP5.0预测表明,N端的前40个氨基酸是信号肽。同源性模型表明,BsLPMO10A含有一个免疫球蛋白G(IgG)样β-三明治折叠和一个含有铜离子的组氨酸支架序列(图9)。两个保守的组氨酸形成一个T形的“组氨酸支架”,His41和His130,位于催化结构域的表面,代表了LPMO的典型特征。“组氨酸支架”和几个附近的芳香族氨基酸残基被确定为底物结合或催化位点相关(Book et al.,2014;Labourel et al.,2020;Span&Marletta,2015;Wu et al.,2013;Zhou,Qi,Huang,&Zhu,2019)。与C1-、C4-或C1/C4-氧化模式的AA9酶不同,AA10 LPMO被认为主要以C1-氧化模式催化底物,并可进一步分类为C1-和C1/C4-氧化亚家族(Li et al.,2021b)。在这项研究中,系统发育树分析表明,BsLPMO10A与来自AA10家族的其他C1氧化LPMO聚集在一起(图1)。尽管BsLPMO10A和枯草芽孢杆菌基因组中的其他12种LPMO共存,但BsLPMO10A与这些酶的相似性相对较低(33.70-62.63%),但与来自芽孢杆菌属的未表征的AA10蛋白的相似性较高(99.53%)(WP_001065159.1)。迄今为止,在CAZy数据库中已经对AA10家族中的约30种酶进行了表征,这些酶主要来源于细菌。与这些功能研究的AA10 LPMO相比,BsLPMO10A与地衣芽孢杆菌DSM13BlLPMO10A(GenBank编号:AAU39477.1)(Courtade et al.,,2020)和解淀粉芽孢杆菌DSM7BaLPMO10A(GenBank编号:CBI42985.1)(Hemsworth et al.,2013)的相似度最高,相似度分别为73.4和63.5%,但这两者都是几丁质活性的LPMO。
(2)BsLPMO10A是一种嗜温酶,由一定量的抗坏血酸或H
纯化的BsLPMO10A及其截短的催化结构域[BsLPMO10A(CD)]的分子量分别为~56(图2中A)和~34kDa(图2中B)。两种酶都对MLG-L、MLG-B、LBG、KGM、BX和SBA有活性(图2中C)。值得注意的是,与仅催化结构域相比,包含催化结构域和FNⅢ的全长BsLPMO10A对MLG-L(P<0.001)、MLG-B(P<0.001)、LBG(P<0.05)和KGM(P<0.01)(表2)催化活性更高。FNⅢ结构域广泛存在于细菌、酵母、植物和动物蛋白中。据报道,芽孢杆菌属、蜡状芽孢杆菌(Mutahiret al.,2018)和苏云金芽孢杆菌(Manjeet,Madhuprakash,Mormann,Moerschbacher,&Podile,2019)包含一个或多个FNⅢ结构域。然而,人们对其功能和详细机制知之甚少,有时还存在争议。敲除FNⅢ结构域(也称为X1结构域)并未改变TfAA10B的催化效率(Arfi,&Umbreit,2014;Kruer-Zerhusen et al.,2017)。相比之下,周等人(Zhou,Irwin,Escovar-Kousen,&Wilson,2004)表明没有FNⅢ结构域的截短Cel9A-90的催化活性降低到野生型的43%。令人惊讶的是,两种酶TfAA10B和Cel9A-90均来自褐色嗜热裂孢菌。以往的研究表明,FNⅢ模块有利于稳定酶的构象,提高可溶性和不溶性底物的活性(Han,Shang-Guan,&Yang,2019;Kataeva et al.,2002;Mutahir et al.,2018;Nguyen et al.,2021)。关于在不同底物上的不同性能,我们推测BsLPMO10A可能优先作用于某些由葡萄糖或甘露糖单元组成的多糖,其次是由木糖或阿拉伯糖组成的多糖(表2和图2中C)。在这种情况下,FNⅢ结构域极大地有助于底物结合和/或催化效率。因此,与截短酶相比,野生型BsLPMO10A对“优选”底物(包括冰岛苔藓地衣多糖、大麦β-葡聚糖、刺槐豆胶和魔芋葡甘露聚糖)显示出明显更高的活性(P<0.05)。对于“不太优选”的底物,例如山毛榉木聚糖和甜菜阿拉伯聚糖,去除FNⅢ结构域不会导致催化活性的严重降低,导致与野生型和截短的BsLPMO10A的活性相当。在最近的一项研究中,据报道FNⅢ结构域可能通过提高其对可溶性底物的亲和力(较低的Km值)来增加酶活性(Nguyen et al.,2021)。然而,FNⅢ结构域在酶性能中的详细机制仍有待解决。在本研究研究的多糖中,BsLPMO10A和BsLPMO10A(CD)对PASC、MCC、胶体几丁质、果胶或PGA均无活性。因此,采用全长BsLPMO10A进行进一步研究,因为它在各种多糖的分解中具有高活性。
表2.全长和截短BsLPMO10A的比活性
数据代表平均值±SD(n=4)。ND,未检测到。使用t检验进行BsLPMO10A和BsLPMO10A(CD)之间的统计分析。*,P<0.05;**,P<0.05;***,P<0.001
BsLPMO10A的最适温度和pH分别为50℃和5.0(图3中A和3中B),表明BsLPMO10是一种在中性和弱酸性条件下具有活性的中温酶,这与大多数先前报道的LPMO表现出最佳温度范围为40–60℃(Li et al.,2021a;Li,Dilokpimol,Kabel,&de Vries,2022;Zhang,Chen,Long,&Ding,2021)一致。值得注意的是,观察到源自高温堆肥宏基因组的MgLPMO10显示出最高的熔化温度(Tm=83℃)和高达80℃的催化活性(Tuveng et al.,2020)。更引人注目的是,米曲霉AA17酶LPMO-AoAA17显示出100℃的最佳温度,在121℃和15psi高压灭菌后甚至具有活性(Bhatia&Yadav,2021)。众所周知,铜对LPMO的氧化活性至关重要,使用EDTA螯合去除Cu
(3)BsLPMO10A从底物中释放天然和C1氧化的寡糖,特别是通过β-1,4糖苷键连接的多糖
根据BsLPMO10A的底物范围,葡聚糖样底物用于HPAEC-PAD和MALDI-TOF-MS分析。结果表明,BsLPMO10A能够从MLG-L或MLG-B中释放C1氧化和天然(非氧化)寡糖(图4中A)。然而,由于存在β-1,3-和β-1,4-糖苷键((Eklof,Shojania,Okon,McIntosh,&Brumer,2013),保留时间为5至17min的洗脱峰对应于聚合度(DP)范围为2至6的天然产物,而在17至25min观察到的峰对应于C1氧化产物(Correa et al.,2019;Stepnov et al.,2021;Zhang etal.,2021)。据报道,C4氧化的LPMO主要在30-35min的保留时间内表现出典型的曲线,在约40min时对应于C1/C4双氧化产物的大峰(Zarah Forsberg et al.,2014;Isaksen et al.,2014;Sun et al.,2020)。在这项研究中,没有检测到对应于双氧化产物的信号,因此,我们推测BsLPMO10A是一种在C1碳上氧化的AA10 LPMO(图4中A和4中B)。为了更多地了解催化产物的组成和裂解位点,使用MALDI-TOF-MS验证了寡糖的分子量。图4中B和4中C显示m/z信号为505([M+H Da]+)或527、689、851和1013([M+Na Da]+)的产物对应于纤维三糖(DP3)、纤维四糖(DP4)、纤维五糖(DP5)和纤维六糖(DP6)。m/z值为543、705、867和1029([M+16+Na Da]+)的信号对应于具有末端C1特异性醛糖酸的氧化纤维三糖(DP3ox)、纤维四糖(DP4ox)、纤维五糖(DP5ox)和纤维六糖(DP6ox)(Phillips,Beeson,Cate,&Marletta,2011;X.Zhang etal.,2021)。结果表明,BsLPMO10A主要释放C1氧化和天然寡糖,DP值为3至6。为了化学计量确定BsLPMO10A的总氧化活性,使用一种瘤胃微生物葡聚糖酶(IDSGLUC5-38),可有效地将葡聚糖底物转化为葡萄糖和纤维二糖(Cao et al.,2021)。反应24h后,MLG-L释放出3127±535μmol/L天然产物和3100±139μmol/LC1氧化产物。值得注意的是,与MLG-L相比,BsLPMO10A从MLG-B中释放出更多的天然产物(645±137μmol/L)和C1氧化产物(1260±58μmol/L)(图4中D)。MLG-B和MLG-L被归类为混合键葡聚糖(MLG),这两种底物的主链由通过(1→4)和(1→3)键连接的β-D-葡萄糖残基组成。然而,这些β-(1→4)和β-(1→3)键的比例和分布在MLG之间有所不同。由于BsLPMO10A对β-(1→3)连接的海带多糖无活性(表2),这推断该酶攻击β-(1→4)键以释放天然和C1-氧化的纤维寡糖。MLG-B和MLG-L的β-(1→4):β-(1→3)键的平均比例分别约为3:1和2:1(https://www.megazyme.com),这与MLG-B比MLG-L释放更多产品一致(图4中D)。
类似地,发现BsLPMO10A从BX中释放天然和C1氧化的低聚木糖(图5中A)。BX是一种支链木聚糖,在主链中包含一个木糖单元,并在侧链中装饰有约13%GlcA-OMe(表2)(https://www.megazyme.com/Xylan-Beechwood-purified)。MALDI-TOF-MS分析表明,BsLPMO10A释放的m/z信号为547([M+H Da]+)或569和701([M+Na Da]+)或759、891和1023([M+GlcA-OMe+Na Da]+)分别对应于直链-/支链-木四糖(DP4)、木戊糖(DP5)和木六糖(DP6)。m/z信号为585([M+16+NaDa]+)、695([M+16+H Da]+)或753([M+GlcA-OMe+16+H Da]+)或511、775、907和1039([M+GlcA-OMe+16+Na Da]+的m/z值)对应于C1氧化的线性/支链-木二糖(DP2)、木四糖(DP4)、木五糖(DP5)和木六糖(DP6)(图5中B)。此外,瘤胃微生物木聚糖酶(IDSXYN11-1)有效地将木聚糖转化为木糖和木二糖(Wang,2015a)都用于BX的分解。反应24h后,产生959±56μmol/L的天然产物和387±161μmol/L C1氧化产物(图5中C)。有趣的是,来自BX的C1氧化/天然产物的比率为0.40,低于从MLG-B(0.99)和MLG-L(1.95)获得的比率(图4中D),这可能是由于它偏爱β-(Glc1→4Glc)其次是β-(Xyl1→4Xyl)(表2)。如上所述,多糖主链内的糖环单元和连接类型与LPMO催化密切相关。同时,被修饰的侧链被认为在氧化反应中起作用。在最近的一项研究中,
此外,BsLPMO10A还表现出对KGM和SBA的催化作用,产生天然和C1氧化的寡糖(图6中A和6中B)。然而,该酶对PASC、几丁质、果胶和PGA的活性难以检测(图6中C-E)。据文献报道,AA10 LPMOs能够催化几丁质和/或PASC底物,例如来自地衣芽孢杆菌的BaAA10A(Forsberg et al.,2014),来自单核细胞增生李斯特菌的LmLPMO10(Paspaliari et al.,2015)和来自灰色链霉菌的SgLPMO10F(Nakagawa et al.,2015)。因此,这些LPMO过去被归类为几丁质结合蛋白21(CBP21)或碳水化合物结合模块33(CBM33)。然而,除了几丁质和纤维素氧化外,首次报道来自Kitasatospora papulosa的KpLPMO10A作用于木聚糖,木聚糖由β-(1→4)-D-木糖残基组成(Correa et al.,2019)。更令人惊讶的是,源自Paenibacilluscurdlanolyticus的PcAA10显示出对一系列几丁质、纤维素(Avicel和α-纤维素)和半纤维素(桦木木聚糖、燕麦木聚糖和象牙坚果甘露聚糖)底物的活性(Limsakul et al.,2020)。与先前报道的LPMO不同,本研究中开发的BsLPMO10A显示出对半纤维素分解的强大活性,例如MLG、木聚糖、甘露聚糖和阿拉伯聚糖(表2),表现出比PcAA10更宽的活性底物谱。尽管在AA9LPMO中普遍观察到针对甘露聚糖的活性(Agger et al.,2014;Calderaro et al.,2020;Liu,Olson,Wu,Broberg,&Sandgren,2017),但BsLPMO10A和PcAA10显示出很少见的甘露聚糖降解能力在AA10 LPMO中发现。更有趣的是,据我们所知,BsLPMO10A在本研究中首次显示出对阿拉伯聚糖的活性(表2和图6中B)。除了糖环、糖苷键和修饰的侧链外,多糖的分散状态或聚集体的形成也可能有助于LPMO的催化效率。最近的一项研究报告称,AoLPMO9A/B(Chen,Zhang,Long,&Ding,2021)和MtLPMO9B(Sun et al.,2021)的氧化效应急剧下降,同时结晶度指数增加。BsLPMO10A的催化效率在由β-1,4连接的葡萄糖组成的底物中也有所不同。我们推测BsLPMO10A对可溶性底物(包括冰岛苔藓地衣多糖和大麦β-葡聚糖)的活性更高,其次是部分可溶性PASC和不溶性MCC(表2)。综上所述,BsLPMO10A反之亦然。
(4)BsLPMO10A促进多种多糖和天然木质纤维素生物质的降解
鉴于其对多种底物的广泛催化活性,BsLPMO10A被用于与GH协同降解一系列多糖。尽管仅用BsLPMO10A处理后释放的还原糖可忽略不计,但观察到该酶加速了MLG-L、BX、PASC和几丁质的分解(图7)。共同反应72h后,和单独的GH组相比,协同组MLG-L、BX、PASC和几丁质中的还原糖分别为3176±97、7436±165、649±44和2604±130μmol/L,分别为单独组的1.47、1.56、1.44和1.25倍(P<0.001)。对于LBG的分解,与单独的内切甘露聚糖酶水解相比,BsLPMO10A和内切甘露聚糖酶共反应72h后,还原糖产量增加了11.68±7.85%(P=0.12)(图7中C)。值得注意的是,尽管BsLPMO10A本身并没有从PASC或几丁质中释放出类似的寡糖(图6中D和6中E),但它显着促进了相关GH对这两种底物的分解(图7中D和7中E)。由于它们在多糖解聚中的广泛用途,LPMOs被广泛用于与GHs协同进行底物降解。在过去十年中,来自AA9-11和13-16的LPMO已被证明与多种多糖具有协同作用,包括纤维素(Harris et al.,2010;Xin,Blossom,Lu,&Felby,2022)、几丁质(Nakagawa et al.,2015;Paspaliari etal.,2015)、木聚糖(Correa et al.,2019;Jung et al.,2015)和果胶(Sabbadin et al.,2021)。然而,发现BsLPMO10A显着促进多种多糖,尤其是半纤维素,其中主链包含β-1,4糖苷键,而与糖环种类无关(表2和图6)。
随后,BsLPMO10A与葡聚糖酶IDSGLUC5-38、甘露聚糖酶BsMAN26-3和木聚糖酶TfXYN11-1一起用于饲料的分解。为了消除木质素对催化过程的阻碍作用,我们用2%NaOH对原料进行预处理以去除其中的木质素,并获得含有28-38%纤维素和18-32%半纤维素的碱处理样品(Paritosh et al.,2021)。这些结果表明LPMO对半纤维素表现出强烈的活性,但对纤维素几乎没有活性(图8)。仅用BsLPMO10A处理后,除大豆秸秆外,所有测试基质中的半纤维素组合物均显着下降(P<0.05),如葡聚糖、木聚糖、甘露聚糖和阿拉伯聚糖降解的强大能力所示(表2)。例如,BsLPMO10A和甘露聚糖酶之间的协同作用显着降低(P<0.05)半纤维素组成,在花生壳中降低了10.61±6.18%(图8中A),在水稻壳中降低了8.19±3.85%(P<0.05)。图8中E)。BsLPMO10A和葡聚糖酶的协同作用显着降低(P<0.05)半纤维素组成在拉毛果秸秆(图8中C)和水稻壳中的9.65±4.04%(图8中E)。BsLPMO10A和木聚糖酶之间的协同作用显着降低(P<0.05)半纤维素组成在大豆秸秆中降低了17.67±4.68%(图8中B),在水稻壳中降低了10.00±4.14%(图8中E)和小麦秸秆中的16.16±2.79%(图8中F)。此外,BsLPMO10A、葡聚糖酶、木聚糖酶和甘露聚糖酶的协同作用显着解聚了纤维素和半纤维素(P<0.05)。天然植物来源的原料由纤维素、半纤维素、果胶和木质素组成。由于大豆秸秆、拉毛果秸秆、水稻壳和小麦秸秆中的木聚糖和葡聚糖相对丰富(Balan et al.,2008;Wu etal.,2018),木聚糖酶和葡聚糖酶与甘露聚糖酶处理相比,处理对它们的分解更有效,半纤维素减少了9.65-17.67%(图8中B、8中C、8中E和8中F)。此前有报道称,LPMO会导致底物出现缺口并引发纤维结构的解体,导致链断裂和原始纳米纤维的释放(Li et al.,2021b;Villares et al.,2017;Zhang et al.,2017)。因此,LPMO处理的木质纤维素表现出强烈的原纤化。使用原子力显微镜进行的详细形态观察表明,C1-/C4-氧化的LPMO直接结合到纳米晶纤维素的表面以降解底物(Eibinger,Sattelkow,Ganner,Plank,&Nidetzky,2017;Moreau et al.,2019),为BsLPMO10A分解天然底物提供了详细的证据。与多糖氧化LPMO不同的是,一种源自米曲霉的AA17 LPMO(LPMO-AoAA17)被发现通过切割β-O-4键对木质素起作用(Bhatia&Yadav,2021)。
- 儿茶素作为裂解性多糖单加氧酶降解纤维素的电子供体的应用
- 茶多酚作为裂解性多糖单加氧酶降解纤维素的电子供体的应用
