用于32种病毒检测的引物组合和扩增子靶向测序方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及用于32种病毒检测的引物组合和扩增子靶向测序方法。
背景技术
NGS,即下一代测序技术(Next-generation sequencing technology)又称高通量测序技术(High-throughput sequencing),能一次对几十万到几百万条DNA分子进行序列测定但读长一般较短。在病原检测中,利用NGS技术可直接对临床样本中的核酸进行高通量测序,然后与数据库进行比对,实现感染性疾病的溯源、检测、分型和耐药评估等多个方面。基于NGS鉴别微生物的主要方法有两种,分别是宏基因组测序(metagenomic NGS,mNGS)和靶向测序(targeted NGS,tNGS)。
mNGS直接对临床样本中的核酸进行无差别、无选择性的高通量测序,能够快速、客观的检测临床样本中的较多病原微生物,能够检测出新发和罕见病原体,它在重症感染领域,特别是疑难、罕见病导致的重症感染中发挥了难以替代的作用。但mNGS检测结果的灵敏度受宿主及其他微生物背景核酸的影响较大,且成本较高。在组织样本中,人源DNA的含量会在99%以上,这对样本的去除人源背景和测序通量提出来一定的要求。
相比于mNGS,tNGS是通过(超)多重PCR或杂交捕获的方式检测样本中已知病原微生物,可以提高灵敏及降低测序成本。tNGS检测目标仅包含预先设定的病原体,特异性富集待检靶标基因,因此不会受到人源核酸和背景菌群的影响。通过特异性引物或探针的设计,一次可富集几百到几千个靶标片段,能够实现病毒、细菌和耐药检测单管建库,无需RNA和DNA分别建库。这种方法相比于mNGS测序成本低,对丰度低的病毒和突变检测具有更高的灵敏性。
发明内容
本发明的目的是提供一种用于32种病毒检测的引物组合。
本发明采取的技术方案为:一种用于32种病毒检测的引物组合,包括
上游引物F1:5’-GAACGACATGGCTACGATCCGACTT special F-3’
下游引物R1:5’-GACCGCTTGGCCTCCGACTT special R-3’,其中special F包括序列表中的Seq-1-108中的单数序列,special R包括序列表中的Seq-1-108中的双数序列。
上述的引物组合还包括:
随机引物N9:NNNNNNNNN。
上述的引物组合还包括:
第二轮扩增上游通用引物
F2:5’-GAACGACATGGCTACGA-3’(Seq-109)
第二轮扩增下游BC引物
R2-MGI_BC:5’-TGTGAGCCAAGGAGTTG
本发明还公开了一种用于32种病毒检测的扩增子靶向测序方法,其步骤包括:
(1)合成上述的引物组合;
(2)提取待测样本中的RNA/DNA作为模板,加入上游引物F1、下游引物R1、随机引物N9进行一步RT-PCR法作为第一轮PCR扩增,以富集靶标区域。本次反应同时对DNA和RNA两种类型的核酸进行检测,将RNA的反转录和DNA的扩增在同一个反应内完成,大大简化了操作流程;
(3)第一轮PCR扩增的产物经过磁珠纯化,作为第二轮PCR的模板,加入引物F2和R2-MGI_BC进行第二轮PCR扩增。每个样本的R2-MGI_BC中的barcode区域序列互不相同;
(4)第二轮PCR扩增的产物经磁珠纯化后,通过DNB一步法,使目标序列呈环状扩增,获得文库;
(5)将DNB产物加载到芯片上,进行高通量测序。
本发明的方法可以快速鉴定样本中是否存在32种病毒中的一种或若干种,样本检测限可低至5ng,检测准确率高,在95%以上,无携带污染。
附图说明
图1为标准品1的扩增文库出库Qsep结果。
图2为标准品2的扩增文库出库Qsep结果。
图3为标准品1的下机数据质量。
图4为标准品2的下机数据质量。
具体实施方式
为更进一步阐述本发明为实现预定发明目的所采取的技术手段及功效,以下结合附图及较佳实施例,对依据本发明的具体实施方式、结构、特征及其功效,详细说明如后。
实施例1针对32种病毒的特异性引物设计和合成
1、针对32种病毒进行引物设计,扩增片段长度在200bp±40bp的范围内,以满足纯化操作需求。根据每个检测目标的具体情况,可选择1-2个不重叠的靶向区域,且相距超过500bp,避免产生引物交叉。32种病毒如表1所示,表2是设计的32种病毒的特异引物序列specialF/R。
2、引物合成
第一轮PCR扩增的引物:
上游引物F1:5’-GAACGACATGGCTACGATCCGACTT special F-3’
下游引物R1:5’-GACCGCTTGGCCTCCGACTT special R-3’
随机引物N9:NNNNNNNNN;
第二轮扩增上游通用引物
F2:5’-GAACGACATGGCTACGA-3’
第二轮扩增下游BC引物
R2-MGI_BC:5’-TGTGAGCCAAGGAGTTG
其中
表1. 32种病毒
/>
表2.病原特异引物序列
/>
/>
/>
实施例2针对32种病毒的扩增子靶向测序方法
1.核酸提取
购取甲型流感病毒H1N1的标准品,并与人源阴性样本进行1:1混合,进行两个平行实验,记为标准品1和标准品2。使用DNA/RNA共提取试剂盒按照说明书进行核酸提取(如QIAGEN Allrep DNA/RNA Mcro Kit),并用Qubit测DNA/RNA浓度。DNA和RNA也可分开提取,同时加入反应体系。
2.第一轮扩增
在PCR管中,以25μl的体系进行核酸靶向扩增,反应系统包括以下表格所示。各成分配置好后震荡混匀,在PCR仪中扩增。
第一轮扩增体系:
第一轮扩增程序:
/>
3.第一轮磁珠纯化
25ul上一轮PCR产物、25ul水和45ul beads(0.9x)混合,弃上清,留磁珠,80%乙醇洗两遍,11ul水洗脱,回收10ul。
4.第二轮扩增
在PCR管中,以25μl的体系进行核酸靶向扩增,反应系统包括以下表格所示。各成分配置好后震荡混匀,在PCR仪中扩增。
第二轮扩增体系:
第二轮扩增程序:
5.第二轮磁珠纯化
25ul第二轮PCR扩增产物、75ul水和80ulbeads(0.8x)混合,留上清178ul,再加入20ulbeads(0.2x),留磁珠,80%乙醇清洗两次,25ul水洗脱。
6.DNB制备
1)得出的文库,用QSEP100测纯化后的片段长度,再根据文库片段长度和文库浓度计算文库投入量,再根据相应公式计算文库投入体积。
2)在PCR管中,以40μl体系进行DNB制备,选用的是华大智造DNB SEQ一步法DNB制备试剂盒,货号为A0201。该系统包括20μl的DNB制备缓冲液、20μl的Input dsDNA和TE缓冲液混合液。
3)震荡混匀后,进行下一步制备,以84μl体系进行下一步反应,该系统包括40μl的DNB聚合酶混合液I、4μl的DNB聚合酶混合液II和40μl上一轮产物。
4)待反应结束,加入20μl的终止缓冲液,阔口枪头混匀,测浓度。
7.DNB加载及上MGI测序仪器
1)在PCR管中,以200μl体系进行DNB加载,该系统包括50μl的DNB加载缓冲液I、50μl的DNB加载缓冲液II和100μl的DNB。
2)用阔口枪头小心吹打混匀,上测序仪器。
8.实验结果
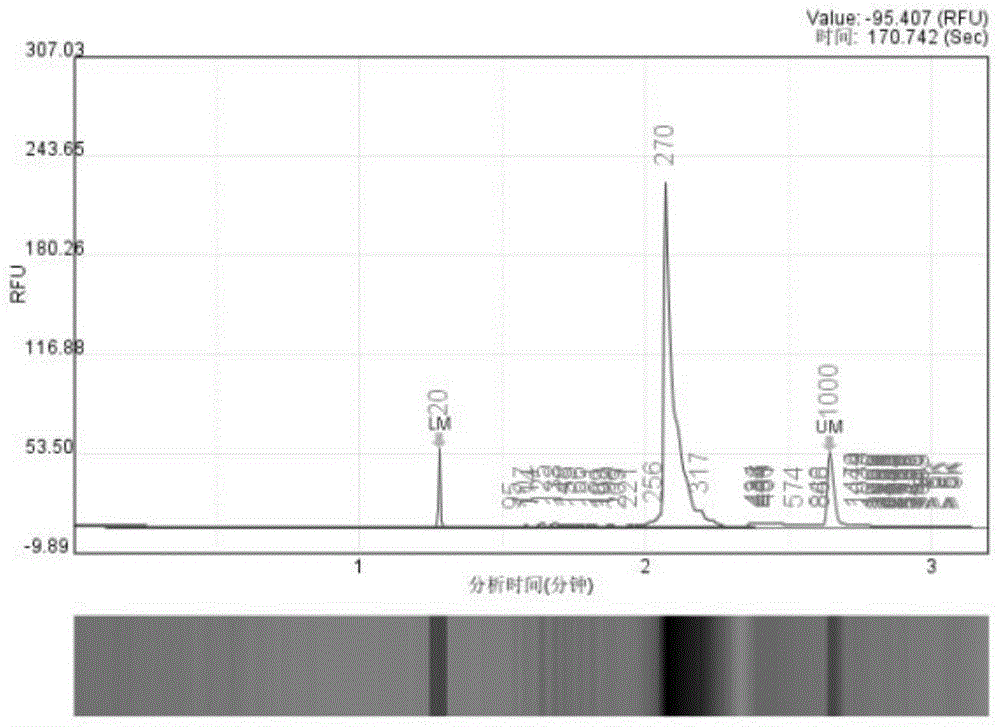
1)图1和图2表示两个阳性标准品多重PCR建库之后的QSep100图。图1为标准品1,主峰为270bp;图2为标准品2,主峰为240bp。
2)图3和图4表示进行测序结束后,不同样本的碱基在不同位置处下机数据的质量。
3)表4表示标准品下机的测序数据,以及测序结果。
表4
性能参数:
A.数据质控接头比例<15%;
B.最低建库起始量5ng;
C.MGI平台SE50测序模式;
D.病原体检测准确率>95%(阳性参考品能正确检出),无携带污染(排除近源物种导致的假阳性);
E.检测限不高于:300cp/ml;
F.重复性良好(低值样本可稳定检出,检出率≥95%);
G.无竞争性干扰,阳性参考品高浓度的病原体不影响检测限浓度的其他病原体检出。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭示如上,然而并非用以限定本发明,任何本领域技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的技术内容做出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简介修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 基于高通量测序构建多种遗传代谢性肝病靶向文库的引物组合、方法及试剂盒
- 用于检测和/或辅助检测GⅡ型诺如病毒的引物组、试剂、试剂盒和检测方法
- 用于检测和/或辅助检测致手足口病毒CVA16的引物组、试剂、试剂盒和检测方法
- 用于检测和/或辅助检测致手足口病毒EV71的引物组、试剂和试剂盒及检测方法
- 用于检测猪圆环病毒3型的PCR引物对、试剂盒及检测方法
- 适用于扩增子测序文库构建的引物及扩增子测序文库的构建方法
- 基于扩增子测序的大片段重排检测的引物组合物、试剂盒和检测方法
