一种高抗性淀粉含量水稻的培育方法
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于水稻分子育种领域,具体涉及一种高抗性淀粉含量水稻的培育方法。
背景技术
近年来,与饮食和能量代谢相关的慢性疾病,如超重、肥胖和II型糖尿病等的发病率在全球范围内大幅增加,精加工淀粉类食品的高消费是这些病症的一个主要诱发因素。常规的淀粉通常能量较高,食用后在人体小肠中极易被消化、吸收并转化为血糖;而抗性淀粉(Resistant starch,RS)是一类特殊的淀粉,在人体小肠中几乎不能被酶解成葡萄糖,而只能在人体大肠中被发酵成有益的短链脂肪酸。因此,食用富含RS的食物不仅可以有效地降低升糖指数(GI)、增加饱腹感,预防血糖相关疾病,而且还能通过改善肠道(大肠)微环境、降低结肠pH值等有助于预防结肠癌等肠道相关疾病。
水稻是一种重要的主粮作物,也是世界范围内多数人,特别是亚洲人群的主要淀粉摄入来源。然而,常规栽培水稻中的RS含量通常小于1%,远远低于人类每日推荐的RS摄入量。因此,选育富含RS的水稻是水稻品种改良的重要方向。
淀粉是水稻胚乳中最主要的成分,占胚乳干重的80%以上,由不同比例的直链淀粉和支链淀粉组成。胚乳直链淀粉和支链淀粉组成和结构是决定稻米品质的关键因素。水稻胚乳中淀粉的合成受一系列酶的调控,这些酶的编码基因统称为淀粉合成相关基因(Starch synthesis related gene,SSRG)。当前,已经有一些通过调控编码淀粉分支酶(SBE)和可溶性淀粉合成酶(SS)的两类SSRG表达来提高水稻胚乳中RS含量的成功案例。例如,通过抑制或敲除SBE3/SBEIIb基因的表达可显著提高稻米RS含量;SBE1/SBEI基因突变或抑制其表达对稻米RS水平无有显著影响,但同时抑制或敲除SBE1和SBE3基因的表达可以在sbe3单突变的基础上进一步提高RS含量达到约15%,表明两个基因在RS形成中存在功能冗余;在具有高直链淀粉含量、强GBSSI酶活性的Wx
发明内容
本发明针对上述现有技术中存在的问题,提供了一种高抗性淀粉含量水稻的培育方法,一种利用基因组编辑技术多敲除淀粉合成相关基因SS3a和SS3b提高稻米抗性淀粉含量、降低淀粉消化速率,进而改良稻米营养健康品质的方法;该方法获得的稻米消化速率显著降低,具有较优的营养健康品质。
本发明的目的是通过以下技术方案来实现的:
第一方面,本发明提供一种可溶性淀粉合成酶基因,所述可溶性淀粉合成酶基因为SS3a和SS3b;SS3a和SS3b的基因号RAP Locus分别为Os08g0191433和Os04g0624600。
第二方面,本发明提供一种可溶性淀粉合成酶基因在培育高抗性淀粉含量水稻中的应用。
所述应用的方法如下:构建可溶性淀粉合成酶基因SS3a和SS3b的共敲除载体,利用农杆菌介导的方法将共敲除载体导入水稻,筛选获得同时敲除SS3a和SS3b基因的水稻。
优选的,所述共敲除载体包含基因SS3a和SS3b,载体系统为CRISPR/Csa9,系统中包含中间载体SK-gRNA和最终载体pC1300-Cas9。
优选的,所述构建可溶性淀粉合成酶基因SS3a和SS3b的共敲除载体的具体步骤如下:
步骤(a):以序列如SEQ ID NO.1的SS3a基因片段和序列如SEQ ID NO.2的SS3b基因片段为靶位点,分别在两个靶位点正向序列前加GGCA,在反向互补序列前加AAAC,人工合成两对序列如SEQ ID NO.3、SEQ ID NO.4、SEQ ID NO.5和SEQ ID NO.6所示的互补引物;引物如下:
步骤(b):将步骤(a)的引物用PCR仪退火形成带有粘性末端的DNA双链,分别连入用Aar I酶酶切过的中间载体SK-gRNA;分别酶切含靶位点的SK-gRNA载体,回收gRNA片段,并利用同尾酶系统将其同时连入一个最终载体pC1300-Cas9中。
优选的,步骤(a)中序列如SEQ ID NO.1的SS3a基因片段位于SS3a基因外显子1上;序列如SEQ ID NO.2的SS3b基因片段位于SS3b基因外显子10上。
优选的,所述利用农杆菌介导的方法将共敲除载体导入水稻的具体步骤如下:将共敲除载体转入EHA105农杆菌菌株,采用农杆菌介导的遗传转化方法浸染水稻愈伤;进行培养、筛选得到T
优选的,所述在SS3a和SS3b基因序列上设计引物,引物如下:
。
通过本发明提供的培育高抗性淀粉含量水稻应用制备的水稻米粉中抗性淀粉含量达到9.54%-9.73%,远高于野生型水稻的0.58%。
本发明构建了水稻可溶性淀粉合成酶基因SS3a和SS3b的共敲除载体,将其导入水稻品种日本晴中,通过PCR扩增和测序手段检测到SS3a和SS3b基因靶位点均发生了多种类型的突变,表明共敲除载体成功导入水稻受体中并发挥了作用。
本发明具有以下有益效果:本发明通过基因组编辑技术多敲除淀粉合成相关基因SS3a和SS3b,SS3a和SS3b基因共敲除稻米的抗性淀粉含量显著提高、消化速率显著降低,同时理化品质也发生显著改变,其营养健康品质显著改良。将本发明培育高抗性淀粉含量水稻的方法及相关遗传材料应用于水稻育种实践,有望为选育营养健康的水稻新品种带来新突破。
附图说明
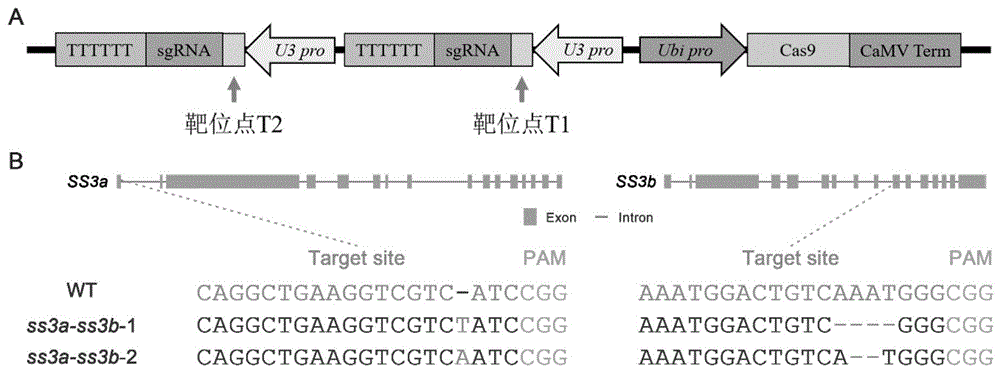
图1是CRISPR/Cas9载体构建及突变材料靶位点序列对比。A为共敲除SS3a和SS3b基因CRISPR/Cas9载体的T-DNA结构图;B为SS3a和SS3b纯合突变系与野生型对照(WT)中靶位点T1和T2附近序列比对。“UTR”表示非编码序列;“Exon”表示外显子;“Intron”表示内含子;“Target site”表示靶位点;“PAM”表示原型间隔序列毗邻区;“WT”表示野生型。
图2为SS3a和SS3b纯合突变系与野生型对照(WT)的农艺性状比较。A为灌浆期的植株形态;B为精米籽粒;C-H分别为粒长、粒宽、粒厚、千粒重、垩白粒率和垩白度。图A和B的比例尺分别为10厘米和5毫米。“**”表示P<0.01时的统计显著性差异。
图3为SS3a和SS3b纯合突变系与野生型对照(WT)成熟米粉中的消化特性比较。A-C分别为抗性淀粉含量、总可消化淀粉含量和消化曲线。“**”表示P<0.01时的统计显著性差异。
图4为SS3a和SS3b纯合突变系与野生型对照(WT)成熟米粉中的理化特性比较。A-D分别为总淀粉含量、表观直链淀粉含量、甘油三酯含量和直链淀粉-脂质复合物含量;E为RVA粘滞性图谱。“**”表示P<0.01时的统计显著性差异。
具体实施方式:
为理解本发明,下面以实施例进一步说明本发明,但不限制本发明。
下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过常规商业途径获得。下述实施例中所涉及的实验方法、检测方法等,若无特别说明,均为现有技术中的常规实验方法、检测方法等。实施例1:利用CRISPR/Cas9技术共敲除SS3a和SS3b创制高抗性淀粉含量水稻新种质
1.水稻材料
常规粳稻(Oryza sativa subsp.geng)品种日本晴(下文简称为WT),以及以日本晴为受体创建的2个SS3a和SS3b基因共敲除水稻材料(分别命名为ss3a-ss3b-1和ss3a-ss3b-2)。SS3a和SS3b的基因号RAP Locus分别为Os08g0191433和Os04g0624600。
2.载体构建
本研究基因编辑使用的是经典的CRISPR/Csa9系统。分别选取位于SS3a基因外显子1上的T1序列和位于SS3b基因外显子10上的T2序列作为靶位点(图1B)。具体靶位点序列为:
T1(SEQ ID NO.1)CAGGCTGAAGGTCGTCATC;
T2(SEQ ID NO.2)AAATGGACTGTCAAATGGG;
根据所用CRISPR/Cas9系统要求,将靶位点设计成引物。具体操作是在靶位点正向序列前加GGCA,在反向互补序列前加AAAC,交由生物公司合成,具体引物序列为:
T1-F(SEQ ID NO.3)ggcaCAGGCTGAAGGTCGTCATC;
T1-R(SEQ ID NO.4)aaacGATGACGACCTTCAGCCTG;
T2-F(SEQ ID NO.5)ggcaAAATGGACTGTCAAATGGG;
T2-R(SEQ ID NO.6)aaacCCCATTTGACAGTCCATTT;
将靶位点引物混合后变性退火形成带有粘性末端的片段,连入用Aar I酶(Fermentas公司)酶切过的中间载体SK-gRNA中。连接产物(SK-gRNA-T1和SK-gRNA-T2)分别转化大肠杆菌后用通用引物T3进行测序验证。测序正确、携带SS3a和SS3b基因靶位点的中间载体用同尾酶系统分别酶切,同时连入用Kpn I和BamH I酶切过的最终载体pC1300-Cas9中。连接产物(pC1300-Cas9-T1-T2)转化大肠杆菌后用载体引物pC1300-F进行测序验证(图1A)。
T3(SEQ ID NO.7)ATTAACCCTCACTAAAGGGA;
pC1300-F(SEQ ID NO.8)ACACTTTATGCTTCCGGCTC。
3.遗传转化
将测序正确的重组载体质粒pC1300-Cas9-T1-T2转入EHA105农杆菌菌株,采用农杆菌介导的遗传转化方法侵染水稻愈伤。共培养3天后,在含有潮霉素的筛选培养基上培养2周。筛选到的抗性愈伤在预分化培养基上培养10天左右,将预分化的愈伤转至分化培养基上培养,一个月左右得到抗性转基因T
4.突变植株的检测与筛选
取T
检测SS3a(T1 Test-F/R)和SS3b(T2 Test-F/R)靶位点突变情况的扩增引物和潮霉素检测引物(Hyg-1/2)序列分别为:
T1 Test-F(SEQ ID NO.9)GTCAGGACAGTGCAAAACTCCA;
T1 Test-R(SEQ ID NO.10)AGAAGGACGAACACTTGGTGGA;
T2 Test-F(SEQ ID NO.11)GCTTCCACCCTTCTCATACACA;
T2 Test-R(SEQ ID NO.12)AACAGAACACGGCCAGGTCA;
Hyg-1(SEQ ID No.13)GCTTCTGCGGGCGATTTGTGT;
Hyg-2(SEQ ID No.14)GGTCGCGGAGGCTATGGATGC;
经过多代的筛选,我们获得了2种SS3a和SS3b基因均被敲除的纯合系,分别命名为ss3a-ss3b-1和ss3a-ss3b-2。在ss3a-ss3b-1中,SS3a基因靶位点处插入一个T碱基,SS3b基因靶位点处删除4个碱基(AAAT);在ss3a-ss3b-2中,SS3a基因靶位点处插入一个A碱基,SS3b基因靶位点处删除2个碱基(AA)。在ss3a-ss3b-1和ss3a-ss3b-2中,SS3a和SS3b基因均均发生移码突变,不能合成有功能的SS3a和SS3b蛋白(图1B)。
5.农艺性状调查
对ss3a-ss3b-1、ss3a-ss3b-2和野生型对照的植株形态和籽粒性状进行调查。结果显示,ss3a-ss3b-1和ss3a-ss3b-2的植株形态、粒长和粒宽相比于野生型对照无显著变化,但粒厚和千粒重显著降低、垩白粒率和垩白度显著增加(图2、表1)。
表1.ss3a-ss3b突变体与野生型对照的农艺性状比较。
所有数据均为平均值±标准差,n>2,“**”表示有极显著差异,没有标示表示没有显著差异。
6.消化特性分析
利用可消化和抗性淀粉检测试剂盒(Megazyme公司,货号K-DSTRS)和体外消化实验对ss3a-ss3b-1、ss3a-ss3b-2和野生型对照成熟米粉中的消化特性进行分析。结果显示,ss3a-ss3b-1和ss3a-ss3b-2米粉中的抗性淀粉含量显著增加,达到9.54%-9.73%,远高于野生型水稻的0.58%(图3A、表2);同时总可消化淀粉含量显著降低(图3B、表2),消化曲线显著放缓(图3C、表3)。这些结果表明共敲除SS3a和SS3b基因可显著改良稻米的营养健康品质。
表2.ss3a-ss3b突变体与野生型对照的抗性淀粉含量和总可消化淀粉含量比较。
所有数据均为平均值±标准差,n=3,“**”表示有极显著差异,没有标示表示没有显著差异。
表3.ss3a-ss3b突变体与野生型对照不同时间点的消化度比较。
所有数据均为平均值±标准差,n=3,“**”表示有极显著差异,没有标示表示没有显著差异。
7.理化品质分析
为了进一步明确SS3a和SS3b基因共敲除对稻米品质的影响,我们对ss3a-ss3b-1、ss3a-ss3b-2和野生型对照成熟米粉中的总淀粉含量、表观直链淀粉含量、甘油三酯含量、直链淀粉-脂质复合物含量和粘滞特性进行了分析。结果显示,ss3a-ss3b-1和ss3a-ss3b-2米粉中的总淀粉含量显著降低,表观直链淀粉含量、甘油三酯含量、直链淀粉-脂质复合物含量均极显著增加(图4A-D、表4);快速粘滞性分析(RVA)图谱显示,ss3a-ss3b-1和ss3a-ss3b-2的粘滞曲线整体显著下降(图4E)。这些结果均表明SS3a和SS3b基因共敲除稻米的理化品质发生了显著变化。
表4.ss3a-ss3b突变体与野生型对照的稻米理化特性比较。
所有数据均为平均值±标准差,n=3,“**”表示有极显著差异,没有标示表示没有显著差异。
综上所述,我们利用CRISPR/Cas技术成功在粳稻品种日本晴背景下创建了SS3a和SS3b基因的共敲除水稻材料,使两个基因的功能完全丧失。消化特性和理化品质分析结果显示,SS3a和SS3b基因共敲除稻米的抗性淀粉含量显著提高、消化特性显著改良,同时理化品质也发生显著改变。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。在不脱离本发明的范围和精神的前提下,本领域内的技术人员根据本发明作出的各种改变或变形都应包括在本发明所附权利要求的范围内。
- 一种高抗性淀粉含量功能性水稻的培育方法
- 一种高抗性淀粉含量水稻的培育方法
