一种多肽修饰的靶向纳米粒及其制备方法和应用
文献发布时间:2024-04-18 19:58:53
技术领域
本申请属于纳米生物材料技术领域,具体涉及一种多肽修饰的靶向纳米粒及其制备方法和应用。
背景技术
心肌梗死(Myocardial Infarction,MI)是指心脏中冠状动脉堵塞引起的心脏局部组织缺血导致的心肌组织不可逆性的坏死。心肌梗死和心力衰竭是全世界人类死亡的主要原因。目前临床药物治疗心衰还远未达到理想的效果。基因疗法是通过基因转移技术将外源基因导入受体细胞以治疗由基因缺陷引起的疾病,通过高度特异性识别作用对治疗基因转运载体进行修饰,使得治疗基因能够特异性进入受体组织。
纳米脂质体(Nanoliposome,NLPs)具有类细胞结构,能够改变包装药物的体内分布,提高药物的治疗指数、减少药物的使用剂量和降低药物的毒性。脂质体作为其中一种纳米载体,制备简单、易于表面修饰、易于大量生产等优势,是构建基因载体的理想材料。
因此,提供一种对纳米脂质体表面进行靶向性修饰,使其搭载治疗基因到达心肌受损区域,并起到保护心脏的作用,显得尤为重要。
发明内容
针对现有技术存在的上述问题,本发明所要解决的第一技术问题是提供一种多肽修饰的靶向纳米粒;本发明所要解决的第二技术问题是提供该多肽修饰的靶向纳米粒的制备方法;本发明所要解决的第三技术问题是提供该多肽修饰的靶向纳米粒的应用。
为解决上述问题,本发明提供如下技术方案:
第一方面,一种多肽修饰的靶向纳米粒,包括肽段GKWHCTTKFPHHYCL、脂质纳米粒和药学上可接受的载体,脂质纳米粒表面共价结合有肽段GKWHCTTKFPHHYCL,然后通过正负电荷吸附作用与药学上可接受的载体连接,得到多肽修饰的靶向纳米粒。
作为本发明的一种优选,药学上可接受的载体包括病毒载体和非病毒载体。
作为本发明的一种优选,药学上可接受的载体为非病毒载体。
作为本发明的一种优选,药学上可接受的载体为质粒。
作为本发明的一种优选,药学上可接受的载体为Serca2a质粒。
作为本发明的一种优选,利用GKWHCTTKFPHHYCL多肽与I型胶原蛋白特异性结合,促进纳米粒在体内能够靶向到达心肌受损区域,从而高效率递送Serca2a质粒。
作为本发明的一种优选,脂质纳米粒的原料包括磷脂、PEG脂质和阳离子胆固醇衍生物。
作为本发明的一种优选,磷脂可以为现有技术中任意一种能够用作脂质纳米粒中磷脂的材料,不做特别限定,可以根据实际需要而具体选择,例如,可以为DOPE、DOPC、DOPS、POPS、DOPG、DOPI、DSPC、HSPC、EggPC、DPPC、POPC、POPE或DLPC。
作为本发明的一种优选,磷脂为DPPC。
作为本发明的一种优选,PEG脂质可以为现有技术中任意一种能够用作脂质纳米粒中PEG脂质的材料,不做特别限定,可以根据实际需要而具体选择,例如,可以为DMG-PEG2000、DMG-PEG5000、DSPE-PEG2000或DSPE-PEG5000。
作为本发明的一种优选,PEG脂质为DMG-PEG2000。
作为本发明的一种优选,阳离子胆固醇衍生物为DC-胆固醇。
第二方面,一种多肽修饰的靶向纳米粒的制备方法,包括以下步骤:
1)按比例称取磷脂、PEG脂质和阳离子胆固醇衍生物,加入三氯甲烷,至混合均匀得到脂质体混合溶液;
2)旋蒸至三氯甲烷完全蒸发,加入缓冲溶液进行超声清洗,得到脂膜水化液;
3)对脂膜水化液进行超声乳化,离心,得到脂质纳米粒;
4)对脂质纳米粒进行重悬,然后加入Serca2a质粒,孵育,得到多肽修饰的靶向纳米粒。
作为本发明的一种优选,步骤1)中,磷脂、PEG脂质和阳离子胆固醇衍生物的质量比为5:2:1~2。
作为本发明的一种优选,步骤1)中,磷脂、PEG脂质和阳离子胆固醇衍生物的比例为10:4:3。
作为本发明的一种优选,步骤1)中的三氯甲烷与步骤2)中的缓冲溶液的体积比为1:1。
作为本发明的一种优选,步骤3)中,超声乳化的功率为100~150w,超声乳化的时间为5~10min。
作为本发明的一种优选,步骤3)中,超声乳化的功率为125w,超声乳化的时间为8min。
作为本发明的一种优选,步骤4)中,孵育的温度为4℃。
作为本发明的一种优选,步骤4)中,孵育的时间为0.5~3h。
作为本发明的一种优选,步骤4)中,孵育的时间为1h。
第三方面,一种包含所述的多肽修饰的靶向纳米粒的药物组合物或疫苗。
第四方面,所述的多肽修饰的靶向纳米粒在制备维持生物体内心肌细胞钙稳态的药物中的应用。
第五方面,所述的多肽修饰的靶向纳米粒在制备预防或治疗心肌梗死的药物中的应用。
与现有技术相比,本发明具有以下有益效果:
1)本发明制备方法简单,制备得到的多肽修饰的靶向纳米粒,生物相容性好,且由于纳米粒表面共价结合有肽段GKWHCTTKFPHHYCL,能够对病理部位能够更加高效进行靶向递送,兼具低免疫原性和同源靶向能力。
2)将本发明制备得到的多肽修饰的靶向纳米粒,将其应用于小鼠心肌梗死模型中,利用GKWHCTTKFPHHYCL多肽与I型胶原蛋白特异性结合,能够促进纳米粒子在体内能够靶向到达心肌受损区域,从而高效率的递送并Serca2a质粒,维持小鼠体内心肌细胞的钙稳态,特异性增强小鼠的心脏功能,延缓其纤维化进程,从而起到保护小鼠心脏的作用,为制备心肌梗死的预防和/或治疗药物提供了新的思路。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为实施例1制备得到的多肽修饰的靶向纳米粒的透射电镜图;图中标尺为500nm;
图2为实施例1制备的多肽修饰的靶向纳米粒的粒径图;
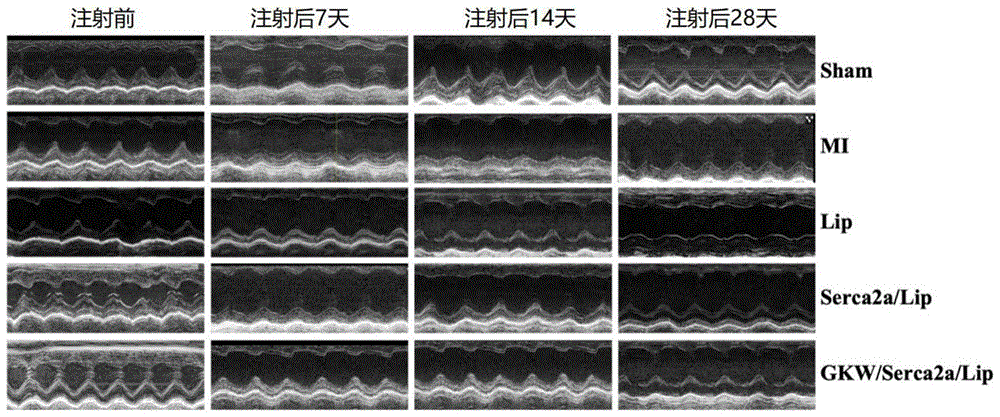
图3为实施例1与对比例1-4所对应的不同组别的超声心动图;图中,Sham组为假手术组,MI组为心肌梗死手术组,Lip组为DSPE-PEG2000表面没有共价结合多肽且脂质纳米粒不连接Serca2a质粒的纳米粒组,Serca2a/Lip组为DSPE-PEG2000表面没有共价结合多肽但脂质纳米粒连接有Serca2a质粒的纳米粒组,GKW/Serca2a/Lip为DSPE-PEG2000表面共价结合有多肽且脂质纳米粒连接有Serca2a质粒的多肽修饰的靶向纳米粒组;
图4为实施例1与对比例1-4所对应的不同组别的射血分数图、短轴收缩率图、LVS内径图和LVD内径图;图中,A为射血分数图,B为短轴收缩率图,C为LVS内径图即左室收缩末期内径图,D为LVD内径图即左室舒张末期内径图;
图5为实施例1与对比例1-4所对应的不同组别的生存率曲线图。
具体实施方式
下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
按照10:4:3的质量比用微量电子天平秤称取二棕榈酰磷脂酰胆碱(DPPC)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)和DC-胆固醇(DC-Chol),均置于容积100ml的圆底烧瓶中。其中,DSPE-PEG2000表面共价结合有多肽GKWHCTTKFPHHYCL;加入5ml三氯甲烷,并轻摇瓶身使溶液均匀混合直至完全溶解。将装有脂质体混合溶液的圆底烧瓶固定于旋转蒸发仪,50℃负压旋转(转速:100rpm),蒸发2小时后使三氯甲烷完全蒸发,脂质体在瓶身形成一层乳白色均匀脂质膜。旋转蒸发完成后,将圆底烧瓶里加入5ml PBS置于超声波清洗仪内清洗震荡3分钟,直至贴附于瓶身的乳白色脂膜完全脱落,得到白色混悬液,即为脂膜水化液,最后将其转移至50ml的圆底离心管中。采用声振仪对圆底离心管内的混悬液进行乳化,乳化过程中声振仪功率为:125w,时间:8min(开:5s,关:5s),此步骤均在冰浴中进行。将所得的乳状液体置于高速冷冻离心机内离心分离,温度:4℃,转速:8000rpm,时间:5min,离心完后去弃上清液,用双蒸水重悬沉淀,重复三次以上离心步骤,制备得到脂质纳米粒溶液。
将制备好的脂质纳米粒溶液中加入提取的Serca2a质粒,共同敷育1h,通过正负电荷吸附作用使Serca2a质粒与脂质纳米粒连接,得到多肽修饰的靶向纳米粒GKW/Serca2a/Lip。
图1示出本实施例制备的多肽修饰的靶向纳米粒的透射电镜图;图中标尺为500nm。
图2示出本实施例制备的多肽修饰的靶向纳米粒的粒径图,具体粒径数据如下表1所示。
表1多肽修饰的靶向纳米粒的粒径数据
根据Wang J,Bo H,Meng X,et al.A simple and fast experimental model ofmyocardial infarction in the mouse[J].Texas Heart Institute Journal,2006,33(3):290.公开的方法,通过结扎小鼠冠状动脉左前降支(LAD),构建小鼠心肌梗死模型,具体构建方法如下:
外科手术室温控制在25℃,用乙醚麻醉小鼠,然后通过绑住腿和上颌固定在仰卧位。在左胸部剃光并用75%乙醇消毒后,沿着胸骨左侧的1.5厘米横向切口将皮肤精细地解剖。在解剖皮肤之前,沿着切口边缘通过4-0聚丙烯缝合线。皮下组织沿左胸大肌下缘分离,左胸大肌折射。第4肋间隙暴露并在微钳的帮助下精细解剖1厘米。然后使用自保持型微牵开器分离第3和第4肋骨,使其足以充分暴露操作区域,但肋骨保持完整。心脏被轻轻按压胸部挤出;然后用左手的拇指和食指握住心脏,其顶点指向头部的左侧。5-0聚丙烯缝合线从肺漏斗的左边缘传递到左耳廓的右下角,距离约为2至3毫米。不结扎左冠状动脉的主干,而是将左前降冠状动脉和心大静脉结扎在一起。LAD结扎后不久,胸部的心脏被置换,胸部的血液和空气被食指挤出。用开胸术前准备的缝合线闭合胸部。通过尾静脉注射上述制备的溶液,每48小时注射一次,28天后检测其治疗效果。
实施例2
按照5:2:2的质量比用微量电子天平秤称取二油酰基卵磷脂(DOPC)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇5000(DSPE-PEG5000)和DC-胆固醇(DC-Chol),均置于容积100ml的圆底烧瓶中。其中,DSPE-PEG5000表面共价结合有多肽GKWHCTTKFPHHYCL;加入5ml三氯甲烷,并轻摇瓶身使溶液均匀混合直至完全溶解。将装有脂质体混合溶液的圆底烧瓶固定于旋转蒸发仪,50℃负压旋转(转速:100rpm),蒸发2小时后使三氯甲烷完全蒸发,脂质体在瓶身形成一层乳白色均匀脂质膜。旋转蒸发完成后,将圆底烧瓶里加入5ml PBS置于超声波清洗仪内清洗震荡3分钟,直至贴附于瓶身的乳白色脂膜完全脱落,得到白色混悬液,即为脂膜水化液,最后将其转移至50ml的圆底离心管中。采用声振仪对圆底离心管内的混悬液进行乳化,乳化过程中声振仪功率为:100w,时间:10min(开:5s,关:5s),此步骤均在冰浴中进行。将所得的乳状液体置于高速冷冻离心机内离心分离,温度:4℃,转速:8000rpm,时间:5min,离心完后去弃上清液,用双蒸水重悬沉淀,重复三次以上离心步骤,制备得到脂质纳米粒溶液。
将制备好的脂质纳米粒溶液中加入提取的Serca2a质粒,共同敷育1h,通过正负电荷吸附作用使Serca2a质粒与脂质纳米粒连接,得到多肽修饰的靶向纳米粒GKW/Serca2a/Lip。
根据Wang J,Bo H,Meng X,et al.A simple and fast experimental model ofmyocardial infarction in the mouse[J].Texas Heart Institute Journal,2006,33(3):290.公开的方法,通过结扎小鼠冠状动脉左前降支(LAD),构建小鼠心肌梗死模型,具体构建方法如下:
外科手术室温控制在25℃,用乙醚麻醉小鼠,然后通过绑住腿和上颌固定在仰卧位。在左胸部剃光并用75%乙醇消毒后,沿着胸骨左侧的1.5厘米横向切口将皮肤精细地解剖。在解剖皮肤之前,沿着切口边缘通过4-0聚丙烯缝合线。皮下组织沿左胸大肌下缘分离,左胸大肌折射。第4肋间隙暴露并在微钳的帮助下精细解剖1厘米。然后使用自保持型微牵开器分离第3和第4肋骨,使其足以充分暴露操作区域,但肋骨保持完整。心脏被轻轻按压胸部挤出;然后用左手的拇指和食指握住心脏,其顶点指向头部的左侧。5-0聚丙烯缝合线从肺漏斗的左边缘传递到左耳廓的右下角,距离约为2至3毫米。不结扎左冠状动脉的主干,而是将左前降冠状动脉和心大静脉结扎在一起。LAD结扎后不久,胸部的心脏被置换,胸部的血液和空气被食指挤出。用开胸术前准备的缝合线闭合胸部。通过尾静脉注射上述制备的溶液,每48小时注射一次,28天后检测其治疗效果。
实施例3
按照5:2:1的质量比用微量电子天平秤称取1-棕榈酰基-2-油酰基卵磷脂(POPC)、二肉豆蔻酰甘油-聚乙二醇2000(DMG-PEG2000)和DC-胆固醇(DC-Chol),均置于容积100ml的圆底烧瓶中。其中,DMG-PEG2000表面共价结合有多肽GKWHCTTKFPHHYCL;加入5ml三氯甲烷,并轻摇瓶身使溶液均匀混合直至完全溶解。将装有脂质体混合溶液的圆底烧瓶固定于旋转蒸发仪,50℃负压旋转(转速:100rpm),蒸发2小时后使三氯甲烷完全蒸发,脂质体在瓶身形成一层乳白色均匀脂质膜。旋转蒸发完成后,将圆底烧瓶里加入5ml PBS置于超声波清洗仪内清洗震荡3分钟,直至贴附于瓶身的乳白色脂膜完全脱落,得到白色混悬液,即为脂膜水化液,最后将其转移至50ml的圆底离心管中。采用声振仪对圆底离心管内的混悬液进行乳化,乳化过程中声振仪功率为:150w,时间:5min(开:5s,关:5s),此步骤均在冰浴中进行。将所得的乳状液体置于高速冷冻离心机内离心分离,温度:4℃,转速:8000rpm,时间:5min,离心完后去弃上清液,用双蒸水重悬沉淀,重复三次以上离心步骤,制备得到脂质纳米粒溶液。
将制备好的脂质纳米粒溶液中加入提取的Serca2a质粒,共同敷育1h,通过正负电荷吸附作用使Serca2a质粒与脂质纳米粒连接,得到多肽修饰的靶向纳米粒GKW/Serca2a/Lip。
根据Wang J,Bo H,Meng X,et al.A simple and fast experimental model ofmyocardial infarction in the mouse[J].Texas Heart Institute Journal,2006,33(3):290.公开的方法,通过结扎小鼠冠状动脉左前降支(LAD),构建小鼠心肌梗死模型,具体构建方法如下:
外科手术室温控制在25℃,用乙醚麻醉小鼠,然后通过绑住腿和上颌固定在仰卧位。在左胸部剃光并用75%乙醇消毒后,沿着胸骨左侧的1.5厘米横向切口将皮肤精细地解剖。在解剖皮肤之前,沿着切口边缘通过4-0聚丙烯缝合线。皮下组织沿左胸大肌下缘分离,左胸大肌折射。第4肋间隙暴露并在微钳的帮助下精细解剖1厘米。然后使用自保持型微牵开器分离第3和第4肋骨,使其足以充分暴露操作区域,但肋骨保持完整。心脏被轻轻按压胸部挤出;然后用左手的拇指和食指握住心脏,其顶点指向头部的左侧。5-0聚丙烯缝合线从肺漏斗的左边缘传递到左耳廓的右下角,距离约为2至3毫米。不结扎左冠状动脉的主干,而是将左前降冠状动脉和心大静脉结扎在一起。LAD结扎后不久,胸部的心脏被置换,胸部的血液和空气被食指挤出。用开胸术前准备的缝合线闭合胸部。通过尾静脉注射上述制备的溶液,每48小时注射一次,28天后检测其治疗效果。
对比例1
与实施例1基本相同,不同的是DSPE-PEG2000表面没有共价结合多肽,制备得到的纳米粒记作Serca2a/Lip。
对比例2
与实施例1基本相同,不同的是DSPE-PEG2000表面没有共价结合多肽且脂质纳米粒不连接Serca2a质粒,制备得到的纳米粒记作Lip。
对比例3
MI组为心肌梗死手术组,具体方法为:C57BL/6J小鼠通过腹腔注射戊巴比妥(60mg/kg)进行麻醉,然后以200次/分钟的呼吸频率和0.15ml的潮气量进行机械通气。小鼠被麻醉后,进行左胸切开,放置胸骨牵引器以分离肋骨并暴露心脏。在模型组和给药组中用8-0线结扎左前降支动脉(LAD)。最后,用5-0线将肌肉、筋膜和皮肤依次分层缝合。而后不做任何处理,仅在每次治疗组给药时给予相同剂量生理盐水。
对比例4
Sham组为假手术组,具体造模方法同心肌梗死组,但不结扎左前降支动脉(LAD),而后不做任何处理,仅在每次治疗组给药时给予相同剂量生理盐水。
图3为实施例1与对比例1-4所对应的不同组别的超声心动图,超声心动图检测左心室功能,结果显示:在MI模型建立成功7天后,小鼠的EF(射血分数)值和FS(短轴缩短率)值都有明显下降,同时LVSD(左室收缩末期内径)上升,提示小鼠左心室增大,左心功能下降。而Serca2a/Lip组和GKW/Serca2a/Lip组同MI造模组相比,其心脏收缩功能有所改善,这两组的EF分别为63.90±2.030%、70.06±1.314%;而GKW/Serca2a/Lip治疗组与Serca2a/Lip治疗组相比,显示了更强的保护作用(P<0.05)。在治疗的第14天和第28天,各组的EF(射血分数)、FS(短轴缩短率)和LVSD(左室收缩末期内径)都有类似且更大的变化。此外,GKW/Serca2a/Lip组治疗28天后可明显缓解由MI诱导的LVDD(左室舒张末期内径)上调,而Serca2a/Lip组并未显示此变化。
图4为实施例1与对比例1-4所对应的不同组别的射血分数图、短轴收缩率图、LVS内径图和LVD内径图;超声心动图检测左心室功能显示:心肌梗死模型建立7天后,EF值和FS值均显著下降(EF:78.42±1.598%对56.35±1.838%,P<0.001;FS:46.12±1.499%对28.72±1.163%,P<0.001),同时伴随着LVSD的上调(1.774±0.06622mm对2.390±0.1894mm,P<0.05)。Serca2a/Lip和GKW/Serca2a/Lip都能减轻MI诱导的小鼠功能障碍(EF:63.90±2.030%[Serca2a/Lip,P<0.05]和70.06±1.314%[GKW/Serca2a/Lip,P<0.001]vs.56.35±1.838%[MI];FS:33.95±1.404%[Serca2a/Lip,P<0.05]和38.49±1.077%[GKW/Serca2a/Lip,P<0.001]vs.28.72±1.163%[MI];LVSD:2.250±0.1240mm[Serca2a/Lip,P=0.5545]和1.839±0.1043mm[GKW/Serca2a/Lip,P<0.05]vs.2.390±0.1894mm[MI]),而与Serca2a/Lip治疗组相比,GKW/Serca2a/Lip治疗组显示出更显著的保护作用(P<0.05)。在治疗的第14天和第28天,各组的EF、FS和LVSD都发生了相似且更大的变化。此外,使用GKW/Serca2a/Lip治疗28天可显著缓解MI诱导的LVDD上调,而使用Serca2a/Lip则没有(3.740±0.2074mm[Serca2a/Lip,P=0.0758]和3.354±0.07490mm[GKW/Serca2a/Lip,P=0.001]vs.4.287±0.1698mm[MI])。以上结果表明,在28天内,GKW/Serca2a/Lip比非靶向的Serca2a负载纳米颗粒对小鼠的心脏具有持续和更有效的保护作用。
图5为实施例1与对比例1-4所对应的不同组别的生存率曲线图,治疗后28天显示,GKW/Serca2a/Lip治疗组小鼠生存率在80%左右,而MI心肌梗死组,其小鼠生存率在50%以下,同时,单纯LIP组和非靶向组其小鼠生存率较MI组高,但是均显著低于GKW/Serca2a/Lip治疗组。
以上结合具体实施方式和范例性实例对本申请进行了详细说明,不过这些说明并不能理解为对本申请的限制。本领域技术人员理解,在不偏离本申请精神和范围的情况下,可以对本申请技术方案及其实施方式进行多种等价替换、修饰或改进,这些均落入本申请的范围内。本申请的保护范围以所附权利要求为准。
- 一种载PD1抗体的靶向相变型纳米粒及其制备方法和应用
- 一种基于功能化纳米粒的COX-2抑制剂靶向筛选系统及其制备方法和应用
- 一种金纳米粒子/三维氧化锰/聚吡咯修饰玻碳电极的制备方法及应用
- 一种清道夫受体-A靶向的脂肪酸修饰的白蛋白纳米粒及其制备方法和应用
- 一种靶向肽修饰的中药多组分“外泌体样”融合纳米粒及其制备方法和应用
