检测CM-TMA生物标志物的方法
文献发布时间:2024-04-18 19:59:31
相关专利申请的交叉引用
本国际专利申请要求2021年5月28日提交的美国临时专利申请号63/194,704和2021年10月26日提交的美国临时专利申请号63/272,033的优先权,每一个申请的披露内容均以其全文并入本文。
背景
1.领域
本披露涉及用于检测补体介导的血栓性微血管病(CM-TMA)生物标志物的药剂和方法。这些药剂可以特异性结合CM-TMA生物标志物,优选补体组分因子B的蛋白水解片段(Ba)和可溶性C5b9(sC5b9),并且可以用于诊断和治疗CM-TMA的方法中。
2.相关技术描述
补体介导的血栓性微血管病(CM-TMA)是一种由过量补体产生驱动的临床障碍。其特征是血小板减少和微血管病性溶血性贫血(MAHA),并伴有微血管血栓形成,导致全身器官损伤(TMA)。CM-TMA的一种形式是非典型溶血性尿毒症综合征(aHUS),其特征是由于补体系统天然调节因子的丧失而导致病理性补体激活,从而导致全身内皮和器官损伤。红斑狼疮是一种与补体激活以及称为狼疮性肾炎(LN)的肾衰竭相关的多系统免疫复合物障碍。这些患者中的一部分还出现TMA,伴有进行性危及生命的血小板减少症、MAHA和与aHUS类似的进行性肾功能衰竭。这部分患者对皮质类固醇、环磷酰胺、免疫调节和血浆置换的应答性较差。Park等人
发明内容
本披露部分基于尿液和/或血浆中能够对CM-TMA患者进行诊断、预后、管理和治疗的生物标志物的鉴定。具体地,本披露涉及以下蛋白生物标志物,例如胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;和/或补体sC5b-9/肌酐比率;优选地使用包括至少两种生物标志物Ba和sC5b9的生物标志物特征,在诊断CM-TMA和测量患者对抗C5抗体疗法(例如用雷夫利珠单抗
在实施例中,用于评估完全TMA应答的方法可包括检测受试者中的一组生物标志物,可包括检测从该受试者获得的流体生物样品中至少1种、至少2种、至少3种、至少4种、至少5种、至少6种选自由以下组成的组的生物标志物的水平:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;补体sC5b-9/肌酐比率、sVCAM-1、sTNF-R1和/或血栓调节蛋白;优选地检测包含至少两种生物标志物的子集中的生物标志物的水平,该至少两种生物标志物包含Ba和sC5b9。生物标志物的子集可包含血清sVCAM-1、血清sTNF-R1、血浆血栓调节蛋白和尿液sC5b-9。
在实施例中,用于诊断受试者中补体介导的血栓性微血管病(CM-TMA)的方法可以包括(a)检测从受试者获得的流体生物样品中选自由以下组成的组的生物标志物的水平:胱抑素C、胱抑素C/肌酐比率、补体因子Ba、补体因子Ba/肌酐比率、补体sC5b-9、补体sC5b-9/肌酐比率、sVCAM-1、sTNF-R1、血栓调节蛋白或其组合;以及(b)将一种或多种生物标志物的水平;优选地特征中生物标志物的水平;与对照进行比较,其中该受试者的生物样品中的生物标志物水平与对照相比的增加表明该受试者患有、怀疑患有或有风险患CM-TMA。
在实施例中,用于评估受试者中补体介导的血栓性微血管病(CM-TMA)的治疗的方法可以包括(a)从患有补体介导的血栓性微血管病(CM-TMA)的受试者获得流体生物样品;(b)检测从该受试者获得的流体生物样品中选自由以下组成的组的生物标志物的水平:胱抑素C、胱抑素C/肌酐比率、补体因子Ba、补体因子Ba/肌酐比率、补体sC5b-9、补体sC5b-9/肌酐比率、sVCAM-1、sTNF-R1、血栓调节蛋白或其组合;(c)将该一种或多种生物标志物的水平与对照进行比较,其中该对照包含未患有补体介导的血栓性微血管病(CM-TMA)的患者,(d)治疗患有补体介导的血栓性微血管病(CM-TMA)的受试者;(e)从患有补体介导的血栓性微血管病(CM-TMA)的受试者获得流体生物样品;(f)检测从该受试者获得的流体生物样品中选自由以下组成的组的生物标志物的水平:胱抑素C、胱抑素C/肌酐比率、补体因子Ba、补体因子Ba/肌酐比率、补体sC5b-9、补体sC5b-9/肌酐比率、sVCAM-1、sTNF-R1、血栓调节蛋白、sC5b-9或其组合;(f)将该一种或多种生物标志物的水平与对照进行比较,其中该对照包含未患有补体介导的血栓性微血管病(CM-TMA)的患者。
在实施例中,用于检测生物标志物的方法可以包括(a)从患有补体介导的血栓性微血管病(CM-TMA)的受试者获得流体生物样品;以及(b)检测从该受试者获得的流体生物样品中选自由以下组成的组的生物标志物的水平:胱抑素C、胱抑素C/肌酐比率、补体因子Ba、补体因子Ba/肌酐比率、补体sC5b-9、补体sC5b-9/肌酐比率、sVCAM-1、sTNF-R1、血栓调节蛋白或其组合。该方法可以进一步包括将一种或多种生物标志物的水平与对照进行比较,其中该对照包含未患有补体介导的血栓性微血管病(CM-TMA)的患者。
在实施例中,流体生物样品包含异质样品,该异质样品可包含血浆Ba、尿液Ba/Cr、尿液sC5b-9/Cr和血浆sC5b-9。
在实施例中,检测步骤可以包括检测血清VCAM-1、血清sTNF-R1、血浆血栓调节蛋白和尿液sC5b-9。
在实施例中,用于诊断受试者中补体介导的血栓性微血管病(CM-TMA)的方法可以包括(a)检测从该受试者获得的流体生物样品中至少1种、至少2种、至少3种、至少4种、至少5种、至少6种选自由以下组成的组的生物标志物的水平:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;和/或补体sC5b-9/肌酐比率;优选地检测包含至少两种生物标志物的特征中的生物标志物的水平,该至少两种生物标志物包含Ba和sC5b9;以及(b)将一种或多种生物标志物的水平;优选地特征中生物标志物的水平;与对照进行比较,其中该受试者的生物样品中的生物标志物水平与对照相比的增加表明该受试者患有、怀疑患有或有风险患CM-TMA。
在实施例中,用于检测胱抑素C、补体因子Ba、补体sC5b-9的方法可以包括(a)检测从受试者获得的流体生物样品中至少1种、至少2种、至少3种、至少4种、至少5种、至少6种选自由以下组成的组的生物标志物的水平:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;和/或补体sC5b-9/肌酐比率;优选地检测包含至少两种生物标志物的特征中的生物标志物的水平,该至少两种生物标志物包含Ba和sC5b9;以及(b)将一种或多种生物标志物的水平;优选地特征中生物标志物的水平;与对照,任选地健康受试者进行比较。在实施例中,受试者的生物样品中的生物标志物水平与对照相比的增加表明该受试者患有、怀疑患有或有风险患CM-TMA。
在实施例中,用于检测受试者中的一组生物标志物的方法可以包括检测从该受试者获得的流体生物样品中选自由以下组成的组的生物标志物:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;和/或补体sC5b-9/肌酐比率;优选地检测包含至少两种生物标志物的子集中的生物标志物的水平,该至少两种生物标志物包含Ba和sC5b9。
在实施例中,用于检测受试者中的一组生物标志物的方法可以包括检测从该受试者获得的流体生物样品中选自由以下组成的组的生物标志物:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9,任选的尿液sC5b-9;补体sC5b-9/肌酐比率、sVCAM-1、任选的血清sVACM-1、sTNF-R1、任选的血清sTNF-R1、血栓调节蛋白、任选的血浆血栓调节蛋白、或其组合。
在实施例中,生物标志物可以选自由以下组成的组:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9,任选的尿液sC5b-9;补体sC5b-9/肌酐比率、sVCAM-1、任选的血清sVACM-1(可溶性血管细胞粘附分子-1)、sTNF-R1(可溶性肿瘤坏死因子受体1)、任选的血清sTNF-R1、血栓调节蛋白、任选的血浆血栓调节蛋白、或其组合。
在实施例中,流体生物样品可包括血清、血液、尿液、血浆或其混合物。流体生物样品可以包括尿液。流体生物样品可以包括血浆。流体生物样品可以包括血液。流体生物样品可以包括血清。流体生物样品可以包括尿液、血浆和血清的混合物。
在实施例中,生物标志物可以与受试者的估计肾小球滤过率(eGFR)和/或尿蛋白肌酐比率(UPCR)相关。
在实施例中,该方法可以包括检测来自受试者和对照的流体生物样品中的肌酐水平,并基于肌酐水平将流体生物样品中的生物标志物的水平归一化;优选地,其中流体生物样品可以包括尿液并且使用肌酐测定来检测肌酐水平。
在实施例中,对照可包含来自健康受试者的相同生物样品。
在实施例中,生物标志物可以包含选自胱抑素C、补体因子Ba和/或sC5b9的蛋白生物标志物,并且检测包括使生物标志物与包含特异性地结合该生物标志物的抗体或其抗原结合片段的药剂接触。抗体或其抗原结合片段可以选自由以下组成的组:人源化抗体、重组抗体、双抗体、嵌合的或嵌合型抗体、单克隆抗体、去免疫抗体、全人抗体、单链抗体、Fv片段、Fd片段、Fab片段、Fab'片段、F(ab’)
在实施例中,检测步骤可以包括检测包含以下生物标志物的生物标志物特征:(a)胱抑素C+Ba;(b)胱抑素C+sC5b9;(c)胱抑素C+胱抑素C/肌酐;(d)胱抑素C+Ba/肌酐;(e)胱抑素C+sC5b9/肌酐;(f)Ba+sC5b9;(g)Ba+胱抑素C/肌酐;(h)Ba+Ba/肌酐;(i)Ba+sC5b9/肌酐;(j)sC5b9+胱抑素C/肌酐;(k)sC5b9+Ba/肌酐;(l)sC5b9+sC5b9/肌酐;(m)胱抑素C/肌酐+Ba/肌酐;(n)胱抑素C/肌酐+sC5b9/肌酐;或(o)Ba/肌酐+sC5b9/肌酐。
在实施例中,检测步骤可以包括检测包含以下生物标志物的生物标志物特征:(a)胱抑素C+Ba+sC5b9;(b)胱抑素C+Ba+胱抑素C/肌酐;(c)胱抑素C+Ba+Ba/肌酐;(d)胱抑素C+Ba+sC5b9/肌酐;(e)胱抑素C+sC5b9+胱抑素C/肌酐;(f)胱抑素C+sC5b9+Ba/肌酐;(g)胱抑素C+sC5b9+sC5b9/肌酐;(h)胱抑素C+胱抑素C/肌酐+Ba/肌酐;(i)胱抑素C+胱抑素C/肌酐+sC5b9/肌酐;(j)胱抑素C+Ba/肌酐+sC5b9/肌酐;(k)Ba+sC5b9+胱抑素C/肌酐;(l)Ba+sC5b9+Ba/肌酐;(m)Ba+sC5b9+sC5b9/肌酐;(n)Ba+胱抑素C/肌酐+Ba/肌酐;(o)Ba+胱抑素C/肌酐+sC5b9/肌酐;(p)Ba+Ba/肌酐+sC5b9/肌酐;(q)sC5b9+胱抑素C/肌酐+Ba/肌酐;(r)sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(s)sC5b9+Ba/肌酐+sC5b9/肌酐;或(t)胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐。
在实施例中,检测步骤可以包括检测包含以下生物标志物的生物标志物特征:(a)胱抑素C+Ba+sC5b9+胱抑素C/肌酐;(b)胱抑素C+Ba+sC5b9+Ba/肌酐;(c)胱抑素C+Ba+sC5b9+sC5b9/肌酐;(d)胱抑素C+sC5b9+胱抑素C/肌酐+(e)胱抑素C+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(f)胱抑素C+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;(g)Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐;(h)Ba+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(i)Ba+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;或(j)sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐。
在实施例中,检测步骤可以包括检测包含以下生物标志物的生物标志物特征:(a)胱抑素C+Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐;(b)胱抑素C+Ba+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(c)胱抑素C+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;或(d)Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐。
在实施例中,检测步骤可以包括检测包含以下生物标志物的生物标志物特征:(a)胱抑素C+Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐。
在实施例中,该方法可以进一步包括检测选自Ba和sC5b9的血浆生物标志物。
在实施例中,该方法可以进一步包括检测包含Ba和sC5b9的血浆生物标志物特征。
在实施例中,流体生物样品可包含含有尿液和血浆的异质样品,并且检测步骤可包括检测生物标志物特征,该生物标志物特征包含选自以下的至少一种尿液生物标志物和至少一种血浆生物标志物:(a)尿液胱抑素C+血浆Ba;(b)尿液胱抑素C+血浆sC5b9;(c)尿液Ba+血浆Ba;(d)尿液Ba+血浆sC5b9;(e)尿液sC5b9+血浆Ba;(f)尿液sC5b9+血浆sC5b9;(g)尿液胱抑素C/肌酐+血浆Ba;(h)尿液胱抑素C/肌酐+血浆sC5b9;(i)尿液Ba/肌酐+血浆Ba;(j)Ba/肌酐+血浆sC5b9;(k)尿液sC5b9/肌酐+血浆Ba;或(l)尿液sC5b9/肌酐+血浆sC5b9。
在实施例中,流体生物样品可包含含有尿液和血浆的异质样品,并且检测步骤可包括检测生物标志物特征,该生物标志物特征包含选自以下的至少一种尿液生物标志物和至少两种血浆生物标志物:(a)尿液胱抑素C+血浆Ba+血浆sC5b9;(b)尿液Ba+血浆Ba+血浆sC5b9;(c)尿液sC5b9+血浆Ba+血浆sC5b9;(d)尿液胱抑素C/肌酐+血浆Ba+血浆sC5b9;(e)尿液Ba/肌酐+血浆Ba+血浆sC5b9;或(f)尿液sC5b9/肌酐+血浆Ba+血浆sC5b9。
在实施例中,流体生物样品可包含含有尿液和血浆的异质样品,并且检测步骤包括检测生物标志物特征,该生物标志物特征包含选自以下的至少两种尿液生物标志物和至少一种血浆生物标志物:(a)尿液胱抑素C+尿液Ba+血浆Ba或血浆sC5b9;(b)尿液胱抑素C+尿液sC5b9+血浆Ba或血浆sC5b9;(c)尿液胱抑素C+尿液胱抑素C/肌酐+血浆Ba或血浆sC5b9;(d)尿液胱抑素C+尿液Ba/肌酐+血浆Ba或血浆sC5b9;(e)尿液胱抑素C+尿液sC5b9/肌酐+血浆Ba或血浆sC5b9;(f)尿液Ba+尿液sC5b9+血浆Ba或血浆sC5b9;(g)尿液Ba+尿液胱抑素C/肌酐+血浆Ba或血浆sC5b9;(h)尿液Ba+尿液Ba/肌酐+血浆Ba或血浆sC5b9;(i)尿液Ba+尿液sC5b9/肌酐+血浆Ba或血浆sC5b9;(j)尿液sC5b9+尿液胱抑素C/肌酐+血浆Ba或血浆sC5b9;(k)尿液sC5b9+尿液Ba/肌酐+血浆Ba或血浆sC5b9;(l)尿液sC5b9+尿液sC5b9/肌酐+血浆Ba或血浆sC5b9;(m)尿液胱抑素C/肌酐+尿液Ba/肌酐+血浆Ba或血浆sC5b9;(n)尿液胱抑素C/肌酐+尿液sC5b9/肌酐+血浆Ba或血浆sC5b9;或(o)尿液Ba/肌酐+尿液sC5b9/肌酐+血浆Ba或血浆sC5b9。生物标志物可以包括血浆补体因子Ba、sC5b-9、血栓调节蛋白和D-二聚体;血清sTNF-RI和sVCAM-1;尿液因子Ba、sC5b-9和胱抑素C。
在实施例中,该方法可以进一步包括测量次要标志物,该次要标志物包含受试者的估计肾小球滤过率(eGFR)。
在实施例中,该方法可以进一步包括测量次要标志物,该次要标志物包含受试者的尿蛋白/肌酐比率(UPCR)。
在实施例中,生物标志物和一种或多种次要标志物的水平与对照相比升高。
在实施例中,对照可包含从没有补体介导的血栓性微血管病(CM-TMA)的受试者、任选地具有不可检测的尿液sC5b9水平的受试者获得的相同流体生物样品。
在实施例中,受试者可以是哺乳动物。受试者可以是人。
在实施例中,受试者可能患有、可能怀疑患有或可能有风险发展补体介导的血栓性微血管病(CM-TMA)。
在实施例中,受试者可能已经或正在用补体抑制剂治疗。补体抑制剂可包含选自由抗体、小分子、多肽、多肽类似物、拟肽物和适体或其组合组成的组的补体C5抑制剂。补体C5抑制剂可以选自由以下组成的组:重组抗C5微型抗体MB12/22、靶向内皮的抗C5微型抗体MB12/22-RGD、C5特异性适体ARC187、C5特异性适体ARC1905(培戈-阿伐普他)、葡萄球菌超抗原样蛋白7(SSL7)、毛白钝缘蜱C抑制剂(OmCl)或其组合。补体抑制剂可以包含抗C5抗体或其抗原结合片段,该抗C5抗体或其抗原结合片段(a)特异性结合补体C5,并且任选地(b)抑制C5裂解成片段C5a和C5b;优选地,其中抗原结合片段包含抗C5抗体的抗体重链互补决定区1-3(V
在实施例中,抗C5抗体可以包含雷夫利珠单抗或其生物类似物;优选地,其中该治疗包括用雷夫利珠单抗治疗,用雷夫利珠单抗治疗包括在第1天的单次负荷剂量,随后基于该受试者的体重从第15天开始定期维持给药,其中(a)对于体重≥40至<60千克(kg)的受试者,治疗包括2400毫克(mg)负荷,然后每8周3000mg维持剂量;(b)对于体重≥60至<100kg的受试者,治疗包括2700mg负荷,然后每8周3300mg维持剂量;以及(c)对于体重≥100kg的受试者,治疗包括3000mg负荷,然后每8周3600mg维持剂量。抗C5抗原结合片段可包含培克珠单抗。
在实施例中,受试者可能已经用补体抑制剂治疗并且在从受试者获得流体生物样品之前治疗进行了少于一个月,任选地少于31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2或1天。
在实施例中,该方法可以进一步包括确定受试者是否有发展补体介导的血栓性微血管病(CM-TMA)的风险。
在实施例中,受试者可能在预定给药方案下已经或正在用补体抑制剂治疗,该方法进一步包括确定患者是否对补体抑制剂疗法有治疗性应答。
在实施例中,受试者可能患有或可能有风险发展补体介导的血栓性微血管病(CM-TMA),该补体介导的血栓性微血管病包含非典型溶血性尿毒症综合征(aHUS);优选地,其中CM-TMA包含肾aHUS。
在实施例中,监测受试者对用补体C5抑制剂治疗的应答性的方法包括在该治疗之前和之后检测从该受试者获得的流体生物样品中至少1种、至少2种、至少3种、至少4种、至少5种、至少6种选自由以下组成的组的生物标志物的水平:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;和/或补体sC5b-9/肌酐比率;优选地检测包含至少两种生物标志物的特征中的生物标志物的水平,该至少两种生物标志物包含Ba和sC5b9,并比较该治疗之前和该治疗之后该受试者的流体生物样品中该一种或多种生物标志物的水平;优选地,该特征中的生物标志物的水平;其中该受试者患有、怀疑患有或有风险发展补体介导的血栓性微血管病(CM-TMA);其中该受试者已经或正在用补体C5抑制剂治疗;并且其中与用该补体C5抑制剂治疗之前该一种或多种生物标志物的水平相比,治疗后该受试者的流体生物样品中该一种或多种生物标志物的水平降低表明该受试者对该治疗有应答。该方法可以进一步包括测量次要标志物,该次要标志物包含受试者的估计肾小球滤过率(eGFR)。该方法可以进一步包括测量次要标志物,该次要标志物包含受试者的尿蛋白/肌酐比率(UPCR)。治疗后受试者的流体生物样品中的生物标志物和一种或多种次要标志物的水平可能降低。
在实施例中,使用补体抑制剂以足以诱导补体介导的血栓性微血管病(CM-TMA)相关生物标志物蛋白的生理变化的方式治疗CM-TMA的方法,该方法可以包括:(a)测定从该受试者获得的生物流体中这些CM-TMA相关生物标志物蛋白的水平或活性,其中这些CM-TMA相关生物标志物蛋白选自由以下组成的组:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;和/或补体sC5b-9/肌酐比率;优选地确定包含至少两种生物标志物的特征中的生物标志物的水平或活性,该至少两种生物标志物包含Ba和sC5b9;以及(b)向患有、怀疑患有或有风险发展CM-TMA的受试者施用补体抑制剂,施用的量和频率足以导致该生物标志物或该生物标志物特征的水平或活性与该生物标志物或该生物标志物特征在用该抑制剂治疗前从该受试者获得的相同类型的生物流体样品中的水平或活性相比降低。补体抑制剂可以包含雷夫利珠单抗。
在实施例中,用于确定在预定给药方案下用补体抑制剂治疗的患有补体介导的血栓性微血管病(CM-TMA)的患者是否需要不同的给药方案的方法,该方法可以包括(A)确定该CM-TMA患者是否在预定给药方案下对用补体抑制剂治疗有应答,其中该确定包括:确定从该受试者获得的生物流体中CM-TMA相关生物标志物蛋白的浓度和活性之一或两者,其中该CM-TMA相关生物标志物蛋白选自由以下组成的组:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;和/或补体sC5b-9/肌酐比率;优选地确定包含至少两种生物标志物的特征中的生物标志物的水平,该至少两种生物标志物包含Ba和sC5b9,并且其中:(a)与用该抑制剂治疗之前从该受试者获得的相同类型的生物流体样品中的浓度相比,该生物标志物或该生物标志物特征的水平或活性降低表明该受试者对用该抑制剂治疗有应答;以及(B)如果患者对用该补体抑制剂治疗没有应答,则向无应答患者施用不同的补体抑制剂或以与预定给药方案相比更高剂量或更频繁给药的方案施用相同的补体抑制剂。补体抑制剂可以包含雷夫利珠单抗。生物标志物可以选自由以下组成的组:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9,任选的尿液sC5b-9;补体sC5b-9/肌酐比率、sVCAM-1、任选血清sVACM-1;sTNF-R1,任选血清sTNF-R1;血栓调节蛋白,任选血浆血栓调节蛋白;或其组合。
在实施例中,用于诊断补体介导的血栓性微血管病(CM-TMA)的试剂盒可以包含测定板和结合剂,任选地连同使用该试剂盒的说明书,其中该结合剂是抗体或其抗原结合片段,该抗体或其抗原结合片段独立地特异性结合多种生物分析物,其中这些分析物是CM-TMA的蛋白生物标志物,并且其中这些蛋白生物标志物包含补体组分因子B的蛋白水解片段(Ba)和可溶性C5b9(sC5b-9),任选地连同胱抑素C。生物标志物可以选自由以下组成的组:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9,任选的尿液sC5b-9;补体sC5b-9/肌酐比率、sVCAM-1、任选血清sVACM-1;sTNF-R1,任选血清sTNF-R1,血栓调节蛋白,任选血浆血栓调节蛋白;或其组合。试剂盒可以进一步包含用于肌酐测定的试剂。试剂盒可以进一步包含用于确定尿蛋白/肌酐比率(UPCR)的试剂。
在实施例中,用于治疗受试者中补体介导的血栓性微血管病(CM-TMA)的组合物可以包含有效量的补体抑制剂,其中该补体抑制剂是抗C5抗体或其C5结合片段,优选依库珠单抗、雷夫利珠单抗或其生物类似物。有效量可以是与用补体抑制剂治疗之前生物标志物和/或生物标志物特征的水平相比足以降低受试者中该生物标志物和/或生物标志物特征的水平的量。生物标志物可以包含至少1种、至少2种、至少3种、至少4种、至少5种、至少6种选自由以下组成的组的生物标志物:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;补体sC5b-9/肌酐比率或其组合。生物标志物特征可包含至少两种生物标志物,该至少两种生物标志物包含Ba和sC5b9。可以在从受试者获得的流体生物样品中检测生物标志物和/生物标志物特征的水平。流体生物样品可以是尿液、血浆或其组合。生物标志物可以选自由以下组成的组:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9,任选的尿液sC5b-9;补体sC5b-9/肌酐比率、sVCAM-1、任选血清sVACM-1;sTNF-R1,任选血清sTNF-R1;血栓调节蛋白,任选血浆血栓调节蛋白;或其组合。
在实施例中,本披露涉及有效量的补体抑制剂用于制造治疗补体介导的血栓性微血管病(CM-TMA)的药物的用途,其中该补体抑制剂是抗C5抗体或其C5结合片段,优选依库珠单抗、雷夫利珠单抗或其生物类似物。有效量可以是与用补体抑制剂治疗之前生物标志物和/或生物标志物特征的水平相比足以降低受试者中该生物标志物和/或生物标志物特征的水平的量。生物标志物可以包含至少1种、至少2种、至少3种、至少4种、至少5种、至少6种选自由以下组成的组的生物标志物:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;补体sC5b-9/肌酐比率或其组合。生物标志物特征可包含至少两种生物标志物,该至少两种生物标志物包含Ba和sC5b9。可以在从受试者获得的流体生物样品中检测生物标志物和/生物标志物特征的水平。流体生物样品可以是尿液、血清、血浆或其组合。生物标志物可以选自由以下组成的组:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9,任选的尿液sC5b-9;补体sC5b-9/肌酐比率;sVCAM-1,任选血清sVACM-1;sTNF-R1,任选血清sTNF-R1;血栓调节蛋白,任选血浆血栓调节蛋白,或其组合。
附图说明
为了进一步理解本披露的本质、目的和优点,应当参考下面的详细描述,并结合附图阅读,其中相同的附图标记表示相同的要素。
图1描绘了雷夫利珠单抗治疗情况下补体失调和肾损伤减少的生物标志物。p值衍生自重复测量分析的混合模型,其中经对数转换的生物标志物作为因变量,并且就诊的固定分类效应和经对数转换的基线值的固定连续效应作为协变量,测试零假设(即,相对于基线的平均变化等于零)相比于另一种假设(即,平均变化不等于零)。虚线代表正常供体样品的最小值和最大值。BL,基线;Cr,肌酐。
图2描绘了基线生物标志物与基线临床测量之间的关联。回归系数源自简单线性回归分析,其中经对数转换的基线临床测量作为因变量,经对数转换的基线生物标志物水平作为自变量。基线生物标志物每增加2倍,实验室值就会增加(或减少)2倍(提高到回归系数)。要计算增加(或减少)百分比,请从此值中减去1,然后乘以100;p值源自回归系数为零的原假设的双侧t检验。报告Spearman相关系数。轮廓方框表示补体失调和肾损伤的生物标志物的统计学显著性结果。突出显示/阴影表示非常高的相关性。Cr,肌酐;eGFR,估计肾小球滤过率;LDH,乳酸脱氢酶;UPCR,尿蛋白/肌酐比率。
图3描绘了基线生物标志物与治疗26周临床测量变化之间的关联。回归系数源自简单线性回归分析,用经对数转换的简单线性回归分析,以临床测量中相对于基线的26周变化作为因变量,以基线生物标志物水平的log(2)作为自变量。基线生物标志物每增加2倍,实验室值的变化就会按回归系数增加(或减少);p值源自回归系数为零的原假设的双侧t检验。报告Spearman相关系数。红色方框表示补体特异性生物标志物的统计学显著性结果。黄色突出显示表示非常高的相关性。Cr,肌酐;eGFR,估计肾小球滤过率;LDH,乳酸脱氢酶;UPCR,尿蛋白/肌酐比率。
图4描绘的数据显示基线生物标志物水平与26周时的选定临床结果显著相关。*定义为血小板计数正常化、LDH正常化和血清肌酐改善。CI,置信区间;Cr,肌酐;LDH,乳酸脱氢酶;TMA,血栓性微血管病。
图5描绘了随时间到52周观察到的血液中生物标志物水平的小提琴图。(A)血浆Ba;(B)血浆血栓调节蛋白;(C)血浆sC5b-9;(D)血浆D-二聚体;(E)血清sTNF-R1;(F)血清sVCAM-1。雷夫利珠单抗剂量根据体重确定,并在基线时给予负荷剂量,第15天给予第2剂量,第71天给予维持剂量,此后每周一次。水平线代表25%、中值和75%四分位数。P值是根据重复测量分析的混合模型计算得出的,以生物标志物作为因变量,以就诊的固定分类效应和基线值的固定连续效应作为协变量。相对于基线的平均变化为零的原假设相对于平均变化不等于零的备择假设进行了检验。
图6描绘了随时间到52周观察到的尿液中生物标志物水平的小提琴图。(A)尿液胱抑素C/肌酐;(B)尿液sC5b-9/肌酐;(C)尿液Ba/肌酐。雷夫利珠单抗剂量根据体重确定,并在基线时给予负荷剂量,第15天给予第2剂量,第71天给予维持剂量,此后每周一次。水平线代表25%、中值和75%四分位数。P值是根据重复测量分析的混合模型计算得出的,以生物标志物作为因变量,以就诊的固定分类效应和基线值的固定连续效应作为协变量。相对于基线的平均变化为零的原假设相对于平均变化不等于零的备择假设进行了检验。
图7描绘了52周时根据完全TMA应答状态的eGFR和生物标志物(血液中)相对于基线随时间变化的线图。(A)血浆Ba,ng/mL(实心圆圈);(B)血浆血栓调节蛋白,ng/mL(实心圆圈);(C)血浆sC5b-9,ng/mL(实心圆圈);(D)血浆D-二聚体,ng/mL(实心圆圈);(E)血清sTNF-R1,ng/mL(实心圆圈);(F)血清sVCAM-1,ng/mL(实心圆圈)。将血液和尿液生物标志物相对于基线的变化与52周的eGFR临床测量进行比较。实线表示完全TMA应答者;虚线表示无完全TMA应答者;实心星表示eGFR(mL/min/1.73m
图8描绘了52周时根据完全TMA应答状态的eGFR和生物标志物(尿液中)相对于基线随时间变化的线图。(A)尿液胱抑素C/肌酐,ng/mg肌酐(实心圆圈);(B)尿液sC5b-9/肌酐,ng/mg肌酐(实心圆圈);(C)尿液Ba/肌酐,ng/mg肌酐(实心圆圈)。将血液和尿液生物标志物相对于基线的变化与52周的eGFR临床测量进行比较。实线表示完全TMA应答者;虚线表示无完全TMA应答者;实心星表示eGFR(mL/min/1.73m
图9描绘了基于基线生物标志物水平,治疗52周时完全TMA应答的逻辑回归分析。优势比源自逻辑回归分析(其中应答变量作为因变量,基线生物标志物水平的对数作为自变量),并且代表基线生物标志物中每增加2倍,实现功效应答的几率增加(或减少)。CI,置信区间;Cr,肌酐;LDH,乳酸脱氢酶;TMA,血栓性微血管病。
图10描绘了患者相对于正常供体的Ba和sC5b-9水平的接受者操作特征(ROC)曲线。A.尿液和血浆中各个sC5b-9和Ba水平的点图。B.尿液和血浆中组合的生物标志物的ROC曲线。C.尿液和血浆中组合的生物标志物的小提琴图。D.组合的生物标志物的汇总表。TP,真阳性;TN,真阴性;FP,假阳性;FN,假阴性。
图11描绘了患者相对于正常供体的Ba和sC5b-9水平的接受者操作特征(ROC)曲线。A.尿液和血浆中各个生物标志物的ROC曲线。B.尿液和血浆中各个生物标志物的小提琴图。
具体实施方式
在进一步描述本披露之前,应当理解,本披露不限于下面描述的本披露的特定实施例,因为可以对特定实施例进行变化并且仍然落入所附权利要求的范围内。还应当理解,所使用的术语是为了描述特定实施例的目的,并且不旨在进行限制。相反,本披露的范围将由所附权利要求书确定。
在本说明书和所附权利要求中,除非上下文另有明确指示,否则单数形式“一个/一种(a/an)”和“该(the)”包括复数指示物。除非另外定义,否则本文所用的所有技术和科学术语均具有与本披露所属领域的普通技术人员通常所理解的相同的含义。
“抗体”(Ab)和“免疫球蛋白”(Ig)是具有相同结构特性的糖蛋白。虽然抗体展现出对特定抗原的结合特异性,但免疫球蛋白既包括抗体也包括缺乏抗原特异性的其他抗体样分子。
“天然抗体和免疫球蛋白”通常是约150,000道尔顿的异四聚体糖蛋白,由两条相同的轻(L)链和两条相同的重(H)链构成。每个轻链通过一个共价二硫键连接至重链,虽然二硫键的数量在不同免疫球蛋白同种型的重链之间变化。每个重链和轻链也具有规则隔开的链内二硫桥键。每个重链在一个末端处具有可变结构域(VH),随后是多个恒定结构域。每个轻链具有在一个末端处的可变结构域(VL)和在它的另一末端处的恒定结构域;轻链的恒定结构域与重链的第一恒定结构域对齐,并且轻链可变结构域与重链可变结构域对齐。认为特定的氨基酸残基在轻链和重链可变结构域之间形成界面。Clothia等人
术语“可变”广义地指以下事实:可变结构域的某些部分在抗体之间在序列上差异很大,并且用于每种特定抗体针对其特定抗原的结合和特异性。然而,可变性在整个抗体的可变结构域中并不均匀分布。它集中在三个区段中,称为互补决定区(CDR)或高变区,二者都在轻链和重链可变结构域中。可变结构域的更高度保守的部分称为框架(FR)。天然的重链和轻链的可变结构域各自包含四个FR区域,其主要采用β折叠构型,通过三个CDR连接,这三个CDR形成环,所述环连接β折叠结构并且在一些情况下形成β折叠结构的一部分。每条链中的CDR通过FR区域紧密靠近地保持在一起,并且与另一条链的CDR一起促进形成抗体的抗原结合位点(参见Johnson&Wu“Kabat Databse and its applications:30years afterthe first variability plot[卡巴特数据库及其应用:第一个可变性图30年后]”
木瓜蛋白酶消化抗体产生两个相同的抗原结合片段,称为“Fab”片段,每个片段有单抗原结合位点和残余“Fc”片段(其名称反映了其易于结晶的能力)。胃蛋白酶处理得到具有两个抗原结合位点的F(ab′)2片段,该片段仍能交联抗原。
“Fv”是含有完整抗原识别和结合位点的最小抗体片段。在双链Fv种类中,此区域由以下组成:紧密的非共价关联的一个重链可变结构域和一个轻链可变结构域的二聚体。在单链Fv种类中,一个重链可变结构域和一个轻链可变结构域可以通过柔性肽接头共价连接,使得轻链和重链可以按与双链Fv种类中的结构类似的“二聚的”结构关联。正是在这种构型下,每个可变结构域的三个CDR相互作用,以在VH-VL二聚体的表面上确定抗原结合位点。总的来说,这六个CDR赋予抗体抗原结合特异性。然而,即使是单个可变结构域(或仅包含对抗原特异的三个CDR的Fv的一半)也具有识别和结合抗原的能力,尽管亲和力低于整个结合位点。
Fab片段还包含轻链的恒定结构域和重链的第一恒定结构域(CH1)。Fab'片段与Fab片段的不同之处在于在重链CH1结构域的羧基末端添加了几个残基,包括来自抗体铰链区的一个或多个半胱氨酸。Fab'-SH在本文中是针对其中恒定结构域的一个或多个半胱氨酸残基带有游离硫醇基团的Fab'的命名。F(ab′)2抗体片段最初作为成对的Fab'片段产生,片段间具有铰链半胱氨酸。抗体片段的其他化学偶联也是已知的。
任何脊椎动物物种的抗体(免疫球蛋白)的“轻链”都可以根据其恒定结构域的氨基酸序列指定为两种明显不同的类型之一,分别称为kappa(“κ”)和lambda(“λ”)。
根据其重链恒定结构域的氨基酸序列,可以将免疫球蛋白分配到不同的类别中。免疫球蛋白主要有五类:IgA、IgD、IgE、IgG和IgM,其中一些可以进一步分为亚类(同种型),例如,IgG1、IgG2、IgG3、IgG4、IgA1和IgA2。对应于不同类别的免疫球蛋白的重链恒定结构域分别称为α、δ、ε、γ和μ。不同类别的免疫球蛋白的亚基结构和三维构型是熟知的。“Therapeutic Antibody Engineering[治疗性抗体工程改造]”(第1版)Strohl&StrohlWoodhead Publishing[斯特罗尔-斯特罗尔伍德黑德出版公司](2012)。术语“抗体”具体涵盖单克隆抗体,包括抗体片段克隆。
“抗体片段”包含完整抗体的一部分,通常是完整抗体的抗原结合区或可变区。抗体片段的实例包括Fab、Fab'、F(ab')2和Fv片段;双抗体;单链抗体分子,包括单链Fv(scFv)分子;以及由抗体片段形成的多特异性抗体。“Human Monoclonal Antibodies:Methodsand Protocols[人单克隆抗体:方法和方案]”(第2版)Steinitz(编辑)Humana Press[哈马纳出版社](2019)。
如本文所用,“单克隆抗体”广义地指自基本上均质的抗体群体(例如构成该群体的个体抗体除可少量存在的天然存在的可能突变外是同一的)获得的抗体(或抗体片段)。单克隆抗体是高度特异性的,针对单个抗原位点。此外,与通常包含针对不同决定簇(表位)的不同抗体的常规(多克隆)抗体制剂相反,每种单克隆抗体针对抗原上的单一决定簇。除了它们的特异性之外,单克隆抗体还在它们通过杂交瘤培养物合成因此不被其他免疫球蛋白污染方面是有优势的。修饰语“单克隆”表示抗体的特征是从基本上同质的抗体群体中获得,并且不应解释为需要通过任何特定方法生产抗体。例如,根据本发明有待使用的单克隆抗体可以通过Kohler等人,Nature[自然],256:495(1975)首次描述的杂交瘤方法,或可以通过重组DNA方法(参见,例如美国专利号4,816,567)制备。例如,“单克隆抗体”还包括使用以下文献中描述的技术从噬菌体抗体文库分离的含有抗原识别和结合位点的抗体片段的克隆(Fv克隆):Clackson等人,Nature[自然],352:624-628(1991)和Marks等人,J.Mol.Biol.[分子生物学杂志],222:581-597(1991)。
本文中的单克隆抗体具体包括“嵌合”抗体(免疫球蛋白),其中重链和/或轻链的一部分与对应的衍生自一个特定种类的抗体或属于一个特定抗体种类或亚类的序列相同或同源,而该一个或多个链的其余部分是与衍生自另一个种类的抗体的或属于另一个抗体种类或亚类的抗体连同此种抗体的片段中的对应序列相同或同源,只要它们表现出所需的生物活性即可(美国专利号4,816,567,归属于Cabilly等人;Morrison等人,Proc.Natl.Acad.Sci.USA[],81:6851-6855(1984));“Antibody Engineering[抗体工程改造]”第2卷(第2版)Kontermann&Dübel.Springer Press[施普林格出版社](2010)。
“人”抗体(也称为“全人”抗体)广义地指包含人框架区和来自人免疫球蛋白的所有CDR的抗体。在一个实例中,框架和CDR来自相同来源的人重链和/或轻链氨基酸序列。然而,来自一种人抗体的框架可以被工程改造以包含来自不同人抗体的CDR。
“人源化”形式的非人(例如鼠)抗体是嵌合免疫球蛋白、免疫球蛋白链或其片段(例如Fv、Fab、Fab'、F(ab')2或抗体的其他抗原结合子序列),其含有衍生自非人免疫球蛋白的最小序列。大多数情况下,人源化抗体是人免疫球蛋白(受体抗体)(其中接受体的互补决定区(CDR)的残基被非人物种(例如小鼠、大鼠或兔)的CDR残基取代))或合成序列(供体抗体)(其具有所需的特异性、亲和力和容量)。在一些情况下,人免疫球蛋白的Fv框架区(FR)残基被相应的非人残基替代。此外,人源化抗体可包含既不在接受体抗体中也不在导入的CDR或框架序列中发现的残基。进行这些修饰以进一步改善和优化抗体性能。在一些实施例中,所有CDR均来自人源化免疫球蛋白中的供体免疫球蛋白。恒定区不需要存在,但如果存在,它们应该与人免疫球蛋白恒定区基本相同,例如,至少约85-90%,例如约95%或更多相同。因此,人源化免疫球蛋白的所有部分,可能除了CDR之外,与天然人免疫球蛋白序列的相应部分基本上相同。“人源化抗体”是包含人源化轻链和人源化重链免疫球蛋白的抗体。人源化抗体与提供CDR的供体抗体结合相同的抗原。人源化免疫球蛋白或抗体的受体框架可具有被取自供体框架的氨基酸的有限数量的取代。人源化或其他单克隆抗体可以具有另外的保守氨基酸取代,其对抗原结合或其他免疫球蛋白功能基本上没有影响。人源化免疫球蛋白可以通过基因工程改造构建。参见例如,美国专利号5,585,089。
“单链Fv”或“scFv”抗体片段包含抗体的VH和VL结构域,其中这些结构域存在于单条多肽链中。一般而言,scFv多肽进一步包含VH与VL结构域之间的多肽接头,其使得scFv能够形成抗原结合所需的结构。关于scFv的评论参见Pluckthun,The Pharmacology ofMonoclonal Antibodies[单克隆抗体的药理学],第113卷,Rosenburg和Moore编辑,Springer-Verlag,New York[施普林格出版公司,纽约],第269-315页(1994)。
本文所用的“双抗体”广义地指具有两个抗原结合位点的小抗体片段,这些片段包含与同一条多肽链(VH-VL)中的轻链可变结构域(VL)连接的重链可变结构域(VH)。通过使用太短而不允许同一链上的两个结构域之间配对的接头,这些结构域被迫与另一条链的互补结构域配对并产生两个抗原结合位点。双抗体更全面地描述于,例如,EP 404,097;WO93/11161;和Hollinger等人,Proc.Natl.Acad.Sci.USA[美国国家科学院院刊],90:6444–6448(1993)。
“分离的”抗体是已经从其自然环境的组分鉴定并且分离和/或回收的抗体。其自然环境的污染物组分是会干扰抗体的诊断或治疗用途的物质,并且可能包括酶、激素和其他蛋白或非蛋白溶质。在优选的实施例中,抗体将被纯化至(1)如通过Lowry法所确定的按抗体的重量计高于95%,并且最优选地按重量计高于99%,(2)通过使用旋转杯测序仪,足以获得N末端或内部氨基酸序列的至少15个残基的程度,或(3)在使用考马斯蓝或优选地银染色的还原或非还原条件下,根据SDS-PAGE的均一性。分离的抗体包括重组细胞内的原位抗体,因为抗体的天然环境的至少一种组分将不存在。然而,通常,通过至少一个纯化步骤制备分离的抗体。
如本文所用,“结合剂”广义地指结合抗原(例如,生物标志物蛋白)的任何天然存在的、合成的或基因工程改造的药剂,例如蛋白。结合剂可以是天然存在的抗体或衍生自天然存在的抗体。结合蛋白或结合剂可以通过与特定抗原结合形成复合物来发挥与抗体类似的作用。结合剂或结合蛋白可以包括抗体的分离的抗原结合片段。
本文所用的“哺乳动物”广义地指哺乳动物纲的任何和所有温血脊椎动物,其特征是皮肤上覆盖着毛发,并且在雌性中,具有产奶的乳腺以滋养幼崽。哺乳动物包括但不限于人、家养动物和农场动物以及动物园动物、竞技动物或宠物。哺乳动物的实例包括但不限于羊驼、犰狳、水豚、猫、骆驼、黑猩猩、毛丝鼠、牛、狗、沙鼠、山羊、大猩猩、豚鼠、仓鼠、马、人、狐猴、羊驼、小鼠、非人灵长类动物、猪、大鼠、绵羊、鼩鼱、松鼠和貘。哺乳动物包括但不限于牛、狗、马、猫、鼠、绵羊、猪、灵长类和啮齿类动物。哺乳动物还包括华盛顿特区史密森学会国家自然历史博物馆(National Museum of Natural History,Smithsonian Institutionin Washington D.C.)维护的世界哺乳动物物种(Mammal Species of the World)中列出的任何和所有物种。同样,术语“受试者”或“患者”包括人和兽医受试者和/或患者。
如本文所用,“正常”广义地指患有/不患有特定疾病或病症(例如CM-TMA、aHUS)并且也不怀疑患有或有风险患该疾病或病症。术语“正常”在本文中还用于限定从正常或健康个体或受试者(或这样的受试者组)分离的生物样本或样品(例如,生物流体),例如,“正常对照样品”或“正常对照生物流体”。
如本文所用,“有风险发展aHUS”的受试者广义地指具有一种或多种(例如,两种、三种、四种、五种、六种、七种或八种或更多种)风险因素发展该疾病的受试者。aHUS的风险因素在医学领域中是众所周知的,包括,例如,发展该病症的倾向,例如,该病症的家族史或发展该病症的遗传倾向,例如,补体因子H(CFH)、膜辅因子蛋白(MCP;CD46)、C4b结合蛋白、补体因子B(CFB)或补体因子I(CFI)中的一个或多个突变。参见,例如,Warwicker等人(1998)Kidney Int[国际肾脏期刊]53:836-844;Richards等人(2001)Am J Hum Genet[美国人类遗传学杂志]68:485-490;Caprioli等人(2001)Am Soc Nephrol[美国肾病学会杂志]12:297-307;Neuman等人(2003)J Med Genet[医学遗传学杂志]40:676-681;Richards等人(2006)Proc Natl Acad Sci USA[美国国家科学院院刊]100:12966-12971;Fremeaux-Bacchi等人(2005)J Am Soc Nephrol[美国肾病学会杂志]17:2017-2025;Esparza-Gordillo等人(2005)Hum Mol Genet[人类分子遗传学]14:703-712;Goicoechea de Jorge等人(2007)Proc Natl Acad Sci USA[美国国家科学院院刊]104(1):240-245;Blom等人(2008)J Immunol[免疫学杂志]180(9):6385-91;和Fremeaux-Bacchi等人(2004)JMedical Genet[医学遗传学杂志]41:e84)。另参见Kavanagh等人(2006),同上。风险因素还包括,例如,肺炎链球菌感染、妊娠、癌症、暴露于抗癌剂(例如,奎宁、丝裂霉素C、顺铂或博莱霉素)、暴露于免疫治疗剂(例如,环孢菌素、OKT3或干扰素)、暴露于抗血小板剂(例如,噻氯匹定或氯吡格雷)、HIV感染、移植、自身免疫性疾病以及和并型甲基丙二酸尿症和同型胱氨酸尿症(cblC)。参见例如,Constantinescu等人(2004)Am J Kidney Dis[美国肾病杂志]43:976-982;George(2003)Curr Opin Hematol[血液学最新观点]10:339-344;Gottschall等人(1994)Am J Hematol[美国血液学杂志]47:283-289;Valavaara等人(1985)Cancer[癌症]55:47-50;Miralbell等人(1996)J Clin Oncol[临床肿瘤学杂志]14:579-585;Dragon-Durey等人(2005)J Am Soc Nephrol[美国肾病学会杂志]16:555-63;和Becker等人(2004)Clin Infect Dis[临床感染疾病]39:S267-S275。因此,有患aHUS风险的人可以是,例如,有aHUS家族史者和/或HIV感染者。从上面可以清楚地看出,“有风险发展aHUS”的受试者并非是目的物种内的所有受试者。
如本文所用,“怀疑患有aHUS”的受试者广义地指具有该病症的一种或多种症状的受试者。这种病症的症状是医学领域的技术人员所熟知的,包括例如严重高血压、蛋白尿、尿毒症、嗜睡/疲劳、易怒、血小板减少、微血管病性溶血性贫血和肾功能损害(例如急性肾衰竭)。从前述段落中可以清楚地看出,“怀疑患有aHUS”的受试者并非目的物种内的所有受试者。
如本文所用,CM-TMA上下文中的“触发因素”是导致CM-TMA发生的事件、情况或状况。在一些实施例中,CM-TMA触发因素是自身免疫病症或事件。在一些实施例中,触发因素是感染,例如细菌感染、病毒感染、真菌感染或寄生虫感染。在一些实施例中,触发物是移植,例如,骨髓移植或实体器官移植(例如,选自肾脏、胰腺、肝脏、心脏和小肠移植)。在一些实施例中,触发因素是一种或多种药物。在一些实施例中,触发因素是恶性高血压。
补体系统
补体系统与机体的其他免疫系统共同作用以抵御细胞病原体和病毒病原体的入侵。有至少25种补体蛋白,发现这些蛋白是血浆蛋白和膜辅因子的复杂集合。血浆蛋白约占脊椎动物血清中球蛋白的10%。补体组分通过一系列复杂但精确的酶促裂解和膜结合事件相互作用,以此实现其免疫防御功能。由此引起的补体级联使得具有调理、免疫调节和溶解功能的产物产生。与补体激活有关的生物活性的简明汇总提供于例如第16版的The MerckManual[默克家庭诊疗手册]中。
补体级联通过经典途径、替代途径或凝集素途径进行。这些途径共享许多组分,虽然它们的初始步骤不同,但它们会聚并共享相同的“末端补体”组分(C5到C9),这些组分负责激活和破坏靶细胞。
经典途径(CP)通常由抗体识别并结合靶细胞上的抗原位点启动。替代途径(AP)可以不依赖于抗体,并且可以由病原体表面上的某些分子启动。此外,凝集素途径通常以甘露糖结合型凝集素(MBL)与高甘露糖底物的结合启动。这些途径在补体组分C3被活性蛋白酶裂解以产生C3a和C3b的点处会聚。激活补体攻击的其他途径可以在导致补体功能各个方面的事件序列中稍后起作用。C3a是过敏毒素。C3b与细菌和其他细胞以及某些病毒和免疫复合物结合,并对它们进行标记以便从循环中去除。C3b的这种调理功能通常被认为是补体系统最重要的抗感染作用。C3b还与每个途径特有的其他组分形成复合物,形成经典或替代C5转化酶,其将补体组分C5(下文中称为“C5”)裂解成C5a和C5b。
C5的裂解释放生物活性物质,例如C5a(有效的过敏毒素和趋化因子)和C5b(其通过一系列蛋白相互作用导致裂解性末端补体复合物C5b-9的形成)。C5a和C5b-9还具有多效性细胞激活特性,这是通过放大下游炎性因子(例如水解酶、活性氧、花生四烯酸代谢物和各种细胞因子)的释放。
C5b与C6、C7和C8结合以在靶细胞表面形成C5b-8复合物。在结合几个C9分子后,形成攻膜复合物(MAC,C5b-9,末端补体复合物--TCC)。当足够数量的MAC插入靶细胞膜时,它们产生的开口(MAC孔)介导靶细胞的快速渗透裂解。较低的非裂解浓度的MAC会产生其他影响。特别是,少量C5b-9复合物进行膜插入到内皮细胞和血小板中会导致有害的细胞激活。在某些情况下,激活可能先于细胞裂解。
C3a和C5a是激活的补体组分。这些可触发肥大细胞脱颗粒,从而使组胺从嗜碱性粒细胞和肥大细胞释放以及释放其他炎症介质中,导致平滑肌收缩、血管通透性增加、白细胞激活和其他炎性现象,包括导致细胞过多的细胞增殖。C5a还用作趋化肽,用于将促炎性粒细胞吸引到补体激活位点。C5a受体存在于支气管和肺泡上皮细胞以及支气管平滑肌细胞的表面。在嗜酸性粒细胞、肥大细胞、单核细胞、中性粒细胞和激活的淋巴细胞上也发现了C5a受体。
补体介导的血栓性微血管病(CM-TMA)是一种由过量补体产生驱动的临床障碍。其特征是血小板减少和微血管病性溶血性贫血(MAHA),并伴有微血管血栓形成,导致全身器官损伤(TMA)。
aHUS是一种危及生命的遗传性疾病,涉及慢性补体失调。患有该疾病的患者患有血栓性微血管病(TMA)等疾病,这可能导致中风和肾衰竭。依库珠单抗是一种拮抗性抗C5抗体,已被证明可以显著降低TMA、使血小板水平正常化并改善aHUS患者的肾功能。然而,即使补体抑制剂治疗对aHUS患者具有明显而稳健的临床益处,一些患者在治疗时仍然会出现几种aHUS生物标志物蛋白水平升高的情况。参见,美国专利号9,494,601。
aHUS可以是遗传性的、获得性的或特发性的。当同一家族的两个或更多个(例如,三个、四个、五个或六个或更多)成员相隔至少六个月受疾病影响,并且已经排除暴露于共同的触发剂,或者当在受试者中鉴定出一个或多个aHUS相关的基因突变(例如,CFH、MCP/CD46、CFB或CFI中的一个或多个突变)时,aHUS可以被认为是遗传性的。例如,受试者可具有CFH相关aHUS、CFB相关aHUS、CFI相关aHUS或MCP相关aHUS。高达30%的遗传aHUS与CFH突变相关,12%与MCP突变相关,5-10%与CFI突变相关,不到2%与CFB突变相关。遗传aHUS可以是多重的(例如,家族性;两个或更多受影响的家庭成员)或单一(例如,家庭中的单一事件)。当可以鉴定出潜在的环境因素(例如,药物、全身性疾病或不会产生志贺样外毒素的病毒剂或细菌剂)时,aHUS可被视为获得性。当没有明显的触发因素(遗传或环境)时,aHUS可被视为特发性。
本文描述的方法可以包括将受试者鉴定为患有、怀疑患有aHUS或有风险发展aHUS的受试者。除了使用本文所述的aHUS生物标志物谱分析之外,还可以进行实验室测试以确定人受试者是否患有血小板减少症、微血管病性溶血性贫血或急性肾功能不全。血小板减少症可由医疗专业人员诊断为以下中的一项或多项:(i)血小板计数小于150,000/mm
CM-TMA生物标志物的检测
本披露提供了用于检测患有CM-TMA的患者和/或接受补体抑制剂治疗的那些CM-TMA患者的生物流体中的CM-TMA生物标志物的药剂和方法。aHUS很难诊断。
临床上尚无用于诊断和监测补体介导的血栓性微血管病(CM-TMA)患者的经过验证的生物标志物;非典型溶血性尿毒症综合征(aHUS)(CM-TMA的一个形式)患者的生物标志物表征可以为CM-TMA患者的诊断、治疗决策和监测提供信息。
用于CM-TMA患者诊断、预后和监测的经过验证的生物标志物的需求尚未得到满足。发明人出人意料地发现,补体因子Ba和sC5b-9的测量证明了在鉴定TMA患者的CM-TMA/aHUS亚群中的临床效用。事实上,发明人出人意料发现,血管组织生物标志物TNF-RI和血栓调节蛋白与因子Ba一起,基于它们与肾功能障碍和对雷夫利珠单抗治疗的完全TMA应答的强相关性而证明了潜在的临床预后效用。
本文所述的方法可以包括选自以下的至少1种、至少2种、至少3种、至少4种、至少5种或至少6种蛋白生物标志物:(1)胱抑素C;(2)补体Ba;(3)sC5b9;(4)胱抑素C/肌酐;(5)补体Ba/肌酐;(6)sC5b9/肌酐,在诊断、监测和治疗CM-TMA患者中的用途。在生物标志物衍生自尿液的情况下,本披露提供了以下的用途:(a)胱抑素C;(b)Ba;(c)sC5b9;(d)胱抑素C/肌酐;(e)Ba/肌酐;(f)sC5b9/肌酐。更具体地,本披露涉及上述生物标志物单独地或与次级标志物如估计肾小球滤过率(eGFR)和/或尿蛋白肌酐比率(UPCR)联合地在例如使用补体抑制剂如抗C5抗体(如雷夫利珠单抗)诊断和治疗CM-TMA中的用途。特别是,观察到治疗开始后,基线(BL)血浆补体因子Ba与治疗后eGFR变化相关(例如,在输注雷夫利珠单抗26周时)。类似地,尿液sC5b-9、sC5b-9/Cr、尿液Ba和Ba/Cr与治疗后UPCR变化相关(例如,在输注雷夫利珠单抗26周时)。
在本文描述的方法中检测到的生物标志物可以选自由以下组成的组:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9,任选的尿液sC5b-9;补体sC5b-9/肌酐比率;sVCAM-1,任选血清sVACM-1;sTNF-R1,任选血清sTNF-R1;血栓调节蛋白,任选血浆血栓调节蛋白;或其组合。
本披露的CM-TMA生物标志物的结构(例如,氨基酸序列)是已知的并且登记在数据库(例如,GENBANK和/或UNIPROT)中。例如,人胱抑素C已登记为GENBANK号NP_000090(日期:2021年9月12日)和UNIPROT号P01034(日期:2021年6月2日)。被裂解形成Ba和Bb的人补体B已登记为GENBANK号NP_001701(日期:2021年7月26日)和UNIPROT号P00751(日期:2021年6月2日)。形成sC5b9复合物的人C5-C9已登记为GENBANK号NP_001726(C5蛋白;日期:2021年10月3日);NP_000056(C6蛋白;日期:2021年4月20日);NP_000578(C7蛋白;日期:2021年6月27日);NP_000553(C8α蛋白;日期:2021年6月30日)、NP_000057(C8β蛋白;日期:2021年6月24日)和NP_000597(C8γ蛋白;日期:2021年2月14日);NP_001728(C9蛋白;日期:2021年6月26日)和UNIPROT编号P01031(C5蛋白);P13671(C6蛋白);P10643(C7蛋白);P07357(C8α蛋白)、P07358(C8β蛋白)和P07360(C8γ蛋白);和P02748(C9蛋白),均于2021年6月2日登记。人VCAM-1已登记为GENBANK号NP_001069(日期:2021年9月7日)和UNIPROT号P19320(日期:2021年6月2日)。人TNFR-1已登记为GENBANK号NP_001056(日期:2021年10月17日)和UNIPROT号P19438(日期:2021年6月2日)。人血栓调节蛋白已登记为GENBANK号NP_000352(日期:2021年9月12日)和UNIPROT号P07204(日期:2021年6月2日)。
本披露进一步基于以下出人意料的发现:补体生物标志物补体组分因子B的蛋白水解片段(Ba)(在血浆和尿液中)和可溶性C5b9(sC5b-9)(尿液中)与aHUS患者基线时和经抗C5疗法治疗26周的肾功能相关。此类生物标志物在CM-TMA中显示出诊断潜力,并且可以预测肾脏对补体抑制的应答。
虽然本披露不受任何特定理论的约束,但发明人发现监测用补体抑制剂(例如抗C5抗体)治疗的患者的Ba和/或sC5b-9浓度的变化对于诊断患者患有或有风险发展CM-TMA(包括aHUS)是有用的。监测Ba和/或sC5b-9的状态也可用于确定CM-TMA患者是否对补体抑制剂疗法有应答。此外,评估Ba和/或sC5b-9的状态也可用于鉴定补体抑制剂(例如,抗05抗体)的剂量,包括阈值剂量,所述剂量由于其对人体中Ba和/或sC5b-9生物标志物蛋白的浓度的影响而足以实现对疾病的有临床意义的效果(例如,足以治疗补体相关疾病,例如aHUS)。
发明人鉴定了CM-TMA的生物标志物,即Ba和sC5b-9。发明人发现某些蛋白浓度升高或在某些情况下浓度降低与CM-TMA的存在相关。类似地,从用补体抑制剂治疗的CM-TMA患者获得的生物流体中某些蛋白的浓度(或活性)降低或升高表明该患者对用抑制剂的疗法有应答。补体生物标志物Ba(在血浆和尿液中检测到)和sC5b-9(在尿液中检测到)与CM-TMA患者基线时和经抗C5疗法治疗26周的肾功能相关。因此,这些蛋白的浓度和/或活性水平的分析可用于评估CM-TMA的风险、诊断CM-TMA、监测CM-TMA的进展或减轻、和/或监测对补体抑制剂的治疗应答等。
特征中的组织特异性生物标志物及其组合
尿液生物标志物
尿液生物标志物可用于CM-TMA患者的诊断、监测和疗法中。可用于此目的的尿液生物标志物包括(a)胱抑素C;(b)Ba;(c)sC5b9;(d)胱抑素C/肌酐;(e)Ba/肌酐;(f)sC5b9/肌酐或其任何组合,例如,包含至少2种、至少3种、至少4种、至少5种或全部6种上述生物标志物。
可以在样品中检测包含上述生物标志物的组合的尿液生物标志物特征,并且任选地,将其用于CM-TMA患者的诊断、监测和疗法中。部分地由于生物标志物组合的累加的或甚至协同的预测能力,可以期望在本披露的各种实施例中采用这样的特征。当不同的生物标志物衍生自不同的生物样品时(例如,包括尿液sC5b9蛋白水平和血浆Ba蛋白水平的特征),这可能是更期望的。
包含至少两种尿液生物标志物的尿液生物标志物特征的实例包括但不限于:(a)胱抑素C+Ba;(b)胱抑素C+sC5b9;(c)胱抑素C+胱抑素C/肌酐;(d)胱抑素C+Ba/肌酐;(e)胱抑素C+sC5b9/肌酐;(f)Ba+sC5b9;(g)Ba+胱抑素C/肌酐;(h)Ba+Ba/肌酐;(i)Ba+sC5b9/肌酐;(j)sC5b9+胱抑素C/肌酐;(k)sC5b9+Ba/肌酐;(l)sC5b9+sC5b9/肌酐;(m)胱抑素C/肌酐+Ba/肌酐;(n)胱抑素C/肌酐+sC5b9/肌酐;以及(o)Ba/肌酐+sC5b9/肌酐。
包含至少三种尿液生物标志物的尿液生物标志物特征的实例包括但不限于:(a)胱抑素C+Ba+sC5b9;(b)胱抑素C+Ba+胱抑素C/肌酐;(c)胱抑素C+Ba+Ba/肌酐;(d)胱抑素C+Ba+sC5b9/肌酐;(e)胱抑素C+sC5b9+胱抑素C/肌酐;(f)胱抑素C+sC5b9+Ba/肌酐;(g)胱抑素C+sC5b9+sC5b9/肌酐;(h)胱抑素C+胱抑素C/肌酐+Ba/肌酐;(i)胱抑素C+胱抑素C/肌酐+sC5b9/肌酐;(j)胱抑素C+Ba/肌酐+sC5b9/肌酐;(k)Ba+sC5b9+胱抑素C/肌酐;(l)Ba+sC5b9+Ba/肌酐;(m)Ba+sC5b9+sC5b9/肌酐;(n)Ba+胱抑素C/肌酐+Ba/肌酐;(o)Ba+胱抑素C/肌酐+sC5b9/肌酐;(p)Ba+Ba/肌酐+sC5b9/肌酐;(q)sC5b9+胱抑素C/肌酐+Ba/肌酐;(r)sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(s)sC5b9+Ba/肌酐+sC5b9/肌酐;以及(t)胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐。
包含至少四种尿液生物标志物的尿液生物标志物特征的实例包括但不限于:(a)胱抑素C+Ba+sC5b9+胱抑素C/肌酐;(b)胱抑素C+Ba+sC5b9+Ba/肌酐;(c)胱抑素C+Ba+sC5b9+sC5b9/肌酐;(d)胱抑素C+sC5b9+胱抑素C/肌酐+(e)胱抑素C+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(f)胱抑素C+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;(g)Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐;(h)Ba+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(i)Ba+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;或(j)sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐。包含至少五种尿液生物标志物的尿液生物标志物特征的实例包括但不限于:(a)胱抑素C+Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐;(b)胱抑素C+Ba+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(c)胱抑素C+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;(d)Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐。
包含至少六种尿液生物标志物的尿液生物标志物特征的进一步代表性实例包括但不限于:(a)胱抑素C+Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐。包含本文所述的生物标志物组合的尿液生物标志物特征中的任何一种或组合可用于本文所述的方法中。
血浆生物标志物
血浆生物标志物可用于CM-TMA患者的诊断、监测和疗法中。可用于此目的的血浆生物标志物包括(a)补体Ba和(b)sC5b9,或其任意组合,例如,包含至少2种上述血浆生物标志物。
血浆生物标志物特征可以包括上述血浆生物标志物的组合。例如,包含至少两种血浆生物标志物的血浆生物标志物特征可包含Ba和sC5b9。另外的血浆生物标志物包括血浆血栓调节蛋白。
来自异质样品的生物标志物
包含来自异质样品(例如,尿液和血浆)的生物标志物的示例性生物标志物特征可以用于本文所述的诊断和治疗方法中。可以在流体生物样品中检测包括来自异质样品(例如,尿液和血浆)的生物标志物的示例性生物标志物特征。
来自异质样品的两种生物标志物特征(至少一种来自尿液,一种来自血浆)可用于诊断和治疗方法中。可以在流体生物样品中检测来自异质样品的示例性两种生物标志物特征。示例性异质两种生物标志物特征包含但不限于(a)尿液胱抑素C+血浆Ba;(b)尿液胱抑素C+血浆sC5b9;(c)尿液Ba+血浆Ba;(d)尿液Ba+血浆sC5b9;(e)尿液sC5b9+血浆Ba;(f)尿液sC5b9+血浆sC5b9;(g)尿液胱抑素C/肌酐+血浆Ba;(h)尿液胱抑素C/肌酐+血浆sC5b9;(i)尿液Ba/肌酐+血浆Ba;(j)尿液Ba/肌酐+血浆sC5b9;(k)尿液sC5b9/肌酐+血浆Ba;(l)尿液sC5b9/肌酐+血浆sC5b9。
来自异质样品的三种生物标志物特征(例如,包括来自尿液的至少一种和来自血浆的两种)可用于本文所述的诊断和治疗方法中。可以在流体生物样品中检测来自异质样品的示例性三种生物标志物特征。异质三种生物标志物特征的实例包括但不限于(a)尿液胱抑素C+血浆Ba+血浆sC5b9;(b)尿液Ba+血浆Ba+血浆sC5b9;(c)尿液sC5b9+血浆Ba+血浆sC5b9;(d)尿液胱抑素C/肌酐+血浆Ba+血浆sC5b9;(e)尿液Ba/肌酐+血浆Ba+血浆sC5b9;(f)尿液sC5b9/肌酐+血浆Ba+血浆sC5b9。
来自异质样品的三种生物标志物特征(例如,包括来自尿液的至少两种和来自血浆的一种)可用于本文所述的诊断和治疗方法中。可以在流体生物样品中检测来自异质样品的示例性三种生物标志物特征。异质三种生物标志物特征的实例包括但不限于(a)尿液胱抑素C+尿液Ba+血浆Ba或血浆sC5b9;(b)尿液胱抑素C+尿液sC5b9+血浆Ba或血浆sC5b9;(c)尿液胱抑素C+尿液胱抑素C/肌酐+血浆Ba或血浆sC5b9;(d)尿液胱抑素C+尿液Ba/肌酐+血浆Ba或血浆sC5b9;(e)尿液胱抑素C+尿液sC5b9/肌酐+血浆Ba或血浆sC5b9;(f)尿液Ba+尿液sC5b9+血浆Ba或血浆sC5b9;(g)尿液Ba+尿液胱抑素C/肌酐+血浆Ba或血浆sC5b9;(h)尿液Ba+尿液Ba/肌酐+血浆Ba或血浆sC5b9;(i)尿液Ba+尿液sC5b9/肌酐+血浆Ba或血浆sC5b9;(j)尿液sC5b9+尿液胱抑素C/肌酐+血浆Ba或血浆sC5b9;(k)尿液sC5b9+尿液Ba/肌酐+血浆Ba或血浆sC5b9;(l)尿液sC5b9+尿液sC5b9/肌酐+血浆Ba或血浆sC5b9;(m)尿液胱抑素C/肌酐+尿液Ba/肌酐+血浆Ba或血浆sC5b9;(n)尿液胱抑素C/肌酐+尿液sC5b9/肌酐+血浆Ba或血浆sC5b9;(o)尿液Ba/肌酐+尿液sC5b9/肌酐+血浆Ba或血浆sC5b9。
来自异质样品的四种生物标志物特征(例如,包括来自尿液的至少两种和来自血浆的两种)可用于本文所述的诊断和治疗方法中。可以在流体生物样品中检测来自异质样品的示例性四种生物标志物特征。异质四种生物标志物特征的实例包括但不限于(a)尿液胱抑素C+尿液Ba+血浆Ba+血浆sC5b9;(b)尿液胱抑素C+尿液sC5b9+血浆Ba+血浆sC5b9;(c)尿液胱抑素C+尿液胱抑素C/肌酐+血浆Ba+血浆sC5b9;(d)尿液胱抑素C+尿液Ba/肌酐+血浆Ba+血浆sC5b9;(e)尿液胱抑素C+尿液sC5b9/肌酐+血浆Ba+血浆sC5b9;(f)尿液Ba+尿液sC5b9+血浆Ba+血浆sC5b9;(g)尿液Ba+尿液胱抑素C/肌酐+血浆Ba+血浆sC5b9;(h)尿液Ba+尿液Ba/肌酐+血浆Ba+血浆sC5b9;(i)尿液Ba+尿液sC5b9/肌酐+血浆Ba+血浆sC5b9;(j)尿液sC5b9+尿液胱抑素C/肌酐+血浆Ba+血浆sC5b9;(k)尿液sC5b9+尿液Ba/肌酐+血浆Ba+血浆sC5b9;(l)尿液sC5b9+尿液sC5b9/肌酐+血浆Ba+血浆sC5b9;(m)尿液胱抑素C/肌酐+尿液Ba/肌酐+血浆Ba+血浆sC5b9;(n)尿液胱抑素C/肌酐+尿液sC5b9/肌酐+血浆Ba+血浆sC5b9;(o)尿液Ba/肌酐+尿液sC5b9/肌酐+血浆Ba+血浆sC5b9。
来自异质样品的四种生物标志物特征(例如,包括来自尿液的至少三种和来自血浆的一种)可用于本文所述的诊断和治疗方法中。可以在流体生物样品中检测来自异质样品的示例性四种生物标志物特征。异质三种生物标志物特征的实例包括但不限于(a)尿液胱抑素C+尿液Ba+尿液sC5b9+血浆Ba或血浆sC5b9;(b)胱抑素C+Ba+胱抑素C/肌酐+血浆Ba或血浆sC5b9;(c)胱抑素C+Ba+Ba/肌酐+血浆Ba或血浆sC5b9;(d)胱抑素C+Ba+sC5b9/肌酐+血浆Ba或血浆sC5b9;(e)胱抑素C+sC5b9+胱抑素C/肌酐+血浆Ba或血浆sC5b9;(f)胱抑素C+sC5b9+Ba/肌酐+血浆Ba或血浆sC5b9;(g)胱抑素C+sC5b9+sC5b9/肌酐+血浆Ba或血浆sC5b9;(h)胱抑素C+胱抑素C/肌酐+Ba/肌酐+血浆Ba或血浆sC5b9;(i)胱抑素C+胱抑素C/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(j)胱抑素C+Ba/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(k)Ba+sC5b9+胱抑素C/肌酐+血浆Ba或血浆sC5b9;(l)Ba+sC5b9+Ba/肌酐+血浆Ba或血浆sC5b9;(m)Ba+sC5b9+sC5b9/肌酐+血浆Ba或血浆sC5b9;(n)Ba+胱抑素C/肌酐+Ba/肌酐+血浆Ba或血浆sC5b9;(o)Ba+胱抑素C/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(p)Ba+Ba/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(q)sC5b9+胱抑素C/肌酐+Ba/肌酐+血浆Ba或血浆sC5b9;(r)sC5b9+胱抑素C/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(s)sC5b9+Ba/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(t)胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9。
来自异质样品的四种生物标志物特征(例如,两种来自血清,一种来自血浆,一种来自尿液)可用于本文所述的诊断和治疗方法中。可以在流体生物样品中检测来自本文描述的异质样品的示例性四种生物标志物特征。示例性四种生物标志物特征可以包括血清sVCAM-1(循环血管粘附分子-1)、血清sTNF-R1(可溶性肿瘤坏死因子受体1)、血浆血栓调节蛋白和尿液C5b-9。
来自异质样品的五种生物标志物特征(例如,包括来自尿液的至少三种和来自血浆的两种)可用于本文所述的诊断和治疗方法中。可以在流体生物样品中检测来自本文描述的异质样品的示例性五种生物标志物特征。异质三种生物标志物特征的实例包括但不限于选自由以下组成的组的特征:(a)尿液胱抑素C+尿液Ba+尿液sC5b9+血浆Ba或血浆sC5b9;(b)胱抑素C+Ba+胱抑素C/肌酐+血浆Ba或血浆sC5b9;(c)胱抑素C+Ba+Ba/肌酐+血浆Ba或血浆sC5b9;(d)胱抑素C+Ba+sC5b9/肌酐+血浆Ba或血浆sC5b9;(e)胱抑素C+sC5b9+胱抑素C/肌酐+血浆Ba或血浆sC5b9;(f)胱抑素C+sC5b9+Ba/肌酐+血浆Ba或血浆sC5b9;(g)胱抑素C+sC5b9+sC5b9/肌酐+血浆Ba或血浆sC5b9;(h)胱抑素C+胱抑素C/肌酐+Ba/肌酐+血浆Ba或血浆sC5b9;(i)胱抑素C+胱抑素C/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(j)胱抑素C+Ba/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(k)Ba+sC5b9+胱抑素C/肌酐+血浆Ba或血浆sC5b9;(l)Ba+sC5b9+Ba/肌酐+血浆Ba或血浆sC5b9;(m)Ba+sC5b9+sC5b9/肌酐+血浆Ba或血浆sC5b9;(n)Ba+胱抑素C/肌酐+Ba/肌酐+血浆Ba或血浆sC5b9;(o)Ba+胱抑素C/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(p)Ba+Ba/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(q)sC5b9+胱抑素C/肌酐+Ba/肌酐+血浆Ba或血浆sC5b9;(r)sC5b9+胱抑素C/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(s)sC5b9+Ba/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9;(t)胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐+血浆Ba或血浆sC5b9,除了包括两种血浆生物标志物,例如Ba和sC5b9(上述异质四种生物标志物特征包含可替代的而不是组合的血浆生物标志物)。
来自异质样品的五种生物标志物特征(例如,包括来自尿液的至少四种和来自血浆的一种)可用于本文所述的方法中。可以在流体生物样品中检测来自本文描述的异质样品的示例性五种生物标志物特征。异质五种生物标志物特征的实例包括但不限于来自尿液的选自下组四种生物标志物特征,该组由以下组成:(a)胱抑素C+Ba+sC5b9+胱抑素C/肌酐;(b)胱抑素C+Ba+sC5b9+Ba/肌酐;(c)胱抑素C+Ba+sC5b9+sC5b9/肌酐;(d)胱抑素C+sC5b9+胱抑素C/肌酐+(e)胱抑素C+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(f)胱抑素C+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;(g)Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐;(h)Ba+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(i)Ba+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;或(j)sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐,以及来自血浆的选自由补体Ba和(b)sC5b9或其任何组合组成的组的一种生物标志物。
来自异质样品的六种生物标志物特征(例如,包括来自尿液的至少四种和来自血浆的两种)可用于本文所述的方法中。可以在流体生物样品中检测来自本文描述的异质样品的示例性六种生物标志物特征。异质六种生物标志物特征的实例可以包括,例如(1)来自尿液的选自下组四种生物标志物特征,该组由以下组成:(a)胱抑素C+Ba+sC5b9+胱抑素C/肌酐;(b)胱抑素C+Ba+sC5b9+Ba/肌酐;(c)胱抑素C+Ba+sC5b9+sC5b9/肌酐;(d)胱抑素C+sC5b9+胱抑素C/肌酐+(e)胱抑素C+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(f)胱抑素C+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;(g)Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐;(h)Ba+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(i)Ba+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;或(j)sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐以及来自血浆的两种生物标志物特征,例如以上的Ba+sC5b9,或(2)来自尿液的选自由以下组成的组的五种生物标志物特征:(a)胱抑素C+Ba+sC5b9+胱抑素C/肌酸酐+Ba/肌酸酐;(b)胱抑素C+Ba+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(c)胱抑素C+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;(d)Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐,以及来自血浆的选自由补体Ba和(b)sC5b9或其任何组合组成的组的单一生物标志物。
来自异质样品的七种生物标志物特征(例如,包括来自尿液的至少五种和来自血浆的两种)可用于本文所述的方法中。可以在流体生物样品中检测来自本文描述的异质样品的示例性七种生物标志物特征。异质七种生物标志物特征的实例可以包括来自尿液的选自下组的五种生物标志物特征,该组由以下组成:(a)胱抑素C+Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐;(b)胱抑素C+Ba+sC5b9+胱抑素C/肌酐+sC5b9/肌酐;(c)胱抑素C+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐;(d)Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐和来自血浆的两种生物标志物特征,例如Ba和sC5b9。
来自异质样品的八种生物标志物特征(例如,包括来自尿液的至少六种和来自血浆的两种)可用于本文所述的方法中。可以在流体生物样品中检测来自本文描述的异质样品的示例性八种生物标志物特征。异质八种生物标志物特征的实例可以包括来自尿液的六种生物标志物特征(其包含胱抑素C+Ba+sC5b9+胱抑素C/肌酐+Ba/肌酐+sC5b9/肌酐)以及来自血浆的两种生物标志物特征,例如Ba和sC5b9。
本文描述的蛋白生物标志物可以被归一化,例如,基于受试者生物样品中的肌酐水平。为了归一化,优选使用相同来源的生物样品来测定肌酸酐水平,生物标志物从该来源衍生。优选地,本披露涉及基于尿液肌酐水平(ng生物标志物/mg肌酐)的尿液生物标志物的归一化。特别是,尿液Ba、sC5b9和细胞抑制素C的水平基于尿肌酐水平进行归一化。
可以将生物标志物水平针对受试者样品中的肌酸酐水平进行归一化,肌酸酐水平与受试者的生物标志物水平或生物标志物特征的测定同时进行(例如,同时或相隔非常小的时间间隔,例如,小于1小时,优选小于30分钟,特别是小于20分钟,或特别是小于5分钟的间隔)。例如,血浆Ba和/或血浆sC5b9的水平可以基于血浆肌酐水平进行归一化。
本文所述的诊断和/或治疗方法可以包括测量至少一种次要标志物以及本文所述的生物标志物和/或生物标志物特征,其中生物标志物水平任选地针对受试者样品中的肌酐水平进行归一化。次要标志物的代表性实例包括,例如,估计肾小球滤过率(eGFR)和/或尿蛋白肌酐比率(UPCR)。优选地,这些次要标志物与生物标志物或生物标志物特征同时测量,任选地与归一化分析物的水平(肌酐水平)一起测量。
诊断和/或检测方法
一种用于检测生物样品中的生物标志物的方法可以包括从受试者获得生物流体;将该生物流体与结合生物标志物的药剂接触,这些生物标志物是例如选自补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或其组合的蛋白生物标志物;并检测该药剂与生物标志物的结合,该生物标志物是例如选自补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者的蛋白生物标志物。该方法可以进一步包括测定Ba和/或sC5b-9的水平。任何标准方法可用于检测生物标志物,包括基于抗体的检测,包括标准免疫测定,例如酶联免疫吸附测定(ELISA)、放射免疫测定(RIA)等。
一种用于监测或评估受试者中CM-TMA相关生物标志物蛋白的状态的方法可以包括从受试者获得生物流体;将该生物流体与结合生物标志物的药剂接触,这些生物标志物是例如选自补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或其组合的蛋白生物标志物;并检测该药剂与生物标志物的结合,该生物标志物是例如选自补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者的蛋白生物标志物。该方法可以进一步包括测定Ba和/或sC5b-9的水平。
用于评估受试者中CM-TMA相关生物标志物蛋白的浓度和活性水平之一或两者的方法可以包括获得生物流体、通过免疫测定法检测蛋白生物标志物,例如补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者。该方法可以进一步包括基于标准测定例如计算生物标志物的量或相对量/单位体积样品来测定生物标志物的浓度。对于活性测定,可以进行标准活性测定。例如,当生物标志物是补体Bb并且目的参数是受试者样品中Bb的活性时,可以进行C3裂解测定。该测定辨识Bb是C3bBb复合物(C3转化酶)的催化活性位点,并且能够将新的C3裂解为C3a和C3b。类似地,其中生物标志物是补体sC5b9并且目的参数是受试者样品中sC5b9的活性,可以使用末端补体复合物测定例如CH50。CH50测试是裂解测定,它使用抗体致敏的绵羊红细胞(EA)作为经典补体途径的激活剂和测试血清的各种稀释以确定提供50%裂解所需的量。溶血百分比通过分光光度法测定。CH50测试是TCC的间接测量,因为TCC本身直接负责溶血,可以进行裂解测定来测量溶血。在一些实施例中,可以使用直接测定。
用于监测或确定患者是否有风险发展血栓性微血管病的方法可以包括获得生物流体、通过免疫测定法检测一种或多种前述生物标志物或生物标志物特征,例如补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者。该方法可以进一步包括测定Ba和/或sC5b-9的水平。
用于监测或评估受试者中CM-TMA相关生物标志物蛋白的状态的方法或用于评估受试者中一种或多种前述生物标志物或生物标志物特征(例如补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者)的浓度和活性水平之一或两者的方法可以包括获得生物流体、通过免疫测定法检测一种或多种前述生物标志物或生物标志物特征,例如补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者。该方法可以进一步包括测定Ba和/或sC5b-9的水平。
用于确定受试者是否患有或有风险发展CM-TMA的方法可以包括获得生物流体、通过免疫测定法检测一种或多种前述生物标志物或生物标志物特征,例如补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者。该方法可以进一步包括测定Ba和/或sC5b-9的水平。
用于确定受试者是否对用补体抑制剂治疗有应答的方法可以包括获得生物流体、通过免疫测定法检测一种或多种前述生物标志物或生物标志物特征,例如补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者。该方法可以进一步包括测定Ba和/或sC5b-9的水平。在一些实施例中,本披露涉及使用补体抑制剂以足以诱导补体介导的血栓性微血管病(CM-TMA)相关生物标志物蛋白的生理变化的方式治疗CM-TMA的方法,该方法包括:(a)测定从该受试者获得的生物流体中这些CM-TMA相关生物标志物蛋白的水平或活性,其中这些CM-TMA相关生物标志物蛋白选自由以下组成的组:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;补体sC5b-9/肌酐比率或其组合;优选地确定包含至少两种生物标志物的特征中的生物标志物的水平或活性,该至少两种生物标志物包含Ba和sC5b9;以及(b)向患有、怀疑患有或有风险发展CM-TMA的受试者施用补体抑制剂,施用的量和频率足以导致该生物标志物或该生物标志物特征的水平或活性与该生物标志物或该生物标志物特征在用该抑制剂治疗前从该受试者获得的相同类型的生物流体样品中的水平或活性相比降低。在这些实施例中,优选补体抑制剂包含抗C5抗体,例如雷夫利珠单抗。
用于确定在预定给药方案下用补体抑制剂治疗的患有补体介导的血栓性微血管病(CM-TMA)的患者是否需要不同的给药方案的方法可以包括(A)确定该CM-TMA患者是否在预定给药方案下对用补体抑制剂治疗有应答,其中该确定包括:确定从该受试者获得的生物流体中CM-TMA相关生物标志物蛋白的浓度和活性之一或两者,其中该CM-TMA相关生物标志物蛋白选自由以下组成的组:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;补体sC5b-9/肌酐比率或其组合;优选地确定包含至少两种生物标志物的特征中的生物标志物的水平,该至少两种生物标志物包含Ba和sC5b9,并且其中:(a)与用该抑制剂治疗之前从该受试者获得的相同类型的生物流体样品中的浓度相比,该生物标志物或该生物标志物特征的水平或活性降低表明该受试者对用该抑制剂治疗有应答;以及(B)如果患者对用该补体抑制剂治疗没有应答,则向无应答患者施用不同的补体抑制剂或以与预定给药方案相比更高剂量或更频繁给药的方案施用相同的补体抑制剂。在这些实施例中,优选补体抑制剂包含抗C5抗体,例如雷夫利珠单抗。
受试者可以是患有、怀疑患有或有风险发展aHUS的人。受试者可以是患有、怀疑患有或有风险发展CM-TMA的人。受试者可以是患有、怀疑患有或有风险发展狼疮、任选狼疮性肾炎的人。
受试者可以是已经(或正在)用补体抑制剂、任选地补体组分C5抑制剂(例如抗C5抗体)治疗的受试者。在从受试者获得样品之前治疗可以已经进行少于一个月(例如少于31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2或1天)。
本文描述的方法可以进一步包括确定受试者是否患有或有风险发展CM-TMA、特别是aHUS、狼疮、任选狼疮性肾炎或其组合的步骤。在受试者已经或正在按照预定给药方案用补体抑制剂(例如,抗C5抗体)治疗的情况下,该方法可进一步包括确定患者是否对补体抑制剂疗法有应答。
补体组分因子B的蛋白水解片段(Ba)和可溶性C5b9(sC5b-9)的浓度与用抑制剂治疗前从受试者获得的相同类型的生物流体样品中的这些生物标志物的浓度相比降低表明受试者对用抑制剂治疗有应答。
用于监测受试者对用补体组分C5抑制剂治疗的应答性的方法可以包括检测生物流体中的生物标志物,其中该生物标志物是补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)、或两者。生物流体获得自以下受试者:(i)其患有、怀疑患有或有风险发展CM-TMA,以及(ii)其正在(或已经,例如最近已经)按照预定给药方案用补体组分C5的抑制剂进行治疗。根据此类方法,(a)与用抑制剂治疗前从受试者获得的相同类型的生物流体样品中的浓度相比,补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者的浓度降低;或(b)与用补体的竞争物治疗前从受试者获得的相同类型生物流体样品中的浓度相比浓度增加,则表明受试者对用抑制剂治疗有应答。
用于确定受试者是否对用补体抑制剂治疗有应答的方法可以包括检测生物流体中的生物标志物,其中该生物标志物是补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)、或两者。与用抑制剂治疗前从受试者获得的相同类型的生物流体样品中的浓度相比,补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者的浓度降低。
用于监测受试者对用补体抑制剂治疗的应答性的方法可以包括检测生物流体中的生物标志物,其中该生物标志物是补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)、或两者。受试者患有、怀疑患有或有风险发展CM-TMA,并且受试者已经或正在用补体抑制剂治疗。(A)与用抑制剂治疗前从受试者获得的相同类型生物流体样品中的浓度相比,检测生物流体中生物标志物的浓度降低,其中该生物标志物是补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者;或(B)与用补体抑制剂治疗前从受试者获得的相同类型生物流体样品中的浓度相比浓度增加,则表明受试者对用抑制剂治疗有应答。
一种以足以诱导与血栓形成或凝血相关的生物标志物蛋白的生理变化的方式使用补体抑制剂来减少狼疮、任选狼疮性肾炎的数量、频率或发生、发生可能性或发展风险的方法包括:(a)测定从受试者获得的生物流体中生物标志物蛋白的浓度,其中这些生物标志物蛋白是补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)、或两者并且与血栓形成和/或凝血相关;以及(b)向患有、怀疑患有或有风险发展狼疮、任选狼疮性肾炎的受试者施用补体抑制剂,施用的量和频率足以引起生物标志物蛋白的生理学变化,其中该生理学变化是相对于在用该补体抑制剂治疗之前从该受试者获得的等效生物样品中标志物的浓度,该生物标志物蛋白的浓度降低。该方法可以包括在治疗之前和之后测量生物标志物的浓度。
一种用于确定在预定给药方案下用补体抑制剂治疗的CM-TMA患者是否需要以下的方法:(i)用不同的补体抑制剂治疗或(ii)在不同的给药方案下用相同的补体抑制剂治疗可以包括:(A)确定该CM-TMA患者是否在预定给药方案下对用补体抑制剂治疗有应答,其中该确定包括:在从该受试者获得的生物流体中测量生物流体中生物标志物的浓度和活性之一或两者,其中该生物标志物是该生物体液中的补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者,并且其中:(a)与用抑制剂治疗前从受试者获得的相同类型的生物流体样品中的浓度相比,补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者的浓度降低;或(b)与用补体抑制剂治疗前从受试者获得的相同类型生物流体样品中的浓度相比浓度增加,则表明受试者对用抑制剂治疗有应答;以及(B)如果患者对用该补体抑制剂治疗没有应答,则向患者施用不同的补体抑制剂或以与预定给药方案相比更高剂量或更频繁给药的方案施用相同的补体抑制剂。
一种用于诊断受试者患有或有风险发展非典型溶血性尿毒症综合征(aHUS)的方法可以包括测量生物流体中至少两种aHUS相关生物标志物蛋白—补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者—的浓度。生物流体是从怀疑患有或有风险发展aHUS的受试者获得的生物流体。根据该方法,与相同类型的正常对照生物流体中的浓度相比,补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)、或两者的浓度升高表明受试者患有或有风险发展aHUS。对照可以从健康受试者获得,例如,不具有CM-TMA的受试者,优选其尿液样品不含有可检测水平的sC5b9的受试者,如通过标准免疫测定测量的
一种用于确定CM-TMA患者是否对用补体抑制剂进行的疗法有应答的方法可以包括:测量从患有、怀疑患有或有风险发展CM-TMA的患者获得的生物样品中的Ba和/或sC5b-9的浓度,并且用补体抑制剂(例如,抗C5抗体)进行治疗;以及如果与用该补体抑制剂治疗前从该患者获得的相同类型的生物样品中的一种或多种生物标志物的浓度相比,该生物样品中的一种或多种生物标志物的浓度降低,则确定患者对该疗法有应答,或者,如果与用该补体抑制剂治疗前从该患者获得的相同类型的生物样品中的一种或多种生物标志物的浓度相比,该生物样品中的一种或多种生物标志物的浓度没有降低,则确定患者对该疗法无应答。因此,该方法可用于评估或监测用补体抑制剂治疗的CM-TMA患者的末端补体阻断。在患者对疗法无应答或应答较差的实施例中,该方法可以进一步包括改变补体抑制剂的剂量或剂量频率或选择不同的补体抑制剂(例如,C3激活的抑制剂)用于治疗患者。
检测方法
生物标志物、补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者,可以使用免疫测定来测量,例如,酶联免疫吸附测定(ELISA)、放射免疫测定(RIA)、荧光免疫测定(FIA)、化学发光免疫测定(CLIA)、计数免疫测定(CIA)、比色免疫测定、蛋白印迹、斑点印迹、细胞计数珠阵列(CBA)或其组合。免疫测定的方法是本领域已知的。
结合C5b的抗体以及制备此类抗体的方法是本领域已知的。市售抗C5b抗体可从许多供应商处获得,包括,例如,健康生物技术公司(Hycult Biotechnology)(目录号:HM2080;克隆568)和
抗体可以是抗因子B抗体(例如由ATCC保藏号PTA-6230生产的单克隆抗体1379)。抗因子B抗体也描述于,例如,Ueda等人(1987)J Immunol[免疫学杂志]138(4):1143-9;Tanhehco等人(1999)Transplant Proc[移植学进展]31(5):2168-71;美国专利号7,999,082和7,964,705;和WO 09/029669。
在实例部分和其他地方,提供了可用于实施本披露的各种实施例的代表性抗体类型,例如,包含有关特定供应商和/或目录号的信息。应当理解,本披露不限于使用来自特定供应商/制造商的抗体检测试剂的示例性实施例。针对本披露的生物标志物/分析物的抗体可以从任何制造商获得,包括博奇公司(Biolegend)(圣地亚哥,加利福尼亚州)、南方生物技术公司(Southern Biotech)(伯明翰,阿拉巴马州)、美国生物技术公司(United StatesBiological)(USB;塞勒姆,马萨诸塞州)、生命跨度生物科学公司(Lifespan Biosciences)(LSBIO;西雅图,华盛顿州)、
可以使用阵列来检测生物标志物。例如,阵列可以是蛋白芯片,其中阵列的每个地址是测定板的孔。阵列的每个地址可以是其上固定有结合剂的颗粒(例如,珠)。
测量生物样品中的蛋白表达水平可以通过任何合适的方法进行。参见例如,Greenfield(编辑)(2014)“Antibodies:A Laboratory Manual[抗体:实验室手册]”,ColdSpring Harbor Laboratory[冷泉港实验室]:冷泉港,纽约州。一般而言,通过以下来测定蛋白水平:将从受试者获得的生物样品与生物标志物蛋白的结合剂接触;检测样品(例如,生物流体)中与结合剂结合的一种或多种生物标志物蛋白的水平;以及将样品中一种或多种生物标志物蛋白的水平与对照样品(例如,正常样品)中相应蛋白生物标志物的水平进行比较。在某些实施例中,合适的结合剂是具有或不具有肽组分的核糖体、RNA分子或多肽(例如,包含蛋白标志物的多肽序列的多肽、其肽变体或这样的序列的非肽模拟物)。
合适的结合剂还包括对本文所述的生物标志物蛋白具有特异性的抗体。适用于本发明方法的抗体包括单克隆和多克隆抗体以及抗体的抗原结合片段(例如,Fab片段或scFv)。抗体,包括单克隆和多克隆抗体、片段和嵌合体,可以使用本领域已知的方法来制备。用于本发明方法的抗体可以通过本领域熟知的方法纯化。Greenfield(编辑)(2014)“Antibodies:A Laboratory Manual[抗体:实验室手册]”,Cold Spring HarborLaboratory[冷泉港实验室]:冷泉港,纽约州。抗体也可以从商业来源获得。
结合剂直接或间接用可检测部分进行标记。可检测剂的作用是通过允许结合剂与蛋白标志物(或其片段)结合形成的复合物可视化来有利于诊断方法的检测步骤。可以选择可检测剂,使得其产生可测量的信号,并且其强度与正在分析的样品中存在的蛋白标志物的量相关(优选成比例)。用于标记生物分子例如多肽和抗体的方法是本领域众所周知的。多种可检测试剂中的任何一种都可以用于本发明的实践中。合适的可检测剂包括但不限于:各种配体、放射性核素、荧光染料、化学发光剂、微粒(例如,量子点、纳米晶体、磷光体)、酶(例如,ELISA中使用的酶、例如,辣根过氧化物酶、β-半乳糖苷酶、荧光素酶、碱性磷酸酶)、比色标记、磁性标记以及生物素、地高辛或其他对其而言可用抗血清或单克隆抗体的半抗原和蛋白。
结合剂(例如,抗体)可以固定在载物或支持物上(例如,珠、磁性颗粒、乳胶颗粒、微量滴定板孔、比色皿、或其他反应容器)。合适的载物或支持材料的实例包括琼脂糖、纤维素、硝基纤维素、葡聚糖、
生物样品中的蛋白表达水平可以使用免疫测定法来确定。此类测定的实例有时间分辨荧光免疫测定(TR-FIA)、放射免疫测定、酶免疫测定(例如,ELISA)、免疫荧光免疫沉淀、乳胶凝集、血凝、蛋白印迹和组织化学测试,这些都是常规方法在本领域众所周知。结合剂与蛋白标志物结合形成的复合物产生的信号的检测和定量的方法将取决于测定的性质和可检测部分(例如,荧光部分)。
在实例中,基因(例如,Ba和/或sC5b-9)的蛋白表达的存在或量可以使用蛋白印迹技术来确定。例如,裂解物可以从生物样品中制备,或者生物样品(例如生物流体)本身可以与莱姆利(Laemmli)缓冲液接触并进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)。然后,可以将按大小分离的SDS-PAGE解析的蛋白转移至滤膜(例如,硝酸纤维素),并使用对目的蛋白具有特异性的可检测标记抗体进行免疫印迹技术。结合的可检测标记抗体的存在或量表明生物样品中蛋白的存在或量。
在实例中,免疫测定可用于检测和/或测量生物标志物蛋白(例如,Ba和/或sC5b-9)的蛋白表达。如上所述,为了检测的目的,可以用带有检测部分(例如,荧光剂或酶)的抗体进行免疫测定。生物样品中的蛋白可以直接与固相基质(例如,多孔测定板、硝化纤维、琼脂糖、
可替代地,可以使用本领域已知的用于检测蛋白的基于质谱的方法或基于图像的方法来测定蛋白表达水平。其他合适的方法包括2D-凝胶电泳、基于蛋白组学的方法,例如从凝胶中回收的各个蛋白的鉴定(例如,通过质谱法或N末端测序)和/或生物信息学。
用于检测或测量蛋白表达的方法可以任选地以允许快速制备、处理和分析多个样品的形式进行。例如,这可以是在多孔测定板(例如,96孔或386孔)或阵列(例如,蛋白芯片)中。可以手动或自动提供各种试剂的储备溶液,并且随后的样品制备、移液、稀释、混合、分配、洗涤、孵育(例如,杂交)、样品读出、数据收集(光学数据)和/或分析(计算机辅助图像分析)可以使用市售分析软件、机器人技术和能够检测从测定产生的信号的检测仪器来自动完成。此类检测器的示例包括但不限于分光光度计、发光计、荧光计和测量放射性同位素衰变的装置。
诊断性抗体
抗体或其抗原结合片段可以选自由以下组成的组:人源化抗体、重组抗体、双抗体、嵌合的或嵌合型抗体、单克隆抗体、去免疫抗体、全人抗体、单链抗体、Fv片段、Fd片段、Fab片段、Fab'片段、F(ab’)
单克隆抗体
本文披露的单克隆抗体可以是任何同种型。单克隆抗体可以是例如IgM或IgG抗体,例如IgG1或IgG2。根据众所周知的程序,免疫特异性结合Ba或sC5b-9的抗体类别可以与另一种抗体类别进行转换(例如,可以将IgG转换为IgM)。类别转换还可用于将一种IgG子类转换为另一种子类,例如从IgG1转换为IgG2。
本发明的抗体可以是单价、二价、三价或多价的。例如,单价scFv可以通过化学方式或通过与另一种蛋白或物质结合而多聚化。与六组氨酸标签或Flag标签融合的scFv可以使用Ni-NTA琼脂糖(凯杰公司(Qiagen))或使用抗Flag抗体(斯塔基公司(Stratagene,Inc.))进行多聚化。
本发明的抗体可以是单特异性的、双特异性的、三特异性的或具有更大的多特异性。多特异性抗体可以对Ba和/或sC5b-9或其片段的不同表位以及异源表位例如异源多肽或固体支持材料具有特异性。参见,例如,WO 93/17715;WO 92/08802;WO 91/00360;WO 92/05793;Tutt等人,J.Immunol.[免疫学杂志]147:60-69(1991);美国专利号4,474,893;4,714,681;4,925,648;5,573,920;5,601,819;Kostelny等人
抗体产生方法
可用于本文所述方法中的抗体(包括scFv和包含本发明抗体片段或变体或可替代地由本发明抗体片段或变体组成的其他分子)可通过本领域已知的用于抗体合成的任何方法产生,特别是通过化学合成或优选地通过重组表达技术。Greenfield(编辑)(2014)“Antibodies:A Laboratory Manual[抗体:实验室手册]”,Cold Spring HarborLaboratory[冷泉港实验室]:冷泉港,纽约州。
免疫特异性结合Ba和/或sC5b-9或其片段的单链Fv(scFv)可以使用本领域已知的噬菌体展示方法产生。在噬菌体展示方法中,功能性抗体结构域展示在携带编码它们的多核苷酸序列的噬菌体颗粒的表面上。具体地,编码VH和VL结构域的DNA序列从动物cDNA文库(例如,淋巴组织的人或鼠cDNA文库)或合成cDNA文库中扩增。编码VH和VL结构域的DNA通过PCR通过scFv接头连接在一起,并克隆到噬菌粒载体(例如,p CANT AB 6或pComb 3HSS)中。将载体电穿孔到大肠杆菌中,并用辅助噬菌体感染大肠杆菌。这些方法中使用的噬菌体通常是丝状噬菌体,包括fd和M13,并且VH和VL结构域通常重组融合到噬菌体基因III或基因VIII。表达结合目的抗原的抗原结合结构域的噬菌体(例如,Ba和/或sC5b-9或其片段)可以用抗原选择或鉴定,使用经标记的抗原或结合或捕获到固体表面或珠的抗原。可用于制备本发明的抗体的噬菌体展示方法的实例包括但不限于以下中披露的那些:Brinkman等人,J.Immunol.Methods[免疫方法杂志]182:41-50(1995);Ames等人,J.Immunol.Methods[免疫方法杂志]184:177-186(1995);Kettleborough等人Eur.J.Immunol.[欧洲免疫学杂志]24:952-958(1994);Persic等人,Gene[基因]187 9-18(1997);Burton等人Advances inImmunology[免疫学进展]57:191-280(1994);WO 91/10737;WO 92/01047;WO 92/18619;WO93/11236;WO 95/15982;WO 95/20401;W097/13844;和美国专利号5,698,426;5,223,409;5,403,484;5,580,717;5,427,908;5,750,753;5,821,047;5,571,698;5,427,908;5,516,637;5,780,225;5,658,727;5,733,743和5,969,108。
如上述参考文献中所述,在噬菌体选择后,可以分离来自噬菌体的抗体编码区,并用于产生完整抗体,包括人或人源化抗体,或任何其他所期望的抗原结合片段,并在任何所期望的宿主中表达,包括哺乳动物细胞、昆虫细胞、植物细胞、酵母和细菌,例如,如下所述。使用本领域已知的方法,也可以采用重组产生Fab、Fab’和F(ab’)2片段的技术,这些方法例如是以下中描述的那些:WO 92/22324;Mullinax等人,BioTechniques[生物技术]12(6):864-869(1992);Sawai等人,AJRI 34:26-34(1995);和Better等人,Science[科学]240:1041-1043(1988)。
为了产生完整抗体,可以使用包括VH或VL核苷酸序列、限制性位点和保护限制性位点的侧翼序列的PCR引物来扩增scFv克隆中的VH或VL序列。利用本领域技术人员已知的克隆技术,可以将PCR扩增的VH结构域克隆到表达VH恒定区,例如人γ4恒定区的载体中,并且可以将PCR扩增的VL结构域克隆到表达VL恒定区,例如人κ或λ恒定区的载体中。优选地,用于表达VH或VL结构域的载体包含适合指导重链和轻链在所选表达系统中表达的启动子,分泌信号,免疫球蛋白可变结构域、免疫球蛋白恒定结构域的克隆位点,和选择标志物,例如新霉素。VH和VL结构域也可以克隆到表达必要恒定区的一个载体中。然后使用本领域技术人员已知的技术,将重链转化载体和轻链转化载体共转染入细胞系,以产生表达全长抗体(例如IgG)的稳定或瞬时细胞系。
一旦化学合成或重组表达可用于本文所述方法中的抗体(包括包含抗体片段或其变体或可替代地由抗体片段或其变体组成的分子),它可以通过本领域已知的用于纯化免疫球蛋白分子,或更一般地,蛋白分子的任何方法来纯化,例如,通过色谱法(例如,离子交换色谱法,亲和色谱法,特别是通过在蛋白A之后对特定抗原的亲和色谱法,和尺寸柱色谱法)、离心、差异溶解,或通过任何其他用于蛋白纯化的标准技术。此外,可用于本文所述方法的抗体可与本文所述或本领域已知的异源多肽序列融合,以促进纯化。
用于重组产生可用于本文所述方法的抗体的方法是本领域普通技术人员众所周知的。抗体还可以通过使用本领域普通技术人员熟知的常规技术构建包含操纵子和编码抗体的DNA序列的表达载体来产生。此外,本发明涉及载体,特别是质粒、粘粒、病毒、噬菌体和基因工程中常见的其他载体,其可以包含上述核酸分子。载体中包含的核酸分子可以连接至确保原核和真核细胞中转录的调节元件。
载体包含有利于在靶宿主细胞内表达外源蛋白的操作的元件。方便地,首先在细菌宿主(例如大肠杆菌)中进行序列的操纵和用于转化的DNA的产生,并且通常,载体将包括促进此类操作的序列,包括细菌复制起点和适当的细菌选择标记。选择标志物编码对于在选择性培养基中生长的转化宿主细胞的存活或生长所必需的蛋白。没有用含有选择基因的载体转化的宿主细胞将不能在培养基中存活。典型的选择基因编码的蛋白对抗生素或其他毒素具有抗性,补充营养缺陷型,或提供无法从复合培养基中获得的关键营养素。用于转化酵母的示例性载体和方法在本领域中有描述。参见,例如,Burke,等人(2000)Methods inYeast Genetics[酵母遗传学方法]Spring Harbor Laboratory Press[冷泉港实验室出版社]。
编码抗体的多核苷酸可以可操作地连接至转录和翻译调节序列,这些翻译调节序列提供多肽在酵母细胞中的表达。这些载体组分可以包括但不限于以下一种或多种:增强子元件、启动子和转录终止序列。也可以包括用于分泌多肽的序列(例如信号序列)。
当核酸与另一核酸序列处于功能关系时,核酸是“可操作地连接”的。例如,如果信号序列的DNA表达为参与多肽分泌的前蛋白,则该信号序列的DNA与该多肽的DNA可操作地连接;如果启动子或增强子影响序列的转录,则其可操作地连接至编码序列。一般而言,“可操作地连接”广义地指连续连接的DNA序列,并且在分泌性前导序列的情况下,指连续且在阅读框中。但是,增强子不必是连续的。
启动子是位于结构基因起始密码子上游(5')(通常在约100bp至1000bp内)的非翻译序列,其控制与其可操作地连接的特定核酸序列的转录和翻译。这些启动子分为几类:诱导型、组成型和可阻遏型启动子(例如,其应答于缺乏阻遏物而增加转录水平)。诱导型启动子可以应答于培养条件的某些变化(例如营养物的存在或不存在或温度的变化)在其控制下启动从DNA的增加的转录水平。
通过本领域普通技术人员熟知的常规技术将表达载体转染到宿主细胞中以产生转染的宿主细胞,通过本领域普通技术人员熟知的常规技术培养所述转染的宿主细胞以产生所述抗体。
用于表达抗Ba和/或抗sC5b-9抗体的宿主细胞可以是细菌细胞,如大肠杆菌、酵母(如酿酒酵母),或真核细胞(如哺乳动物细胞系)。可以使用用于此目的的明确类型的哺乳动物细胞,例如骨髓瘤细胞、3T3、HeLa、C6A2780、Vero、MOCKII、中国仓鼠卵巢(CHO)、Sf9、Sf21、COS、NSO或HEK293细胞系。
构建载体的一般方法、产生宿主细胞所需的转染方法和从所述宿主细胞产生抗体及其片段所需的培养方法都包括常规技术。尽管优选用于产生抗体的细胞系是哺乳动物细胞系,但是可以使用任何其他合适的细胞系,例如细菌细胞系,如大肠杆菌衍生的菌株,或酵母细胞系。
类似地,一旦产生抗体,就可以根据本领域的标准程序进行纯化,例如错流过滤、硫酸铵沉淀和亲和柱色谱。
可以使用任何已知的方法,例如结合测定,来筛选与CM-TMA相关生物标志物或生物标志物特征结合的抗体。在代表性方法中,在标准细胞中表达靶生物标志物或其抗原表位,并使用本领域已知的选择技术淘选抗体。抗体可以排序,例如,基于结合亲和力,例如,解离常数(K
生物流体
适用于本文所述方法的生物样品包含,例如任何生物流体。生物样品可以是例如从受试者(例如,哺乳动物如人)获得的样品,或者可以衍生自这样的受试者。生物样品还可以是生物流体,例如尿液、全血或其级分(例如,血浆或血清)、唾液、精液、痰、脑脊液、泪液或粘液。如果需要,可以将生物样品进一步分级分离成含有特定目的分析物(例如,蛋白)的级分。例如,全血样品可以被分级分离成血清或含有特定类型蛋白的级分。如果需要,生物样品可以是来自受试者的不同生物样品的组合,例如两种不同流体的组合。
从患者获得的生物流体可以是血液,任选地是血液级分,包括但不限于血清或血浆。生物流体可以是尿液。生物流体可以是血液、血清、血浆、尿液或其组合。可以对一种生物流体进行测量。在本文描述的方法中,可以对从受试者获得的至少两种不同的生物流体(例如,血液、血浆、血清和尿液的组合)进行测量。例如,测量一种类型的生物流体中的第一生物标志物蛋白的浓度,并且测量第二种类型的生物流体中的第二生物标志物蛋白的浓度。
适合于本发明的生物样品可以是从受试者收集的新鲜或冷冻样品,或具有已知诊断、治疗和/或结果历史的档案样品。生物样品可获得自受试者,例如患有、怀疑患有或有风险发展补体相关障碍(例如CM-TMA)的受试者。可以采用用于获得生物样品的任何合适的方法,尽管示例性方法包括,例如静脉切开术、拭子(例如,颊拭子)、灌洗或细针抽吸活检程序。
蛋白提取物可以从生物样品中制备。蛋白提取物包含总蛋白含量。蛋白提取方法是本领域众所周知的。参见,例如Roe(2001)“Protein Purification Techniques:APractical Approach[蛋白纯化技术:实用方法]”,第2版,牛津大学出版社。许多不同的多功能试剂盒可用于从体液和组织中提取蛋白,并且可从以下商购:例如伯乐实验室(BioRadLaboratories)(赫拉克勒斯,加利福尼亚州)、碧迪生物科学克隆技术公司(BDBiosciences Clontech)(山景城,加利福尼亚州)、化学国际公司(ChemiconInternational,Inc.)(特曼库拉,加利福尼亚州)、卡尔生物化学公(司Calbiochem)(圣地亚哥,加利福尼亚州)、皮尔斯生物技术公司(Pierce Biotechnology)(罗克福德,伊利诺伊州)和英杰公司(Invitrogen Corp.)(卡尔斯巴德,加利福尼亚州)。
用于获得和/或储存保留生物样品中生物标志物的活性或完整性的样品的方法是本领域技术人员众所周知的。例如,生物样品可进一步与一种或多种另外药剂接触,例如合适的缓冲液和/或抑制剂,包括蛋白酶抑制剂,这些药剂旨在保持或最小化蛋白结构的变化(例如,渗透压或pH的变化)。此类抑制剂包括但不限于螯合剂例如乙二胺四乙酸(EDTA)、乙二醇四乙酸(EGTA),蛋白酶抑制剂例如苯甲基磺酰氟(PMSF)、抑肽酶和亮抑酶肽。用于存储或以其他方式操作样品的适当缓冲液和条件例如中描述于Pollard和Walker(1997),“Basic Cell Culture Protocols,[基本细胞培养方案]”第75卷,Methods in molecularbiology[分子生物学方法],Humana Press[哈马纳出版社];Masters(2000)“Animal cellculture:a practical approach[动物细胞培养:一种实用的方法],”第232卷,Practicalapproach series[实用方法系列],Oxford University Press[牛津大学出版社];和Jones(1996)“Human cell culture protocols[人细胞培养方案],”第2卷,Methods inmolecular medicine[分子医学方法],Humana Press[哈马纳出版社]。
可以对样品进行处理以消除或最小化干扰物质的存在。例如,可以对生物样品进行分级分离或纯化以去除非目的的一种或多种材料(例如,细胞)。分级分离或纯化生物样品的方法包括但不限于流式细胞术、荧光激活细胞分选和沉降。
本文描述的方法可以包括记录一种或多种生物标志物蛋白浓度的一个或多个测量值。该记录可以是书面的或在计算机可读介质上。该方法可以进一步包括将生物标志物蛋白浓度的一个或多个测量值传达给受试者和/或照顾受试者的执业医师。
治疗CM-TMA的治疗性方法
“完全TMA应答”广义地指综合结果测量,该综合结果测量需要血液学参数(例如,血小板计数和乳酸脱氢酶[LDH])正常化和肾功能改善(血清肌酐相对于基线降低≥25%);对于接受透析的参与者,基线是在透析结束后至少6天建立的。参与者必须满足至少相隔4周(28天)进行的2次独立评估的这些标准,以及在26周初始评估期内进行的任何测量。发明人出人意料地发现,(1)血清sVCAM-1、(2)血清sTNF-R1、(3)血浆血栓调节蛋白和(4)尿液sC5b-9的较低基线水平与达到完全TMA应答的较高可能性相关。
此外,完全TMA应答可以通过接受治疗的患者中血小板计数和LDH正常化以及血清肌酐的改善的综合测量来评估。
可以在部分地基于受试者的体重的预定给药方案下向受试者施用补体抑制剂。示例性抗C5抗体给药方案(例如,长期给药方案)描述于WO 2010/054403和美国专利号9,658,236中。
补体抑制剂可以是抗体或其抗原结合片段、小分子、多肽、多肽类似物、拟肽物或适体。补体抑制剂可抑制以下中的一种或多种:补体组分C1、C2、C3、C4、C5、C6、C7、C8、C9、因子D、因子B、备解素、MBL、MASP-1、MASP-2、生物活性片段或其组合。补体抑制剂可以抑制与C5a相关的过敏性毒性活性的产生和/或与C5b相关的膜攻击复合物的组装中的一者或两者。
可以使用包括但不限于以下的补体抑制化合物的天然存在或可溶形式:CR1、LEX-CR1、MCP、DAF、CD59、H因子、眼镜蛇毒液因子、FUT-175、补体抑素(complestatin)、K76 COOH及其组合。
补体抑制剂可以是补体受体2(CR2)-H因子(FH)分子,其包含:a)包含CR2(例如,人CR2)或其片段的CR2部分,和b)包含FH或其片段的FH部分,其中CR2-FH分子或其片段能够与CR2配体结合,并且其中CR2-FH分子能够抑制替代途径的补体激活。示例性CR2-FH融合蛋白描述于WO 2007/149567和WO 2011/143637中。补体抑制剂可包含靶向结构域例如CR2或抗C3d抗体,如WO 2011/163412中所述。靶向结构域与其他补体抑制剂例如CD59、CD55和H因子样分子的融合体可以在本文所述的方法中用作补体抑制剂。WO 2011/163412。
补体抑制剂可以选自由以下组成的组:重组抗C5微型抗体MB12/22、靶向内皮的抗C5微型抗体MB12/22-RGD、C5特异性适体ARC187、C5特异性适体ARC1905(培戈-阿伐普他)、葡萄球菌超抗原样蛋白7(SSL7)、毛白钝缘蜱C抑制剂(OmCl)或其组合。
补体抑制剂可以是拮抗性抗体或其抗原结合片段。抗体或其抗原结合片段可以选自由以下组成的组:人源化抗体、重组抗体、双抗体、嵌合的或嵌合型抗体、单克隆抗体、去免疫抗体、全人抗体、单链抗体、Fv片段、Fd片段、Fab片段、Fab'片段、F(ab’)
拮抗剂抗体可以是抗C5抗体,包括但不限于
本文所述的方法可以包括如果受试者对在预定给药方案下的抑制剂治疗没有应答,则相对于预定给药方案以更高剂量或以增加的给药频率向受试者施用补体抑制剂的步骤。
治疗补体介导的血栓性微血管病(CM-TMA)的方法可以包括向患有、怀疑患有或有风险发展CM-TMA的受试者施用补体抑制剂(例如,补体组分C5的抑制剂),其量和频率足以实现补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者的生理变化,其中该生理变化选自由以下组成的组:(a)与用抑制剂治疗前从受试者获得的相同类型的生物流体样品中的浓度相比,补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者的浓度降低;或(b)与用补体抑制剂治疗前从受试者获得的相同类型生物流体样品中的浓度相比浓度增加。在一些实施例中,至少一种CM-TMA相关生物标志物可以是补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者。
一种使用补体抑制剂以足以诱导补体介导的血栓性微血管病(CM-TMA)相关生物标志物蛋白的生理变化的方式治疗CM-TMA的方法,该方法包括:(a)测定从受试者获得的生物流体中CM-TMA相关生物标志物蛋白的浓度,其中这些CM-TMA相关生物标志物蛋白是补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)、或两者;以及(b)向患有、怀疑患有或有风险发展CM-TMA的受试者施用补体抑制剂,施用的量和频率足以引起两(2)中CM-TMA相关生物标志物蛋白中的至少每一个的生理变化,其中该生理变化选自由以下组成的组:(a)与用抑制剂治疗前从受试者获得的相同类型的生物流体样品中的浓度相比,补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者的浓度降低;以及(b)与用补体抑制剂治疗前从受试者获得的相同类型生物流体样品中的浓度相比,从受试者获得的生物流体中的浓度增加。该方法可以进一步包括确定是否发生生理变化。
用于检测受试者中的一组生物标志物的方法可以包括检测从该受试者获得的流体生物样品中至少1种、至少2种、至少3种、至少4种、至少5种、至少6种选自由以下组成的组的生物标志物的水平:胱抑素C;胱抑素C/肌酐比率;补体因子Ba;补体因子Ba/肌酐比率;补体sC5b-9;和/或补体sC5b-9/肌酐比率;优选地检测包含至少两种生物标志物的子集中的生物标志物的水平,该至少两种生物标志物包含Ba和sC5b9。
本文所述的方法可以进一步包括测量生物流体中CM-TMA相关生物标志物蛋白的浓度,其中这些CM-TMA相关生物标志物蛋白是补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)、或两者。生物流体可以从受试者获得。
本文所述的方法可包括确定补体组分因子B的蛋白水解片段(Ba)、可溶性C5b9(sC5b-9)或两者生理变化是否已发生。治疗后,Ba和sC5b9的浓度可以降低。例如,治疗后,Ba和sC5b9各自的浓度(例如,尿液、血液、血浆、血清浓度)可以降低。
治疗开始后第6周,Ba浓度可以降低至少10%。治疗开始后第12周,Ba浓度可以降低至少30%。降低的Ba浓度可以是血液、血清、血浆、尿液或其组合中的浓度。血浆中可以存在降低的Ba浓度。
治疗开始后第3周,sC5ab9浓度可以降低至少40%。治疗开始后第6周,sC5ab9浓度可以降低至少70%。治疗开始后第3周,sC5ab9浓度可以降低至少50%。降低的sC5ab9浓度可以是血液、血清、血浆、尿液或其组合中的浓度。血浆中可以存在sC5ab9浓度。尿液中可以存在sC5ab9浓度。血浆和尿液中可以存在sC5ab9浓度。
在本文描述的方法中,该方法可以包括以足以实现生物标志物的生理变化的量和频率向受试者施用补体抑制剂。
一种或多种生物标志物蛋白的生理变化可以在施用抑制剂(例如,长期施用)后两天、三天、四天、五天、六天、一周、两周、三周、四周、六周、两个月、九周或三个月或更长时间发生。
在施用有效量的补体抑制剂后,一种或多种生物标志物蛋白的浓度可以在施用抑制剂后降低至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%。
在施用有效量的补体抑制剂后,一种或多种生物标志物蛋白的浓度在施用一个或多个剂量的补体抑制剂后可以降低至生物标志物蛋白正常浓度的50%、49%、48%、47%、46%、45%、44%、43%、42%、41%、40%、39%、38%、37%、36%、35%、34%、33%、32%、31%、30%、29%、28%、27%、26%、25%、24%、23%、22%、21%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%以内。
本文所述方法的受试者在用补体抑制剂治疗前的三个月内(例如,11、10、9、8、7、6、5、4、3、2或1周)可能已经接受过至少一次透析(例如,至少两次、三次、四次或五次或更多次)。例如,受试者可能已经在接受补体抑制剂疗法前两个月接受过一次透析。在另一实例中,受试者可以是在接受补体抑制剂疗法之前的三个月内已经接受三次透析的受试者。此外,相对于健康人中的浓度(例如,血液、血浆、血清和/或尿液浓度),Ba、sC5b9、胱抑素C和/或肌酐的浓度可以升高。
受试者可以正在经历首次急性补体介导的血栓性微血管病(CM-TMA)表现。例如,在用补体抑制剂治疗之前,受试者可以具有相对于正常浓度升高的至少一种上述生物标志物或上述生物标志物特征(包括例如多种生物标志物)的浓度。
受试者是患有CM-TMA,但被认为处于临床缓解状态的受试者(例如,受试者是具有正常水平的血小板或其他血液标志物(例如LDH或触珠蛋白)的受试者)。受试者可以是本文所述的一种或多种CM-TMA生物标志物水平升高的受试者,所述生物标志物包括但不限于Ba、sC5b9、胱抑素C和/或肌酐中的一种或多种。
本文所述的方法可进一步包括监测生物标志物的状态,并确定是否开始(除补体抑制剂疗法之外的)第二疗法或修改对补体介导的血栓性微血管病(CM-TMA)患者施用的一种或多种第二疗法的给药方案。例如,在用补体抑制剂治疗(例如,长期治疗)期间,可以在从受试者获得的一种或多种生物流体中测量一种或多种CM-TMA相关生物标志物蛋白的浓度。如果一种或多种生物标志物蛋白的浓度尚未正常化和/或保持升高,则执业医师可选择向受试者施用一种或多种另外的第二药剂(例如,抗炎药)以解决生物标志物升高引起的任何病理生理学影响。
本文所述任何方法中使用的正常对照浓度可以是(或可以基于)例如从一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个、10个、15个、20个、25个、30个、35个或40个或更多个)健康个体获得的一个或多个生物样品中的给定生物标志物蛋白的浓度。在一些实施例中,生物标志物的正常对照浓度可以是(或可以基于)例如从两个或更多个(例如,两个、三个、四个、五个、六个、七个、八个、九个、10个、15个、20个、25个、30个、35个或40个或更多个)健康个体获得的合并样品中的生物标志物的浓度。在本文描述的任何方法的一些实施例中,合并样品可以来自健康个体或至少来自没有或不怀疑患有(也没有风险发展)CM-TMA的个体。例如,确定受试者是否患有CM-TMA可包括比较从患者获得的生物样品(或几种不同类型的生物样品)中一种或多种补体组分蛋白的测量浓度,并将测量浓度与合并的健康样品中相同蛋白的平均浓度进行比较。在一些实施例中,这样的健康人对照浓度可以是值的范围,或者从该范围获得的中值或平均值。
治疗剂的施用
使用部分地取决于施用途径的多种方法,组合物(例如,补体抑制剂和/或第二药剂)可以施用于受试者,例如人受试者。途径可以是例如,静脉内注射或输注(IV)、皮下注射(SC)、腹膜内(IP)注射或肌肉内注射。
施用可以通过例如,局部输注、注射或借助于植入物。植入物可以是多孔材料、无孔材料或凝胶状材料,包括膜,例如硅胶(sialastic)膜,或纤维。植入物可以被配置为向受试者持续或定期释放组合物。参见,例如,美国专利申请公开号2008/0241223;美国专利号5,501,856;4,863,457;和3,710,795;以及欧洲专利号EP 488401和EP 430539。组合物可以通过基于例如扩散、可腐蚀或对流系统的可植入装置递送至受试者,例如渗透泵、可生物降解的植入物、电扩散系统、电渗系统、蒸汽压力泵、电解泵、泡腾泵、压电泵、基于腐蚀的系统、或机电系统。
能够治疗或预防受试者中补体介导的血栓性微血管病(CM-TMA)的补体抑制剂(例如,抗C5抗体或其片段)的合适剂量可取决于多种因素,包括例如,待治疗受试者的年龄、性别和体重以及所用的具体抑制剂化合物。例如,与治疗同一患者所需的抗C5抗体的剂量相比,用CM-TMA治疗受试者可能需要不同剂量的人C5特异性siRNA。影响施用给受试者的剂量的其他因素包括,例如,CM-TMA的类型或严重程度。例如,患有CFH相关非典型溶血性尿毒症综合征(aHUS)的受试者可能需要施用与患有MCP相关aHUS的受试者不同剂量的抑制剂。其他因素可以包括,例如,同时或之前影响受试者的其他医学障碍,受试者的一般健康状况,受试者的遗传倾向,饮食,施用时间,排泄率,药物组合,和施用给受试者的任何其他另外的治疗剂。还应当理解,用于任何特定受试者的具体剂量和治疗方案将取决于治疗医师的判断(例如,医生或护士)。
抑制剂可以固定剂量或以毫克/千克“mg/kg”的剂量施用。还可以选择剂量以减少或避免针对组合物中的一种或多种活性剂的抗体或其他宿主免疫应答的产生。抑制剂例如抗C5抗体的示例性剂量包括1-100mg/kg、0.5-50mg/kg、0.1-100mg/kg、0.5-25mg/kg、1-20mg/kg和1-10mg/kg体重。
可以约每12天(例如,约每10、11、13、14、15、16、17、18、19、20、21、28、30、42或49天或更长时间)约900mg的剂量对人静脉内施用抗C5抗体(例如,依库珠单抗、雷夫利珠单抗)。参见,例如Hill等人(2005)Blood[血液]106(7):2559。
可以每周约600(例如,约625、650、700、725、750、800、825、850、875、900、925、950或1,000或更多)mg的剂量对人静脉内施用抗C5抗体(例如,依库珠单抗、雷夫利珠单抗),任选地施用两周或更多周(例如,三周、四周、五周、六周、七周或八周或更多周)。初始治疗后,可以约每14天(例如,约每11、12、13、14、15、16、17、18、19、20、21、28、30、42或49天或更长时间)约900mg的剂量对人施用抗体,例如作为维持剂量。参见,例如,Hillmen等人(2004)NEngl JMed.[新英格兰医学杂志]350(6):552-9和Dmytrijuk等人(2008)The Oncologist[肿瘤学家]13(9):993。
可以每周约900(例如,925、950、975、1000、1100或1200或更多)mg的剂量对人静脉内施用抗C5抗体(例如,依库珠单抗、雷夫利珠单抗),任选地施用两周或更多周(例如,三周、四周、五周、六周、七周或八周或更多周)。初始治疗后,可以约每14天(例如,约每11、12、13、14、15、16、17、18、19、20、21、28、30、42或49天或更长时间)约1200mg的剂量对人施用抗体,例如作为维持剂量。参见,例如,国际专利申请公开号WO 2010/054403。
在一些实施例中,本披露涉及治疗人受试者的CM-TMA,包括根据前述方法诊断或预测CM-TMA,例如检测受试者样品中的至少1种、至少2种、至少3种、至少4种、至少5种、至少6种选自以下的生物标志物:(1)胱抑素C;(2)胱抑素C/肌酐;(3)补体因子Ba;(4)补体因子Ba/肌酐;(5)补体sC5b-9;和/或(6)补体sC5b-9/肌酐,任选地连同(7)sTNFR1、(8)VCAM-1和/或(9)血栓调节蛋白;优选地检测从该受试者获得的流体生物样品中包含至少两种生物标志物的生物标志物特征的水平,该至少两种生物标志物包含Ba和sC5b9;以及向受试者施用抗C5抗体或其抗原结合片段。在一些实施例中,治疗方法包括在施用抗C5抗体或抗原结合片段之前和之后检测一种或多种生物标志物,其中,与施用抗C5抗体或抗原结合片段之前的生物标志物浓度相比,施用抗C5抗体或抗原结合片段之后受试者样品中生物标志物浓度的调节(例如,衰减)表明受试者正在接受CM-TMA的有效治疗。
在一些实施例中,抗C5抗体选自依库珠单抗、雷夫利珠单抗、特度鲁单抗(tesidolumab)、帕泽利单抗(pozelimab)或珂罗利单抗(crovalimab),或其生物类似物或抗原结合片段。例如,依库珠单抗的优选生物类似物包括ABP 959、SB12或Elizaria。在一些实施例中,抗C5抗体包含依库珠单抗(SOLIRIS),其在WO 1995029697和US 6,355,245中描述,并且依库珠单抗的重链和轻链在WO 2007106585和US 9,718,880中提供。在一些实施例中,抗C5抗体包含雷夫利珠单抗(也称为
在一些实施例中,在CM-TMA的治疗中,以固定剂量施用抗C5抗体或抗原结合片段。例如,在一个实施例中,以如下剂量施用抗C5抗体或抗原结合片段而不考虑患者的体重:10mg、20mg、25mg、50mg、75mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg、300mg、325mg、350mg、375mg、400mg、425mg、450mg、475mg、500mg、525mg、550mg、575mg、600mg、625mg、650mg、675mg、700mg、725mg、750mg、775mg、800mg、825mg、850mg、875mg、900mg、925mg、950mg、975mg、1000mg、1100mg、1200mg、1300mg、1400mg、1500mg、1600mg、1700mg、1800mg、1900mg、2000mg、2100mg、2200mg、2300mg、2400mg、2500mg、2600mg、2700mg、2800mg、2900mg、3000mg、3100mg、3200mg、3300mg、3400mg、3500mg、3600mg、3700mg、3800mg、3900mg、4000mg、4100mg、4200mg、4300mg、4400mg、4500mg、4600mg、4700mg、4800mg、4900mg、5000mg、5100mg、5200mg、5300mg、5400mg、5500mg、5600mg、5700mg、5800mg、5900mg、6000mg、6100mg、6200mg、6300mg、6400mg、6500mg、6600mg、6700mg、6800mg、6900mg、7000mg、7100mg、7200mg、7300mg、7400mg、7500mg、7600mg、7700mg、7800mg、7900mg、8000mg、8100mg、8200mg、8300mg、8400mg、8500mg、8600mg、8700mg、8800mg、8900mg、9000mg、9100mg、9200mg、9300mg、9400mg、9500mg、9600mg、9700mg、9800mg、9900mg、10000mg、10100mg、10200mg、10300mg、10400mg、10500mg、10600mg、10700mg、10800mg、10900mg、或11000mg。
在另一个实施例中,抗C5抗体或其抗原结合片段(例如,雷夫利珠单抗
在另一个实施例中,抗C5抗体或抗原结合片段的剂量基于患者的体重。例如,在一个实施例中,将10mg、20mg、25mg、50mg、75mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg、300mg、325mg、350mg、375mg、400mg、425mg、450mg、475mg、500mg、525mg、550mg、575mg、600mg、625mg、650mg、675mg、700mg、725mg、750mg、775mg、800mg、825mg、850mg、875mg、900mg、925mg、950mg、975mg、1000mg、1100mg、1200mg、1300mg、1400mg、1500mg、1600mg、1700mg、1800mg、1900mg、2000mg、2100mg、2200mg、2300mg、2400mg、2500mg、2600mg、2700mg、2800mg、2900mg、3000mg、3100mg、3200mg、3300mg、3400mg、3500mg、3600mg、3700mg、3800mg、3900mg、4000mg、4100mg、4200mg、4300mg、4400mg、4500mg、4600mg、4700mg、4800mg、4900mg、5000mg、5100mg、5200mg、5300mg、5400mg、5500mg、5600mg、5700mg、5800mg、5900mg、6000mg、6100mg、6200mg、6300mg、6400mg、6500mg、6600mg、6700mg、6800mg、6900mg、7000mg、7100mg、7200mg、7300mg、7400mg、7500mg、7600mg、7700mg、7800mg、7900mg、8000mg、8100mg、8200mg、8300mg、8400mg、8500mg、8600mg、8700mg、8800mg、8900mg、9000mg、9100mg、9200mg、9300mg、9400mg、9500mg、9600mg、9700mg、9800mg、9900mg、10000mg、10100mg、10200mg、10300mg、10400mg、10500mg、10600mg、10700mg、10800mg、10900mg、或11000mg抗C5抗体或抗原结合片段施用于体重≥30至<40kg的患者。在另一个实施例中,将1200mg或2700mg的抗C5抗体或其抗原结合片段(例如雷夫利珠单抗
在另一个实施例中,将10mg、20mg、25mg、50mg、75mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg、300mg、325mg、350mg、375mg、400mg、425mg、450mg、475mg、500mg、525mg、550mg、575mg、600mg、625mg、650mg、675mg、700mg、725mg、750mg、775mg、800mg、825mg、850mg、875mg、900mg、925mg、950mg、975mg、1000mg、1100mg、1200mg、1300mg、1400mg、1500mg、1600mg、1700mg、1800mg、1900mg、2000mg、2100mg、2200mg、2300mg、2400mg、2500mg、2600mg、2700mg、2800mg、2900mg、3000mg、3100mg、3200mg、3300mg、3400mg、3500mg、3600mg、3700mg、3800mg、3900mg、4000mg、4100mg、4200mg、4300mg、4400mg、4500mg、4600mg、4700mg、4800mg、4900mg、5000mg、5100mg、5200mg、5300mg、5400mg、5500mg、5600mg、5700mg、5800mg、5900mg、6000mg、6100mg、6200mg、6300mg、6400mg、6500mg、6600mg、6700mg、6800mg、6900mg、7000mg、7100mg、7200mg、7300mg、7400mg、7500mg、7600mg、7700mg、7800mg、7900mg、8000mg、8100mg、8200mg、8300mg、8400mg、8500mg、8600mg、8700mg、8800mg、8900mg、9000mg、9100mg、9200mg、9300mg、9400mg、9500mg、9600mg、9700mg、9800mg、9900mg、10000mg、10100mg、10200mg、10300mg、10400mg、10500mg、10600mg、10700mg、10800mg、10900mg、或11000mg抗C5抗体或抗原结合片段施用于体重≥40至<60kg的患者。在另一个实施例中,将2400mg或3000mg的抗C5抗体或其抗原结合片段(例如雷夫利珠单抗
在另一个实施例中,将10mg、20mg、25mg、50mg、75mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg、300mg、325mg、350mg、375mg、400mg、425mg、450mg、475mg、500mg、525mg、550mg、575mg、600mg、625mg、650mg、675mg、700mg、725mg、750mg、775mg、800mg、825mg、850mg、875mg、900mg、925mg、950mg、975mg、1000mg、1100mg、1200mg、1300mg、1400mg、1500mg、1600mg、1700mg、1800mg、1900mg、2000mg、2100mg、2200mg、2300mg、2400mg、2500mg、2600mg、2700mg、2800mg、2900mg、3000mg、3100mg、3200mg、3300mg、3400mg、3500mg、3600mg、3700mg、3800mg、3900mg、4000mg、4100mg、4200mg、4300mg、4400mg、4500mg、4600mg、4700mg、4800mg、4900mg、5000mg、5100mg、5200mg、5300mg、5400mg、5500mg、5600mg、5700mg、5800mg、5900mg、6000mg、6100mg、6200mg、6300mg、6400mg、6500mg、6600mg、6700mg、6800mg、6900mg、7000mg、7100mg、7200mg、7300mg、7400mg、7500mg、7600mg、7700mg、7800mg、7900mg、8000mg、8100mg、8200mg、8300mg、8400mg、8500mg、8600mg、8700mg、8800mg、8900mg、9000mg、9100mg、9200mg、9300mg、9400mg、9500mg、9600mg、9700mg、9800mg、9900mg、10000mg、10100mg、10200mg、10300mg、10400mg、10500mg、10600mg、10700mg、10800mg、10900mg、或11000mg抗C5抗体或其抗原结合片段施用于体重≥60至<100kg的患者。在另一个实施例中,将2700mg或3300mg的抗C5抗体或其抗原结合片段(例如雷夫利珠单抗
在另一个实施例中,将10mg、20mg、25mg、50mg、75mg、100mg、125mg、150mg、175mg、200mg、225mg、250mg、275mg、300mg、325mg、350mg、375mg、400mg、425mg、450mg、475mg、500mg、525mg、550mg、575mg、600mg、625mg、650mg、675mg、700mg、725mg、750mg、775mg、800mg、825mg、850mg、875mg、900mg、925mg、950mg、975mg、1000mg、1100mg、1200mg、1300mg、1400mg、1500mg、1600mg、1700mg、1800mg、1900mg、2000mg、2100mg、2200mg、2300mg、2400mg、2500mg、2600mg、2700mg、2800mg、2900mg、3000mg、3100mg、3200mg、3300mg、3400mg、3500mg、3600mg、3700mg、3800mg、3900mg、4000mg、4100mg、4200mg、4300mg、4400mg、4500mg、4600mg、4700mg、4800mg、4900mg、5000mg、5100mg、5200mg、5300mg、5400mg、5500mg、5600mg、5700mg、5800mg、5900mg、6000mg、6100mg、6200mg、6300mg、6400mg、6500mg、6600mg、6700mg、6800mg、6900mg、7000mg、7100mg、7200mg、7300mg、7400mg、7500mg、7600mg、7700mg、7800mg、7900mg、8000mg、8100mg、8200mg、8300mg、8400mg、8500mg、8600mg、8700mg、8800mg、8900mg、9000mg、9100mg、9200mg、9300mg、9400mg、9500mg、9600mg、9700mg、9800mg、9900mg、10000mg、10100mg、10200mg、10300mg、10400mg、10500mg、10600mg、10700mg、10800mg、10900mg、或11000mg抗C5抗体或抗原结合片段施用于体重≥100kg的患者。在另一个实施例中,将3000mg或3600mg的抗C5抗体或其抗原结合片段(例如雷夫利珠单抗
在另一个实施例中,提供了治疗患有CM-TMA的人患者的方法,该方法包括按以下向患者施用抗C5抗体或其抗原结合片段(例如,雷夫利珠单抗
(a)在第1天一次,按以下剂量:体重≥30至<40kg的患者1200mg,体重≥40至<60kg的患者2400mg,体重≥60至<100kg的患者2700mg,或体重≥100kg的患者3000mg;以及
(b)在第15天和此后每八周,剂量为:体重≥30至<40kg的患者2700mg,体重≥40至<60kg的患者3000mg,体重≥60至<100kg的患者3300mg,或体重≥100kg的患者3600mg。
在另一个实施例中,提供了用CM-TMA治疗人患者的方法,其中抗C5抗体或其抗原结合片段(例如,雷夫利珠单抗
(a)在第1天一次,剂量为1200mg;以及
(b)在第15天和此后每八周,剂量为2700mg。
在另一个实施例中,提供了治疗患有CM-TMA的人患者的方法,其中抗C5抗体或其抗原结合片段(例如,雷夫利珠单抗
(a)在第1天一次,剂量为2400mg;以及
(b)在第15天和此后每八周,剂量为3000mg。
在另一个实施例中,提供了治疗患有CM-TMA的人患者的方法,其中抗C5抗体或其抗原结合片段(例如,雷夫利珠单抗
(a)在第1天一次,剂量为2700mg;以及
(b)在施用周期的第15天和此后每八周,剂量为3300mg。
在另一个实施例中,提供了治疗患有CM-TMA的人患者的方法,其中抗C5抗体或其抗原结合片段(例如,雷夫利珠单抗
(a)在第1天一次,剂量为3000mg;以及
(b)在第15天和此后每八周,剂量为3600mg。
在另一个实施例中,提供了治疗患有CM-TMA的人患者的方法,该方法包括向患者施用有效量的抗C5抗体或其抗原结合片段,其中该抗C5抗体或其抗原结合片段包含分别如SEQ ID NO:19、18和3所示的CDR1、CDR2和CDR3重链序列以及分别如SEQ ID NO:4、5和6所示的CDR1、CDR2和CDR3轻链序列,以及与人新生儿Fc受体(FcRn)结合的变体人Fc区,其中变体人Fc CH3区在对应于天然人IgG Fc区的甲硫氨酸428和天冬酰胺434的残基处(各自以EU编号)包含Met-429-Leu和Asn-435-Ser取代,并且其中按以下向患者施用抗C5抗体或其抗原结合片段
(a)在第1天一次,按以下剂量:体重≥30至<40kg的患者1200mg,体重≥40至<60kg的患者2400mg,体重≥60至<100kg的患者2700mg,或体重≥100kg的患者3000mg;以及
(b)在第15天和此后每八周,剂量为:体重≥30至<40kg的患者2700mg,体重≥40至<60kg的患者3000mg,体重≥60至<100kg的患者3300mg,或体重≥100kg的患者3600mg。
在另一个实施例中,抗C5抗体或抗原结合片段以毫克/千克(mg/kg)的剂量施用。例如,在一个实施例中,抗C5抗体或其抗原结合片段以如下剂量施用:0.1mg/kg、0.25mg/kg、0.5mg/kg、0.75mg/kg、1.0mg/kg、1.25mg/kg、1.50mg/kg、1.75mg/kg、2.0mg/kg、2.25mg/kg、2.50mg/kg、2.75mg/kg、3.0mg/kg、3.25mg/kg、3.50mg/kg、3.75mg/kg、4.0mg/kg、4.25mg/kg、4.50mg/kg、4.75mg/kg、5.0mg/kg、5.25mg/kg、5.50mg/kg、5.75mg/kg、6.0mg/kg、6.25mg/kg、6.50mg/kg、6.75mg/kg、7.0mg/kg、7.25mg/kg、7.50mg/kg、7.75mg/kg、8.0mg/kg、8.25mg/kg、8.50mg/kg、8.75mg/kg、9.0mg/kg、9.25mg/kg、9.50mg/kg、9.75mg/kg、10.0mg/kg、11.25mg/kg、11.50mg/kg、11.75mg/kg、12.0mg/kg、12.25mg/kg、12.50mg/kg、12.75mg/kg、13.0mg/kg、13.25mg/kg、13.50mg/kg、13.75mg/kg、14.0mg/kg、14.25mg/kg、14.50mg/kg、14.75mg/kg、15.0mg/kg、15.25mg/kg、15.50mg/kg、15.75mg/kg、16.0mg/kg、16.25mg/kg、16.50mg/kg、16.75mg/kg、17.0mg/kg、17.25mg/kg、17.50mg/kg、17.75mg/kg、18.0mg/kg、18.25mg/kg、18.50mg/kg、18.75mg/kg、19.0mg/kg、19.25mg/kg、19.50mg/kg、19.75mg/kg、20.0mg/kg、20.25mg/kg、20.50mg/kg、20.75mg/kg、21.0mg/kg、21.25mg/kg、21.50mg/kg、21.75mg/kg、22.0mg/kg、22.25mg/kg、22.50mg/kg、22.75mg/kg、23.0mg/kg、23.25mg/kg、23.50mg/kg、23.75mg/kg、24.0mg/kg、24.25mg/kg、24.50mg/kg、24.75mg/kg或25.0mg/kg。
在一个实施例中,每周一次、每周两次、每周三次、每周四次、每周五次、每周六次或每天施用抗C5抗体或抗原结合片段。在另一个实施例中,每两周一次、每三周一次、每四周一次、每五周一次、每六周一次、每七周一次、每八周一次、每九周一次,每十周一次,每十一周一次,或每十二周一次施用抗C5抗体或抗原结合片段。在另一个实施例中,在第1天以负荷剂量施用抗C5抗体或抗原结合片段,然后在第15天和此后每八周施用不同的维持剂量。
在另一个实施例中,施用抗C5抗体或其抗原结合片段持续一个或多个施用周期。在一个实施例中,施用周期是26周。在另一个实施例中,治疗包括至少1、2、3、4、5、6、7、8、9、10或11个周期。在另一个实施例中,治疗患者约1、2、3、4、5或6个月。在另一个实施例中,治疗在人患者的一生中持续进行。
抗C5抗体或抗原结合片段可以通过任何合适的方式施用。在一个实施例中,静脉内施用抗C5抗体或抗原结合片段(例如,雷夫利珠单抗
根据本文描述的方法治疗的患者可以已经在起始治疗之前3年内或在起始治疗之时接种了脑膜炎球菌感染疫苗。在接受脑膜炎球菌疫苗后不到2周接受治疗的患者还可以用适当的预防性抗生素治疗直到接种后2周。根据本文所述方法治疗的患者可以接种了针对脑膜炎球菌血清型A、C、Y、W135和/或B的疫苗。
根据本文描述的方法治疗的患者可患有与狼疮性肾炎、系统性硬化症或实体器官移植相关的TMA。这些患者可以在治疗前接种针对流感嗜血杆菌b型(Hib)和肺炎链球菌的疫苗。
本文所述的治疗方案足以维持该抗C5抗体或其抗原结合片段的特别血清谷浓度。例如,在一个实施例中,该治疗可以维持该抗C5抗体或其抗原结合片段的血清谷浓度为50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、200、205、210、215、220、225、230、240、245、250、255、260、265、270、280、290、300、305、310、315、320、325、330、335、340、345、350、355、360、365、370、375、380、385、390、395或400μg/mL或更高。在一个实施例中,该治疗维持该抗C5抗体或其抗原结合片段的血清谷浓度为100μg/mL或更高。在另一个实施例中,治疗维持抗C5抗体或其抗原结合片段的血清谷浓度为150μg/mL或更高。在另一个实施例中,治疗维持抗C5抗体或其抗原结合片段的血清谷浓度为200μg/mL或更高。在另一个实施例中,治疗维持抗C5抗体或其抗原结合片段的血清谷浓度为250μg/mL或更高。在另一个实施例中,治疗维持抗C5抗体或其抗原结合片段的血清谷浓度为300μg/mL或更高。在另一个实施例中,该治疗维持该抗C5抗体或其抗原结合片段的血清谷浓度在100μg/ml和200μg/mL之间。在另一个实施例中,该治疗维持该抗C5抗体或其抗原结合片段的血清谷浓度为约175μg/mL。
为了获得有效的应答,可以以维持至少50μg、55μg、60μg、65μg、70μg、75μg、80μg、85μg、90μg、95μg、100μg、105μg、110μg、115μg、120μg、125μg、130μg、135μg、140μg、145μg、150μg、155μg、160μg、165μg、170μg,175μg、180μg、185μg、190μg、195μg、200μg、205μg、210μg、215μg、220μg、225μg、230μg、235μg、240μg、245μg、250μg、255μg或260μg抗体/毫升患者血液的量和频率向患者施用抗C5抗体。在另一个实施例中,以维持在50μg和250μg抗体/毫升之间的患者血液的量和频率向该患者施用该抗C5抗体。在另一个实施例中,以维持在100μg和200μg抗体/毫升之间的患者血液的量和频率向该患者施用该抗C5抗体。在另一个实施例中,以维持约175μg抗体/毫升患者血液的量和频率向患者施用该抗C5抗体。
在另一个实施例中,为了获得有效应答,以一定的量和频率向患者施用抗C5抗体,以维持最小游离C5浓度。例如,在一个实施例中,可以以维持0.2μg/mL、0.3μg/mL、0.4μg/mL、0.5μg/mL或更低的游离C5浓度的量和频率向患者施用抗C5抗体。在另一个实施例中,本文所述的治疗在整个治疗期间将游离C5浓度降低大于99%。
“长期施用”、“长期治疗”、“长期地治疗”或其类似的语法变体广义地指一种治疗方案,其用于维持患者血液中治疗剂的某一阈值浓度,以便在延长的时间内完全或基本上抑制患者的全身性补体活性。因此,用补体抑制剂长期治疗的受试者可以用抑制剂治疗大于或等于2周的一段时间(例如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51或52周;1、2、3、4、5、6、7、8、9、10、11或12个月;或1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5或12年或患者的剩余寿命),抑制剂的量和给药频率足以维持患者血液中抑制或基本抑制患者全身性补体活性的抑制剂浓度。补体抑制剂可以以有效维持血清溶血活性小于或等于20%(例如,19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%或5%)的量和频率长期施用给有需要的患者。参见,例如Hill等人(2005)Blood[血液]106(7):2559。补体抑制剂可以以有效维持血清乳酸脱氢酶(LDH)水平在LDH正常范围的至少20%(例如,19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%或5%)内的量和频率施用给患者。参见Hill等人(2005)同上。补体抑制剂可以以有效维持血清LDH水平低于550(例如低于540、530、520、510、500、490、480、470、460、450、440、430、420、410、400、390、380、370、360、350、340、330、320、310、300、290、280或小于270)IU/L的量和频率施用给患者。为了维持患者的全身性补体抑制,可以对患者长期施用补体抑制剂,例如每周一次、每两周一次、每周两次、每天一次、每月一次或每三周一次。
在一些实施例中,治疗包括按照其给药方案施用雷夫利珠单抗。在一些实施例中,雷夫利珠单抗作为静脉内(i.v.)配制品施用,包括在第1天的单次负荷剂量,随后基于该受试者的体重从第15天开始定期维持给药,其中(a)对于体重≥40至<60千克(kg)的受试者,治疗包括2400毫克(mg)负荷,然后每8周3000mg维持剂量;(b)对于体重≥60至<100kg的受试者,治疗包括2700mg负荷,然后每8周3300mg维持剂量;以及(c)对于体重≥100kg的受试者,治疗包括3000mg负荷,然后每8周3600mg维持剂量。在一些实施例中,雷夫利珠单抗作为皮下(SC)配制品施用。
组合物
组合物可包含治疗有效量的人补体组分C5抑制剂(例如,抗C5抗体或其抗原结合片段)。两种优选的抗C5抗体包括但不限于依库珠单抗
组合物可以是进一步包含赋形剂、载剂、稀释剂、稳定剂、缓冲剂、抗氧化剂或其组合的药物组合物。药物组合物可包含治疗有效量的人补体组分C5抑制剂(例如,抗C5抗体或其抗原结合片段)。两种优选的抗C5抗体包括但不限于依库珠单抗
有效量可由本领域普通技术人员部分基于所施用抑制剂的效果,或抗体和一种或多种另外的活性剂(如果使用一种以上的药剂)的组合效果来容易地确定。人补体组分C5的抑制剂(例如,抗C5抗体)[例如,依库珠单抗、雷夫利珠单抗]的治疗有效量也可以根据诸如个体的疾病状态、年龄、性别和体重以及抗体(和一种或多种另外的活性剂)在个体中引发期望的应答的能力(例如,至少一种状况参数的改善,例如,CM-TMA的至少一种症状的改善)等因素而变化。例如,治疗有效量的人补体组分C5抑制剂(例如,抗C5抗体)可以抑制以下(减轻以下的严重性或消除以下的发生)和/或预防以下:血小板减少症、微血管病性溶血性贫血、肾衰竭和/或本领域已知或本文描述的CM-TMA的任何一种症状。两种优选的抗C5抗体包括但不限于依库珠单抗
本文所述的组合物可包含治疗有效量的人补体组分C5抑制剂。两种优选的抗C5抗体包括但不限于依库珠单抗
此类组合物的毒性和治疗功效可以通过细胞培养物或实验动物(aHUS的动物模型)中的已知药学程序来测定。可以使用这些程序,例如,用于确定LD
从细胞培养测定和动物研究获得的数据可以用于配制一系列的用于在人中使用的剂量。aHUS的合适动物模型是本领域已知的并且描述于,例如,Atkinson等人(2007)Journal of Experimental Medicine[实验医学杂志]204(6):1245-1248。此类抑制剂的剂量通常位于抑制剂(例如,抗C5抗体或其抗原结合片段)的循环浓度范围内,这些循环浓度包括ED
人补体组分C5抑制剂所需的剂量可以根据受试者血液中人C5蛋白的浓度来确定。例如,具有较高浓度的循环人C5蛋白水平的受试者可能比具有较低水平的循环人C5的受试者需要更高剂量的人C5抑制剂。用于测定来自受试者的血液来源的流体样品中人补体组分C5浓度的方法是本领域已知的并且描述于,例如Rawal等人(1998)J Biol Chem[生物化学杂志]273(27):16828-16835。
该方法可以与CM-TMA的其他疗法结合进行。例如,该组合物可以在肾切除术(例如,双侧肾切除术)、透析、血浆置换或血浆输注的同时、之前或之后施用给受试者(参见,例如,Noris等人(2005)“Non-shiga toxin-associated hemolytic uremic syndrome[非志贺毒素相关的溶血性尿毒症综合征]”.于:Zipfel P(编辑).Complement and KidneyDisease[补体和肾脏疾病].Basel:Birkhauser-Verlag[巴塞尔:伯克希-维乐格出版社],65-83)。
人补体组分C5的抑制剂(例如,抗C5抗体或其抗原结合片段)[例如,依库珠单抗、雷夫利珠单抗]可以作为单一疗法施用于受试者。可替代地,如上所述,该抑制剂可以作为与另一种治疗(例如,CM-TMA的另一种治疗)的组合疗法施用给受试者。例如,组合疗法可以包括给受试者(例如人患者)施用一种或多种另外的药剂(例如抗高血压药),所述药剂为患有或有风险发展CM-TMA的受试者提供治疗益处。人补体组分C5抑制剂和一种或多种另外的活性剂可以同时施用。可以首先施用抑制剂并且随后施用一种或多种另外的活性剂。在一些实施例中,首先施用一种或多种另外的活性剂,然后及时施用抑制剂。
人补体组分C5的抑制剂可以替代或增强先前或当前施用的疗法。例如,在用抗C5抗体或其抗原结合片段治疗后,一种或多种另外的活性剂的施用可以停止或减少,例如,以较低水平施用。可以维持先前的疗法。可以维持先前的疗法直至人C5抑制剂的水平达到足以提供治疗效果的水平。两种疗法可以组合施用。
如本文所定义,监测受试者(例如人患者)CM-TMA的改善是指评估受试者疾病参数的变化,例如疾病的一种或多种症状的改善。此类症状包括本文描述的CM-TMA的任何症状。在一些实施例中,在治疗开始后至少1小时,例如至少2、4、6、8、12、24或48小时,或至少1天、2天、4天、10天、13天、20天或更长时间,或至少1周、2周、4周、10周、13周、20周或更长时间,进行评估。可以在以下一个或多个时期对受试者进行评估:开始治疗之前;治疗期间;或者在施用治疗的一个或多个要素之后。评估可以包括评估进一步治疗的需要,例如,评估是否应改变剂量、施用频率或治疗持续时间。它还可以包括评估添加或弃用所选治疗方式的需要,例如,添加或弃用本文描述的CM-TMA的任何治疗。
因子B蛋白水解片段(Ba)的浓度
可以测量因子B的蛋白水解片段的浓度。该片段可以是Ba。生物样品可以是血液、血清、血浆和/或尿液样品。生物样品可以是血浆和尿液。
当生物样品中Ba的浓度比正常对照Ba浓度高至少两倍时,则认为生物样品中Ba的浓度升高。当生物样品中Ba的浓度比正常对照Ba浓度高至少五倍时,则认为生物样品中Ba的浓度升高。当生物样品中Ba的浓度大于约1,000ng/mL时,认为其浓度升高。当生物样品中Ba的浓度大于约1,500ng/mL时,认为其浓度升高。当生物样品中Ba的浓度大于约2,500ng/mL时,认为其浓度升高。
相对于治疗前从受试者获得的相同类型生物流体样品中的Ba浓度,治疗后Ba浓度(例如,血浆Ba浓度)降低至少10%、15%、20%、25%、30%、35%、40%、45%或50%,表明受试者具有或可能实现完全血栓性微血管病(TMA)应答(例如,TMA事件停止)。第一次补体抑制剂治疗后第12周可能会出现这种降低。第一次补体抑制剂治疗后第12-17周内可能会出现这种降低。第一次补体抑制剂治疗后第26周可能会出现这种降低。
末端补体复合物(sC5b-9)的浓度
当样品中sC5b-9的浓度比正常对照高至少十倍时,则认为样品中sC5b-9的浓度升高。当生物样品中sC5b-9的浓度比正常对照Ba浓度高至少五十倍时,则认为生物样品中sC5b-9的浓度升高。当生物样品中sC5b-9的浓度比正常对照Ba浓度高至少一百倍时,则认为生物样品中sC5b-9的浓度升高。当生物样品中sC5b-9的浓度为至少20ng/mg尿肌酐时,认为其浓度升高。当生物样品中sC5b-9的浓度为至少30ng/mg尿肌酐时,认为其浓度升高。对照浓度可以从来自健康受试者的生物样品中确定,该健康受试者是例如,没有CM-TMA的受试者,优选其尿液样品不含可检测水平的sC5b9的受试者,如通过标准免疫测定测量的。
肌酐水平
在本披露的一些实施例中,测量受试者生物样品中的肌酐水平。可以使用任何常规方法来测量肌酐水平,包括但不限于比色测定法(例如,Jaffe法)、酶法、化学发光测定法、色谱技术、分子印迹聚合物(MIP)、毛细管法电泳、分光光度法、电位传感器、电化学传感器(ECA)、pH计和电流传感器。这些技术可以在血液样品、尿液样品、甚至唾液样品上进行,几乎不需要至不需要样品处理(Wei等人,Anal Chem[分析化学],2012Sep 18;84(18):7933-7)。在一些实施例中,可以使用与肌酐结合的纳米颗粒(NP)来改进上述测定。
估计肾小球滤过率(eGFR)
成人的正常GFR值为约90以上。即使没有疾病,这可能会随着年龄的增长而降低,例如,70+岁的人GFR可能高于约75。无论任何年龄,GFR值低于60均表明存在肾脏痛苦和/或疾病。CKD-EPI肌酐等式(2009)可用于估计GFR。
表示为单个等式:
eGFR=
141x min(S
max(S
0.993
1.018[如果是女性]x
1.159[如果是非洲人后裔]
eGFR(估计肾小球滤过率)=mL/min/1.73m
S
κ=0.7(女性)或0.9(男性)
α=-0.329(女性)或-0.411(男性)
min=表示S
max=表示S
年龄=岁
CKD-EPI肌酐等式(2009)是本领域已知的并且由National Kidney Foundation[国家肾脏基金会]提供。国家肾脏基金会网站(2021);Levey等人
本文描述的生物标志物的状态可以预测用补体抑制剂治疗的CM-TMA患者的估计肾小球滤过率(eGFR)的改善。例如,Ba和/或sC5b-9浓度的降低(例如,在慢性治疗方案中初始治疗后26周内)表明用补体抑制剂治疗的CM-TMA患者已实现或可能实现eGFR的有临床意义的改善。
尿蛋白/肌酐(Cr)比率(UPCR)
UPCR小于约0.2被认为在正常范围内。Huang等人
生物标志物与次级标志物eGFR和/或UPCR之间的关联
本披露的实施例涉及CM-TMA生物标志物在CM-TMA的诊断、管理和治疗中的用途,这些生物标志物与前述次级标志物如eGFR和/或UPCR相关。如代表性实例部分中所例证的,CM-TMA的次级标志物(例如eGFR和/或UPCR)与本披露的主要蛋白生物标志物之间的关联水平可以使用常规技术,例如回归分析,来确定。
试剂盒
还提供了包含可用于实施本文描述的方法的各种试剂和材料的试剂盒。本文描述的用于测量、诊断、评估和/或估计的程序可以由诊断性实验室、实验性实验室或个体从业者执行。本发明提供了可用于任何或所有这些情况的试剂盒。
试剂盒可包含用于根据本文提供的方法表征或处理生物样品(例如,生物流体)、测量生物标志物水平(例如,蛋白或核酸水平)、诊断受试者中的CM-TMA或监测受试者中的治疗应答的材料和试剂。试剂盒可包含特异性检测一种或多种CM-TMA生物标志物蛋白(例如,Ba、sC5b9或两者)的蛋白水平的至少一种或多种试剂,以及任选地使用试剂盒的说明书。试剂盒可包含,例如,本文描述的任何阵列。
试剂盒可包含合适的对照样品(例如,来自正常健康个体的生物流体或包含已知的对照量的特定目的分析物的溶液)。试剂盒可包含用于根据本文所述的一种或多种方法使用试剂盒的说明书,并且可以包含用于处理从受试者获得的生物样品(例如,生物流体)和/或用于进行测试的说明书或用于解释结果的说明书。
实例
实例1
患者中CM-TMA生物标志物的检测
使用雷夫利珠单抗(末端C5补体抑制剂)在aHUS成人中的III期研究数据(NCT02949128),将患者的基线(BL;治疗前)血清、血浆和尿液生物标志物水平与健康志愿者(HV)的水平进行比较,并在BL和治疗开始后26周评估与肾功能(例如估计肾小球滤过率[eGFR]和尿蛋白/肌酐[Cr]比率[UPCR])的关联。报告回归系数和p值(双侧t检验)。
结果:该分析包括55名患者:中值年龄39(范围19-76)岁;67%女性;53%白种人,27%亚洲人。与HV相比,特定的BL生物标志物升高,并且确定了BL生物标志物水平与BLeGFR和BL UPCR之间的关联(表1)。BL血浆补体因子Ba与雷夫利珠单抗治疗26周后的eGFR变化相关,而尿液sC5b-9、sC5b-9/Cr、Ba和Ba/Cr与治疗26周后的UPCR变化相关。
表1
*与观察到的HV最大值相比;**尿液sC5b-9在HV中检测不到,因此HV值设置为1/2LLOQ(在本文描述的进一步研究中,sC5b-9的正常供体值设置为尿液sC5b-9的定量下限的一半(1/2LLOQ))。
结论:补体生物标志物Ba(血浆和尿液)和sC5b-9(尿液)与aHUS患者基线时和经抗C5疗法治疗26周的肾功能相关。此类生物标志物在CM-TMA中证明了诊断潜力,并且可以预测肾脏对末端补体抑制的应答。
实例2
患者中CM-TMA生物标志物的检测
aHUS是补体介导的血栓性微血管病的一种形式,由替代补体途径失调引起,无论是否有确定的触发因素,通常会导致肾脏损伤/衰竭;对其他器官系统的损害很常见。目前还没有经过验证的生物标志物或检测方法可用于aHUS的诊断或预后。鉴定aHUS患者中单个具有临床意义的生物标志物或其组合可能会导致更快速的诊断、临床病程的预测和/或更早的治疗开始。
使用在补体抑制剂疗法初治型aHUS成人中的补体C5抑制剂雷夫利珠单抗III期研究的探索性生物标志物数据,该分析包括:
(a)将该群体的基线生物标志物水平与正常工会提的水平进行比较;
(b)评估雷夫利珠单抗治疗期间生物标志物水平相对于基线的纵向变化;
(c)检查基线生物标志物水平与基线临床测量值以及治疗26周后临床测量值变化之间的关联;以及
(d)检查基线生物标志物水平与治疗26周后临床结果之间的关联。
表2患者人口统计特征和疾病特征
/>
表3患者人口统计特征和疾病特征
表4患者人口统计特征和疾病特征
另请参见Rondeau等人
*完整分析集,其中N=55构成生物标志物分析集;
§测试的患者人数,n=39;
CF,补体因子;CI,置信区间;eGFR,估计肾小球滤过率;LDH,乳酸脱氢酶;TMA,血栓性微血管病
表5与正常供体水平相比,治疗前aHus成人中大多数生物标志物升高
*本研究名义上总共评估了55名aHUS成人、10名正常尿液供体和20名正常血清/血浆供体;
在正常供体尿液样品中无法检测到sC5b-9,因此对于本分析,尿液sC5b-9的正常供体值设置为1/2LLOQ。
所有生物分析测定(商业ELISA和定制MSD两者)均根据2018年FDA生物标志物方法指南进行了验证。样品测试和数据报告是在受监管、质量控制的实验室中进行的。
轮廓方框表示血浆和尿液中针对肌酐归一化的补体特异性生物标志物的结果。
aHUS,非典型溶血性尿毒症综合征,Cr,肌酐;ELISA,酶联免疫吸附测定;FDA,美国食品和药物管理局;LLOQ,定量下限;MSD,细观尺度发现公司(meso scalediscovery)
除血清sVCAM-1外,与正常供体中观察到的最高水平相比,63-100%的aHUS成人中所有生物标志物均升高。补体特异性生物标志物Ba和sC5b-9在>75%的患者中升高,其中在≥97%的患者血浆和尿液Ba升高。这是在尿液、血浆和血清中检查的一组生物标志物。
在尿液样品中,发明人还评估了针对肌酐归一化的生物标志物水平。加轮廓突出了补体因子Ba和蛋白sC5b-9的结果,它们与补体活性(分别是替代途径和末端途径)特异性相关。这些结果支持使用这些生物标志物来诊断aHUS和其他补体介导的病症。
图1描绘了雷夫利珠单抗治疗情况下补体失调和肾损伤减少的生物标志物。雷夫利珠单抗的首个剂量后,尿液Ba/Cr和sC5b-9/Cr水平显著下降,表明C5抑制的早期药效作用。从第71天起,血浆Ba水平与基线水平相比显著降低,表明持续的末端抑制可以降低替代补体途径活性。雷夫利珠单抗的首个剂量后,尿液胱抑素C/Cr水平显著下降,表明肾脏恢复。发明人评估了归一化数据,该数据最好地证明了随时间的变化。这些结果表明,补体特异性生物标志物确实会应答于抗C5疗法而减少,这支持了治疗应答监测的使用。
图2描绘了基线生物标志物与基线临床测量之间的关联。血浆Ba和尿液Ba/Cr和sC5b-9/Cr以及尿液胱抑素C/Cr的基线水平与较低的基线eGFR和升高的基线蛋白尿显著相关。在非补体特异性生物标志物和相同的临床测量之间也观察到显著的关联。Ba和sC5b-9的结果被突出,因为这些补体特异性生物标志物与基线时的肾功能测量(特别是eGFR和蛋白尿)显著相关。
图3描绘了基线生物标志物与治疗26周临床测量变化之间的关联。使用雷夫利珠单抗治疗26周后:(a)基线尿液sC5b-9/Cr与血小板计数增加显著相关;(b)基线尿液Ba/Cr和sC5b-9/Cr与蛋白尿水平的变化显著负相关;以及(c)基线血浆Ba与eGFR的变化显著负相关。还观察到非补体特异性生物标志物的一些显著关联。
突出显示的结果表明,血浆中的基线Ba,特别是尿液中的Ba和sC5b-9(归一化结果)与C5抑制剂治疗期间的肾功能相关。这表明它们可用于预测(评估)治疗结果。
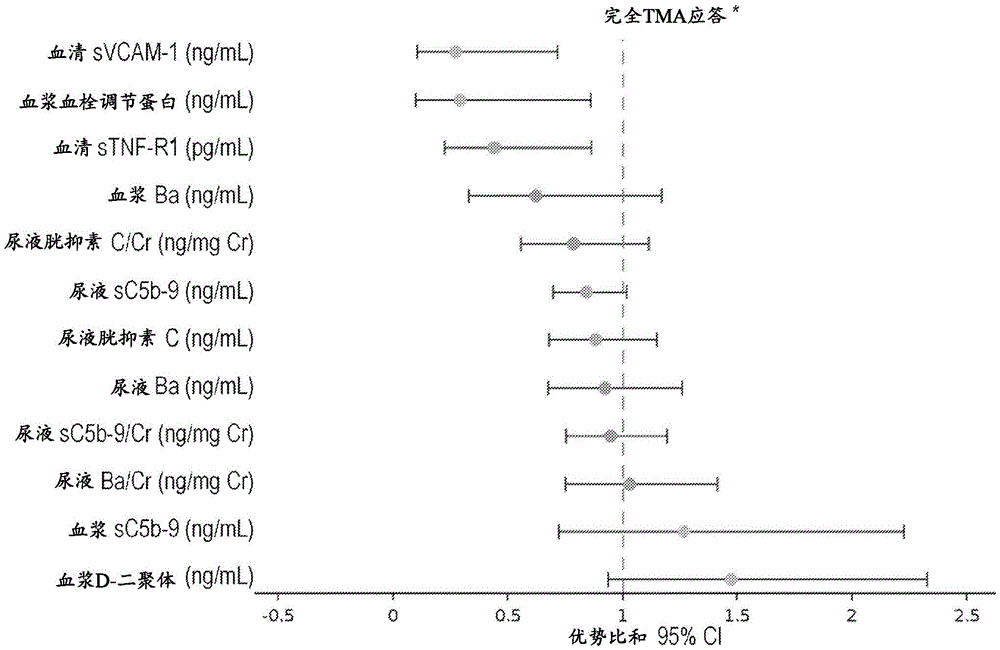
图4描绘的数据显示基线生物标志物水平与26周时的选定临床结果显著相关。优势比源自逻辑回归分析(其中应答变量作为因变量,基线生物标志物水平的对数作为自变量),并且代表基线生物标志物中每增加2倍,实现功效应答的几率增加(或减少)。26周时:(1)血清sVCAM-1和sTNF-R1的较低基线水平与实现TMA完全应答的较高可能性显著相关;(2)血浆血栓调节蛋白的较低基线水平与实现完全TMA应答的较高可能性显著相关;以及(3)尿液sC5b-9的较低基线水平与实现完全TMA应答的较高可能性显著相关。发明人评估了完全TMA应答:血小板计数和LDH正常化以及血清肌酐改善的综合测量。在补体特异性生物标志物中,尿液中的sC5b-9与C5抑制剂治疗后的完全TMA应答具有最显著的相关性。在非补体特异性生物标志物中,与肾功能相关的生物标志物具有最显著的相关性。
通过评估血液和/或尿液中的7种生物标志物对新诊断的初治型aHUS成人的临床诊断、预后和预测效用,发明人得出以下观察结果:
(1)与正常供体相比,aHUS患者血浆(Ba和sC5b-9)和尿液(Ba)中的补体生物标志物升高;
(2)血浆Ba、尿液Ba/Cr和sC5b-9/Cr以及尿液胱抑素C/Cr的基线水平与基线时的肾功能(eGFR较低和蛋白尿升高)显著相关;
(3)补体生物标志物水平(尿液Ba/Cr和sC5b-9/Cr)随着C5抑制而显著下降,证明C5抑制对补体活性的早期药效作用;以及
(4)基线尿液sC5b-9水平与26周时的完全TMA应答显著相关。
测量补体生物标志物Ba和sC5b-9,特别是在尿液中测量,在CM-TMA/aHUS的诊断中具有效用,以及在监测对补体抑制剂治疗(用抗C5抗体例如依库珠单抗
该数据表明,测量血浆和尿液生物标志物蛋白可以产生补体介导的肾脏疾病(例如CM-TMA)以及对补体抑制剂疗法的应答的诊断、预后和/或预测特征。
实例3
非典型溶血性尿毒症综合征(aHUS)成人中补体介导的血栓性微血管病(CM-TMA)
的探索性诊断和预后生物标志物:雷夫利珠单抗3期研究分析
介绍
TMA是广义的临床术语,涵盖血小板减少症、微血管病性溶血性贫血和微血管血栓形成三联征的病症,通常会导致器官损伤/衰竭。CM-TMA是TMA障碍的子集,由存在或不存在补体基因突变和获得性自身抗体时的补体激活的产生所驱动。通常被认为是CM-TMA的原型形式的aHUS由替代补体途径过度激活引起的,导致末端补体过度激活。补体级联,包括分裂产物的产生。
尽管有关于CM-TMA/aHUS病理生理学的信息,但其差别性诊断和预后方面仍存在一些临床挑战。其中一个这样的挑战是缺乏可以定义这种异质性疾病群体的敏感的、特异的且经过临床验证的生物标志物。因此,需要继续探索新的基质、样品收集方案和生物分析方法,以鉴定和准确测量aHUS患者中的单个具有临床意义的生物标志物和/或其组合。鉴定aHUS患者的生物标志物“特征”可能有助于为其他形式的CM-TMA患者的诊断、治疗决策和治疗监测提供信息。
Cofiell等人的研究探索了补体抑制(通过抗补体C5单克隆抗体(mAb)依库珠单抗治疗)对aHUS患者的多种细胞过程(包括补体激活、炎症、内皮损伤、血栓形成和肾损伤)的标志物的药效作用。Cofiell等人Eculizumab reduces complement activation,inflammation,endothelial damage,thrombosis,and renal injury markers in aHUS[依库珠单抗减少aHUS中的补体激活、炎症、内皮损伤、血栓形成和肾损伤标志物].
研究发现,在使用依库珠单抗治疗后,与正常供体样品相比,这些过程的大多数血液和尿液标志物恢复到正常或接近正常水平。同前。相反,治疗后近端替代途径和内皮激活的标志物仍然部分升高,表明依库丽单抗作用机制上游的途径持续失调。同前。然而,生物标志物的效用并不是Cofiell等人研究的重点,这意味着需要对分析的蛋白作为aHUS/CM-TMA特异性生物标志物的效用进行更具体的评估。
方法
当前的分析使用了雷夫利珠单抗在aHUS成人中的3期临床研究数据,以探索补体激活、炎症和肾损伤的血液和尿液生物标志物在aHUS成人中的潜在诊断和预后效用。发明人评估了雷夫利珠单抗治疗26周和52周后生物标志物水平相对于基线的纵向变化。发明人在事后分析中回顾性评估了雷夫利珠单抗在aHUS成人中的3期研究的初始评估(26周)和延长期(52周)的数据。
目的生物标志物是血浆补体因子Ba、sC5b-9、血栓调节蛋白和D-二聚体;血清sTNF-RI和sVCAM-1;尿液因子Ba、sC5b-9和胱抑素C。在一天中随机时间和排尿量的探索性条件下进行点尿液收集。为了控制尿液收集中的这些变化,针对尿液肌酐浓度对尿液生物标志物进行归一化。使用碧迪公司(Becton-Dickinson)(BD)
将aHUS患者的基线血清、血浆和尿液生物标志物水平(在治疗开始前进行评估)与从正常供体样品中获得的生物标志物水平进行比较;正常血清和血浆样品来自瑞颂公司(Alexion)内部供体、BioIVT(韦斯特伯里,纽约,美国)和乐天生物科学公司(SanguineBiosciences)(沃尔瑟姆,马萨诸塞州美国),而正常尿液样品则来自瑞颂公司内部供体和乐天生物科学公司。
使用重复测量混合模型(MMRM)分析纵向生物标志物水平以及用雷夫利珠单抗治疗后相对于基线的水平变化,其中经对数转换的生物标志物水平作为因变量,并且就诊固定分类效应和经对数转换的基线水平的固定连续效应作为协变量。
还在血浆交换(PE)/血浆输注(PI)和基线透析状态的背景下评估了基线生物标志物。
通过基线生物标志物水平和基线临床测量之间以及基线生物标志物水平和治疗开始后26周和52周时临床测量变化之间的Spearman相关系数,评估基线生物标志物与TMA关键临床测量—血小板计数、乳酸脱氢酶(LDH)浓度、估计肾小球滤过率(eGFR)和尿蛋白/肌酐比率(UPCR)—的相关性。还进行了简单的线性回归分析,其中经对数转换的基线临床测量作为因变量,并且经对数转换的基线生物标志物水平作为自变量,以及临床变量相对于基线的26周和52周变化作为因变量,并且经对数转换的基线生物标志物水平作为自变量。对于与基线临床测量的关联,基线生物标志物每增加2倍,就会导致实验室值增加(或减少)两倍(提高到回归系数)。在评估26周和52周时与临床测量的变化的关联时,基线生物标志物每增加两倍,就会导致实验室值的变化按回归系数增加(或减少)。双侧t检验用于检验回归分析后的显著性。
基于基线生物标志物和第52周的生物标志物水平,对临床测量(例如,血小板计数、LDH、eGFR和UPCR)进行进一步的线性回归分析。因变量是临床测量中相对于基线的52周变化,自变量是经log(2)转换的基线生物标志物水平和经log(2)转换的给药后生物标志物水平。结果按第52周时的完全TMA应答状态(定义为:血小板计数正常化、LDH正常化以及血清肌酐相对于基线改善≥25%,同时在至少相隔4周的两次单独评估中满足)进行分层。
进行逻辑回归分析以评估基线时鉴定的生物标志物与完全TMA应答之间的关系。如果26周时的评估确认了完全TMA应答的终点,则患者将被纳入该分析组。对于逻辑回归分析,将临床应答设置为因变量,将基线生物标志物水平的对数设置为自变量。报告了优势比(OR)和95%置信区间(CI),其中OR代表基线生物标志物每增加两倍,实现功效应答的几率增加(或减少);通过Wald检验评估逻辑回归分析后的统计显著性。
将来自aHUS患者和正常供体的尿液和血浆中Ba和sC5b-9的基线水平输入CombiROC(CombiROC.eu上提供的在线工具),以生成接受者操作特征(ROC)曲线,用于分析敏感性和特异性。该网站由国家分子遗传学研究所(意大利米兰)的蛋白微阵列和生物信息学机构维护。
结果
基线人口统计特征
共有56名aHUS成人参加了这项临床试验,其中55名被纳入当前的生物标志物分析中;患者人口统计特征和疾病特征概述于表6。首次输注时的中值年龄为40.1岁,大多数为女性(66%)和白种人(52%)。
表6基线人口统计特征和疾病特征
/>
a
CF,补体因子;eGFR,估计肾小球滤过率;LDH,乳酸脱氢酶;TMA,血栓性微血管病;yr,岁
表转载自Rondeau E,等人Kidney Int[肾脏国际]2020;97:1287–96,根据知识共享CC-BY-NC-ND许可条款(Creative Commons CC-BY-NC-ND license)。
aHUS患者与正常供者之间的基线生物标志物水平比较
表7列出了aHUS成人和正常供体中的基线生物标志物水平的比较。与正常供体相比,aHUS患者的所有生物标志物均升高,但血浆sC5b-9和血清sVCAM-1除外。≥95%的患者中血浆和尿液中替代补体途径特异性生物标志物因子Ba升高。>85%的患者中尿液中末端补体途径特异性生物标志物sC5b-9升高。
表7 aHUS成人和正常供体中的基线生物标志物水平的比较
a
aHUS,非典型溶血性尿毒症综合征;Cr,肌酐
雷武珠单抗治疗后生物标志物相对于基线的纵向变化
在接受雷夫利珠单抗治疗的aHUS成人中,观察到血液和尿液生物标志物的药效学效应,包括与所有收集时间点的基线相比,肌酐归一化尿液sC5b-9和Ba水平显著降低(图5A-F和6A-C)。直到第127天,血清sTNF-R1和血浆D-二聚体水平也相对于基线水平显著降低(图5)。
基线生物标志物与治疗前血浆置换/血浆输注(PE/PI)和透析的关联
当评估基线生物标志物与治疗前PE/PI状态的任何关联时,首次输注雷夫利珠单抗的7天内接受PE/PI的患者与没有这么做的患者相比具有更低的血浆sC5b-9水平和更高的尿液Ba/肌酐水平(表8)。治疗开始后5天内接受透析的患者的血浆Ba、血清sTNF-R1和尿液Ba/肌酐显著高于未接受透析的患者(表9)。
/>
基线生物标志物与基线临床测量的关联
根据基线临床测量相对于基线生物标志物水平的简单回归分析(表10),血浆Ba、血浆血栓调节蛋白和血清sTNF-RI的增加均与较低的基线eGFR值显著相关。归一化尿液胱抑素C、sC5b-9和Ba也与较低的基线eGFR值相关。血浆Ba、血栓调节蛋白和D-二聚体、血清sTNF-RI和归一化尿液胱抑素C、sC5b-9和Ba的增加均与较高的基线UPCR值显著相关。未发现任何基线生物标志物水平与基线血小板计数之间存在显著关联。
/>
26周和52周时基线生物标志物与临床测量的变化的关联
使用针对基线生物标志物水平的简单回归对26周和52周时临床测量的变化进行分析,发现基线生物标志物水平与任一时间点的血小板计数变化之间没有显著关联(表11)。基线尿液sC5b-9/肌酐水平与26周时的LDH变化显著相关,但在52周时则不然(表12)。血浆Ba和D-二聚体、血清sTNF-R1和sVCAM-1以及尿液胱抑素C/肌酐和Ba/肌酐的增加与26周时eGFR相对于基线的变化显著负相关(表13)。
表11.26周和52周时基线生物标志物与血小板计数变化的比较
表12.26周和52周时基线生物标志物与乳酸脱氢酶变化的比较
/>
LDH,乳酸脱氢酶
表13 26周和52周时基线生物标志物与估计肾小球滤过率变化的比较
/>
eGFR,估计肾小球滤过率
52周时观察到相同的关系,此外还有与基线血浆血栓调节蛋白水平呈显著负相关(表13以及图7和8)。
基线生物标志物与26周和52周时完全TMA应答的关联
通过逻辑回归分析进行评估时,发现血清sVCAM-1、血浆血栓调节蛋白、血清sTNF-R1和血浆Ba水平的增加与实现完全TMA应答的较高可能性显著相关;对于归一化尿液SC5b-9,这种关联接近显著性。在治疗52周时观察到了相同的关联(图9)。>60%的患者实现了完全TMA应答,完全TMA应答的中值时间为86天(95%CI 42,401)。
基线生物标志物水平与完全TMA应答的关联
与无应答者相比,完全TMA应答者的血浆Ba和尿液sC5b-9、血浆血栓调节蛋白和血清sTNF-R1的基线水平显著降低(图9)。
选择的基线生物标志物水平的临床敏感性和特异性
对aHUS患者血浆和尿液中的基线Ba和sC5b-9水平相比于正常供体水平的CombiROC分析表明,当单独分析生物标志物时,两组之间存在一定程度的重叠(图10A)。当使用组合生物标志物分析时,这种效应消失,从而在尿液和血浆中实现了高特异性和选择性(图10B、C和D)。
对于单独曲线下面积值,尿液中的sC5b-9比血浆中的大得多(0.72相比于0.52),而对于Ba,其在血浆中更大(0.67相比于0.80)(图11A)。血浆sC5b-9出现中的假阳性(FP)和假阴性(FN)结果多于尿液sC5b-9(32FP,19FN相比于0FP,5FN);然而,尿液和血浆中Ba水平的分布非常相似,几乎没有假结果(图11B)。
讨论
在这项研究中,发现与替代和末端补体途径活性相关的生物标志物(分别为Ba和sC5b-9)与基线PE/PI和透析状态以及与肾功能相关的基线临床测量(即eGFR和UPCR)显著相关。基线血浆Ba和尿液sC5b-9水平均显示与52周时的完全TMA应答相关。根据分析介质(血浆相比于血清相比于尿液)并且对于尿液生物标志物,观察到这些生物标志物的效用存在差异,无论它们是否针对肌酐水平进行归一化。例如,血浆sC5b-9而不是尿液sC5b-9以及尿液Ba而不是血浆Ba与治疗开始7天内需要PE/PI的患者相关。由于血浆输注本质上会改变血液生物标志物水平,因此尿液有望成为这种情况下生物标志物测试的更可靠介质。然而,当针对肌酐水平进行归一化时,尿液Ba不再与PE/PI状态显著相关。此外,虽然尿液和血浆Ba均与治疗开始前5天内的透析状态显著相关,但只有尿液sC5b-9具有这种关联;当针对肌酐归一化时,尿液Ba而不是sC5b-9仍然与透析状态显著相关。
分析介质也与其他sC5b-9关联相关。在尿液中进行分析时,发现sC5b-9的基线水平比正常供体水平高得多。此外,基线尿液sC5b-9而不是血浆sC5b-9与52周时UPCR的变化显著相关;在52周的治疗过程中,尿液sC5b-9而不是血浆sC5b-9水平降低。这些观察结果以及我们对尿液相比于血浆中sC5b-9的ROC分析表明,尿液是更可靠的分析介质。
这项研究的结果表明,Ba和sC5b-9—特别是在尿液样品中分析时—显示出用作CM-TMAs生物标志物的潜力,这可以通过它们与选择的临床测量和结果的关联得到证明,同时与正常供体中观察到的最大水平相比,它们在aHUS成人中几乎普遍升高。图10进一步证明了它们在尿液中检测的可靠性,特别是以组合时。
点图(图10A)以图形方式描绘了aHUS相比于HV中Ba在sC5b-9水平的相对分布。AUC曲线(图10B)描绘了使用基于CombiROC网络的算法组合Ba和sC5b-9值时的组合敏感性/1-特异性,小提琴图(图10C)提供了aHUS和HV相对于真阳性/真阴性/假阳性/假阴性的最佳阈值截止的分布的可视化并且汇总表(图10D)提供了COmbiROC分析的实际值,这是图10C小提琴图的表格形式。补充部分中的CombiROC数据是单独的结果。因此,这一证据证实,在测量活性和鉴定补体介导的TMA患者方面,组合这2种补体特异性生物标志物在临床上比任何单独一种更敏感和特异,可以预测补体抑制剂疗法的临床益处。
该分析表明,这些生物标志物可能对CM-TMA疾病特定方面,特别是与肾功能相关的方面的诊断和预后有效用。
这项研究的结果支持使用sC5b-9(特别是尿液sC5b-9)作为aHUS的潜在生物标志物,并有一个将其用作肾功能(肾功能障碍)标志物的具体案例,如通过其与治疗期间UPCR变化的显著相关性来证明。此外,sC5b-9水平还与基线PE/PI需求(血浆sC5b-9)和透析状态(尿液sC5b-9)相关。
结论
该分析的结果强调了特别是在尿液中的一组关键的生物标志物,其在aHUS管理中具有潜在的诊断和预后效用。这些数据还证明了应答于抗补体C5疗法对生物标志物水平的药效学影响,以及它们用于预测治疗应答的效用,特别是Ba和sC5b-9。需要在更大的患者群体中进一步评估和验证这些生物标志物,以指导患者风险分层和管理决策。
本说明书中引用的所有参考文献均通过引用并入本文,就好像每个参考文献都具体且单独地表明通过引用并入一样。任何参考文献的引用都是出于其在申请日之前的披露,并且不应被解释为承认本披露由于在先发明而无权早于此参考文献。
应当理解,上述要素中的每一个或者两个或更多个元件也可以在与上述类型不同的其他类型的方法中找到有用的应用。无需进一步分析,前述内容将充分揭示本披露的要点,使得其他人可以通过应用现有知识,容易地使其适用于各种应用,而不省略从现有技术的观点来看清楚地构成所附权利要求中阐述的本披露的一般或特定方面的必要特征的特征。前述实施例仅以示例的方式呈现。
- 一种板材加工用自动上料机构
- 一种全自动三工位板材纵横开料锯
- 一种可自动升降挡屑条的数控开料机
- 一种家具板材加工用自动数控开料系统
- 一种家具板材加工用自动数控开料系统
