一种利用软骨细胞筛选有效治疗骨关节炎的间充质干细胞的方法及应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于细胞治疗技术领域,具体涉及一种利用软骨细胞筛选有效治疗骨关节炎的间充质干细胞的方法及应用。
背景技术
间充质干细胞(MSCs)具有多能性、自我更新能力、低免疫原性、免疫调节功能和损伤趋化性,多种组织含有间充质干细胞,例如羊膜、胎盘、脐带等。已证实人脐带衍生间充质干细胞(hUCMSCs)不仅具有MSCs的特征,而且还具有一些与胚胎干细胞相同的表型特征。脐带为胎儿与胎盘连接的纽带,内有两条管腔较小、管壁较厚的脐动脉和一条管腔较大、管壁较薄的脐静脉。脐血管周围有起保护作用的胚胎结缔组织,称为华通胶。脐带一般长约30~70cm,平均为50cm。脐带是母体与胎儿间进行气体交换、营养物质供应和代谢废物排出的重要通道。脐带在胎儿出生后即成为废弃品,从脐带组织中获取hUCMSCs是安全、无创和符合伦理的,这些优点使hUCMSCs成为再生医学和组织工程的有前途的种子细胞。
骨关节炎(osteoarthritis,OA)是一种常见的退行性关节疾病,主要特点是关节软骨的退行性改变、细胞外基质(软骨等)的减少、软骨下骨的改变和滑膜的炎症反应等,它的发病机制目前尚不清楚,其存在各种的诱发因素,包括高龄、肥胖、性别(女性高患病率)、关节创伤以及遗传易感性等。现有的治疗手段旨在减轻疼痛、缓解症状以及改善关节功能。软骨变性为本病特征性病理改变,也是OA最基本的病理改变。在软骨修复方面,最近的研究表明干细胞分泌的因子、外泌体可极大地增强软骨的修复能力并起到保护软骨的作用。
相较于正常骨关节组织液,OA患者骨关节组织液中存在较高含量的IL-1β,IL-1β是一类炎症因子,其水平与OA患者病情严重程度包括疼痛评分、僵硬度评分等显著正相关,在OA形成发展中发挥着关键作用。
根据中国食品药品检定研究院要求,hUCMSCs在制作注射液前需要分别进行鉴别实验、细菌、真菌和病毒检查等安全性检测,以及免疫反应作为有限性检测,但这些标准是基于MSCs整体来检测的,未针对hUCMSCs给出特异性的指标,对于hUCMSCs的安全性检测是足够的,但无法准确判断hUCMSCs的治疗疾病的有效性。
发明内容
有鉴于此,本发明的目的在于提供一种利用软骨细胞筛选有效治疗骨关节炎的间充质干细胞的方法,是以与人脐带间充质干细胞(hUCMSCs)培养上清共培养的炎症软骨细胞分泌的TNF-α含量为评估指标,表征人脐带间充质干细胞对炎症环境中软骨细胞的影响,从而建立一种快速有效地筛选方法。
本发明提供了一种利用软骨细胞筛选有效治疗骨关节炎的间充质干细胞的方法,包括以下步骤:
将炎症软骨细胞与间充质干细胞或间充质干细胞外泌体进行共培养,以共培养后的炎症软骨细胞分泌的TNF-α水平为标准判断间充质干细胞是否有效;
当共培养后的炎症软骨细胞分泌的TNF-α水平显著低于未经共培养的炎症软骨细胞,说明共培养的间充质干细胞有效治疗骨关节炎。
优选的,所述间充质干细胞包括以下至少一种:人脐带来源的间充质干细胞、人羊膜来源的间充质干细胞和人胎盘来源的间充质干细胞。
优选的,所述炎症软骨细胞是利用白介素-1β刺激正常人软骨细胞得到。
优选的,所述白介素-1β的浓度为10~20ng/ml。
优选的,所述白介素-1β的刺激时间为45~50h。
优选的,当所述炎症软骨细胞与间充质干细胞共培养时,所述炎症软骨细胞和间充质干细胞的数量比为(1~2):1。
优选的,当所述炎症软骨细胞与间充质干细胞外泌体共培养时,所述炎症软骨细胞在间充质干细胞外泌体溶液中的密度为(1.0~2.0)×10
优选的,检测炎症软骨细胞分泌的TNF-α水平的时间为共培养45~50h。
本发明提供了所述方法筛选得到的间充质干细胞在制备预防和/或治疗骨关节炎的药物中的应用。
本发明提供了一种利用软骨细胞筛选有效治疗骨关节炎的间充质干细胞的方法,包括以下步骤:将炎症软骨细胞与间充质干细胞或间充质干细胞外泌体进行共培养,以共培养后的炎症软骨细胞分泌的TNF-α水平为标准判断间充质干细胞是否有效;当共培养后的炎症软骨细胞分泌的TNF-α水平显著低于未经共培养的炎症软骨细胞,说明共培养的间充质干细胞有效治疗骨关节炎。本发明采用上述方法筛选得到有效治疗骨关节炎的间充质干细胞,再以构建的新西兰兔骨关节炎动物模型为对象,使用人脐带间充质干细胞(hUCMSCs)进行右后肢关节腔注射进行治疗,结果表明,本发明筛选的间充质干细胞与模型动物有效治疗结果一致。同时将不符合筛选标准的间充质干细胞用于模型动物的治疗,对西兰兔的骨关节炎无明显的治疗效果。这说明本发明的筛选方法在筛选治疗骨关节炎的间充质干细胞方面有效可靠。
附图说明
图1为不同批次的间充质干细胞的细胞形态图;
图2为Cell 1流式细胞分析图谱;
图3为Cell 2流式细胞分析图谱;
图4为Cell 3流式细胞分析图谱;
图5为Cell 1三系分化检测结果;
图6为Cell 2三系分化检测结果;
图7为Cell 3三系分化检测结果;
图8为Cell 1共培养的软骨细胞分泌TNF-α检测结果;
图9为Cell 2共培养的软骨细胞分泌TNF-α检测结果;
图10为Cell 3共培养的软骨细胞分泌TNF-α检测结果;
图11为共培养的软骨细胞分泌TNF-α检测结果。
具体实施方式
本发明提供了一种利用软骨细胞筛选有效治疗骨关节炎的间充质干细胞的方法,包括以下步骤:
将炎症软骨细胞与间充质干细胞或间充质干细胞外泌体进行共培养,以共培养后的炎症软骨细胞分泌的TNF-α水平为标准判断间充质干细胞是否有效;
当共培养后的炎症软骨细胞分泌的TNF-α水平显著低于未经共培养的炎症软骨细胞,说明共培养的间充质干细胞有效治疗骨关节炎。
在本发明中,所述间充质干细胞优选包括以下至少一种:人脐带来源的间充质干细胞、人羊膜来源的间充质干细胞和人胎盘来源的间充质干细胞。在本发明实施例中,对不同批次的人脐带来源的间充质干细胞进行筛选,筛选的间充质干细胞对新西兰兔的骨关节炎有较好的治疗效果,说明本发明的筛选方法成立。
在本发明中,所述炎症软骨细胞优选是利用白介素-1β刺激正常人软骨细胞得到。所述白介素-1β的浓度优选为10~20ng/ml,更优选为15ng/ml。所述白介素-1β的刺激时间优选为45~50h,更优选为48h。
在本发明中,当所述炎症软骨细胞与间充质干细胞共培养时,所述炎症软骨细胞和间充质干细胞的数量比优选为(1~2):1,更优选为1:1。本发明对所述间充质干细胞外泌体的制备方法没有特殊限制,采用本领域所熟知的制备方法即可,例如将间充质干细胞培养3天,2500rpm离心10min,收集上清。当所述炎症软骨细胞与间充质干细胞外泌体共培养时,所述炎症软骨细胞在间充质干细胞外泌体溶液中的密度优选为(1.0~2.0)×10
在本发明中,还优选包括将筛选的间充质干细胞注射入新西兰兔骨关节炎动物模型中进行验证,结果本发明筛选的间充质干细胞对新西兰兔的骨关节炎有较好的治疗效果。
本发明提供了所述方法筛选得到的间充质干细胞在制备预防和/或治疗骨关节炎的药物中的应用。
下面结合实施例对本发明提供的一种利用软骨细胞筛选有效治疗骨关节炎的间充质干细胞的方法及应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
根据中国食品药品检定研究院的要求,MSCs的质量控制检测方法
1.细胞形态及活率检测:
试验使用显微镜观察显微镜观察,使用细胞计数仪进行活细胞计数、细胞活率和细胞直径。
1.1细胞形态检测:从种子库随机取四支人脐带来源的间充质干细胞冻存管(Cell1、Cell2、Cell3、Cell4)置37℃恒温水浴箱中浸泡2min复苏,将冻存管内容物全部转移到15ml离心管,向里加入4ml MSC-T4完全培养基重悬,300g离心5min,去上清液,再加5mlD-PBS缓冲液,300g离心5min,去上清液,最后用1ml MSC-T4完全培养基重悬,取备用细胞1×10
1.2细胞活率检测:从种子库取一支冻存管置37℃恒温水浴箱中浸泡2min复苏,混匀。打开计数仪:按下计数仪上的ON/OFF按钮,指纹处亮蓝色表示仪器已打开。从混匀的细胞悬液中吸取30μl。吸取0.2%台盼蓝染色液30μl,与细胞悬液充分混匀。用移液枪吸取混匀后的细胞悬液加入样品板,每槽20μl,共两个槽。选择“台盼蓝计数”。插入计数板。自动计算计数结果。
采用显微镜观察法检测细胞形态,结果见图1,体外扩增的人间充质干细胞应贴壁生长,呈纤维状、梭形,符合标准。
细胞活率检测结果见表1。
表1 Cell 1、Cell 2、Cell 3、Cell 4为三个不同批次细胞
2.细胞表面标志物检测:
试验使用流式细胞仪进行细胞表面标志物检测:取备用细胞,用MSC-T4完全培养基制备成5×10
结果见图2~图4和表2。表面标志物CD90、CD105、CD73、CD44的表达水平应大于等于95%,CD11b、CD19、CD34、CD45、HLA-DR的表达水平小于等于2%,符合标准。
表2三批次细胞表面标志物的表达情况
3.间充质干细胞(MSCs)的三系分化检测:
3.1成脂分化检测标准操作:准备24孔板和离心管,按照细胞计数标准操作规程进行计数后取2.0×10
成脂分化培养基配制:10%成脂分化因子补充剂(Adipogenesis supplement)+90%成脂分化培养基(Adipogenesis Differentiation Basal medium),充分混匀,4℃保存;待细胞汇合度达到70%~80%开始诱导,记为Day 0,弃去实验孔上清液,添加0.5mL成脂分化培养基至实验孔内,将24孔板转至37℃、5%CO
3.2成骨分化检测:准备24孔板和离心管,按照细胞计数标准操作规程进行计数后取细胞2.0×10
成骨分化培养基配制:10%Osteogenesis supplement+90%OsteogenesisDifferentiation Basal medium,充分混匀,4℃保存;待细胞汇合度达到60-70%开始诱导,记为Day0,弃去实验孔中上清液,添加0.5mL成骨分化培养基至实验孔内,将24孔板转至37℃、5%CO
3.3成软骨分化检测:准备24孔板和离心管,按照细胞计数标准操作规程进行计数后取干细胞2.0×10
成软骨分化培养基配制:10%Chondrogenesis supplement+90%ChondrogenesisDifferentiation Basal medium,充分混匀,4℃保存;待细胞汇合度达到60-70%开始诱导,记为Day0,弃去实验孔中上清液,添加0.5mL成软骨分化培养基至实验孔内,将24孔板转至37℃、5%CO
采用油红O染色法进行MSC成脂分化,采用茜素红染色法进行MSC成骨分化,采用阿利新蓝染色法进行MSC成软骨分化。结果见图5~图7。由上述诱导分化结果可知,三批MSC细胞均具有可向成脂、成骨、成软骨的分化能力,符合标准。
实施例2
根据中国食品药品检定研究院的要求,MSCs的常规有效性检测方法
1、淋巴细胞增殖抑制试验:
试验采用hUCMSCs与外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)共培养后,使用酶化学发光法(Cell ViabilityAssay)检测淋巴细胞增殖抑制率。化学发光法主要是依据化学检测体系中待测物浓度与体系的化学发光强度在一定条件下呈线性定量关系的原理,利用仪器对体系化学发光强度的检测,而确定待测物含量的一种痕量分析方法。Cell Viability Assay是通过定量存在的腺嘌呤核苷三磷酸(Adenosinetriphosphate,ATP)(它是新陈代谢活跃细胞存在的信号),测定培养物中活细胞数量的均质方法,将培养的第5代hUCMSCs消化、洗涤、计数后,接种至96孔培养板,置入37℃5%CO
结果见表3。
表3 Cell 1、Cell 2、Cell 3、Cell4的淋巴细胞增殖抑制结果
2、特定淋巴细胞亚群检测:
特定淋巴细胞亚群检测采用流式细胞仪技术进行检测。流式细胞仪是对细胞进行自动分析和分选的装置。它可以快速测量、存贮、显示悬浮在液体中的分散细胞的一系列重要的生物物理、生物化学方面的特征参量,并可以根据预选的参量范围把指定的细胞亚群从中分选出来。流式细胞仪技术是通过制备单细胞悬液,用特异性荧光染料标记的抗体进行染色,经染色后的待测细胞在一定气体压力下被压入流动室,在鞘液的包裹下细胞呈单行排列,依次通过检测区域,在激光束的照射下细胞会产生散射光和激发荧光;这两种信号会同时被光电倍增管接收。接收后可转换为电信号,通过模/数转换器,将连续的电信号转换为可被计算机识别的数字信号,进行分析,从而达到分选细胞亚群的功能;通过hUCMSCs与外周血单个核细胞共培养后,制备成单细胞悬液,使用淋巴细胞用试剂盒进行流式细胞仪技术检测,然后收集各组淋巴细胞用试剂盒检测Th1,Th17和Treg亚群的增殖抑制/促进率。
特定淋巴细胞亚群检测结果见表4。
Cell 1、Cell 2、Cell 3为三个不同批次细胞,cell4存在问题,未做淋巴细胞亚群检测。
表4 Cell 1、Cell 2、Cell 3淋巴细胞亚群分析结果
3、淋巴细胞分泌TNF-α抑制试验:
淋巴细胞分泌肿瘤坏死因子α(TumorNecrosis Factor-α,TNF-α)抑制试验采用酶联免疫吸附法检测淋巴细胞共培养后分泌的TNF-α含量。酶联免疫吸附法是把抗原--抗体的免疫反应与酶的催化反应相互结合而发展起来的一种综合性技术,它的灵敏度高,特异性强,因而是近年来病毒检测方法中发展最快、应用最广的一种方法。TNF-αELISA试剂盒是往预先包被人TNF-α捕获抗体的微孔中依次加入样品、不同浓度的标准品,经过孵育并彻底洗涤,加入辣根过氧化物酶(Horseradish Peroxidase,HRP)标记的检测抗体,用底物四甲基联苯胺(TetrUCethylbenzidine,TMB)显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样本中的TNF-α浓度呈正相关。用酶标仪在450nm波长处测吸光度(optical density,OD)值,用公式I计算出淋巴细胞分泌TNF-α的抑制率。
TNF-α抑制率=1-[OD(PBMC+MSC+PHA)-OD(PBMC+MSC)]/[OD(PBMC+PHA)-OD(PBMC)] 公式I。
淋巴细胞分泌TNF-α抑制结果见表5。Cell 1、Cell 2、Cell 3三批次细胞符合标准,而Cell 4批次细胞不符合标准。
表5 Cell 1、Cell 2、Cell 3不同批次细胞的分泌TNF-α抑制结果
实施例3
hUCMSCs体外药效学研究
一、人脐带间充质干细胞复苏及培养
(1)人脐带间充质干细胞复苏
从细胞库液氮罐中取出细胞,迅速置于37℃恒温水浴锅内轻轻摇晃至无明显冰晶为止。
(2)人脐带间充质干细胞培养
按照0.85×10
(3)人脐带间充质干细胞培养上清处理步骤
培养3天后,将培养瓶中的培养基取出,置于50ml离心管中,2500rpm,离心10min,取上清,即可得到人脐带间充质干细胞培养上清。
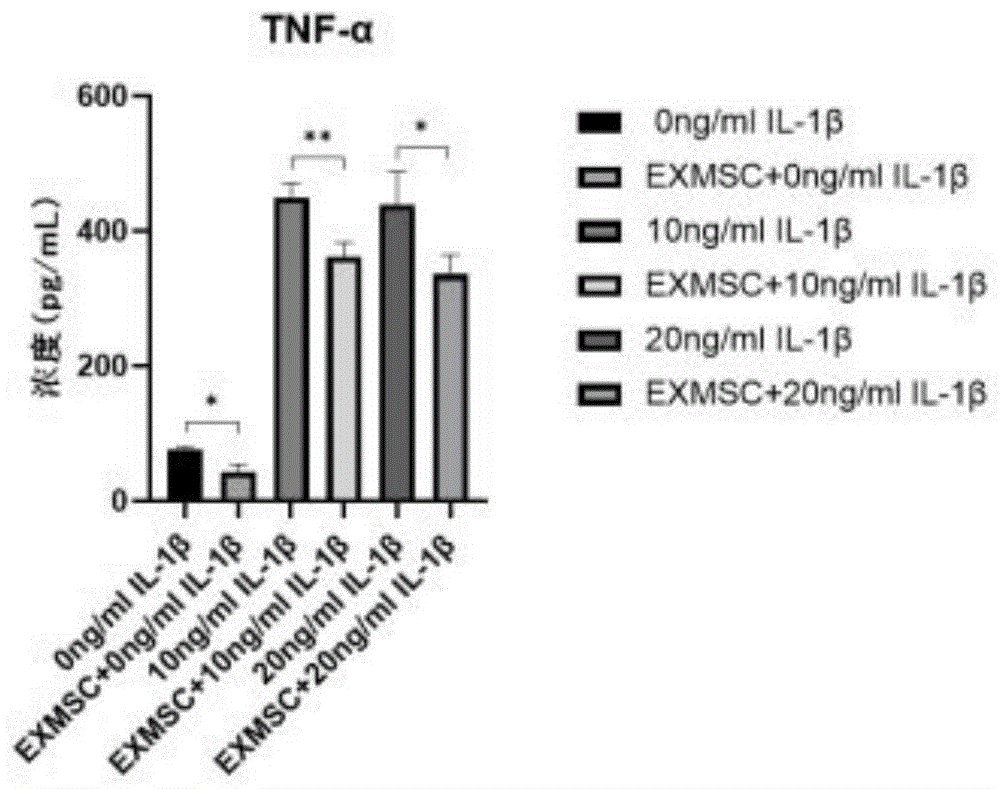
2.OA细胞模型制作
分别使用不同浓度的IL-1β(10ng/ml、20ng/ml)孵育48h建立人软骨细胞炎症模型。
3.试验分组如下:
对照组1:无IL-1β处理的人软骨细胞;
对照组2:人脐带间充质干细胞培养上清单独处理的人软骨细胞;
实验组1:10ng/ml IL-1β处理的人软骨细胞;
实验组2:10ng/ml IL-1β+人脐带间充质干细胞培养上清处理的人软骨细胞;
实验组3:20ng/ml IL-1β处理的人软骨细胞;
实验组4:20ng/ml IL-1β+人脐带间充质干细胞培养上清处理的人软骨细胞。
4.结果检测
按照试验分组,将炎症软骨细胞与人脐带间充质干细胞培养上清进行共培养,共培养48小时后取样,使用人TNF-αELISA检测试剂盒(人TNF-αELISA检测试剂盒,义翘神州,KIT10602)检测TNF-α含量。
hUCMSCs体外药效学研究结果
不同批次细胞共培养后对TNF-α表达释放量见表6~表9和图8~图11。与对照组相比,IL-1β处理的人软骨细胞中TNF-α表达释放量显著升高;而与单独IL-1β处理组相比,人脐带间充质干细胞培养上清+IL-1β共同处理的人软骨细胞中的TNF-α表达释放量降低。可见人脐带间充质干细胞可能通过分泌因子降低炎症环境下软骨细胞TNF-α的释放,抑制关节软骨细胞凋亡、软骨降解,降低骨关节炎症反应,有效改善骨关节炎症状。
表6Cell 1培养上清对IL-1β刺激下的人软骨细胞TNF-α表达释放量
表7Cell 2培养上清对IL-1β刺激下的人软骨细胞TNF-α表达释放量
表8Cell 3培养上清对IL-1β刺激下的人软骨细胞TNF-α表达释放量
表9Cell 4培养上清对IL-1β刺激下的人软骨细胞TNF-α表达释放量
实施例4
hAMMSCs动物药效实验
1.动物模型构建
造模时间:适应期第一天。
造模动物:新西兰兔。动物预编号从小到大的46只雌/雄性别动物。
造模方法:前交叉韧带切断法(bilateral anterior cruciate ligamenttransection(ACLT)),同时切断半月板建立兔膝关节骨关节炎模型。动物手术前给予麻醉(肌肉注射赛拉嗪(来源:吉林省华牧动物保健品有限公司,批号20211110,有效期至2023.10.31)1-2mg/kg和舒泰○R50(来源:法国维克有限公司,批号:8EZGA,有效期至2023.03.31)3-4mg/kg),手术后给与0.4mL/只的美洛昔康注射液和2.0mL/只得注射用头孢曲松钠。
造模位置:右后肢。
造模确认:选取36只动物进行造模。于造模28天后,从造模组动物中选取6只动物(动物预编号从大到小,雌雄各半)安乐死后观察关节腔造模效果。
造模成功评价标准:软骨微纤维化、糜烂和溃疡形成等关节炎特征形成。
2.试验分组
选取动物预编号从小到大的36只/性别动物进入造模组,于适应期第一天开始进行手术造模;造模28天后从造模组中选取造模成功的24只动物(雌雄各半),采用Provantis自带的分组模块,根据性别及体重进行随机分配到4组(组2~组5);采用Provantis自带的分组模块,从未造模的动物中随机选取6只动物(雌雄各半)分配到组1。分组后,动物体重均未超过同性别动物平均体重的±20%,每组同性别动物的平均体重,在5.0%的检验水准下,无统计学差异。分组后剩余动物归还动物管理部。
3.剂量设置及给药
本供试品为人源细胞制剂,临床拟关节腔注射给药,大鼠的起效剂量1×10
本试验剂量设计见下表10。
表10各处理组药物剂量一览表
右后肢关节腔注射。选择理由为与临床拟用途径一致。组3~组6:1次。
4.指标检测
一般观察、体重、摄食量、组织取材和病理学检查。
解剖时所有动物采集下列组织以及肉眼观察异常组织,另外取所有动物给药部位制白片,进行后续番红固绿染色实验。
表11软骨检测评价标准-Mankin评分
Mankin's评分
表12骨关节番红固绿染色评分(Mean±SEM)(n=6)
注:与造模溶媒对照组比较,*P≤0.05,**P≤0.01;n为动物数。
从软骨结构来看,Cell 2、Cell 3组软骨结构破坏程度较轻,Cell 1组与造模溶媒对照组相比有极显著性差异(P≤0.01),Cell 2、Cell 3组与造模溶媒对照组相比有显著性差异(P≤0.05);Cell 4组无显著性差异。
从软骨细胞来看,与空白对照组相比,Cell 1、Cell 2、Cell 3组软骨细胞数量变化较小,Cell 2、Cell 3组与造模溶媒对照组相比有极显著性差异(P≤0.01),Cell 1与造模溶媒对照组相比有显著性差异(P≤0.05);Cell 4组无显著性差异。而软骨基质染色和潮线完整性方面各组间没有显著性差异。
在本试验条件下,根据病理分析结果,Cell 1、Cell 2、Cell 3组的人脐带间充质干细胞注射液(1×10
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 用于机械钟表机芯的游丝外桩保持器
- 包括用于检测轮的角位置的检测装置的钟表机芯
- 包括用于检测轮的角位置的检测装置的钟表机芯
- 装配有电磁换能器的钟表机芯
- 钟表机芯的零件、钟表机芯、钟表以及制造这种钟表机芯零件的方法
- 钟表机芯的零件、钟表机芯、钟表以及制造这种钟表机芯零件的方法
