敲低METTL5基因的shRNA及其应用
文献发布时间:2024-04-18 20:01:55
技术领域
本发明涉及分子生物学与基因工程领域,涉及敲低METTL5基因的shRNA及其应用。
背景技术
肺癌是起源于肺部支气管黏膜或腺体的恶性肿瘤,目前位居全球肿瘤发病率第二和死亡率第一。肺癌根据生物学,治疗和预后分为两大类,小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。非小细胞肺癌(NSCLCs)占肺肿瘤的85%。超过20%的非小细胞肺癌(NSCLCs)在诊断时已是晚期,只进行局部治疗(手术或放疗)的患者总生存率较差,大多数死于远处转移。NSCLC患者生存率改善的原理尚未研究清楚且易产生耐药,原发性或继发性耐药最终会导致所有晚期疾病患者的治疗失败。因此研究治疗相关的新分子机制和靶点十分重要。
甲基转移酶样蛋白5(METTL5)是一种甲基转移酶,可以催化某些结构化rRNA上的m
发明内容
本发明的首要目的在于提供两种靶向敲低METTL5基因的shRNA。
本发明的另一目的在于提供所述一种靶向敲低METTL5基因的质粒系统的应用。
本发明的再一目的在于提供METTL5敲低的非小细胞肺癌细胞株。
本发明的再一目的在于提供一种敲低METTL5基因的方法在探究METTL5对非小细胞肺癌增殖影响中的应用,用以解决上述背景技术中提出的问题。
技术方案
一种shRNA在制备治疗非小细胞肺癌药物中的应用,其特征在于:
所述shRNA包括shMETTL5-1或shMETTL5-2,其中
shMETTL5-1包括如下序列:
shMETTL5-1 oligo1:
5'ACCGGGTCATTCGATACAGTAATTATCTCGAGATAATTACTGTATCGAATGACTTTTTTG3';
shMETTL5-1 oligo2:
5'CGAACAAAAAAGTCATTCGATACAGTAATTATCTCGAGATAATTACTGTATCGAATGACC3';
shMETTL5-2包括如下序列:
shMETTL5-2 oligo1:
5'ACCGGGCCAGCATCATACAAGTTTCACTCGAGTGAAACTTGTATGATGCTGGCTTTTTTG3';
shMETTL5-2 oligo2:
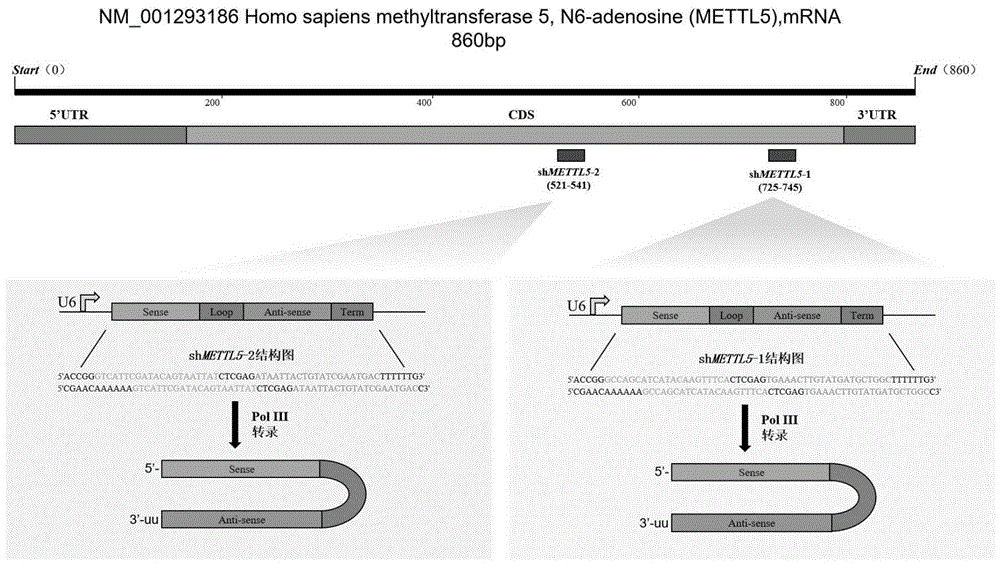
5'CGAACAAAAAAGCCAGCATCATACAAGTTTCACTCGAGTGAAACTTGTATGATGCTGGCC3'。进一步而言,所述的shRNA靶向敲低METTL5基因,shMETTL5-1或shMETTL5-2在细胞内转录后可形成发夹结构,如图1。
进一步,靶向敲低METTL5基因非小细胞肺癌细胞的构建方法,包括如下步骤:
S1:针对METTL5基因CDS区不同位置设计两对shRNA oligo,退火使两条oligo成双链;
S2:将pRSI9-U6-(sh)-UbiC-TagRFP-2A-Puro载体用BbsI酶切形成线性化载体。载体线状化酶切回收;
S3:将上述退火后的oligo和载体连接;
S4:转化涂板单克隆鉴定;
S5:包装空载体及敲低METTL5质粒的慢病毒;
S6:病毒感染人非小细胞肺癌细胞,在感染敲低病毒的非小细胞肺癌细胞株中加入嘌呤霉素,进行筛选,构建稳定转染细胞株,Westernblot检测METTL5的敲低效率。
S1-S4为shRNA质粒的构建过程,其通过短发夹RNA干扰METTL5的表达实现。
一种靶向敲低METTL5基因非小细胞肺癌细胞在制备作为药物筛选靶点或工具中的应用。
有益效果
与现有技术相比,本敲低METTL5基因的方法及其在探究METTL5对非小细胞肺癌增殖影响中的应用具有以下优点:
本发明设计的shRNA对非小细胞肺癌有抑制作用,其可以通过敲低人非小细胞肺癌细胞的METTL5基因实现。
本发明利用稳定敲低人METTL5基因的方法制备的质粒稳定转染人非小细胞肺癌细胞后,即可使人非小细胞肺癌细胞的METTL5基因敲低,因此本发明提供了METTL5敲低细胞或shRNA运用于研究METTL5对非小细胞肺癌细胞增殖的影响,提供一个非小细胞肺癌治疗的可能靶点或工具。
附图说明
图1为shMETTL5设计的模式图;
图2为慢病毒载体图谱;
图3测序结果,其中A为敲低METTL5质粒构建成功后质粒中shMETTL5-1对应片段的测序图;B为敲低METTL5质粒构建成功后质粒中shMETTL5-2对应片段的测序图;
图4为质粒转染后A549和H1299的对照组及METTL5敲低组METTL5蛋白表达;
图5质粒转染后CCK8检测检测结果,其中A为质粒转染后CCK8检测非小细胞肺癌A549的对照组及METTL5敲低组增殖能力;B为质粒转染后CCK8检测非小细胞肺癌H1299的对照组及METTL5敲低组增殖能力;
图6质粒转染后平皿单克隆检测检测结果,其中A为质粒转染后平皿单克隆检测非小细胞肺癌A549的对照组及METTL5敲低组增殖能力;B为质粒转染后平皿单克隆检测非小细胞肺癌H1299的对照组及METTL5敲低组增殖能力。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
1.shRNA质粒的构建
(1):根据METTL5序列的CDS区选择两段分别设计shRNA oligo,序列如下:
(2):磷酸化并退火shRNAoligos,具体体系如下:
PCR仪器退火程序:37℃30min,95℃维持2min,每分钟降低5℃至25℃;
(3):将pRSI9-U6-(sh)-UbiC-TagRFP-2A-Puro载体(如图2)用BbsI酶切,酶切体系如下:
室温酶切过夜,对载体酶切产物进行1%琼脂糖凝胶电泳,回收目的片段,加入1μLCip防止自连;
(4):将上述退火后的oligo和载体连接;
(5):将连接后的质粒转化至感受态细胞DH5α中,均匀涂至含氨苄抗性的LB固体培养基平板中,置于37℃培养箱中培养12-16小时,单个菌落即可出现。挑取单个菌落扩大培养并抽提质粒进行测序,测序结果如图3A和3B,质粒构建成功。
2.慢病毒包装与感染
(1)在HEK293TD细胞中瞬时转染,当HEK293TD细胞融合度到达70-80%时,以Exfect Transfection Reagent为转染试剂,以6cm培养皿的细胞量为例,共三组,分别为空载对照组,shMETTL5-1及shMETTL5-2。
(2)每组准备两个离心管,分别加入500μL和465μL无血清培养基,向其中含有500μL无血清培养基的离心管以质粒:Pspax:VSVG=8:4:1的比例加入总共5μg质粒,向另外一个离心管加入35μL Exfect Transfection Reagent,分别混匀。
(3)将含有质粒的液体加入到含有Exfect Transfection Reagent的离心管中混匀,静置20分钟后,将混合液滴入细胞培养皿中,轻微晃动混匀后放入培养箱。
(4)转染4h后加入血清使终浓度为10%,第二天换为20%血清的培养基,转染48h后收集敲低病毒。(5)收集敲低METTL5病毒后,用0.45μm的滤头过滤病毒后可使用。
(6)以A549及H1299为例,将非小细胞肺癌细胞分别预先铺在细胞培养板上按照过滤后的病毒和培养基1:1的比例加入到培养板中,以shMETTL5-1转染A549,以shMETTL5-2转染H1299。
(7)加入终浓度1μg/ml的polybrene促进病毒感染效率,感染24h后更换新鲜培养基。
3.蛋白质印迹法(Western blot)检测蛋白表达
(1)细胞总蛋白样品准备:收集细胞,1800rpm离心5min。弃去培养液,PBS清洗细胞沉淀2次。最后一次洗涤完成后,尽可能去除PBS,加入适量1×loding dye并充分混匀,100℃金属浴煮10min,使蛋白变性,于-20℃保存样品备用。
(2)蛋白电泳:根据检测蛋白分子量的大小,选择合适浓度的分离胶。取适量的蛋白样品加入SDS-PAGE胶胶孔中,上样量不低于20μg。80V恒压电泳,待样品进入分离胶使用120V恒压电泳。
(3)转膜:将凝胶中的蛋白通过电泳仪转到PVDF膜上。
(4)封闭:转膜结束后将PVDF膜放入提前加入封闭液的盒中,然后置于摇床上封闭60-90min。
(5)洗膜:封闭结束后,将封闭液弃去,加入1×TBST洗膜3次,每次8min。
(6)孵育一抗:将METTL5抗体按照1:1000用一抗稀释液稀释后加入含有膜的盒子中,置于4℃摇床过夜;洗膜3次。
(7)孵育二抗:将二抗稀释后加入至盒子中,直至膜被完全覆盖。二抗比例为1:5000;洗膜3次。
(8)ECL显色:将曝光A液和B液按照1:1混合,在凝胶成像系统中成像,如图4。敲低METTL5的A549及H1299与其对照组相比,METTL5蛋白表达量下降,说明构建慢病毒转染成功。
4.CCK8检测细胞增殖
(1)将稳定敲低METTL5及对照组的非小细胞肺癌细胞株A549、H1299培养至汇合度约80%,消化细胞并计数,按照1200个/孔的细胞数铺板,放入培养箱中37℃培养。
(2)按照1:10的比例将CCK8贮存液加入正常培养基中,稀释成工作液。检测时弃去原有培养基,加入100μL工作液,37℃培养1h后用酶标仪检测450nm处的吸光度。
(3)细胞贴壁4h后开始第一次检测,记为初始吸光度,此后每隔24h检测一次,连续检测96h。结果如图5A及5B,敲低METTL5的A549及H1299与其对照组相比,增殖速度明显下降,说明METTL5对非小细胞肺癌增殖具有促进作用。
5.平皿单克隆形成实验
(1)待培养稳定的shMETTL5及对照组的非小细胞肺癌细胞株A549、H1299生长至80%汇合度后,消化细胞并将其接种到6孔板中,每孔500个细胞,每三天换一次培养液,正常培养10-15天。
(2)弃去培养液,每孔用1mL PBS清洗3次。
(3)弃去PBS,每孔加入1mL 4%多聚甲醛,室温固定15min。
(4)弃去4%多聚甲醛,PBS洗涤3次,室温干燥。
(5)每孔加入1mL结晶紫,室温染色20-30min。
(6)PBS洗涤3次,室温干燥后进行拍照。如图6A及6B,敲低METTL5的A549及H1299与其对照组相比,克隆形成能力明显下降,说明METTL5对非小细胞肺癌克隆形成具有促进作用。
