针对猪链球菌的合成糖结合物疫苗原型
文献发布时间:2024-07-23 01:35:21
技术领域
本发明一般涉及预防与猪链球菌(Streptococcus suis,S.suis)相关的疾病。更具体地说,本发明涉及针对猪链球菌血清型2的疫苗。该疫苗包含化学合成的片段,因此可以在商业上广泛使用。该疫苗用于畜牧生产,并且可以调整用于针对猪链球菌的其他血清型(例如血清型1、1/2、3、9和14),以及可以用于人类。
背景技术
猪链球菌(S.suis)是主要的猪病原体,其在世界范围内发生并且造成重大经济损失。猪链球菌表达荚膜多糖(CPS)是定义血清型的主要细菌毒力因子。猪链球菌可以通过与病猪或受污染的猪肉制品密切接触传播给人类。猪链球菌可以导致猪和人类中的脑膜炎、败血症、心内膜炎、关节炎和感染性休克。猪的死亡率高。目前,市场上尚无预防猪中的猪链球菌相关疾病的有效疫苗。到目前为止,自体疫苗在该领域的使用是令人失望的。
自体疫苗由在受影响农场回收的主要菌株中杀死的细菌(“细菌疫苗(bacterin)”)组成,其由获得许可的实验室制备并且返回仅同一农场。因此,这些疫苗是“农场特异的”。很少有实验研究表明,“实验室制造的”细菌疫苗在与强效佐剂结合时可能是有效的。然而,已经证明这些组合是高度反应性的。由此产生的副作用使此类组合在商业上不可取。
根据加拿大猪健康信息网(Canadian Swine Health Information Network),猪链球菌相关疾病是加拿大养猪场报告的最常见的传染病。此外,在2018年末咨询了养猪从业者、行业以及专业细菌学家和诊断医生后,美国猪健康信息中心(Swine HealthInformation Center,SHIC)的监测和分析工作组(Monitoring and Analysis WorkingGroup)审查并且建立了现在的猪细菌性疾病矩阵(Swine Bacteria Disease Matrix)的最终排名。正如其网站上所述,猪链球菌是列表上最重要的细菌性猪病原体(https://www.swinehealth.org/swine-bacterial-disease-matrix/)。
由于抗菌剂的广泛和常规的预防和补救性预防(metaphylactic)用途,该病的发病率可以高达20%,尽管其在该领域通常保持低于5%。
在畜牧业生产中减少抗菌剂的使用是非常可取的。猪链球菌疾病的预防必须着重于对易感染因素(例如接种疫苗)的管理。
先前的猪链球菌疫苗工作着重于细菌疫苗、亚单位(主要是基于蛋白质的)疫苗或减毒活细菌培养物的评估。例如,WO 2017/062558A1[1]评估了通过传统方法制备的细菌CPS结合疫苗。该方法使用天然CPS的解聚部分(从细菌培养物中纯化)并且使用还原胺化技术与破伤风类毒素偶联作为载体。该方法是复杂的。此外,该方法还呈现出高的批次间可变性、产品表征困难,并且需要病原体处理(II级)以产生CPS。
发明人还知晓Zhang等人的文献[2],该文献公开了类似于猪链球菌血清型2、3、9和14的CPS的寡糖抗原。
需要针对猪链球菌感染的有效疫苗。猪生产者和兽医都需要能够通过商业途径获得的此类疫苗。此外,需要这种可以适用于人类的疫苗。
发明内容
发明人设计并且制备了合成糖结合物疫苗,其包含血清型2的荚膜多糖(CPS)片段。该片段选自于根据本发明的片段,其具有不同的尺寸并且代表血清型2的CPS的不同抗原表位。这些片段(化合物)的制备包括化学和化学酶法。
已知,CPS由线性核(主链)组成,其具有两个不同的侧链基序进行官能化。在本发明的实施例中,片段包含仅线性核。在其它实施例中,片段包含仅两个侧链基序中的一个。在又一实施例中,片段包含核和两个侧链基序中的一个的组合。在又一实施例中,片段包含核和两个侧链基序的组合。在又一实施例中,含有线性核的根据本发明的片段可以包含其1至3个或更多个重复单元。
在本发明的实施例中,每个片段与载体蛋白偶联。例如,制备CRM197和BSA偶联物。正如技术人员所理解的那样,也可以使用其它合适的载体蛋白。这些蛋白质包括例如来自猪链球菌的蛋白质。
在本发明的又一实施例中,使用佐剂制备疫苗制剂。例如,TiterMax
在又一实施例中,疫苗可以适用于针对猪链球菌的其它血清型,包括血清型1、1/2、3、9和14。此外,该疫苗可以适用于人类。
在又一实施例中,使用如Zhang等人[2]文献中描述的附加片段制备疫苗。
因此,本发明根据其方面提供以下:
(1)选自由以下组成的组的通式的化合物:以下A0、B0、C0、D0、E0和F0
其中:
A0至D0中的x是选自1至6的整数;优选地,x是选自1至3的整数;和化合物中连续的糖部分之间的连接物是α或β。
(2)选自由以下组成的组的通式的化合物:以下A、B、C、D、E和F
其中A至D中的x是选自1至6的整数;优选地,x是选自1至3的整数。
(3)选自由以下组成的组的通式的化合物:以下A01、B01、C01、D01、E01和F01
其中:
A01至D01中的x是选自1至6的整数;优选地,x是选自1至3的整数;
化合物中连续的糖部分之间的连接物是α或β;
L是C1至C12直链、支链或环状烷基;优选地,L是直链烷基;和
R
(4)选自由以下组成的组的通式的化合物:以下A1、B1、C1、D1、E1和F1
其中:
A1至D1中的x是选自1至6的整数;优选地,x是选自1至3的整数;
L是C1至C12直链、支链或环状烷基;优选地,L是直链烷基;和
R
(5)选自由以下组成的组的通式的化合物:以下A02、B02、C02、D02、E02和F02
其中:
A02至D02中的x是选自1至6的整数;优选地,x是选自1至3的整数;
化合物中连续的糖部分之间的连接物是α或β;
L是C1至C12直链、支链或环状烷基;优选地,L是直链烷基;和
R
(6)选自由以下组成的组的通式的化合物:以下A2、B2、C2、D2、E2和F2
其中:
A2至D2中的x是选自1至6的整数;优选地,x是选自1至3的整数;和L是C1至C12直链、支链或环状烷基;优选地,L是直链烷基。
(7)选自由以下组成的组的通式的化合物:以下1、4、7和10至14
8.选自由以下组成的组的通式的化合物:以下15、16、17和18至22
(9)根据上述(1)至(8)中任一项的化合物,其通过包括以下的方法制备:化学合成、化学酶合成、或化学合成和化学酶合成两者的组合。
(10)糖结合物疫苗,其包含上述(1)至(8)中任一项所定义的化合物,其中该化合物与载体蛋白偶联;优选地,载体蛋白为CRM-197、BSA、来自猪链球菌(S.suis)的蛋白或另一合适的载体蛋白。
(11)疫苗制剂,其包含上述(1)至(8)项中任一项所定义的化合物和佐剂;优选地,佐剂是TiterMax
(12)疫苗制剂,其包含上述(10)中所定义的糖结合物疫苗和佐剂;优选地,佐剂是TiterMax
(13)根据上述(11)或(12)的疫苗制剂,其是商业上能够获得的。
(14)根据上述(11)至(13)中任一项的疫苗制剂,其用于畜牧生产。
(15)用于制备上述(10)中所定义的糖结合物疫苗或上述(11)至(13)中任一项所定义的疫苗制剂的方法,包括:化学合成、化学酶合成、或化学合成和化学酶合成两者的组合。
(16)预防在哺乳动物中与猪链球菌(S.suis)相关的疾病的方法,该方法包括向哺乳动物给予上述(1)至(8)中任一项定义的化合物、上述(10)中定义的糖结合物疫苗或上述(11)至(13)中任一项定义的疫苗制剂;优选地,该疾病与选自由血清型1、1/2、2、3、9和14组成的组的猪链球菌的血清型相关;更优选地,该疾病与猪链球菌的血清型2相关。
(17)上述(1)至(8)中任一项定义的化合物、上述(10)中定义的糖结合物疫苗或上述(11)至(13)中任一项定义的疫苗制剂在预防在哺乳动物中与猪链球菌(S.suis)相关的疾病的用途;优选地,该疾病与选自由血清型1、1/2、2、3、9和14组成的组的猪链球菌的血清型有关;更优选地,该疾病与猪链球菌的血清型2有关。
(18)上述(1)至(8)中任一项定义的化合物在制备用于预防在哺乳动物中与猪链球菌(S.suis)相关的疾病的疫苗中的用途;优选地,该疾病与选自由血清型1、1/2、2、3、9和14组成的组的猪链球菌的血清型有关;更优选地,该疾病与猪链球菌的血清型2有关。
(19)上述(1)至(8)中任一项定义的化合物、上述(10)中定义的糖结合物疫苗或上述(11)至(13)中任一项定义的疫苗制剂,其用于预防在哺乳动物中与猪链球菌(S.suis)相关的疾病;优选地,该疾病与选自由血清型1、1/2、2、3、9和14组成的组的猪链球菌的血清型有关;更优选地,该疾病与猪链球菌的血清型2有关。
(20)根据上述(16)至(19)中的任一项所述的使用的方法或用途或化合物,其中哺乳动物是人类或非人类。
本发明的其它目的、优点和特征在阅读以下对其具体实施例的非限制性描述时将变得更加明显,其具体实施例参考附图仅作为示例。
附图说明
专利或申请文档包含至少一张彩色附图。在提出请求并且支付必要费用后,该局将提供本专利或专利申请出版物的副本和彩色附图。
在附图中:
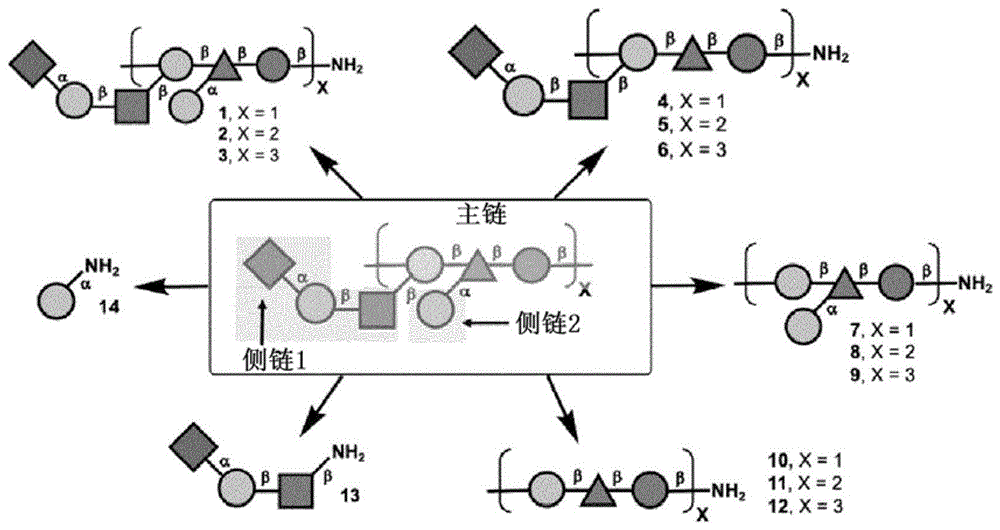
图1:根据本发明的荚膜多糖(CPS)片段(抗原)靶标示意图。单糖定义:蓝色圆圈=葡萄糖,绿色三角形=鼠李糖,黄色圆圈=半乳糖,蓝色方块=N-乙酰氨基葡萄糖,紫色菱形=唾液酸。
图2:猪链球菌血清型2CPS片段1、4、7和10至14。
图3:针对使用TiterMax Gold(1/1vol.)配制的25μg偶联物原型13和原型14免疫的小鼠的相应合成CPS表位的抗体反应。小鼠(每组n=10,绿色圆点)在第0天免疫,并且在第14天加强免疫。安慰剂组小鼠(n=5,黑色圆点)接受使用相同佐剂配制的磷酸盐缓冲盐水(PBS)。酶联免疫测定(ELISA)板涂覆有与牛血清白蛋白(BSA)载体蛋白偶联的相应合成原型,并且与血清样品一起孵育以测量抗合成的CPS表位抗体。示出了每只小鼠针对相应合成的CPS表位的总(IgG加IgM)抗体水平(一个圆点),其中横条表示滴度值的平均值(±SEM)。统计学意义如下:*,P<0.05;***,P<0.001;****,P<0.0001。
图4:针对使用TiterMax Gold(1/1vol.)配制的25μg偶联物原型7和原型10免疫的小鼠的相应合成CPS表位的抗体反应。小鼠(每组n=10,绿色圆点)在第0天免疫,并且在第14天加强免疫。安慰剂组小鼠(n=5,黑色圆点)接受使用相同佐剂配制的PBS。还包括空白小鼠(
图5:针对使用TiterMax Gold(1/1vol.)配制的25μg偶联物原型1和原型4免疫的小鼠的相应合成CPS表位的抗体反应。小鼠(每组n=10,绿色圆点)在第0天免疫,并且在第14天加强免疫。安慰剂组小鼠(n=5,黑色圆点)接受使用相同佐剂配制的PBS。还包括空白小鼠(n=5,白色圆点)。ELISA板涂覆有与BSA载体蛋白偶联的相应合成原型,并且与血清样品一起孵育以测量抗合成的CPS表位抗体。示出了每只小鼠针对相应合成的CPS表位的总(IgG加IgM)抗体水平(一个圆点),其中横条表示滴度值的平均值(±SEM)。统计学意义如下:**,P<0.01;***,P<0.001。D:表示“天”。
图6:针对使用TiterMax Gold(1/1vol.)配制的25μg偶联物原型13和原型14免疫的小鼠的天然纯化CPS(猪链球菌血清型2)的抗体反应。小鼠(每组n=10,绿色圆点)在第0天免疫,并且在第14天加强免疫。安慰剂组小鼠(n=5,黑色圆点)接受使用相同佐剂配制的PBS。ELISA板涂覆有天然(血清型2)CPS,并且与血清样品一起孵育以测量抗CPS抗体。示出了每只小鼠针对天然纯化CPS的总(IgG加IgM)抗体水平(一个圆点),其中横条表示滴度值的平均值(±SEM)。统计学意义如下:*,P<0.05;**,P<0.01。D:表示“天”。
图7:针对使用TiterMax Gold(1/1vol.)配制的25μg偶联物原型7和原型10免疫的小鼠的天然纯化CPS(猪链球菌血清型2)的抗体反应。小鼠(每组n=10)在第0天免疫,并且在第14天加强免疫。安慰剂组小鼠(n=5)接受使用相同佐剂配制的PBS。还包括空白小鼠(n=5)。ELISA板涂覆有天然(血清型2)CPS,并且与血清样品一起孵育以测量抗CPS抗体。示出了每只小鼠针对天然纯化CPS的总(IgG加IgM)抗体水平(一个圆点),其中横条表示滴度值的平均值(±SEM)。统计学意义如下:*,P<0.05;**,P<0.01。D:表示“天”。
图8:针对使用TiterMax Gold(1/1vol.)配制的25μg偶联物原型1和原型4免疫的小鼠的天然纯化CPS(猪链球菌血清型2)的抗体反应。小鼠(每组n=10)在第0天免疫,并且在第14天加强免疫。安慰剂组小鼠(n=5)接受使用相同佐剂配制的PBS。还包括空白小鼠(n=5)。ELISA板涂覆有天然(血清型2)CPS,并且与血清样品一起孵育以测量抗CPS抗体。示出了每只小鼠针对天然纯化CPS的总(IgG加IgM)抗体水平(一个圆点),其中横条表示滴度值的平均值(±SEM)。统计学意义如下::*,P<0.05;**,P<0.01;***,P<0.001。D:表示“天”。
图9:针对使用Montanide ISA 61VG配制的偶联物原型1、4、7、10、11或12免疫的猪的相应合成CPS表位的抗体反应。使用两个剂量进行免疫接种,每次间隔14天。将3周龄小猪分配到安慰剂组(n=10)或疫苗组(n=10)。第一剂疫苗和相应的安慰剂佐剂在三周龄时肌肉给予,第二剂在两周后肌肉给予。ELISA板涂覆有与BSA载体蛋白偶联的相应合成原型,并且与血清样品一起孵育(第25天)以测量抗合成的CPS表位抗体。示出了每只猪的总Ig(IgG+IgM)、IgM、IgG1和IgG2抗体水平(一个圆点),横条代表滴度值的平均值(±SEM)。统计显著性与安慰剂比较如下:*,P<0.05;**,P<0.01;***,P<0.001;****P<0.0001。
图10:接种了使用Montanide ISA 61Vg配制的偶联物1、4、7、10、11或12的小猪的临床评分。使用两个剂量进行免疫接种,每次间隔14天。将3周龄小猪分配到安慰剂组(n=10)或疫苗组(n=10)。第一剂疫苗和相应的安慰剂佐剂在三周龄时肌肉给予,第二剂在两周后肌肉给予。在第二剂疫苗后11天腹膜内进行6ml 1.6×10
图11:接种了使用Montanide ISA 61Vg配制的偶联物1、4、7、10、11或12的小猪的存活率。免疫接种分两次进行,每次间隔14天。将3周龄小猪分配到安慰剂组(n=10)或疫苗组(n=10)。第一剂疫苗和相应的安慰剂佐剂在三周龄时肌肉给予,第二剂在两周后肌肉给予。在第二剂疫苗后11天腹膜内进行6ml1.6×10
图12:Zhang等人[2]提出的使用“附加片段”并且偶联至CRM197的猪免疫接种。每隔14天使用两次剂量(使用Montanide ISA 61VG配制)进行免疫接种。将3周龄小猪分配到安慰剂组(n=15)或疫苗组(n=15)。第一剂疫苗和相应的安慰剂佐剂在三周龄时肌肉给予,第二剂在两周后肌肉给予。在第二剂疫苗后11天腹膜内进行6ml 1.6×10
具体实施方式
在对本发明作进一步描述之前,应当理解,本发明并不局限于下面描述的特定实施例,因为这些实施例的变体可以完成并且仍然属于所附权利要求的范围。还应理解,所采用的术语是为了描述特定实施例;并且不是旨在限制。取而代之的是,本发明的范围将由所附的权利要求书确定。
为了清晰且一致地理解本说明书中使用的术语,下面提供了一些定义。此外,除非另有定义,否则本文中使用的所有技术和科学术语具有与本公开所涉及的领域中普通技术人员通常理解的相同含义。
在权利要求书和/或说明书中与术语“包含(comprising)”结合使用时,使用“一个(a/an)”一词可能意味着“一个”,但它也与“一个或多个(one or more)”、“至少一个(atleast one)”和“一个或多个(one or more than one)”的含义一致。同样,“另一(another)”一词可以意味着至少第二个或更多个。
如本说明书和权利要求书中所用,“包含(comprising)”(以及任何形式的包含,例如“包含(comprise)”和“包含(comprises)”)、“具有(having)”(以及任何形式的具有,例如“具有(have)”和“具有(has)”)、“包括(including)”(以及任何形式的包括,例如“包括(include)”和“包括(includes)”)或“含有(containing)”(以及任何形式的含有,例如“含有(contain)”和“含有(contains)”)等词语是包容性的或开放式的,并且不排除其他未列举的元素或过程步骤。
术语“化合物(compound)”、“片段(fragment)”、“偶联物原型(conjugateprototype)”和“原型(prototype)”可互换使用,以指代根据本发明的化合物。
术语“猪(pig)”和“猪(swine)”在本说明书中可互换使用。
发明人设计并且制备了合成糖结合物疫苗,其包含血清型2的荚膜多糖(CPS)片段。该片段选自于根据本发明的片段,其具有不同的尺寸并且代表血清型2的CPS的不同抗原表位。该片段(化合物)的制备包括化学和化学酶法。
已知,CPS由线性核(主链)组成,其具有两个不同的侧链基序进行官能化。在本发明的实施例中,片段包含仅线性核。在其它实施例中,片段包含仅两个侧链基序中的一个。在又一实施例中,片段包含核和两个侧链基序中的一个的组合。在又一实施例中,片段包含核和两个侧链基序的组合。在又一实施例中,含有线性核的根据本发明的片段可以包含其1至3个或更多个重复单元。在又一实施例中,基于Zhang等人[2]的文献(特别是其片段编号4)合成了附加片段。
在本发明的实施例中,每个片段与载体蛋白偶联。例如,制备CRM197和BSA偶联物。正如技术人员所理解的,也可以使用其它合适的载体蛋白。这些蛋白质包括例如来自猪链球菌的蛋白质。
在本发明的又一实施例中,使用佐剂制备疫苗制剂。例如,TiterMax
在又一实施例中,疫苗可以适用于针对猪链球菌的其它血清型,包括血清型1、1/2、3、9和14。此外,该疫苗可以适用于人类。
下面对本发明的优选实施例进行描述。
示例1
通过合成化学制备结构上限定的猪链球菌荚膜多糖(CPS)片段
CPS片段(抗原)靶标的示意图表示如图1所示。选择尺寸范围从单糖到七糖的来自猪链球菌血清型2的8个CPS片段(1、4、7和10-14,图2)进行合成。制备了这八个化合物,其带有8-叠氮辛基(或8-氨基辛基)接头,以根据需要促进其与蛋白质的偶联,从而引发强烈的免疫反应。
1的合成。
方案1. 1.4、1.8和1.13的合成。缩写:Ac=乙酰基;AcOH=乙酸;Bn=苄基;
使用已知的硫代糖苷(thioglycoside)1.5开始合成1.8(方案1B)[4],其在与2-萘甲基溴和氢化钠反应并且随后水解异亚丙基缩酮时,得到90%的二醇1.6。在相转移条件下C-2羟基基团选择性地苄化[5],从而提供75%总产率的1.7。通过使用吡啶甲酸和1-乙基-3-(3-二甲氨基丙基)-碳二亚胺进行Steglich酯化反应,以90%的产率实现设置甲基吡啶。
先前报道的2,6-二甲基苯基硫代糖苷1.9[6]作为制备1.13(方案1C)的起始原料。使用甲醇钠除去乙酰基,并且使用苯甲醛二甲缩醛和樟脑磺酸处理所得产物,以80%的产率提供缩醛1.10。通过形成使用2-萘基甲基溴处理的中间亚甲基锡缩醛(stannylideneacetal),将1.10中的C-3羟基选择性地保护为萘甲基醚。在两个步骤中以67%的产率形成产物1.11。剩余羟基与乙酸酐和吡啶的乙酰化反应以90%的产率进行,以得到1.12。使用在水和二氯甲烷的混合物中的2,3-二氯-5,6-二氰基-1,4-苯醌处理后,裂解萘甲基醚以73%的产率提供1.13。
如方案2所示,这些单糖可以用于组装1.14、1.17和1.18三种二糖构建单元。如方案2A所示制备二糖1.14。在N-碘代丁二酰亚胺和三氟甲磺酸银的促进下,1.4与1.8的糖基化在-15℃下开始执行,并且升温至0℃。反应后分离二糖的α/β异构体是有问题的;因此,将混合物推进到下一步骤。因此,使用在二氯甲烷和甲醇中的醋酸铜处理中间体以裂解吡啶甲酸酯。在两个步骤中以50%的产率形成预期产物1.14。鼠李糖残基的
方案2. 1.14、1.17和1.18的合成。缩写:Ac=乙酰基;AcOH=乙酸;Bn=苄基;DMP=2,6-二甲基苯基;Et=乙基;Nap=2-萘甲基;NIS=N-碘代丁二酰亚胺;NPhth=邻苯二甲酰亚胺;Ph=苯基;Tf=三氟甲磺酰基(triflyl);TfOH=三氟甲基磺酸(triflic acid)。
方案2B示出了二糖1.17的合成。通过三氟甲基磺酸的介导,在0℃下使用已知的N-苯基三氟乙酰亚胺酯(N-phenyltrifluoroacetimidate)1.15对醇1.1进行糖基化反应[8],以70%总产率提供所需的产物1.16。通过酸水解(在乙酸/水中加热)裂解亚苄基缩醛,并且对产物二醇进行乙酰化,在两个步骤中得到了63%的产率的1.17。此外,1.16以54%的产率转化成二糖1.18,其用于合成抗原4(参见下文)。这是通过在以下两个步骤中将邻苯二甲酰亚胺基转化为N-乙酸酯衍生物来实现的:在回流下将在乙醇中的1.16与乙二胺一起加热,并且对产物进行乙酰化。
合成这些二糖后,如方案3所示,将其转化为七糖1。经过N-碘代丁二酰亚胺和三氟甲基磺酸处理后,将硫代糖苷1.19[9]用于对1.14进行糖基化。通过与在二氯甲烷和水中的2,3-二氯-5,6-二氰基-1,4-苯醌反应,对1.20中的萘甲基醚进行氧化裂解,以73%的产率得到1.21。随后,通过使用N-碘代丁二酰亚胺和三氟甲磺酸银处理,将该醇与硫代糖苷1.17进行糖基化,从而以50%的产率得到五糖1.22。在四氢呋喃和吡啶中使用氢氟酸处理,除去硅基缩醛(silyl acetal),然后通过两个步骤将邻苯二甲酰亚胺基转化为相应的N-乙酸酯衍生物:在回流下将在乙醇中的1.16与乙二胺一起加热,然后对产物进行乙酰化。经过从12.1开始的三个步骤得到49%的化合物1.23。此时,在两个步骤中移除保护基团。首先,通过在水和乙酸乙酯中的连二硫酸钠的存在下使用溴酸钾处理,氧化地裂解苄基醚[10]。然后,经由与在甲醇的甲醇钠反应,通过甲醇分解作用裂解酰基基团。以78%的产率获得脱保护的五糖1.24。
然后将化合物1.24用于连续糖基转移酶催化反应以设置最后两个碳水化合物残基。在这些反应的第一个中,使用HP0826半乳糖基转移酶加入半乳糖残基[11],其以83%的产率得到六糖1.25。半乳糖基转移酶所需的UDP-Gal供体是使用以下两种酶从半乳糖制备的:AtUSP和GalK[11]。使用突变唾液酸转移酶(A200Y/S232Y Pd2,6ST)[12]和CMP-唾液酸添加最终单糖残基。突变酶是必需的,因为使用野生型Pd2,6ST酶导致内部和末端半乳糖残基的显著唾液酸化。以95%的产率获得最终的七糖1。
方案3. 1的合成。缩写:Ac=乙酰基;AcOH=乙酸;AP=碱性磷酸酶;ATP=三磷酸腺苷;Bn=苄基;
4的合成。
方案4. 4的合成。缩写:Ac=乙酰基;AcOH=乙酸;AP=碱性磷酸酶;ATP=三磷酸腺苷;Bn=苄基;CMP=单磷酸胞苷;DDQ=2,3-二氯-5,6-二氰基-1,4-苯醌;DMAP=4-二甲氨基吡啶;EDC=1-乙基-3-(3-二甲氨基丙基)碳二亚胺;Et=乙基;DTT=二硫苏糖醇;IP=无机焦磷酸酶;Lev=乙酰丙酰基;Nap=2-萘甲基;NIS=N-碘代丁二酰亚胺;Ph=苯基;Sia=唾液酸;Tf=三氟甲磺酰基(triflyl);TfOH=三氟甲基磺酸;UTP=三磷酸尿苷。
7的合成。
方案5. 7的合成。缩写:Ac=乙酰基;AcOH=乙酸;Bn=苄基;tBu=叔丁基;NIS=N-碘代丁二酰亚胺;TfOH=三氟甲基磺酸;THF=四氢呋喃;Tol=4-甲苯基(4-甲基苯基)。
10的合成。二糖
方案6. 10的合成。缩写:Ac=乙酰基;AcOH=乙酸;Bn=苄基;DDQ=2,3-二氯-5,6-二氰-1,4-苯醌;Lev=乙酰丙酰基;Nap=2-萘甲基;TfOH=三氟甲基磺酸。
11的合成。
使用硫代糖苷1.8开始合成11.9(方案7B),将其在两个步骤中水解并且以92%的总产量转化为N-苯基三氟乙酰亚胺酯11.5,与制备11.4一样。然后用这种可激活的供体对已知醇11.6进行糖基化。[15]使用三氟甲基磺酸活化进行糖基化,并且立即用乙酸铜和水处理二糖产物以除去吡啶甲酯。这两步转化以73%的产率提供二糖醇11.7(鼠李糖残基的1J
方案7. 11.4和11.9的合成。缩写:Ac=乙酰基;Bn=苄基;Bz=苯甲酰基;DMAP=4-二甲氨基吡啶;EDC=1-乙基-3-(3-二甲氨基丙基)碳二亚胺;Et=乙基;Lev=乙酰丙酰基;Nap=2-萘甲基;NBS=N-溴代丁二酰亚胺;NIS=N-碘代丁二酰亚胺;Pico=甲基吡啶;PPTS=对甲苯磺酸吡啶盐;Tf=三氟甲磺酰基(triflyl);TfOH=三氟甲基磺酸;Tol=4-甲苯基(4-甲基苯基:TTBP=2,4,6-三叔丁基嘧啶。
11的合成如下面方案8所示。使用苯甲酰氯和吡啶对二糖1.14进行苯酰化,以99%的产率得到11.10。通过使用2,3-二氯-5,6-二氰基-1,4-苯醌和二氯甲烷中的水处理对萘甲基醚进行裂解,以80%的产率形成醇11.11。使用三氟甲基磺酸作为促进剂,使用N-苯基三氟乙酰亚胺酯11.4对11.11进行糖基化,以80%的产率得到三糖11.12,然后将其与水合肼反应裂解乙酰丙酸酯。以86%的产率得到产物醇11.13。使用二糖N-苯基三氟乙酰亚胺酯11.9对11.13进行糖基化,然后在β-蒎烯存在下使用2,3-二氯-5,6-二氰基-1,4-苯醌和水裂解萘甲基醚,在两个步骤中提供五糖11.14,产率为22%。这种转化中差的一步是糖基化,所有改进它的尝试都失败了。此外,该产物在糖基化后不能纯化,但可以在去除萘甲基后纯化。将β-蒎烯作为酸清除剂(acid scavenger)添加到萘甲基裂解反应中,以降低不需要的去苄基化程度[16]。通过三氟甲基磺酸的促进,使用11.4糖基化11.14得到六糖11.15,产率为60%。最后,将化合物脱保护并且还原叠氮化物,与7的合成一样。将11.15转化为11,在两个步骤中以92%的总产率进行。
方案8. 11的合成。缩写:Ac=乙酰基;AcOH=乙酸;Bn=苄基;Bz=苯甲酰基;DDQ=2,3-二氯-5,6-二氰-1,4-苯醌;Lev=乙酰丙酰基;Nap=2-萘甲基;TfOH=三氟甲基磺酸。
12的合成。
方案9. 12的合成。缩写:AcOH=乙酸;Bn=苄基;Bz=苯甲酰基;DDQ=2,3-二氯-5,6-二氰-1,4-苯醌;Lev=乙酰丙酰基;Nap=2-萘甲基;TfOH=三氟甲基磺酸。
13的合成。
方案10. 13的合成。缩写:AP=碱性磷酸酶;ATP=三磷酸腺苷;CMP=单磷酸胞苷;IP=无机焦磷酸酶;Sia=唾液酸;UTP=三磷酸尿苷。
14的合成。
方案11. 14的合成。缩写:
示例2
蛋白质偶联物(使用CRM197,白喉毒素的无毒突变体)
CRM197偶联物的制备。
方案12.抗原与CRM197的偶联。缩写:AcOH=乙酸;DTSSP=3,3'-二硫双(磺基琥珀酰亚胺丙酸酯);DTT=二硫苏糖醇;sulfoECMS=N-ε-马来酰亚胺基己酰-氧琥珀酰亚胺酯;PBS=磷酸盐缓冲盐水。
表1.用于CRM197和BSA偶联物合成的接头官能化抗原的制备。
表2.制备CRM197和BSA偶联物和抗原负载(来自MALDI-MS)。
BSA偶联物的制备。
方案13.抗原与BSA的偶联。缩写:AcOH=乙酸;
示例3
小鼠免疫接种
对于小鼠免疫接种,使用原型1、4、7、10、13和14。
疫苗制剂。
小鼠免疫接种和血清收集。
抗体滴定。
对于小鼠血清滴定,导致OD
进行实验,示出了针对相应合成CPS表位的总Ig(IgG+IgM)滴度;参见图3至5。进行了进一步的实验,示出了针对猪链球菌血清型2的天然纯化CPS的总Ig(IgG+IgM)滴度;参见图6至8。基于抗体反应,选择偶联物原型1、4、7和10用于在猪中进一步研究。
示例4
猪免疫接种
对于猪免疫接种,使用选定的原型:1、4、7、10、11和12。Zhang等人[2]文献中的“附加片段”也被用于猪中。
疫苗制剂。
猪免疫接种和血清收集。
猪攻击研究和临床评分。
抗体滴定。
进行了实验,其中ELISA结果示出了疫苗诱导的针对相应合成CPS表位的抗体滴度;参见图9、图10和图11概述了经免疫的猪的猪链球菌攻击后的临床数据。由不同片段诱导的抗体水平各不相同,但抗体同种型模式相似。片段4似乎由猪中天然存在的非特异性抗体识别(针对该片段的在安慰剂组中强烈的ELISA反应证明了这一点)。因此,该片段不适合作为候选疫苗。这一发现表明了不仅化学设计正确的表位的重要性,而且还需要对猪进行临床评估,以预测片段作为候选疫苗的真正价值。事实上,并非所有偶联的CPS片段都有效诱导保护(即减少与猪链球菌病相关的临床症状和/或降低死亡率水平)。事实上,“附加片段”诱导了大量抗体,但未能保护猪免受临床疾病的影响(图12)。因此,声称化合物是潜在的候选疫苗不应仅基于体外测试。根据动物(猪)研究,偶联物1、10和11显示出强烈到部分保护作用,因此是疫苗制剂的有希望的靶点。
在本发明的实施例中,提供以下通式化合物:A0、B0、C0、D0、E0、F0、A、B、C、D、E、F、A01、B01、C01、D01、E01、F01、A1、B1、C1、D1、E1、F1、A02、B02、C02、D02、E02和F02。这些通式中的每一个都如本文详细描述的那样。此外,在本发明的实施例中,提供了以下化学式的化合物:A2、B2、C2、D2、E2和F2。这些式中的每一个都如本文详细描述的那样。
在本发明的实施例中,化合物是通过包括化学合成和/或化学酶合成的方法制备的。
在本发明的实施例中,提供糖结合物疫苗,其包含根据本发明和如上所述的化合物。在其他实施例中,该化合物与载体蛋白偶联。在其他实施例中,载体蛋白是CRM 197、BSA或来自猪链球菌(S.suis)的蛋白质。根据需要,载体蛋白也可以是任何其他合适的载体蛋白。
在本发明的实施例中,提供疫苗制剂,其包含根据本发明的化合物和如上所述的化合物和佐剂。在其他实施例中,佐剂是TiterMax
在本发明的实施例中,提供疫苗制剂,其包含根据本发明和如上文所述的糖结合物疫苗和佐剂。在其他实施例中,佐剂是TiterMax
在本发明的实施例中,疫苗制剂是商业上能够获得的。
在本发明的实施例中,疫苗制剂用于畜牧生产。在其他实施例中,疫苗制剂用于猪(pig)生产。在其他实施例中,疫苗制剂用于猪(swine)生产。
在本发明的实施例中,提供了用于制备如上所述的糖结合物疫苗的方法。在其他实施例中,该方法包括化学合成和/或化学酶合成。
在本发明的实施例中,提供了预防哺乳动物中与猪链球菌(S.suis)相关的疾病的方法。该方法包括向哺乳动物给予如上所述的根据本发明的化合物、如上所述的根据本发明的糖结合物疫苗,或如上所述的根据本发明的疫苗制剂。在其他实施例中,该疾病与选自由血清型1、1/2、2、3、9和14组成的组的猪链球菌的血清型相关。在其它实施例中,该疾病与猪链球菌的血清型2相关。
在本发明的实施例中,提供了根据本发明和如上所述的化合物、根据本发明和如上所述的糖结合物疫苗,以及根据本发明和如上文所述的疫苗制剂中的每个在预防哺乳动物中与猪链球菌(S.suis)相关的疾病中的用途。在其他实施例中,该疾病与选自由血清型1、1/2、2、3、9和14组成的组的猪链球菌的血清型相关。在其它实施例中,该疾病与猪链球菌的血清型2相关。
在本发明的实施例中,提供了根据本发明和如上所述的化合物在制备用于预防哺乳动物中与猪链球菌(S.suis)相关的疾病的疫苗中的用途。在其他实施例中,该疾病与选自由血清型1、1/2、2、3、9和14组成的组的猪链球菌的血清型相关。在其他实施例中,该疾病与猪链球菌的血清型2相关。
在本发明的实施例中,提供了根据本发明和如上所述的化合物、根据本发明和如上所述的糖结合物疫苗,以及根据本发明和如上所述的疫苗制剂,其中每个用于在预防哺乳动物中与猪链球菌(S.suis)相关的疾病。在其他实施例中,该疾病与选自由血清型1、1/2、2、3、9和14组成的组的猪链球菌的血清型相关。在其他实施例中,该疾病与猪链球菌的血清型2相关。
在本发明的实施例中,哺乳动物是人类或非人类。
正如本领域技术人员所理解的,可以对如上所述的本发明的各种实施例进行其它变化和组合。
此外,正如本领域技术人员所理解的,在本发明的实施例中,任何化合物的OH基团都可以由SH基团取代。在本发明的其它实施例中,OH基团中的H可以由低级烷基(例如C1至C3烷基基团)取代。
权利要求的范围不应受示例中所示的优选实施例的限制;但应给予与说明书整体一致的最广泛的解释。
本说明涉及许多文献,其内容通过引用全部并入本文。
参考文献
1.WO 2017/062558A1.
2.Zhang S,Sella M,Sianturi J,Priegue P,Shen D,Seeberger PH.Discoveryof Oligosaccharide Antigens for Semi-Synthetic Glycoconjugate vaccine leadsagainst Streptococcus suis serotypes2,3,9and 14.Angew Chem Int Ed Engl.2021;60(26):14679-14692.doi:10.1002/anie.202103990.Epub 2021May 19.PMID:33852172;PMCID:PMC8252040.
3.Susaki,H.;Suzuki,K.;Ikeda,M.;Yamada,H.;Watanabe,H.K.,Synthesis ofArtificialGlycoconjugates of Arginine-Vasopressin and Their AntidiureticActivities,Chem.Pharm.Bull.1994,42,2090-2096.
4.Elsaidi,H.R.H.;Lowary,T.L.,Effect of phenolic glycolipids fromMycobacterium kansasii on proinflammatory cytokine release.A structure-activity relationship study,Chem.Sci.2015,6,3161-3172.
5.Deng,K.;Adams,M.M.;Gin,D.Y.,Synthesis and Structure Verification ofthe Vaccine Adjuvant QS-7-Api.Synthetic Access to Homogeneous Quillajasaponaria Immunostimulants,J.Am.Chem.Soc.2008,130,5860-5861.
6.Li,Z.;Gildersleeve,J.C.,Mechanistic Studies and Methods To PreventAglycon Transfer of Thioglycosides,J.Am.Chem.Soc.2006,128,11612-11619.
7.Bock,K.;Pedersen,C.,A study of
8.Sun,J.;Han,X.;Yu,B.,Synthesis of a typical N-acetylglucosamine-containing saponin,oleanolic acid 3-ylα-L-arabinopyranosyl-(1,2)-α-L-arabinopyranosyl-(1,6)-2-acetamido-2-deoxy-β-D-glucopyranoside,Carbohydr.Res.2003,338,827-833.
9.Lu,X.;Kovac,P.,Chemical Synthesis of the Galacturonic AcidContaining Pentasaccharide Antigen of the O-Specific Polysaccharide of Vibriocholerae O139 and Its Five Fragments,J.Org.Chem.2016,81,6374-6394.
10.Han,Z.;Chen,C.;Meng,C.;Gao,T.;Peng,P.;Chen,X.;Wang,F.;Cao,H.,Chemoenzymatic synthesis of tumor-associated antigen N3 minor octasaccharide,J.Carbohydr.Chem.2016,35,412-422.
11.Fang,J.-L.;Tsai,T.-W.;Liang,C.-Y.;Li,J.-Y.;Yu,C.-C.,EnzymaticSynthesis of Human Milk Fucosidesα1,2-Fucosyl para-Lacto-N-Hexaose and itsIsomeric Derivatives,Adv.Synth.Catal.2018,360,3213-3219.
12.Xu,Y.;Fan,Y.;Ye,J.;Wang,F.;Nie,Q.;Wang,L.;Wang,P.G.;Cao,H.;Cheng,J.,Successfully Engineering a Bacterial Sialyltransferase for Regioselectiveα2,6-sialylation,ACS Catal.2018,8,7222-7227.
13.Kondo,H.;Aoki,S.;Ichikawa,Y.;Halcomb,R.L.;Ritzen,H.;Wong,C.-H.,Glycosyl Phosphites as Glycosylation Reagents:Scope and Mechanism,J.Org.Chem.1994,59,864-877.
14.Zhang,Z.;Ollmann,I.;Ye,X.-S.;Wischnat,R.;Baasov,T.;Wong,C.-H.,Programmable one-pot oligosaccharide synthesis,J.Am.Chem.Soc.1999,121,734-753.
15.Xiong,C.;Feng,S.;Qiao,Y.;Guo,Z.;Gu,G.,Synthesis and ImmunologicalStudies of Oligosaccharides that Consist of the Repeating Unit ofStreptococcus pneumoniae Serotype 3 Capsular Polysaccharide,Chem.Eur.J.2018,24,8205-8216.
16.Lloyd,D.;Bylsma,M.;Bright,D.K.;Chen,X.;Bennett,C.S.,Mild Methodfor2-Naphthylmethyl Ether Protecting Group Removal Using a Combination of 2,3-Dichloro-5,6-dicyano-1,4-benzoquinone(DDQ)andβ-Pinene,J.Org.Chem.2017,82,3926-3934.
17.Liu,C.;Skogman,F.;Cai,Y.;Lowary,T.,Synthesis of the′primer-adaptor′trisaccharide moiety of Escherichia coli O8,O9,and O9alipopolysaccharide,Carbohydr.Res.2007,342,2818-2825.
18.Kelly,S.D.;Clarke,B.R.;Ovchinnikova,O.G.;Sweeney,R.P.;Williamson,M.L.;Lowary,T.L.;Whitfield,C.,Klebsiella pneumoniae O1 and O2ac antigensprovide prototypes for an unusual strategy for polysaccharide antigendiversification,J.Biol.Chem.2019,294,10863-10876.
19.Huang,Y.-L.;Hung,J.-T.;Cheung,S.K.;Lee,H.-Y.;Chu,K.-C.;Li,S.-T.;Lin,Y.-C.;Ren,C.-T.;Cheng,T.-J.;Hsu,T.-L.;Yu,A.L.;Wu,C.-Y.;Wong,C.-H.,Carbohydrate-based vaccines with a glycolipid adjuvant for breast cancer.Proc.Natl.Acad.Sci.U.S.A.2013,110,2517-2522.,Proc.Natl.Acad.Sci.U.S.A.2013,110,2517-2522.
20.Kamath,V.P.;Diedrich,P.;Hindsgaul,O.,Use of diethyl squarate forthe coupling of oligosaccharide amines to carrier proteins andcharacterization of the resulting neoglycoproteins by MALDI-TOF massspectrometry,Glycoconj.J.1996,13,315-319.
- 用于免疫受损人群的糖结合物疫苗
- 用于免疫受损人群的糖结合物疫苗
