一种酚类化合物ZKYY-041的应用和制备方法
文献发布时间:2023-06-19 09:30:39
技术领域
本发明涉及生物医药技术领域,具体涉及一种酚类化合物ZKYY-041的应用和制备方法。
背景技术
麻类植物是一种化学型复杂的植物,主要是因其自身含有许多天然化学成分。截至1980年,从麻类植物中分离出来的化合物共有432种,到1995年增加至483种,2005年增加至490种。麻属植物的生物活性是众所周知,随着受体的发现,存在探索麻类植物中药理活性化合物作为新治疗剂来源的机会。也存在越来越多的罹患诸如癌症等严重疾病寻求天然药物作为替代或补充疗法的患者,用于癌症或其它症状的新治疗存在持续需求。
不同的生活习惯和环境因素等原因导致癌症的发生率逐渐偏高,恶性肿瘤发现时以是晚期,一旦发现就很难治愈的疾病,目前癌症发病率高且很难治愈,所以对于麻类植物中活性成分的筛选具有很重要的意义。
发明内容
有鉴于此,本发明提供了一种酚类化合物ZKYY-041的应用,所述化合物具有具备良好的抗肿瘤细胞增值活性,其分子式为C
本发明提供了式I所示化合物在制备肿瘤细胞增殖抑制剂中的应用。
本发明还提供了一种肿瘤细胞增殖抑制剂药物,其特征在于,包括活性成分和药学上可接受的辅料,所述活性成分包括式I所示化合物。
本发明提供了式I所示化合物在制备用于治疗肿瘤疾病的药物中的应用。
本发明还提供了一种抗肿瘤药物,包括活性成分和药学上可接受的辅料,所述活性成分包括式I所示化合物。
优选地,上述肿瘤疾病为肝癌或肺癌。
优选地,上述药物包含有效剂量的式I所示化合物。
优选地,有效剂量为650ng/一次用量。
优选地,上述药物为口服制剂或注射制剂,所述口服制剂选自滴丸、片剂、胶囊剂、颗粒剂或口服液剂中的一种;所述注射制剂选自注射液或粉针剂。
本发明还提供了式I所示化合物的制备方法,包括如下步骤:
(1)对麻类植物花序依次进行二氧化碳超临界萃取、乙醇萃取,得到粗提物浸膏;
(2)将得到的粗提物浸膏溶解,依次通过正相硅胶柱色谱、大孔吸附树脂柱色谱、一级中压正相硅胶柱色谱、二级中压正相硅胶柱色谱、三级中压正相硅胶柱色谱、高压反相HPLC色谱进行分离,得到式I所示化合物。
优选地,上述制备方法包括以下特征中的任一项或多项:一、二氧化碳超临界萃取条件为P
本发明的有益效果是:本发明对麻类植物花序进行萃取,得到粗提物浸膏,然后对粗提物浸膏进行分离得到式I所示化合物,采用本发明方法制得的式I所示化合物纯度高,稳定性好,且具备良好的生物活性,且通过细胞实验发现,式I所示化合物具有较好的抗肿瘤细胞增殖活性,尤其在肝癌细胞和肺癌细胞中,抑制细胞增殖效果明显。
附图说明
图1显示为式I所示化合物对人肝癌细胞(HepG2)存活率的影响图;
图2显示为式I所示化合物对人肺癌细胞(A549)存活率的影响;
图3显示为式I所示化合物对人肝癌细胞(HepG2)存活率的影响;
图4显示为式I所示化合物对人肺癌细胞(A549)存活率的影响;
图5显示为式I所示化合物处理人肝癌细胞(HepG2)后的细胞集落显微镜图;
图6显示为式I所示化合物对人肝癌细胞(HepG2)集落形成的影响;
图7显示为式I所示化合物处理人肺癌细胞(A549)后的细胞集落显微镜图;
图8显示为式I所示化合物对人肺癌细胞(A549)集落形成的影响;
图9显示为式I所示化合物对人肝癌细胞(HepG2)迁移率的影响;
图10显示为式I所示化合物对人肺癌细胞(A549)迁移率的影响;
图11显示为式I所示化合物的
图12显示为式I所示化合物的
具体实施方式
为详细说明技术方案的技术内容、构造特征、所实现目的及效果,以下结合具体实施例并配合附图详予说明。
本发明提供了一种酚类化合物ZKYY-041的应用,所述化合物具有具备良好的抗肿瘤细胞增值活性,其分子式为C
实施例1
式I所示酚类化合物ZKYY-041的制备方法,包括如下步骤:
(1)以麻类植物花序为原料,干燥样品粉碎500g采用二氧化碳超临界萃取。萃取条件为:P
(2)取粗提物50g浸膏用石油醚充分溶解,使用常州三泰中压快速制备色谱仪进行正相硅胶柱层析,洗脱剂为正己烷/乙酸乙酯=98:2等梯度洗脱,洗脱至在线检测第六个峰的峰值低于100mAU,流速80mL/min,经薄层色谱分析,合并在线检测图谱的第六个峰,得含有目标化合物的一级组分。取7.8g一级组分进一步使用D101大孔吸附树脂柱层析分离,洗脱体系为30%-100%乙醇/水梯度洗脱,流速调至洗脱液成股流下。经薄层色谱分析,合并部分45%乙醇溶液洗脱部位,得含有目标化合物的二级组分。取1.62g二级组分再进一步使用中压正相硅胶柱层析分离,洗脱体系为二氯甲烷/乙酸乙酯系统梯度洗脱,洗脱至在线检测第八个峰的峰值低于50mAU,流速15mL/min。经薄层色谱分析,合并在线检测图谱的第一个峰,得含有目标化合物的三级组分,取0.732g三级组分再进一步使用中压正相硅胶柱层析分离,洗脱体系为正己烷/乙醚梯度洗脱,洗脱至在线检测第十四个峰的峰值低于30mAU,流速15mL/min。经薄层色谱分析,合并在线检测图谱的第八个峰,得含有目标化合物的四级组分,取0.216g四级组分再进一步采用中压正相硅胶层析分离,洗脱体系为正己烷/乙醚梯度洗脱,洗脱至在线检测第三个峰的峰值低于30mAU,流速15mL/min。经薄层色谱分析,合并在线检测图谱的第一个峰,得含有目标化合物的五级组分,取0.082g五级组分再进一步采用HPLC高压反相制备,洗脱体系为乙腈/水等梯度洗脱,目标化合物出峰时间为20.54min,检测波长为228nm,最终获得目标化合物63mg;
(3)目标化合物的结构解析,最终经过核磁共振谱图(图11-12)确定了数据氢谱、碳谱信息,通过氢谱、碳谱信息并结合相关文献资料Isolation and PharmacologicalEvaluation of Minor Cannabinoids from High-Potency Cannabis sativa,综合鉴定了该化合物的结构如式I所示,目标化合物的核磁共振氢谱和碳谱数据如下:
实施例2
式I所示酚类化合物ZKYY-041的抗肿瘤活性鉴定
药物:实施例1制备的式I所示酚类化合物ZKYY-041。
(1)MTT比色法检测式I所示化合物对肿瘤细胞存活性能的影响
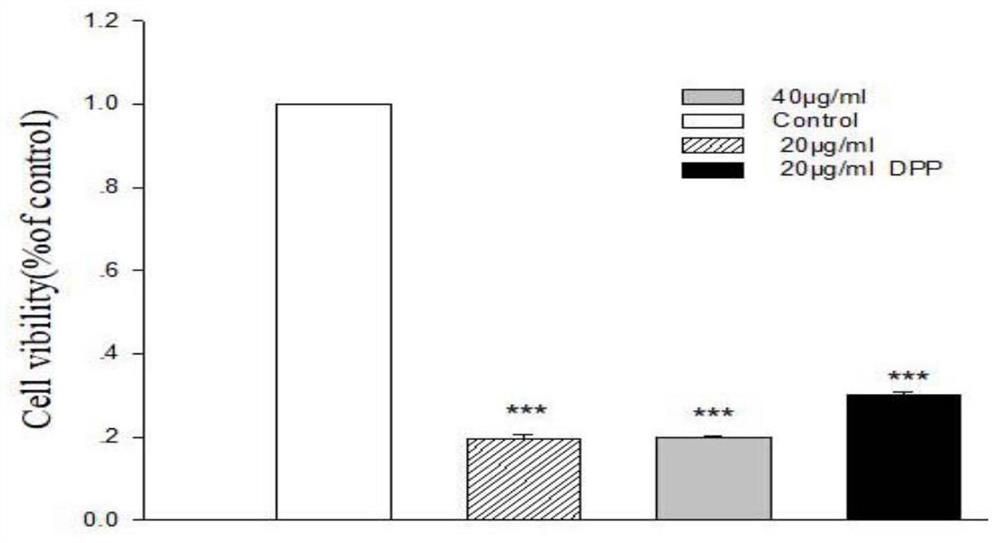
取对数生长期人肝癌细胞(HepG2),用DMEM培养基调整细胞浓度为每孔7000个,以每孔100μL接种于96孔板在培养箱中培养至细胞贴壁后,以100μL DMSO为溶剂分别配制浓度20ug/ml、40ug/ml的式I所示化合物溶液,实验组分别加入上述配制的浓度为20ug/ml、40ug/ml的式I所示化合物处理,空白组加入100μL DMSO,在培养基下作用24h;以剂量为20ug/ml的抗肿瘤药物顺铂(DDP)为对照,用MTT试剂检测细胞存活率,重复3次取平均值;
结果如图1所示,随着浓度的升高,人肝癌细胞(HepG2)的存活率越低,即式I所示化合物ZKYY-041对人肝癌细胞(HepG2)存活性能的抑制作用越强;当浓度为40ug/ml时,其抑制效果比剂量为20ug/ml的抗肿瘤药物顺铂(DDP)还强。
取对数生长期人肺癌细胞(A549),用DMEM培养基调整细胞浓度为每孔7000个,以每孔100μL培养基接种于96孔板在培养箱中培养至细胞贴壁后,以100μL DMSO为溶剂分别配制浓度20ug/ml、40ug/ml的式I所示化合物溶液,实验组分别加入上述配制的浓度为20ug/ml、40ug/ml的式I所示化合物处理,空白组加入100μL DMSO,在培养基下作用24h;以剂量为20ug/ml的抗肿瘤药物顺铂(DDP)为对照,用MTT试剂检测细胞存活率,重复3次取平均值;
结果如图2所示,随着浓度的升高,人肺癌细胞(A549)的存活率越低,即式I所示化合物ZKYY-041对人肺癌细胞(A549)存活性能的抑制作用越强;当浓度为40ug/ml时,其抑制效果比剂量为20ug/ml的抗肿瘤药物顺铂(DDP)还强。
(2)CKK8细胞增值毒性检测法检测式I所示化合物对肿瘤细胞存活性能的影响
取对数生长期人肝癌细胞(HepG2),用DMEM培养基调整细胞浓度为7000个,以每孔100μL DMEM培养基接种于96孔板在培养箱中,37℃培养箱中培养至细胞贴壁后,以100μLDMSO为溶剂分别配制浓度20ug/ml、40ug/ml的式I所示化合物溶液,实验组分别加入上述配制的浓度为20ug/ml、40ug/ml的式I所示化合物处理,空白组加入100μL DMSO,在培养基下作用24h;以剂量为20ug/ml的抗肿瘤药物顺铂(DDP)为对照,用CCK8试剂盒检测细胞存活率,重复3次取平均值;
结果如图3所示,随着浓度的升高,人肝癌细胞(HepG2)的存活率越低,即式I所示化合物对人肝癌细胞(HepG2)存活性能的抑制作用越强;当浓度为40ug/ml时,其抑制效果与剂量为20ug/ml的抗肿瘤药物顺铂(DDP)基本相当。
取对数生长期人肺癌细胞(A549),用DMEM培养基调整细胞为每孔7000个,以每孔100μL培养基接种于96孔板在培养箱中培养至细胞贴壁后,以100μL DMSO为溶剂分别配制浓度20ug/ml、40ug/ml的式I所示化合物溶液,实验组分别加入上述配制的浓度为20ug/ml、40ug/ml的式I所示化合物处理,空白组加入100μL DMSO,在培养基下作用24h;以剂量为20ug/ml的抗肿瘤药物顺铂(DDP)为对照,用CCK8试剂盒检测细胞存活率,重复3次取平均值;
结果如图4所示,随着浓度的升高,人肺癌细胞(A549)的存活率越低,即式I所示化合物对人肺癌细胞(A549)存活性能的抑制作用越强;当浓度为40ug/ml时,其抑制效果比剂量为20ug/ml的抗肿瘤药物顺铂(DDP)还强。
(3)细胞克隆集落形成法检测式I所示化合物对肿瘤细胞增殖性能的影响
取对数生长期人肝癌细胞(HepG2),消化成单个细胞接种于6孔板,每孔细胞350个,加入3ML DMEM培养基在培养箱中培养至贴壁,以100μL DMSO为溶剂分别配制浓度20ug/ml、40ug/ml的式I所示化合物溶液,实验组分别加入上述配制的浓度为20ug/ml、40ug/ml的式I所示化合物处理,空白组加入100μL DMSO,每2-3天更换新鲜的培养基和药物,持续培养一周,直到形成肉眼可见的克隆;经处理每孔加适量0.1%结晶紫染色,后用流水缓慢洗去染色液,空气中晾干,统计细胞的克隆数,显微镜下拍照(图5),计算细胞集落形成率。结果如图6所示,随着浓度的升高,人肝癌细胞(HepG2)的集落形成率越低,即式I所示化合物对人肝癌细胞(HepG2)增殖性能的抑制作用越强。
取对数生长期人肺癌细胞(A549),消化成单个细胞接种于6孔板,每孔细胞350个,加入3ML DMEM培养基在培养箱中培养至贴壁,以100μL DMSO为溶剂分别配制浓度20ug/ml、40ug/ml的式I所示化合物溶液,实验组分别加入上述配制的浓度为20ug/ml、40ug/ml的式I所示化合物处理,空白组加入100μL DMSO,每2-3天更换新鲜的培养基和药物,持续培养一周,直到形成肉眼可见的克隆;经处理每孔加适量0.1%结晶紫染色,后用流水缓慢洗去染色液,空气中晾干,统计细胞的克隆数,显微镜下拍照(图7),计算细胞集落形成率。结果如图8所示,随着浓度的升高,人肺癌细胞(A549)的集落形成率越低,即式I所示化合物对人肺癌细胞(A549)增殖性能的抑制作用越强。
(4)检测式I所示化合物对肿瘤细胞迁移性能的影响
取对数生长期肿瘤细胞分别为人肝癌细胞(HepG2),用DMEM培养基调整细胞浓度为每孔70000个/ML,以每孔2ML DMEM培养基(接种于12孔板中,培养至铺满孔板底,用无菌枪头培养孔自上而下画一条线;以100μL DMSO为溶剂分别配制浓度20ug/ml、40ug/ml的式I所示化合物溶液,实验组分别加入上述配制的浓度为20ug/ml、40ug/ml的式I所示化合物处理,空白组加入100μL DMSO,在0~24h内取不同的时间点观察并拍照,通过计算划痕区域内无细胞区的面积统计细胞迁移情况。
结果如图9所示,式I所示化合物可抑制人肝癌细胞(HepG2)的迁移能力,且随着浓度的升高,肿瘤细胞迁移率降低,呈现递减关系。
取对数生长期肿瘤细胞分别为人肺癌细胞(A549),用DMEM培养基调整细胞浓度为每孔70000个/ML,以每孔2ML DMEM培养基接种于12孔板中,培养至铺满孔板底,用无菌枪头培养孔自上而下画一条线;以100μL DMSO为溶剂分别配制浓度20ug/ml、40ug/ml的式I所示化合物溶液,实验组分别加入上述配制的浓度为20ug/ml、40ug/ml的式I所示化合物处理,空白组加入100μL DMSO,在0~24h内取不同的时间点观察并拍照,通过计算划痕区域内无细胞区的面积统计细胞迁移情况。
结果如图10所示,式I所示化合物可抑制人肺癌细胞(A549)的迁移能力,且随着浓度的升高,肿瘤细胞迁移率降低,呈现递减关系。
需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者终端设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者终端设备所固有的要素。在没有更多限制的情况下,由语句“包括……”或“包含……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者终端设备中还存在另外的要素。此外,在本文中,“大于”、“小于”、“超过”等理解为不包括本数;“以上”、“以下”、“以内”等理解为包括本数。
尽管已经对上述各实施例进行了描述,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例做出另外的变更和修改,所以以上所述仅为本发明的实施例,并非因此限制本发明的专利保护范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围之内。
- 一种酚类化合物ZKYY-041的应用和制备方法
- 一种酚类化合物ZKYY-041的应用和制备方法
