生物分子分析装置
文献发布时间:2023-06-19 10:22:47
技术领域
本发明涉及生物分子(生物聚合物)的分析用装置。
背景技术
在第二代DNA测序领域,不进行延伸反应、荧光标记,直接以电的方式对生物分子(以下称为“DNA”。)的碱基序列进行测定的方法备受瞩目。具体地,正在积极开展纳米孔DNA测序方式的研究开发。该方式是不使用试剂,直接测定DNA链、确定碱基序列的方式。
该纳米孔DNA测序方式中,通过测定使DNA链通过薄膜中形成的细孔(以下称为“纳米孔”。)而产生的封闭电流来测定碱基序列。即,封闭电流根据DNA链所含的各个碱基种类的不同而变化,因而可以通过测定封闭电流量依次对碱基种类进行鉴定。该方式中,不利用酶进行模板DNA的扩增,也不使用荧光体等标记物。因此,通量高,运行成本低,且能够读取长碱基的DNA。
纳米孔DNA测序方式中对DNA进行分析时使用的生物分子分析用设备一般具备充满电解质溶液的第1液槽和第2液槽、分割该第1液槽和第2液槽的薄膜、以及设于第1液槽和第2液槽中的第1电极和第2电极。生物分子分析用设备也可以以阵列设备形式构成。阵列设备是指具有多个被薄膜分割的液室组的设备。例如,将第1液槽设为公共槽,将第2液槽设为多个独立槽。这种情况下,在公共槽和独立槽中分别配置电极。
该构成中,在第1液槽与第2液槽之间施加电压,而且纳米孔中有与纳米孔径相对应的离子电流流过。此外,纳米孔中形成有与施加的电压相对应的电位梯度。如果将生物分子导入第1液槽,则根据扩散及其产生的电位梯度,生物分子经由纳米孔向第2液槽输送。此时,根据使纳米孔封闭的各核酸的封闭率,实施生物分子内的分析。需说明的是,生物分子分析装置具有测定设于生物分子分析用设备的电极之间流通的离子电流(封闭信号)的测定部,基于测得的离子电流(封闭信号)的值,获得生物分子的序列信息。
作为纳米孔DNA测序方式的一个课题,可列举通过纳米孔的DNA的输送控制。为了利用封闭电流量测定DNA链所含的各个碱基种类的不同,认为有必要根据测定时的电流噪音和DNA分子波动的时间常数,将DNA通过纳米孔的速度设为每个碱基100μs以上。但DNA通过纳米孔的速度通常快至每个碱基1μs以下,难以充分测定来源于各碱基的封闭电流。
作为输送控制方法中的一种,有利用在DNA聚合酶进行合成反应时、解旋酶拉开双链DNA中的单链时对成为模板的单链进行输送、控制的力,实现通过纳米孔的DNA的输送控制的方法(例如参照非专利文献1)。关于DNA聚合酶,对于作为模板的DNA而结合引物,使单链部通过纳米孔,聚合酶与引物末端结合而发生合成反应,因此,对抗电场对DNA的拉伸力,实现DNA的输送。此时,可以在测定部获得与碱基种类相对应的离子电流信号。
现有技术文献
非专利文献
非专利文献1:Gerald M Cherf等,自然-生物技术(Nat.Biotechnol.)2012
发明内容
发明所要解决的课题
另一方面,在该输送控制方法中,需要切实进行合成起始点的控制。聚合酶找到单链与双链的边界,使合成开始。这种情况下,需要仅在纳米孔附近实现合成、在离开纳米孔附近的电解质溶液(反应溶液)中不发生合成的构造。但在以往的装置中,存在利用聚合酶的合成会在离开纳米孔的电解质溶液中开始、无法切实地进行生物分子的分析的问题。
用于解决课题的方法
为了解决上述课题,本发明的生物分子分析装置的特征在于:具备具有纳米孔的薄膜、与所述薄膜相接触地配置且含有电解质溶液的液槽、与所述液槽相接触的电极、与所述电极连接的测定部、以及根据所述测定部的测定结果控制施加于所述电极的电压的控制部,所述电解质溶液中导入有生物分子,在所述生物分子的第1端部连接有控制链和分子马达,所述控制链在其上游与引物结合,在其下游具有间隔区。
此外,本发明的生物分子分析方法为对生物分子进行分析的生物分子分析方法,包括:将生物分子导入液槽的工序,所述生物分子在第1端部连接有在上游与引物结合且在其下游具有间隔区的控制链、以及分子马达,所述液槽与具有纳米孔的薄膜相接触地配置且含有电解质溶液;对所述液槽施加电压,将所述生物分子导入至所述纳米孔的工序;在导入至所述纳米孔的所述生物分子中,使所述引物与所述分子马达接触的工序;通过所述引物与所述分子马达接触后所述生物分子的合成反应将所述生物分子在所述纳米孔的内部输送的工序;以及测定所述输送期间流经所述纳米孔的电流的变化的工序。
发明效果
根据本发明,能够在进行生物分子的输送控制的同时,切实地进行合成起始点的控制。
附图说明
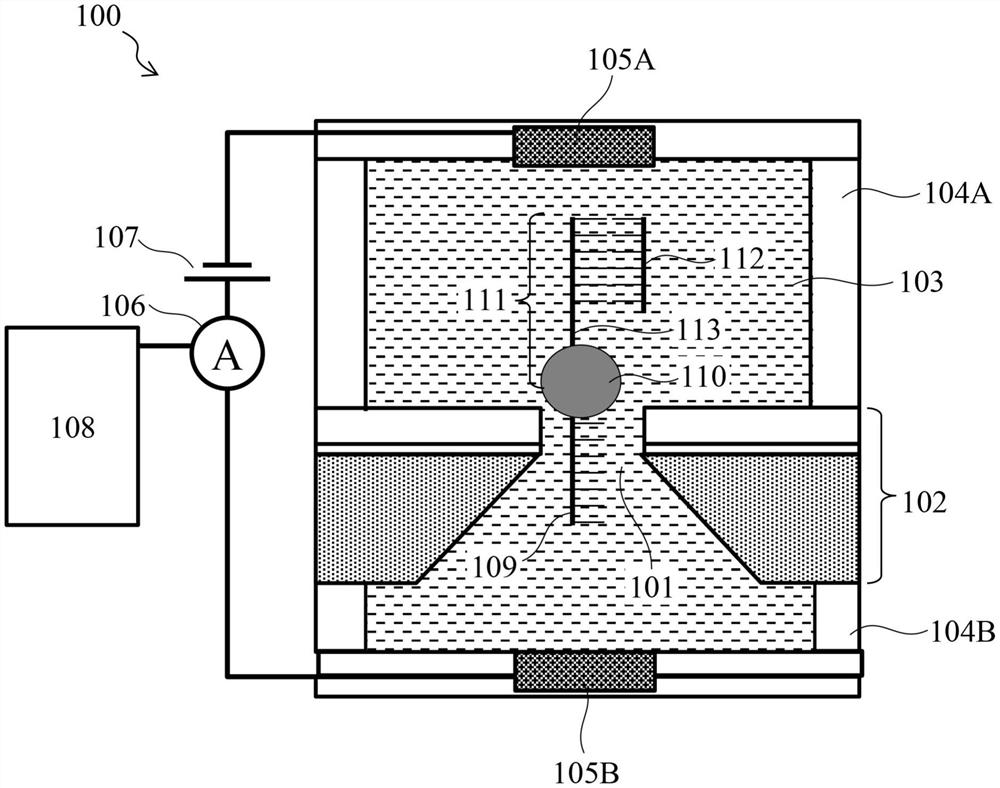
[图1]图1为对第1实施方式涉及的生物分子分析装置的构成的概要进行说明的概要图。
[图2]为对间隔区113的效果进行说明的概要图。
[图3A]为对控制链111和分子马达110的作用进行说明的概念图。
[图3B]为显示第1实施方式中生物分子109的测定步骤的流程图。
[图4]显示的是关于间隔区113的效果的实验结果。
[图5]显示的是关于分子马达110的效果的实验数据。
[图6]显示的是,对于作为成为模板的生物分子的仅由腺嘌呤(A)和胞嘧啶(C)进行逐个碱基重复(例如各50个)而形成的生物分子(模型样品序列)进行封闭电流测定的结果。
[图7]为对生物分子分析装置700的另一构成例进行说明的概要图。
[图8]为显示利用生物分子测定装置100和700进行的测定步骤的流程图。
[图9A]为对作为第2实施方式涉及的生物分子测定装置中的测定对象的生物分子109的结构进行说明的概要图。
[图9B]为对第2实施方式中的生物分子109的测定的概要进行说明的概要图。
[图9C]为对第2实施方式中的生物分子109的测定的概要进行说明的概要图。
[图10A]为对作为第3实施方式涉及的生物分子测定装置中的测定对象的生物分子109的结构进行说明的概要图。
[图10B]为对第3实施方式中的生物分子109的测定的概要进行说明的概要图。
[图10C]为对第3实施方式中的生物分子109的测定的概要进行说明的概要图。
[图10D]为对第3实施方式中的生物分子109的测定的概要进行说明的概要图。
[图11A]为对作为第4实施方式涉及的生物分子测定装置中的测定对象的生物分子109的结构进行说明的概要图。
[图11B]为对第4实施方式中的生物分子109的测定的概要进行说明的概要图。
[图11C]为对第4实施方式中的生物分子109的测定的概要进行说明的概要图。
[图12]为对第5实施方式中的生物分子109的测定的概要进行说明的概要图。
[图13]为显示第5实施方式中生物分子109的测定中的施加电压和信号的波形的时间图。
具体实施方式
以下,基于附图对本发明的实施方式进行说明。需说明的是,虽然所附的附图显示了符合本发明原理的具体实施例,但这些实施例是为了便于理解本发明而给出的,绝对不是为了用于对本发明进行限定性解释。
[第1实施方式]
图1中对第1实施方式涉及的生物分子分析装置的构成的概要进行说明。该装置是以封闭电流方式测定离子电流的生物分子分析用设备,具备形成有纳米孔101的薄膜102、以夹着薄膜102且与薄膜102接触的方式配置且在其内部充满电解质溶液103的一对液槽104(第1液槽104A和第2液槽104B)、以及分别与第1液槽104A和第2液槽104B相接触的一对电极105(第1电极105A和第2电极105B)。测定时,由电压源107在一对电极105之间施加预定的电压,使电流流经一对电极105之间。流经电极105之间的电流的大小用电流计106测定,其测定值用计算机108进行分析。
电解质溶液103例如可使用KCl、NaCl、LiCl、CsCl。在未导入后述分子马达的第2液槽104B中的溶液中,为了抑制生物分子自身互补链的形成,也可以混有4M以上的Urea、DMSO、DMF、NaOH。此外,为了生物分子的稳定化,也可以混有缓冲剂。作为缓冲剂,可使用Tris、EDTA、PBS等。第1电极105A和第2电极105B例如可以以Ag、AgCl、Pt为材料构成。
在电解质溶液103内部导入有作为测定对象的生物分子109(DNA链等)。生物分子109在其一端具有例如由聚合酶构成的分子马达110、以及控制链111。进一步,控制链111在远离分子马达110侧的一端与引物112结合,另一方面,在靠近分子马达110侧的一端具有间隔区113。由于该间隔区113的存在,引物112不与分子马达110接触,在生物分子109到达纳米孔101中之前,合成反应不会进行。分子马达110到达纳米孔101,由此在控制链111中发生变形等、引物112与分子马达110接触,从而合成反应才开始。因此,利用上述结构,能够控制分子马达110的合成起始时刻,能够提高测定合格率。这一点在后文中详细地进行说明。
需说明的是,图1例示的装置中,1个薄膜102仅具有1个纳米孔101,但这不过是一个例子而已,也可以设为在薄膜102中形成多个纳米孔101、将多个纳米孔101的各个区域用分隔壁分离而构成的阵列设备。阵列设备中,可以将第1液槽设为公共槽,将第2液槽设为多个独立槽。这种情况下,可以在公共槽和独立槽中分别配置电极。
图1的生物分子分析装置具备测定流经电极之间的离子电流(封闭信号)的测定部、以及作为基于其测定结果控制对第1电极105A、第2电极105B施加的电压的控制部的计算机108。计算机108基于测得的离子电流(封闭信号)的值获取生物分子109的序列信息。另一方面,也可以通过在纳米孔101内设置电极来获得隧道电流或检测晶体管特性变化,从而获得生物分子109的信息。
这里,进一步详细地对作为测定对象的生物分子109、控制链111、引物112和间隔区113进行说明。
该图1的装置中,如果在第1电极105A与第2电极105B之间施加电压,则在形成有纳米孔101的薄膜102的两面之间产生电位差,溶解于上侧的液槽104A中的生物分子109向位于下侧的液槽104B的方向泳动。电流计106具有使通过电压的施加而流经电极间的电流放大的放大器和ADC(Analog to Digital Converter,模数转换器)(图中未显示)。作为ADC输出的检测值被输出至计算机108。计算机108收集并记录检测到的电流值。
结合于生物分子109的控制链111另行提供,在进行样品调整的预处理的基础上被导入液槽104A。使液槽104A的电解质中共存有适合分子马达110的驱动的缓冲液。缓冲液利用的是适合于所用分子马达的缓冲液,一般混有(NH
生物分子分析装置中,有必要在生物分子通过纳米孔时进行输送控制。该第1实施方式的装置中的输送控制主要利用分子马达110来进行。利用分子马达110进行的输送控制有必要仅在纳米孔101附近开始。发明人进行了深入研究,结果发现,通过对于作为读取对象的生物分子109结合控制链111、进一步在控制链111中在分子马达110侧设置间隔区113,能够仅在生物分子109到达纳米孔101附近的情况下开始利用分子马达110的输送控制。
这种情况下,控制链111优选满足以下的(a)~(d)。
(a)控制链111存在于生物分子109的上游(与测定对象的生物分子夹着分子马达110而位于相反侧)。
(b)在控制链111的上游(远离分子马达110的一侧)结合有引物112。即,控制链111的远侧设为引物结合位点。
(c)在控制链111的下游有间隔区113存在。
(d)作为一例,间隔区113的长度可以设为2mer以上。
电解质溶液中103中,如果从电压源107经由第1电极105A、第2电极105B在纳米孔101的上游侧和下游侧施加电压,则在纳米孔101附近产生电场,由于该力,生物分子109被导入纳米孔101并通过纳米孔101。另一方面,分子马达110的尺寸Dm比纳米孔101的直径Dn大,因此分子马达110无法通过纳米孔101。此时,控制链111中的引物112与滞留在纳米孔101附近的分子马达110相接近,合成反应开始。
其结果是,利用分子马达110使互补链延伸时的力,生物分子109被从纳米孔101向上游侧(第1电极105A侧)提起,由此时获得的信号变化进行由核酸构成的生物分子109的分析。这样的分析结果在试验、诊断、治疗、药物开发、基础研究等领域是有用的。实际上,使如上所述准备的生物分子109在没有纳米孔101的电解质溶液中进行合成反应时是不会发生合成反应的,进行使用具有纳米孔101的薄膜102的电流测定时,确认到来源于分子输送的生物分子的通过信号。
以下,具体地对上述控制链111的构成对合成起始控制的帮助进行说明。图1的装置中,在开始施加电压的起初,生物分子109尚未到达纳米孔101,因此,在电流计106中测得与纳米孔101的直径Dn对应的电流。然后,生物分子109被导入至液槽104A,由于电场而到达纳米孔101附近。
参照图2对结合于生物分子109的控制链111中不存在间隔区113时的不良状况进行说明。如图2所示,不存在间隔区113且引物112与分子马达110接触时,分子马达110会在生物分子109被导入纳米孔101前从引物112开始合成反应(延伸反应)。如果在生物分子109被导入纳米孔101前合成反应已完成,则生物分子109无法通过纳米孔101,或者由于延伸反应的进行,可通过纳米孔101而利用本装置测定的生物分子109的长度(分析长度)变短。与其他方式相比,纳米孔方式的优点在于能够以比生物分子109长的分析长度进行测定这一点,如果像上述那样进行了延伸反应,则会失去该优点。
作为一种消除这些合格率下降要因的策略,有些情况下也可以采取通过基于阻断寡聚物的反应控制来消除的方法(G.M.Cherf等,Nat.biotechnol.(2012))。但引物和阻断寡聚物这两种分子的利用中,有必要同时结合两者,由于结合的发生是概率过程,因此成为合格率下降的要因之一。为了消除全部的发生原因,要求预先组合合成反应停止的机构、不存在多个概率过程。
作为解决上述问题的方法,第1实施方式中,在控制链111的上游侧(远离分子马达110的一侧)设置引物112,同时在下游侧(靠近分子马达110的一侧)设置间隔区113。引物112的末端和分子马达110被间隔区113隔离。由此,在分子马达110到达纳米孔101前(图2的符号α、β),合成反应不会开始。生物分子109通过纳米孔101,然后分子马达110到达纳米孔101,由此,分子马达110与引物112的一端接触,此时才可以开始合成反应和输送控制(图2的符号γ)。
参照图3A和图3B,进一步详细地对该控制链111的动作和生物分子的分析方法进行说明。图3A为对控制链111和分子马达110的作用进行说明的概念图,图3B为显示第1实施方式中生物分子109的测定步骤的流程图。如图3A中概要性显示的那样,生物分子109以结合有控制链111的状态被导入至含有电解质溶液103的液槽104A中。电解质溶液103中溶解有分子马达110。生物分子109与分子马达110和控制链111在电解质溶液103中结合。需说明的是,也可以在使控制链111、分子马达110在其他溶液中结合于生物分子109后再导入至液槽104A。
控制链111在上游与引物112结合,且在其下游具有间隔区113,引物112与分子马达110被间隔区113隔离。以这种方式,经由第1电极105A、第2电极105B对液槽104A、104B施加第1电压V1,该液槽104A、104B中,具有由引物112和间隔区113构成的控制链111的生物分子109溶解在电解质溶液103中(图3B的步骤S1)。由此,如图3A的(a)所示,结合有分子马达110的生物分子109由于纳米孔101附近产生的电位梯度而被导入纳米孔101。
向纳米孔101导入生物分子109后,将两个电极105A、105B间的电压切换至第2电压V2(图3B的步骤S2)。由此,生物分子109进一步向下游侧移动,分子马达110向纳米孔101侧靠近。分子马达110的尺寸Dm比纳米孔101的直径Dn大(Dm>Dn),因此如果分子马达110到达纳米孔101的入口(液槽104A侧),则无法通过纳米孔101向出口侧行进(液槽104B侧),而是停在纳米孔101的入口。另一方面,带负电荷的生物分子109进一步向下游方向移动,控制链111以间隔区113为中心发生形状变化。这样一来,分子马达110与控制链111中的引物112的末端接触、结合(图3A的(b))。由此,结合于引物112末端的分子马达110使合成反应开始。
分子马达110与引物112结合(接触)后,将两个电极105A、105B间的电压切换至第3电压V3(图3B的步骤S3),由此开始生物分子109的提起(输送)动作和测序。如果开始基于分子马达110的合成反应,则由于提起的力F1比生物分子109通过纳米孔101的力F2大,生物分子109向与电场方向相反的方向被输送。该输送期间,可以用电流计106和计算机108检测(测序)来源于生物分子109的特性的信号(电流的变化)。
这里,关于施加电压,导入生物分子109时使用的第1电压V1、使分子马达110与引物112结合时施加的第2电压V2、以及测定时的第3电压V3可以全部相同。另一方面,根据分子马达110种类的不同,结合力、提起力是不同的,因此也存在使用不同电压更能检测到希望的信号的情况。有助于生物分子109的通过速度的力F2除了由提起力F1、电场来决定以外,还由纳米孔101内壁的摩擦力来决定。因此,也有必要根据纳米孔101的尺寸(直径、厚度等)对施加电压V1~V3进行调整。
第1实施方式中,作为一例,使用聚合酶作为分子马达110,使用表1所示序列的DNA作为生物分子109和引物112。在“Z”所示位置,可以配置iSpC3作为间隔区113。
[表1]
图4显示的是关于间隔区113的效果的实验例。
该实验中,在缓冲溶液中导入结合有控制链111且具有间隔区113的生物分子109,通过电泳,确认该结合控制链的生物分子的溶液内合成反应。进一步,将作为用作分子马达110的分子的聚合酶、以及形成互补链的dNTP也导入缓冲溶液中。此外,作为比较对象(参照),也测定了未导入用作分子马达110的聚合酶和形成互补链的dNTP情况下的延伸反应。关于用作分子马达110的分子(聚合酶),研究了分子A、分子B这2种。
图4中,“寡聚+”表示的是存在间隔区113的情况。此外,关于“聚合酶+”“聚合酶-”表示是在缓冲溶液中存在作为分子马达110的聚合酶的状态下的实验(+)或者在不存在的状态下的实验(-)。关于“dNTP+”“dNTP-”表示是在缓冲溶液中存在形成互补链的dNTP的状态下的实验(+)或者在不存在的状态下的实验(-)。
此外,为了确认盐的影响,也对在缓冲液中添加有0.3M KCl的缓冲溶液中的延伸反应结果进行了确认。图4中,“0.3M KCl+”“0.3M KCl-”表示的是缓冲溶液中是否添加了0.3M KCl。B1~E1是使用分子A时的实验结果,F1~A2是使用分子B时的实验结果。
分子A、B中,可进行反应的缓冲条件(B1、F1)下出现的条带的位置与不可进行延伸反应的缓冲条件(C1、G1)下出现的条带的位置都是相同的。由此可见,在可进行延伸反应的缓冲条件下,延伸反应并未发生。此外,由D1和H1的结果可见,两分子在0.3M KCl中的延伸反应也均被抑制。由以上结果可见,通过在连接于生物分子109的控制链111中存在间隔区113,缓冲溶液中的延伸反应受到抑制。
图5显示的是用于确认是否成为下述情形的实验数据:在作为具有分子马达110和间隔区113的部分双链DNA的生物分子109中,分子马达110与部分双链DNA接触,从而使延伸反应开始,能够输送生物分子109。该实验中,在被具有纳米孔101的薄膜102分离的液槽104A、104B内的缓冲溶液中,设定与图4同样的溶液条件。而且,在该缓冲溶液中溶解与图4同样的、与具有分子马达110(BST聚合酶)和间隔区113的控制链111连接的生物分子109,进行封闭电流测定。
封闭电流测定中,以不存在生物分子109的状态下测得的电流值为基准(孔电流),监测封入了生物分子109时观测到的电流减小(纳米孔101被生物分子109封闭),观测分子的通过速度、状态。
如果生物分子109结束了从纳米孔101的通过,则获得的电流值恢复至作为基准的孔电流。可以由该封闭时间计算生物分子109通过纳米孔101的速度,同时,可以由封闭量来分析生物分子的特性。封闭电流测定中使用的施加电压在该实验中全部设为0.1V。
在使用分子马达110的实验中,预先使作为模板的生物分子109与引物112结合而生成部分双链DNA后,为了与分子马达110结合,37℃下在缓冲溶液中进行10分钟温育。然后,将与分子马达110结合的部分双链DNA混合在作为测定溶液的0.3M KCl中。以DNA量为10nM的方式调整。
图5(a)显示的是对未与分子马达110结合、仅结合了引物112的生物分子109进行测定时的封闭信号以及封闭时间和封闭量的分布图。虽然封闭信号的波形有波动,但可以看出,获得的信号的封闭时间为1ms以下,生物分子109以非常快的速度通过纳米孔101。
然后,在将生物分子109与由聚合酶构成的分子马达110结合的状态下同样地获得封闭信号的结果示于图5(b)。获得了在图5(a)的条件下没有确认到的长时间(~数千ms)的封闭信号。由封闭时间和封闭量的分布图也可见,检测到多个封闭时间1ms以上的信号(用虚线的圆表示)。该封闭时间1ms以上的信号被认为是基于在分子马达110到达纳米孔101后进行延伸反应而产生的。
进一步,将由聚合酶构成的分子马达110与生物分子109结合、但测定溶液中未加入底物时的封闭信号获取结果示于图5(c)。确认到长时间维持电流减小的现象。
确认到电流的减小、即孔的闭塞后,电流值没有自动恢复至孔电流。如果在图中三角标志所示时间进行施加电压的反转,则可确认到恢复至孔电流的现象。但数秒后再次确认到电流减小的情形,前述现象再次重复。该现象在图5(b)中并未确认到。
从以上结果可以推断出以下内容。图5(a)中,如图5A左侧记载的那样,观察到作为模板的生物分子109与引物112结合而成的样品的通过现象,推测在纳米孔101中,观察到引物112从模板的解链(unzipping)。
另一方面,图5(c)中,由前述图4的通过电泳确认溶液内的合成反应的结果也推测,由聚合酶构成的分子马达110导致的延伸反应没有进行,观测到在纳米孔101附近停止的状态。
而图5(b)中,推测因为溶液中存在底物,所以可以利用由聚合酶构成的分子马达110进行从引物112开始的延伸反应,因此能够确认到由聚合酶导致的输送所带来的封闭现象。需说明的是,对图5(b)中未确认到的封闭现象的封闭时间进行分析,平均为1600ms,从本次使用的模板的长度53nt进行换算,是以30ms/nt的速度通过的。这与利用聚合酶输送的时间大体相等。
综上所述,认为能够实现:间隔区113导致的溶液中的输送停止,以及生物分子109在纳米孔101附近的输送开始和合成的开始。
图6中显示的是,使用仅由腺嘌呤(A)和胞嘧啶(C)逐个碱基重复(例如各50个)而形成的生物分子(模型样品序列)作为成为模板的生物分子,与图5同样地进行封闭电流测定的结果。图6上侧的图表显示的是封闭电流的波形,下侧的图表是按照2个阈值电流将封闭电流的波形标准化而得的标准化波形。
如图6上侧的图表所示,如果将封闭电流的波形按照2个阈值电流(CACAC、ACACA)进行标准化,对标准化波形的脉冲数进行计数,则观测到与作为测定对象的模型样品序列中腺嘌呤和胞嘧啶的数量相等数量的脉冲。根据该图6的实验结果也可认为,测得的封闭电流的信号是反映处于间隔区113下游的模板(生物分子109)的特性(碱基序列)的信号,延伸反应以能够分辨相邻碱基产生的信号的差别的速度发生。
然后,对间隔区113的材料进行研究。作为控制链111所含的间隔区113的材料,可以使用以下材料。间隔区113不含碱基,为直链状连接体。条件是,间隔区113的配置长度为从引物112的连接部开始2个碱基以上、即具有约0.6×2nm以上的长度。适当的接头的例子在本领域是公知的(根据IDT主页(http://sg.idtdna.com/site/Catalog/Modifications/Category/6)、参照Diehl等(自然方法)Nature Methods、2006、3(7):551-559),没有限定,包括能够在链中配置的C3 Spcer、PC spacer、Spacer9、Spacer18、dSpacer,但不限定于此。除了上述材料以外,还可以为直链状碳链、直链状氨基酸、直链脂肪酸、直链状糖链等。
图7显示的是与图1的生物分子分析装置不同的生物分子分析装置700的构成例。对于与图1的装置同样的构成要素给与同一符号,省略了重复说明。与图1的装置不同的点在于,薄膜102B具有多个纳米孔101,薄膜102A下方的液槽104B被分隔壁(具体地,薄膜102C的侧壁)分割为多个空间。固定薄膜102A的薄膜102B和102C中,在与纳米孔101对应的位置设有通孔,利用薄膜102C的通孔侧壁,形成多个空间。在多个空间中分别设有第2电极105B。需说明的是,液槽104A作为相对于位于下侧的多个空间而言的公共液槽使用。多个空间由于分隔壁而相互绝缘。因此能够独立测定流经各纳米孔101的电流。
在设于薄膜102B和102C的各个通孔中露出的薄膜102A优选是通过施加电压形成纳米孔101时难以形成2个以上纳米孔101的面积,而且是强度上允许的面积。作为一例,该面积例如可以设为100~500nm程度。此外,为了实现一个DNA碱基的分辨率,薄膜102A的膜厚优选设为能够形成具有相当于一个碱基的实效膜厚的纳米孔101的膜厚。作为一例,膜厚适合设为7nm左右或该值以下。
与图1的情况同样地,液槽104A和液槽104B中充满电解质溶液103。图7的情况下,电解质溶液103的容量为微升级或毫升级。
电解质溶液103例如使用KCl、NaCl、LiCl、CsCl。在未对这些溶液导入分子马达110的液槽104B中,为了抑制生物分子109自身互补链的形成,也可以混有4M以上的Urea、DMSO、DMF、NaOH。此外,为了生物分子109的稳定化,也可以混有缓冲剂。作为缓冲剂,使用Tris、EDTA、PBS等。
以下,对前述生物分子分析装置的制作方法进行说明。以所谓封闭电流方式的用于生物分子的分析的生物分子分析装置的基本构成本身在本技术领域是已知的,其构成要素对于本领域技术人员而言是能够容易地理解的。例如在美国专利第5795782号、“Scientific Reports(科学报告)4、5000、2014、Akahori、等”、“Nanotechnology(纳米技术)25(27):275501、2014、Yanagi、等”、“Scientific Reports(科学报告)、5、14656、2015、Goto、等”、“Scientific Reports(科学报告)5、16640、2015”中公开了具体的设备。
形成有纳米孔101的薄膜102可以是中心具有细孔、由嵌入了蛋白质的两亲性分子层构成的双层脂质(生物孔),也可以是由可通过半导体精细加工技术形成的材质构成的薄膜(固体孔)。作为可通过半导体精细加工技术形成的材质,例如有氮化硅(SiN)、氧化硅(SiO
作为一例,利用半导体精细加工技术的薄膜可以通过以下步骤制作。首先,在厚度725μm的8英寸Si晶圆表面,分别以12nm/250nm/100nm的膜厚使Si
接下来,通过反应性离子蚀刻,按照500nm见方的条件将Si晶圆表面最上部的Si
接下来,将该保护膜除去后,将500nm见方露出的SiO层用BHF溶液(HF/NH4F=1/60,8min)除去。由此得到膜厚12nm的露出薄膜Si
关于纳米孔101的尺寸,可以根据作为分析对象的生物分子的种类选择适当的尺寸。作为一例,纳米孔101的尺寸例如为0.9nm~100nm、优选为0.9nm~50nm,具体地,可以设为约0.9nm以上10nm以下。例如直径约为1.4nm的ssDNA(单链DNA)的分析中使用的纳米孔101的直径优选为1.4nm~10nm程度,更优选为1.4nm~2.5nm程度,具体地,可以设为约1.6nm。
此外,例如直径约为2.6nm的dsDNA(2本链DNA)的分析中使用的纳米孔101的直径可以优选设为3nm~10nm左右,更优选设为3nm~5nm左右。
纳米孔101的深度可以通过调整薄膜的厚度来调整。纳米孔101的深度设为构成生物分子的单体单元的2倍以上、优选为3倍以上、更优选为5倍以上的大小。例如生物分子由核酸构成的情况下,纳米孔101的深度优选设为3个碱基以上的大小、例如约为1nm以上。由此,能够在控制生物分子的形状和移动速度的同时使其进入纳米孔101,能够实现高灵敏度和高精度的分析。此外,纳米孔101的形状基本为圆形,也可以设为椭圆形、多边形。
具备多个具有纳米孔101的薄膜的阵列型装置构成的情况下,优选使具有纳米孔101的薄膜有规律地排列。配置多个薄膜111A的间隔可以根据所使用的电极、电测定体系的能力设为0.1μm~10μm,优选设为0.5μm~4μm。
需说明的是,在薄膜中形成纳米孔101的方法没有特别限定,例如可以使用利用透射型电子显微镜等的电子束照射、利用施加电压的绝缘破坏等。例如可以使用“ItaruYanagi等,Sci.Rep.4、5000(2014)”中记载的方法。
纳米孔101的形成例如可以通过以下步骤来进行。在将分割体置于生物分子分析用设备等之前,利用Ar/O
电压的施加不仅在纳米孔101形成时进行,也在形成纳米孔101后测定通过纳米孔101流动的离子电流时进行。这里,将位于下侧的液槽称为cis槽,将位于上侧的液槽称为trans槽。此外,将施加于cis槽侧的电极的电压V
施加脉冲后的电流值可以用电流计(例如4156B PRECISION SEMICONDUCTORANALYZER,Agilent Technologies、Inc.)读取。根据施加脉冲电压前形成的纳米孔101的直径选择电流值条件(阈值电流),依次增加纳米孔101的直径,能够获得目标直径。
纳米孔101的直径根据离子电流值估算。条件选择的基准如表2所示。
[表2]
表2施加电压条件
这里,第n次脉冲施加电压时间t
[数1]
t
除了施加脉冲电压的方法以外,纳米孔101的形成也可以通过利用基于TEM的电子射线照射来进行(A.J.Storm等,自然-材料(Nat.Mat.)2(2003))。
如果由电源对设于上下2个液槽的电极施加电压,则纳米孔101附近产生电场,液体中带负电的生物分子从纳米孔101内通过。此时,有前述封闭电流Ib流过。
与薄膜接触的能够容纳测定溶液的液槽可以适当设为不对封闭电流的测定产生影响的材质、形状和大小。以与分割这些液槽的薄膜接触的方式注入测定溶液。
电极优选用可与测定溶液中的电解质进行电子转移反应(法拉第反应)的材质制作,典型地,用卤化银或碱性卤化银制作。从电位稳定性和可靠性的观点出发,优选使用银或银氯化银。
电极可以由成为极化电极的材质制作,例如可以用金、铂等制作。这种情况下,为了确保稳定的离子电流,优选在测定溶液中添加能够辅助电子转移反应的物质、例如铁氰化钾或亚铁氰化钾等。或者,优选在该极化电极表面固定可进行电子转移反应的物质、例如二茂铁类。
电极的结构可以全部由前述材质构成,或者也可以是在基底材料(铜、铝等)的表面覆盖有前述材质。电极的形状没有特别限定,优选为与测定溶液接触的表面积大的形状。电极与配线接合,向测定电路输送电信号。
图7的生物分子分析装置包括上述构成作为要素。上述纳米孔方式的生物分子分析装置可以与记载使用步骤、使用量等的说明书一起提供。控制链可以以可即时使用的状态提供,也可以以仅未结合有作为测定对象的生物分子的状态构成、提供。这样的形态和调制是本领域技术人员能够理解的。关于纳米孔设备也同样地,可以以可即时使用、形成有纳米孔的状态提供,也可以以在提供前形成的状态提供。
图8为显示利用生物分子测定装置100和700的测定步骤的流程图。首先从溶液提取作为测定对象的生物分子109(步骤S11),使该生物分子109与控制链111结合(步骤S12)。该控制链111可以设为修饰有可与后续回收中使用的珠子表面的修饰基结合的分子。生物分子109例如可以从对象生物的细胞液提取获得。生物分子109在提取后结合控制链111并回收。回收时一般使用珠子,在珠子表面修饰有可与在控制链上修饰的分子结合的分子。
珠子表面例如常常结合有链亲和素。这种情况下,通过在控制链111的3’端修饰有生物素,能够利用珠子,只对控制链111可连接的样品进行回收。链亲和素和生物素的结合对象相反也无妨。利用珠子回收目标样品(测定对象生物分子109)后(步骤S13),可以根据情况将珠子去掉(步骤S14)。将珠子去掉时,可以通过在具有珠子直径以下的多孔结构的膜的两端施加800mV以上的电场来去除。或者,也可以在SA-生物素键的下游设置二硫键位点,从而利用还原剂使其解离。
然后,将提取的生物分子109溶解在测定溶液中,注入至图1或图7所示的生物分子分析装置。然后,通过施加电压,生物分子109被导入纳米孔101,通过施加希望的电压,进行生物分子109的分析。
如上所述,根据第1实施方式的生体分析装置和分析方法,能够在进行生物分子的输送控制的同时,切实地进行合成起始点的控制。
[第2实施方式]
然后,参照图9A~图9C对本发明第2实施方式涉及的生物分子分析装置进行说明。该第2实施方式的生物分子分析装置的整体构成与第1实施方式是同样的,因而省略了重复说明。该第2实施方式中,作为测定对象的生物分子109的构成与第1实施方式是不同的。
第1实施方式中,以将单链DNA的生物分子109作为测定对象的情况为例进行了说明。该第2实施方式中,以双链DNA的生物分子109为测定对象。
双链DNA的情况下,在未对生物分子109进行处理的状态下无法通过电泳导入至纳米孔101。因此,该第2实施方式中,如图9A所示,在作为测定对象的双链的基因组片段901的一端添加导入链904。导入链904在作为测定对象的基因组片段901的一侧至少具有双链结构。其中,以能够向导入纳米孔101的方式,与基因组片段901相反侧的、导入链904的前端部分形成单链的突出末端903。
在基因组片段901的基端侧,与第1实施方式同样地,隔着包含分子马达110的分子马达结合位点902连接有控制链111。控制链111中,与第1实施方式同样地添加有引物112,在引物112与分子马达110之间,与第1实施方式同样地设有间隔区113。
接下来,参照图9B和图9C,对在该第2实施方式的生物分子分析装置中测定图9A中说明的生物分子109的方法的概要进行说明。
图9A的基因组片段901例如被导入至图1的装置的液槽104A,如果在两个电极105A和105B之间施加电压,则图9A的基因组片段901的导入链904被导入至纳米孔101。
如图9B所示,如果导入链904的突出末端903被导入纳米孔101,则导入链904的双链DNA被解链(unzipping),随之基因组片段901的双链DNA也被解链。然后,如图9C所示,如果分子马达110到达纳米孔101,则分子马达110与引物112接触,由此在形成单链的基因组片段901’中,延伸反应开始。以后的动作与第1实施方式大体相同。根据该第2实施方式的构成,具有双链结构的生物分子也能够利用图1那样的纳米孔方式的装置进行分析。
[第3实施方式]
接下来,参照图10A~图10D对本发明第3实施方式涉及的生物分子分析装置进行说明。该第3实施方式的生物分子分析装置的整体构成与第1实施方式是同样的,因而省略了重复说明。该第3实施方式中,作为测定对象的生物分子的构成与第1实施方式是不同的。对于与第2实施方式的生物分子的构成相同的构成,在图10A中给与相同符号,以下省略了重复说明。
与第1实施方式同样地,该第3实施方式的生物分子109中,在作为测定对象的基因组片段901的一端添加导入链904。但是,该第3实施方式中,在导入链904与基因组片段之间,连接有第2控制链1011。该第2控制链1011具有第2分子马达911,同时,在与基因组片段901连接的部分设有间隔区113’。即,该第3实施方式中,作为生物分子的基因组片段901在第1端部与控制链111和第1分子马达110连接,在第2端部与第1分子马达110与第2分子马达911连接。第2分子马达911具有使双链解离或者使互补链解链的作用。第1分子马达110为聚合酶,第2分子马达911为解旋酶。
然后,对第3实施方式中将生物分子109导入至纳米孔101的方法进行说明。在作为测定对象的生物分子109的上游,与图9A同样地隔着分子马达结合位点902结合有控制链111。在下游,结合有具有双链解离作用或使生物分子的互补链解链的分子马达911、以及第2控制链1011,该第2控制链1011在其上游具有间隔区113’。在第2控制链1011的下游连接有导入链904。
从作为检测对象的生物细胞提取生物分子901,与第1控制链111、分子马达结合位点902和连接有导入链904的第2控制链1011结合后,回收生物分子109。并且,将回收的生物分子109导入至与薄膜102接触的液槽104A。如果对薄膜102施加电压,则生物分子109被导入链904导入至纳米孔101。由此,如图10B所示,导入链904的双链结构开始解离。
然后,如果导入链904的解离完成、第2分子马达911到达纳米孔101,则由解旋酶构成的第2分子马达911与基因组片段901的互补链接触。由此,如图10C所示,基因组片段901的互补链的解离和分解开始。如果基因组片段901的互补链的分解或解离结束,则分子马达911从基因组片段901游离出来。
如果基因组片段901的分解或解离结束,则如图10D所示,由聚合酶构成的第1分子马达110到达纳米孔101。由此,与第1实施方式中同样地,通过引物112与第1分子马达110接触,从而延伸反应开始,可以开始对成为单链的基因组片段901的分析。
如上所述,根据该第3实施方式,导入链904的解离结束后,能够利用第2分子马达911使作为双链DNA的基因组片段901开始解离,能够在纳米孔方式中实现双链DNA迅速且准确的分析。
[第4实施方式]
然后,参照图11A对本发明第4实施方式涉及的生物分子分析装置进行说明。该第4实施方式的生物分子分析装置的整体构成与第1实施方式是同样的,因而省略了重复说明。该第4实施方式中,作为测定对象的生物分子的构成与第1实施方式是不同的。对于与第4实施方式的生物分子的构成同样的构成,在图11A中给与和图1相同的符号,以下省略了重复说明。
该第4实施方式中,在测定对象的双链结构的基因组片段901的一端连接有分子马达结合位点116,进一步在分子马达结合位点116的另一端连接有导入链1102。分子马达结合位点116具有由解旋酶构成的分子马达1101。在这一点上与前述实施方式具有由聚合酶构成的分子马达是不同的。由解旋酶构成的分子马达与聚合酶不同,能够使双链结构的生物分子解离,形成单链结构。由解旋酶构成的分子马达1101结合于分子马达结合位点116中控制链的单链区域。导入链1102具有突出末端1103,但突出末端1103使用间隔区而不是单链。
接下来,参照图11B和图11C对第4实施方式中将基因组片段901导入至纳米孔101的方法进行说明。首先,从具有作为测定对象的基因组的细胞提取、纯化基因组片段901后,与结合有导入链1102的分子马达结合位点116结合。需说明的是,在基因组片段901的与结合有分子马达结合位点116一侧相反侧的一端可以结合有能够与珠子等用于提取生物分子的结构结合的位点。
然后,将用于提取基因组片段901的结构切断后,将提取的基因组片段901导入至与具有纳米孔101的薄膜102接触的测定溶液。图1或图7的装置中,如果在两个电极105A、105B之间施加电压,则基因组片段901的导入链1102被导入至纳米孔101。如图11B所示,如果导入链1102被导入至纳米孔101,则双链区域的互补链开始解离。如果该互补链的解离结束、由解旋酶构成的分子马达1101到达纳米孔101,则该分子马达1101与基因组片段901的一端接触。由此,解旋酶导致的互补链的解离开始,基因组片段901成为单链,变得能够通过纳米孔101。由此,基因组片段901被输送至纳米孔101内部,开始利用纳米孔方式对基因组片段901的分析。
[第5实施方式]
接下来,参照图12和图13对本发明第5实施方式涉及的生物分子分析装置进行说明。该第5实施方式的生物分子分析装置的整体构成与第1实施方式是同样的,因而省略了重复说明。
该第5实施方式中,作为测定对象的生物分子的构成以及用于此目的的装置的动作与第1实施方式是不同的。该第5实施方式中,为了提高生物分子的分析精度,生物分子按照能够实行可重复分析生物分子的往复运动控制的方式构成。这里,往复运动控制是指能够进行如下操作的控制:使生物分子109在纳米孔101中上下多次移动从而对1个生物分子109进行重复测定。
此外,生物分子分析装置以进行电压施加的方式构成,该电压的施加能够实现这样的往复运动控制。具体地,通过在生物分子109的两端结合尺寸比纳米孔101大的阻断分子1201、1202,能够实现往复运动控制。通过进行往复运动控制,能够对同一生物分子进行重复测定,能够提高测定精度。
参照图12对该第5实施方式中利用往复运动控制进行的生物分子的分析步骤的概要进行说明。利用往复运动控制进行的重复分析可以通过将生物分子109困在纳米孔101附近、将施加电压的极性重复反转从而进行往复运动来实现。
首先,如图12(a)所示,在作为测定对象的生物分子109的一端,隔着控制链111结合第1阻断分子1201,封入至第1液槽104A中。
然后,如图12(b)所示,如果在两个电极105A、105B之间施加第1电压(V1),则通过电泳,生物分子109导入至(通过)纳米孔101。第1阻断分子1201的大小比纳米孔101的直径大,因此第1阻断分子1201无法通过纳米孔101,生物分子109被困在纳米孔101中。
如果生物分子109通过了纳米孔101,则如图12(b)右侧所示,生物分子109的另一端与封入于第2液槽104B中的第2阻断分子1202结合。以这种方式,在生物分子109的两端位于薄膜102两侧的状态下分别与第1阻断分子1201和第2阻断分子1202连接,从而生物分子109可以在第1阻断分子1201与第2阻断分子1202之间,在纳米孔101内部往复运动。
如果生物分子109通过纳米孔101,得到两端与第1阻断分子和第2阻断分子1201、1202连接的状态,则接下来,具有分子马达110的引物结合位点结合于生物分子109。需说明的是,通过使第1电压V1的极性反转,控制链111中引物112和分子马达110的结合变得容易。
接下来,如图12(c)所示,如果代替第1电压V1而在两个电极105A和105B之间施加第2电压V2,分子马达110到达纳米孔101,则分子马达110与控制链111中的引物112接触,由此,生物分子109的延伸反应开始,与第1实施方式同样地进行生物分子的分析。如果延伸反应进行至生物分子109的末端,则分子马达110从生物分子109游离出来(参照图12(c)右侧)。
然后,如图12(d)所示,如果施加第3电压V3来代替第2电压V2,则利用分子马达110合成的生物分子109的互补链109C由于电压V3的作用而解链(unzipping),从生物分子109游离出来。
接下来,如图12(e)所示,施加与第3电压V3极性不同的第4电压V4来代替第3电压V3,则引物112与分子马达110的结合进行,由此,生物分子109恢复图12(b)的状态。然后,通过施加第2电压V2,再次重复生物分子109的测定。
对1个生物分子109重复足够次数的测定后,如图12(f)所示,在两个电极105A、105B之间施加第5电压V5来代替第4电压V4。由此,第1阻断分子1201或第2阻断分子1202从生物分子109分离。由此形成可对于与已完成测定的生物分子109不同的新的生物分子开始上述测定的状态。这里,第5电压V5是能够产生比阻断分子1201、1202与生物分子109的结合位点的力更大的电场的电压。例如利用基于链霉亲和素(Streptavidin)与生物素(biotin)的结合时,在利用膜厚7nm的纳米孔时,如果进行800mV的电压施加则能够切断。
图13为显示进行图12(a)~(f)的工序时得到的信号的波形和施加的电压的波形变化的图表。图13中,重复输入同样的电压波形。通过这样的电压波形的重复输入,其结果是,得到多个信号组,能够提高测定对象生物分子109的测定精度。需说明的是,信号组中,包括来源于生物分子的信号和判定为输送控制停止的信号。
计算机108对用电流计106检测到的电流值进行检测,通过检测到预定的电流或与之对应的电压,将其作为触发,在两个电极105A和105B之间切换施加的电压的值(V1→V2→V3→V4)。
例如就图13而言,信号组(m)中,施加第2电压V2时,得到来源于作为分析对象的生物分子109的信号1211。信号1211是根据生物分子109的核酸序列等发生振动的信号。
然后,如果生物分子109移动、到达生物分子109的末端、分析结束,则信号1211的基于碱基序列的振动结束,回落至大体固定的电压1212。计算机108检测到该预定的电压1212,从而从第2电压V2切换至作为用于使生物分子109返回初始位置的电压的第3电压V3。生物分子109返回初始位置的行程中,利用电流计106检测到的电流值也基于生物分子109的结构发生振动。如果该电流值回落至预定值,则判定已完成向初始位置的回归,施加电压V3切换至特性相反的第4电压V4。由此,引物112和分子马达110向生物分子109的结合再次进行,开始生物分子109的再次测定,得到信号组(m+1)。如果对生物分子109的多次(n次)测定结束,则施加第5电压V5,由此,对1个生物分子109的测定结束。
需说明的是,如上所述,生物分子109例如可以从对象生物的细胞液提取获得。在提取后,生物分子109与控制链111结合并被回收。回收时,一般使用的是珠子,珠子表面修饰有可与修饰于控制链的分子结合的分子。前述阻断分子1201、1202也可以直接使用控制链结合分子的回收中使用的珠子。或者,也可以在利用珠子回收后将生物分子去掉,再次经过结合阻断分子的过程,进行测定。
以上对本发明的一些实施方式进行了说明,但这些实施方式是作为例子提出的,并非用于对发明范围的限定。这些新的实施方式可以以各种其他形态来实施,在不脱离发明宗旨的范围内,可以进行各种省略、替换、变更。这些实施方式及其变形是包括在发明的范围、宗旨内的,同时,也包括在权利要求书记载的发明和与之等同的范围内。
符号说明
100、700:生物分子分析装置;101:纳米孔;102:薄膜;103:电解质溶液;104A、104B:液槽;105A:第1电极;105B:第2电极;106:电流计;107:电压源;108:计算机;109:生物分子(DNA链等);110、911、1101:分子马达;111、1011:控制链;112:引物;113、113’:间隔区;116、902:分子马达结合位点;901:基因组片段;903、1103:突出末端;1201、1202:阻断分子;904、1102:导入链。
- 生物分子分析方法及生物分子分析装置
- 生物分子分析试剂盒及生物分子分析方法
