新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量的检测方法
文献发布时间:2023-06-19 10:41:48
技术领域
本发明属于新型冠状病毒(SARS-CoV-2)灭活疫苗检测技术领域,涉及新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量的检测方法,尤其涉及利用液相色谱串联质谱定量检测新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量的方法。
背景技术
2019年底发现的新型冠状病毒(SARS-CoV-2)疫情迅速席卷全球,对全球各地区人民的生命健康和社会的经济发展都带来巨大的损失。SARS-CoV-2病毒直径在为60~140nm,主要有4种结构蛋白,分别为S(棘突)蛋白、N(核衣壳)蛋白、M(膜)蛋白、E(包膜)蛋白。其中,S蛋白是病毒最重要的表面膜蛋白,也是引起免疫应答的重要抗原,是疫苗设计的关键靶点。疫苗作为狙击和预防新冠病毒的一种有效方式,成为全球药物研发的关注焦点。灭活疫苗是针对新发突发传染病最有效的疫苗研发途径。具有生产工艺成熟、质量标准可控、保护范围广等优点,可用于大规模接种,并且有国际通行标准来判断疫苗的安全性和有效性。灭活疫苗中有效抗原含量的检测尤为关键。
灭活疫苗是针对新发突发传染病最有效的疫苗研发途径。具有生产工艺成熟、质量标准可控、保护范围广等优点,可用于大规模接种,并且有国际通行标准来判断疫苗的安全性和有效性。灭活疫苗中有效抗原含量的检测,如新冠病毒中S蛋白和N蛋白的含量测定,对于疫苗评价有着十分重要的意义。
传统方法检测灭活疫苗中新型冠状病毒S蛋白含量需要依靠免疫学分析方法,如双抗体夹心酶联免疫法检测。采用酶联免疫技术检测新型冠状病毒中的S蛋白,利用重组表达S蛋白抗原,通过基础免疫和加强免疫小鼠或家兔,制备单克隆或多克隆抗体。将纯化后抗S蛋白抗体包被固相载体如酶联反应板,封闭干板后,加入待测产品,进行孵育洗板操作后,加入酶标记的抗S蛋白抗体,形成标记后的免疫复合物,通过洗涤,将未被结合的酶结合物以及其它物质去除。通过显色或者发光等方式对标记物进行检测,通过标准曲线可以定量检测待测产品中SARS-CoV-2的S蛋白含量。利用酶联法检测S蛋白的技术需要大量时间通过动物免疫过程制备特异性抗体,且对抗体质量要求较高,不仅需要极高的特异性,而且抗体一般需要较高的亲和力。酶联免疫实验在检测过程中易受检测样本中其它成分干扰影响测定结果,造成定量不准确。酶联免疫技术实验操作过程复杂,需要进行3~5步骤孵育和酶联反应板洗涤操作,人为因素对实验影响较大,而且去反应过程易受环境因素影响,故其稳定性和重复性较差。由于酶联免疫法线性范围较窄,一般为10
近年来,液相色谱串联质谱技术在蛋白质的检测分析方面具有高选择性和高灵敏度等优点,非常适用于复杂生物基质中靶向蛋白质的定性和定量研究。
发明内容
基于现有技术检测新型冠状病毒灭活疫苗中新型冠状病毒S蛋白的缺陷,本发明的第一目的在于提供一种用于液相色谱串联质谱定量检测新型冠状病毒S蛋白的定量肽段;本发明的第二目的在于提供所述定量肽段在液相色谱串联质谱定量检测新型冠状病毒S蛋白中的应用;本发明的第三目的在于提供一种新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量的检测方法,其利用本发明筛选获得的新型冠状病毒的S蛋白定量检测的定量肽段和定量离子对,通过高效液相色谱串联质谱定量检测方法,利用S蛋白标准品制作标准曲线,将待测新冠疫苗中间产品及成品经样品处理和酶解后进行高效液相色谱串联质谱定量检测,得到样品中定量肽段的MRM峰面积(即:子离子峰面积),基于标准曲线和进样体积获得待测的灭活疫苗样品中新型冠状病毒SARS-CoV-2的定量肽段的含量,除以进样体积,即得到待测的灭活疫苗样品中新型冠状病毒S蛋白的浓度。
本发明的目的通过以下技术方案得以实现:
一方面,本发明提供一种用于液相色谱串联质谱定量检测新型冠状病毒S蛋白的定量肽段,其氨基酸序列如下:
GWIFGTTLDSK(SEQ ID NO:1)。
本发明的定量肽段具有特异性强、响应值高、在不同新型冠状病毒疫苗的中间产品及成品中序列稳定性强等优点。
上述的定量肽段中,优选地,所述定量肽段的定量离子对中母离子的质荷比为612.8161,子离子的质荷比为244.1080和/或216.1080。
采用本发明上述的定量肽段及其定量离子对,将其应用到液相色谱串联质谱定量检测新型冠状病毒S蛋白中,具有检测准确率高,精确度高,避免了新型冠状病毒灭活疫苗样品中病毒蛋白结构变化、蛋白修饰及基质效应等对检测的影响,能够用于新冠病毒灭活疫苗中各工艺阶段样品的新型冠状病毒S蛋白含量检测。
另一方面,本发明还提供上述定量肽段在液相色谱串联质谱定量检测新型冠状病毒S蛋白中的应用。
再一方面,本发明还提供一种新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量的检测方法,其包括以下步骤:
对重组新型冠状病毒SARS-CoV-2的S蛋白标准品进行孵育并进行酶解处理;采用高效液相色谱串联三重四级杆质谱分析检测设备(HPLC-MRM-MS/MS),进样酶解处理后的重组新型冠状病毒SARS-CoV-2的S蛋白标准品,以标准品含量为横坐标,以上述的定量肽段的子离子峰面积为纵坐标绘制标准曲线;
取待测新型冠状病毒SARS-CoV-2的灭活疫苗样品进行孵育并进行酶解处理;将酶解后的上清液进样检测,根据所述定量肽段的子离子峰面积,基于标准曲线和进样体积获得待测的灭活疫苗样品中新型冠状病毒SARS-CoV-2的定量肽段的含量,除以进样体积,即得到待测的灭活疫苗样品中新型冠状病毒S蛋白的浓度。
上述的检测方法中,所述重组新型冠状病毒SARS-CoV-2的S蛋白标准品为市售获得。
上述的检测方法中,优选地,重组新型冠状病毒SARS-CoV-2的S蛋白标准品或待测新型冠状病毒SARS-CoV-2的灭活疫苗样品进行孵育的过程包括:
向重组新型冠状病毒SARS-CoV-2的S蛋白标准品或待测的灭活疫苗样品中等体积加入RapiGEST,于70~90℃条件下孵育20~60min(破坏病毒膜结构,释放有效抗原成分)后,接着加入二硫苏糖醇(DTT)至终浓度为25mmol/L(二硫苏糖醇的终浓度),于65℃条件下孵育60min,温度降至室温后加入碘代乙酰胺溶液至终浓度为50mmol/L(碘代乙酰胺的终浓度),避光室温孵育20~60min。
上述的检测方法中,优选地,孵育后进行酶解处理的过程包括:
向220μL孵育后的重组新型冠状病毒SARS-CoV-2的S蛋白标准品或孵育后的待测的灭活疫苗样品中加入NH
本发明优化了新型冠状病毒灭活疫苗的样品处理及酶解条件,通过对表面活性剂类型和浓度、烷基化过程、胰蛋白酶用量比及酶解时间等方面的优化,使样品酶解效率得到大幅提高。
上述的检测方法中,优选地,重组新型冠状病毒SARS-CoV-2的S蛋白标准品或待测新型冠状病毒SARS-CoV-2的灭活疫苗样品的高效液相色谱检测条件如下:
色谱柱:C18柱,优选选用ACQUITY UPLC PEPTIDE BEH C18(2.1mm×100mm),进样量为5~10μL,色谱柱温度为60℃;
流动相组成:流动相A为0.1%甲酸水溶液,流动相B为含0.1%甲酸的乙腈溶液;流动相B在0~20min内含量从0~45%变化进行梯度洗脱,流速为0.3mL/min。
上述的检测方法中,优选地,重组新型冠状病毒SARS-CoV-2的S蛋白标准品或待测新型冠状病毒SARS-CoV-2的灭活疫苗样品的质谱检测条件如下:
离子源参数:雾化器流量3.0L/min,干燥器流量10.0L/min,接口温度300℃,脱溶剂气温度526℃,电喷雾电压3.0kV;DL温度250℃。
上述的检测方法中,优选地,母离子质荷比为612.8161、子离子质荷比为244.1080的定量离子对的Q1 Pre偏差(v)-20.0;CE=-20;Q3 Pre偏差(v)-17.0。
上述的检测方法中,优选地,母离子质荷比为612.8161、子离子质荷比为216.1080的定量离子对的Q1 Pre偏差(v)-15.0;CE=-24;Q3 Pre偏差(v)-15.0。
本发明的有益效果:
(1)本发明的定量肽段具有特异性强、响应值高、在不同新型冠状病毒疫苗的中间产品及成品中序列稳定性强等优点。
(2)将本发明的定量肽段及其定量离子对应用到液相色谱串联质谱定量检测新型冠状病毒S蛋白中,具有检测线性关系好、线性范围宽、准确率高、精确度高、特异性强、灵敏度高等特点,避免了新型冠状病毒灭活疫苗样品中病毒蛋白结构变化、蛋白修饰及基质效应等对检测的影响,能够用于新冠病毒灭活疫苗各阶段中间产品及成品的新冠病毒S蛋白含量检测。
附图说明
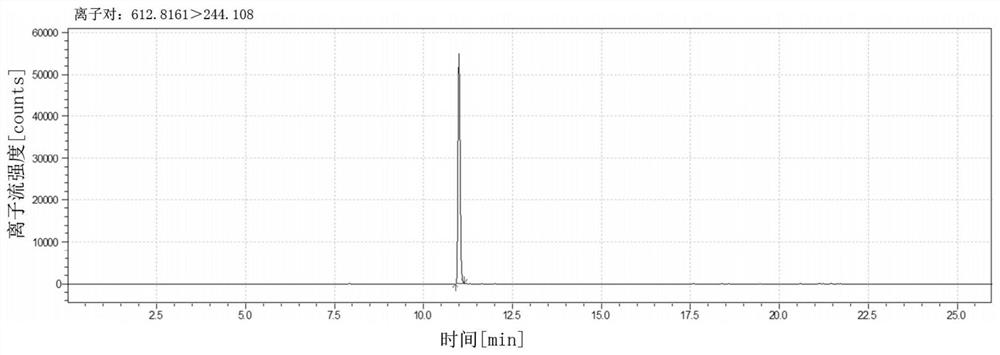
图1为本发明实施例1中筛选获得的定量肽段GWIFGTTLDSK的离子流图。
图2为本发明实施例1中筛选获得的定量肽段GWIFGTTLDSK的二级碎片质谱图。
图3为本发明实施例2中新型冠状病毒灭活疫苗S蛋白的定量肽段GWIFGTTLDSK的标准曲线图。
图4为本发明实施例2中酶解后的新型冠状病毒疫苗的上清液进样检测的S蛋白定量肽段GWIFGTTLDSK的MRM图谱。
具体实施方式
为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
实施例1本发明定量肽段及定量离子对筛选过程:
利用液相色谱飞行时间质谱对新冠病毒灭活疫苗产品进行高分辨质谱分析,筛选特征性肽段以及其一级母离子和二级产物离子信息,具体过程如下:
1、筛选用到的试剂:
50mmol/L的NH
500mmol/L的DTT溶液:称取0.37mg的DTT,采用50mmol/L的NH
1mol/L碘代乙酰胺溶液:称取0.37g的碘代乙酰胺,采用50mmol/L的NH
0.1%的RapiGEST溶液:称取1mg的RapiGEST,加入1mL的50mmol/L的NH
胰蛋白酶溶液:称取20μg的胰蛋白酶溶解液于200μL的50mmol/L的NH
2、重组新型冠状病毒SARS-CoV-2的S蛋白标准品及新型冠状病毒SARS-CoV-2的灭活疫苗样品处理:
取重组新型冠状病毒SARS-CoV-2的S蛋白标准品或待测新型冠状病毒灭活疫苗样品,等体积加入0.1%的RapiGEST溶液,于70℃条件下孵育40min,然后加入500mmol/L的DTT溶液至终浓度为25mmol/L,于65℃条件下孵育40min,温度降至室温后加入1mol/L的碘代乙酰胺溶液至终浓度为50mmol/L,室温避光反应30min。接着向220μL样品溶液中加入50mmol/L的NH
3、新型冠状病毒灭活疫苗原液样本(上述酶解后获得的上清液)的质谱检测分析:
采用液相色谱飞行时间质谱进行检测。
液相色谱检测操作如下:
色谱柱:ACQUITY UPLC PEPTIDE BEH C18(2.1mm×100mm);流动相组成:流动相A为0.1%的甲酸水溶液,流动相B为含0.1%的甲酸的乙腈溶液;色谱柱温度为60℃,样品的进样量为10μL,流动相B在0~70min内含量从0~45%变化进行梯度洗脱,流速为0.3mL/min。
质谱检测操作如下:
使用Xevo G2-XS高分辨质谱仪器,采用MSE模式进行分析,采集和分析软件为UNIFI,质谱分析范围是50~2000m/z,毛细管电压为3.0KV,脱溶剂气流速为600L/h,脱溶剂气温度为250℃。
从质谱测定的S蛋白序列的结果中分析获得检测信号最强的5个特征性肽段序列及14对离子对质谱信息(如下表1所示)。通过Uniprot和NCBI数据库验证分析,5个肽段序列均为S蛋白特征性序列。
表1:
4、本发明定量肽段和定量离子对的筛选:
筛选策略:首先肽段应当属于S蛋白特征性序列,其次要保证定量肽段及其对应的定量离子对在各类样品(标准品、病毒培养液、中间产品、成品)中都有较高的响应,这样才可以达到检测目的。发明人创造性的利用液相色谱串联质谱方法检测新型冠状病毒S蛋白标准品、新型冠状病毒灭活疫苗各制备阶段病毒培养液、中间产品及成品(中间产品指的是成品前一步的疫苗原液产品,成品指的是中间产品加入一定比例的疫苗佐剂和辅料后制备的新型冠状病毒灭活疫苗),依据各类样品质谱信号响应情况,综合筛选得到适用于新型冠状病毒灭活疫苗样品S蛋白检测的定量肽段和其定量离子对。本发明的筛选方法区别于传统仅依靠质谱打分数据选择确定定量肽段和定量离子对,而是创造性通过对不同阶段样品的实际检测情况,依据上述筛选策略,筛选出能实现各阶段产品检测的定量肽段和定量离子对。筛选结果如下表2所示,表2中的母离子和子离子的检测值为质荷比值,各样品的检测值为MRM峰面积(质谱信号值)。
表2:
注:“-----”代表无质谱信号。
表2中可见GWIFGTTLDSK肽段的612.8161(m/z)>244.1080(m/z)与612.8161(m/z)>216.1080(m/z)离子对检测新型冠状病毒S蛋白标准品、新冠病毒灭活疫苗病毒培养液、中间产品、成品的质谱信号值均较高,而其它肽段的离子对均有对一类或多类样品未检出的情况存在,分析有以下原因:(1)GWIFGTTLDSK肽段在上述样品的酶解处理过程中均能稳定产生;(2)此肽段在样品处理后溶液中较为稳定;(3)此肽段的612.8161(m/z)>244.1080(m/z)与612.8161(m/z)>216.1080(m/z)离子对质谱相应值较高。综上原因,经过筛选,只有一个肽段的两个离子对可以满足所有要求,最终确定用于新型冠状病毒灭活疫苗样品S蛋白的定量肽段的序列为GWIFGTTLDSK,定量离子对为612.8161(m/z)>244.1080(m/z)和/或612.8161(m/z)>216.1080(m/z)。图1为GWIFGTTLDSK肽段的离子流图,图2为GWIFGTTLDSK肽段的二级碎片质谱图。由图2可以看出,该定量肽段经过碰撞后的图谱中能够显示出本发明定量离子对的两个子离子,证实了本发明的定量子离子为上述母离子的碎片离子。
实施例2新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量的检测方法
本实施例提供利用实施例1的定量肽段和定量离子对结合高效液相色谱串联三重四级杆质谱分析检测设备(HPLC-MRM-MS/MS)对新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量进行检测的方法。
本实施例中涉及到的高效液相色谱检测条件如下:
色谱柱:C18柱,优选选用ACQUITY UPLC PEPTIDE BEH C18(2.1mm×100mm),进样量为10μL,色谱柱温度为60℃;
流动相组成:流动相A为0.1%甲酸水溶液,流动相B为含0.1%甲酸的乙腈溶液;流动相B在0~20min内含量从0~45%变化进行梯度洗脱,流速为0.3mL/min。
本实施例中涉及到的质谱检测条件如下:
离子源参数:雾化器流量3.0L/min,干燥器流量10.0L/min,接口温度300℃,脱溶剂气温度526℃,电喷雾电压3.0kV;DL温度250℃;
离子对612.8161(m/z)>244.1080(m/z)的Q1 Pre偏差(v)-20.0;CE=-20;Q3 Pre偏差(v)-17.0;
离子对612.8161(m/z)>216.1080(m/z)的Q1 Pre偏差(v)-15.0;CE=-24;Q3 Pre偏差(v)-15.0。
具体操作如下:
(1)将重组新型冠状病毒SARS-CoV-2的S蛋白标准品采用50mmol/L的NH
(2)采用高效液相色谱串联三重四级杆质谱分析检测设备,不同体积进样重组新型冠状病毒SARS-CoV-2的S蛋白标准品,以标准品含量为横坐标(X),以实施例1筛选的新型冠状病毒SARS-CoV-2的定量肽段离子对612.8161>244.1080子离子峰面积(Y)为纵坐标绘制标准曲线;标准曲线如图3所示,标准方程如下:
Y=3.17816×10
(3)取待测新型冠状病毒SARS-CoV-2的灭活疫苗样品进行孵育并进行酶解处理,具体如下:
向待测的灭活疫苗样品中加入0.1%的RapiGEST,于70℃条件下孵育40min后,接着加入500mmol/L的DTT至终浓度为25mmol/L,于65℃条件下孵育60min,温度降至室温后加入1mol/L碘代乙酰胺溶液至终浓度为50mmol/L,避光室温孵育30min。接着向220μL孵育后的待测的灭活疫苗样品中加入50mmol/L的NH
(4)将酶解后的上清液进样检测,进样量为5μL,根据新型冠状病毒SARS-CoV-2的定量肽段的612.8161(m/z)>244.1080(m/z)子离子峰面积(如图4所示的01批样品),基于标准曲线和进样体积获得待测的灭活疫苗样品中新型冠状病毒SARS-CoV-2的定量肽段的含量,除以进样体积,即得到待测的灭活疫苗样品中新型冠状病毒S蛋白的浓度,具体检测结果如下表3所示。
表3:
实施例3新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量的方法验证
本实施例对实施例2的定量肽段和定量离子对结合高效液相色谱串联三重四级杆质谱分析检测设备对新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量检测方法进行方法学验证的过程。
本实施例中涉及到的高效液相色谱检测条件如下:
色谱柱:C18柱,优选选用ACQUITY UPLC PEPTIDE BEH C18(2.1mm×100mm),进样量为10μL,色谱柱温度为60℃;
流动相组成:流动相A为0.1%甲酸水溶液,流动相B为含0.1%甲酸的乙腈溶液;流动相B在0~20min内含量从0~45%变化进行梯度洗脱,流速为0.3mL/min。
本实施例中涉及到的质谱检测条件如下:
离子源参数:雾化器流量3.0L/min,干燥器流量10.0L/min,接口温度300℃,脱溶剂气温度526℃,电喷雾电压3.0kV;DL温度250℃;
离子对612.8161(m/z)>244.1080(m/z)的Q1 Pre偏差(v)-20.0;CE=-20;Q3 Pre偏差(v)-17.0;离子对612.8161(m/z)>216.1080(m/z)的Q1 Pre偏差(v)-15.0;CE=-24;Q3Pre偏差(v)-15.0。
具体操作如下:
(1)线性:参见图3所示,采用本发明的定量肽段和定量离子对获得的标准曲线中,定量肽段子离子的峰面积(Y)与其含量(X)呈线性相关,相关系数高达0.9999279,具有非常好的线性关系。
(2)定量限与检出限:以定量肽段子离子检测信噪比大于等于10(S/N≥10)时的浓度为定量限;以定量子离子信噪比大于等于3(S/N≥3)时的浓度为检出限(LODs)。所测定量肽段检出限和定量限分别为0.0014μg和0.003μg。表明此方法灵敏度高,可以满足S蛋白检测要求。
(3)精密度:以上述方法重复进样测定5次酶切处理后样品,计算子离子峰面积的相对标准偏差。结果如下表4所示。
表4:
由表4可以看出,所测定量肽段子离子峰面积相对标准偏差(RSD%)约为2.1%,表明该方法精密度良好。
(4)准确度:向待测新冠灭活疫苗原液空白基质中加入S蛋白标准品,通过上述样品处理方法检测,用标准曲线测得加标样品浓度,比较实测值和理论值计算加标回收率。结果如表5所示。
表5:
由表5可以看出,所测肽段平均回收率为94.2%,该方法准确度良好。
序列表
<110> 北京生物制品研究所有限责任公司
<120> 新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量的检测方法
<130> GAI20CN6436
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 11
<212> PRT
<213> SARS-CoV-2
<400> 1
Gly Trp Ile Phe Gly Thr Thr Leu Asp Ser Lys
1 5 10
<210> 2
<211> 19
<212> PRT
<213> SARS-CoV-2
<400> 2
Val Val Val Leu Ser Pro Glu Leu Leu His Ala Pro Ala Thr Val Cys
1 5 10 15
Gly Pro Lys
<210> 3
<211> 17
<212> PRT
<213> SARS-CoV-2
<400> 3
Leu Asn Asp Leu Cys Phe Thr Asn Val Tyr Ala Asp Ser Phe Val Ile
1 5 10 15
Arg
<210> 4
<211> 10
<212> PRT
<213> SARS-CoV-2
<400> 4
Val Thr Leu Ala Asp Ala Gly Phe Ile Lys
1 5 10
<210> 5
<211> 9
<212> PRT
<213> SARS-CoV-2
<400> 5
Phe Leu Pro Phe Gln Gln Phe Gly Arg
1 5
- 新型冠状病毒灭活疫苗中新型冠状病毒S蛋白含量的检测方法
- 铝佐剂吸附型新型冠状病毒灭活疫苗中抗原的解离方法
