一种去除有核红细胞的血液单细胞悬液的制备方法
文献发布时间:2023-06-19 11:22:42
技术领域:
本发明属于动物细胞生物学技术领域,具体涉及一种去除有核红细胞的血液单细胞悬液的制备方法。
背景技术:
血细胞是动物机体免疫的重要组分。脊椎动物的血细胞主要包括:红细胞、白细胞和血栓细胞。白细胞又分为粒细胞、单核细胞和淋巴细胞,其中粒细胞又分为中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞。目前,研究者主要通过细胞化学染色、流式细胞术和荧光染色技术来辨别血细胞类型,这些技术的局限性在于只能通过已知的标记来区分血细胞类型,无法定义新的血细胞类型及生物标记。
单细胞测序(Single-Cell Sequencing)是目前应用最广泛的高通量测序技术之一,其中单细胞转录组测序一个重要的研究内容就是利用Marker基因分辨组织细胞异质性,在单细胞分辨率下重新定义细胞类型,并根据每个细胞的基因表达量挖掘新的细胞亚群和Marker基因。因此利用单细胞转录组测序可以完善物种的血细胞图谱,为血液学研究提供坚定的理论基础。目前,在人类、大鼠和小鼠上,已有文献报道可利用淋巴细胞分离液分离出血液中的淋巴细胞,进而利用单细胞转录组测序进一步定义淋巴细胞亚群。
鉴于脊椎动物血液中红细胞异质性极小但占比极大,理论上可裂解红细胞后再进行单细胞转录组测序,从而可以避免单细胞悬液中大量的红细胞对测序结果的影响。然而目前商品化的红细胞裂解液仅可裂解无细胞核的成熟红细胞,无法裂解鸟类和龟类等物种的有核红细胞。综上所述,建立一种去除有核红细胞的血液单细胞悬液的制备方法,对于完善鸟类和龟类等有核红细胞物种的血细胞图谱至关重要。
发明内容:
本发明的目的在于提供一种去除有核红细胞的血液单细胞悬液的制备方法,解决了以上背景技术的不足之处,本方法获得的单细胞悬液无有核红细胞,且细胞数量多、活率高。
为了实现本发明的目的,本发明采用如下技术方案:一种去除有核红细胞的血液单细胞悬液的制备方法,如下:抽取0.5mL新鲜的有核红细胞血液加入至含有50μL EDTA-K2的无酶无菌1.5mL离心管中,20℃孵育10min,随后3000rpm、4℃离心10min,弃血浆;向离心管中加入1mL 4℃预冷的有核红细胞裂解液,4℃孵育10min,随后3000rpm、4℃离心10min,弃上清;向离心管中再加入1mL 4℃预冷的有核红细胞裂解液,4℃孵育5min,随后3000rpm、4℃离心10min,弃上清;再向离心管中加入0.1mL 4℃预冷的无酶无菌PBS轻微吹打重悬离心管底部的白色沉淀,利用细胞计数仪或血球计数板检测细胞浓度,并通过台盼蓝染色计算细胞活率,加入合适体积的4℃预冷的无酶无菌PBS用于稀释单细胞悬液,使细胞终浓度满足10x Genomics上机操作。
本发明还具有如下技术特征:
1、所述的PBS不包含钙离子和镁离子,且pH=7.4。
2、所述的有核红细胞裂解液配制方法:按如下固液配比分别称取0.823736gNH
本发明的有益效果及优点:本方法能够实现低成本、快速、高效地获得去除有核红细胞的血液单细胞悬液,并保证其它血细胞保持良好活力,活细胞比例达80%以上,制备的单细胞悬液适用于10x Genomics单细胞转录组测序,为探究鸟类、龟类等有核红细胞物种的血细胞图谱提供重要的技术支持。
附图说明:
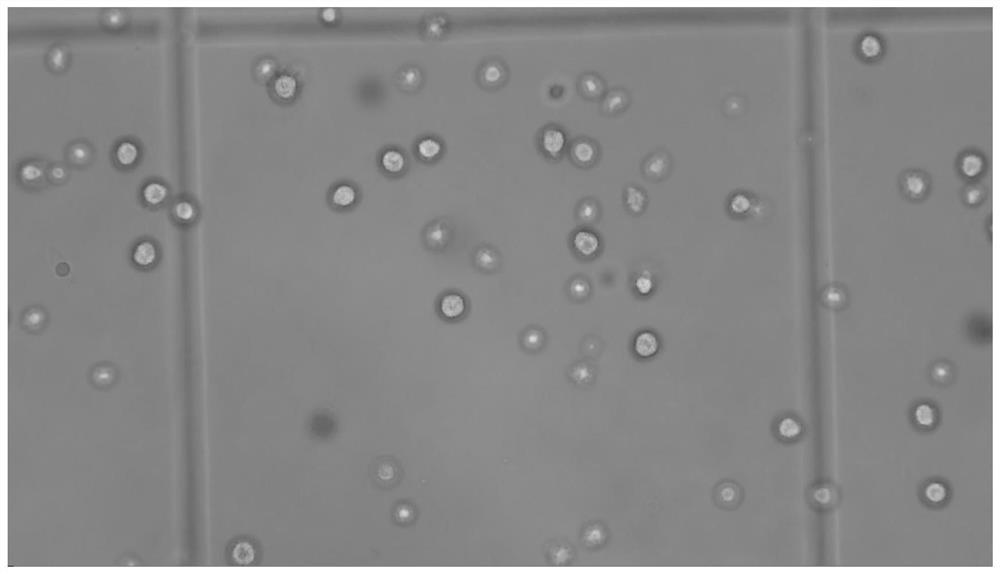
图1:红耳龟去除有核红细胞的血液单细胞悬液的0.4%台盼蓝染色(10倍目镜*10倍物镜)。
图2:红耳龟去除有核红细胞的血液单细胞悬液的0.4%台盼蓝染色(10倍目镜*40倍物镜)。
注:死细胞或细胞碎片经0.4%台盼蓝染色后呈现为蓝色,活细胞经0.4%台盼蓝染色后呈现为无色、透明。
具体实施方式:
为更加清楚的解释本发明的技术方案,结合附图对本发明进行进一步的详细说明。此处描述的具体实施例仅用以解释本发明,并不用于限定发明。
本发明采用的试剂和耗材皆为普通市售品,皆可于市场购得。
实施例1:
一种去除有核红细胞的血液单细胞悬液的制备方法,具体步骤如下:
步骤一:抽取0.5mL新鲜的有核红细胞血液,将其放置于含有50μL EDTA-K2的无酶无菌1.5mL离心管中,20℃孵育10min。
步骤二:在4℃条件下3000rpm离心10min,弃血浆。
步骤三:向离心管中加入1mL 4℃预冷的有核红细胞裂解液,4℃孵育10min。
步骤四:在4℃条件下3000rpm离心10min,弃上清。
步骤五:向离心管中加入1mL 4℃预冷的有核红细胞裂解液,4℃孵育5min。
步骤六:在4℃条件下3000rpm离心10min,弃上清。
步骤七:向离心管中加入0.1mL 4℃预冷的无酶无菌PBS,轻微吹打重悬离心管底部的白色沉淀,即获得去除有核红细胞的血液单细胞悬液。
步骤八:针对步骤七获得的单细胞悬液,利用细胞计数仪或血球计数板检测细胞浓度,并通过台盼蓝染色计算细胞活率。
步骤九:针对步骤七获得的单细胞悬液及步骤八获得的细胞浓度及细胞活率,加入合适体积的4℃预冷无酶无菌PBS稀释单细胞悬液,使细胞终浓度满足10x Genomics上机操作。
如上所述的PBS不包含钙离子和镁离子,且pH=7.4。
如上所述的有核红细胞裂解液配制方法:按如下固液配比分别称取0.823736gNH
实施例2:
一种制备红耳龟去除有核红细胞的血液单细胞悬液的方法,具体步骤如下:
步骤一:用一次性注射器抽取身体健康、精神状态良好的红耳龟新鲜的有核红细胞血液0.5mL至含有50μL EDTA-K2的无酶无菌1.5mL离心管中,20℃孵育10min。
步骤二:将步骤一的溶液在4℃条件下3000rpm离心10min,弃血浆。
步骤三:向步骤二的离心管中加入1mL 4℃预冷的有核红细胞裂解液,4℃孵育10min。所述的有核红细胞裂解液配制方法:分别称取0.823736g NH
步骤四:将步骤三的溶液4℃条件下3000rpm离心10min,弃上清。
步骤五:向步骤四的离心管中加入1mL 4℃预冷的有核红细胞裂解液,4℃孵育5min。所述的有核红细胞裂解液配制方法同步骤三所述。
步骤六:将步骤五的溶液4℃条件下3000rpm离心10min,弃上清。
步骤七:向步骤六的离心管中加入0.1mL 4℃预冷的无酶无菌PBS,轻微吹打重悬离心管底部的白色沉淀,即获得红耳龟去除有核红细胞的血液单细胞悬液。所述的PBS不包含钙离子、镁离子,PH=7.4。
步骤八:针对步骤七获得的单细胞悬液,利用血球计数板检测细胞浓度,并通过0.4%台盼蓝染色计算细胞活率,如图1-图2所示,活细胞比例达80%以上。
步骤九:针对步骤七获得的单细胞悬液及步骤八获得的细胞浓度及细胞活率,加入合适体积的4℃预冷的无酶无菌PBS稀释单细胞悬液,使细胞终浓度满足10x Genomics上机操作。所述的PBS溶液要求同步骤七所述。
- 一种去除有核红细胞的血液单细胞悬液的制备方法
- 一种用于单细胞测序的膀胱尿路上皮单细胞悬液的制备方法及应用
