一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法及应用
文献发布时间:2023-06-19 11:26:00
技术领域
本发明涉及生物化学技术领域,更具体的,涉及一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法及应用。
背景技术
荧光碳点(简称CDs)是一种具有独特光致发光性能的零维碳纳米材料,作为一种新型材料,其具有尺寸小、光致发光性能好、生物相容性好、细胞毒性小、光化学稳定性好等优点,在生物成像、光催化、传感和纳米药物等方面有着广泛的应用。截至目前,针对荧光碳点这一领域的大部分研究都是关于荧光碳点水溶液的荧光性能及应用,鲜有报道涉及荧光碳点对真菌的抑制作用。
真菌是主要的植物病原菌,在多种水果的生长季节和采后贮藏过程中,会造成严重的产量和质量损失。例如,指状青霉菌是一种常见的侵染性真菌病原菌,它会导致柑橘采后严重的产量损失和品质差,引起绿霉病。目前,控制绿霉病在很大程度上依赖于商业杀菌剂,最常用的商业杀菌剂包括噻吩甲醚、多菌灵和咪唑啉等,但这些商业化学杀菌剂易表现出急性残留毒性,并引起病原体耐药性发展、环境污染和健康危害的问题,因此迫切需要研究和开发安全性能好、抑菌效果好、毒副作用小的新型抗真菌产品。
综上所述,研发一种具有抗真菌性能的2-甲氧基-1,4-萘醌基荧光碳点实为必要。
发明内容
本发明所提供的一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法,主要用于解决目前常用的商业杀菌剂易表现出急性残留毒性,并引起病原体耐药性发展、环境污染和健康危害,迫切需要研发安全性能好、抑菌效果好、毒副作用小的新型抗真菌产品的问题。
为实现上述目的,本发明提供的技术方案如下:
一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法,包括以下步骤:
S1.前驱体溶液配制:称取2-甲氧基-1,4-萘醌置于容器中,然后加入二甲基亚砜,2-甲氧基-1,4-萘醌与二甲基亚砜的用量配比为2:1(mg/mL),用玻璃棒搅拌均匀后,放入超声清洗仪中超声处理8~15分钟至完全溶解;
S2.高温高压反应:将步骤S1所得的前驱体溶液转移至聚氟乙烯高压反应釜中,然后放入高温烘箱中,于100~180℃条件下反应5~10小时后,自然冷却至室温,得到粗产物;
S3.成品收集:将步骤S2所得的粗产物转移至烧杯中,置于真空冷冻干燥机中冻干后,收集的粉末状成品即为抗真菌2-甲氧基-1,4-萘醌基荧光碳点,成品在使用时可以采用二甲基亚砜(DMSO)复溶。
进一步优选的,在步骤S2中,反应温度为120~180℃。
进一步优选的,在步骤S2中,反应时间为6~8小时。
进一步优选的,在步骤S1中,超声处理的时间为10~12分钟。
更进一步的,所述步骤S3得到的抗真菌2-甲氧基-1,4-萘醌基荧光碳点的粒径小于10nm,晶格条纹间距为0.19nm。
本发明的另一个目的在于保护通过上述制备方法制得的抗真菌2-甲氧基-1,4-萘醌基荧光碳点制备方法制得的抗真菌2-甲氧基-1,4-萘醌基荧光碳点在抑制真菌活性方面的应用。
进一步的,作为一种优选应用方式,所述抗真菌2-甲氧基-1,4-萘醌基荧光碳点用于抑制指状青霉菌的活性。
进一步的,作为一种优选应用方式,所述抗真菌2-甲氧基-1,4-萘醌基荧光碳点用于抑制意大利青霉菌的活性。
本发明所提供的抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法中用到的原料特性如下:
2-甲氧基-1,4-萘醌,又名β-甲萘醌、维生素K3,为结晶性粉末状,具有抗癌、抗菌和抗过敏等作用,其生物活性主要源自其高氧化还原电位,2-甲氧基-1,4-萘醌在活细胞中可被黄素酶代谢,多次反应后产生大量活性氧(ROS),最终使真菌细胞损伤或死亡。
二甲基亚砜(DMSO)是一种含硫有机化合物,常温下为无色无臭的透明液体,是一种吸湿性的可燃液体。具有高极性、高沸点、热稳定性好、非质子、与水混溶的特性,能溶于乙醇、丙醇、苯和氯仿等大多数有机物,被誉为“万能溶剂”。二甲基亚砜也是一种渗透性保护剂,能够降低细胞冰点,减少冰晶的形成,减轻自由基对细胞损害,改变生物膜对电解质、药物、毒物和代谢产物的通透性。
本发明以2-甲氧基-1,4-萘醌和二甲基亚砜作为原料制备前驱体,其各自所具有的官能团在高温高压条件下,能发生脱水缩合过程和基于氢键的自组装行为,使尺寸增大,同时在高温烘烤条件下粒子的核心会进一步碳化,从而形成荧光碳点。由于荧光碳点可以在非常宽的光谱范围内有效收集光,从而显示出了强大的光动力效应,光激发的荧光碳点能够产生活性氧(ROS),活性氧能够破坏细菌细胞壁和渗透膜,从而杀死或抑制微生物,体现出抗菌作用。
本发明还通过实验验证了由2-甲氧基-1,4-萘醌合成的荧光碳点对意大利青霉菌和指状青霉菌具有抑制作用,并进一步测定了其最小抑菌浓度(MIC值),可以为抗真菌新型荧光碳点的制备与应用提供科研参考依据。
与现有技术相比,本发明技术方案的有益效果是:
1.本发明提供的抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法设计合理,工艺步骤简单,操作简便可行,反应耗时短,产品结构稳定、纯度高以及具有良好的光学特性等优点;
2.本发明的抗真菌2-甲氧基-1,4-萘醌基荧光碳点制备过程中所使用的原料种类少,易于获取,制备成本低,无需大量使用有毒溶剂,产品安全性能好、抑菌效果好、毒副作用小,且本发明的制备方法具有良好的重复再现性;
3.本发明提供的抗真菌2-甲氧基-1,4-萘醌基荧光碳点用于抑制真菌活性,抗菌效果好,可以有效抑制指状青霉菌和意大利青霉菌的活性,作为一种新型的抗菌剂,具有良好的推广应用前景。
附图说明
图1为原料2-甲氧基-1,4-萘醌以及荧光碳点1-CDs、2-CDs和5-CDs的水合粒径分布图;
图2为实施例1制得的荧光碳点1-CDs的高分辨透射电镜图;
图3为实施例2制得的荧光碳点2-CDs的高分辨透射电镜图;
图4为对比例制得的荧光碳点5-CDs的高分辨透射电镜图;
图5为原料2-甲氧基-1,4-萘醌以及荧光碳点1-CDs、2-CDs和5-CDs的傅里叶变换红外光谱图;
图6为原料2-甲氧基-1,4-萘醌以及荧光碳点1-CDs、2-CDs和5-CDs的X射线光电子能谱图;
图7为原料2-甲氧基-1,4-萘醌以及荧光碳点1-CDs、2-CDs和5-CDs的荧光光谱图;
图8为原料2-甲氧基-1,4-萘醌以及荧光碳点1-CDs、2-CDs和5-CDs的紫外吸收光谱图;
图9为荧光碳点1-CDs、2-CDs对指状青霉菌的抑菌实验效果图;
图10为荧光碳点1-CDs、2-CDs对指状青霉菌的最小抑制浓度测定结果图;
图11为荧光碳点1-CDs、2-CDs对意大利青霉菌的抑菌实验效果图;
图12为荧光碳点1-CDs、2-CDs对意大利青霉菌的最小抑制浓度测定结果图。
具体实施方式
下面通过具体实施方式来进一步说明本发明,以下实施例为本发明较佳的实施方式。应当理解的是,本说明书中描述的实施例仅仅是为了解释本发明而并非为了限定本发明,实施例的参数、比例等可因地制宜做出选择而对结果并无实质性影响,并且任何人在本发明权利要求范围内所做的修改仍在本发明权利要求保护范围之内。因此本发明要求保护的范围并不局限于所述。
若未特别指明,本发明实施例中所用材料、试剂等均为市售商品。
1.主要原料、实验菌株:
①2-甲氧基-1,4-萘醌(生产商:Sigma);
②二甲基亚砜(生产商:麦克林);
③指状青霉菌和意大利青霉菌来自中国科学院华南植物园。
2.主要仪器:
①荧光碳点的形貌特征鉴定采用HRTEM:JEM-2100F透射电子显微镜;
②荧光碳点的结构特性鉴定采用Thermo fisher Scientific K-Alpha+x射线光电子光谱仪以及NicoletAvatar 360傅里叶变换红外光谱仪;
③荧光碳点的水合粒径测定采用梅特勒-托利多激光粒度分析仪;
④荧光碳点的紫外吸收特性测定采用Shimadzu UV-2550紫外可见分光光度计;
⑤荧光碳点的荧光特性测定采用Hitachi FL7000荧光分光光度计。
实施例1:
一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法,包括以下步骤:
S1.前驱体溶液配制:称取500mg 2-甲氧基-1,4-萘醌置于容器中,然后加入250mL二甲基亚砜,用玻璃棒搅拌均匀后,放入超声清洗仪中超声处理10分钟至完全溶解;
S2.高温高压反应:将步骤S1所得的前驱体溶液转移至聚氟乙烯高压反应釜中,然后放入高温烘箱中,于120℃条件下反应6小时后,自然冷却至室温,得到粗产物;
S3.成品收集:将步骤S2所得的粗产物转移至烧杯中,置于真空冷冻干燥机中冻干后,收集的粉末状成品即为2-甲氧基-1,4-萘醌基荧光碳点,将其命名为1-CDs。
实施例2:
一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法,包括以下步骤:
S1.前驱体溶液配制:称取600mg 2-甲氧基-1,4-萘醌置于容器中,然后加入300mL二甲基亚砜,用玻璃棒搅拌均匀后,放入超声清洗仪中超声处理15分钟至完全溶解;
S2.高温高压反应:将步骤S1所得的前驱体溶液转移至聚氟乙烯高压反应釜中,然后放入高温烘箱中,于180℃条件下反应6小时后,自然冷却至室温,得到粗产物;
S3.成品收集:将步骤S2所得的粗产物转移至烧杯中,置于真空冷冻干燥机中冻干后,,收集的粉末状成品即为2-甲氧基-1,4-萘醌基荧光碳点,将其命名为2-CDs。
实施例3:
一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法,包括以下步骤:
S1.前驱体溶液配制:称取550mg 2-甲氧基-1,4-萘醌置于容器中,然后加入275mL二甲基亚砜,用玻璃棒搅拌均匀后,放入超声清洗仪中超声处理12分钟至完全溶解;
S2.高温高压反应:将步骤S1所得的前驱体溶液转移至聚氟乙烯高压反应釜中,然后放入高温烘箱中,于100℃条件下反应10小时后,自然冷却至室温,得到粗产物;
S3.成品收集:将步骤S2所得的粗产物转移至烧杯中,置于真空冷冻干燥机中冻干后,收集的粉末状成品即为2-甲氧基-1,4-萘醌基荧光碳点,将其命名为3-CDs。
实施例4:
一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法,包括以下步骤:
S1.前驱体溶液配制:称取500mg 2-甲氧基-1,4-萘醌置于容器中,然后加入250mL二甲基亚砜,用玻璃棒搅拌均匀后,放入超声清洗仪中超声处理8分钟至完全溶解;
S2.高温高压反应:将步骤S1所得的前驱体溶液转移至聚氟乙烯高压反应釜中,然后放入高温烘箱中,于150℃条件下反应5小时后,自然冷却至室温,得到粗产物;
S3.成品收集:将步骤S2所得的粗产物转移至烧杯中,置于真空冷冻干燥机中冻干后,收集的粉末状成品即为2-甲氧基-1,4-萘醌基荧光碳点,将其命名为4-CDs。
对比例:
一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法,包括以下步骤:
S1.前驱体溶液配制:称取600mg 2-甲氧基-1,4-萘醌置于容器中,然后加入300mL二甲基亚砜,用玻璃棒搅拌均匀后,放入超声清洗仪中超声处理10分钟至完全溶解;
S2.高温高压反应:将步骤S1所得的前驱体溶液转移至聚氟乙烯高压反应釜中,然后放入高温烘箱中,于200℃条件下反应6小时后,自然冷却至室温,得到粗产物;
S3.成品收集:将步骤S2所得的粗产物转移至烧杯中,置于真空冷冻干燥机中冻干后,收集得到粉末状成品,命名为5-CDs。
为鉴定和验证本发明所制得的抗真菌2-甲氧基-1,4-萘醌基荧光碳点的结构特征及性能,特以实施例2、实施例5以及实施例6所制备的抗真菌2-甲氧基-1,4-萘醌基荧光碳点为例,设置以下实验例分别对其形貌特征、结构特性、光学特性以及抗真菌活性进行测定和分析。
实验例1:
实验例1以2-甲氧基-1,4-萘醌(附图中均以Raw material表示)和实施例1、实施例2以及对比例所制得的荧光碳点(1-CDs、2-CDs以及5-CDs)为例,采用HRTEM:JEM-2100F透射电子显微镜对其形貌特征进行测定。
分别称取适量的原料2-甲氧基-1,4-萘醌以及等量的1-CDs、2-CDs和5-CDs,用去离子水将其溶解后,采用梅特勒-托利多激光粒度分析仪测定的各物质水合粒径,结果如图1所示。
由图1可见,本发明实施例1、实施例2所制备的荧光碳点1-CDs、2-CDs在水中的分散性更均匀,平均水合粒径更小。
此外,将1-CDs,、2-CDs和5-CDs三种荧光碳点置于透射电子显微镜下进行观察,所得到1-CDs、2-CDs和5-CDs各自对应的高分辨透射电镜图如图2~4所示。
由图2~4可以观察到荧光碳点的形态和晶格条纹,实施例1、实施例2所制备的荧光碳点1-CDs、2-CDs荧光碳点均呈球形颗粒状,具有良好的单分散性,平均粒径为4nm,晶格条纹间距为0.19nm,对应于石墨烯平面,表明其中包含类石墨结构,但对比例所制备的荧光碳点5-CDs的单分散性较差。
实验例2:
实验例2以实施例1、实施例2、对比例所制得的荧光碳点(1-CDs、2-CDs、5-CDs)以及原料2-甲氧基-1,4-萘醌为例,采用傅里叶变换红外光谱(FT-IR)和X射线光电子能谱(XPS)鉴定其结构特性并分析其化学组成,所得的傅立叶变换红外光谱如图5所示(图中纵坐标表示透射比,横坐标表示波长)。
由图5可见,显示1-CDs、2-CDs以及5-CDs的表面皆包含C-H(2918cm
实验例2中全XPS扫描所得的X射线光电子能谱分别如图6所示(其中a、b、c图为1-CDs的X射线光电子能谱图;d、e、f图为2-CDs的X射线光电子能谱图;g、h、i图为5-CDs的X射线光电子能谱图;j、k、l图为2-甲氧基-1,4-萘醌的X射线光电子能谱图),图6中的纵坐标“Intensity”表示相对强度,横坐标“Binding Energy”表示结合能。
由图6可见,1-CDs、2-CDs、5-CDs以及2-甲氧基-1,4-萘醌中均存在C1s、O 1s等构成元素,有284eV、531eV两个对应峰。2-甲氧基-1,4-萘醌中的C1s、O 1s原子比为71.36%、28.64%;1-CDs的C1s、O 1s原子比为79.25%,20.75%;2-CDs的C1s、O 1s原子比为83.34%,16.66%;5-CDs的C1s、O 1s原子比为88.35%,11.65%。
从原料2-甲氧基-1,4-萘醌及荧光碳点的C/O原子比可以看出,随着温度升高,碳含量逐渐升高,碳点的碳化程度也逐渐升高,说明碳点的形成伴随着碳化脱水过程。在原料2-甲氧基-1,4-萘醌与三种碳点(1-CDs、2-CDs、5-CDs)的C、O的XPS高分辨图谱中,三种碳点皆形成了C-O键,说明加热可以使2-甲氧基-1,4-萘醌的C=O分解。总之可见,X射线光电子能谱的分谱元素及基团分析与傅里叶变换红外光谱基团分析高度一致。
实验例3:
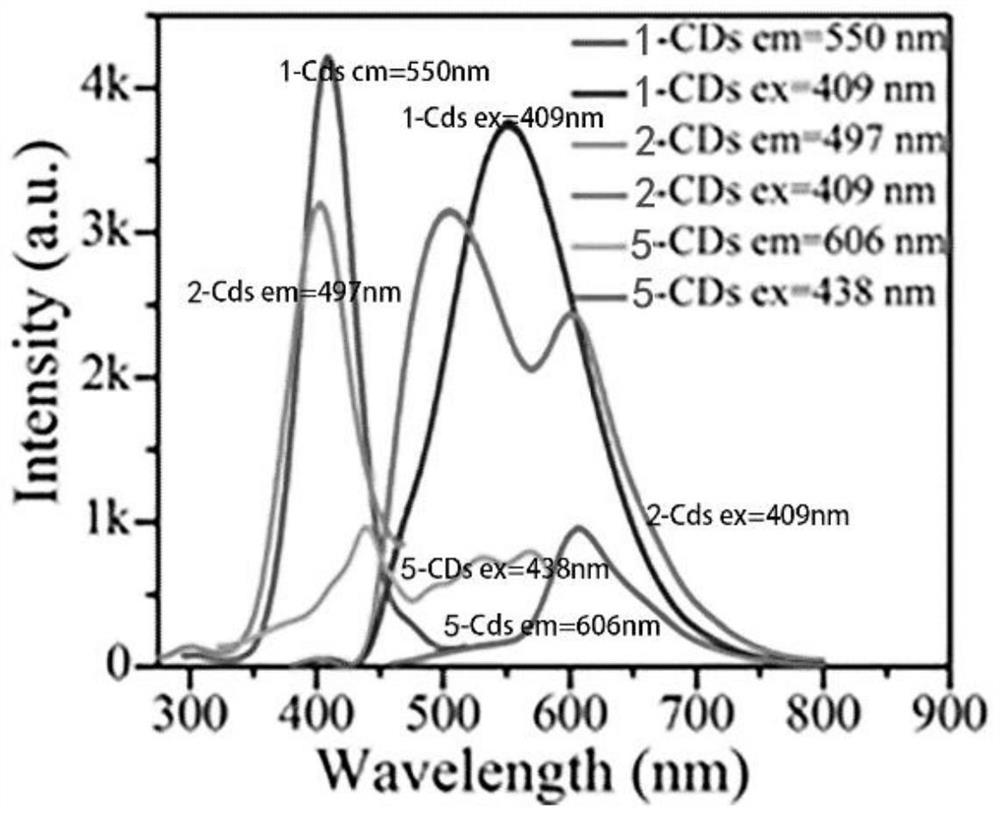
实验例3以实施例1、实施例2以及对比例所制得的荧光碳点(1-CDs、2-CDs以及5-CDs)以及原料2-甲氧基-1,4-萘醌为例,采用Hitachi FL7000荧光分光光度计对其荧光特性进行测定分析,结果如图7所示(纵坐标“Intensity”为相对强度,横坐标“BindingEnergy”为结合能)。
由图7可见,1-CDs的最佳发射在550nm,最佳激发在409nm;2-CDs具有分别位于497nm及602nm的双发射峰,且最佳发射在497nm,最佳激发在409nm;5-CDs的最佳发射在606nm,最佳激发在438nm,而原料2-甲氧基-1,4-萘醌在254nm以及365nm激发下均检测不到荧光信号,说明本发明制得的荧光碳点具有明显的荧光特性。
此外,实验例3还以实施例1、实施例2以及对比例所制得的荧光碳点(1-CDs、2-CDs以及5-CDs)为例,采用Shimadzu UV-2550紫外可见分光光度计对其紫外吸收特性进行测定分析,结果如图8所示。
由图8可见,原料2-甲氧基-1,4-萘醌、1-CDs以及2-CDs在275nm处呈现主要吸收峰;而5-CDs的吸收峰更宽,在255~275nm处呈现主要的吸收峰。而且与原料2-甲氧基-1,4-萘醌不同的是:1-CDs和2-CDs在332nm处具有更强的吸收。
实验例4:
实验例4是以实施例1和实施例2所制得的荧光碳点(1-CDs、2-CDs)为例,验证荧光碳点对指状青霉菌活性的抑制效果,并测定最小抑菌浓度(MIC值)。实验操作如下:
①将配制好的PDA培养基(PDA,20g/L琼脂,20g/L葡萄糖,200g/L马铃薯提取物)放置于锥形瓶中,在121℃条件下灭菌20min;在28℃以及无菌环境下将经过灭菌的PDA培养基倒入培养皿上,制备多个PDA平板,在PDA平板上常规维持指状青霉菌;
②用无菌水冲洗PDA平板上的孢子,并将孢子稀释到1×10
③将定量滤纸打成直径约6mm的小圆纸片,在121℃下灭菌21min,然后将实施例1和实施例2所制得的荧光碳点(1-CDs和2-CDs)用二甲基亚砜(DMSO)溶解配制成5μg/mL的样液,并以2-甲氧基-1,4-萘醌溶液作为对比样液,将配制的荧光碳点样液以及对比样液用移液枪润湿在经过灭菌处理的纸片上,将纸片移植到PDA培养皿上,并在对应纸片做好荧光碳点标记,后在28℃下培养2天,观察荧光碳点的抑菌情况,实验结果如图9所示,可以看出荧光碳点1-CDs和2-CDs周围均产生了明显的抑菌圈。
为进一步测定本发明制得的荧光碳点对指状青霉菌的最小抑菌浓度(MIC值),特将荧光碳点1-CDs用二甲基亚砜(DMSO)溶解配制成0、0.7μg/mL、1.4μg/mL、2.8μg/mL、5.6μg/mL、11.2μg/mL、22.4μg/mL和44.8μg/mL的样液,将荧光碳点2-CDs用二甲基亚砜(DMSO)溶解配制成0、0.5μg/mL、1μg/mL、2μg/mL、4μg/mL、8μg/mL和16μg/mL的样液,并以二甲基亚砜(DMSO)作为对比样液,将配制的不同浓度的荧光碳点样液用移液枪加到PDA培养皿上,设置各个浓度对应的实验组以及对照组,每个实验组以及对照组各设3个重复试验,所有实验组以及对照组均在28℃下培养2天,观察抑菌效果,结果如图10所示。
由图10可见,针对荧光碳点1-CDs,对照组以及荧光碳点浓度为0、0.7μg/mL的实验组的培养基浑浊,说明指状青霉菌正常生长,而荧光碳点浓度为1.4μg/mL、2.8μg/mL、5.6μg/mL、11.2μg/mL、22.4μg/mL和44.8μg/mL的实验组的培养基清澈,表明无指状青霉菌生长;针对荧光碳点2-CDs,对照组以及荧光碳点浓度为0、1μg/mL、2μg/mL的实验组的培养基浑浊,说明指状青霉菌正常生长,而荧光碳点浓度为4μg/mL、8μg/mL、16μg/mL的实验组的培养基清澈,表明无指状青霉菌生长。
综上所述,可以得出荧光碳点1-CDs和2-CDs对指状青霉菌的最小抑菌浓度(MIC值)分别为1.4~2.8μg/mL和4~8μg/mL。
实验例5:
实验例5是以实施例1和实施例2所制得的荧光碳点(1-CDs、2-CDs)为例,验证荧光碳点对意大利青霉菌活性的抑制效果,并测定最小抑菌浓度(MIC值)。实验操作如下:
①将配制好的PDA培养基(PDA,20g/L琼脂,20g/L葡萄糖,200g/L马铃薯提取物)放置于锥形瓶中,在121℃条件下灭菌20min;在28℃以及无菌环境下将经过灭菌的PDA培养基倒入培养皿上,制备多个PDA平板,在PDA平板上常规维持意大利青霉菌;
②用无菌水冲洗PDA平板上的孢子,并将孢子稀释到1×10
③将定量滤纸打成直径约6mm的小圆纸片,在121℃下灭菌21min,然后将实施例1和实施例2所制得的荧光碳点(1-CDs和2-CDs)用二甲基亚砜(DMSO)溶解配制成5μg/mL的样液,并以2-甲氧基-1,4-萘醌溶液作为对比样液,将配制的荧光碳点样液以及对比样液用移液枪润湿在经过灭菌处理的纸片上,将纸片移植到PDA培养皿上,并在对应纸片做好荧光碳点标记,后在28℃下培养2天,观察荧光碳点的抑菌情况,实验结果如图11所示,可以看出荧光碳点1-CDs和2-CDs周围均产生了明显的抑菌圈。
为进一步测定本发明制得的荧光碳点对意大利青霉菌的最小抑菌浓度(MIC值),特将荧光碳点1-CDs用二甲基亚砜(DMSO)溶解配制成0、0.7μg/mL、1.4μg/mL、2.8μg/mL、5.6μg/mL、11.2μg/mL、22.4μg/mL和44.8μg/mL的样液,将荧光碳点2-CDs用二甲基亚砜(DMSO)溶解配制成0、0.5μg/mL、1μg/mL、2μg/mL、4μg/mL、8μg/mL和16μg/mL的样液,并以二甲基亚砜(DMSO)作为对比样液,将配制的不同浓度的荧光碳点样液用移液枪加到PDA培养皿上,设置各个浓度对应的实验组以及对照组,每个实验组以及对照组各设3个重复试验,所有实验组以及对照组均在28℃下培养2天,观察抑菌效果,结果如图12所示。
由图12可见,针对荧光碳点1-CDs,对照组以及荧光碳点浓度为0、0.7μg/mL的实验组的培养基浑浊,说明意大利青霉菌正常生长,而荧光碳点浓度为1.4μg/mL、2.8μg/mL、5.6μg/mL、11.2μg/mL、22.4μg/mL、44.8μg/mL的实验组的培养基清澈,表明无意大利青霉菌生长;针对荧光碳点2-CDs,对照组以及荧光碳点浓度为0、0.5μg/mL、1μg/mL的实验组的培养基浑浊,说明意大利青霉菌正常生长,而荧光碳点浓度为2μg/mL、4μg/mL、8μg/mL、16μg/mL的实验组的培养基清澈,表明无意大利青霉菌生长。
从而得出荧光碳点1-CDs和2-CDs对意大利青霉菌的最小抑菌浓度(MIC值)分别为1.4~2.8μg/mL和2~4μg/mL。
综上所述,本发明提供的制备方法所制得的2-甲氧基-1,4-萘醌基荧光碳点具有良好的抗真菌效果,尤其是对指状青霉菌和意大利霉菌的活性具有良好的抑制效果。本发明中的实验过程和结果也对荧光碳点作为抗菌剂的进一步研发和应用提供了科研参考依据。
本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施例的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施例予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法及应用
- 一种抗真菌2-甲氧基-1,4-萘醌基荧光碳点的制备方法及应用
