肿瘤细胞迁移能力的分析、分选的微流控芯片及制备工艺
文献发布时间:2023-06-19 11:30:53
技术领域
本发明涉及细胞迁移能力分析技术领域,特别涉及肿瘤细胞迁移能力的分析、分选的微流控芯片及制备工艺。
背景技术
细胞的异质性(Heterogeneity)广泛存在于干细胞分化,肿瘤发生,药物代谢和免疫应答等过程当中。这是指同一来源的细胞群中,每个单细胞的基因组或功能都是不一样的。科学家们越来越认识到所谓“平均”状态下的细胞生物学并不能满足功能和机制发明的需要,这些方法往往掩盖了细胞间的差异性,阻碍我们在肿瘤转移上理解生物个体的复杂性和异质性。因此,从单细胞水平上进行肿瘤细胞的发明是非常必要的。
针对目前细胞迁移能力的分析方法主要为划痕实验和transwell实验,这些方法能够对群体细胞的迁移能力进行平均测量,实验结果由于对结果的平均化处理,可能会掩盖来自于单个或少数细胞功能性的关键信息,同时由于缺乏相应的细胞回收手段,难以靶向分析特定迁移表型的细胞,无法进一步挖掘细胞迁移背后的分子机制。
目前单细胞分析技术主要包括显微操作,流式细胞术等方法,但是这些方法在技术上存在操作繁琐、对细胞造成机械损伤、价格昂贵等问题。
发明内容
本发明的目的在于提供肿瘤细胞迁移能力的分析、分选的微流控芯片及制备工艺,同时实现迁移能力的单细胞分析,并根据其特定的迁移能力实现细胞分选,可以提供更加详尽的细胞迁移能力信息,以解决上述背景技术中提出的问题。
为实现上述目的,本发明提供如下技术方案:
肿瘤细胞迁移能力的分析、分选的微流控芯片,包括细胞进样通道、化学浓度梯度通道、迁移通道和微型钩子,所述细胞进样通道的两个分支通过迁移通道连接化学浓度梯度通道,所述细胞进样通道与迁移通道的连接处设置有微型钩子,所述细胞进样通道的顶端具有细胞进样入口,所述化学浓度梯度通道的底端具有化合物进样入口,化学浓度梯度通道的中部具有细胞进样出口,化学浓度梯度通道的顶端具有化合物进样出口。
进一步地,所述细胞进样入口采取50-200μm宽、400-600μm长的入口通道。
进一步地,所述化学浓度梯度通道生成通道的规格为7500×200μm的尺寸,每个浓度梯度生成通道至少连接着20-40个单细胞迁移通道。
进一步地,所述微型钩子的直径为5-20μm,微型钩子在细胞进样通道的内部形成单细胞分离单元。
本发明提供的另一种方案:肿瘤细胞迁移能力的分析、分选的微流控芯片的制备工艺,包括如下步骤:
步骤1:采用光刻法制备微流控芯片的模具;
步骤2:芯片的模板制备完后,经过模板预处理,在基片上涂覆光刻胶SU-8进行光刻;
步骤3:在步骤2的基片上采用UV显影固化,最后键合玻璃在基片上得到微流控芯片。
进一步地,微流控芯片模板制作的步骤如下:以直径为4英寸的单抛硅片作为模版基片,使用负性光刻胶制作微流控芯片的模板。
进一步地,微流控芯片的操作方法包括如下步骤:
第一步:启动主入口,通过微量注射泵,把细胞悬液通入到微通道中,在捕获微通道和微型钩子结构的作用下被捕获于相应捕获位点;
第二步:在大多数单细胞被微型钩子捕获后,采用低血清培养基(1%)以洗涤通道内未捕获的细胞,所有废液均从出口流出;
第三步:配置合适浓度的EGF溶液,并将TRITC-Dextran加入到EGF溶液来检测化学浓度梯度,将EGF溶液和低血清细胞培养液通入到芯片的化学浓度梯度生成通道的入口,测量化学浓度梯度通道中荧光染料的强度分布并验证梯度的形成;
第四步:待大多数细胞都被单细胞分离后且微通道已经没有其他细胞,封闭所有出入口,把芯片置于倒置显微镜配套的显微镜恒温台,使用倒置显微镜对整个芯片内的所有单细胞进行观察,确定细胞的单细胞捕获率,然后开启显微镜的实时观察模式,按每15min拍一次照的速度记录所有单细胞的迁移轨迹和迁移距离,从而实现动态分析的功能;
第五步:当细胞在培养装置中培养了16h后,将芯片取出,根据细胞是否能在16h后通过迁移通道到达化学浓度梯度通道分为两种细胞分群,即细胞的迁移速度是否大于62.5μm/h,划分为强迁移细胞和弱迁移细胞,首先启动主入口,利用微量注射泵缓慢将20μLPBS缓慢通入芯片中约2分钟,来洗涤整个微通道,然后继续往入口通入50μL 0.25%胰蛋白酶约5分钟,孵育5-15分钟后,可观察到大部分细胞从原来的贴壁状态转换为悬浮状态,再往入口通入PBS,所有单细胞将流向相应的出口,利用移液枪即可在对应的出口中收集到目标细胞。
与现有技术相比,本发明的有益效果是:
1.可以对单个细胞的迁移能力进行实时动态的分析,并对其单细胞迁移能力进行量化和比较,能够有效地区分强迁移细胞和弱迁移细胞,并从异质性细胞群体中分选出特定迁移能力的细胞亚群。
2.相较于其他联合其他技术(如抗体免疫磁珠技术、电场分离技术和超声波操控技术等)的微流控芯片单细胞迁移分析方法,该芯片仅通过芯片内设计合适的单细胞分离阵列,即可实现无标记式的单细胞分离。
3.区别于传统的群体细胞迁移分析方法,实现了芯片上的单细胞迁移分析,排除了细胞与细胞间的相互作用,能够以单细胞分析为导向对肿瘤细胞的单细胞迁移能力进行发明。
附图说明
图1为本发明的微流控芯片的总体设计和细节结构示意图;
图2为本发明图1的局部放大图;
图3为本发明的微流控芯片的结构设计示意图;
图4为本发明的微流控芯片的模具制备的步骤示意图;
图5为本发明的微流控芯片制备的示意图;
图6为本发明的利用相场法对流体在芯片结果内的流动进行建模和分析结果示意图;
图7为本发明的微流控芯片内部的显微摄像图;
图8为本发明的单细胞分离能力和迁移能力进行检测结果示意图;
图9为本发明的细胞的迁移距离示意图。
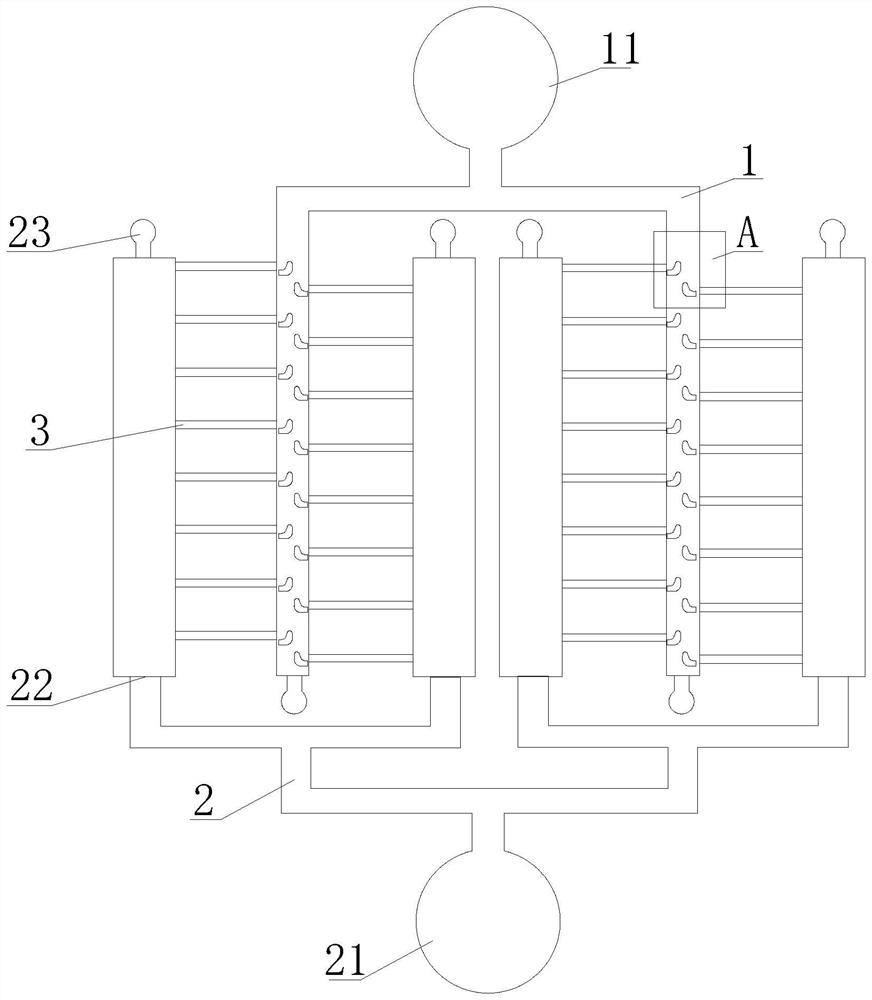
图中:1、细胞进样通道;11、细胞进样入口;2、化学浓度梯度通道;21、化合物进样入口;22、细胞进样出口;23、化合物进样出口;3、迁移通道;4、微型钩子。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
参阅图1-2,肿瘤细胞迁移能力的分析、分选的微流控芯片,包括细胞进样通道1、化学浓度梯度通道2、迁移通道3和微型钩子4,所述细胞进样通道1的两个分支通过迁移通道3连接化学浓度梯度通道2,所述细胞进样通道1与迁移通道3的连接处设置有微型钩子4,所述细胞进样通道1的顶端具有细胞进样入口11,化学浓度梯度通道2的底端具有化合物进样入口21,化学浓度梯度通道2的中部具有细胞进样出口22,化学浓度梯度通道2的顶端具有化合物进样出口23。
参阅图3,细胞进样入口11采取了50-200μm宽、400-600μm长的入口通道,利用液流分离的原理实现细胞分散,将群体细胞逐渐分离成5-10个细胞/1个微通道的形式,有利于后续捕获微通道的单细胞捕获。
化学浓度梯度通道2生成通道的规格为7500×200μm的尺寸,每个浓度梯度生成通道至少连接着20-40个单细胞迁移通道,通道内的化合物在层流作用下逐渐扩散,形成浓度不同的化学诱导物,足够驱使细胞进样通道内的单细胞朝化学浓度梯度通道作迁移。
微型钩子4可以在通道内产生流速差和空间位阻,实现单细胞的分离。通过设计勾子的直径为5-20μm,正好符合细胞的最小直径,可以很容易的被细胞占领。同时设计了40μm宽、1000μm长的尺度的迁移微通道作为单细胞迁移区域,保证细胞有足够的空间进行迁移,微型钩子4在细胞进样通道1的内部形成单细胞分离单元。
细胞捕获通道末端和化学梯度生成末端均设置独立的出口,用于单细胞迁移后的细胞分选,该设计同时也能保证每个捕获微通道的微环境是相互独立的。细胞迁移达到我们预先设计的时间终点后,我们可以根据实验目的,在芯片的入口通入0.25%胰蛋白酶来使细胞恢复悬浮状态,再通过微流体冲刷即可将微通道中的细胞从出口上收集下来。
微流控芯片模板制作步骤为:本发明采用AutoCAD软件对芯片的微通道层结构进行绘制和设计。本发明采用光刻法制备微流控芯片的模具(图4),以直径为4英寸的单抛硅片作为模版基片,使用负性光刻胶(SU-83025)制作微流控芯片的模版。
微流控芯片的制备包括如下步骤:
芯片的模板制备完后,经过模版预处理→PDMS软光刻→固化→打孔→前处理→键合等操作(图5),将芯片模板上的微图案复刻到PDMS芯片上,以光滑玻璃片为基底,制作该项目所需要的微流控芯片。
微流控芯片的操作方法包括如下步骤:
第一步:启动主入口,通过微量注射泵,把细胞悬液通入到微通道中,在捕获微通道和微型钩子4结构的作用下被捕获于相应捕获位点;
第二步:在大多数单细胞被微型钩子4捕获后,采用低血清培养基(1%)以洗涤通道内未捕获的细胞,所有废液均从出口流出;
第三步:配置合适浓度的EGF溶液,并将TRITC-Dextran加入到EGF溶液来检测化学浓度梯度,将EGF溶液和低血清细胞培养液通入到芯片的化学浓度梯度生成通道的入口,测量化学浓度梯度通道2中荧光染料的强度分布并验证梯度的形成;
第四步:待大多数细胞都被单细胞分离后且微通道已经没有其他细胞,封闭所有出入口,把芯片置于倒置显微镜配套的显微镜恒温台,使用倒置显微镜对整个芯片内的所有单细胞进行观察,确定细胞的单细胞捕获率,然后开启显微镜的实时观察模式,按每15min拍一次照的速度记录所有单细胞的迁移轨迹和迁移距离,从而实现动态分析的功能;
第五步:当细胞在培养装置中培养了16h后,将芯片取出,根据细胞是否能在16h后通过迁移通道3到达化学浓度梯度通道2分为两种细胞分群,即迁移速度是否大于62.5μm/h,划分为强迁移细胞和弱迁移细胞,首先启动主入口,利用微量注射泵缓慢将20μLPBS缓慢通入芯片中约2分钟,来洗涤整个微通道,然后继续往入口通入50μL 0.25%胰蛋白酶约5分钟,孵育5-15分钟后,可观察到大部分细胞从原来的贴壁状态转换为悬浮状态,再往入口通入PBS,所有单细胞将流向相应的出口,利用移液枪即可在对应的出口中收集到目标细胞。
(1)微流控芯片已成功制备并初步结构验证
本发明提出的微流控芯片内部的显微摄像图如图6所示,可以看到目前获得的PDMS芯片具有完整的捕获位点、迁移通道和化学浓度梯度生成通道。在细胞进样通道内,由于钩子结构的直径为14μm,且勾子和PDMS墙壁之间的最小距离为3μm,远小于旁路通道的直径(20μm),在微流体和流速差的作用下,可以在微流控芯片内的微米级空间上捕获单细胞。迁移通道为大约在1000μm左右的直微通道,该设计不仅可以为单细胞迁移提供足够的空间也能间接地在通道内形成一定的化学浓度梯度,从而驱使肿瘤细胞沿着一个方向往前迁移。
图6中,微流控芯片的结构细节图,芯片主要由细胞进样主通道和化学浓度梯度主通道构成,每两个主通道之间会交错着数个单细胞迁移通道,在细胞进样通道和单细胞迁移通道的交汇处,设计独立的单细胞分离单元,用于单细胞的捕获。
(2)微流控芯片可实现单细胞分离
进一步采用MDA-MB-231/GFP细胞对该芯片的单细胞分离能力和迁移能力进行检测,结果显示(图7),该微结构可以很好的将细胞捕获并分离于勾子结构上。通过发明细胞密度和微流体流速对单细胞捕获的影响,最后,确定最佳细胞密度为5×10
(3)微流控芯片可实现乳腺癌细胞的单细胞迁移分析
经过0.5h的培养,细胞能够在芯片内贴壁。再在芯片内引入0.5mg/mL的EGF化学诱导物后,细胞逐渐在微通道内进行迁移运动,并朝着浓度梯度通道方向作迁移运动。采用了一套基于奥林巴斯IX83倒置显微镜及其配套软件(Cellsens Dimension)的数据采集方法,通过在整个实验期间实时监测细胞在迁移微通道的位置,可以容易地获得每个细胞的迁移距离(图8)。
图8中,微流控芯片上细胞在微通道内进行单细胞迁移,图8a显示单个细胞分别在0、0.5和16h在微通道内的位置,通过计算细胞在微通道内的位置可以测量出细胞在单位时间内的迁移距离;图8b和8c分别为MDA-MB-231细胞的每个细胞的单细胞迁移距离的箱式图以及弱迁移细胞和强迁移细胞的细胞分群比例结果,可以看出MDA-MB-231细胞的迁移能力。
综上,本发明通过微结构设计,利用进样时于微通道中产生的微流体流速差,来实现细胞的单细胞分离。同时利用独立设计的迁移微通道,使整体微通道阵列处于一个各自分离状态,从而达到每个单细胞都独享各自的微环境。同时,微通道的长度也保证了每个细胞具有足够的空间进行迁移运动。与显微系统整合后,可以实时对细胞的迁移路径和迁移形态进行数据收集,并对其进行分析得到每个细胞的迁移能力、迁移能力之间的个体差异和强/弱迁移细胞亚群比率。另外,通过微流体操作可以富集特定迁移能力的细胞亚群,以用作后续的分子生物学发明。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 肿瘤细胞迁移能力的分析、分选的微流控芯片及制备工艺
- 一种基于微流控芯片的肿瘤细胞迁移动力学监测方法
