包含布洛芬和磷酸盐缓冲剂的用于肠胃外施用的药物组合物
文献发布时间:2023-06-19 11:39:06
技术领域
本发明涉及用于肠胃外施用的布洛芬组合物。特别地,本发明涉及包含布洛芬或其药学上可接受的盐和磷酸盐缓冲剂的药物组合物及其医学用途,所述布洛芬组合物在塑料容器中。
背景技术
疼痛管理和发热的控制是医院中术后病人护理的关键要素。几种镇痛药可用于口服、局部和肠胃外应用。在这种背景下,布洛芬由于其高功效和良好安全性而成为优选的选择。对允许用于通过静脉输注的短期治疗的制剂存在新兴需求。
用于肠胃外用途的布洛芬制剂可以浓缩物的形式获得。然而,它们需要额外的步骤(例如稀释步骤)以便获得即时用于注射的溶液。
对更容易处理并且允许方便和安全应用的即时可用的肠胃外布洛芬制剂存在需求。理想地,这样的制剂被储存在容器中,所述容器也容易、方便且安全的使用,诸如塑料容器。
发明内容
发明人惊奇地发现,与包含较高量磷酸盐缓冲剂和较高比例磷酸盐缓冲剂比布洛芬的布洛芬制剂相比,包含相对低量磷酸盐缓冲剂和相对低比例磷酸盐缓冲剂比布洛芬的布洛芬制剂稳定,且对于患者更方便。有利地,这样的制剂可以被储存在塑料容器中。
因此,在本发明的一方面,提供了用于肠胃外施用的药物组合物,其包含
a)布洛芬或其药学上可接受的盐,和
b)磷酸盐缓冲剂,
其中布洛芬或其药学上可接受的盐的浓度在15-25mmol/l的范围中,并且其中磷酸盐与布洛芬的摩尔比在0.35:1至0.37:1的范围中。
在本发明的另一方面,提供了用于肠胃外施用的药物组合物,其包含
a)布洛芬或其药学上可接受的盐,和
b)磷酸盐缓冲剂,
其中布洛芬或其药学上可接受的盐的浓度在2-6g/l的范围中,并且其中磷酸盐与布洛芬的摩尔比在0.35:1至0.37:1的范围中。
在本发明的又一方面,提供了在塑料容器中的如本说明书中所定义的药物组合物。
在本发明的又一个方面,提供了用于治疗疼痛和/或减少发热的如本说明书中所定义的药物组合物。
有利地,本发明的药物组合物即时可用,且因此易于处理。本发明的组合物允许以所需剂量方案对需要其的患者方便且安全的肠胃外施用布洛芬。有利地,所述药物组合物既不需要大量的缓冲剂,也不需要存在可能引起吸附到塑料容器上的赋形剂(例如氨基酸)。
发明详述
药物组合物
本发明的药物组合物包含布洛芬或其药学上可接受的盐。布洛芬是本领域技术人员已知的。布洛芬的优选的盐是钠、钾、锂或铵盐。布洛芬的更优选的盐是钠或钾盐。布洛芬的特别优选的盐是钠盐。
本发明的药物组合物包含磷酸盐缓冲剂。本领域技术人员知道什么是磷酸盐缓冲剂。如本说明书中所用的磷酸盐缓冲剂是指包含磷酸盐、磷酸氢盐、磷酸二氢盐和/或磷酸的缓冲系统。
本发明的药物组合物包含特定比例的布洛芬或其药学上可接受的盐和磷酸盐缓冲剂。如本说明书中所用,磷酸盐与布洛芬的摩尔比是指布洛芬及其药学上可接受的盐的摩尔数与磷酸盐、磷酸氢盐、磷酸二氢磷酸酯和磷酸的摩尔总数的比例。例如,在包含19.4mmol/l布洛芬或其药学上可接受的盐、5.0mmol/l磷酸二氢钠和2.0mmol/l磷酸氢二钠的组合物中,如本说明书中所用的磷酸盐与布洛芬的摩尔比为0.36。
如果没有另外的说明,则表述“mmol/l”是指“mmol每l的药物组合物”。如果没有另外说明,则表述“g/l”是指“g每l的药物组合物”。特别地,本说明书中所给出的布洛芬和磷酸盐缓冲剂浓度是基于药物组合物的总体积。
本发明的药物组合物用于肠胃外施用。优选地,所述药物组合物用于静脉内施用。
磷酸盐与布洛芬的摩尔比在0.35:1至0.37:1的范围中。
优选地,磷酸盐缓冲剂包含三碱金属磷酸盐、二碱金属磷酸氢盐和/或碱金属磷酸二氢盐,更优选二碱金属磷酸盐和/或碱金属二氢磷酸盐。
如本说明书中所用的碱金属优选地是指锂(Li)、钠(Na)或钾(K),更优选钠或钾,特别优选钠。
在特别优选的实施方案中,所述磷酸盐缓冲剂包含磷酸二氢钠和磷酸氢二钠。磷酸二氢钠可以例如以水合物的形式被使用,诸如二水合物(NaH
在根据本发明的药物组合物中的磷酸盐缓冲剂的量优选地以允许用于储存稳定的组合物制备的方式被调节。通常,基于药物组合物的总体积,磷酸盐缓冲剂的浓度在4-10mmol/l的范围中,优选在5-9mmol/l的范围中,更优选在6-8mmol/l的范围中。
药物组合物可以包含碱化剂和/或酸化剂,以便根据用于肠胃外施用的溶液的要求调节所述药物组合物的pH。碱化剂(特别优选氢氧化钠)也可以被用于增溶布洛芬。在一个实施方案中,所述药物组合物包含碱化剂。优选地,所述碱化剂选自碳酸钠、碳酸钾、碳酸氢钠、碳酸氢钾、氢氧化钠和氢氧化钾,优选氢氧化钠。在另一个实施方案中,所述药物组合物包含酸化剂,优选盐酸。
优选地,本发明的药物组合物的pH在6.5至8.2的范围中,更优选在7.2-8.0的范围中,甚至更优选在7.4-7.8的范围中。
通常,基于药物组合物的总体积,布洛芬或其药学上可接受的盐的浓度在2-6g/l的范围中,优选在3-5g/l的范围中,更优选在3,5-4.5g/l的范围中。同样通常,基于药物组合物的总体积,布洛芬或其药学上可接受的盐的浓度在15-25mmol/l的范围中,优选在17-23mmol/l的范围中,更优选在19-20mmol/l的范围中。
优选地,所述药物组合物包含张力调节剂,以便根据用于肠胃外施用的溶液的要求调节所述药物组合物的张力。合适的张力调节剂是本领域技术人员已知的。优选的张力调节剂是甘油、丙二醇、山梨糖醇、甘露糖醇、右旋糖、乳糖、氯化钾或氯化钠。更优选的张力剂是甘油、丙二醇或氯化钠。特别优选的张力剂是氯化钠。
在一个实施方案中,所述药物组合物不包含氨基酸或其盐和/或有机胺或其盐。
优选地,所述药物组合物是含水组合物。通常,含水组合物是包含水的组合物。在这样优选的实施方案中,基于药物组合物的总体积,所述药物组合物的水含量通常在50-100体积%的范围中,更优选在80-100体积%的范围中,甚至更优选在90-100体积%的范围中,特别优选在95-100体积%的范围中,例如,在99-100体积%的范围中。特别优选地,水被用作唯一的溶剂。优选地,在所述药物组合物中所包含的水是能够被用于肠胃外目的的微生物学上纯化的水,诸如注射用水(WFI)。
优选地,本发明的药物组合物是即时可用的组合物。如本说明书中所用的即时可用的组合物是指在施用前不需要被进一步稀释的组合物。它可以按原样被施用。
本发明的药物组合物通常是澄清且无色至浅黄色的溶液,具有良好的储存稳定性。例如,它可以在25℃下被储存至少24个月。
容器
在一方面,本发明提供了在塑料容器中的药物组合物。
优选地,所述塑料容器是塑料瓶、塑料袋或塑料小瓶,甚至更优选塑料瓶或塑料袋,特别优选塑料瓶。这种塑料容器稳定且易于处理,并且允许易于运输和施用。
优选地,所述塑料容器包含选自聚乙烯、聚丙烯、聚丁烯、聚异戊二烯、聚苯乙烯和聚氯乙烯的聚合物,更优选聚乙烯,甚至更优选低密度聚乙烯(LDPE)。所述聚合物可以以均聚物或共聚物的形式存在。如本说明书中所用的共聚物包括无规共聚物和嵌段共聚物。
所述塑料容器可以包含一层或多层,优选1-3层,更优选1层。在所述塑料容器包含更多层的情况下,各层的聚合物组成可以相同或不同。
优选地,所述塑料容器包含塑料盖。优选地,所述塑料盖包含聚乙烯、聚丙烯、聚氯乙烯或其混合物或共聚物,更优选聚丙烯或其共聚物。
优选地,所述塑料容器的体积在25-1000ml的范围中,优选在50-500ml的范围中,更优选在50-150ml的范围中,特别优选为100ml。
通常,在所述塑料容器中的药物组合物在25℃下的储存稳定性为至少6个月,优选至少12个月,更优选至少24个月。
制备
可以采用本领域技术人员已知的方法来制备本发明的药物组合物。例如,可以通过a)混合其组分和b)任选地调节pH来制备所述药物组合物。在特别优选的实施方案中,其中所述药物组合物在塑料容器中并被灭菌,制造过程可例如包含以下步骤:
a)混合所述药物组合物的组分;
b)任选地调节pH;
c)任选地过滤;
d)填充塑料容器;
e)灭菌。
可以例如使用孔径在0.2-0.6μm的范围中的过滤器来进行过滤,其能够除去微生物污染。在特别优选的实施方案中,所述过滤包含两个过滤步骤。
使用本领域已知的填充技术来进行塑料容器的填充。在优选的实施方案中,在所述塑料容器是LDPE容器的情况下,可以例如使用吹填密封技术进行填充。
优选地,将在塑料容器中的所述药物组合物灭菌以便提供用于肠胃外施用的储存稳定的组合物。通常的灭菌方法包括通过干热、湿热、辐照和气体灭菌。优选地,使用热灭菌。更优选地,使用湿热灭菌。特别优选地,使用以过热水作为灭菌介质的湿热灭菌。过热水的温度通常为至少100℃,优选至少110℃,更优选至少111℃。在优选的实施方案中,过热水的温度为约111℃。在另一个实施方案中,过热水的温度为约121℃。
用途
根据本发明的一方面,如本说明书中所定义的药物组合物用于治疗疼痛和/或减少发热。优选地,所述治疗是短期治疗。更优选地,所述治疗是短期急性治疗。优选地,所述疼痛是轻度至中度疼痛。在一个实施方案中,所述药物组合物用于治疗疼痛,优选用于轻度至中度疼痛的短期治疗。在另一个实施方案中,所述药物组合物用于减少发热。
附图简要说明
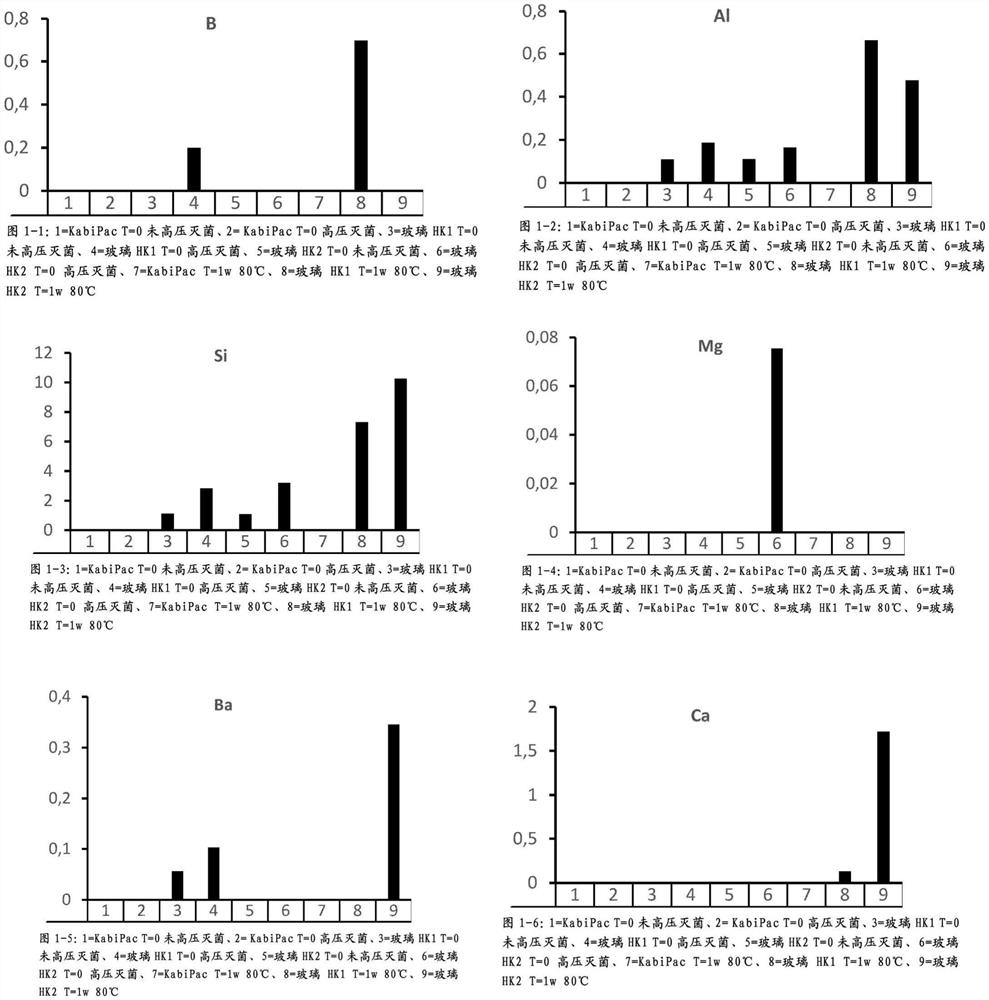
图1.ICP-MS结果(实施例1d)第II部分),离子含量(mg/L)
实施方案
1.用于肠胃外施用的药物组合物,其包含
a)布洛芬或其药学上可接受的盐,和
b)磷酸盐缓冲剂,
其中布洛芬或其药学上可接受的盐的浓度在15-25mmol/l的范围中,并且其中磷酸盐与布洛芬的摩尔比在0.35:1至0.37:1的范围中。
2.用于肠胃外施用的药物组合物,其包含
a)布洛芬或其药学上可接受的盐,和
b)磷酸盐缓冲剂,
其中布洛芬或其药学上可接受的盐的浓度在2-6g/l的范围中,并且其中磷酸盐与布洛芬的摩尔比在0.35:1至0.37:1的范围中。
3.根据前述实施方案中任意一项的药物组合物,其中布洛芬或其药学上可接受的盐的浓度在17-22mmol/l的范围中,优选在18-21mmol/l的范围中,更优选在19-20mmol/l的范围中。
4.根据前述实施方案中任意一项的药物组合物,其中布洛芬或其药学上可接受的盐的浓度在3-5g/l的范围中,更优选在3.5-4.5g/l的范围中。
5.根据前述实施方案中任意一项的药物组合物,其中所述磷酸盐缓冲剂包含三碱金属磷酸盐、二碱金属磷酸氢盐和/或碱金属磷酸二氢盐,优选地包含二碱金属磷酸氢盐和/或碱金属磷酸二氢盐。
6.根据前述实施方案中任意一项的药物组合物,其中所述碱金属是钠或钾,优选钠。
7.根据前述实施方案中任意一项的药物组合物,其中所述磷酸盐缓冲剂包含磷酸二氢钠和/或磷酸氢二钠,优选磷酸氢二钠和磷酸氢二钠。
8.根据前述实施方案中任意一项的药物组合物,其中磷酸盐缓冲剂的浓度在4-10mmol/l的范围中,优选在5-9mmol/l的范围中,更优选在6-8mmol/l的范围中。
9.根据前述实施方案中任意一项的药物组合物,其中所述组合物的pH在6.5至8.2的范围中,优选在7.2-8.0的范围中,更优选在7.4-7.8的范围中。
10.根据前述实施方案中任意一项的药物组合物,其还包含张力调节剂。
11.根据前述实施方案的药物组合物,其中所述张力调节剂选自甘油、丙二醇、山梨糖醇、甘露糖醇、右旋糖、乳糖、氯化钾和氯化钠,优选地是甘油、丙二醇或氯化钠,更优选地是氯化钠。
12.根据前述实施方案中任意一项的药物组合物,其还包含碱化剂。
13.根据前述实施方案的药物组合物,其中所述碱化剂选自碳酸钠、碳酸钾、碳酸氢钠、碳酸氢钾、氢氧化钠和氢氧化钾,优选地是氢氧化钠。
14.根据前述实施方案中任意一项的药物组合物,其还包含酸化剂。
15.根据前述实施方案的药物组合物,其中所述酸化剂是盐酸。
16.根据前述实施方案中任意一项的药物组合物,其是液体组合物。
17.根据前述实施方案中任意一项的药物组合物,其是含水组合物。
18.根据前述实施方案中任意一项的药物组合物,其是含水液体组合物。
19.根据前述实施方案中任意一项的药物组合物,其是即时可用的组合物。
20.根据前述实施方案中任意一项的药物组合物,其包含
a)19.4mmol/l布洛芬或其药学上可接受的盐,
b)5.0mmol/l磷酸二氢钠,和
c)2.0mmol/l磷酸氢二钠
其中所述组合物进一步包含氯化钠,并且其中所述组合物的pH在7.2-8.0的范围中,优选在7.4-7.8的范围中。
21.22.根据前述实施方案中任意一项的药物组合物,其包含
a)4.0g/l布洛芬或其药学上可接受的盐,
b)5.0mmol/l磷酸二氢钠,和
c)2.0mmol/l磷酸氢二钠
其中所述组合物进一步包含氯化钠,并且其中所述组合物的pH在7.2-8.0的范围中,优选在7.4-7.8的范围中。
22.23.根据前述实施方案中任意一项的药物组合物,其中所述组合物不含精氨酸、赖氨酸或其盐。
23.24.根据前述实施方案中任意一项的药物组合物,其中所述组合物不含氨基酸或其盐。
24.25.根据前述实施方案中任意一项的药物组合物,其中所述组合物不含氨基丁三醇或其盐。
25.26.根据前述实施方案中任意一项的药物组合物,其中所述组合物不含有机胺或其盐。
26.27.根据前述实施方案中任意一项的药物组合物,其在塑料容器中。
27.28.在容器中用于肠胃外施用的药物组合物,其包含
a)布洛芬或其药学上可接受的盐,和
b)磷酸盐缓冲剂,
其中布洛芬或其药学上可接受的盐的浓度在15-25mmol/l的范围中,其中磷酸盐与布洛芬的摩尔比在0.35:1至0.37:1的范围中。
28.29.在容器中用于肠胃外施用的药物组合物,其包含
a)布洛芬或其药学上可接受的盐,和
b)磷酸盐缓冲剂,
其中布洛芬或其药学上可接受的盐的浓度在2-6g/l的范围中,其中磷酸盐与布洛芬的摩尔比在0.35:1至0.37:1的范围中。
29.30.根据实施方案26至28中任意一项的药物组合物,其中所述塑料容器是塑料瓶、塑料袋或塑料小瓶,更优选塑料瓶或塑料袋,特别优选塑料瓶。
30.31.根据实施方案29的药物组合物,其中所述塑料包含聚乙烯、聚丙烯、聚丁烯、聚异戊二烯、聚苯乙烯、聚氯乙烯或其混合物或共聚物,优选聚乙烯,更优选低密度聚乙烯(LDPE)。
31.32.根据实施方案29或30的药物组合物,其中所述塑料包含聚乙烯、聚丙烯、聚氯乙烯或其混合物或共聚物,优选聚丙烯或其共聚物。
32.33.根据实施方案26至31中任意一项的药物组合物,其中所述塑料容器的体积在25-500ml的范围中,优选在50-150ml的范围中,更优选在80-120ml的范围中,特别优选为100ml。
33.34.根据实施方案26至32中任意一项的药物组合物,其中所述塑料容器包含塑料盖,优选聚丙烯盖。
34.35.根据前述实施方案中任意一项的药物组合物,其中所述组合物被灭菌,优选地被热灭菌,更优选地被湿热灭菌。
35.36.根据前述实施方案中任意一项的水性药物组合物,其包含
a)19.4mmol/l布洛芬或其药学上可接受的盐,
b)5.0mmol/l磷酸二氢钠,和
c)2.0mmol/l磷酸氢二钠,
其中所述组合物进一步包含氯化钠,其中所述组合物的pH在7.2-8.0(优选7.4-7.8)的范围中,其中所述塑料容器是包含聚丙烯盖的具有100ml体积的聚乙烯容器,并且其中所述组合物被灭菌。
36.37.根据前述实施方案中任意一项的水性药物组合物,其包含
a)4.0g/l布洛芬或其药学上可接受的盐,
b)5.0mmol/l磷酸二氢钠,和
c)2.0mmol/l磷酸氢二钠,
其中所述组合物进一步包含氯化钠,其中所述组合物的pH在7.2-8.0(优选地7.4-7.8)的范围中,其中所述塑料容器是包含聚丙烯盖的具有100ml体积的聚乙烯容器,并且其中所述组合物被灭菌。
37.38.根据前述实施方案中任意一项的药物组合物,其是即时可用的组合物。
38.39.如前述实施方案中任意一项所定义的药物组合物,其用于治疗疼痛和/或减少发热。
通过以下实施例进一步说明本发明,但本发明不受这些实施例限制。
实施例
实施例1.药物组合物的制备
在60-65°将氢氧化钠溶液添加到WFI中。随后,添加布洛芬粉末。在布洛芬完全溶解后,将溶液冷却至50℃,接着添加氯化钠和磷酸盐缓冲物质。将溶液的pH调节至pH=7.4-7.8。在两步过滤方法中过滤该溶液,在第一步中采用0.6μm过滤器,且在第二步中采用0.2μm过滤器。
该组合物包含以下成分,总体积为5000L:
填充和灭菌:用药物组合物填充聚乙烯容器
实施例2.药物组合物的稳定性
a)氧气敏感性
制备了具有如在实施例1中所示的组成的两种制剂。将一种制剂暴露在空气中,并将一种在氮气保护下储存。在溶液的外观、着色度、pH、可见颗粒和亚可见颗粒、同渗质量摩尔浓度和杂质方面,两种制剂均显示出相当的结果。在所研究的所有参数方面,所有结果均满足用于肠胃外施用的溶液的接受标准。
b)pH稳定性/吸附行为
制备了如在实施例1中所描述的在聚乙烯容器(
c)稳定性,包括热稳定性
在低密度聚乙烯容器(
d)储存稳定性I
制备了在
第I部分:降解产物
将制剂在不同条件下分别储存了3个月和6个月。
储存条件:25℃±2℃/40%±5%RH
30℃±2℃/35%±5%RH
40℃±2℃/≤25%RH
制剂在测试期间是稳定的。例如,在所有情况下(即在所有测试的储存条件下分别在3个月和6个月后),总降解产物的量均<0.1%。
第II部分:离子含量
制备了具有如在实施例1中所描述的组成的样品。将100ml所得药物组合物分别填充到
储存条件:
通过电感耦合等离子体质谱法(IC-MS)进行了样品分析。结果(表1和图1)清楚地表明,与在该实验中使用的两种不同的玻璃容器相比,
表1 ICP-MS结果(实施例1d)第II部分)。
- 包含布洛芬和磷酸盐缓冲剂的用于肠胃外施用的药物组合物
- 用于治疗剂的肠胃外施用的组合物
