一种肠癌辅助诊断模型构建和辅助诊断方法及系统
文献发布时间:2023-06-19 11:49:09
技术领域
本发明属于医疗数据处理技术领域,特别涉及一种辅助诊断模型构建和辅助诊断方法及系统,尤其涉及一种肠癌辅助诊断模型构建和辅助诊断方法及系统。
背景技术
肠癌(Colorectal Cancer,CRC)是全球第二大癌症相关死亡原因和第三大常见癌症类型。结肠镜检查是筛查CRC最常用的工具,可直接活检肠道肿瘤肿块进行病理诊断,其优势在于能够在早期发现癌前病变和肠癌,在早期手术切除往往是治愈的。在观察性研究中,结肠镜筛查有助于降低肠癌的死亡率,其中约80%的肠癌可通过息肉切除术预防。对比研究表明,及时治疗非典型增生或早期肠癌可延长总生存期。此外,活检不完全常导致早期肠癌误诊为轻、中度不典型增生,继而导致治疗不当。因此,在结肠镜下准确区分良恶性病变对选择最佳治疗方案、避免不适当的内镜下切除和改善预后具有重要的医学意义。根据NICE(NBI国际肠内窥镜协会)和WASP(息肉工作组)分类系统,内镜医师的一个关键任务是结肠镜下病变的鉴别诊断。然而,据我们所知,这两个标准不能在白光成像模式下对肠肿物进行良恶性诊断。在美国,被诊断为肠癌患者的5年总生存率从I期和II期患者的90.1%,III期患者的69.2%到IV期患者的11.7%不等;因此,能够早期识别肠癌患者的人工智能模型将大大延长患者的总生存期。
自AlexNet赢得2012年ImageNet竞赛以来,深度卷积神经网络(deepconvolutional neural network,DCNN)模型在医学成像数据解释中得到了广泛的应用。深度学习模型也被证明可以提高内镜医师检测息肉或腺瘤及上消化道癌肿的能力。然而,利用卷积神经网络来分析大范围肠镜图像来进行肠癌光学辅助诊断的研究还未见报道。因此,一种可以帮助内镜医师区分肠病变的良恶性,提高肠镜检查效率的肠癌辅助诊断模型成为肠癌光学辅助诊断研究的重点。
发明内容
本发明的目的是提供一种肠癌辅助诊断模型(CRCNet)构建和辅助诊断方法及系统,CRCNet在鉴别肠癌与腺瘤、息肉等良性疾病方面具有较高的性能,一致性和稳定性好,预测结果可信度相当于熟练的肠镜医师。
为此,本发明技术方案如下:
第一方面,本发明提供一种肠癌辅助诊断模型的构建方法,至少包括以下步骤:
S01历史诊疗样本图像获取:获取历史诊疗样本的肠内镜图像,所述肠内镜图像包含肠癌组和非肠癌组;
S02预处理:对所述肠内镜图像进行预处理;
S03模型训练:将预处理后的肠内镜图像输入卷积神经网络模型,对所述卷积神经网络进行训练(卷积神经网络提取内镜图像的特征进行学习,所述内镜图像的特征包含黏膜表面突出显示的微血管形态、黏膜纹路、黏膜颜色等图片颜色和形态信息;卷积神经网络提取上述的图像特征,根据输出结果反向传播对卷积神经网络的网络参数进行更新优化训练),直至所述卷积神经网络输出的表示预测患病概率满足识别要求,获得肠癌辅助诊断模型。
根据现有技术中常用于图像分类的卷积神经网络,发明人拟从如下几种卷积神经网络类型中进行选择,分别为:ResNet、VGGNet、GoogLeNet、Inception以及Inception的变体Inception ResNet。发明人通过输入内镜图像进行训练的方式逐一对上述的各种卷积神经网络进行测试,发现ResNet、VGGNet、GoogLeNet的网络结构相似,这几种卷积神经网络虽然能提取内镜图像特征,但是其存在着一些缺陷,如评估网络计算量大、训练所需时间长、所需训练数据量大、容易过拟合、应用难度大、容易发生梯度弥散等。Inception相较于上述几种网络,一定程度上优化了上述几种网络存在的缺陷,能良好的应用于肠癌辅助诊断模型的构建过程中。在Inception的基础上,将Inception与ResNet的结构进行结合,ResNet的结构可极大地加速训练,同时网络性能也有所提升,最终本发明采用Inception ResNetv2卷积神经网络。
优选地,所述步骤S01历史诊疗样本图像获取中,根据拍摄肠内镜图像时所用光源的种类,分为普通白光模式图像集和窄带成像模式图像集(使用Narrow Band Imaging,NBI技术以及窄谱滤光片);在本发明中,优选所有图像都是jpeg格式,且均在标准肠道准备后由高清仪器(Olympus CF-HQ2,PCF-Q260JI,日本东京)生成。
优选地,所述步骤S03模型训练中,选取普通白光模式图像集输入卷积神经网络模型中进行训练,直至所述卷积神经网络模型输出的表示预测患病概率满足识别要求,获得肠镜下肠癌辅助诊断模型。使用白光成像方式更具临床相关性和潜在的更具平移性,因为它依赖于在常规结肠镜检查中看到的图像。CRCNet可进一步扩大白光对早期结直肠病变的识别,特别是对无窄带成像设备的社区医院。
优选地,所述步骤S02预处理采用动态数据增强技术进行预处理,增加在现实世界中观察到的数据多样性。
优选地,所述采用动态数据增强技术进行预处理,至少包括以下步骤:
S021:对肠内镜图像进行筛选,剔除模糊、空白、失焦和/或肠道准备不良图像,保留显象合格图像;
S022:将所述显象合格图像依次进行随机调整大小、裁剪、透视、水平翻转、旋转、颜色抖动和光照噪声的操作,以扩增数据,增加样本量;
S023:将所述显象合格图像分为一个训练数据集和两个验证数据集;优选将80%的合格图像作为训练数据集,将剩余20%的合格图像作为验证数据集。
优选地,所述步骤S03模型训练包括以下步骤:
将所述普通白光模式图像的训练数据集输入卷积神经网络模型中,对所述卷积神经网络进行训练,直至所述卷积神经网络模型完成指定的迭代周期后,或者当内部测试的分类结果评价指标在指定的迭代周期内不再上升时,训练完成,得到肠癌辅助诊断模型。
本发明使用训练期间未包括的随机图像子集来计算每个层级结束时的模型丢失;选择损失最小的模型作为最佳模型,并在测试集上对其性能进行了评估。
卷积神经网络模型(Inception ResNet v2)包括stem模块、Inception ResNet模块、Reduction模块、Average Pooling层、Dropout层和Softmax层。
上述步骤S03模型训练包括以下步骤:
S031将所述训练数据集中的某张内镜图像输入所述stem模块中,通过所述stem模块对所述内镜图像进行卷积计算、最大池化操作和特征拼接,以初步提取所述内镜图像的特征获得特征图像Y;
S032将所述特征图像Y输入所述Inception ResNet模块和所述Reduction模块中,通过所述Inception ResNet模块对所述特征图像Y进行Relu激活、卷积计算、线性卷积激活、特征拼接操作进一步提取特征,通过所述Reduction模块减小图像尺寸降维,将所述特征图像Y转化为图像特征矩阵Z;
S033将所述图像特征矩阵Z输入所述Average Pooling层进行均值池化操作抽象为特征向量F;将所述特征向量F依次通过所述Dropout层进行随机失活操作、所述Softmax层进行逻辑回归操作,使所述特征向量F转化为二分类输出P,所述二分类输出P∈(0,1),用于表示预测患病概率;
S034通过交叉熵计算公式计算所述二分类输出P与该内镜图像真实标签之间的交叉熵损失;将所述交叉熵损失通过梯度下降算法反向传播至所述卷积神经网络,用于更新所述卷积神经网络的网络参数;
S035将所述验证数据集中的肠镜图像输入所述卷积神经网络中,根据输出的预测患病概率计算分类结果评价指标对本轮模型训练效果进行内部测试;具体的,从验证数据集中任选一张内镜图像,输入到卷积神经网络中,卷积神经网络输出一个对应的预测良恶性概率,计算该预测患病概率与该内镜图像真实标签之间的偏差,通过该偏差,计算分类结果评价指标对本轮模型训练效果进行内部测试。常用的分类结果评价指标包括准确率、特异度、敏感度、AUC值、损失值曲线中至少一项或任意几项的组合。
准确率的计算方式为:准确率=((正确预测出的阳性个数+正确预测出的阴性个数)/总测定个数)*100%,准确率越高则说明本轮模型训练效果越好。
特异度的计算方式为:特异度=真阴性人数/(真阴性人数+假阳性人数)*100%,特异度的范围为0-1,其表示的是模型正确判断正常内镜图像的能力,该值越高,表示模型判断的准确性越高。
灵敏度的计算方式为:灵敏度=真阳性人数/(真阳性人数+假阴性人数)*100%,灵敏度的范围为0-1,其表示的是模型正确判断患病内镜图像的能力,该值越高,表示模型判断的准确性越高。
AUC值是ROC曲线(receiver operating characteristic curve,接受者操作特性曲线)下的面积,用于表征模型的整体性能效果,ROC曲线采用不同阈值下的特异度和灵敏度的变化曲线。在多轮模型训练过程中,AUC值应不断变大,表征模型性能越来越好,反之则代表本轮模型训练效果较差。一般AUC值的大小为0.5-1。
损失值曲线是由一系列损失值建立的曲线,损失值是模型的训练指标,每一轮迭代过程中都会通过损失函数来计算损失值,进而决定下一次模型参数梯度更新的方向和大小,常见的损失函数有交叉熵、二值化交叉熵和均方误差等。
通过该分类结果评价指标可以较为准确地反映本轮模型训练效果,使得操作者在模型训练过程中可以掌握每轮模型训练的训练效果,根据训练效果,可及时对模型训练过程做出调整。比如当分类结果评价指标明显异常时,操作者可以及时发现,并对模型训练过程进行检查,如输入的内镜图像是否清晰,卷积神经网络是否正常运行等。通过引入内部测试过程,使得操作者能及时的掌握每轮模型训练的效果,在训练异常时能及时发现,能保证模型训练过程的正确顺畅进行,且能保证最终获得的肠癌辅助诊断模型具有较高的准确率。
S036、依次输入多张不同的内镜图像,重复所述步骤S031-S35,不断更新优化所述卷积神经网络的网络参数,使所述卷积神经网络的二分类输出P不断逼近真实标签;在完成指定的迭代周期如100次后,或者当内部测试的分类结果评价指标在指定的迭代周期如100次内不再上升时,所述辅助诊断模型训练完成;
优选地,在步骤S03之后还包括步骤S04外部测试;
优选地,所述步骤S04外部测试至少包括以下步骤:
将所述验证数据集中的肠镜图像输入所述肠癌辅助诊断模型中,根据输出的预测患病概率计算分类结果评价指标,来反映该肠癌辅助诊断模型预测的准确性;
优选地,所述分类结果评价指标包括恶性数字评分和/或热图;
优选地,对于给定的个体,所述恶性数字评分θ的计算方法如下:
θ=-[w
其中,n表示为该个体可用图像的总数,p表示所述个体可用图像被分类为恶性肿瘤的预测概率;
其中,w
w
优选地,所述热图的评价方法为使用梯度加权类激活映射算法(Grad-CAM)确定对所述卷积神经网络预测贡献最大的区域。
具体的,从验证数据集中任选一张内镜图像,输入到训练完成的肠癌辅助诊断模型中,辅助诊断模型对输入的内镜图像进行特征提取和计算,然后输出该内镜图像的预测患病概率。计算该预测患病概率与该内镜图像真实标签之间的偏差,通过该偏差,计算分类结果评价指标,通过该分类结果评价指标来反映该肠癌辅助诊断模型预测的准确性。常用的分类结果评价指标包括准确率、特异度、敏感度、AUC值、损失值曲线中至少一项或任意几项的组合。在模型训练完成后,对训练完成的肠癌辅助诊断模型的预测能力进行外部测试,以获得该肠癌辅助诊断模型预测的准确性。
外部测试时的准确率、特异度、敏感度、AUC值、损失值曲线的计算方式与内部测试过程相似,在此不再赘述。外部测试时,通过上述至少一项或任意几项的组合来反映模型的整体性能效果,主要为预测结果的准确性。通常来说,准确率、特异度、敏感度这三个数值越高,代表模型预测结果的准确性越高,模型越可靠。而AUC值一般为0.5-1。损失值曲线的变化趋势应逐渐变小,代表预测结果逐渐逼近真实标签。
在实际应用过程中,以准确率这一分类结果评价指标为例,可以设置一个准确率阈值,比如当辅助诊断模型预测的准确率到达90%以上时,该辅助诊断模型视为合格,可用于临床诊断中,否则视为不合格,需要重新进行模型训练。通过设置外部测试步骤,在肠癌辅助诊断模型训练完成后对其预测的准确性进行计算评估,保证了应用于实际诊断过程中的辅助诊断模型预测的准确性和可靠性。
第二方面,本发明提供一种肠癌辅助诊断方法,包括:
获取被检测者的肠内镜图像;
将所述肠镜图像输入到如第一方面所述的肠癌辅助诊断模型的构建方法所构建的肠癌辅助诊断模型中,得到预测患病概率。
具体的,通过电子肠镜进入被检测者的肠腔内对局部粘膜进行拍摄,包括但不限于直肠、乙状结肠、降结肠、横结肠、升结肠、盲肠部位,以及肉眼判断的可疑病变部位,拍摄完成后即可获得被检测者的内镜图像。
第三方面,本发明提供一种肠癌辅助诊断模型构建系统,其特征在于,包括:
样本获取模块,用于获取肠内镜图像;
预处理模块,用于对所述肠内镜图像进行预处理;
模型训练模块,用于将预处理后的肠内镜图像输入卷积神经网络中,对所述卷积神经网络进行训练,获得肠癌辅助诊断模型。
第四方面,本发明提供一种肠癌辅助诊断系统,包括:
图像获取模块,用于获取被检测者的肠内镜图像;
诊断模块,用于将所述肠内镜图像输入到如第一方面所述的肠癌辅助诊断模型的构建方法所构建的肠癌辅助诊断模型中,得到预测患病概率。
优选地,所述肠癌辅助诊断系统包括:
上位机和显示装置,所述图像获取模块和所述显示装置均与所述上位机通信连接;
所述图像获取模块为电子肠内镜;
所述诊断模块搭载在所述上位机上;
所述图像获取模块拍摄被检测者的肠内镜图像并自动传输到所述上位机,所述上位机通过所述诊断模块输出该肠内镜图像的预测患病概率并即时传输到所述显示装置上进行显示。图像获取模块具体为电子肠镜,电子肠镜包含肠镜本体(如可直接购买的ENF-VH、Olympus Medical Systems Corp)、内窥镜系统(如可直接购买的OTV-S190、OlympusMedical Systems Corp)和内窥镜冷光源(如可直接购买的CLVS190、Olympus MedicalSystems Corp)。
上位机具体可以为PC、笔记本电脑、智能手机、pad等具有数据处理能力的智能终端。显示装置具体可为显示屏(如可直接购买的OEV-261H、Olympus Medical SystemsCorp),还可以搭配键盘、鼠标、触摸屏等输入设备用于向上位机输入控制指令。
第五方面,本发明提供一种电子设备,包括:
处理器、存储器以及存储在所述存储器上且可在所述处理器上运行的计算机程序,所述处理器运行所述计算机程序时实现如第一方面所述的肠癌辅助诊断模型的构建方法的步骤,或如第二方面所述的辅助诊断方法的步骤。
处理器可以为中央处理器(Central Processing Unit,CPU),还可以为其他通用处理器、数字信号处理器(Digital Signal Processor,DSP)、专用集成电路(ApplicationSpecific Integrated Circuit,ASIC)、现场可编程门阵列(Field-Programmable GateArray,FPGA)或者其他可编程逻辑器件、分立门或者晶体管逻辑器件、分立硬件组件等芯片,或者上述各类芯片的组合。
存储器作为一种非暂态计算机可读存储介质,可用于存储非暂态软件程序、非暂态计算机可执行程序以及模块,如本发明实施例中的肠癌辅助诊断模型构建方法或结肠癌辅助诊断方法对应的程序指令/模块。处理器通过运行存储在存储器中的非暂态软件程序、指令以及模块,从而执行处理器的各种功能应用以及数据处理,即实现上述实施例中的方法。
第六方面,本发明提供一种计算机可读存储介质,其上存储有计算机指令,其特征在于,所述计算机指令在被处理器执行时实现如第一方面所述的肠癌辅助诊断模型的构建方法的步骤,或如第二方面所述的辅助诊断方法的步骤。
与现有技术相比,本发明提供的肠癌辅助诊断模型(简称CRCNet)的构建方法通过输入肠癌组和非肠癌组两组图像数据对卷积神经网络训练,获得肠癌辅助诊断模型。在临床诊断时,将被检测者的内镜图像输入所得肠癌辅助诊断模型中,肠癌辅助诊断模型对输入图像进行分析运算,随即输出预测良恶性概率。医师可参考输出的预测良恶性概率并结合自身的经验对病变组织的性质作出判断,决定是否进行取材活检及后续处理。本发明可根据输入的内镜图像输出该内镜图像的预测患病概率以供医师参考诊断,可辅助医师的肠癌诊断过程,可有效提高肠癌诊断的准确率,弥补内镜医师的技术和经验不足,提高后续活检的检出率,从而实现肠癌早筛早诊早治,改善患者的治疗效果和预后的目的,预测结果较为准确,对于肠癌的诊断过程有良好的辅助作用。
附图说明
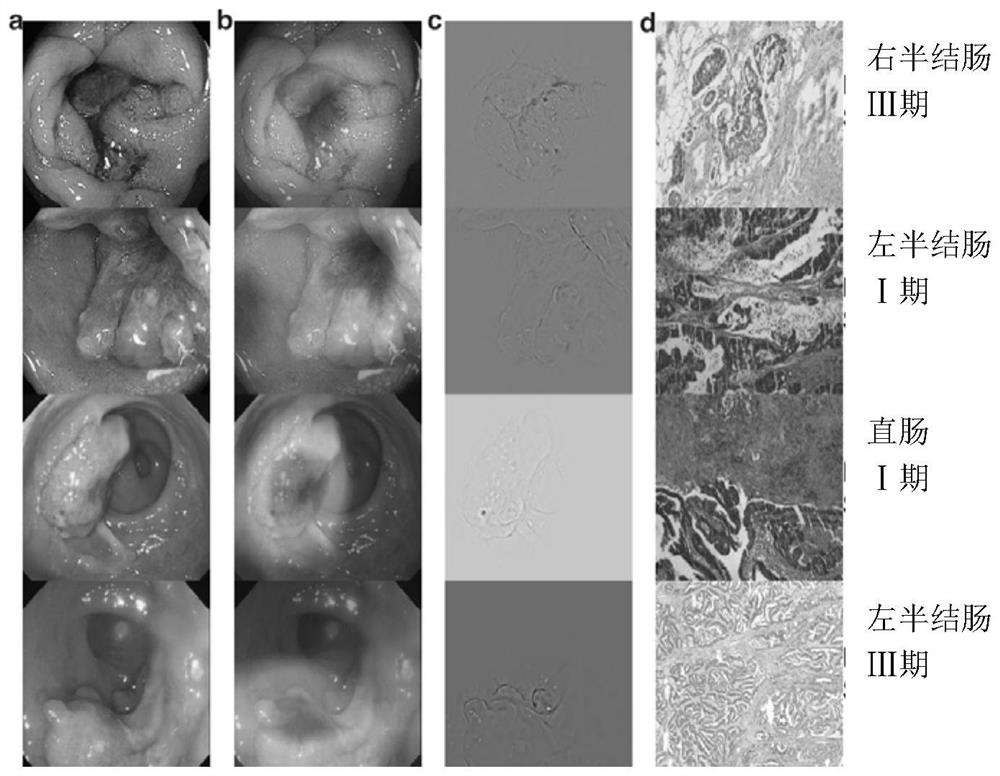
图1为不同部位的恶性结肠镜检查图像。
具体实施方式
下面结合具体实施例对本发明做进一步的说明,但下述实施例绝非对本发明有任何限制。
数据来源
2011年8月至2019年3月,在天津市肿瘤医院(TCH)获得了12179名患者的464105张图像作为历史诊疗样本图像(即
三个
效果说明
将所有的历史诊疗样本图像(即
随后,将获得的肠癌辅助诊断模型应用在三个测试集上,对其性能进行评估,结果如下。
1)数据统计结果
TCH测试集的结果显示,AUPRC为0.882(95%CI:0.828-0.931),准确率为87.3%(83.5%-90.6%),召回率为90.4%(0.844-0.947),特异性为85.3%(79.8%-89.7%),F1为85.2%。
TFCH测试集的结果显示,AUPRC为0.874(0.820-0.926),准确率为91.6%(88.6%-94.1%),召回率为78.9%(69.0%-86.8%),特异性为95.0%(92.1%-97.1%),F1为79.8%。
TGH测试集的结果显示,AUPRC为0.867(95%CI:0.795-0.923),准确率为98.0%(97.2%-98.7%),召回率为74.6%(62.9%-84.2%),特异性为99.2%(98.6%-99.6%),F1为78.5%。
TCH测试集的AUROC曲线下的面积为0.930(0.903–0.956),对于TFCH,为0.961(0.943–0.979)。TGH测试集,为0.989(0.980–0.997)。
对于左侧(降结肠和乙状结肠)、右侧(升结肠和横结肠)和直肠位置的CRCNet光学辅助诊断,TCH测试集的AUPRC值分别为0.729(0.601–0.866)、0.622(0.483–0.79)和0.788(0.699–0.874)、0.743(0.609–0.866)、0.734(0.588–0.859)和0.748(0.594–0.887),TGH测试集的AUPRC值分别为0.572(0.401–0.815)、0.691(0.514–0.858)和0.728(0.558–0.942)。TCH测试集的AUROC值在0.927到0.939之间,TFCH测试集的AUROC值在0.949到0.975之间,TGH测试集的AUROC值在0.978到0.996之间。
2)与内窥镜医师的比较结果
通过手术或活检标本的病理学检查,评价CRCNet在鉴别良恶性疾病中的作用。病理学家从病理系统中检索并复习病理信息,在每个测试集中由5名内窥镜医师对肠癌患者的图像进行一致性解释,以测量CRCNet在图像水平上区分恶性和良性的表现。每位内窥镜医师至少有六年的工作经验,以及大于1000次结肠镜检查,光学诊断率在85%到95%之间(数据来自医师自我报告)。对于两个外部TFCH和TGH测试集,所有的CRC患者和200个对照的随机子集被选择并由内窥镜医师解释。对于内部TCH测试集,所有CRC患者和对照组均由内窥镜医师解释。要求这五位内窥镜医师根据临床经验将每一个病人分为肠癌或对照组。
所有大肠癌患者和来自TFCH和TGH测试集的200个随机对照组的患者,以及来自TCH测试集的所有患者被用来评估CRCNet与5名熟练的内窥镜医师之间的差异。每位内窥镜医师读取和解释的图像总数为38788张。对于TCH测试集,CRCNet的AUPRC为0.882(95%CI0.828–0.931);对于TFCH测试集,AUPRC为0.92(95%CI 0.874–0.955);对于TGH测试集,AUPRC为0.969(95%CI0.937–0.992)。与内窥镜医师相比,CRCNet的F1指标分别为0.852、0.857和0.928,而这三个测试集的F1指标分别为0.768、0.878和0.873。
五位经验丰富的内窥镜医师在TCH测试集中的评分一致率为56.7%(206/363,Fleiss'Kappa 0.58,p<0.001),在TFCH测试集中的评分一致率为76.6%(222/290,Fleiss'Kappa 0.75,p<0.001),在TGH测试集中的评分一致率为88.2%(239/271,Fleiss'Kappa0.87,p<0.001)。这组5名内窥镜医师的平均准确度和召回率在TCH和TGH测试集中位于PR曲线以下,而在TFCH测试集中位于PR曲线以上。在这组5名内窥镜医师的平均准确度水平上,CRCNet在TCH(91.3%vs.83.8%;p<0.001)和TGH(96.5%vs.90.3%;p=0.006)测试集中获得了较高的召回率,在TFCH(82.9%vs.87.6%;p=0.29)测试集中获得了相当的召回率。而在这组5名内窥镜医师的平均召回率水平上,CRCNet在TGH(93.7%vs.83.8%;p=0.02)测试集中获得了更高的准确率,在TCH(81.3%vs.77.9%;p=0.32)和TFCH(81.1%vs.83.4%;p=0.52)测试集中获得了类似的准确率。
3)图像水平性能
我们还测量了CRCNet在图像水平上对来自三个测试集的CRC患者图像的分类性能。CRCNet在检测恶性图像方面取得了很高的性能:对于TCH测试集,AUPRC为0.990(95%CI0.987–0.993),F1为95.6%;对于TFCH测试集,AUPRC为0.991(95%CI 0.987–0.995),F1为96.3%;对于TGH,AUPRC为0.997(95%CI 0.995–0.999),F1为97.3%。
4)CRCNet预测性能的直观解释
我们使用Grad-CAM算法来识别图像区域,来确定对CRCNet的预测贡献最大的区域。此外,还评估了CRCNet在鉴别左侧(降结肠和乙状结肠)、右侧(升结肠和横结肠)和直肠部位大肠癌方面的性能,如图1所示。在患者层面,我们比较了CRCNet与五位内镜医师在这些测试集上的表现。在图像层面,我们使用这五位内窥镜医师对这三个测试集中的大肠癌患者影像的一致性解释来衡量CRCNet的分类性能。此外,我们要求这五位内窥镜医师手动检查预测恶性程度低的假阴性和预测恶性程度高的假阳性,内窥镜医师检查255张随机选取的恶性结肠镜图像及其伴随的显著热图。在这255个显著热图中,这5位内窥镜医师认为CRCNet输出的热图捕捉恶性病变区域的准确率百分比为94.3%(95%CI:91.4%–97.1%)。
结果显示,CRCNet模型在识别大肠癌患者方面比五名熟练的内镜医师具有更高的准确率和召回率。CRCNet在三个测试集上都实现了一致和稳健的性能,在其中两个测试集上的精确度和另一个测试集上的召回率都有显著的提高。在影像层面,CRCNet对结肠病变的良恶性鉴别有较好的效果。此外,肠镜医师发现,来自CRCNet的循证视觉解释对常规临床实践有效。
CRCNet有助于减少结肠镜专家对大肠癌光学诊断的依赖,提高诊断的一致性;将多种非癌性疾病(如息肉、腺瘤、慢性黏膜炎症和炎症性肠病)纳入对照组,并以病理检查作为金标准。因此,CRCNet可以学习非癌特征,从而提高模型性能并避免验证偏差。肠镜医师在鉴别大肠癌方面的表现取决于经验,并且由于人源性诊断系统通常是通过专家共识建立的,并且会受到人为影响,而CRCNet却可以提供客观的光学诊断。
CRCNet的另一个优点是可以在图形处理单元上实时一致地报告结果,从而有利于实时检测CRC,减少工作量、不一致性和误诊频次。CRCNet可以克服肠镜医师固有的局限性,如感知偏差和视觉疲劳。CRCNet在图像水平上显示出高度的保真度和一致性,它可以作为结肠镜检查的二次读取工具。大肠癌患者的预后与病理分期密切相关。CRCNet对早期(I期和II期)和晚期(III期和IV期)大肠癌患者恶性程度的预测得分具有可比性(平均值0.679对0.689,p=0.843),表明CRCNet对早期大肠癌患者的检测效果与晚期大肠癌患者相同。此外,CRCNet的视觉解释可以进一步提供循证分类,帮助内窥镜医师对图像进行解释。这可以证明CRCNet所做的预测是正确的,特别是当存在不可靠的预测时。
将CRCNet集成到结肠镜判读系统中还可以帮助内镜医师加快判读过程。从CRCNet重复读取可以增强内窥镜医师管理高风险CRC患者的能力。CRCNet鉴别良恶性病变可减少不必要的活检。
应该注意到并理解,在不脱离后附的权利要求所要求的本发明的精神和范围的情况下,能够对上述详细描述的本发明做出各种修改和改进。因此,要求保护的技术方案的范围不受所给出的任何特定示范教导的限制。
申请人声明,以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
- 一种肠癌辅助诊断模型构建和辅助诊断方法及系统
- 一种面向医学影像的人工智能辅助诊断模型构建系统
