经导管再生肺动脉瓣
文献发布时间:2023-06-19 11:57:35
相关申请的交叉引用
本申请要求2018年11月1日提交的美国申请号62/754,102的权益,其内容出于所有目的通过引用以其全部并入本文。
技术领域
本公开涉及人工肺动脉瓣及其应用,更具体地,涉及由生物可吸收框架和可以与人工瓣膜接受者的活组织整合的再生组织构造的肺动脉瓣。
背景技术
人类心脏可能患有各种瓣膜疾病。这些瓣膜疾病可导致心脏严重功能异常,并最终需要用人工瓣膜替换原生瓣膜。另外地,瓣膜疾病可影响年轻且仍在成长和发展的儿童和青少年。当儿童或青少年接受替换瓣膜时,人工瓣膜不会随接受者一起成长,因此,必须在儿童身上替换人工瓣膜,以补偿不断成长的心脏。存在许多已知的人工瓣膜以及将这些人工瓣膜植入人体内的许多已知方法。
各种外科技术可用于替换或修复患病或受损的瓣膜。由于狭窄和其他心脏瓣膜疾病,每年成千上万的患者进行手术,其中有缺陷的原生心脏瓣膜被假体瓣膜替换。另一种用于治疗有缺陷的瓣膜的不太激烈的方法是通过修复或重建,该方法通常用于最小钙化的瓣膜上。外科疗法的问题在于,它给这些慢性病患者带来了巨大的风险——与外科手术修复有关的高发病率和高死亡率。
当替换原生瓣膜时,假体瓣膜的外科手术植入通常需要开胸手术,在此期间心脏停止并且患者被置于心肺旁路(所谓的“心肺机”)上。在一种常见的外科手术过程中,患病的原生瓣膜小叶被切除,并在瓣环处将假体瓣膜缝合到周围组织。由于与手术相关的创伤以及随之而来的体外血液循环持续时间,一些患者无法在手术过程中幸存下来或不久后死亡。众所周知,患者的风险随着体外循环所需时间量的增加而增加。由于这些风险,许多具有有缺陷的原生瓣膜的患者被认为无法手术,因为他们的状况太虚弱以至于无法承受手术。据一些估计,超过50%的患有瓣膜狭窄的年龄超过80岁的受试者不能进行瓣膜置换。
另外地,目前的人工瓣膜的大小是静态的,并不能生长或针对成长中的身体进行调节。因此,患有瓣膜疾病的儿童和青少年需要多次手术以用更大的瓣膜替换人工瓣膜以补偿接受者的生长。由于随着儿童和青少年成长需要进行多次手术,因此置换过程固有的风险和危险随着这些个体而增加。
进一步地,由于与常规的心脏直视手术有关的缺点,经皮和微创手术方法受到了广泛的关注。在一种技术中,假体瓣膜被配置为通过导管插入以更少的侵入性手术被植入。例如,美国专利号5,411,522和6,730,118(其通过引用以其全部并入本文)描述了可塌缩的经导管心脏瓣膜,该心脏瓣膜可以在导管上以压缩状态经皮引入,并通过球囊膨胀或利用自扩张框架或支架而在期望位置扩张。
发明内容
公开了根据本发明的实施方式的人工心脏瓣膜及其使用方法。在一个实施方式中,一种可植入的人工心脏瓣膜包括框架,该框架具有在框架的流入端与框架的流出端之间延伸的纵轴,该框架的流入端配置为当假体瓣膜植入时接收流入假体瓣膜的顺行血液;定位在该框架内并由再生组织构造的小叶结构;和定位在框架的内表面周围并沿纵轴延伸的内裙部(skirt),该内裙部由第二再生组织构造。
在进一步实施方式中,框架由生物可吸收材料构造。
在另一实施方式,生物可吸收材料选自聚(L-丙交酯)、聚(D-丙交酯)、聚乙交酯、聚(L-丙交酯-共-乙交酯)、聚羟基链烷酸酯、多糖、蛋白质、聚酯、聚羟基链烷酸酯类、聚亚烷基酯(polyalkelene esters)、聚酰胺、聚己内酯、聚丙交酯-共-聚己内酯、聚乙烯酯、聚酰胺酯、聚乙烯醇、己内酯聚合物的改性衍生物、聚三亚甲基碳酸酯、聚丙烯酸酯、聚乙二醇、水凝胶、可光固化水凝胶、末端二醛(terminal dial)、聚(L-丙交酯-共-三亚甲基碳酸酯)、聚羟基丁酸酯、聚羟基戊酸酯、聚-原酸酯、聚-酸酐、聚亚氨基碳酸酯、以及其共聚物和组合。
在仍进一步实施方式中,小叶结构和内裙部由相同的再生组织构造。
在仍另一实施方式中,框架还包括多个连合部窗口框架,以允许小叶结构的附接。
在又进一步实施方式中,连合部窗口框架由非生物可吸收材料构造,和框架由生物可吸收材料构造。
在又另一实施方式中,小叶结构包括多个小叶,每个小叶包括具有自由流出边缘的主体部分,从主体部分的相对侧延伸的两个相对的上凸耳(tab),和两个相对的下凸耳,每个下凸耳从与相应上凸耳相邻的主体部分延伸,下凸耳在自由流出边缘的相对端处从主体部分延伸。
在再次进一步实施方式中,下凸耳围绕径向延伸的折痕折叠,该折痕从自由流出边缘的相对端径向延伸,使得下凸耳的第一部分平放在相应小叶的主体部分上,并且下凸耳围绕轴向延伸的折痕折叠,使得下凸耳的第二部分在与第一部分不同的平面中延伸,径向延伸的折痕和轴向延伸的折痕不平行。
在再次另一实施方式,每个下凸耳的第二部分缝合至相应的上凸耳。
在进一步额外的实施方式中,框架可径向地塌缩至塌缩配置和可径向地扩张至扩张配置。
在另一额外的实施方式中,框架还包括组织接合元件,以允许人工心脏瓣膜固定到血管壁。
在仍又进一步实施方式中,组织接合元件包括生物可吸收胶,以防止组织接合元件扩张和允许人工心脏瓣膜被再定位。
在仍又另一实施方式中,再生组织和第二再生组织选自polyglactin、胶原蛋白和聚乙醇酸。
在再次仍进一步实施方式中,再生组织还包括选自以下的细胞外基质蛋白:羟脯氨酸、玻连蛋白、纤连蛋白和胶原蛋白I型、胶原蛋白III型、胶原蛋白IV型、胶原蛋白VI、胶原蛋白XI、胶原蛋白XII、肌原纤蛋白I、生腱蛋白、饰胶蛋白聚糖、辅聚糖(byglycan)、多能聚糖、无孢蛋白(asporin)和其组合。
在再次仍另一实施方式中,内裙部延伸超出框架的流出端和流入端中的至少一个并形成附接至框架的外表面的外裙部。
在仍进一步额外的实施方式中,框架还包括生长因子,以促进再生组织的整合。
在又另一实施方式中,框架的流入端部分的外径小于框架的流出端部分的外径。
在再次进一步仍实施方式中,框架具有多个开口,并且当假体瓣膜处于径向塌缩配置时,小叶结构的部分通过该开口突出。
在仍另一额外实施方式中,用于在患者体内植入人工心脏瓣膜的组件包括递送装置,该递送装置包括细长杆(shaft);和适于以径向塌缩配置安装在杆上用于递送至体内的径向可扩张的人工心脏瓣膜,假体心脏瓣膜包括具有流入端部分的框架,该流入端部分限定框架的流入端,其配置为当所述人工心脏瓣膜植入时接收进入人工心脏瓣膜的顺行血流,并且框架还具有流出端部分,该流出端部分限定与框架的流入端相对的框架的流出端,假体心脏瓣膜还包括定位在框架内的小叶结构、沿框架的内表面定位的内裙部,小叶结构由再生组织构造,和内裙部由第二再生组织构造。
在再次又进一步实施方式中,框架由生物可吸收材料构造。
在另一实施方式,生物可吸收材料选自聚(L-丙交酯)、聚(D-丙交酯)、聚乙交酯、聚(L-丙交酯-共-乙交酯)、聚羟基链烷酸酯、多糖、蛋白质、聚酯、聚羟基链烷酸酯类、聚亚烷基酯、聚酰胺、聚己内酯、聚丙交酯-共-聚己内酯、聚乙烯酯、聚酰胺酯、聚乙烯醇、己内酯聚合物的改性衍生物、聚三亚甲基碳酸酯、聚丙烯酸酯、聚乙二醇、水凝胶、可光固化水凝胶、末端二醛、聚(L-丙交酯-共-三亚甲基碳酸酯)、聚羟基丁酸酯、聚羟基戊酸酯、聚-原酸酯、聚-酸酐、聚亚氨基碳酸酯、和其共聚物和组合。
在仍进一步实施方式中,小叶结构和内裙部由相同的再生组织构造。
在再次仍另一实施方式中,框架还包括多个连合部窗口框架,以允许小叶结构的附接。
在又进一步额外实施方式中,连合部窗口框架由非生物可吸收材料构造,和框架由生物可吸收材料构造。
在又另一额外实施方式中,框架的流入端部分的外径小于框架的流出端部分的外径。
在再次进一步额外实施方式中,框架具有多个开口,并且当假体瓣膜处于径向塌缩配置时,小叶结构的部分通过该开口突出。
在再次另一额外实施方式中,小叶结构包括多个小叶,每个小叶包括具有自由流出边缘的主体部分,从主体部分的相对侧延伸的两个相对的上凸耳,和两个相对的下凸耳,每个下凸耳从与相应上凸耳相邻的主体部分延伸,下凸耳在自由流出边缘的相对端处从主体部分延伸。
在再次进一步实施方式中,下凸耳围绕径向延伸的折痕折叠,该折痕从自由流出边缘的相对端径向延伸,使得下凸耳的第一部分平放在相应小叶的主体部分上,并且下凸耳围绕轴向延伸的折痕折叠,使得下凸耳的第二部分在与第一部分不同的平面中延伸,径向延伸的折痕和轴向延伸的折痕不平行。
在再次另一实施方式,每个下凸耳的第二部分缝合至相应的上凸耳。
在再次仍又进一步实施方式中,内裙部延伸超出框架的流出端和流入端中的至少一个并形成附接至框架的外表面的外裙部。
在再次仍又另一实施方式中,框架还包括组织接合元件,以允许人工心脏瓣膜固定到血管壁。
在仍又进一步实施方式中,组织接合元件包括生物可吸收胶,以防止组织接合元件扩张和允许人工心脏瓣膜被再定位。
在仍又进一步额外实施方式中,递送装置还包括围绕细长杆的一部分的可膨胀球囊,径向可扩张的人工心脏瓣膜被定位在球囊之上。
在仍又另一额外实施方式中,递送装置还包括外套管,径向可扩张的人工心脏瓣膜设置在该外套管中。
在仍又另一实施方式中,再生组织和第二再生组织选自polyglactin、胶原蛋白和聚乙醇酸。
在再次仍进一步实施方式中,再生组织还包括选自以下的细胞外基质蛋白:羟脯氨酸、玻连蛋白、纤连蛋白和胶原蛋白I型、胶原蛋白III型、胶原蛋白IV型、胶原蛋白VI、胶原蛋白XI、胶原蛋白XII、肌原纤蛋白I、生腱蛋白、饰胶蛋白聚糖、辅聚糖、多能聚糖、无孢蛋白和其组合。
在再次仍另一实施方式中,内裙部延伸超出框架的流出端和流入端中的至少一个并形成附接至框架的外表面的外裙部。
在仍进一步额外实施方式中,框架还包括生长因子,以促进再生组织的整合。
进一步实施方式包括使用导管植入人工心脏瓣膜的方法,其包括:进入患者的脉管系统;将径向可扩张的人工心脏瓣膜推进至患者的肺动脉,其中人工心脏瓣膜处于径向塌缩配置并包括具有流入端部分的框架,该流入端部分限定框架的流入端,其配置为当所述人工心脏瓣膜植入时接收进入人工心脏瓣膜的顺行血流,并且框架还具有流出端部分,该流出端部分限定与框架的流入端相对的框架的流出端,假体心脏瓣膜还包括定位在框架内的小叶结构、沿框架的内表面定位的内裙部,小叶结构由再生组织构造,和内裙部由第二再生组织构造,和人工心脏瓣膜安装在递送装置上;以及将径向可扩张的人工心脏瓣膜递送至患者的肺动脉。
在再次又进一步额外的实施方式中,经皮实现进入患者的脉管系统。
在再次又另一额外实施方式中,通过进入股静脉实现进入患者的脉管系统。
在再次仍又进一步额外实施方式中,通过患者的股静脉、下腔静脉、三尖瓣和右心室执行推进步骤。
在再次仍又另一额外实施方式中,递送装置是导管。
在另一进一步实施方式中,导管是包括球囊的球囊导管,球囊被萎缩,径向可扩张人工心脏瓣膜定位在球囊之上,和通过使球囊膨胀实现递送步骤,膨胀球囊使径向可扩张人工心脏瓣膜径向扩张。
在仍进一步实施方式中,导管是包括外套管的鞘导管,径向可扩张人工心脏瓣膜设置在外套管中,通过缩回外套管实现递送步骤,并且缩回套管允许径向可扩张人工心脏瓣膜扩张。
在又另一进一步实施方式中,框架由生物可吸收材料构造。
在另一实施方式,生物可吸收材料选自聚(L-丙交酯)、聚(D-丙交酯)、聚乙交酯、聚(L-丙交酯-共-乙交酯)、聚羟基链烷酸酯、多糖、蛋白质、聚酯、聚羟基链烷酸酯类、聚亚烷基酯、聚酰胺、聚己内酯、聚丙交酯-共-聚己内酯、聚乙烯酯、聚酰胺酯、聚乙烯醇、己内酯聚合物的改性衍生物、聚三亚甲基碳酸酯、聚丙烯酸酯、聚乙二醇、水凝胶、可光固化水凝胶、末端二醛、聚(L-丙交酯-共-三亚甲基碳酸酯)、聚羟基丁酸酯、聚羟基戊酸酯、聚-原酸酯、聚-酸酐、聚亚氨基碳酸酯、和其共聚物和组合。
在再次另一进一步实施方式中,框架还包括多个连合部窗口框架,以允许小叶结构的附接。
另一进一步额外实施方式,连合部窗口框架由非生物可吸收材料构造,和框架由生物可吸收材料构造。
在仍进一步实施方式中,小叶结构和内裙部由相同的再生组织构造。
在再次另一额外实施方式中,小叶结构包括多个小叶,每个小叶包括具有自由流出边缘的主体部分,从主体部分的相对侧延伸的两个相对的上凸耳,和两个相对的下凸耳,每个下凸耳从与相应上凸耳相邻的主体部分延伸,下凸耳在自由流出边缘的相对端处从主体部分延伸。
在再次进一步实施方式中,下凸耳围绕径向延伸的折痕折叠,该折痕从自由流出边缘的相对端径向延伸,使得下凸耳的第一部分平放在相应小叶的主体部分上,并且下凸耳围绕轴向延伸的折痕折叠,使得下凸耳的第二部分在与第一部分不同的平面中延伸,径向延伸的折痕和轴向延伸的折痕不平行。
在再次另一实施方式,每个下凸耳的第二部分缝合至相应的上凸耳。
在再次仍又另一实施方式中,框架还包括组织接合元件,以允许人工心脏瓣膜固定到血管壁。
在仍又进一步实施方式中,组织接合元件包括生物可吸收胶,以防止组织接合元件扩张和允许人工心脏瓣膜被再定位。
在仍又另一实施方式中,再生组织和第二再生组织选自polyglactin、胶原蛋白和聚乙醇酸。
在再次仍进一步实施方式中,再生组织还包括选自以下的细胞外基质蛋白:羟脯氨酸、玻连蛋白、纤连蛋白和胶原蛋白I型、胶原蛋白III型、胶原蛋白IV型、胶原蛋白VI、胶原蛋白XI、胶原蛋白XII、肌原纤蛋白I、生腱蛋白、饰胶蛋白聚糖、辅聚糖、多能聚糖、无孢蛋白和其组合。
在再次仍另一实施方式中,内裙部延伸超出框架的流出端和流入端中的至少一个并形成附接至框架的外表面的外裙部。
在仍进一步额外实施方式中,框架还包括生长因子,以促进再生组织的整合。
在又另一额外实施方式中,框架的流入端部分的外径小于框架的流出端部分的外径。
在再次进一步额外实施方式中,框架具有多个开口,并且当假体瓣膜处于径向塌缩配置时,小叶结构的部分通过该开口突出。
又进一步实施方式包括治疗患者的瓣膜疾病的方法,其包括:鉴定患者的瓣膜疾病;将人工心脏瓣膜植入患者的血管,其中人工瓣膜包括具有流入端部分的框架,该流入端部分限定框架的流入端,其配置为当所述人工心脏瓣膜植入时接收进入人工心脏瓣膜的顺行血流,并且框架还具有流出端部分,该流出端部分限定与框架的流入端相对的框架的流出端,假体心脏瓣膜还包括定位在框架内的小叶结构、沿框架的内表面定位的内裙部,小叶结构由再生组织构造,和内裙部由第二再生组织构造。
在又另一进一步额外实施方式中,瓣膜疾病选自:法鲁四联症和大动脉错位。
在另一进一步额外实施方式中,通过心脏直视手术执行植入步骤。
在再次另一进一步额外实施方式中,心脏直视手术包括沿肺动脉、向上并沿着肺支之一的纵向切口。
在又另一进一步额外实施方式中,通过使用包括细长杆的导管经导管插入执行植入步骤,人工心脏瓣膜是径向可扩张的并处于径向塌缩配置,并且人工心脏瓣膜安装在杆上。
在再次进一步实施方式中,通过经皮进入患者的脉管系统执行经导管插入。
在仍进一步实施方式中,通过进入患者的股静脉执行经导管插入。
在仍进一步额外实施方式中,导管被推进通过股静脉、下腔静脉、三尖瓣和右心室。
在再次仍又另一实施方式中,导管是包括球囊的球囊导管,其中球囊被萎缩,径向可扩张人工心脏瓣膜定位在球囊之上,和其中通过使球囊膨胀实现递送步骤,其中膨胀球囊使径向可扩张人工心脏瓣膜径向扩张。
在再次又进一步额外实施方式中,导管是包括外套管的鞘导管,径向可扩张人工心脏瓣膜设置在外套管中,和通过缩回外套管实现递送步骤,缩回套管允许径向可扩张人工心脏瓣膜扩张。
在仍又进一步额外实施方式中,框架由生物可吸收材料构造。
在另一实施方式,生物可吸收材料选自:聚(L-丙交酯)、聚(D-丙交酯)、聚乙交酯、聚(L-丙交酯-共-乙交酯)、聚羟基链烷酸酯、多糖、蛋白质、聚酯、聚羟基链烷酸酯类、聚亚烷基酯、聚酰胺、聚己内酯、聚丙交酯-共-聚己内酯、聚乙烯酯、聚酰胺酯、聚乙烯醇、己内酯聚合物的改性衍生物、聚三亚甲基碳酸酯、聚丙烯酸酯、聚乙二醇、水凝胶、可光固化水凝胶、末端二醛、聚(L-丙交酯-共-三亚甲基碳酸酯)、聚羟基丁酸酯、聚羟基戊酸酯、聚-原酸酯、聚-酸酐、聚亚氨基碳酸酯、和其共聚物和组合。
在又进一步额外实施方式中,框架还包括多个连合部窗口框架,以允许小叶结构的附接。
在再次另一进一步实施方式中,连合部窗口框架由非生物可吸收材料构造,和框架由生物可吸收材料构造。
在仍进一步实施方式中,小叶结构和内裙部由相同的再生组织构造。
在再次另一额外实施方式中,小叶结构包括多个小叶,每个小叶包括具有自由流出边缘的主体部分,从主体部分的相对侧延伸的两个相对的上凸耳,和两个相对的下凸耳,每个下凸耳从与相应上凸耳相邻的主体部分延伸,下凸耳在自由流出边缘的相对端处从主体部分延伸。
在再次进一步实施方式中,下凸耳围绕径向延伸的折痕折叠,该折痕从自由流出边缘的相对端径向延伸,使得下凸耳的第一部分平放在相应小叶的主体部分上,并且下凸耳围绕轴向延伸的折痕折叠,使得下凸耳的第二部分在与第一部分不同的平面中延伸,径向延伸的折痕和轴向延伸的折痕不平行。
在再次另一实施方式,每个下凸耳的第二部分缝合至相应的上凸耳。
在再次仍又另一实施方式中,框架还包括组织接合元件,以允许人工心脏瓣膜固定到血管壁。
在仍又进一步实施方式中,组织接合元件包括生物可吸收胶,以防止组织接合元件扩张和允许人工心脏瓣膜被再定位。
在仍又另一实施方式中,再生组织和第二再生组织选自polyglactin、胶原蛋白和聚乙醇酸。
在再次仍进一步实施方式中,再生组织还包括选自以下的细胞外基质蛋白:羟脯氨酸、玻连蛋白、纤连蛋白和胶原蛋白I型、胶原蛋白III型、胶原蛋白IV型、胶原蛋白VI、胶原蛋白XI、胶原蛋白XII、肌原纤蛋白I、生腱蛋白、饰胶蛋白聚糖、辅聚糖、多能聚糖、无孢蛋白和其组合。
在再次仍另一实施方式中,内裙部延伸超出框架的流出端和流入端中的至少一个并形成附接至框架的外表面的外裙部。
在仍进一步额外实施方式中,框架还包括生长因子,以促进再生组织的整合。
在又另一额外实施方式中,框架的流入端部分的外径小于框架的流出端部分的外径。
在再次进一步额外实施方式中,框架具有多个开口,并且当假体瓣膜处于径向塌缩配置时,小叶结构的部分通过该开口突出。
本文公开的治疗方法还包括模拟治疗的方法,例如用于训练和教育。这样的方法可以在任何合适的平台上执行,例如,尸体、其部分(例如尸体心脏和/或脉管系统),人的或非人的;物理模型;在计算机芯片上(例如在解剖幻影上);或这些平台的任何组合。
额外的实施方式和特征在下面的描述中部分地阐述,并且在审查说明书时对于本领域技术人员将部分地变得显而易见,或者可以通过本公开的实践而获悉。通过参考构成本公开的一部分的说明书的其余部分和附图,可以实现对本公开的本质和优点的进一步理解。
附图说明
当结合附图考虑以下详细描述时,将更好地理解本发明的这些和其他特征和优点,其中:
图1A图解了处于舒张期的人心脏的剖视图。
图1B图解了处于收缩期的人心脏的剖视图。
图2A–2E图解了肺动脉的截面图,其表明肺动脉可以具有多种不同的形状和大小。
图3A–3D图解了肺动脉的透视图,其表明肺动脉可以具有多种不同的形状和大小。
图4A图解了根据本发明的某些实施方式的示例性人工瓣膜的侧视图。
图4B图解了根据本发明的某些实施方式的示例性人工瓣膜的透视图。
图4C–4D图解了根据本发明的某些实施方式的示例性人工瓣膜的侧视图。
图4E图解了根据本发明的某些实施方式的部署在血管中的示例性人工心脏瓣膜的侧视图。
图5A–5G图解了根据本发明的某些实施方式的示例性小叶结构的组件。
图6A–6I图解了根据本发明的某些实施方式的小叶结构的示例性连合部部分的组件。
图7A–7G图解了根据本发明的某些实施方式的人工心脏瓣膜的示例性框架。
图8A–8R图解了根据本发明的某些实施方式的示例性组织接合元件的侧视图。
图9A–9D图解了根据本发明的某些实施方式的再生组织的整合和人工心脏瓣膜的生物可吸收材料的生物吸收的示例。
图10A图解了根据本发明的某些实施方式的人工心脏瓣膜的圆柱形框架。
图10B图解了根据本发明的某些实施方式的人工心脏瓣膜的沙漏形框架。
图11A和11B图解了根据本发明的某些实施方式的人工心脏瓣膜在肺动脉中的可能放置位置。
图12图解了处于收缩期的人心脏的剖视图,其显示了根据本发明的某些实施方式的使用导管植入人工心脏瓣膜的示例性路径。
图13图解了根据本发明的某些实施方式的处于压缩态并安装在球囊导管上的人工心脏瓣膜。
图14A和14B图解了根据本发明的某些实施方式的处于压缩态并安装在导管上的示例性人工心脏瓣膜的横截面图。
图15A–15C图解了根据本发明的某些实施方式的使用球囊导管的人工心脏瓣膜的示例性实施方式的部署。
图16A–16E图解了根据本发明的某些实施方式的使用鞘导管的人工心脏瓣膜的示例性实施方式的部署。
具体实施方式
现在转向图表和附图,本发明的实施方式一般涉及人工心脏瓣膜及其应用。尽管许多实施方式被图解为在肺动脉内使用,但是除了这里描述的那些之外的其他应用和其他实施方式也在本技术的范围内,使得人工瓣膜可以用于解剖结构、心脏或脉管系统的其他区域,如上腔静脉或下腔静脉。此外,本技术的实施方式可具有与本文所述的那些不同的配置、零件或程序。因此,本领域的普通技术人员将相应地理解,该技术可以具有包括附加元件的其他实施方式,或者该技术可以具有其他实施方式,其没有以下示出和描述以及在附图中示出的数个特征。
应当注意的是,本文公开了用于递送和植入的人工瓣膜和系统的各种实施方式,并且可以进行这些选项的任何组合,除非明确排除。同样,人工瓣膜的不同构造可以混合和匹配,例如通过组合任何瓣膜类型和/或特征、组织覆盖物等,即使没有明确公开。简而言之,除非相互排斥或物理上不可能,否则可以组合所公开系统的各个零件。
为了统一起见,在这些图和其他应用中,人工瓣膜被描绘成肺分叉端向上,而心室端向下。这些方向也可以称为“远侧”作为向上或肺分叉端的同义词,以及“近侧”作为向下或心室端的同义词,它们是与医生视角相关的术语。
图1A和1B图解了处于舒张期(图1A)和收缩期(图1B)的人类心脏H的剖视图。右心室RV和左心室LV与右心房RA和左心房LA分别通过三尖瓣TV和二尖瓣MV(即房室瓣)分开。此外,主动脉瓣AV将左心室LV与升主动脉(未识别)分开,肺动脉瓣PV将右心室与主肺动脉PA分开。这些瓣膜中的每一个都具有向内延伸穿过相应孔口的柔性小叶,这些小叶在流动流中聚集或“接合(coapt)”以形成单向流体阻塞表面。本申请的人工瓣膜主要关于肺动脉瓣进行描述。因此,将更详细地解释右心房RA和右心室RV的解剖结构。应当理解,本文所述的器械也可用于其他区域,例如下腔静脉和/或上腔静脉中,作为对反流(regurgitant)或以他方式有缺陷的三尖瓣的治疗;在主动脉(如,扩大的主动脉)中,作为对有缺陷的主动脉瓣的治疗;在心脏或脉管系统的其他区域中,在移植物中等。
右心房RA通过上腔静脉SVC和下腔静脉IVC接受来自静脉系统的脱氧血液,前者从上方进入右心房,后者从下方进入右心房。冠状窦CS是静脉连接在一起形成一个大血管的集合,其从心肌(心肌)(heart muscle(myocardium))收集脱氧血液,并将其递送到右心房RA。在舒张期或舒张期间,参见图1A,右心房RA中收集的静脉血通过右心室RV的扩张进入三尖瓣TV。在收缩期或收缩中,参见图1B,右心室RV收缩,迫使静脉血通过肺动脉瓣PV和肺动脉进入肺部。在一个示例性实施方式中,本申请所描述的器械用于替换或补充有缺陷的肺动脉瓣的功能。在收缩期期间,三尖瓣TV的小叶关闭以防止静脉血反流回到右心房RA。
参考图2A–2E和3A–3D,图解的非详尽示例图解了主肺动脉可以具有多种不同的形状和大小。例如,如图2A-2E的截面图和图3A-3D的透视图所示,不同患者的主肺动脉之间的长度、直径和曲率或轮廓可能会有很大差异。此外,直径可以沿着单个主肺动脉的长度显着变化。这些差异在患有某些病症和/或因先前手术而受损的主肺动脉中可能更加显著。例如,法鲁四联症(TOF)或大动脉错位(TGA)的治疗往往导致更大和更不规则形状的主肺动脉。
法鲁四联症(TOF)是一种心脏异常,是指四种相关的心脏缺陷一起共同发生的组合。这四种缺陷是室间隔缺损(VSD)、骑跨主动脉(其中主动脉瓣被扩大,并似乎从左心室和右心室产生,而不是如正常心脏中的左心室)、肺动脉狭窄(肺动脉瓣和流出道或瓣膜下方的区域变窄,这导致从右心室到主肺动脉的血流受阻)和右心室肥厚(右心室肌肉壁增厚,其因为右心室以高压泵送而发生)。
大动脉错位(TGA)是指主动脉和肺动脉从其正常位置“转位”,使得主动脉起自右心室和肺动脉起自左心室的异常。
一些病症的外科治疗涉及沿肺动脉、向上并沿肺支之一的纵向切口。该切口可以消除或显著损害肺动脉瓣的功能。手术后使用跨瓣环补片(trans-annular patch)覆盖切口。跨瓣环补片可以减少与其他手术相关的主肺动脉PA的狭窄或受限病症。然而,跨瓣环补片技术也可导致主肺动脉在大小和形状上有很大程度的变化(参见图3A-3D)。肺动脉瓣PV的损伤或消除可造成严重的反流,并且在本发明之前,通常需要之后的心脏直视手术来替换肺动脉瓣。
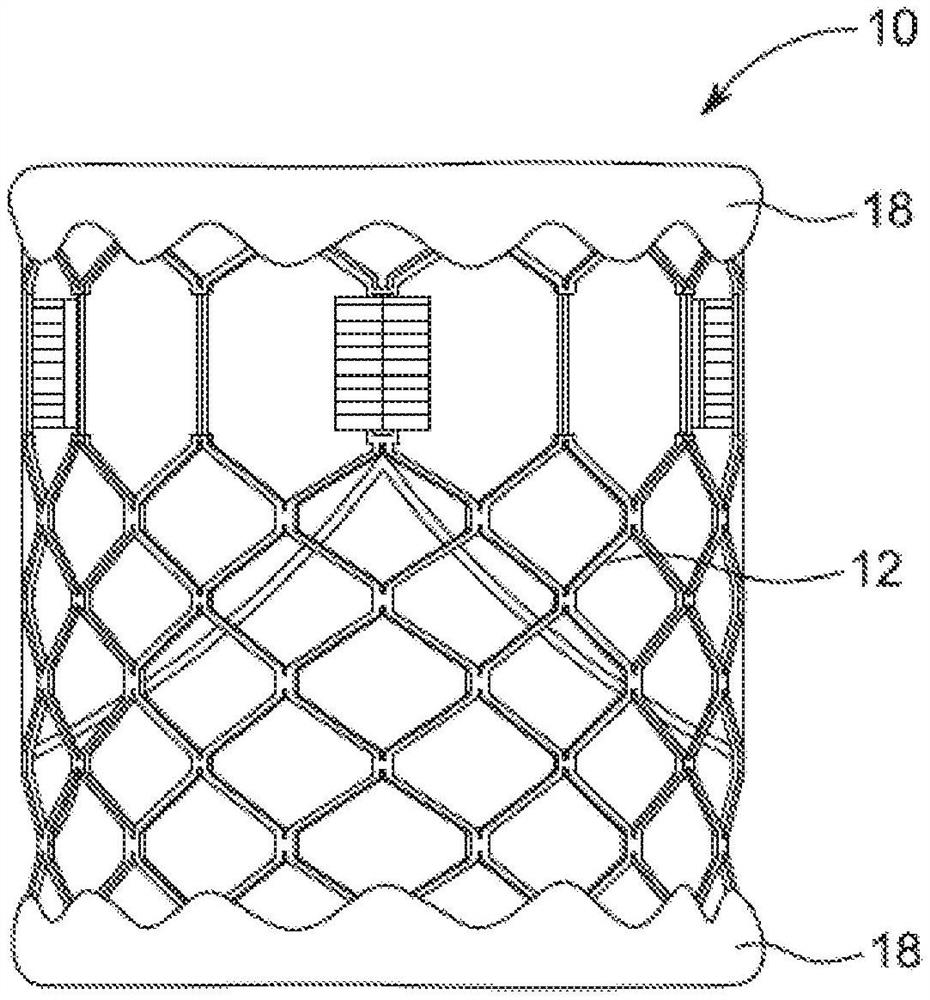
转向图4A-4D,图解了本发明的实施方式。图解的瓣膜适于植入患者的主肺动脉中,尽管在其他实施方式中,这些实施方式也可以适于植入其他血管中,其包括主动脉和各种天然的心脏瓣环。图4A-4E中图解的人工瓣膜10图解为示出在图底部的流入端和在图顶部的流出端,从而形成人工瓣膜10的流入端和流出端之间的纵轴。流入端被配置为接收流过患者循环系统的顺行血液。在各种实施方式中,人工瓣膜10包括:支架或框架12、小叶结构14和内裙部16。在一些实施方式中,内裙部16沿人工瓣膜10的纵轴延伸框架12的整个长度,例如图4A和4B所示。然而,在额外的实施方式中,例如图4C所示,形成内裙部16的组织可以比框架12长并且可以包裹在框架12的一端或两端之上以形成外裙部18,从而当被放置到肺动脉干中时减少或消除框架12的暴露。进一步的实施方式可以包括将人工瓣膜10固定在患者的肺动脉干中的各种机构。在一些实施方式中,例如图4D所示,固定机构将是从框架12突出的组织接合元件170。这些组织接合元件170可以将人工瓣膜10的框架12保持在患者血管中的适当位置。
人工心脏瓣膜10的各种实施方式被设计成可扩张的,使得框架12可以被压缩成塌缩配置。如图4A-4E所示,可扩张的人工心脏瓣膜的各种实施方式包括由成角度支柱形成的框架,该成角度的支柱形成蜂窝状结构。关于可扩张结构的其他细节将在下面描述。
在人工心脏的一些实施方式中,用于构造这些各种元件的材料可以是永久性的或稳定的,以允许移除和/或替换人工心脏瓣膜。在其他实施方式中,用于构造这些各种元件的材料可以被选择以允许零件与身体整合;例如,用于裙部和/或小叶的组织可以是再生组织,身体可以将其整合到原生血管中。另外地,一些实施方式的框架的至少一部分可以选自生物可吸收材料,从而允许框架降解。进一步的实施方式可以使用用于框架的生物可吸收材料和用于小叶和/或裙部的再生组织两者,可以允许人工心脏瓣膜与人体完全整合和随人体生长。上面描述的各种零件的材料和构造方法将在下面描述。还应该注意的是,当需要出现时,各种实施方式可以使用上述元件的任何组合,以有效替换患者体内的瓣膜。
图4B图解了一些实施方式的人工瓣膜10的流出端的透视图。如图4B所示,一些实施方式具有小叶结构14,其包括三个小叶40,其可以布置成以三尖瓣布置塌缩,尽管额外的实施方式可以具有更多或更少数量的小叶40。在各种实施方式中,单个小叶40在连合部122处连接。在一些实施方式中,这些连合部122可以缝合到内裙部16,而其他实施方式可以使连合部122穿过连合部窗框30以便将小叶结构14附接到框架12。可选地,某些实施方式可以通过将连合部122缝合到内裙部16和使连合部122穿过连合部窗框30将连合部122固定到内裙部16和框架12两者上。有关连接小叶和连合部的其他细节将在下面详细描述。
在额外的实施方式中,内裙部16通过缝合固定到框架12。将内裙部16缝合到框架12可以作为将内裙部16固定到框架12的唯一手段,或将内裙部16缝合到框架12可以使用小叶结构14的连合部122结合固定内裙部16与框架12。可以通过本领域已知的手段来完成将内裙部16缝合到框架12上,使得在一些实施例中,内裙部16固定到框架12并且可以允许人工瓣膜10扩张。在美国专利号9,393,110中描述了这种缝合方法,其公开内容通过引用以其整体并入本文。
如图4B所示,各种实施方式的小叶结构14的下边缘期望地具有起伏的弯曲扇形形状(图4A中所示的缝合线154跟踪小叶结构的扇形形状)。通过形成具有这种扇形几何形状的小叶,小叶上的应力减小,其进而提高瓣膜的耐用性。此外,凭借扇形形状,可以消除或至少最小化每个小叶腹部(每个小叶的中心区域)处的可能导致这些区域早期钙化的褶皱和波纹。扇形几何形状还减少了用于形成小叶结构14的组织材料的量,从而允许在瓣膜的流入端处具有更小、更均匀的卷曲轮廓。小叶40可由各种天然或合成材料形成,包括心包组织(例如,牛心包组织)、生物相容的合成材料,或本领域已知的和美国专利号5,198,100中描述的各种其他合适的天然或合成材料,其全部内容以其全部通过引用方入本文。在另外的实施方式中,小叶40和小叶结构14可以由再生组织形成以允许将小叶整合到患者组织中。关于再生组织的使用和制造的细节描述如下。
根据一些实施方式的部署的人工瓣膜10在图4E中示出。在该图中,人工瓣膜10已经被放置在患者的血管900中,例如主肺动脉中。框架12在点P处接触血管壁902的部分。在一些实施方式中,点P将包括如上所述的组织接合元件170。在一些实施方式中,内裙部16,或在额外的实施方式中,外裙部18可以接触血管壁902,以形成组织接触部,这可以促进用于瓣膜构造(包括内裙部16、外裙部18和小叶(未示出))的再生组织的整合。
现在转向图5A–5G,根据各种实施方式详述了小叶结构的构造。如图5A中最佳所示,所示构造中的每个小叶40具有在小叶的相对侧上的相对上凸耳112之间延伸的上(流出)自由边缘110。在每个上凸耳112下方有将上凸耳与对应的下凸耳116分开的切口114。在下凸耳116的相应端部之间延伸的小叶的下(流入)边缘部分108包括垂直的或轴向的边缘部分118和基本上V形的中间边缘部分120,垂直的或轴向的边缘部分118在从对应的下凸耳116向下延伸的小叶的相对侧上,和基本上V形的中间边缘部分120具有在小叶的下端部处的平滑弯曲的顶点部分119和在轴向边缘部分和顶点部分之间延伸的一对倾斜部分121。在一些实施方式中,倾斜部分可具有比顶点部分更大的曲率半径。在各种其他实施方式中,每个小叶40可具有固定(例如,缝合)到下边缘部分108的内表面的加强条带72,如图5B所示。
在实施方式中,小叶40可以在它们的相邻侧处彼此固定以形成连合部。多个柔性连接器124(其中一个在图5C中示出)可用于互相连接小叶的成对的相邻侧并将小叶安装到各种实施方式的框架上。柔性连接器124可由天然或合成材料制成,例如如下所述的再生组织或一片编织的PET织物。应当注意,可以使用其他合成和/或天然材料。每个柔性连接器124可包括在连接器的中心处从下边缘延伸到上边缘的楔形件126。楔形件126可包括用临时缝合128固定到连接器的非金属材料,例如但不限于绳索、线(thread)、缝合材料或一片再生组织。在各种实施方式中,一旦将楔形件126固定到某些实施方式的框架上,楔形件126有助于防止小叶凸耳的旋转运动。连接器124可具有沿其上边缘和下边缘形成的一系列内切口130和外切口132。
图5D示出了两个小叶40的相邻侧通过柔性连接器124互相连接的实施方式。在这样的实施方式中,柔性连接器124的相对端部可以与具有与凸耳116的垂直边缘对准的内切口130的下凸耳116成重叠关系放置。通过沿着从下边缘上的外切口132延伸到连接器的上边缘上的外切口132的线缝合,可以将每个凸耳116固定到柔性连接器124的对应端部。可以使用三个柔性连接器124将三个小叶40彼此并排固定,如图5E所示。
现在参考图5F和5G,在各种实施方式中,两个小叶的相邻子连合部部分118可以直接彼此缝合。在所示示例中,缝合材料用于形成进出缝线133和梳状缝线134,它们延伸穿过两个小叶上的子连合部部分118和加强条带72。剩余的两对相邻的子连合部部分118可以以相同的方式缝合在一起以形成组装的小叶结构14,然后可以以下列方式将其固定到框架。
图6A-6G示出了用于将小叶结构14的连合部部分122固定到框架的连合部窗口框架30的一种具体方法的实施方式。首先,如图6A所示,固定两个小叶40的相邻侧的柔性连接器124被横向折叠,并将上凸耳部分112向下折叠抵靠柔性连接器124。如图6A和6B所示,每个上凸耳部分112被纵向(垂直)折缝以呈现L形,具有抵靠小叶的内表面折叠的内部142和抵靠连接器124折叠的外部144。然后可以将外部144沿缝合线146缝合到连接器124上。接下来,如图6B所示,将连合部凸耳组件(由一对通过连接器124连接的下凸耳部分116组成)插入穿过连合部窗口框架30。图6C为人工瓣膜10的侧视图,其显示了通过连合部窗口框架30向外延伸的连合部凸耳组件。
图6D-6G图示了根据一些实施方式的将连合部固定到框架的方法。具体地,图6D示出了框架和小叶结构的一部分的横截面视图,其显示了固定到对应连合部窗口框架30上的两个小叶的相邻凸耳部分,而图6E-6G显示了框架和小叶结构的一部分的透视图,其显示了固定到对应连合部窗口框架30的两个小叶的相邻凸耳部分。如图6D和6E所示,连合部凸耳组件在楔形件126处被径向向内按压,使得下凸耳部分116中的一个和连接器124的一部分折叠在连合部窗口框架30的一侧上抵靠框架12,而另一个下凸耳部分116和连接器124的一部分折叠在连合部窗口的另一侧上抵靠框架12。形成一对缝合线148以按图6D所示的方式将下凸耳部分116保持抵靠框架12。每条缝合线148延伸穿过连接器124、下凸耳部分116、楔形件126和连接器124的另一部分。然后,如图6D和6F所示,用主缝合线150将每个下凸耳部分116固定到对应的上凸耳部分112,主缝合线150延伸穿过连接器124的一层、下凸耳部分116、连接器124的另一层、连接器124的另一层和上凸耳部分112。最后,如图6D和6G所示,用于形成主缝合线150的缝合材料可用于在凸耳部分112、116的边缘处进一步形成锁缝(whipstitch)152,其延伸穿过夹在上凸耳部分112和下凸耳部分116之间的两层连接器124。
如图6A和6D所示,在实施方式中,向下折叠的上凸耳部分112在连合部处形成双层小叶材料。上凸耳部分112的内部142被平放,并且邻接形成连合部的两个小叶40的层,使得每个连合部在连合部窗口框架30的内部正好包括四层小叶材料。与小叶40的刚好从相对更刚性的四层部分径向向内的部分相比,连合部的该四层部分可以更耐弯曲或铰接(articulating)。这导致小叶40响应于在体内操作期间流过瓣膜的血液而主要在向下折叠的内部142的内边缘143处铰接,而不是与围绕连合部窗口框架30的轴向支柱进行铰接。因为小叶在与连合部窗口框架30径向向内间隔开的位置处铰接,所以小叶可避免与框架接触和损坏。然而,在高的力下,连合部的四层部分可以围绕与连合部窗口框架30相邻的纵轴145(图6D)张开,每个内部142抵靠相应的外部144折叠。例如,当人工瓣膜被压缩并安装到递送杆上时,可能会发生这种情况,从而允许较小的卷曲直径。当在瓣膜的扩张期间,使球囊导管膨胀时,连合部的四层部分也可以围绕轴线145张开,这可以减轻由球囊引起的连合部上的一些压力,并因此连合部在扩张期间中不被损坏。
附加实施方式可用于通过其他方法固定连合部。图6H和6I图解了连合部的实施方式的横截面图,其利用不同方法将连合部固定到某些实施方式的框架。具体地,图6H图解了连合部凸耳组件,其穿过连合部窗口框架30并在楔形件126处径向向内按压,使得一个下凸耳部分116和连接器124的一部分抵靠连合部窗口框架30的一侧上的内裙部16折叠。形成一对缝合线148,以保持下凸耳部分116抵靠内裙部16。每条缝合线148延伸通过连接器124、下凸耳部分116、楔形件126和连接器124的另一部分。然后,用主缝合线150将每个下凸耳部分116固定至内裙部16,主缝合线150延伸穿过连接器124的一层、下凸耳部分116、连接器124的另一层和内裙部16。额外的缝合线156可以被应用于连接器-凸耳-裙部组件,以提供额外的强度和/或固定可以存在的另外组织。
图6I图解了连合部凸耳组件穿过内裙部16并在楔形件126处径向向内按压,使得连合部凸耳组件附接至裙部而不附接至框架的实施方式。在此类实施方式中,用主缝合线150将每个下凸耳部分固定至内裙部16,主缝合线150延伸通过连接器124的一层、下凸耳部分116、连接器124的另一层和内裙部16。可以存在一对缝合线148,以保持下凸耳部分116抵靠内裙部16。每条缝合线148延伸通过连接器124、下凸耳部分116、楔形件126和连接器124的另一部分。在一些实施方式中,每条缝合线148可以进一步延伸通过内裙部16。然后,额外的缝合线156可以被应用于连接器-凸耳-裙部组件,以提供额外的强度和/或固定可以存在的另外组织。
在各种实施方式中,在将所有连合部凸耳组件固定至相应的连合部窗口后,连合部凸耳组件之间的小叶40的下边缘可以被缝合至内裙部16。关于将小叶缝线至人工瓣膜的内裙部的细节可以在Levi等人的美国专利号9,393,110中发现,其公开内容通过引用以其全部并入本文。
在各种实施方式中,用于内裙部和小叶结构(包括小叶)的组织是再生组织,使得人工瓣膜将整合到接受人工瓣膜的个体的身体内。合适的材料将允许患者身体完全整合该材料,使得该材料随着患者身体继续生长。这种材料将允许瓣膜结构和裙部随着患者心脏生长以伴随方式生长,使得不需要替换。再生材料可包括来自天然来源的脱细胞化组织,这可能需要结扎分支血管。可选地,一些实施方式将使用人工构建体来形成再生组织,其被工程化并且可不需要结扎部分的步骤。人工组织构建体的示例包括但不限于由polyglactin、胶原蛋白和聚乙醇酸产生的组织,它们形成支架或构建体。在使用人工构建体的一些实施方式中,人工构建体包括细胞外基质蛋白,以允许组织的整合。再生组织以及构建这些材料的示例可以在Tranquillo等人的美国专利号6,666,886和Dahl等人的美国专利号9,657,265中发现,其公开内容通过引用以其全部并入本文。
在使用聚乙醇酸支架的实施方式中,聚乙醇酸支架是生物可吸收的,并且细胞外基质蛋白将允许宿主组织的接种,从而将再生组织并入到患者体内。合适的细胞外基质蛋白的示例包括但不限于羟脯氨酸、玻连蛋白、纤连蛋白和胶原蛋白I型、胶原蛋白III型、胶原蛋白IV型、胶原蛋白VI、胶原蛋白XI、胶原蛋白XII、肌原纤蛋白I、生腱蛋白、饰胶蛋白聚糖、辅聚糖、多能聚糖、无孢蛋白和其组合。在一些实施方式中,聚乙醇酸支架将包括支架内的细胞外基质蛋白,而在其他实施方式中,细胞外基质蛋白将以细胞外基质蛋白覆盖聚乙醇酸支架。在又进一步实施方式中,细胞外基质蛋白将既在聚乙醇酸支架内又包被(涂覆)聚乙醇酸支架。
在某些实施方式中,裙边将与肺动脉干组织融合,并为小叶提供锚固点和为瓣膜提供结构支撑。各种实施方式将对于裙部和小叶使用不同的再生组织,以提供提高的组织整合。这种组合可以提高小叶的柔性,同时在并入作为血管壁的裙部中保持更大的刚度或强度。
参考图7A和7B,示出了根据某些实施方式的框架12。所示实施方式中的框架12包括成角度的支柱22的下部第一排I,所述成角度的支柱22端对端布置并且在框架的流入端处周向延伸;周向延伸的成角度的支柱24的第二排II;周向延伸的成角度的支柱26的第三排III;周向延伸的成角度的支柱28的第四排IV;以及在框架的流出端处周向延伸的成角度的支柱32的第五排V。多个基本笔直的轴向延伸的支柱34可用于将第一排I的支柱22与第二排II的支柱24互相连接。成角度的支柱32的第五排V通过多个轴向延伸的窗口框架部分30(其限定连合部窗口20)和多个轴向延伸的支柱31连接到成角度的支柱28的第四排IV。每个轴向支柱31和每个框架部分30从由两个成角度的支柱32的下端会聚限定的位置延伸到由两个成角度的支柱28的上端会聚限定的另一个位置。图7C-7G是由图7B中分别由字母A、Β、C、D和E标识的框架12的部分的放大视图。
根据许多实施方式,每个连合部窗口框架部分30安装到小叶结构14的相应连合部。可以看出,每个框架部分30在其上端和下端处固定到相邻排的支柱以提供坚固的配置,其与用于支撑小叶结构的连合部的已知悬臂支柱相比,增强了瓣膜在循环载荷下的抗疲劳性。这种配置能够减小框架壁厚以实现较小的瓣膜卷曲直径。在特定实施方式中,在内径和外径之间测量的框架12的厚度T(图7A)为约0.48mm或更小。
框架的支柱和框架部分共同地限定了框架的多个开放孔(cell)。在框架12的流入端,支柱22、支柱24和支柱34限定了限定开口36的下排孔。支柱24、26和28的第二、第三和第四排限定了限定开口38的中间两排孔。支柱28和32的第四排和第五排连同框架部分30和支柱31一起限定了限定开口40的上排孔。开口40与中间开口38和/或下部开口36相比相对较大,并且大小被设计成当框架12被卷曲以最小化卷曲轮廓时允许小叶结构14的部分突出或凸起进入和/或通过开口40。
如图7D最佳所示,在各种实施方式中,支柱31的下端在节点或连接处44处连接到两个支柱28,并且支柱31的上端在节点或连接处46处连接到两个支柱32。在一些实施方式中,支柱31的厚度S
在许多实施方式中,框架12被配置成防止或至少最小化瓣膜在预定球囊压力下可能的过度扩张,尤其是在支撑小叶结构14的框架的流出端部分处。在一方面,框架被配置为在支柱之间具有相对较大的角度42a、42b、42c、42d、42e。角度越大,打开(扩张)框架所需的力就越大。当框架12处于其压缩状态时(例如,安装在球囊上)。当框架被压缩时,支柱两端之间的垂直距离最大,当施加来自球囊膨胀(或另一个扩张器械的扩张)的打开力时,在相反方向作用于支柱端部的力之间会提供一个相对大的力矩。当框架径向扩张时,支柱两端之间的垂直距离减小。随着垂直距离的减小,力之间的力矩也减小。因此,可以看出,随着支柱端部之间的垂直距离和力矩减小,需要相对更大的扩张力。而且,随着框架扩张,在支柱的端部处的应变硬化(加强)增加,这增加了在支柱的端部处引起进一步塑性变形所需的扩张力。因此,在各种实施方式中,可以选择框架的支柱之间的角度以限制框架在给定打开压力(例如,球囊的膨胀压力)下的径向扩张。在具体实施方式中,当框架扩张至其功能尺寸时,这些角度至少为110度或更大,更具体地,当框架扩张至其功能尺寸时,这些角度至少为120度或更大。
此外,如图7B所示,在一些实施方式中,框架中最下排开口中的开口36与中间两排开口中的开口38相比相对更大。这种配置允许框架在卷曲时呈现从瓣膜流出端处的最大直径到瓣膜流入端处的最小直径逐渐变细的整体锥形形状。当卷曲时,框架12具有沿着与框架的流入端相邻的框架的一部分延伸的直径减小的区域。下部区域的直径与框架上部的直径相比减小。当瓣膜部署时,框架可以扩张成图7A所示的圆柱形。
在一些实施方式中,框架可由如此材料构成,使得框架在引入时在体内保持完整,而其他实施方式可由生物可吸收的材料构成,使得框架在体内最终降解。用于构造框架的材料将在下面详细讨论。当由塑性可扩张的材料制成时,框架12(以及因此瓣膜10)可以在递送导管上卷曲到径向压缩状态,然后在患者体内通过可膨胀球囊或等效扩张机制扩张。当由自扩张材料构成时,框架12(以及因此瓣膜10)可以被卷曲到径向压缩状态并且通过插入到递送导管的鞘或等效机构中而被限制在压缩状态。一旦在体内时,瓣膜可以从递送鞘推进,这允许瓣膜扩张到其功能尺寸。
如上所述,在各种实施方式中,框架12将包括组织接合元件170以将人工瓣膜10固定到患者的血管。图8A-8R示出了可以放置在框架12上的各种可能的组织接合元件。在图8A的实施方式中,组织接合元件170包括在其远侧尖部452附近形成有菱形窗口451的杆450,远侧尖部452可以足够锋利以穿透组织。在这样的实施方式中,形状可以被设置为使得窗口451在扩张配置中偏向(biased toward)被打开,如图8A所示。在递送器械之前,窗口451可以被捏合关闭并且可以将生物可吸收胶455注入到窗口451中以将其保持在闭合配置中,如图8B所示。在该器械部署时,远侧尖端452可以穿透原生组织,如,血管壁,如图8C所示。窗口451内的胶455将其保持在闭合配置一段时间,以允许操作员在必要时重新放置或移出该器械。如果留在适当位置,胶455会腐蚀,从而允许窗口451重新打开到扩张配置,其将组织接合元件170保持在组织中,如图8D所示。
在图8E-8H所示的实施方式中,组织接合元件170包括箭头形尖端453,该尖端453具有两个或更多个翼部454,该翼部454偏置成径向向外成角度并指向近侧方向,如图8E所示。生物可吸收胶或涂层455可以施加在箭头尖端453上以将翼部454保持在径向收缩配置中,如图8F所示。在收缩配置中,器械100被部署使得组织接合元件170刺穿原生组织,如图8G所示。生物可吸收涂层455然后逐渐侵蚀,直到它允许翼部454返回到横向扩张配置,如图8H所示,从而将组织接合元件170保持在组织中。
图8I-8L示出了进一步实施方式。在该实施方式中,组织接合元件170包括处于未偏置状态的螺旋尖端456。生物可吸收涂层455可用于将螺旋尖端456保持在伸直配置中,如图8J所示。组织接合元件170可以在收缩配置中穿透组织,并且当生物可吸收涂层455充分侵蚀以允许螺旋尖端456返回到其部署配置时,组织接合元件170可以保持在组织中。
图8M-8R是可以并入在各种器械结构(统称为“ST”)上的额外组织接合元件的实施方式的放大侧视图,诸如支柱、连接器、柱、臂和/或肋,其可以并入到器械特征,诸如锚固构件110或瓣膜支撑件120。例如,代替组织接合元件170或除组织接合元件170之外,额外组织接合元件还可以包括一个或多个切出的突出部350(图8M和8N)。在塌缩或伸直的配置中,如图8O的侧视图所示,切出的突出部350相对于结构ST的表面保持低起伏(low relief)以在递送期间保持低轮廓。随着器械100扩张并且结构ST改变为其部署配置(如,图8P所示的曲率),突出部与ST分离至更高的起伏。突出部350还可以被配置为抓握瓣环下(subannular)组织,将切出的突出部拉离结构ST甚至更远。器械结构ST还可以成形为包括沿其边缘或面的一个或多个的尖锐突出部352,如图8Q所示,或者还可以包括尖鳞状突出部354,如图8R所示。
根据各种实施方式,可用于形成在体内保持完整的经导管框架12和组织接合元件170的合适的塑性可扩张材料包括但不限于不锈钢、镍基合金(如,钴-铬或镍-钴-铬合金)、镍钛诺、某些聚合物或其组合。在具体实施方式中,框架12由镍-钴-铬-钼合金制成,诸如
然而,一些实施方式具有生物可吸收框架和组织接合元件,其可以由合适的材料构造,所述材料包括但不限于聚(L-丙交酯)(PLLA)、聚(D-丙交酯)(PDLA)、聚乙交酯(PGA)、聚(L-丙交酯-共-乙交酯)(PLGA)、聚羟基链烷酸酯(PHA)、多糖、蛋白质、聚酯、聚羟基链烷酸酯类、聚亚烷基酯、聚酰胺、聚己内酯、聚丙交酯-共-聚己内酯、聚乙烯酯、聚酰胺酯、聚乙烯醇、己内酯聚合物的改性衍生物、聚三亚甲基碳酸酯、聚丙烯酸酯、聚乙二醇、水凝胶、可光固化水凝胶、末端二醛、聚(L-丙交酯-共-三亚甲基碳酸酯)、聚羟基丁酸酯;聚羟基戊酸酯、聚-原酸酯、聚-酸酐、聚亚氨基碳酸酯、和其共聚物和组合。
另外,具有生物可吸收框架的一些实施方式将用增强组合物进行增强。用于生物可吸收框架的增强组合物可包括镁和镁合金。镁及其合金是生物相容的、生物可吸收的且易于机械操纵,为增强生物可吸收聚合物支架提供了有吸引力的解决方案。镁的放射学优势包括与磁共振成像(MRI)、磁共振血管造影术和计算机断层扫描(CT)的兼容性。包括镁及其合金的脉管支架比其他裸金属支架更不易形成血栓。镁及其合金的生物相容性源于其对细胞的相对无毒性。镁在动植物组织中含量丰富,特别地,镁是细胞中第四富含的金属离子,最富含的游离二价离子,并因此深深地和内在地融入(woven)细胞代谢。镁依赖性酶几乎出现在每一个代谢途径中,也被用作信号传导分子。生物可吸收且适用于增强生物可吸收聚合物支架的镁合金包括镁与其他金属(包括但不限于铝和锌)的合金。在一个实施方式中,镁合金包含约1%至约10%之间的铝和约0.5%至约5%之间的锌。
本发明的镁合金包括但不限于Sumitomo Electronic Industries(SEI,Osaka,Japan)镁合金AZ31(3%的铝、1%的锌和96%的镁)以及AZ61(6%的铝、1%的锌和93%的镁)。合金的主要特性包括高拉伸强度和响应延展性。典型的AZ31合金的拉伸强度至少为280MPa,而AZ61合金的拉伸强度至少为330MPa。
具有生物可吸收镁材料的增强生物可吸收聚合物材料可以通过以下方法之一完成,包括但不限于使用生物可吸收镁线、镁纤维缠绕在聚合物支架周围或在聚合物支架内或浸渍在生物可吸收聚合物框架内。
在某些实施方式中,用于框架和组织接合元件的特定材料被选择为允许框架被经历瓣膜置换的患者的身体吸收。可以基于身体吸收或并入特定材料的时间来选择这些材料的吸收特性。因此,可以使用不同的材料或材料的组合来确保框架在再生组织与患者组织整合之后溶解。因此,如果组织的整合发生在不到一年的时间内,那么将需要保持瓣膜完整性一年以上的框架材料。例如,如果再生组织的整合发生在6-12个月的时间范围内,框架应保持其完整性至少一年,并在3、6、9或12个月的时间段内被身体完全吸收。因此,在24个月结束时,人工瓣膜将完全整合到身体中,几乎没有或没有剩余的框架残留物。
图9A-9D图解了框架的整合和吸收过程的示例。图9A图解了植入患者肺动脉干中的人工瓣膜10的实施方式。如该图中所见,框架12是完整的并且内裙部组织尚未与患者的组织整合。在图9B中,包括内裙部16的组织部分已经与患者的组织整合,而框架仍然存在以在此过程期间为人工瓣膜10提供支撑。图9C和9D图解了人工瓣膜10的完全整合,其中组织已整合且框架已被吸收。
进一步,一些实施方式将在框架中使用非生物可吸收材料和生物可吸收材料的组合。使用生物可吸收材料和非生物可吸收材料的组合将允许框架的一些部分降解,而某些部分将在患者体内保持完整以随着时间的推移继续提供支撑。某些实施方式由包括非生物可吸收连合部窗口的生物可吸收框架制成。在具有非生物可吸收连合部窗口和生物可吸收框架的实施方式中,框架将随着时间而降解,但是连合部窗口将在体内保持永久,以通过永久地固定瓣膜结构的连合部为小叶提供额外的支撑。图9D示出了组织与患者身体完全整合的实施方式,框架已被吸收,而连合部窗口框架30由非生物可吸收材料制成并在框架完全吸收后仍存在于体内。
额外的实施方式将包括框架和组织接合元件中的生长因子。生长因子可以刺激或促进再生组织与患者的整合。可用于实施方式中的生长因子的示例包括但不限于转化生长因子α(TGF-α)、转化生长因子β(TGF-β)、碱性成纤维细胞生长因子(bFGF)、脉管上皮生长因子(VEGF)和其组合。在某些实施方式中,生长因子被并入框架材料中,而一些实施方式具有涂覆框架材料的生长因子。在额外的实施方式中,生长因子既并入框架材料中又涂覆框架材料。生长因子可配制成随时间释放或可在生物吸收过程中随着框架降解而释放。
尽管到目前为止已经在图中示出了具体的人工瓣膜形状,但是应当理解这些形状可以根据具体应用而变化。现在转向图10A和10B,示出了根据实施方式的人工瓣膜的各种示例性形状。如上述和图10A所示,框架本质上可以是圆柱形的,以便安装在患者的肺动脉干中。圆柱形框架可适合放置在血管中远离原生瓣膜的点处,使得人工瓣膜补充患者中有毛病或有缺陷的瓣膜。然而,一些实施方式将使用沙漏形框架用于人工瓣膜,如图10B所示。沙漏形框架可为人工瓣膜提供某些优势,使得沙漏形瓣膜可放置在瓣膜的原生位置处。以此方式,沙漏瓣膜就可以替换原生瓣膜而不是补充该瓣膜。沙漏瓣膜通过放置在如此位置处来完成此任务,在该位置沙漏框架的腰部位置为原生瓣膜瓣(valve flap)提供空间。
人工瓣膜10在主肺动脉PA中放置的示例如图11A-11B所示。在图11A-11B中,心脏H的剖面图显示为处于收缩期。当心脏处于收缩期时,肺动脉瓣(未显示)打开,且血液从右心室RV流动并通过肺动脉PA。图11A图示了根据各种实施方式的部署在原生肺动脉瓣下游的人工瓣膜10的位置。在图11B中,一些实施方式的人工瓣膜10被部署在肺动脉瓣的部位处,从而替换患者的原生瓣膜。
治疗患者的方法(例如,治疗心脏瓣膜功能不全/反流/疾病/等的方法)可以包括多种步骤,其包括与在期望的位置/治疗区域中引入和部署人工瓣膜相关的步骤。一些实施方式通过手术手段放置在患者体内,而其他实施方式通过经导管插入放置在适当位置。例如,图12图解了通过导管3600部署的各种实施方式的人工瓣膜。人工瓣膜10可以以多种不同的方式定位和部署。可以通过股静脉进入,也可以经皮进入。通常地,可以使用任何通向肺动脉的脉管路径。在一个示例性实施方式中,后接导管3600的导丝通过股静脉、下腔静脉、三尖瓣和右心室RV被推进到肺动脉PA。某些实施方式的人工瓣膜10放置在右心室流出道/肺动脉PA中,而其他实施方式的人工瓣膜10放置在原生瓣膜的位置处。在此描述的任何和所有方法、操作、步骤等可以在活体动物或非活体尸体、尸体心脏、模拟器、拟人虚假目标(anthropomorphic ghost)、类似物等上执行。
多种类型的导管可用于将人工瓣膜递送到患者的肺动脉干中。一些实施方式使用球囊气囊,其中瓣膜围绕使框架扩张到肺动脉干中的球囊压缩。其他实施方式将使用鞘导管,其将人工瓣膜压缩至鞘中,并且当其从鞘中移出时框架自行扩张。在使用球囊导管的实施方式中,人工瓣膜可以围绕球囊压缩,如图13所示。
图13示出了根据各种实施方式的安装在递送装置的细长杆180上的人工瓣膜10,形成用于将人工瓣膜10植入患者体内的递送组件。人工瓣膜10以径向塌缩配置安装以用于递送到体内。杆180包括用于在体内扩张球囊的可膨胀球囊182,卷曲的人工瓣膜10定位在萎缩的球囊182之上。如进一步所示,人工瓣膜10包括小叶的连合部部分,其通过对应的连合部窗口径向向外延伸到框架外部的位置,并被缝合到连合部窗口框架30的侧支柱上。当瓣膜在杆180上被径向压缩到塌缩配置时,为了最小化瓣膜的卷曲轮廓,连合部窗口框架30可以相对于框架的周围部分(例如在相邻连合部窗口之间延伸的框架部分)径向向内凹陷。例如,当人工瓣膜10径向塌缩时,框架的连合部窗口框架30可以相对于在相邻的连合部窗口框架30之间延伸的框架部分向内凹陷约0.2mm和约1mm之间的径向距离。以这种方式,包括连合部部分的瓣膜的流出端部分的外径可以大体上一致,这与从人工瓣膜10的周围部分向外突出的连合部部分相反,后者会阻碍瓣膜递送到体内。即使具有径向凹陷的连合部窗口框架30,当瓣膜在杆上径向塌缩时,框架的流入端部的外径仍可小于或约等于框架的流出端部分的外径,这允许最小化的瓣膜的最大总直径。通过在安装在递送杆上时使瓣膜的直径最小化,该组件可以包含在较小直径的导管内,并因此可以通过体内较小的血管,并且总体上具有较少侵入性。
图14A和14B显示了安装在球囊导管上的压缩的人工瓣膜250的横截面。图14A图解了框架202的实施方式,其中框架202具有轴向间隔的支柱210,其工程化成宽度相对较小,从而允许处于卷曲配置的支柱210之间的空间。在这种配置中,卷曲的人工瓣膜250将允许小叶的部分通过开口向外突出,如图14A上的216指示的。由于这种向外突出,人工瓣膜250可以被压缩成比正常存在下更小的直径。相比之下,图14B展示了已知的人工瓣膜的横截面。在该实施方式中,支柱没有被工程化成具有更小的宽度,因此不允许间隙和小叶的向外突出。因此,卷曲的人工瓣膜的外径将更大。
图15A-15C示出了人工心脏瓣膜组件600,其包括用于安装在递送杆604的球囊606上的假体瓣膜的框架602的实施方式。框架602的形状可以类似于图10A中所示的圆柱形框架并且可以包括流入端部分610、流出端部分612和中间部分614。为清楚起见,未示出瓣膜的其他零件,例如小叶和裙部。相对于中间部分614的厚度,框架602在流入端部分610和流出端部分612处可以具有减小的厚度。由于较薄的端部分,当球囊606膨胀时,端部分610、612比中间部分614提供更小的扩张阻力并且更快地扩张,如图15B中所示。因为端部分比中间部分更快地扩张,所以框架602对球囊606限制,这抑制了框架向球囊的任一端滑动并降低框架过早从球囊滑落的风险。如图15C所示,球囊的进一步膨胀可导致框架的中间部分614扩张至与端部610、612相同的最终直径,用于植入,之后球囊可被萎缩并移出。在递送过程中控制瓣膜在球囊上的位置可能很重要,特别是对于在扩张过程中缩短并相对于球囊移动的框架。在图15A-15C所示的实施方式中,框架的中间部分614可以相对于球囊保持恒定,而由于球囊的“狗骨式”作用,两个端部分朝向中间部分缩短。可以使用任何常规手段来生产在端部分610、612处具有减小的厚度的框架602,例如用研磨、砂纸等打磨端部分。在一个实施方式中,框架的端部分610、614具有约0.37mm的厚度而中间部分614具有约0.45mm的厚度。
额外的实施方式将使用鞘导管来部署人工瓣膜。图16A-16E示出了用于递送和部署人工瓣膜10的导管3600的示例性实施方式的远侧部分。导管3600可以采用多种不同的形式。在图示的示例中,导管3600包括外管/套管4910、内管/套管4912、连接到内管4912的人工瓣膜连接器4914和通过连接管4916连接到人工瓣膜连接器4914的细长前锥体28。
人工瓣膜10可设置在外管/套管4910中(参见图16A)。细长腿部5000可以将人工瓣膜10连接到人工瓣膜连接器4914(参见图16A)。细长腿部5000可以是比保持部分414的其余部分更长的保持部分。导管3600可以被在导丝5002之上引导以将人工瓣膜10定位在递送部位。
参考图16B-16E,外管4910相对于内管4912、人工瓣膜连接器4914和细长前锥体28逐渐缩回以部署人工瓣膜10。在图16B中,人工瓣膜10开始从外管4910扩张,在图16C中,人工瓣膜10的远端14从外管4910扩张。在图16D中,人工瓣膜10从外管扩张出来,除了细长腿部5000依然被人工瓣膜连接器4914保持在外管4910中。在图16E中,人工瓣膜连接器4914从外管4910延伸以释放腿部5000,从而完全部署人工瓣膜。在循环系统中部署人工瓣膜期间,可以使用类似的步骤并且可以以类似的方式部署人工瓣膜。
等同原则
尽管上面的描述包含许多具体的实施方式,但是这些不应被解释为对本公开范围的限制,而应被解释为其一个实施实施方式的示例。因此,本公开的范围不应由所示出的实施方式来确定,而应由所附权利要求及其等同物来确定。
- 经导管再生肺动脉瓣
- 经导管球笼形肺动脉瓣膜组件
