一种检测细胞参数的多功能电学检测芯片
文献发布时间:2023-06-19 11:59:12
技术领域
本发明涉及微流控领域,特别是一种检测细胞参数的多功能电学检测芯片。
背景技术
活体单细胞分析是揭示细胞的行为、功能及微观不均一性的核心工具,可有效阐明细胞的基本结构、功能信息及病理状态,揭示细胞间的个体差异性,是细胞生物学、发育生物学、疾病病理学、细胞质量控制分析、药物研发、医学诊疗等领域的研究热点,对于揭示生命体规律与探究重大疾病机理等具有重要意义。通过构建与细胞尺寸相匹配的微米级通道,微流控技术为实现细胞的高效操控与精准检测提供了极为便捷的条件。
申请号为201910858617.X的专利公开了一种微流控芯片的设计方法,其能够实现两种单细胞的捕获以实现对细胞特征进一步分析。申请号为202010226539.4的专利公开了一种微流控芯片,其能够通过四T型压缩通道准确地获取细胞和细胞核固有尺寸信息。由于检测芯片结构和阻抗测量策略的限制,现有微流控阻抗细胞仪通常只能分析处理部分特征参数,因而影响了细胞检测的可靠性。此外,由细胞阻抗峰提取得到的特征参数大部分只能间接表征细胞的整体介电特性和力学特性,而无法洞察细胞的局部信息。因此,现阶段仍然缺少一种能够一次性表征待测细胞多个参数的电学检测芯片。
发明内容
发明目的:本发明所要解决的技术问题是针对现有技术的不足,提供一种能够一次性表征细胞多个参数的多功能电学检测芯片。
为了解决上述技术问题,本发明采取的技术方案如下:
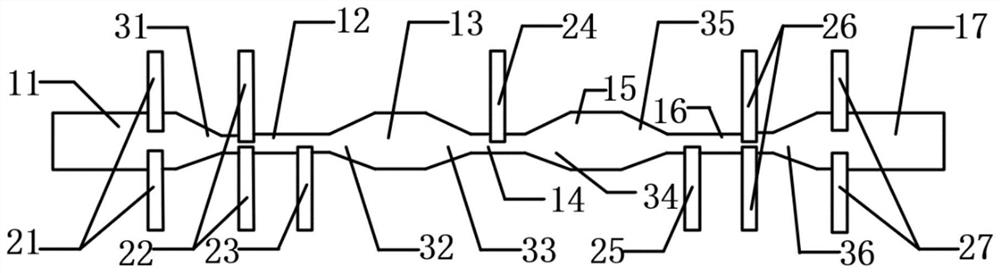
一种检测细胞参数的多功能电学检测芯片,包括通过连接流道依次连接的输入流道、一级收缩流道、一级恢复流道、二级收缩流道、二级恢复流道、三级收缩流道、输出流道;
所述输入流道靠近后方连接流道的端部两侧,对称设有一级随形立体电极对;
所述一级收缩流道靠近前方连接流道的端部两侧,对称设有二级随形立体电极对;
所述一级收缩流道靠近后方连接流道的端部一侧,设有三级随形立体电极;
所述二级收缩流道的中部一侧,设有四级随形立体电极;
所述三级收缩流道靠近前方连接流道的端部一侧,设有五级随形立体电极;
所述三级收缩流道靠近后方连接流道的端部两侧,对称设有六级随形立体电极对;
所述输出流道靠近前方连接流道的端部两侧,对称设有七级随形立体电极对;
各级随形立体电极的末端与对应流道壁面共形,各级随形立体电极的末端作为对应流道的壁面。
进一步地,所述输入流道、一级收缩流道、一级恢复流道、二级收缩流道、二级恢复流道、三级收缩流道、输出流道,以及它们之间的连接流道的截面均为圆形;
所述输入流道、一级恢复流道、二级恢复流道以及输出流道的流道直径相同且略大于待测细胞直径;所述一级收缩流道、二级收缩流道以及三级收缩流道的流道直径相同且略小于待测细胞直径。
优选地,所述三级随形立体电极与五级随形立体电极以四级随形立体电极为对称轴,对称分布;
三级随形立体电极与五级随形立体电极位于同一侧,四级随形立体电极位于另一侧。
具体地,一级随形立体电极对与七级随形立体电极对构成一组电极对;二级随形立体电极对与六级随形立体电极对构成一组电极对;三级随形立体电极、四级随形立体电极和五级随形立体电极构成一组电极对。通过向三组电极对中的芯片上侧电极注入多频电压信号后,由芯片下侧电极采集电流信号经过差分电路处理后得到正、负波信号,对正、负波信号进行滤波、信号分割和阻抗峰提取分析后可得出细胞在不同状态下的细胞位置、细胞直径、细胞形状参数、阻抗幅值、阻抗相位参数、细胞阻抗不透明性(高频阻抗幅值与低频阻抗幅值之比)参数和弛豫指数。
优选地,各级流道的密封材料均选自PDMS、玻璃或PMMA等透明材料中的任意一种;各级电极的材料均选自金、ITO或纳米银等导电材料中的任意一种。
有益效果:
本发明多功能电学检测芯片的圆截面流道,有利于细胞的输运、挤压变形,并且流道圆形截面的对称性更加便于理论分析与建模仿真计算。与流道圆周壁面共形的随形立体电极结构,提高了检测区域内细胞所占的体积分数,降低了测量电信号的泄露,因此能够有效提高细胞阻抗测量的灵敏度,同时能够进行多个参数的一次性表征,可在单细胞分析技术的发展和临床应用中发挥重要作用。
附图说明
下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/ 或其他方面的优点将会变得更加清楚。
图1为本发明多功能电学检测芯片整体结构示意图。
图2为本发明多功能电学检测芯片中输入流道和端部一级随形立体电极对的局部示意图。
图3为待测细胞进入一级随形立体电极对位置时信号检测结果。
图4为待测细胞进入二级随形立体电极对位置时信号检测结果。
图5为待测细胞进入三级随形立体电极位置时信号检测结果。
其中,各附图标记分别代表:
11、输入流道,12、一级收缩流道,13、一级恢复流道,14、二级收缩流道,15、二级恢复流道,16、三级收缩流道,17、输出流道,21、一级随形立体电极对,22、二级随形立体电极对,23、三级随形立体电极,24、四级随形立体电极,25、五级随形立体电极,26、六级随形立体电极对,27、七级随形立体电极对,31、第一连接流道,32、第二连接流道,33、第三连接流道,34、第四连接流道,35、第五连接流道, 36、第六连接流道。
具体实施方式
下面结合附图对本发明作详细说明。
如图1所示,该多功能电学检测芯片包括通过连接流道依次连接的输入流道11、一级收缩流道12、一级恢复流道13、二级收缩流道14、二级恢复流道15、三级收缩流道16、输出流道17。
其中,输入流道11与一级收缩流道12之间通过第一连接流道31连接;一级收缩流道12与一级恢复流道13之间通过第二连接流道32连接;一级恢复流道13与二级收缩流道14之间通过第三连接流道33连接;二级收缩流道14与二级恢复流道15之间通过第四连接流道34连接;二级恢复流道15与三级收缩流道16之间通过第五连接流道35连接;三级收缩流道16与输出流道17之间通过第六连接流道36连接。
输入流道11靠近第一连接流道31的端部两侧,对称设有一级随形立体电极对21;
一级收缩流道12靠近第一连接流道31的端部两侧,对称设有二级随形立体电极对22;
所述一级收缩流道12靠近第二连接流道32的端部一侧,设有三级随形立体电极23;
所述二级收缩流道14的中部一侧,设有四级随形立体电极24;
所述三级收缩流道16靠近第五连接流道35的端部一侧,设有五级随形立体电极25;
所述三级收缩流道16靠近第六连接流道36的端部两侧,对称设有六级随形立体电极对26;
所述输出流道17靠近第六连接流道36的端部两侧,对称设有七级随形立体电极对27。
如图2所示,一级随形立体电极对21末端与对应的输入流道11壁面共形,一级随形立体电极对21的末端作为输入流道11的壁面。其它各级随形立体电极的末端同样与对应流道壁面共形,各级随形立体电极的末端同样作为对应流道的壁面。
其中,输入流道11、一级收缩流道12、一级恢复流道13、二级收缩流道14、二级恢复流道15、三级收缩流道16、输出流道17,以及它们之间的连接流道的截面均为圆形;输入流道11、一级恢复流道13、二级恢复流道15以及输出流道17的流道直径相同且大于待测细胞直径;所述一级收缩流道12、二级收缩流道14以及三级收缩流道 16的流道直径相同且小于待测细胞直径。
三级随形立体电极23与五级随形立体电极25以四级随形立体电极24为对称轴,对称分布;三级随形立体电极23与五级随形立体电极25位于同一侧,四级随形立体电极24位于另一侧。
一级随形立体电极对21与七级随形立体电极对27构成一组电极对以检测细胞在整个检测区域内的信号;二级随形立体电极对22与六级随形立体电极对26构成一组电极对以检测细胞在整个收缩流道内的信号;三级随形立体电极23、四级随形立体电极24和五级随形立体电极25构成一组电极对以检测细胞恢复变形阶段的信号。通过向三组电极对中的芯片上侧电极注入多频电压信号后,由芯片下侧电极采集电流信号经过差分电路处理后得到正、负波信号,对正、负波信号进行滤波、信号分割和阻抗峰提取分析后可一次性表征得出细胞在不同状态下的细胞位置、细胞直径、细胞形状参数、阻抗幅值、阻抗相位参数、细胞阻抗不透明性(高频阻抗幅值与低频阻抗幅值之比)参数和弛豫指数。
各级流道的密封材料均选自PDMS透明材料;各级电极的材料均选自金导电材料。
本实施例中多功能电学检测芯片的输入流道11、一级恢复流道13、二级恢复流道15和输出流道17截面圆直径为30μm,一级收缩流道12、二级收缩流道14和三级收缩流道16截面圆直径为5μm,细胞悬浮液选用MCF-7悬浮液,将MCF-7悬浮液经由输入流道注入该多功能电学检测芯片中,待MCF-7悬浮液充满整个芯片腔室后,将该多功能电学检测芯片与压力注射器相连,通过压力注射器给出定值压力,从输入流道放置乳腺癌细胞,乳腺癌细胞随MCF-7悬浮液运动。调整函数信号发生器,使其产生幅值为1V,频率为2MHz的交流激励电压。当乳腺癌细胞在输入流道11内运动时,对一级随形立体电极对21和七级随形立体电极对27施加交流激励电压,得到电流响应信号I
本发明提供了一种检测细胞参数的多功能电学检测芯片的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
- 一种检测细胞参数的多功能电学检测芯片
- 一种集成预分选的细胞机械和电学多参数联合检测的装置
