一种多荧光核酸探针的制备方法及其应用
文献发布时间:2023-06-19 11:59:12
技术领域
本发明涉及核酸检测材料制备技术领域,具体涉及一种多荧光核酸探针的制备方法及其应用。
背景技术
核酸探针,是指序列已知的并带有标记物的核酸片段,可以和与其互补的核酸序列杂交,用于待测样品中特定基因序列的检测。或者是在具有与其特异性相互作用的分子存在时会导致核酸探针的构型、构象发生改变,从而引起信号变化,可以用于化学、生物、医学和药学等领域的靶向分子识别。在众多的核酸探针中,荧光核酸探针因为具有灵敏度高、特异性好、设计多样化和定量分析能力强等特点,成为分析化学的研究热点之一。荧光核酸探针主要由目标识别单元和信号转导单元两部分组成。功能化核酸是荧光核酸探针的理想识别单元之一,由一段已知序列的核酸片段组成,同时具有稳定性好、结合力强、生物相容性好,以及易于合成和修饰等优点。荧光报告单位通常为有机染料分子或无机荧光纳米材料,在检测过程中负责把识别单元与分析物结合引起的化学环境的变化转化为可检测的信号。
现有几种经典的荧光核酸探针有分子信标型核酸探针、链置换型核酸探针、核酸适配体探针等,而它们的信号输出均依赖于探针末端的单个荧光基团,即探针与荧光基团的比例为1:1,这在一定程度上限制了探针的灵敏度,影响了相关生物传感器的检出限。
发明内容
本发明的目的在于提供一种方法简单、制作容易、适用于普通实验室的多荧光核酸探针的合成方法,通过本发明合成的多荧光核酸探针的荧光基团增加,在结构上实现信号的放大,增强荧光核酸探针在分析检测、生物成像等研究中的灵敏度,提高荧光核酸探针的实用价值。
为实现上述目的,本发明采用的技术方案是:
一种多荧光核酸探针的制备方法,包括以下步骤:
A、以5-乙炔基-尿嘧啶脱氧核苷酸(5-EdUTP)代替胸腺嘧啶脱氧核苷酸(dTTP)进行核酸扩增,得到高密度炔烃的双链DNA;
B、步骤A中得到的双链DNA经外切酶Lambda Exonuclease处理后,5’端磷酸化标记的核酸链被消解,得到高密度炔烃单链DNA,即探针链;
C、通过铜离子催化的点击反应,带有叠氮基的染料cy3-azide被成功修饰到高密度炔烃的单链DNA上,得到多荧光核酸探针。
进一步地,所述步骤A中核酸扩增的PCR反应体系为:1×PCR Buffer(Mg2+Plus),1μM上游引物和1μM下游引物,20pg/100μL的Template,0.2mM dATP、0.2mM dGTP、0.2mMdCTP、0.2mM EdUTP、2.5units/100μLTaKaRa Taq酶,余量为ddH
进一步地,所述步骤B中双链DNA与Lambda Exonuclease外切酶按照2μg/10U的比例混合,孵育条件为:37℃,30min;75℃,10min。
进一步地,所述步骤C中点击反应的条件为60μL单链DNA溶液,20μL 100mM cy3-azide,pH7.4的10μL 0.1M PBS缓冲液,10μL CuAAC催化液,37℃下孵育60min。其中所述CuAAC催化液的配制:70μL H
本发明还提供一种多荧光核酸探针的应用,用于生物传感器中,例如石墨烯-核酸探针的生物传感器,多荧光核酸探针吸附在石墨烯纳米片表面,由于荧光分子与纳米片之间发生荧光共振能量转移,荧光淬灭;当检测的靶标核酸与探针结合后形成双链,即从石墨烯表面解吸附,荧光共振能量转移消失,荧光得到恢复,实现了一个荧光从无到有的过程。根据荧光的恢复强度与靶标的浓度成比例,对靶标进行定量分析,其灵敏度相对于传统荧光探针达到了数量级的提升。
与现有技术相比,本发明的有益效果是:
(1)所制多荧光核酸探针一条探针链上带有多个荧光基团,在结构上实现信号的放大,灵敏度增强;
(2)多荧光核酸探针的制备方法简单、合成步骤少、所需时间短,在普通的实验室也可以快速合成。
(3)通过本发明所制的多荧光核酸探针可广泛应用于生物传感器以及生物成像等各个领域。
附图说明
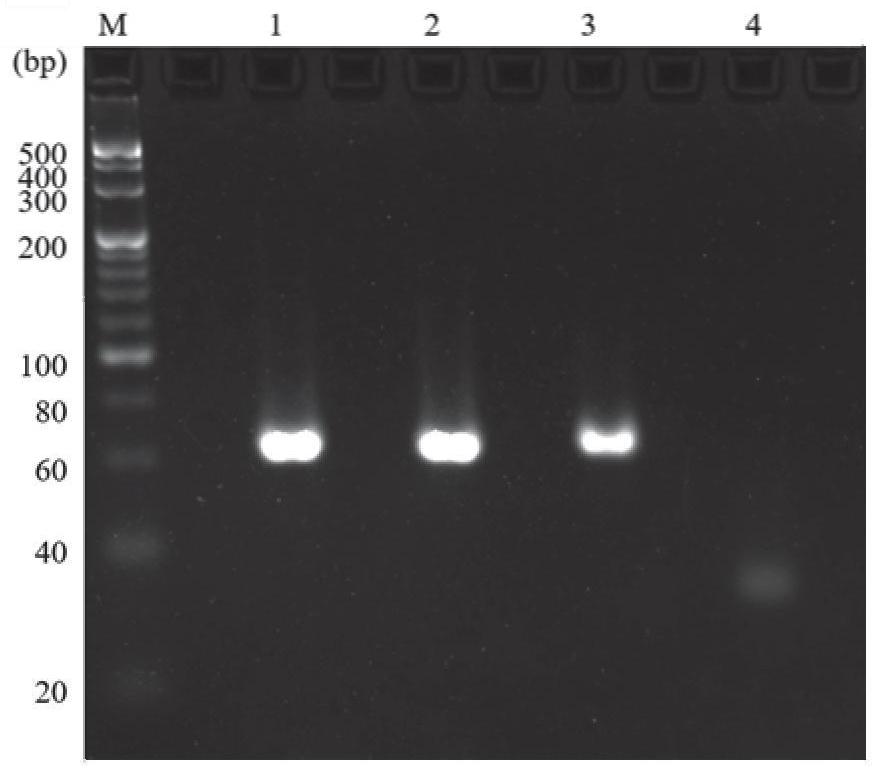
图1为探针合成过程中琼脂糖凝胶电泳图;
图2为合成的探针链与标准探针的紫外吸收光谱示意图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1制备用于检测EV-71病毒的多荧光核酸探针方法
A、双链DNA制备:
模板序列、上游引物、下游引物均为Takara生物公司合成。
模板序列:5’-GAG CAG TCA CAG TCC AGA AGG GCA TGT CAG GGC TTG GAT ACCTCG CAT TCA CCC TTG CAC GAT AC-3’;
上游引物:5’-GAG CAG TCA CAG TCC AGA AG-3’(5’端磷酸化)
下游引物:5’-GTA TCG TGC AAG GGT GAA TGC-3’
PCR反应体系
按照上述的PCR反应体系进行PCR反应,扩增条件为:95℃,30s;55℃,30s;72℃,30s,经40个循环,72℃,5min。扩增产物经试剂盒纯化后得到单纯的双链DNA。
B、探针单链的制备:
步骤A中得到的双链DNA与Lambda Exonuclease外切酶按照2μg/10U的比例混合,孵育条件为:37℃,30min;75℃,10min。5’端磷酸化标记的核酸链被消解,经纯化后得到高密度炔烃单链DNA;
探针链序列为:5’-GTA TCG TGC AAG GGT GAA TGC GAG GTA TCC AAG CCC TGACAT GCC CTT CTG GAC TGT GAC TGC TC-3’
C、单链DNA与多个荧光分子的连接:
CuAAC催化液的配制:70μL H20,4μL THPTA(100mM),1μL CuSO
D、将多荧光核酸探针吸附在石墨烯纳米片表面,制备石墨烯-核酸探针的生物传感器。由于荧光分子与纳米片之间发生荧光共振能量转移,荧光淬灭;当检测的靶标核酸与探针结合后形成双链,即从石墨烯表面解吸附,荧光共振能量转移消失,荧光得到恢复,实现了一个荧光从无到有的过程。根据荧光的恢复强度与靶标的浓度成比例,对靶标进行定量分析,其灵敏度相对于传统荧光探针达到了数量级的提升。
实施例2EdUTP与dTTP合成的双链DNA的比较
按实施例1中的步骤A,将EdUTP替换为dTTP,获得双链DNA。将该双链DNA、实施例1中获得的以EdUTP合成的高密度炔烃双链DNA、纯化后的高密度炔烃双链DNA、探针链经琼脂糖凝胶电泳分析。步骤如下:
制胶:在加有60mL的1X TBE缓冲液的锥形瓶中,加入准确称量的琼脂糖粉,在微波炉中加热溶解,冷却至50-60℃左右加入溴化乙锭,充分混匀后导入制胶模中,在室温下使胶凝固。
上样:取适量样品与6×上样缓冲液混匀,每个样品槽的上样量为10μL。
电泳:加完样后,合上电泳槽盖,立即接通电源。控制电压保持在90V,当条带移动到距凝胶前沿约2cm时,停止电泳,紫外下拍照并观察,得到图1。
图1是步骤A、B的各个DNA链的琼脂糖凝胶电泳图,1是以A、G、C、T四种核苷酸合成的双链;2是以EdUTP合成的高密度炔烃双链DNA;3为纯化后的高密度炔烃双链DNA;4为经外切酶消解后得到的高密度炔烃单链DNA,即探针链。琼脂糖凝胶电泳图的结果表明,EdUTP可以成功取代dTTP合成双链DNA,并进行后续的外切酶消解过程,成功合成探针单链。
实施例3合成探针链与标准探针的比较
购买的标准探针序列为:5’-GTA TCG TGC AAG GGT GAA TGC GAG GTA TCC AAGCCC TGA CAT GCC CTT CTG GAC TGT GAC TGC TC-3’,5’端连接了一个荧光分子;
本发明合成的多荧光核酸探针序列为:5’-GTA TCG TGC AAG GGT GAA TGC GAGGTA TCC AAG CCC TGA CAT GCC CTT CTG GAC TGT GAC TGC TC-3’,DNA链上连有多个荧光分子;
将两种探针稀释成单链DNA浓度一致,均为32ng/μL时,经Nanodrop 2000测定cy3在550nm处的吸光度,结果如图2所示。
图2所示的紫外吸收光谱示意图,由cy3在550nm处的吸光度值比较得出,本发明合成的多荧光核酸探针的荧光分子是购买的标准探针的4.6倍。
尽管已经对本发明的技术方案做了较为详细的阐述和列举,应当理解,对于本领域技术人员来说,对上述实施例做出修改或者采用等同的替代方案,这对本领域的技术人员而言是显而易见,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 一种多荧光核酸探针的制备方法及其应用
- 一种高效低毒荧光核酸探针的制备方法
