GL-V9在制备预防和/或治疗肝纤维化药物中的应用
文献发布时间:2023-06-19 12:00:51
技术领域
本发明涉及黄酮类化合物在制备预防和/或治疗肝纤维化药物中的应用,尤其涉及 GL-V9在制备预防和/或治疗肝纤维化药物中的应用。
背景技术
肝纤维化是世界范围内的一个健康问题,患病率迅速上升,并且缺乏特异性和有效的治疗方法。肝脏是体内主要的代谢器官,具有强大的再生能力。肝损伤发生后肝脏通常可以再生,但若存在长期损伤与慢性炎症的不断刺激,肝脏的再生能力将极大地被削弱,并引起纤维化发生。多种病因如酒精性肝病、非酒精性脂肪性肝炎、病毒性肝炎、慢性胆汁淤积及自身免疫性肝炎都可发展为纤维化而进展至肝硬化和肝癌。肝纤维化是慢性肝病进展至肝硬化的关键步骤,它是一种机体代偿修复反应。CCL4在肝细胞内经微粒体细胞色素氧化酶P450代谢生成大量自由基,攻击肝细胞使其发生凋亡或坏死,反复刺激诱导形成经典的肝纤维化动物模型,广泛用于抗肝纤维化药物的筛选、评价和机制研究中。
发明内容
发明目的:本发明的目的为提供GL-V9在制备预防和/或治疗肝纤维化药物中的应用。
技术方案:本发明的GL-V9在制备预防和/或治疗肝纤维化药物中的应用。
GL-V9分子式为C
进一步地,GL-V9降低血清中ALT和HA的含量。GL-V9降低肝脏中TGF-β1、α-SMA、Collagen1、MMP2和TIMP1 mRNA的表达。
本发明的含有GL-V9的组合物在制备预防和/或治肝纤维化药物中的应用。
本发明的GL-V9在制备预防和/或治疗肝纤维化药物中的应用中,可以单独使用,也可以与其他药物配合同时使用,或者与其他药物一起制成复方制剂使用,都可以达到治疗肝纤维化的目的。
组合物是以GL-V9作为活性成分,加上药学上可接受的载体所制成的药物。
本发明的药学上可接受的辅料,是指制备不同剂型时加入所需的各种常规辅料。
有益效果:与现有技术相比,本发明具有如下显著优点:GL-V9给药组可使小鼠血清中ALT、HA的含量以及肝脏中TGF-β1、α-SMA、Collagen1、MMP2、TIMP1 mRNA 的表达显著降低,可以改善肝组织的病理学改变。GL-V9通过减少胶原纤维沉积发挥对 CCL4诱导肝纤维化的保护作用和治疗作用,并有剂量依赖性。
附图说明
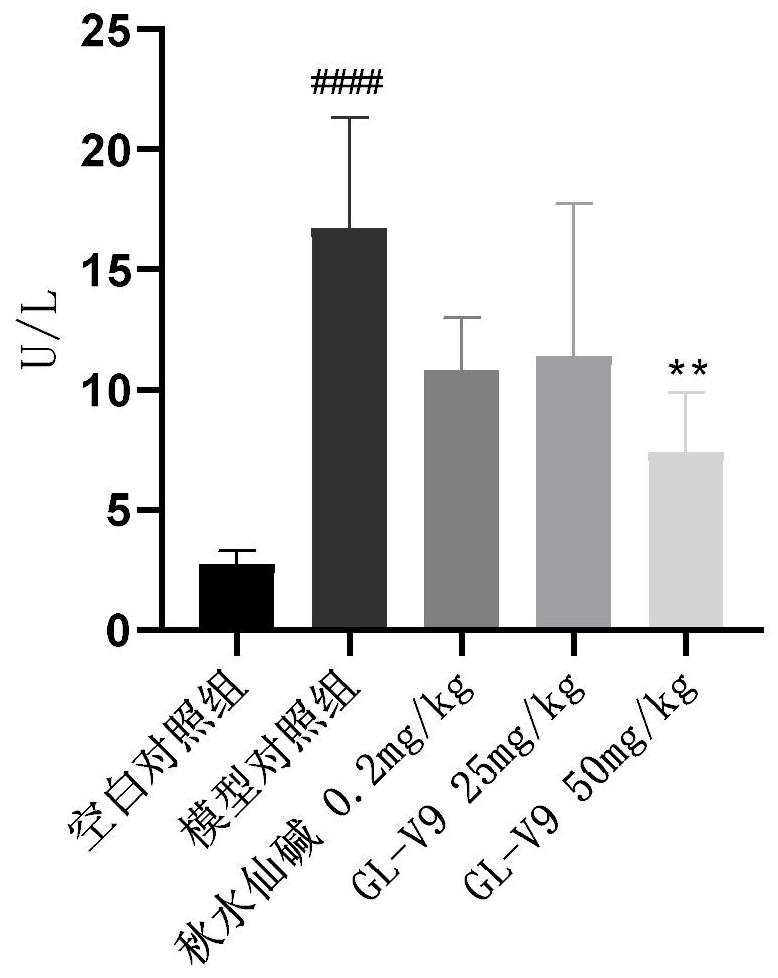
图1为GL-V9保护作用对实验动物血清ALT浓度的影响(
图2为GL-V9保护作用对实验动物血清HA浓度的影响(
图3为GL-V9保护作用对小鼠肝纤维化肝脏中TGF-β1 mRNA表达的影响(
图4为GL-V9保护作用对小鼠肝纤维化肝脏中α-SMA mRNA表达的影响(
图5为GL-V9保护作用对小鼠肝纤维化肝脏中Collagen1 mRNA表达的影响 (
图6为GL-V9保护作用对小鼠肝纤维化肝脏中MMP2 mRNA表达的影响(
图7为GL-V9保护作用对小鼠肝纤维化肝脏中TIMP1 mRNA表达的影响(
图8(a)-(e)为GL-V9保护作用对肝纤维化小鼠肝组织HE染色检测(×20,标尺 250μm);
图9(a)-(e)为GL-V9保护作用对肝纤维化小鼠肝组织Masson染色检测(×20,标尺250μm),。
图10为GL-V9治疗作用对实验动物血清ALT浓度的影响(
图11为GL-V9治疗作用对实验动物血清HA浓度的影响(
图12为GL-V9治疗作用对小鼠肝纤维化肝脏中TGF-β1 mRNA表达的影响(
图13为GL-V9治疗作用对小鼠肝纤维化肝脏中α-SMA mRNA表达的影响(
图14为GL-V9治疗作用对小鼠肝纤维化肝脏中Collagen1 mRNA表达的影响 (
图15为GL-V9治疗作用对小鼠肝纤维化肝脏中MMP2 mRNA表达的影响(
图16为GL-V9治疗作用对小鼠肝纤维化肝脏中TIMP1 mRNA表达的影响(
图17(a)-(e)为GL-V9治疗作用对肝纤维化小鼠肝组织HE染色检测(×20,标尺250μm);
图18(a)-(e)为GL-V9治疗作用对肝纤维化小鼠肝组织Masson染色检测(×20,标尺250μm)。
具体实施方式
下面结合实施例对本发明的技术方案作进一步说明。
实施例1
1.实验材料
1.1药物
(1)实验药物:GL-V9,纯度>98%。GL-V9 25mg/kg:精密称取GL-V9粉末12.5mg,分次加入5mlCMC-Na,充分研磨为混悬液。GL-V9 50mg/kg:精密称取GL-V9粉末28mg,分次加入5.6mlCMC-Na,充分研磨为混悬液。给药剂量为10ml/kg。
(2)对照药物:秋水仙碱片,生产厂家:昆药集团股份有限公司,批号:1904E,含药量0.84%。秋水仙碱0.2mg/kg:将秋水仙碱片研磨成粉末,精密称取16.38mg,含药0.13mg,分次加入6.8mlCMC-Na,充分研磨为混悬液。给药剂量为10ml/kg。
(3)造模药物:CCL4,生产厂家:MACKLIN,批号:C805332。CCL4 2ml/kg:移液枪精密吸取2.4mlCCl4,溶于9.6ml橄榄油中。给药剂量为2ml/kg。
(4)ALT、HA ELISA检测试剂盒购自南京建成生物工程研究所。
(5)Real-time PCR相关试剂:DEPC水购自biosharp公司;RNA提取Trizol试剂盒、cDNA合成试剂盒及双链DNA染料SYBR Green PCR试剂盒均购自Vazyme公司;上、下游引物购自上海生工生物工程有限公司。
1.2实验仪器
(1)酶标仪:Molecular Devices Spectra Max 190,Molecular DevicesCorportion公司产品。
(2)电子天平:QUINTIX224-1CN,赛多利斯科学仪器(北京)有限公司产品。
(3)离心机:DLAB D3024R,大龙兴创实验仪器(北京)有限公司产品。
(4)96孔PCR扩增仪:MiniAmp Plus Thermal Cycler,赛默飞世尔科技公司产品。
(5)实时荧光定量PCR:Roche
1.3实验动物
来源、种系、品系:C57BL/6J小鼠,由常州卡文斯实验动物有限公司提供(实验动物生产许可证:SCXK(苏)2016-0001)
周龄:6-8周
体重:18-22g
性别:雄性
2.实验方法
2.1实验动物分组
(1)保护作用实验动物分组
持续造模4周。造模期间,同时给予各组小鼠相应药物,持续4周。实验期间监测小鼠体重,一周称重2次。
(2)治疗作用实验动物分组
持续造模6周。从第3周开始,同时给予各组小鼠相应药物,持续4周。实验期间监测小鼠体重,一周称重2次。
(3)小鼠血清ALT ELISA检测
谷丙转氨酶(ALT)在37℃及PH7.4条件下,作用于丙氨酸及α-酮戊二酸组成的底物,生成丙酮酸及谷氨酸。反应30min后加入2,4-二硝基苯肼(DNPH)盐酸溶液,即中止反应,同时DNPH与酮酸中羰基加成,生成丙酮酸苯腙。苯腙在碱性条件下呈红棕色,于505nm比读吸光度并计算酶活力。
(4)小鼠血清HA ELISA检测
向预先包被了抗体的酶标孔中加入样本,再加入生物素标记的识别抗原,在37℃下孵育30min,两者与固相抗体竞争结合形成免疫复合物,经PBST洗涤除去未结合的生物素抗原,然后加入亲和素-HRP,在37℃下孵育30min,亲和素-HRP与生物素抗体结合,洗涤后结合的HRP催化TMB(四甲基联苯胺)成蓝色,随后在酸的作用下转化成黄色,在450nm波长下有吸收峰,吸光值与样本中抗原的浓度成负相关。
(5)Real-time PCR实验
首先提取肝脏组织中的总RNA。将肝组织放入1.5mlRNase-free离心管中,加入1mlRNA isolater,放入1个磁珠,置入预冷的研磨仪中充分研磨。将裂解液转移至 RNase-free离心管中,12,000x g 4℃离心5min,吸取上清。向上述裂解液中加入200μL 氯仿。剧烈震荡15sec成乳浊液,4℃静置5min。12,000x g 4℃离心15min。小心吸取上层水相至新的RNase-free离心管中。加入等体积预冷的异丙醇,上下颠倒混匀,4℃静置10min。12,000x g4℃离心10min,白色沉淀用1ml 75%乙醇洗涤,涡旋混匀,室温静置5min。12,000x g 4℃离心5min。在洁净环境中室温敞口干燥沉淀2-5min。加入适量的RNase-free ddH2O溶解沉淀,检测RNA浓度后进行反转录反应或保存于-80 ℃待用。
按照反转录试剂盒说明书将RNA逆转录为cDNA。在RNase-free离心管中加入4xgDNA wiper Mix 4μL,总RNA 1μL,RNase-free ddH
加入PCR反应体系,
(6)CCL4诱导肝纤维化小鼠肝组织病理学评价
小鼠肝组织用10%中性福尔马林固定后,常规脱水包埋,切片厚2μm。
苏木精-伊红染色:脱蜡后将切片放入全自动染色机,中性树胶封固。玻片扫描仪扫描拍摄,观察肝组织病理学变化。
Masson染色:常规脱蜡后将切片入媒染液,置入60℃的温箱内1h进行媒染,流水冲洗10min。天青石蓝染色液滴染2-3min,水洗2次。Mayer苏木素染色液滴染2-3min,水洗2次。酸性乙醇分化液分化数秒至组织完全变红,水洗10min终止分化。丽春红品红染色液滴染10min,水洗2次。磷钼酸溶液处理约10min。倾去上液,滴加苯胺蓝染色液5min。用弱酸溶液洗去苯胺蓝溶液后,继续滴加弱酸工作液覆盖切片处理2min。 95%的乙醇脱水30s。无水乙醇脱水2次。二甲苯透明2次,每次1-2min。中性树胶封固。玻片扫描仪扫描拍摄观察肝组织纤维数量变化。
3.实验结果
3.1GL-V9对CCL4诱导肝纤维化的保护作用
3.1.1GL-V9对实验动物血清ALT,HA浓度的影响
如图1,2所示,模型组均可极显著性增加实验动物血清中的ALT(P<0.0001)和 HA(P<0.0001)的浓度。对于ALT,与模型组相比,秋水仙碱0.2mg/kg、GL-V9 25mg/kg 剂量组血清浓度降低,但无显著性;GL-V9 50mg/kg剂量组血清浓度极显著性降低 (P<0.01)(图1)。对于HA,与模型组相比,秋水仙碱0.2mg/kg、GL-V9 25mg/kg、GL-V9 50mg/kg剂量组血清浓度均极显著性降低(P<0.0001)(图2)。说明秋水仙碱0.2mg/kg、 GL-V9 25mg/kg、GL-V950mg/kg对于CCL4引起的实验动物血清ALT,HA浓度增高具有改善作用,即可改善肝纤维化的发生发展。
3.1.2GL-V9对实验动物肝脏中TGF-β1,α-SMA,Collagen1,MMP2,TIMP1 mRNA的影响
如图3,4,5,6,7所示,与空白对照组相比,模型组均可显著性增加实验动物肝脏中TGF-β1(P<0.05),α-SMA(P<0.01),Collagen1(P<0.001),MMP2(P<0.0001), TIMP1(P<0.01)mRNA的表达。对于TGF-β1 mRNA,与模型组相比,秋水仙碱0.2mg/kg、 GL-V9 25mg/kg、GL-V950mg/kg剂量组表达极显著性降低(P<0.001)(图3)。对于α-SMA mRNA,与模型组相比,秋水仙碱0.2mg/kg、GL-V9 25mg/kg、GL-V9 50mg/kg剂量组表达极显著性降低(P<0.01)(图4)。对于Collagen1 mRNA,与模型组相比,GL-V9 50mg/kg 剂量组表达显著性降低(P<0.05),秋水仙碱0.2mg/kg、GL-V9 25mg/kg剂量组表达极显著性降低(P<0.01)(图5)。对于MMP2mRNA,与模型组相比,秋水仙碱0.2mg/kg、 GL-V9 25mg/kg、GL-V9 50mg/kg剂量组表达极显著性降低(P<0.0001)(图6)。对于 TIMP1 mRNA,与模型组相比,秋水仙碱0.2mg/kg(P<0.001)、GL-V9 25mg/kg(P<0.01)、 GL-V9 50mg/kg(P<0.01)剂量组表达极显著性降低(图7)。说明秋水仙碱0.2mg/kg、 GL-V9 25mg/kg、GL-V9 50mg/kg改善肝纤维化的发生发展是通过减少TGF-β1,α-SMA, Collagen1,MMP2,TIMP1的表达来实现的。
3.1.3HE染色检测GL-V9对实验动物肝脏病理学的影响
如图8(a)-(e)所示,空白对照组肝组织示肝细胞排列尚整齐,肝细胞未见明确变性,肝窦未见明显扩张,可见散在点状坏死伴炎症细胞浸润,未见明显纤维组织增生(图8(a))。模型对照组肝组织示肝细胞排列紊乱,肝窦未见明显扩张,汇管区纤维组织增生伴炎细胞浸润,并见明显桥接纤维化,部分区有假小叶形成,汇管区周围可见较多肝细胞明显水肿变性(图8(b))。秋水仙碱0.2mg/kg剂量组肝组织示肝细胞排列稍紊乱,肝细胞未见明确坏死,肝窦未见明显扩张,汇管区纤维组织增生伴炎细胞浸润,并见桥接纤维化,汇管区周围肝细胞轻度水肿变性(图8(c))。GL-V9 25mg/kg剂量组肝组织示肝细胞排列稍紊乱,肝细胞未见明确坏死,肝窦未见明显扩张,汇管区纤维组织增生伴炎症细胞浸润,可见细长纤维间隔伴桥接纤维化形成,汇管区周围肝细胞轻度水肿变性(图8(d))。 GL-V9 50mg/kg剂量组肝组织示肝细胞排列稍紊乱,肝细胞未见明确坏死,肝窦未见明显扩张,汇管区纤维组织增生伴炎症细胞浸润,部分区可见细长纤维间隔形成(图8(e))。 HE染色结果明显表现出,CCL4造模后小鼠肝脏有了相当的病理性损伤和坏死,而给予 GL-V9后小鼠肝脏病理学特征有了明显改观,即GL-V9对肝脏有很好的保护作用。
3.1.4Masson染色检测GL-V9对实验动物肝脏病理学的影响
如图9(a)-(e)所示,空白对照组显示汇管区及中央静脉见少量胶原纤维呈蓝色反应 (图9(a))。模型对照组显示汇管区蓝色胶原纤维沉积,自汇管区周围向外延伸,细长蓝色纤维条索相互桥连,部分区呈假小叶样结构(图9(b))。秋水仙碱0.2mg/kg、GL-V9 25mg/kg剂量组显示汇管区蓝色胶原纤维沉积,部分自汇管区周围向外延伸,可见蓝色纤细纤维条索相互桥连(图9(c)-(d))。GL-V9 50mg/kg剂量组显示汇管区蓝色胶原纤维沉积,部分自汇管区周围向外延伸,可见纤细蓝色纤维条索(图9(e))。Masson染色结果明显表现出,CCL4造模后小鼠肝脏有了相当的胶原纤维沉积,而给予GL-V9后小鼠肝脏胶原纤维沉积明显减少,即GL-V9对肝脏有很好的保护作用。
3.2GL-V9对CCL4诱导肝纤维化的治疗作用
3.2.1GL-V9对实验动物血清ALT,HA浓度的影响
如图10,11所示,模型组均可极显著性增加实验动物血清中的ALT(P<0.0001) 和HA(P<0.001)的浓度。对于ALT,与模型组相比,秋水仙碱0.2mg/kg(P<0.01)、 GL-V9 50mg/kg(P<0.001)剂量组血清浓度极显著性降低,GL-V9 25mg/kg剂量组血清浓度降低,但无显著性(图10)。对于HA,与模型组相比,秋水仙碱0.2mg/kg、GL-V9 25mg/kg、GL-V9 50mg/kg剂量组血清浓度均极显著性(P<0.0001)降低(图11)。说明秋水仙碱0.2mg/kg、GL-V9 25mg/kg、GL-V9 50mg/kg对于CCL4引起的实验动物血清 ALT,HA浓度增高具有改善作用,即可改善肝纤维化的发生发展。
3.2.2GL-V9对实验动物肝脏中TGF-β1,α-SMA,Collagen1,MMP2,TIMP1 mRNA的影响
如图12,13,14,15,16所示,与空白对照组相比,模型组均可极显著性增加实验动物肝脏中TGF-β1(P<0.01),α-SMA(P<0.01),Collagen1(P<0.0001),MMP2 (P<0.0001),TIMP1(P<0.0001)mRNA的表达。对于TGF-β1 mRNA,与模型组相比,秋水仙碱0.2mg/kg、GL-V950mg/kg剂量组表达极显著性降低(P<0.01),GL-V9 25mg/kg剂量组表达显著性降低(P<0.05)(图12)。对于α-SMA mRNA,与模型组相比,秋水仙碱0.2mg/kg剂量组表达显著性降低(P<0.05),GL-V9 50mg/kg剂量组表达极显著性降低(P<0.01),GL-V9 25mg/kg剂量组表达降低,但并无显著性(图13)。对于 Collagen1 mRNA,与模型组相比,秋水仙碱0.2mg/kg、GL-V9 25mg/kg、GL-V9 50mg/kg 剂量组表达极显著性降低(P<0.0001)(图14)。对于MMP2mRNA,与模型组相比,秋水仙碱0.2mg/kg(P<0.001)、GL-V9 50mg/kg(P<0.01)剂量组表达极显著性降低, GL-V9 25mg/kg剂量组表达显著性降低(P<0.05)(图15)。对于TIMP1 mRNA,与模型组相比,秋水仙碱0.2mg/kg(P<0.0001)、GL-V9 25mg/kg(P<0.001)、GL-V9 50mg/kg (P<0.0001)剂量组表达极显著性降低(图16)。说明秋水仙碱0.2mg/kg、GL-V9 25mg/kg、 GL-V9 50mg/kg是通过减少TGF-β1,α-SMA,Collagen1,MMP2,TIMP1的表达来治疗肝纤维化的。
3.2.3HE染色检测GL-V9对实验动物肝脏病理学的影响
如图17(a)-(e)所示,空白对照组肝组织示肝细胞排列尚整齐,肝细胞未见明显变性,可见散在点状坏死,肝窦未见明显扩张,部分汇管区周围见炎细胞浸润,未见明显纤维组织增生(图17(a))。模型对照组肝组织示肝细胞排列稍紊乱,肝细胞未见明显坏死,肝窦未见明显扩张,汇管区纤维组织增生伴炎症细胞浸润,可见细长纤维间隔伴明显桥接纤维化形成,部分区可见假小叶形成,汇管区周围肝细胞轻度水肿(图17(b))。秋水仙碱 0.2mg/kg剂量组肝组织示肝细胞排列稍紊乱,肝细胞轻度水肿,未见明确坏死,肝窦未见明显扩张,汇管区纤维组织增生伴炎症细胞浸润,部分区可见细纤维间隔形成。局灶区域可见桥接纤维化形成(图17(c))。GL-V9 25mg/kg剂量组肝组织示肝细胞排列稍紊乱,肝细胞轻度水肿,未见明确坏死,肝窦未见明显扩张,汇管区纤维组织增生伴炎症细胞浸润,部分区可见细长纤维间隔伴明显桥接纤维化形成,小灶区有假小叶形成趋势(图 17(d))。GL-V9 50mg/kg肝组织示肝细胞排列稍紊乱,肝细胞未见明确变性及坏死,肝窦未见明显扩张,汇管区纤维组织增生伴炎症细胞浸润,部分区可见细长纤维间隔伴明显桥接纤维化形成,小灶区有假小叶形成趋势(图17(e))。HE染色结果明显表现出,CCL4 造模后小鼠肝脏有了相当的病理性损伤和坏死,而给予GL-V9后小鼠肝脏有了明显改观,即GL-V9对肝纤维化有很好的治疗作用。
3.2.4Masson染色检测GL-V9对实验动物肝脏病理学的影响
如图18(a)-(e)所示,空白对照组显示汇管区及中央静脉见少量胶原纤维呈蓝色反应 (图18(a))。模型对照组显示汇管区蓝色胶原纤维沉积,自汇管区周围向外延伸,细长蓝色纤维条索相互桥连,部分区呈假小叶样结构(图18(b))。秋水仙碱0.2mg/kg剂量组显示汇管区蓝色胶原纤维沉积,部分自汇管区周围向外延伸,可见纤细蓝色纤维条索(图 18(c))。GL-V9 25mg/kg、GL-V9 50mg/kg剂量组显示汇管区蓝色胶原纤维沉积,部分自汇管区周围向外延伸,可见蓝色纤细纤维条索相互桥连(图18(d)-(e))。Masson染色结果明显表现出,CCL4造模后小鼠肝脏有了相当的胶原纤维沉积,而给予GL-V9后小鼠肝脏胶原纤维沉积明显减少,即GL-V9对肝纤维化有很好的治疗作用。
综合所有的实验结果,我们发现CCL4作为一种外源性的毒物,可以损伤肝细胞,使血清中ALT、HA含量增加;也可增加肝脏中TGF-β1,α-SMA,Collagen1,MMP2, TIMP的表达,导致胶原蛋白分泌增加,降解减少,最终导致胶原纤维的沉积,引起肝纤维化。
秋水仙碱作为阳性药,是国际上公认的治疗肝纤维化的药物,可以破坏肝前胶原分泌的软管的聚集,刺激胶原酶的产生,进而促进胶原的降解,减少细胞外基质的沉积,缓解肝纤维化。
GL-V9给药组小鼠血清中ALT、HA含量显著下降,说明小鼠肝细胞破坏减少。 GL-V9给药组小鼠肝脏中TGF-β1,α-SMA,Collagen1,MMP2,TIMP1 mRNA的表达显著下降,说明刺激因子TGF-β1表达减少,使肝细胞分泌的Collagen1和α-SMA减少; MMP2,TIMP1表达降低,使Collagen1和α-SMA降解增多,最终使细胞外基质沉积减少,缓解了肝纤维化;HE染色显示,GL-V9给药组改善了病理学改变,细胞水肿、坏死、炎症细胞浸润等病理学特征明显减少;Masson染色也显示给药组的纤维连接显著减少。各项指标均显示,GL-V9低剂量组的效果没有秋水仙碱剂量组好或与之相当,而 GL-V9高剂量组效果更显著,说明GL-V9对CCL4诱导的肝纤维化有保护作用和治疗作用,且具有剂量依赖性。
综上所述,我们发现GL-V9可以减少细胞外基质的沉积,对CCL4诱导的肝纤维化有良好的保护和治疗作用,并有剂量依赖性,GL-V9低剂量组的效果没有秋水仙碱剂量组好或与之相当,而GL-V9高剂量组效果更显著,且毒性作用小。因此,GL-V9有潜力成为逆转肝纤维化的新药。
- GL-V9在制备预防和/或治疗肝纤维化药物中的应用
- GL-V9在制备预防和/或治疗结肠炎药物中的应用
