非对称罗丹明染料和其在生物测定中的用途
文献发布时间:2023-06-19 12:02:28
背景技术
使用荧光罗丹明染料作为检测标记已经发现在分子生物学、细胞生物学和分子基因学中得到广泛使用。例如,使用荧光标记的寡核苷酸现已广泛用于各种不同的测定中,包含多核苷酸测序、荧光原位杂交(FISH)、核酸阵列上的杂交测定、荧光偏振研究和核酸扩增测定(包含用荧光探针和/或引物进行的聚合酶链扩增测定)。
已经描述了使用荧光染料的各种多重测定系统。例如,已经描述了用于多重测定系统中的罗丹明染料,如WO 2012/067901中描述的用于人类鉴定测定(HID)的那些罗丹明染料。不幸地是,包含罗丹明染料的现有染料组的光谱特性限制了开发组合使用大于6种染料的稳健且灵敏的测定系统的能力。为了实现此种较高重系统,需要开发具有独特地适于创建此类替代性多重染料组的光谱特性的新的罗丹明染料。
发明内容
描述了可以用于标记合成寡核苷酸的荧光化合物。在一个实施例中,所述化合物具有式(I)
其中R
R
R
R
R
R
每个R
每个R
每个R
每个R
n是范围为1到10的整数。
另一方面,本公开描述了一种寡核苷酸,其包括通过使与固体支持物连接的寡核苷酸与具有以下式的结构的试剂反应产生的标记部分:
LM-L-PEP
其中PEP是磷酸酯前体基团,L是将所述标记部分与所述PEP基团连接的任选的接头,并且LM包括式(I)的N-保护的NH-罗丹明部分
其中R
R
R
R
R
R
每个R
每个R
每个R
每个R
n是范围为1到10的整数。
另一方面,一种可用于标记寡核苷酸的试剂,所述试剂是根据以下结构式的化合物:
LM-L-PEP
其中LM表示包括N-保护的NH-罗丹明部分的标记部分,PEP是包括氨基亚磷酸酯基团或H-膦酸酯基团的磷酸酯前体基团,并且L是将所述标记部分与所述磷酸酯前体基团连接的任选的接头,其中以下结构(I)的N-保护的NH-罗丹明部分:
其中R
其中n是范围为1到10的整数;
其中R
前提是式LM-L-PEP的化合物的R
另一方面,一种方法包括:
用多个扩增引物对扩增核酸样品以形成多种扩增产物,其中所述引物对中的每个引物对中的至少一个引物包括具有结构式LM-L-PEP的经标记的核苷酸,其中所述扩增产物中的每种扩增产物包括不同的基因座。
附图说明
图1提供了可以用于将包括本文中所描述的试剂的各种不同部分彼此连接的示例性接头;
图2提供了不包含合成柄的非核苷合成试剂的示例性实施例;
图3提供了不包含合成柄的核苷合成试剂的示例性实施例;
图4提供了包含合成柄的非核苷合成试剂的示例性实施例;
图5提供了包含合成柄的非核苷合成试剂的示例性实施例;
图6提供了非核苷固体支持物试剂的示例性实施例;
图7提供了核苷固体支持物试剂的示例性实施例;
图8A展示了用于合成在其5'羟基处用NH-罗丹明染料标记的寡核苷酸的合成试剂的具体实施例的用途;
图8B展示了接头氨基亚磷酸酯的用途和用于原位合成在其5'端处用能量转移染料标记的寡核苷酸的合成试剂的具体实施例,并且
图9展示了用于合成在其3羟基处用能量转移染料标记的寡核苷酸的合成试剂的具体实施例的用途。
图10展示了用于多重测定中的提出的染料组的光谱。Cmp A,如PCT/US2019/67925中所描述的非对称罗丹明;Cmp B,如结构D.1中所示出的非对称罗丹明。
具体实施方式
应当理解,前面的总体描述和以下的详细描述两者均仅是示例性和解释性的,并且不旨在限制如本文中所描述的组合物和方法。在本公开中,除非另外说明,否则“或者”的使用意指“和/或”。类似地,表述“包括(comprise或comprises或comprising)”和“包含(include或includes或including)”不旨在是限制性的。
如本文和所附权利要求中所使用的,单数形式“一个或一种(a或an)”和“所述(the)”包含复数指代物,除非上下文另外明确规定。应进一步注意,权利要求可以被撰写为排除任何任选要素。因此,这种陈述旨在充当对于此类与权利要求要素的叙述相结合的排除性术语如“单独地”、“仅”等的使用,或“否定型”限制的使用的先行基础。
如本文所使用的,术语“包含(including)”、“含有(containing)”和“包括(comprising)”以其开放的非限制性的意义使用。
为了提供更简洁的描述,本文给出的定量表达中的一些定量表达未用术语“约”限定。应理解的是,无论是否明确使用术语“约”,本文给出的每个数量意在是指实际给定值,并且还意在是指基于本领域的普通技术人员将合理地推断出的这种给定值的近似值,其包含由于这种给定值的实验和/或测量条件而引起的等效值和近似值。每当以百分比给出产率时,这种产率是指实体的质量相对于可以在特定化学计量条件下获得的同一实体的最大量给出的产率。除非有不同指示,否则以百分比给出的浓度是指质量比。
4.1定义
如本文中所使用的,以下术语和短语旨在具有以下含义:
烷基本身或作为另一个取代基的一部分是指通过从母体烷烃、烯烃或炔烃的单个碳原子中去除一个氢原子衍生的具有规定数量的碳原子(即,C1-C6意指一个到六个碳原子)的饱和或不饱和支链、直链或环状单价烃基。典型的烷基包含但不限于:甲基;乙基,如乙烷基(ethanyl)、乙烯基乙炔基;丙基,如丙烷-1-基、丙烷-2-基、环丙烷-1-基、丙-1-烯-1-基、丙-1-烯-2-基、丙-2-烯-1-基、环丙-1-烯-1-基;环丙-2-烯-1-基、丙-1-炔-1-基、丙-2-炔-1-基等;丁基,如丁烷-1-基、丁烷-2-基、2-甲基-丙烷-1-基、2-甲基-丙烷-2-基、环丁烷-1-基、丁-1-烯-1-基、丁-1-烯-2-基、2-甲基-丙-1-烯-1-基、丁-2-烯-1-基、丁-2-烯-2-基、丁-1,3-二烯-1-基、丁-1,3-二烯-2-基、环丁-1-烯-1-基、环丁-1-烯-3-基、环丁-1,3-二烯-1-基、丁-1-炔-1-基、丁-1-炔-3-基、丁-3-炔-1-基等;等等。在预期特定饱和水平的情况下,使用如下文所定义的命名法“链烷基”、“烯基”和/或“炔基”。如本文中所使用的,“低级烷基”意指(C1-C8)烷基。
“链烷基”本身或作为另一个取代基的一部分是指通过从母体烷烃的单个碳原子去除一个氢原子衍生的饱和支链、直链或环状烷基。典型的链烷基包含但不限于:甲烷基;乙烷基;丙烷基,如丙烷-1-基、丙烷-2-基(异丙基)、环丙烷-1-基等;丁烷基,如丁烷-1-基、丁烷-2-基(仲丁基)、2-甲基-丙烷-1-基(异丁基)、2-甲基-丙烷-2-基(叔丁基)、环丁烷-1-基等;等等。如本文中所使用的,“低级链烷基”意指(C1-C8)链烷基。
“烯基”本身或作为另一个取代基的一部分是指通过从母体烷烃的单个碳原子去除一个氢原子衍生的具有至少一个碳-碳双键的不饱和支链、直链或环状烷基。所述基团可以关于一个或多个双键呈顺式或反式构型。典型的烯基包含但不限于:乙烯基;丙烯基,如丙-1-烯-1-基、丙-1-烯-2-基、丙-2-烯-1-基、丙-2-烯-2-基、环丙-1-烯-1-基;环丙-2-烯-1-基;丁烯基,如丁-1-烯-1-基、丁-1-烯-2-基、2-甲基-丙-1-烯-1-基、丁-2-烯-1-基、丁-2-烯-2-基、丁-1,3-二烯-1-基、丁-1,3-二烯-2-基、环丁-1-烯-1-基、环丁-1-烯-3-基、环丁-1,3-二烯-1-基等;等等。如本文中所使用的,“低级烯基”意指(C2-C8)烯基。
“炔基”本身或作为另一个取代基的一部分是指通过从母体烷烃的单个碳原子去除一个氢原子衍生的具有至少一个碳-碳三键的不饱和支链、直链或环状烷基。典型的炔基包含但不限于:乙炔基;丙炔基,如丙-1-炔-1-基、丙-2-炔-1-基等;丁炔基,如丁-1-炔-1-基、丁-1-炔-3-基、丁-3-炔-1-基等;等等。如本文中所使用的,“低级炔基”意指(C2-C8)炔基。
“烷基二基”本身或作为另一个取代基的一部分是指通过从母体烷烃、烯烃或炔烃的两个不同碳原子中的每个碳原子去除一个氢原子或通过从母体烷烃、烯烃或炔烃的单个碳原子中去除两个氢原子衍生的具有规定数量的碳原子(即,C1-C6意指一个到六个碳原子)的饱和或不饱和支链、直链或环状二价烃基。两个单价基团中心或二价基团中心的每个化合价可以与相同或不同的原子形成键。典型的烷基二基包含但不限于:甲烷二基;乙基二基,如乙烷-1,1-二基、乙烷-1,2-二基、乙烯-1,1-二基、乙烯-1,2-二基;丙基二基,如丙烷-1,1-二基、丙烷-1,2-二基、丙烷-2,2-二基、丙烷-1,3-二基、环丙烷-1,1-二基、环丙烷-1,2-二基、丙-1-烯-1,1-二基、丙-1-烯-1,2-二基、丙-2-烯-1,2-二基、丙-1-烯-1,3-二基、环丙-1-烯-1,2-二基、环丙-2-烯-1,2-二基、环丙-2-烯-1,1-二基、丙-1-烯-1,3-二基等;丁基二基,如丁烷-1-二基、丁烷-1,2-二基、丁烷-1,3-二基、丁烷-1,4-二基、丁烷-2,2-二基、2-甲基-丙烷-1,1-二基、2-甲基-丙烷-1,2-二基、环丁烷-1,1-二基;环丁烷-1,2-二基、环丁烷-1,3-二基、丁-1-烯-1,1-二基、丁-1-烯-1,2-二基、丁-1-烯-1,3-二基、丁-1-烯-1,4-二基、2-甲基-丙-1-烯-1,1-二基、2-亚甲烷基-丙烷-1,1-二基、丁-1,3-二烯-1,1-二基、丁-1,3-二烯-1,2-二基、丁-1,3-二烯-1,3-二基、丁-1,3-二烯-1,4-二基、环丁-1-烯-1,2-二基、环丁-1-烯-1,3-二基、环丁-2-烯-1,2-二基、环丁-1,3-二烯-1,2-二基、环丁-1,3-二烯-1,3-二基、丁-1-炔-1,3-二基、丁-1-炔-1,4-二基、丁-1,3-二炔-1,4-二基等;等等。在预期特定饱和水平的情况下,使用命名法烷基烷基二基、烯基二基和/或炔基二基。在明确期望两个化合价在同一碳原子上的情况下,使用命名法“亚烷基”。在一些实施例中,烷基二基是(C1-C8)烷基二基。具体实施例包含其中基团中心在末端碳处的饱和非环状烷基二基,例如甲烷二基(甲醇);乙烷-1,2-二基(乙醇);丙烷-1,3-二基(丙醇);丁烷-1,4-二基(丁醇);等等(也被称为下文所定义的烷基烯酮(alkylenos))。如本文中所使用的,“低级烷基二基”意指(C1-C8)烷基二基。
“亚烷基”本身或作为另一个取代基的一部分是指通过从直链或支链母体烷烃、烯烃或炔烃的两个末端碳原子中的每个末端碳原子去除一个氢原子或通过从母体环烷基的两个不同环原子中的每个环原子中去除一个氢原子衍生的具有两个末端单价基团中心的直链饱和或不饱和烷基二基。在特定的亚烷基中,如果存在双键或三键的位次,则在方括号中指示。典型的亚烷基包含但不限于:亚甲基(甲醇);乙烯,如乙醇、亚乙烯基、乙炔;丙烯,如丙醇、丙[1]烯醇、丙[1,2]二烯醇、丙[1]炔醇等;丁烯,如丁醇、丁[1]烯醇、丁[2]烯醇、丁[1,3]二烯醇、丁[1]炔醇、丁[2]炔醇、丁[1,3]二炔醇等;等等。在预期特定饱和水平的情况下,使用命名法链烷醇、链烯醇和/或链炔醇。在一些实施例中,亚烷基是(C1-C8)或(C1-C3)亚烷基。具体实施例包含直链饱和链烷醇基团,例如甲醇、乙醇、丙醇、丁醇等。如本文中所使用的,“低级亚烷基”意指(C1-C8)亚烷基。
“杂烷基”、“杂链烷基”、“杂烯基”、“杂炔基”、“杂烷基二基”和“亚杂烷基”本身或作为另一个取代基的一部分分别是指其中碳原子中的一个或多个碳原子各自独立地被相同或不同的杂原子或杂原子基团替代的烷基、链烷基、烯基、炔基、烷基二基和亚烷基。可以替代碳原子的典型的杂原子和/或杂原子基团包含但不限于-O-、-S-、-S-O-、-NR'-、-PH-、-S(O)-、-SO2-、-S(O)NR'-、-SO2NR'-等,包含其组合,其中R'是氢或取代基,例如(C1-C8)烷基、(C6-C14)芳基或(C7-C20)芳基烷基。
“环烷基”和“杂环烷基”本身或作为另一个取代基的一部分分别是指“烷基”和“杂烷基”基团的环状形式。对于杂烷基,杂原子可以占据与分子的其余部分连接的位置。典型环烷基包含但不限于:环丙基;环丁基,如环丁烷基和环丁烯基;环戊基,如环戊烷基和环戊烯基;环己基,如环己烷基和环己烯基;等等。典型的杂环烷基包含但不限于四氢呋喃基(例如,四氢呋喃-2-基、四氢呋喃-3-基等)、哌啶基(例如,哌啶-1-基、哌啶-2-基等)、吗啉基(例如,吗啉-3-基、吗啉-4-基等)、哌嗪基(例如,哌嗪-1-基、哌嗪-2-基等)等等。
“母体芳香族环系统”是指具有共轭π电子系统的不饱和环状或多环状环系统。稠合环系统特别地包含在“母体芳香族环系统”的定义内,在所述稠合环系统中,环中的一个或多个环是芳香族并且所述环中的一个或多个环是饱和或不饱和的,例如芴、茚满、茚、非那烯(phenalene)、四氢化萘等。典型的母体芳香族环系统包含但不限于醋蒽烯(aceanthrylene)、苊烯(acenaphthylene)、醋菲烯(acephenanthrylene)、精蒽(anthracene)、薁(azulene)、苯、
“芳基”本身或作为另一个取代基的一部分是指通过从母体芳香族环系统的单个碳原子中去除一个氢原子衍生的具有规定数量的碳原子(即,C6-C14意指6个到14个碳原子)的单价芳香族烃基。典型的芳基包含但不限于衍生自以下的基团:醋蒽烯、苊烯、醋菲烯、精蒽、薁、苯、
“芳基烷基”本身或作为另一个取代基的一部分是指其中与碳原子(在一些实施例中,末端或sp3碳原子)键合的氢原子中的一个被芳基替代的非环状烷基。典型的芳基烷基包含但不限于苄基、2-苯基乙烷-1-基、2-苯基乙烯-1-基、萘基甲基、2-萘基乙烷-1-基、2-萘基乙烯-1-基、萘苄基、2-萘苯基乙烷-1-基等。在预期具有指定饱和度的烷基部分的情况下,使用命名法芳基链烷基、芳基烯基和/或芳基炔基。当规定限定数量的碳原子时,例如(C7-C20)芳基烷基,所述数量是指包括芳基烷基的碳原子的总数。
“母体杂芳香族环系统”是指其中一个或多个碳原子各自独立地被相同或不同的杂原子或杂原子基团替代的母体芳香族环系统。用于替代碳原子的典型杂原子或杂原子基团包含但不限于N、NH、P、O、S、S(O)、SO2、Si等。稠合环系统特别地包含在“母体杂芳香族环系统”的定义内,在所述稠合环系统中,其中环中的一个或多个环是芳香族的并且所述环中的一个或多个环是饱和或不饱和的,例如苯并苯并二噁烷、苯并呋喃、色满、色烯、吲哚、二氢吲哚、呫吨等。那些已识别的环也包含在“母体杂芳香族环系统”的定义中,例如苯并吡喃酮和1-甲基-1,2,3,4-四唑。典型的母体杂芳香族环系统包含但不限于吖啶、苯并咪唑、苯并异噁唑、苯并二噁烷、苯并二噁唑、苯并呋喃、苯并吡喃酮、苯并噻二唑、苯并噻唑、苯并三唑、苯并恶嗪、苯并恶唑、苯并恶唑啉、咔唑、β-咔啉、色满、色烯、苯甲基、噌啉、呋喃、咪唑、吲唑、吲哚、吲哚啉、吲哚嗪、异苯并呋喃、异色烯、异吲哚、异吲哚啉、异喹啉、异噻唑、异噁唑、萘啶、噁二唑、噁唑、哌啶、菲啶、菲咯啉、吩嗪、酞嗪、哒嗪、蝶啶、嘌呤、吡喃、吡嗪、吡唑、哒嗪、吡啶、嘧啶、吡咯、吡咯嗪、喹唑啉、喹啉、喹啉嗪、喹喔啉、四唑、噻二唑、噻唑、噻吩、三唑、呫吨等等。
“杂芳基”本身或作为另一个取代基的一部分是指通过从母体杂芳香族环系统的单个原子中的去除一个氢原子衍生的具有规定数量的环原子(例如,“5-14元”意指5到14个环原子)的单价杂芳香族基团。典型的杂芳基包含但不限于衍生自以下的基团:吖啶、苯并咪唑、苯并异噁唑、苯并二噁烷、苯并二噁唑、苯并呋喃、苯并吡喃酮、苯并噻二唑、苯并噻唑、苯并三唑、苯并恶嗪、苯并恶唑、苯并恶唑啉、咔唑、β-咔啉、色满、色烯、苯甲基、噌啉、呋喃、咪唑、吲唑、吲哚、吲哚啉、吲哚嗪、异苯并呋喃、异色烯、异吲哚、异吲哚啉、异喹啉、异噻唑、异噁唑、萘啶、噁二唑、噁唑、哌啶、菲啶、菲咯啉、吩嗪、酞嗪、哒嗪、蝶啶、嘌呤、吡喃、吡嗪、吡唑、哒嗪、吡啶、嘧啶、吡咯、吡咯嗪、喹唑啉、喹啉、喹啉嗪、喹喔啉、四唑、噻二唑、噻唑、噻吩、三唑、呫吨等等以及其加氢异构体。
“杂芳基烷基”本身或作为另一个取代基的一部分是指其中与碳原子(在一些实施例中,末端或sp3碳原子)键合的氢原子之一被杂芳基替代的非环状烷基。在预期具有指定饱和度的烷基部分的情况下,使用命名法杂芳基链烷基、杂芳基烯基和/或杂芳基炔基。当规定限定数量的原子时,例如6-20元杂芳基烷基,所述数量是指包括芳基烷基的原子的总数。
“卤基烷基”本身或作为另一个取代基的一部分是指其中氢原子中的一个或多个氢原子被卤素替代的烷基。因此,术语“卤基烷基”意指包含单卤基烷基、二卤基烷基、三卤基烷基等直到全卤基烷基。例如,表述“(C1-C2)卤基烷基”包含氟甲基、二氟甲基、三氟甲基、1-氟乙基、1,1-二氟乙基、1,2-二氟乙基,1,1,1-三氟乙基、全氟乙基等。
上文所定义的基团可以包含本领域中通常用于产生另外的公认的取代基的前缀和/或后缀。作为非限制性具体实例,“烷基氧基”和/或“烷氧基”是指式-OR”的基团,“烷基胺”是指式-NHR”的基团,并且“二烷基胺”是指式-NR”R”的基团,其中每个R”是烷基。
如本文中所使用的,“DNA”是指如本领域中所了解呈其各种形式的脱氧核糖核酸,如基因组DNA、cDNA、分离的核酸分子、载体DNA以及染色体DNA。“核酸”是指呈任何形式的DNA或RNA(核糖核酸)。如本文中所使用的,术语“分离的核酸分子'1是指已经从其天然环境中去除的核酸分子(DNA或RNA)。分离的核酸分子的一些实例是载体中含有的重组DNA分子、维持
在异源宿主细胞中的重组DNA分子、部分或基本上纯化的核酸分子和合成DNA分子。“分离的”核酸可以不含天然地侧接衍生出核酸的生物体的基因组DNA中的核酸的序列(即,位于核酸的5'和3'端处的序列)。此外,“分离的”核酸分子(如cDNA分子)当通过重组技术产生时可以基本上不含其它细胞材料或培养基或当以化学方式合成时基本上不含化学前体或其它化学品。
“短串联重复序列”或“STR”基因座是指基因组DNA的含有短的重复序列元件的区域。重复的序列元件的长度不限于但通常为三到七个碱基对。每个序列元件在STR中重复至少一次并且在本文中被称为“重复单元”。术语STR还涵盖基因组DNA的区域,其中超过单个重复单元串联重复或插入碱基重复,前提是序列中的至少一个序列串联重复至少两次。
“多态短串联重复基因座”是指其中在基因组DNA的特定区域中的重复序列元件的数量(和所述序列的净长度)因等位基因而异并且因个体而异的STR基因座。
如本文中所使用的,“等位基因分型标准物(allelic ladder)”是指由来自基因座的经扩增的等位基因组成的标准大小标志物。“等位基因”是指与DNA区段相关的基因变异,即,占据同一基因座的DNA序列的两种或更多种替代形式之一。
“生化命名法”是指如本文中所使用的标准生化命名法,其中核苷酸碱基被命名为腺嘌呤(A)、胸腺嘧啶(T)、鸟嘌呤(G)和胞嘧啶(C)。对应的核苷酸是例如脱氧鸟苷-5'三磷酸(dGTP)。
“DNA多态性”是指DNA序列中的两种或更多种不同核苷酸序列在同一杂交群体中共存的条件。
“基因座(Locus)”或“基因座(genetic locus)”是指染色体上的特定物理位置。基因座的等位基因位于同源染色体上的相同位点处。
“基因座特异性引物”是指与所述基因座的一部分或其互补链(至少所述基因座的一个等位基因)特异性杂交并且在扩增方法中所使用的条件下不与其它DNA序列有效杂交的引物。
“聚合酶链反应”或“PCR”是指其中使用重复的变性循环、用引物进行的退火和用DNA聚合酶进行的延伸来将靶DNA序列的拷贝数扩增大约10
如本文中所使用的,“扩增”是指以酶促方式增加特定核苷酸序列的量的过程。这种扩增不限于但主要是通过PCR实现。如本文中所使用的,“变性”是指从退火状态分离两条互补核苷酸链。变性可以通过多种因素诱导,例如缓冲液的离子强度、温度或破坏碱基配对相互作用的化学品。如本文中所使用的,“退火”是指核苷酸链之间的特定相互相用,其中所述链基本上基于如通过沃森-克里克(Watson-Crick)碱基配对所测定的链之间的互补性彼此结合。为了发生退火,互补性不必是100%。如本文中所使用的,“延伸”是指在引物寡核苷酸和靶核酸退火之后的扩增循环,其中聚合酶使用靶核酸作为重复模板来实现引物延伸成适当大小的片段。
“引物”是指以使得引物的3'末端可以充当使用DNA聚合酶进行的聚合和延伸的位点的方式与基因座的DNA链杂交的单链寡核苷酸或DNA片段。“引物对”是指两个引物,其包括在要扩增的DNA序列的一端处与单链杂交的引物1和在要扩增的DNA序列的互补链上与另一端杂交的引物2。“引物位点”是指引物与其杂交的靶DNA的区域。
“基因标志物”通常是具有用于进行分析(如DNA分型,其中基于个体的DNA的变异区分所述个体)的所关注特性的基因组DNA的等位基因。大多数DNA分型方法被设计成用于检测并分析已知以至少两种不同形式或等位基因出现在群体中的DNA标志物的一个或多个区域的长度和/或序列的差异。此种变异被称为“多态性”,并且发生此种变异的DNA的任何区域被称为“多态性基因座”。进行DNA分型的一种可能的方法涉及将PCR扩增技术(KBMullis,美国专利第4,683,202号)与对长度变异多态性的分析结合。PCR在传统上仅可以用于可靠地扩增相对较小的DNA区段;即,仅扩增长度小于3,000个碱基的DNA区段(M.Ponce和L.Micol(1992),《NAR》20(3):623;R.Decorte等人(1990),《DNA与细胞生物学(DNACELLBIOL)》9(6):461 469)。短串联重复序列(STR)、小卫星和数量可变串联重复序列(VNTR)是长度变异多态性的一些实例。含有小卫星或VNTR的DNA区段一般过长以致于不能通过PCR可靠地扩增。相比之下,含有大约三到七个核苷酸的重复单元的STR足够短足以用作PCR应用中的基因标志物,因为扩增方案可以被设计成产生比可能来自DNA的其它可变长度区域的产物小的产物。
如本文中所使用的,术语“试剂盒”是指用于递送材料的任何递送系统。在反应测定的上下文中,此类递送系统包含允许将反应试剂(例如,适当的容器中的寡核苷酸、酶、一个或多个引物组等)和/或支持材料(例如,缓冲液、用于进行测定的书面说明等)从一个位置储存、运输或递送到另一个位置的系统。例如,试剂盒包含一个或多个含有相关反应试剂和/或支持材料的外壳(例如,盒子)。如本文中所使用的,术语“片段化试剂盒”是指包括各自含有全部试剂盒组件的子部分的两个或更多个单独容器的递送系统。容器可以一起或单独地递送给预期的接受者。例如,第一容器可以含有用于在测定中使用的酶,而第二容器含有寡核苷酸。实际上,术语“片段化试剂盒”中包含包括各自含有全部试剂盒组件的子部分的两个或更多个单独容器的任何递送系统。相比之下,“组合试剂盒”是指在单个容器中(例如,在容纳期望的组件中的每个组件的单个盒子中)含有反应测定的所有组件的递送系统。术语“试剂盒”包含片段化试剂盒和组合试剂盒两者。
4.2示例性实施例
本公开提供了可以用于化学合成携带包括罗丹明染料的标记部分的寡核苷酸的试剂。传统上,难以化学合成罗丹明标记的寡核苷酸,部分原因是缺乏对寡核苷酸的逐步化学合成中通常采用的合成和/或脱保护条件稳定的含罗丹明的合成试剂的可用性。现已发现,用碱不稳定保护基团(如乙酰基)保护NH-罗丹明染料的环外胺基提供了对寡核苷酸的固相合成中通常采用的化学合成和脱保护条件稳定的N-保护的NH-罗丹明染料。结果,N-保护的NH-罗丹明可以掺入到可以用于合成用包括罗丹明染料的标记部分标记的寡核苷酸的试剂中,由此避免了合成后与标签连接的需要。因为标记是在合成期间连接的,所以可以纯化所产生的经标记的寡核苷酸以供使用,而无需使用HPLC。
所述试剂利用了寡核苷酸的逐步固相合成中众所周知的试剂和化学成份的各种特征,并且可以呈在寡核苷酸链的逐步固相合成期间与羟基偶联的合成试剂的形式或以核苷单体试剂(如核苷氨基亚磷酸酯试剂和/或任选地其它试剂)以逐步方式与其偶联以产生合成的寡核苷酸的固体支持物试剂的形式。
合成试剂和固体支持物试剂在性质上可以是核苷的,因为所述试剂可以包含核苷部分,或者在性质上可以是非核苷的。
本文中所描述的所有试剂均包含包括N-保护的NH-罗丹明染料或部分的标记部分。N-保护的NH-罗丹明染料可以是唯一包括标记部分的染料,或者可替代地其可以是包括较大染料网络的两种或更多种染料之一。固体支持物试剂另外地包含固体支持物和可以与另外的基团偶联的一个或多个合成柄。合成试剂另外地包含用于将试剂偶联到伯羟基的PEP基团,并且可以任选地包含一个或多个合成柄。包括试剂的各个部分和基团可以以允许所述各个部分和基团执行其相应功能的任何方式和/或朝向连接在一起。所述各个部分和基团可以通过部分上包含的连接基团彼此连接,或者可以在接头的帮助下彼此连接。
下文更详细地描述了包括本文中所描述的试剂的各个部分、基团和接头。
4.3接头和连接基团
包括本文中所描述试剂的各个基团和部分通常用接头彼此连接。任何特定接头的身份将部分地取决于彼此连接的部分的身份。通常,接头包含间隔部分,所述间隔部分实际上可以包括对经标记的寡核苷酸的合成所使用的合成条件(如通常用于通过亚磷酸三酯方法合成寡核苷酸的条件)稳定的原子或官能团的任何组合,并且在结构上可以是直链、支链或环状的,或者可以包含直链、支链和/或环状结构的组合。间隔部分在性质上可以是单体的,或者其可以是或包含在性质上是聚合物的区域。间隔部分可以被设计成具有指定性质,如在指定条件下被切割的能力或指定程度的刚性、柔性、疏水性和/或亲水性。
如下文将更详细描述的,本文中所描述的试剂的许多实施例是通过以指定方式使合成子彼此缩合以产生期望的试剂来合成的。每个合成子通常包含适于形成期望的键的一个或多个连接基团。通常,连接基团包括能够与另一个官能团F
能够彼此形成共价键的互补官能团对在本领域中是众所周知的。在一些实施例中,F
因此,接头合成子通常可以通过式LG-Sp-LG来描述,其中每个LG彼此独立地表示连接基团,并且Sp表示间隔部分。在一些实施例中,接头合成子可以通过式F
4.4标记部分
本文中所描述的试剂可以包含标记部分,包括NH-罗丹明染料,在环外胺基之一处被具有特定性质的保护基团保护。通常,罗丹明染料的特征在于以下四种主要特征:(1)母体呫吨环;(2)环外胺取代基;(3)环外亚铵取代基;和(4)在邻位处被羧基取代的苯基。在一些实施例中,本公开的NH-罗丹明染料通常可以通过式(Ia)来描述。在一些实施例中,环外胺和/或亚铵基通常位于母体呫吨环的C3'和C6'碳原子处,尽管其中母体呫吨环包括与C3'和C4'碳和/或C5'和C6'碳稠合的苯并基的“经延伸的”罗丹明也是已知的。在这些经延伸的罗丹明中,特征性环外胺和亚铵基位于经延伸的呫吨环的对应位置处。
经羧基取代的苯基与母体呫吨环的C1碳连接。作为邻羧基取代基的结果,罗丹明染料可以以两种不同的形式存在:(1)开放的酸形式;和(2)封闭的内酯形式。虽然不旨在受任何操作理论的束缚,但是因为本文中所描述的示例性N-保护的NH-罗丹明染料的NMR光谱与所述染料的封闭的螺内酯形式一致,所以据信包括本文中所描述的试剂的标记部分的N-保护的NH-罗丹明染料呈封闭的螺内酯形式。因此,本文以其封闭的螺内酯形式展示了各种罗丹明和其未受保护的对应物。然而,应当注意,这仅是为了方便,并且不旨在将本文中所描述的各种试剂限制于染料的内酯形式。在某些实施例中,化合物的开放的酸形式相对于化合物的封闭的螺内酯形式是荧光的(或表现出荧光增加)。本文中所描述的化合物的胺基可呈封闭的螺内酯形式受到保护,并且可以被制备成并用作氨基亚磷酸酯以对核酸进行高产率和高纯度标记。因此,本文中还提供了包含呈脱保护的、开放的内酯形式的化合物的荧光标记的核酸探针和引物。图8和9中示出了从固体支持物脱保护胺基并切割核酸探针之后的开放的内酯形式的代表性实例。
在封闭的螺内酯形式中,母体呫吨环的A和C环是芳香族的,并且C3'取代基和C6'取代基两者均是胺。本文中所描述的标记部分中所包含的罗丹明染料的环外胺基是未经取代或单取代的,使得这些胺基是伯胺或仲胺。此类罗丹明染料在本文中被称为“NH-罗丹明”。因此,如本文中所使用的,“NH-罗丹明”通常包括以下母体NH-罗丹明环结构:
其中R
在本文所描述的实施例中的任何实施例中,示例性标记部分可以属于式(II.1)、(II.2)、(II.3)、(II.4)
本领域技术人员将容易地了解,本公开描述了式I内的其它标记部分,如式(II.1)、(II.2)和(II.3)的那些标记部分,其中R
在本文中所描述的结构式(Ia)和其它式的NH-罗丹明环中,R
在一些实施例中,R
可替代地,两个相邻环原子可以包含在芳基桥中,如苯甲基或萘基。包含根据其中R
在一些实施例中,所述取代基彼此独立地选自低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基、R
因为本文中所描述的试剂将用于化学合成经标记的寡核苷酸,所以R
用于对合成寡核苷酸进行合成和脱保护的条件在本领域中是众所周知的,并且例如在核酸化学的当前方案(Current Protocols in Nucleic Acid Chemistry)第I卷,Beancage等人,编者:John Wiley和Sons,2002中进行了描述,所述文献的公开内容通过引用并入本文中。简而言之,采用氨基亚磷酸酯试剂的合成方法涉及多轮以下步骤:(i)DMT脱保护以揭示游离羟基,这可能会受到用含2.5%或3%二氯乙酸或三氯乙酸的二氯甲烷进行的处理的影响;(ii)将核苷或其它氨基亚磷酸酯试剂与所述游离羟基偶联,这可以在含有0.45M或0.5M的四唑的乙腈中进行;(iii)氧化,这可以通过用I
用于在合成中进行各个步骤的其它条件在本领域中也是已知的。例如,氨基亚磷酸酯偶联可以在含有0.25M的5-乙硫基-1H-四唑、0.25M的4,5-二氰基咪唑(DCI)或0.25M的5-苄硫基-1H-四唑(BTT)的乙腈中进行。氧化可以在含0.1M、0.05M或0.02M的I
尽管受到可以在温和条件(如通过在室温下用浓缩的氢氧化铵处理4-17小时或用含0.05M的碳酸钾的甲醇进行处理或用含25%叔丁胺的HO/EtOH进行处理)下去除的基团保护的核苷氨基亚磷酸酯试剂在本领域中也已知的,但是从合成试剂去除任何保护基团并进行切割通常可以通过在60℃下用浓缩的氢氧化铵处理1-12小时来实现。技术人员将能够容易地选择具有适于在特定合成和脱保护和/或切割条件下使用的性质的保护基团。各种各样的胺保护基团例如在Greene和Wuts,“有机化学中的保护基团(Protective Groups InOrganic Chemistry)”第3版,John Wiley和Sons,1999(以下简称“Green和Wuts”)例如第309-405页处进行了教导。技术人员可以容易地从Green和Wuts中所教导的那些保护基团中选择具有适合的性质的保护基团R
连接基团LG可以与N-保护的NH-罗丹明合成子的任何可用碳原子或与这些碳原子之一连接的取代基连接。连接基团的位置可以部分地取决于N-保护的NH-罗丹明合成子将与其连接的基团或部分。在一些实施例中,连接基团连接在N-保护的NH-罗丹明合成子的C1'、C2'、C4'、C5'、C7'、C8'、C5、C6或C7位置处。在具体实施例中,连接基团连接在C4'、C5'、C5或C6位置处。
N-保护的NH-罗丹明合成子可以包含单个连接基团LG,或者其可以包含多于一个连接基团LG。在采用多于一个连接基团的实施例中,所述连接基团可以相同,或者所述连接基团可以不同。包含彼此不同的多个连接基团LG的N-保护的NH-罗丹明合成子可以具有使用正交化学与母体NH-罗丹明环的不同位置连接的不同基团或部分。在一些情况下,连接基团的身份可以取决于其在母体NH-罗丹明环上的位置。在其中连接基团LG连接在母体NH-罗丹明环的C4'或C5'位置处的一些实施例中,所述连接基团LG是式-(CH)
在其中连接基团LG连接在母体NH-罗丹明环的5或6位置处的一些实施例中,所述连接基团LG是式-(CH
如先前所讨论的,标记部分可以包括一种或多种另外的染料,使得N-保护的NH-罗丹明一旦被脱保护就成为较大的能量转移染料网络的成员。此类能量转移染料网络在本领域中是众所周知的,并且包含其光谱特性匹配和/或其彼此的相对距离被调节的荧光染料的组合,使得网络中的一种荧光染料在被适当波长的入射辐射激发时将其激发能量转移到网络中的另一种荧光染料,然后所述另一种荧光染料其激发能量转移到网络中的又另一种荧光染料,依此类推,从而通过网络中的最终受体染料产生荧光。染料网络提供具有长斯托克位移的标记部分。在此类网络中,将其激发能量转移或贡献给网络中的另一种荧光团的荧光团被称为“供体”。从另一种荧光团接收或接受激发能量的荧光团被称为“受体”。在仅含有两种荧光染料的染料网络中,一种荧光染料充当供体,并且另一种荧光染料充当受体。在含有三种或更多种荧光染料的染料网络中,至少一种染料既充当供体又充当受体。染料网络如何工作的原理以及选择和连接适于创建此类网络的单个染料的标准是众所周知的并且在例如Hung等人,1997,《分析生物化学(Anal.Biochem.)》252:78-88中进行了描述。
在本文中所描述的包括染料网络的标记部分中,N-保护的NH-罗丹明染料一旦被脱保护就可以充当供体或受体,或者既充当供体又充当受体,这取决于包括网络的其它染料的身份和期望的入射和荧光波长。适于用作NH-罗丹明染料的供体和/或受体的许多染料在本领域中是已知的,并且包含(通过举例而非限制的方式)呫吨染料(例如,荧光素、罗丹明和rhodol染料)、芘染料、香豆素染料(例如,羟基香豆素和氨基香豆素)、花青染料、酞菁染料和镧系元素复合物。在能量转移染料网络的上下文中的这些染料的具体非限制性实例在以下文献中进行了描述:Hung等人,1996,《分析生物化学》238:165-170;Medintz等人,2004,《美国国家科学院院刊(Proc.Nat'l Acad.Sci.USA)》101(26):9612-9617;美国专利第5,800,996号;Sudhaker等人,2003,《核苷、核苷酸和核酸(Nucleosides,Nucleotides&Nucleic Acids)》22:1443-1445;美国专利第6,358,684号;Majumdar等人,2005,《分子生物学杂志(J.Mol.Biol.)》351:1123-1145;Dietrich等人,2002,《分子生物技术评论(ReviewsMol.Biotechnology.)》82(3):211-231;Tsuji等人,2001,《生物物理学杂志(BiophysicalJ.)》81(1):501-515;Dickson等人,1995,《光化学和光生物学杂志(J.Photochemistry&Photobiology)》27(1):3-19;和Kumar等人,2004,《核酸研究的发展(Developments inNucl.Acid Res.)》1:251-274,所述文献的公开内容通过引用并入本文中。可以根据本文中所描述的原理适当保护的这些染料中的任何染料可以用作包括染料网络的标记部分中的供体和受体染料。在一些实施例中,包括网络的供体和/或受体染料中的一种或多种供体和/或受体染料可以是如本文中所描述的N-保护的NH-罗丹明染料。用于将供体和/或受体染料与罗丹明染料连接以形成染料网络的特定位置以及可用于连接此类染料的特定键和接头在本领域中是众所周知的。具体实例在例如美国专利第6,811,979号;美国专利第6,008,379号;美国专利第5,945,526号;美国专利第5,863,727号;和美国专利第5,800,996号中进行了描述,所述美国专利的公开内容通过引用并入本文中。
在一些实施例中,连接供体和受体染料的接头是如美国专利第6,811,979号中所述描述的阴离子接头,所述美国专利的公开内容通过引用并入本文中(参见例如,第17栏第25行至第18栏第37行处的公开和图1-17)。
在本文中所描述的试剂的一些实施例中,标记部分包含NH-罗丹明染料的供体染料。在一些实施例中,供体染料是荧光素或罗丹明染料,例如本文中所描述的NH-罗丹明染料之一。在具体实施例中,供体染料是荧光素染料。荧光素染料在结构上与罗丹明染料相似,不同之处在于母体呫吨环的3和6位置(对应于结构式(Ia)的NH-罗丹明环的3'和6'位置)被羟基取代。像罗丹明一样,荧光素也可以具有延伸的环结构,其中在母体呫吨环的位置C3'和C4'和/或C5'和C6'处的碳原子包含在芳基桥(如苯并基)中。因此,荧光素通常包含根据以下结构式(IVa)、(IVb)和(IVc)的化合物:
像NH-罗丹明一样,结构式(IVa)、(IVb)和(IVc)的荧光素环的位置C1'、C2'、C2”、C4'、C4”、C5'、C5”、C7'、C7”、C8'、C4、C5、C6和C7处的碳可以被各种不同的取代基(如先前针对NH-罗丹明所描述的那些取代基)取代。
当被包含在本文中所描述的标记部分中时,C3'和C6'位置处的羟基应受到具有与上文所讨论的保护NH-罗丹明的环外胺的基团相同的一般性质的保护基团的保护。因此,在具体实施例中,保护基团对用于合成寡核苷酸的条件(如用于通过亚磷酸三酯方法合成和氧化寡核苷酸的条件)是稳定的,并且在通常用于将合成寡核苷酸从合成树脂脱保护和/或切割的条件(例如在室温或55℃下在浓缩的氢氧化铵中温育)下是不稳定的。
其中C3'和C6'环外羟基包含保护基团的荧光素在本文中被称为“O-保护的荧光素”。分别对应于结构式(IVa)、(IVb)和(IVc)的荧光素的O保护的荧光素如以下结构式(Va)、(Vb)和(Vc)所展示:
其中R
可以受到适当保护并被掺入到标记部分中以用作NH-罗丹明部分的供体的多种不同的荧光素染料在本领域中是已知的。具体示例性荧光素染料在例如美国专利第6,221,604号;美国专利第6,008,379号;美国专利第5,840,999号;美国专利第5,750,409号;美国专利第5,654,441号;美国专利第5,188,934号;美国专利第5,066,580号;美国专利第4,481,136号;美国专利第4,439,356号;WO 99/16832;和EP 0 050 684中进行了描述,所述美国专利的公开内容通过引用并入本文中。技术人员将能够选择具有适于用作特定NH-罗丹明的供体的光谱特性的荧光素。
供体和N-保护的NH-罗丹明受体可以直接或借助接头以多种朝向彼此连接。在供体是O-保护的荧光素或N-保护的NH-罗丹明的一些实施例中,供体通过N-保护的罗丹明受体的C2'、C2”、C4'、C5'、C7'、C7”、C5或C6位置与其C2'、C4'、C5'、C7'、C5或C6位置连接。
下表2中提供了特定的示例性连接朝向:
表2
包括染料网络(如表2的供体-受体染料网络)的标记部分可以在任何可用位置处与试剂的其余部分连接。在一些实施例中,包括头对头连接的受体/供体对的标记部分通过供体或受体部分的C5或C6位置与试剂的其余部分连接。在一些实施例中,包括头对尾连接的受体/供体对的标记部分通过供体或受体部分的C4'、C5'、C5或C6位置与试剂的其余部分连接。在一些实施例中,包括尾对尾连接的受体/供体对的标记部分通过供体或受体的C4'或C5'位置与试剂的其余部分连接。在一些实施例中,包括侧对侧连接的受体/供体对的标记部分通过供体或受体的C4'、C5'、C5或C6位置与试剂的其余部分连接。在一些实施例中,包括侧对头连接的受体/供体对的标记部分通过供体或受体的C4'、C5'、C5或C6位置与试剂的其余部分连接。在一些实施例中,包括侧对尾连接的受体/供体对的标记部分通过供体或受体的C4'、C5'、C5或C6位置与试剂的其余部分连接。
无论其朝向如何,O-保护的荧光素或N-保护的NH-罗丹明受体供体和N-保护的NH-罗丹明受体通常通过接头彼此连接。先前已经发现,将此类供体和受体染料通过在性质上是刚性的和/或相对较长(例如,长度的范围为大约12-20埃)的接头连接是有利的(如本文中所使用的,接头的“长度”是指如通过计算限定部分之间的最短连续路径的化学键的长度之和所测定的连接的部分之间的距离)。在不旨在不受任何操作理论束缚的情况下,据信趋于使供体和受体彼此紧密接近而不允许其生色团彼此接触的接头产生适当有效的能量转移。在这方面,接头的刚性和长度是耦合参数。通常,较短接头(例如,其长度为约5到12埃的接头)应包含较大的刚性度。较长接头(例如,其长度的范围为约15到30埃的接头)可以包含较小的刚性度或甚至无刚性。应避免短的非刚性(软的)接头。
刚性可以通过使用其关于其键的旋转角度受限的基团(例如,通过使用亚芳基或亚杂芳基部分和/或包括双和/或三键的亚烷基部分)来实现。在能量转移染料的上下文中可用于使罗丹明和荧光素染料彼此连接的多种接头在本领域中是已知的,并且例如在美国专利第5,800,996号中进行了描述,所述美国专利的公开内容通过引用并入本文中。可用于使本文中所描述的标记部分中的O-保护的荧光素或N-保护的NH-罗丹明供体与N保护的NH罗丹明受体连接的接头的具体实例包含(通过举例而非限制的方式)以下式的基团:
(L.1)-Z-(CH
(L.2)-Z-(CH
(L.3)-Z-(CH
(L.4)-Z-(CH
(L.5)-Z-[CH
其中每个Z彼此独立地表示如先前所描述的由连接基团F
在一些实施例中,连接供体和受体染料的接头是如美国专利第6,811,979号中所述描述的阴离子接头,所述美国专利的公开内容通过引用并入本文中(参见例如,第17栏第25行至第18栏第37行处的公开和图1-17)。适合的阴离子接头的具体的非限制性示例性实施例包含上述式(L.1)至(L.4)的接头,其中Ar基团中的一个或多个Ar基团被在例如在约pH7到约pH 9的范围内的pH下使用的条件下具有负电荷的一个或多个取代基取代。适合的取代基的具体的非限制性实例包含磷酸酯、硫酸酯、磺酸酯和羧酸酯基团。
在一些实施例中,连接供体和受体染料的接头是如美国专利第6,811,979号中所述描述的阴离子接头,所述美国专利的公开内容通过引用并入本文中(参见例如,第17栏第25行至第18栏第37行处的公开和图1-17)。适合的阴离子接头的具体的非限制性示例性实施例包含上述式(L.1)至(L.4)的接头,其中Ar基团中的一个或多个Ar基团被在例如在约pH7到约pH 9的范围内的pH下使用的条件下具有负电荷的一个或多个取代基取代。适合的取代基的具体的非限制性实例包含磷酸酯、硫酸酯、磺酸酯和羧酸酯基团。
在一些实施例中,标记部分属于式(VI):
A-Z
其中A表示N-保护的NH-罗丹明受体,D表示供体(例如,N-保护的NH-罗丹明或O-保护的荧光素供体),Z
其中在D.1-D.12中的每一个中:
R
或者可替代地,R
R
E
E
其中R
R
Y
前提是当E
在根据结构式(VI)的标记部分的一些具体实施例中,Y
-(CH
-(CH
-(CH
-(CH
-[CH
其中a、b、c、d、e、f和Ar如先前所定义的。
在根据结构式(VI)的标记部分的一些具体实施例中,R9选自-C(O)CH
4.5 PEP基团
本文中所描述的试剂的许多实施例包含PEP基团(“PEP”)。当在用于合成经标记的寡核苷酸的逐步合成中使用时,PEP基团与任何可用的羟基偶联,所述羟基可以是新生的合成寡核苷酸的5'羟基,从而最终在任何需要的氧化和/或脱保护步骤之后产生将标记部分与合成寡核苷酸连接的键。如本领域中已知的,形成的键可以是磷酸酯键或经修饰的磷酸酯键。
适于将试剂与伯羟基偶联以产生磷酸酯键或经修饰的磷酸酯键的各种不同的基团在本领域中是众所周知的。具体实例包含(通过举例而非限制的方式)氨基亚磷酸酯基团(参见例如,Letsinger等人,1969,《美国化学学会期刊(J.Am.Chem.Soc.)》91:3350-3355;Letsinger等人,1975《美国化学学会期刊》97:3278;Matteucci和Caruthers,1981,《美国化学学会期刊》103:3185;Beaucage和Caruthers,1981,《四面体通讯(Tetrahedron Lett.)》22:1859;所述文献的公开内容通过引用并入本文中)、2-氯苯基-或2,5-二氯苯基-磷酸基(参见例如,Sproat和Gait,“通过磷酸三酯方法固相合成寡核苷酸(Solid PhaseSynthesis of Oligonucleotides by the Phosphotriester Method)”,在以下文献中:《寡核苷酸合成:一种实用方法(Oligonucleotide Synthesis,A Practical Approach)》,Gait,编辑,1984,IRL出版社(IRL Press),第83-115页,所述文献的公开内容通过引用并入本文中)和H-膦酸酯基团(参见例如,Garegg等人,1985,《化学学报(Chem.Scr.)25:280-282;Garegg等人,1986,《四面体通讯(Tet.Lett.)》27:4051-4054;Garegg等人1986,《四面体通讯》27:4055-4058;Garegg等人,1986,《化学学报》26:59-62;Froehler和Matteucci,1986,《四面体通讯》27:469-472;Froehler等人,1986,《核酸研究》14:5399-5407,所述文献的公开内容通过引用并入本文中)。在具体实施例中,PEP基团是式(P.1)的氨基亚磷酸酯基团:
(P.1)
其中R
R
在具体实施例中,R
4.6合成柄
本文中所描述的试剂的许多实施例包含一个或多个合成柄,在适合的脱保护后,如果需要的话,所述一个或多个合成柄会提供可以用于将另外的基团或部分与合成的经标记的寡核苷酸连接的位点。所述基团可以在合成经标记的寡核苷酸的过程期间与合成柄连接,或者可替代地,所述合成柄可以在合成后脱保护以显示另外的基团或部分可以与其连接的官能团。例如,合成柄可以包括受对用于进行经标记的寡核苷酸的合成的条件稳定的保护基团保护的伯胺基。合成后与各种合成寡核苷酸上的其它保护基团的去除同时或分开地去除保护基团提供了另外的基团和/或部分可以与其连接的伯氨基。
受到适于在寡核苷酸合成中使用的保护基团保护的各种不同类型的反应性基团在本领域中是已知的,并且包含(通过举例而非限制的方式)氨基(受例如三氟乙酰基或4-单甲氧基三苯甲基保护)、羟基(受例如4,4'-二甲氧基三苯甲基保护)、硫醇基(受例如三苯甲基或烷基硫醇基保护)和醛基(受例如缩醛保护基团保护)。所有这些受保护的反应性基团可以包括本文中所描述的试剂的合成柄。
在一些实施例中,合成柄包括式-OR
4.7固体支持物
本文中所描述的试剂的许多实施例包括其它部分和/或基团与其连接的固体支持物。固体支持物通常用携带适于其它部分的连接的连接基团的接头与其连接的官能团(如氨基或羟基)活化。
可以用适于与多个部分和接头连接的官能团活化的各种材料以及活化所述材料以包含所述官能团的方法在本领域中是已知的,并且包含例如可控孔度玻璃、聚苯乙烯和移植共聚物。这些材料中的任何材料用作本文中所描述的试剂中的固体支持物。
4.8可用于末端羟基标记的合成试剂
本文中所描述的合成试剂的一些实施例通过结构式(VII)来描述:
LM-L-PEP (VII)
其中LM表示如本文中所描述的标记部分,L表示如本文中所描述的任选的接头,并且PEP表示如本文中所描述的PEP基团。试剂可以包含另外的基团或部分,如合成柄。在一些实施例中,合成试剂包括标记部分和PEP基团,并且不包含另外的部分或基团。此类合成试剂可以在寡核苷酸的逐步合成期间与羟基偶联,并且尤其用于将标记部分与合成寡核苷酸的末端羟基(其通常是5'羟)连接。
在一些实施例中,标记部分可以具有以下式:
其中R
PEP基团可以直接与标记部分连接,或者其可以借助接头与标记部分连接。由于PEP基团通常通过将适合的试剂与伯羟基偶联而与分子连接,因此在PEP基团直接与标记部分连接的实施例中,标记部分应包含包括伯羟基的取代基。在PEP基团借助接头与标记部分连接的实施例中,接头合成子应包含适于与标记部分合成子上的连接基团形成键的连接基团和适于与PEP基团连接的伯羟基。适合的接头合成子包含但不限于式F
在一些实施例中,合成试剂是根据结构式(VII)的化合物,其中:
LM是上文具体例示的标记部分的实施例之一;
L选自-Z-(CH
PEP是氨基亚磷酸酯基团,例如如上文所描述的结构式P.1的氨基亚磷酸酯基团。在一些具体实施例中,接头L中的Z是-NH-。
在一些实施例中,根据结构式(VII)的合成试剂中的接头包括核苷,使得合成试剂是核苷的。在一些实施例中,核苷合成试剂是根据结构式(VII.1)的化合物:
(VII.1)
其中PEP表示磷酸酯前体基团,B表示核碱基,LM表示标记部分,并且L2表示将核碱基B与接头LM连接的接头。下文更详细地描述了核碱基B和接头L的特征和特性。在图3中展示了根据结构式(VII.1)的非限制性示例性核苷合成试剂。
下文在方案(I)中提供了用于合成其中PEP基团通过任选的接头与标记部分连接的合成试剂的实施例的示例性方案,其中各个R、F
方案I
在方案(I)中,将包含包括官能团F
4.9可用于内部或3'端标记的合成试剂
本文中所描述的合成试剂可以任选地包含用于连接另外的基团和/或部分的一个或多个合成柄。包含式-OR
包括合成试剂的标记部分、PEP基团和合成柄-OR
R
其中每个L彼此独立地表示任选的接头,LM表示标记部分,并且PEP表示PEP基团。适合的保护基团R
作为另一个具体实例,PEP基团和合成柄-OR
其中L表示接头,LM表示标记部分,并且PEP表示PEP基团。
在具体实施例中,根据结构式(IX)的合成试剂是根据结构式(IX.1)的化合物:
其中LM表示标记部分,-Z-表示由接头上的官能F
在一些实施例中,合成柄-OR
核苷可以是可以受适当保护以在寡核苷酸的合成中使用的任何核苷,并且可以包括2'-脱氧核糖部分、3'-脱氧核糖部分(可用于合成包含2'-5'核苷酸间接头的经标记寡核苷酸)、适当保护的核糖部分、这些核糖部分中的任何核糖部分的取代形式或甚至是非核糖部分。
在一些实施例中,此类核苷合成试剂是根据结构式(IX.2)、(IX.3)、(IX.4)和(IX.5)的化合物:
其中LM表示标记部分,B表示适当保护的核碱基,L
在根据结构式(VII.1)、(IX.2)、(IX.3)、(IX.4)和(IX.5)的合成试剂中,核碱基B实际上可以是可用于掺入到寡核苷酸中的任何杂环。例如,核碱基可以是基因编码嘌呤(腺嘌呤或鸟嘌呤)之一、基因编码嘧啶(胞嘧啶、尿嘧啶或胸腺嘧啶)之一、基因编码嘌呤和/或嘧啶的类似物和/或衍生物(例如,7-脱氮腺嘌呤、7-脱氮鸟嘌呤、5-甲基胞嘧啶)、非基因编码嘌呤和/或嘧啶(例如,肌苷、呫吨和次黄嘌呤)或其它类型的杂环。可用于掺入到寡核苷酸中的各种各样的杂环在本领域中的已知的,并且在例如生物化学与分子生物学实用手册(Practical Handbook of Biochemistry and Molecular Biology),Fasman,编辑,1989,CRC出版社(CRC Press)(参见例如第385-393页和本文中所引用的参考文献)中进行了描述,所述文献的公开内容通过引用并入本文中。所有这些各种杂环以及以后发现的那些杂环都可以包含在本文中所描述的核苷合成试剂中。
当B是根据结构式(VII.1)、(IX.2)、(IX.3)、(IX.4)和(IX.5)的合成试剂中的嘌呤时,所展示的糖部分通常与嘌呤的N9位置连接,并且当B是嘧啶时,所展示的糖部分通常连接在嘧啶的NI位置处。对于本领域技术人员而言,其它核碱基的连接位点将是显而易见的。
核碱基上的任何环外胺或一个或多个其它反应性基团均受对用于合成经标记的寡核苷酸的合成条件稳定的保护基团保护。适于在寡核苷酸合成的上下文中保护核苷核碱基的环外胺基的各种基团以及制备此类经保护的核苷的方法在本领域中是众所周知的。
例如,已经用于保护腺嘌呤的环外胺的基团包含苯并基(Bz)、苯氧基乙酰基(Pac)和异丁酰基(iBu)。已经用于保护胞嘧啶的环外胺的基团包含乙酰基(Ac)和Bz。已经用于保护鸟嘌呤的环外胺的基团包含iBu、二甲基甲酰胺(Dmf)和4-异丙基-苯氧基乙酰基(iPr-Pac)。所有这些保护基团可以通过在55-65℃下用氢氧化铵处理2-3小时去除。然而,这些保护基团中的某些保护基团可以在较温和条件下去除。例如,将保护基团从A
将标记部分LM与核碱基B连接的接头L
在一些实施例中,可用于将LM与核碱基连接的接头L
在一些实施例中,可用于将LM与嘌吟核碱基连接的接头L
在一些实施例中,可用于将LM与嘌吟或嘧啶核碱基连接的接头L
例如,合成用适于掺入到本文中所描述的试剂中的接头(如上文所描述的那些接头)衍生的核苷的方法在例如以下文献中进行了描述:Hobbs等人,1989,《有机化学杂志(J.Org.Chem.)》54:3420;Hobbs等人的美国专利第5,151,507号;Khan等人的美国专利第5,948,648号;以及Khan等人的美国专利第5,821,356号,所述文献的公开内容通过引用并入本文中。衍生的核苷可以用作合成子来合成核苷合成试剂,如将在下文更详细地描述的。
下文展示了可以包括本文中所描述的核苷试剂的接头衍生的核碱基的具体示例性实施例:
可以从接头衍生的核苷合成子制备核苷合成试剂,如下文在方案(II)中所展示的:
方案II
在方案(II)中,接头衍生的核苷合成子110在5'羟基处受酸不稳定保护基团的保护,在方案中用示例性氯试剂R
4.10固体支持物试剂
本文中所描述的试剂的许多实施例包含固体支持物。此类试剂通常包括固体支持物、如本文中所描述的标记部分和合成柄,并且可以包含另外的基团或部分,如另外的标记部分、淬灭部分、合成柄和/或除其它外可用于稳定寡核苷酸双链体的基团,例如嵌入碱基对之间的药剂(嵌入药剂)和结合双链体小沟的药剂(小沟结合或MGB药剂)。固体支持物、标记部分、合成柄和任何任选的另外的部分可以以允许其执行其相应功能的任何方式或朝向彼此连接。
在一些实施例中,固体支持物通过接头与试剂的其余部分连接。将固体支持物与试剂的其余部分连接的接头通常包含可在特定条件下选择性切割的键,使得在合成后,合成的经标记的寡核苷酸可以从固体支持物释放。在一些实施例中,所述键对于用于使合成的经标记的寡核苷酸脱保护的条件是不稳定的,使得所述寡核苷酸在单个步骤中从固体支持物脱保护并切割。此类接头通常包含酯键,但是可以包含其它键,例如碳酸酯、二异丙基甲硅烷基氧基醚、经修改的磷酸酯等。
可用于寡核苷酸合成的上下文中的多种可选择性切割的接头以及用此类接头衍生固体支持物的方法在本领域中是已知的。所有这些各种接头都可以适用于本文中所描述的固体支持物试剂中。图6中展示了包括可在用于脱保护合成寡核苷酸的碱性条件下切割的示例性接头的固体支持物试剂的非限制性实例。
像合成试剂一样,固体支持物试剂本质上可以是非核苷的或核苷的。非核苷固体支持物试剂的示例性实施例包含根据结构式(X)的试剂:
其中LM表示标记部分,L表示任选的可选择性切割的接头,并且-OR
在一些实施例中,结构式(X)的固体支持物合成试剂是根据结构式(X.1)的非核苷试剂。
其中Z、LM、G、Sp
在一些实施例中,结构式(X)的固体支持物合成试剂是根据结构式(X.2)、(X.3)、(X.4)或(X.5)的非核苷试剂:
其中LM、R
4.11另外的示例性实施例
应当理解,贯穿本公开描述的各个部分、基团和接头的具体实施例可以包含在本文中所描述的所有试剂中。而且,各个具体实施例可以以任何组合彼此组合,就好像已经具体例示了具体组合。作为具体实例,本文中所描述的标记部分LM的具体实施例中的任何一个具体实施例可以包含在本文中所描述的非核苷和核苷固体支持物和合成试剂的具体例示的实施例中的任何具体例示的实施例中。作为另一个具体实例,PEP基团PEP的具体实施例中的任何一个具体实施例(如上述结构式(P.1)的氨基亚磷酸酯基团)可以包含在本文中所描述的合成试剂中的任何合成试剂中。
4.12试剂的用途
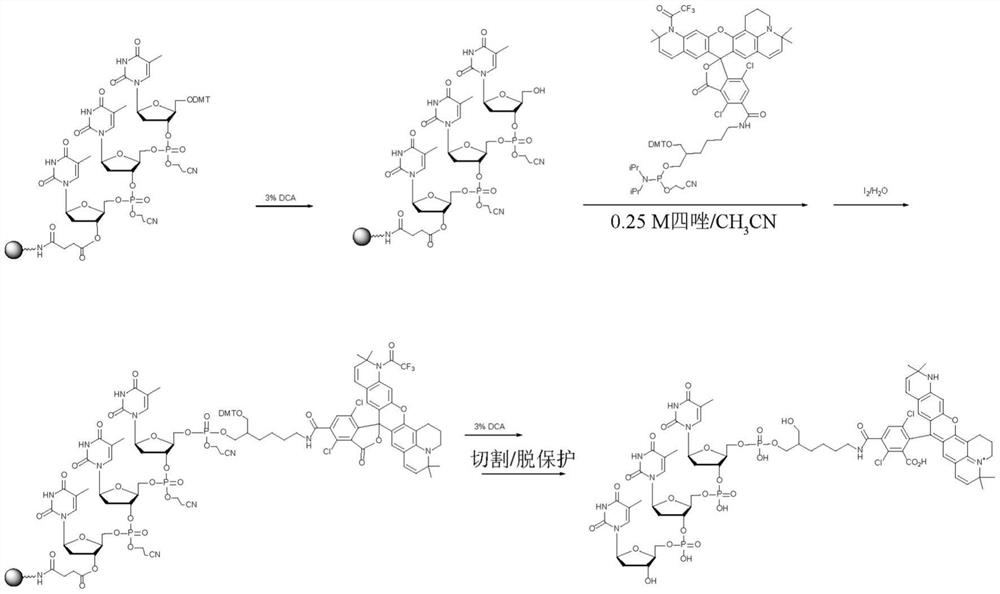
本文中所描述的各种试剂可以用于寡核苷酸的逐步合成中,以直接在合成树脂上合成用罗丹明染料标记的寡核苷酸。因此,各种试剂使得用无数不同的罗丹明对寡核苷酸进行合成标记的能力可用,从而避免了费力的合成后修饰的需要。在图8A中展示了使用示例性合成试剂来合成用NH罗丹明染料标记的寡核苷酸。
如本领域技术人员将理解的,由于可以充当NH-罗丹明染料的供体、受体或甚至淬灭剂的氨基亚磷酸酯试剂的可用性,本文中所描述的试剂允许合成用能量转移染料和/或原位合成的NH-罗丹明-淬灭剂染料对标记的寡核苷酸的能力。在图8B和9中展示了用NH-罗丹明-荧光素能量转移染料对标记的寡核苷酸的示例性合成,其展示了由本文中所描述的试剂提供的多功能性。因为本文中所描述的试剂实际上允许将任何NH-罗丹明染料包含在固体支持物和/或合成试剂中,因此可以方便地在不需要合成后修改的情况下原位合成用具有针对指定应用调整的光谱特性的能量转移染料对标记的寡核苷酸。而且,可以从单独的单体试剂合成用多种不同的能量转移染料对组合标记的寡核苷酸,从而避免制备含有指定染料对的合成试剂的需要。可以在添加或不添加插入连接部分的情况下以逐步方式使染料对的每个成员与新生寡核苷酸连接。
参考图8A,用酸处理支持物结合的合成寡核苷酸以去除保护其5'羟基的DMT基团,从而产生5'脱保护的支持物结合的寡核苷酸。将N-保护的NH-罗丹明氨基亚磷酸酯试剂偶联,然后进行氧化,从而产生呈内酯开放形式的支持物结合的NH-罗丹明标记的寡核苷酸。用浓缩的氢氧化铵进行处理以去除任何保护基团并从固体支持物(树脂)切割合成的寡核苷酸,从而产生用NH-罗丹明染料标记的寡核苷酸。
参考图8B,新生的支持物结合的寡核苷酸可以用通过将N-保护的NH-罗丹明氨基亚磷酸酯合成试剂与寡核苷酸的5'羟基偶联而原位合成的NH-罗丹明-荧光素染料对进行标记,在氧化后,产生NH-罗丹明标记的寡核苷酸。去除DMT基团,然后与O-保护的氨基亚磷酸酯(在所展示的具体实例中为FAM-氨基亚磷酸酯)偶联,从而产生经标记的、支持物结合的寡核苷酸。切割和脱保护产生用NH-罗丹明-FAM能量转移染料对标记的寡核苷酸。
参考图9,固体支持物试剂(其包含受保护的NH-罗丹明-荧光素能量转移染料对作为标记部分)可以经历三个合成循环以产生经标记的支持物结合的寡核苷酸。从固体支持物进行切割产生脱保护的经标记的寡核苷酸。
也可以通过使用氨基亚磷酸酯接头试剂来操纵连接供体染料和受体染料的键的长度和特征。与FAM-氨基亚磷酸酯偶联,然后进行氧化、脱保护和切割,从而产生用NH-罗丹明-FAM能量转移染料对标记的寡核苷酸。在接头氨基亚磷酸酯中,“Sp”是如先前所定义的间隔子。例如,“Sp”可以表示如先前所定义的(Sp
连接NH-罗丹明和FAM染料的接头的长度和特性可以通过在与FAM-氨基亚磷酸酯偶联之前偶联另外的接头氨基亚磷酸酯来调整。接头氨基亚磷酸酯可以相同,或者其可以不同。以这种方式,可以容易地原位合成用其中供体和受体染料以及连接供体和受体的接头被定制成用于特定目的的能量转移染料对标记的寡核苷酸。
技术人员将理解,可以使用充当FAM的受体的任何N保护的NH-罗丹明试剂。此外,可以使用其它O-保护的荧光素以及其它类型的氨基亚磷酸酯染料。因为染料是作为单体添加的,所以可用的能量转移染料标记的数量大于合成其所必需的氨基亚磷酸酯试剂的数量。例如,可以从3种不同的N-保护的NH-罗丹明氨基亚磷酸酯试剂(试剂A、B和C)和3种不同的O-保护的荧光素氨基亚磷酸酯试剂(试剂1、2和3)合成用9种不同的能量转移染料对标记的寡核苷酸:oligo-A1、oligo-A2、oligo-A3、oligo-B1、oligo-B2、oligo-B3、oligo-C1、oligo-C2和oligo-C3。
目前对细胞和组织功能的分析通常需要从通常有限的材料中提取尽可能多的信息。例如,像肿瘤活检这样的样品很难收集,通常只能产生少量可用的核酸。单个靶分析物的PCR检测和测量(称为单重测定)一直是在核酸水平上分析临床研究样品的黄金标准,并且在超过二十五年的时间里,在扩展生物学知识的范围方面发挥了不可估量的作用。
然而,从临床研究样本中获得的有限数量的核酸常常迫使人们选择如何最好地利用这些珍贵的样品。此外,如果样品有限,可以分析的基因座数量也有限,从而减少了可以从样品中提取的信息的量。最后,建立多个单一测定反应所需的另外的时间和材料可能会显著增加复杂项目的费用。
核酸的多重PCR分析是这些问题的一个有吸引力的解决方案,这是一种从单个样品等分试样中扩增和定量多个靶标的策略。在多重PCR中,在单个PCR中用含有荧光染料的多个探针对样品等分试样进行查询。这增加了可以从所述样品中提取的信息的量。通过多重PCR,可以显著节省样品和材料。为了提高该方法的实用性,已经开发了使用几对基因特异性引物和探针来同时扩增和测量多个靶序列的多重PCR。多重PCR具有以下优点:1)效率:多重PCR通过将几个PCR测定结合到一个反应中,有助于保存样品材料并避免孔与孔之间的差异。多重可以更有效地利用有限的样品,如带有在不影响灵敏度的前提下无法拆分成多个等分试样的稀有靶标的样品;2)经济性:即使靶标被一致地扩增,通过使用具有独特报告基因染料的基因特异性探针来独立地检测每个靶标,以基于它们的荧光信号来区分扩增。优化后,多重测定比独立扩增的相同测定更具成本效益。
然而,目前在单一多重PCR测定中,可分析的靶标的数量有限。PCR反应的实验设计比单一反应更复杂。用于检测单个靶标的探针必须含有具有不同光谱的独特报告基因染料。实时检测系统的激发和发射过滤器的设置因制造商而异;因此,作为实验优化过程的一部分,必须为每种染料校准仪器。因此,多重PCR测定发展的一个限制是荧光团的数量,因此探针可以在单个反应中有效测量。例如,在多重PCR中,不同荧光报告基因之间的信号串扰会影响定量或导致假阳性。因此,选择光谱重叠最小的荧光团至关重要。此外,荧光团,特别是它们的发射和激发光谱,还必须与所用的PCR仪器兼容,特别是每个滤光片组的带通规格。
在另外的方面,提供了使用所描述的探针进行单重或多重PCR(如qPCR或终点PCR)的方法。终点PCR是所有PCR循环完成后的分析。与允许在模板加倍时进行定量(指数阶段)的qPCR不同,终点分析基于扩增的平稳阶段。
特别地,一种用于扩增和检测多种靶DNA序列的方法包括:提供包括所述探针的组合物或反应混合物;使反应混合物经受热柱化方案,使得所述多种靶序列的扩增可以发生;以及通过在多个扩增循环中至少一次检测所述探针的荧光来监测扩增。
所述方法的一种或多种核酸靶标可以是技术人员已知的任何核酸靶标。此外,所述靶标可以是低突变区域或高突变区域。例如,本文公开的方法的一个特别有价值的用途涉及靶向高度突变的核酸(如RNA病毒基因)或高度遗传变异的区域(如单核苷酸多态性(SNP))。在一些实施例中,所述靶标可以是片段化的或降解的,例如来自法医样品和/或固定组织的材料。所述靶标可以为任何适合放大的尺寸。本文提供的方法和组合物的一个特别有价值的用途涉及鉴定短片段(如siRNA和miRNA)。另一个特别有价值的用途是用于可能具有片段化和/或降解的核酸的样品,如固定样品或暴露于环境中的样品。因此,所述方法可以用于例如活组织检查组织和法医DNA。所述靶标可以是经过纯化的或未经纯化的。所述靶标可以在体外产生(例如,cDNA靶标),或者可以在生物样品中发现(例如,RNA或基因组DNA(gDNA)靶标)。生物样品可以不经处理而使用,或者可以对生物样品进行处理以去除可能干扰本文公开的方法的物质。
本文提供的探针可用于诊断方法(例如,SNP检测、特定生物标志物的鉴定等),由此所述探针与传染性疾病因子(例如人类疾病,包含但不限于病毒、细菌、寄生虫和真菌)的序列(例如基因组)互补,从而诊断来自患者的具有核酸的样品中传染性因子的存在。靶核酸可以是基因组或cDNA或mRNA或合成的,人或动物的,或微生物的,等等。在其它实施例中,探针可用于诊断或预测不是由感染因子引起的疾病或病症。例如,探针可用于通过鉴定人或动物样品中突变、多态性或等位基因的存在来诊断或预测癌症、自身免疫疾病、精神疾病、遗传疾病等。在一些实施例中,所述探针包括突变或多态性。此外,所述探针可用于评估或跟踪疾病或病症的治疗进展。
受益于多重分析的另一个领域是在人类鉴定的领域中使用基因标志物。基因标志物通常是具有用于进行分析(如DNA分型,其中基于个体的DNA的变异区分所述个体)的所关注特性的基因组DNA的等位基因。大多数DNA分型方法被设计成用于检测并分析已知以至少两种不同形式或等位基因出现在群体中的DNA标志物的一个或多个区域的长度和/或序列的差异。此种变异被称为“多态性”,并且发生此种变异的DNA的任何区域被称为“多态性基因座”。进行DNA分型的一种可能的方法涉及将PCR扩增技术(KB Mullis,美国专利第4,683,202号)与对长度变异多态性的分析结合。短串联重复序列(STR)、小卫星和数量可变串联重复序列(VNTR)是长度变异多态性的一些实例。含有大约三到七个核苷酸的重复单元的STR足够短足以用作PCR应用中的基因标志物,因为扩增方案可以被设计成产生比可能来自DNA的其它可变长度区域的产物小的产物。
已经描述了含有多个STR基因座的几种此类系统。参见例如,
本发明教导的方法设想选择适当的一组基因座、引物和扩增方案以从多个共扩增的基因座产生经扩增的等位基因(扩增子),所述扩增子可以被设计成在大小上不重叠和/或可以以使得能够区分来自大小上不重叠的不同基因座的等位基因的方式来进行标记。另外,这些方法设想选择可在单个扩增方案中兼容使用的多个STR基因座。
除本文中所公开的那些组合之外,还可以通过例如基因座组合的反复试验、通过选择引物对序列以及通过调整引物浓度以鉴定其中所有用于进行分析的基因座可以扩增的平衡来产生成功的组合。一旦公开了这些教导的方法和材料,就可以向本领域的技术人员建议选择供这些教导的方法和试剂盒中使用的基因座、引物对和扩增技术的各种方法。所有此类方法旨在落入所附权利要求的范围内。
可以使用多种不同技术中的任何技术来选择根据本发明教导使用的一组基因座。无论哪些方法可以用于选择通过本教导的方法分析的基因座,在各个实施例中,被选择用于进行多重分析的基因座共享以下特性中的一个或多个特性:(1)其产生足够的扩增产物以允许对DNA进行等位基因评价;(2)其由于另外的碱基在有效的靶基因座的延伸或非特异性扩增子的产生期间掺入而在多重扩增步骤期间产生很少(如果有的话)伪影;并且(3)其由于通过聚合酶进行的扩增反应的提前终止而产生很少(如果有的话)伪影。参见例如,JWSchumm等人(1993),第四届国际人类鉴定座谈会(FOURTH INTERNATIONAL SYMPOSIUM ONHUMAN lDENTIFICATION),第177-187页,普洛麦格公司(Promega Corp.)。
一般来说,寡核苷酸引物可以化学合成。引物设计和选择是PCR优化中的常规程序。本领域普通技术人员可以容易地设计用于扩增所关注的靶基因座的特异性引物,或从本文中所列出的参考文献中获得引物组。所有这些引物均在本发明教导的范围内。
作为实例,可以通过使用本领域中可用且已知用于开发扩增和/或多重系统的各种软件程序中的任何软件程序来选择引物。参看例如Primer
可以使用与DNA的后续扩增相容的样品制备的任何程序制备基因组DNA样品用于本发明传授内容的方法中。本领域的技术人员已知多种所述程序。一些实例是通过酚提取进行DNA纯化(J.Sambrook et al.(1989),在以下文献中分子克隆:实验室手册(MOLECULARCLONING:ALABORATORY MANUAL),第二版,冷泉港实验室出版社(Cold Spring HarborLaboratory Press),纽约冷泉港(Cold Spring Harbor,N.Y.),第9.14-9.19页)和通过盐沉淀进行部分纯化(S.Miller等人(1988),《核酸研究》16:1215)或chelex(PS Walsh等人(1991),《生物技术(BIOTECHNIQUES)》10:506-513;CT Corney等人(I 994),《法医研究杂志(J.FORENSIC Ser.)》39:1254)和使用未经处理的血液释放未经纯化的物质(J.Burckhardt(1994),PCR方法和应用(PCRMETHODS AND APPLICATIONS)3:239-243;RBE McCabe(1991),PCR方法和应用1:99-106;BY Nordvag(1992),《生物技术》12:4第490-492页)。
当使用本教导的方法分析的至少一种DNA样品是人类基因组DNA时,所述DNA可以由组织样品(例如以下中的一个或多个:血液、精液、阴道细胞、毛发、唾液、尿液、骨骼、颊样品、含有胎盘细胞或胎儿细胞的羊水、绒毛膜绒毛和/或这些或其它组织中任何组织的混合物)制备。
含有血液的样品或颊样品也可以直接由
在制备出基因组DNA样品之后,可以在本发明传授内容的多重扩增步骤中共扩增目标基因座。可以使用多种不同扩增方法中的任何扩增方法来扩增基因座,例如PCR(RKSaiki等人(1985),《科学(SCIENCE)》230:1350-1354)、基于转录的扩增(DY Kwoh和TJKwoh(1990),《美国生物技术实验室(AMERICAN BIOTECHNOLOGY LABORATORY),1990年10月)以及链置换扩增(SDA)(GT Walker等人(1992),《美国国家科学院院刊》89:392-396)。在本发明传授内容的一些实施例中,可以通过PCR实现多重扩增,其中使用对多重扩增中的每个基因座具有特异性的引物对,使DNA样品经历扩增。标准PCR的化学组分通常包括溶剂、DNA聚合酶、脱氧核苷三磷酸(“dNTP”)、寡核苷酸引物、二价金属离子以及预计含有PCR扩增的一个或多个靶标的DNA样品。水通常可以用作PCR的溶剂,通常包括缓冲剂和非缓冲盐,如KCL。缓冲剂可以是本领域中已知的任何缓冲液,如但不限于Tris-HCl,并且可以随着常规实验变化以优化PCR结果。本领域的普通技术人员能够容易地确定最佳缓冲条件。PCR缓冲液可以取决于用于扩增的特定酶进行优化。
在PCR中将核苷酸三磷酸聚合成扩增产物的酶可以是任何DNA聚合酶。DNA聚合酶可以是例如本领域中已知的任何抗热聚合酶。可以在本教导中使用的一些聚合酶的实例是来自如水生栖热菌(Thermus aquaticus)、嗜热栖热菌(Thermus thermophilus)、海滨热球菌(Thermococcus litoralis)、嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)、玛氏热袍菌(Thermotoga maritima)和火球菌(Pyrococcus sp)之类的生物体的DNA聚合酶。酶可以通过几种可能的方法中的任何方法获得;例如,从源细菌中分离、通过重组DNA技术产生或购自商业来源。可商购获得的DNA聚合酶的一些实例包含AmpliTaq
在多重反应中使用引物的荧光标记的情况下,通常可以使用至少三种不同的标记来对不同的引物进行标记。当使用大小标志物评价多重反应的产物时,用于制备大小标志物的引物可以用与扩增反应中的所关注基因座的引物不同的标记来标记。随着自动荧光成像和分析的出现,可以实现对多重扩增产物的更快的检测和分析。
在本发明教导的一些实施例中,可以使用荧光团来标记多重扩增的至少一个引物,例如通过与引物共价结合,由此产生经荧光标记的引物。在一些实施例中,多重分析中用于不同目标基因座的引物可以用不同荧光团标记,取决于荧光团的发射波长,每个荧光团产生带不同颜色的产物。这些不同标记的引物可以用于同一多重反应中,并且接着一起分析其各别扩增产物。可以对扩增特异性基因座的引物对的正向或反向引物进行标记,但是更多时候可以对正向引物进行标记。
PCR产物可以在筛分或非筛分培养基上分析。在这些教导的一些实施例中,例如,PCR产物可以通过电泳来分析;例如毛细管电泳,如以下文献中所描述的:H.Wenz et al.(1998),《基因组研究(GENOME REs.)》8:69-80(也参见E.Buel等人(1998),《法医科学杂志(J.FORENSIC SCI.)》43:(1),第164-170页);或平板凝胶电泳,如以下文献中所描述的:M.Christensen等人(1999),《斯堪的纳维亚临床和实验室研究杂志(SCAND.J.CLIN.LAB.INVEST.)》59(3):167-177;或变性聚丙烯酰胺凝胶电泳(参见例如,J.Sambrook et al.(1989),在以下文献中:《分子克隆:实验室手册》,第二版,冷泉港实验室出版社,纽约冷泉港,第13.45-13.57页)。电泳中DNA片段的分离主要基于不同的片段尺寸。扩增产物也可以通过色谱法分析;例如通过尺寸排阻色谱法(SEC)。
一旦经扩增的等位基因分离,就可以可视化和分析这些等位基因和例如凝胶或毛细管中的任何其它DNA(例如,DNA大小标志物或等位基因分型标准物)。通常,用于检测多重基因座的方法可以是通过荧光。参见例如,JW Schumm等人,第八届国际人类鉴定座谈会论文集(PROCEEDINGS FROM THE EIGHTH INTERNATIONAL SYMPOSIUM ON HUMANIDENTIFICATION),由普洛麦格公司于1998年出版,第78-84页;E.Buel等人(1998),同上。在使用经荧光标记的引物检测多重反应中的每个基因座的情况下,可以在扩增之后使用荧光检测器检测经标记的产物。
可以通过与电泳中的大小标准(例如,已知大小的DNA标志物)进行比较来测定DNA样品中的每个基因座处存在的等位基因的大小。用于评价含有两个或更多个多态性STR基因座的多重扩增的标志物还可以包括基因座特异性等位基因分型标准物或针对所评价的基因座的每个基因座的等位基因分型标准物的组合。参见例如,C.Puers等人(1993),《美国人类遗传学期刊(AM.J.HUM.GENET.)》53:953-958;C.Puers等人(1994),《基因组学(GENOMICS)》23:260-264。还参见以下美国专利中对适用于检测STR基因座的一些等位基因分型标准物以及其中公开的分型标准物构建的一些方法的描述:第5,599,666号;第5,674,686号;和第5,783,406号。在单独的基因座的等位基因分型标准物的构建之后,所述分型标准物可以与扩增产物同时进行电泳。每个等位基因分型标准物与来自对应的基因座的等位基因共迁移。
本发明教导的多重反应的产物也可以使用内部泳道标准进行评价;即,被配置成例如在与扩增产物相同的毛细管中进行电泳的专门类型的大小标志物。内部泳道标准可以包括一系列长度已知的片段。内部泳道标准也可以用可在扩增反应中与其它染料区分的荧光染料进行标记。泳道标准可以与经扩增的样品或大小标准/等位基因分型标准物混合,并用任一个进行电泳,以便比较在凝胶电泳的不同泳道或毛细管电泳的不同毛细管中的迁移。内部泳道标准的迁移的变化可以用于指示分离培养基的性能的变异。定量这种差异以及与等位基因分型标准物的相关性可以提供在不同泳道或毛细管中电泳的扩增产物的校准以及未知样品中的等位基因的大小测定的校正。
在使用荧光染料对扩增产物进行标记的情况下,可以使用以下荧光检测设备分析电泳和分离的产物:例如ABI
本发明教导还涉及使用上文所描述的过程的试剂盒。在一些实施例中,基础试剂盒可以包括具有一种或多种基因座特异性引物的容器。试剂盒还可以任选地包括使用说明书。试剂盒可以包括其它任选的试剂盒组分,例如以下中的一个或多个:针对指定基因座中的每个指定基因座的等位基因分型标准物、足够数量的用于扩增的酶、用于促进扩增的扩增缓冲液、用于促进酶活性的二价阳离子溶液、用于扩增期间的链延伸的dNTP、用于制备电泳用扩增材料的加载溶液、作为模板对照的基因组DNA、用于确保材料如预期般在分离培养基中迁移的大小标志物以及用于培训用户并且限制使用错误的方案和手册。试剂盒中的各种试剂的量也可以取决于多种因素改变,例如最佳方法灵敏度。提供与自动检测器或分析器一起使用的用于手动应用的试剂盒或测试试剂盒属于这些教示内容的范围内。
在临床环境中,可以使用STR标志物来例如监测骨髓移植中的供体移植的程度。在医院中,这些标志物还可用于样本匹配和跟踪。这些标志物还进入了其它科学领域,如关于人类种族和民族差异的人口生物学研究(DB Goldstein等人(1995),《美国国家科学院院刊》92:6723-6727)、动植物分类群的进化和物种分化以及变异(MW Bruford等人(1993),《现代生物学(CURR.BIOL.)》3:939-943)。
迷你STR(少于大约200个碱基对的基因座)的扩增允许对高度降解的DNA进行谱分析,如MD Coble(2005),《法医科学杂志》50(1):43-53中所证实的,所述文献通过引用并入本文中。表1(参见2010年11月15日提交的美国专利申请第61/413,946号和2011年8月22日提交的专利申请第61/526,195号中的表1)也提供了被视为迷你STR基因座的基因座,这取决于在引物扩增组中用于扩增STR标志物的引物的定位。
可以在本发明教导的方法中使用之前,使用本领域技术人员已知的任何标准DNA定量方法来测量DNA浓度。此类定量方法包含例如分光光度测量,如通过J.Sambrook等人(1989),同上,附录E.5所描述的;或使用测量技术的荧光法,如通过C F Brunk等人(1979),《分析生物化学(ANAL.BIOCHEM.)》92:497-500所描述的测量技术。可以通过比较以下来测量DNA浓度:DNA标准与人特异性探针(如通过J S Waye等人(1991),《法医科学杂志》36:1198-1203(1991)所描述的人特异性探针)的杂交量。在扩增反应中使用过多的模板DNA可能会产生扩增伪影,这并不表示真正的等位基因。
在多重反应中使用引物的荧光标记的情况下,通常使用至少三种不同的标记、至少四种不同的标记、至少五种不同的标记、至少六种不同的标记。例如,现有的商业测定使用6种独特的染料标记(赛默飞世尔科技公司(Thermo Fisher Scientific)的VeriFiler
以下是本领域中众所周知的并且适于与本发明教导中所描述的化合物组合使用以提供使用多个荧光标记的测定的可能的荧光团的一些实例。清单打算是例示性的并且决不是详尽的。一些可能的荧光团包含:荧光素(FL),其在492nm处最大地吸收并且在520nm处最大地发射;N,N,N',N'-四甲基-6-羧基罗丹明(TAMRA
表3:可商购获得染料
本文中所描述的非对称罗丹明化合物可以与一种或多种另外的荧光标记组合用于多重测定中。本发明教导的各个实施例可以包括包括至少八种不同染料的单一多重反应。所述至少八种染料可以包括上文列出的染料中的任何八种染料。在某些实施例中,一组八种染料包含如本文中所描述的非对称罗丹明化合物以及如PCT/US2019/67925中所描述的另外的非对称罗丹明化合物。在其它实施例中,可以使用包括至少十种或至少十二种不同染料或这些范围内的任何数量的染料的单一多重反应。
还提供了包括所述探针的组合物,如反应混合物或主混合物。在一个实施例中的组合物(如用于实时或定量PCR、终点PCR或PCR的组合物)包括至少一种所述探针。在一个实施例中,用于PCR(例如,qPCR、终点PCR)的组合物或反应混合物或主混合物包括允许检测4个靶核酸的探针和允许检测第5和/或第6个靶核酸中至少一个的所述一个或多个探针,所述探针中的每一个由FRET供体部分(即荧光团)和FRET受体部分(即淬灭剂)组成,其中荧光团具有介于约650与720nm之间的最大发射。本文所述淬灭剂的最大吸光度在660-668nm之间。本文所述淬灭剂的吸光度范围为530-730nm。在替代实施例中,提供了用于将所述荧光团和淬灭剂与所选的寡核苷酸缀合的标记试剂。
此外,这种组合物或反应混合物或主混合物可以包括一种或多种选自以下列表的化合物和试剂:适用于聚合酶链反应的缓冲液、脱氧核苷三磷酸(dNTP)、具有5’至3’核酸外切酶活性的DNA聚合酶、至少一对或几对扩增引物和/或另外的探针。
在一些实施例中,所提供的方法进一步包括使用扩增产物测定靶多核苷酸的基因型。在一些实施例中,所提供的方法进一步包括使用扩增产物测定靶多核苷酸的拷贝数。
本文中所引用的参考著作、专利、专利申请、科学文献和其它印刷出版物以及基因库数据库序列的登录号和特别地PCT/US2019/67925均以全文引用的方式特此并入。
如本领域技术人员将理解的,在不脱离本发明教导的精神的情况下,可以对这些教导的各个实施例进行多种改变和修改。所有此类变化旨在落入这些教导的范围内。
除非另外说明,否则通常根据本领域熟知的常规方法以及如在本说明书通篇引用和讨论的各个一般和更具体的参考文献中所描述的方法进行本发明实施例的方法和技术。参见例如,Loudon,《有机化学(Organic Chemistry)》,第四版,纽约:牛津大学出版社(Oxford University Press),2002,第360-361页,第1084-1085页;Smith和March,《玛奇高等有机化学:反应、机理和结构(March's Advanced Organic Chemistry:Reactions,Mechanisms,and Structure)》,第五版,威利国际科学出版公司(Wiley-Interscience),2001。
本文中所描述的化合物的化学命名法通常是使用克商购获得的ACD/名称2014(ACD/Labs)或ChemBioDraw Ultra 13.0(Perkin Elmer)得出的。
应理解,为清楚起见,在单独的实施例的上下文中描述的本公开的某些特征也可以在单个实施例中组合提供。相反,为简洁起见,在单个实施例的上下文中描述的本公开的各种特征也可以单独提供或以任何适合的子组合的方式提供。与由变量表示的化学基团有关的实施例的所有组合被本公开具体地涵盖并且公开于本文中,正如每个组合单独且明确地公开一样,在某种程度上,此类组合涵盖作为稳定化合物的化合物(即,可以被分离、表征和测试生物活性的化合物)。另外,描述此类变量的实施例中列出的化学基团的所有子组合也被本公开具体地涵盖并且公开于本文中,正如化学基团的每个这种子组合单独且明确地公开于本文中。
化学合成
现在将参考用于下文中其一般制备的说明性合成方案和以下具体实例来描述可用于本说明书的方法的示例性化学实体。技术人员将认识到,为了获得本文的各种化合物,起始材料可以被适当地选择为使得将在有或没有适当保护的情况下通过反应方案携带最终期望的取代基以产生期望产物。可替代地,可能需要或期望采用适合的基团代替最终期望的取代基,所述适合的基团可以通过反应方案被携带并且适当地被期望的取代基替代。此外,本领域技术人员将认识到,以下方案中所示的转化可以以与特定侧基的官能度相容的任何顺序执行。
所有一般化学品均购自商业化学公司,如飞世尔科技公司(Fisher Scientific)、阿克洛斯公司(Acros)或阿法埃莎公司(Alfa Aesar)。飞世尔科技公司的硅胶(220-400目)用于正相快速色谱法。使用来自JT Baker的十八烷基官能化硅胶进行反相色谱法。所有色谱法溶剂梯度均是逐步的。在来自EM Science的铝背衬硅胶载玻片上进行薄层色谱法(TLC)。在来自安莱尔科技公司(Analtech)的HPTLC RP18F Uniplate板上进行反相TLC。用长波长和短波长UV辐照两者可视化显影的斑点。
在相对于溶剂峰进行参考的Varian 400MHz NMR上测定NMR光谱。在具有二极管阵列检测器和多通道波长的安捷伦(Agilent)1200HPLC上进行HPLC。通过安捷伦Pursuit C8150×4.6mm 5μ柱用一定梯度的乙腈和0.1M的醋酸三乙铵(TEAA)以1毫升/分钟运行典型的洗脱。使用与PE Sciex API 150EX质谱仪耦接的安捷伦1200LC系统获得LCMS数据。通过在API Sciex 4000质谱仪上进行直接输注获得MS数据。
用烘箱干燥的注射器在氮气气氛下操纵无水溶剂。如本文中所使用的,术语“水处理”是指包括以下步骤的纯化方法:在规定的有机溶剂中溶解或稀释反应混合物,用规定的水溶液或水洗涤,用饱和NaCl洗涤合并有机层一次,用无水Na
实例1:非对称罗丹明染料的制备。
步骤1:10-甲氧基-5,5,7-三甲基-2,3-二氢-1H,5H-吡啶并[3,2,1-ij]喹啉(2)的制备
将7-甲氧基-2,2,4-三甲基-1,2-二氢喹啉(1)(8.00g,39.4mmol,A.Rosowsky、E.J.Modest,JOC,1965,30,1832.)在乙腈(125ml)中溶解,并与1-溴-3-氯丙烷(24.8g,157mmol)、碘化钠(47.2g,315mmol)和碳酸钠(8.35g,78.8mmol)混合。将混合物回流23小时。将混合物过滤,将滤液浓缩,用水在DCM中洗涤,并进行激发。通过硅胶快速色谱法使用20%DCM/己烷洗脱来对粗制残余物进行纯化,以得到呈米白色固体的2(8.28g,86%)。
步骤2:5,5,7-三甲基-2,3-二氢-1H,5H-吡啶并[3,2,1-ij]喹啉-10-醇(3)的制备
将化合物2(8.28g,34.0mmol)用氢溴酸(50ml)回流1小时。将溶液用碳酸氢钠分批中和。将混合物萃取到EtOAc中,将EtOAc层用水洗涤并激发,以产生呈淡橙色固体的3(7.49g,98%)。
步骤3:2,2,4-三甲基-1,2-二氢喹啉-7-醇(4)的制备
将7-甲氧基-2,2,4-三甲基-1,2-二氢喹啉(1)(10.00g,49.2mmol)用氢溴酸(50ml)回流6小时。将混合物冷却至室温,并且然后在冰浴中冷却。通过抽滤收集所产生的固体,并用冰水洗涤。然后将固体与50%EtOAc/水混合,并用碳酸氢钠中和。将有机层保留,将水层用EtOAc萃取2次,将EtOAc层合并,并进行激发。通过DCM/己烷沉淀、然后通过硅胶快速色谱法使用10%-20%EtOAc/己烷洗脱来对所产生的固体进行纯化,以得到呈浅白色/淡黄色固体的4(Koelmel,Dominik K.等人,《有机和生物分子化学(Organic&BiomolecularChemistry)》,2013,11(24),3954-3962)(7.45g,80%)。
步骤4:3,6-二氯-2-(7-羟基-2,2,4-三甲基-1,2-二氢喹啉-6-羰基)-4-(异丙氧基羰基)苯甲酸(6和7)的制备
将2,2,4-三甲基-1,2-二氢喹啉-7-醇(4)(9.37g,49.5mmol)和3,6-二氯偏苯三甲酸异丙酯(5)(18.01,59.4mmol;5是根据WO 2002/30944中所描述的方法制备的,所述文献通过引用并入本文中以用于制备5)在甲苯(95ml)混合,并回流3.5小时。冷却后,将甲苯去除,并通过通过硅胶快速色谱法使用5%-10%MeOH/DCM洗脱来对所产生的固体进行半纯化。然后,通过硅胶快速色谱法使用2%TEA/35%EtOAc/己烷、然后使用100%EtOAc、然后使用10%-15%MeOH/DCM洗脱来对所产生的固体进行进一步的纯化。然后,将所产生的固体在DCM中溶解,并用1N HCl洗涤两次,并进行激发,以得到呈黄绿色固体的6/7(18.45g,71%)。
步骤4:非对称罗丹明染料8的制备
将化合物6和7(19.79g,37.42mmol)在氯仿(400ml)中溶解,并在室温下与三氯氧磷(10.5ml,112mmol)混合10分钟。将化合物3(8.58g,37.4mmol)在氯仿(200ml)中溶解,并添加到化合物6/7/三氯氧磷溶液。深水绿色立即形成。然后,将溶液回流3.5小时,以得到深蓝色。将溶液浓缩,并且然后在剧烈搅拌下将深蓝黑色固体用氢溴酸(570ml)回流1小时。将热溶液倒在冰上,以得到通过离心和过滤收集并用水洗涤的细蓝色固体。将固体与大量2M醋酸三乙铵(TEAA)混合,过滤以去除细小不可溶物,并通过上样到大型反相色谱柱上并使用50mM TEAA、然后使用60%-65%-70%MeOH/50mM TEAA洗脱来分离异构体。合并之前,通过HPLC对级分进行分析。将染料8的汇集(通过HPLC和RP-TLC得到的第二洗脱染料)用等量的水稀释,并在C18凝胶垫上脱盐,以在浓缩和干燥后得到呈TEA盐的深蓝色固体的染料8(8.79g,32%)。
步骤5:非对称罗丹明染料9的制备
将染料8(5.25g,7.05mmol)在无水DCM(300ml)中溶解,并与TEA(13.8ml,98.7mmol)混合,放置在氮气下,并在冰浴中冷却。逐滴添加三氟乙酸酐(6.86ml,49.3mmol),并将溶液搅拌0.5小时。现在,将无色溶液浓缩,在DCM中重新溶解,并用碳酸氢钠、1NHCl洗涤,并进行激发,以得到化合物9。
实例2:罗丹明染料9氨基亚磷酸酯的制备
步骤1:罗丹明染料9活化酯的制备
将化合物9在无水DCM(200ml)中溶解,与N-羟基琥珀酰亚胺酯(1.62g,14.1mmol)、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC,3.38g,17.6mmol)混合,并搅拌1小时。将溶液用DCM稀释,用1N HCl洗涤,并进行激发,以得到化合物10。
步骤2:N保护的6-氨基-2-DMT己烷-1-醇接头罗丹明染料11的制备
将化合物10在无水DMC(200ml)中溶解,并逐滴添加6-氨基-2-((双(4-甲氧基苯基)(苯基)甲氧基)甲基)己烷-1-醇(4.12g,9.17mmol)和三乙胺(1.47ml,10.6mmol;TEA)的溶液。将这个溶液在室温下搅拌2小时。将溶液用DCM稀释,用水洗涤,并进行激发。使用反相柱色谱法使用95%-100%MeCN/水洗脱来对粗制固体进行纯化,以得到呈绿色固体(5.91g,72%)的化合物11。
步骤3:罗丹明染料9氨基亚磷酸酯的制备
将化合物11(5.97g,5.10mmol)和四唑胺(0.44g,2.54mmol)在无水DCM(150ml)中溶解,搅拌,并放置在氮气下。添加3A分子筛,并进一步搅拌10分钟。向其添加N,N,N',N'-四异丙基二氨基亚磷酸2-氰乙酯(3.07g,10.2mmol),并将混合物在室温下搅拌1小时。滤出分子筛,并将溶液浓缩成固体。通过反相柱色谱法使用20%TEA/MeCN对柱进行预处理来纯化所述固体,并且然后用MeCN充分洗涤。然后,将样品在MeCN中溶解,并用MeCN洗脱。将汇集的含有产物的级分浓缩并干燥,以得到呈深黄色固体的TFA-N-保护的NH-非对称罗丹明染料氨基亚磷酸酯12(6.13g,88%)。
实例3:Big Dye非对称罗丹明标记的寡核苷酸的固相合成
在Biolytic 3900自动DNA合成仪上使用标准操作条件在聚苯乙烯固体支持物上合成用N-保护的非对称罗丹明氨基亚磷酸酯合成试剂标记的寡核苷酸。将N-保护的非对称罗丹明氨基亚磷酸酯12在乙腈溶剂中溶解以进行偶联反应,并使N-保护的非对称罗丹明染料加合物对重复的合成循环稳定,所述重复的合成循环采用用三氯乙酸去除DMT、添加其它专门的氨基亚磷酸酯、用乙酸酐封端并用碘氧化以生成核苷酸间磷酸二酯键。还发现这类非对称罗丹明对用于从固体支持物脱保护和切割合成的经标记的寡核苷酸的条件是稳定的(在65℃下用含有叔丁胺/甲醇/水的溶液处理五小时)。上述方案中展示了用于合成经标记的寡核苷酸的总体方案。通过这个过程,单TFA-非对称罗丹明DMT氨基亚磷酸酯12与支持物结合的寡核苷酸的5'-羟基偶联,以在氧化并去除DMT基团后得到磷酸二酯中间体13。PEG二聚体氨基亚磷酸酯与中间体13的游离羟基偶联,以早氧化、封端并去除DMT后得到中间体14。荧光素氨基亚磷酸酯(赛默飞世尔公司)与中间体14的游离羟基偶联。将所产生的经标记的寡核苷酸氧化、封端、从支持物切割并脱保护,以得到经标记的寡核苷酸15。使用标准色谱方案对寡核苷酸15进行纯化。
可以通过以下编号的条款对本公开进行进一步的描述。
1.以下式的化合物,其中
R1、R2、R3、R6、R7、R8、R11、R12、R13和R14在单独采用时各自彼此独立地选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基、-Rb或-(CH2)n-Rb;或者可替代地,R1和R2和/或R6和R7与其所键合的碳原子一起形成任选地经取代的苯并基;
R4在单独采用时选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基;或者R4和R2或R3中的一个与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基;
R5是H或保护基团;
R9在单独采用时选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基;或者R7和R9与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基;
R10是H或保护基团;或者R8和R10与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基;
R7和R9或R8和R10中的至少一个与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基,并且任选地R4和R2或R3中的一个与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基,前提是化合物不具有以下式:
、或;
每个Ra独立地选自低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、-CX3和6-20元杂芳基烷基;
每个Rb独立地选自-X、-OH、-ORa、-SH、-SRa、-NH2、-NHRa、-NRcRc、-N+RcRcRc、全卤基低级烷基、三卤甲基、三氟甲基、-P(O)(OH)2、-P(O)(ORa)2、P(O)(OH)(ORa)、-OP(O)(OH)2、-OP(O)(ORa)2、-OP(O)(ORa)(OH)、-S(O)2OH、-S(O)2Ra、-C(O)H、-C(O)Ra、-C(S)X、-C(O)ORa、-C(O)OH、-C(O)NH2、-C(O)NHRa、-C(O)NRcRc、-C(S)NH2、-C(O)NHRa、-C(O)NRcRc、-C(NH)NH2、-C(NH)NHRa和-C(NH)NRcRc;
每个Rc独立地是Ra,或者可替代地与同一氮原子键合的两个Rc可与所述氮原子一起形成5到8元饱和或不饱和环,所述5到8元饱和或不饱和环可任选地包含选自O、N和S的相同或不同环杂原子中的一个或多个环杂原子;
每个Rd和Re在单独采用时独立地选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基、-Rb或-(CH2)n-Rb;
X是卤基;并且n是范围为1到10的整数。
2.根据条款1所述的化合物,其中螺内酯环呈开放的酸形式,并且胺基不受保护。在某些实施例中,化合物的开放的酸形式相对于化合物的封闭的螺内酯形式是荧光的(或表现出荧光的增加)。本文中所描述的化合物的胺基可呈封闭的螺内酯形式受到保护,并且可以被制备成并用作氨基亚磷酸酯以对核酸进行高产率和高纯度标记。因此,本文中还提供了包含呈脱保护的、开放的内酯形式的根据条款1所述的化合物的荧光标记的核酸探针和引物。图8和9中示出了从固体支持物脱保护胺基并切割核酸探针之后的呈开放的内酯形式的根据条款1所述的化合物的代表性实例。
赛默飞世尔科技公司提供了包含用于用5种报告染料(即,FAM、VIC、TED、TAZ和SID)对核酸进行标记的试剂和大小标准LIZ(NGM Detect
3.一种寡核苷酸,其包括通过使与固体支持物连接的寡核苷酸与具有以下式的结构的试剂反应产生的标记部分:
LM-L-PEP
其中PEP是磷酸酯前体基团,L是将所述标记部分与所述PEP基团连接的任选的接头,并且LM包括式(I)的N-保护的NH-罗丹明部分,其中
R1、R2、R3、R6、R7、R8、R11、R12、R13和R14在单独采用时各自彼此独立地选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基、-Rb或-(CH2)n-Rb;或者可替代地,R1和R2和/或R6和R7与其所键合的碳原子一起形成任选地经取代的苯并基;并且R2、R3、R7、R8、R12或R13中的一个包括式-Y-的基团,其中Y是选自由以下组成的组:-C(O)-、-S(O)2-、-S-和-NH-;
R4在单独采用时选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基;或者R4和R2或R3中的一个与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基;
R5是H或保护基团;
R9在单独采用时选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基;或者R7和R9与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基;
R10是H或保护基团;或者R8和R10与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基;
R7和R9或R8和R10中的至少一个与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基,并且任选地R4和R2或R3中的一个与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基,前提是化合物不具有以下式:
、或;
每个Ra独立地选自低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、-CX3和6-20元杂芳基烷基;
每个Rb独立地选自-X、-OH、-ORa、-SH、-SRa、-NH2、-NHRa、-NRcRc、-N+RcRcRc、全卤基低级烷基、三卤甲基、三氟甲基、-P(O)(OH)2、-P(O)(ORa)2、P(O)(OH)(ORa)、-OP(O)(OH)2、-OP(O)(ORa)2、-OP(O)(ORa)(OH)、-S(O)2OH、-S(O)2Ra、-C(O)H、-C(O)Ra、-C(S)X、-C(O)ORa、-C(O)OH、-C(O)NH2、-C(O)NHRa、-C(O)NRcRc、-C(S)NH2、-C(O)NHRa、-C(O)NRcRc、-C(NH)NH2、-C(NH)NHRa和-C(NH)NRcRc;
每个Rc独立地是Ra,或者可替代地与同一氮原子键合的两个Rc可与所述氮原子一起形成5到8元饱和或不饱和环,所述5到8元饱和或不饱和环可任选地包含选自O、N和S的相同或不同环杂原子中的一个或多个环杂原子;
每个Rd和Re在单独采用时独立地选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基、-Rb或-(CH2)n-Rb;
X是卤基;并且n是范围为1到10的整数。
4.根据条款3所述的寡核苷酸,其中螺内酯环呈开放的酸形式,并且胺基不受保护。
5.一种可用于标记寡核苷酸的试剂,所述试剂是根据以下结构式的化合物:
LM-L-PEP(XX)
其中LM表示包括N-保护的NH-罗丹明部分的标记部分,PEP是包括氨基亚磷酸酯基团或H-膦酸酯基团的磷酸酯前体基团,并且L是将所述标记部分与所述磷酸酯前体基团连接的任选的接头,其中以下式的N-保护的NH-罗丹明部分,其中:
R1、R2、R3、R6、R7、R8、R11、R12、R13和R14在单独采用时各自彼此独立地选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基、-Rb或-(CH2)n-Rb;或者可替代地,R1和R2和/或R6和R7与其所键合的碳原子一起形成任选地经取代的苯并基;并且R2、R3、R7、R8、R12或R13中的一个包括式-Y-的基团,其中Y是选自由以下组成的组:-C(O)-、-S(O)2-、-S-和-NH-;
R4在单独采用时选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基;或者R4和R2或R3中的一个与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基;
R5是H或保护基团;
R9在单独采用时选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基;或者R7和R9与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基;
R10是H或保护基团;或者R8和R10与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基;
R7和R9或R8和R10中的至少一个与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基,并且任选地R4和R2或R3中的一个与其所键合的原子一起形成任选地经取代的杂环烷基、任选地经取代的杂环烯基或任选地经取代的杂芳基,前提是化合物不具有以下式:
、或;
每个Ra独立地选自低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、-CX3和6-20元杂芳基烷基;
每个Rb独立地选自-X、-OH、-ORa、-SH、-SRa、-NH2、-NHRa、-NRcRc、-N+RcRcRc、全卤基低级烷基、三卤甲基、三氟甲基、-P(O)(OH)2、-P(O)(ORa)2、P(O)(OH)(ORa)、-OP(O)(OH)2、-OP(O)(ORa)2、-OP(O)(ORa)(OH)、-S(O)2OH、-S(O)2Ra、-C(O)H、-C(O)Ra、-C(S)X、-C(O)ORa、-C(O)OH、-C(O)NH2、-C(O)NHRa、-C(O)NRcRc、-C(S)NH2、-C(O)NHRa、-C(O)NRcRc、-C(NH)NH2、-C(NH)NHRa和-C(NH)NRcRc;
每个Rc独立地是Ra,或者可替代地与同一氮原子键合的两个Rc可与所述氮原子一起形成5到8元饱和或不饱和环,所述5到8元饱和或不饱和环可任选地包含选自O、N和S的相同或不同环杂原子中的一个或多个环杂原子;
每个Rd和Re在单独采用时独立地选自氢、低级烷基、(C6-C14)芳基、(C7-C20)芳基烷基、5-14元杂芳基、6-20元杂芳基烷基、-Rb或-(CH2)n-Rb;
X是卤基;并且n是范围为1到10的整数。
6.根据条款5所述的试剂,其中螺内酯环呈开放的酸形式,并且胺基不受保护。
- 非对称罗丹明染料和其在生物测定中的用途
- 经修饰的罗丹明染料和其在生物测定中的用途
