聚合物囊泡纳米STING激动剂及其制备方法与应用
文献发布时间:2023-06-19 12:05:39
技术领域
本发明属于纳米药物技术,具体涉及聚合物囊泡纳米STING激动剂及其制备方法与应用。
背景技术
STING通路的激活可增强机体抗肿瘤的免疫能力,是肿瘤免疫治疗的一种有前途的方法。有研究表明,STING激动剂有利于促进TME中T细胞的浸润以及抗肿瘤免疫治疗。除了天然的cGAMP,病毒、脂质体和环状二核苷酸(CDN)也是STING通路的激动剂,目前主要研究的是CDN,如合成的cGAMP、cdiAMP等。但CDN作为带负电荷、亲水性强的小分子,不容易穿过细胞膜进入APC,还容易被酶解,此外,CDN在体内容易随机扩散和清除,药代动力学差,其全身扩散还可能引起细胞因子风暴。抗肿瘤纳米药物的研发方兴未艾。阳离子聚合物尤其是聚乙烯亚胺(PEI)具有出色的压缩/复合核酸的能力和内涵体/溶酶体逃逸能力,常用于核酸类药物的递送。然而,高分子量PEI的转染能力强,毒性也高,阻碍了其实际体内应用。低分子量PEI毒性虽低但转染效率也低。精胺(SP)是人体内源性多肽小分子阳离子化合物,安全性更高。如何高效低毒地装载CDN并高效释放到APC细胞、激活STING通路引发高效抗肿瘤免疫应答是一个挑战。
发明内容
本发明公开了聚合物囊泡纳米STING激动剂及其制备方法与应用,解决了高效核酸药物递送与载体毒性间的矛盾。本发明合成和表征了PEG-P(TMC-DTC)-PEI和PEG-P(TMC-DTC)-SP,它们在含有CDN的水相中自组装成具有不对称膜结构的囊泡:较长PEG链段(5kDa)为囊泡外壳、较短PEI或SP为囊泡内壳,内壳与带负电的CDN通过静电相互作用复合,从而得到了高效载CDN的囊泡CPs-CDN;囊泡疏水膜中含有DTC所赋予的还原敏感的自交联结构使得CDN的装载更稳定。这样的内壳带正电荷的具有不对称膜结构的囊泡能高效装载和递送CDN到肿瘤细胞内,实现了肿瘤的高效治疗;现有技术没有过该囊泡装载二核苷酸的研究和报道。
本发明基于还原敏感可逆交联的聚合物囊泡,使用低毒的低分子量PEI(600 Da、1200Da等)和SP为阳离子片段,设计制备了两种内壳带正电的聚合物囊泡用于装载CDN形成囊泡STING激动剂(CPs-CDN),分析了其激活STING通路产生抗肿瘤免疫的效果。本发明采用如下技术方案:
聚合物囊泡纳米STING激动剂,由聚合物囊泡装载STING激动剂组成;所述聚合物包括亲水链段、疏水链段以及阳离子片段;所述疏水链段的侧链为含双硫键的二硫戊环。
进一步的,组成载体的聚合物的化学结构式如下:
R为亲水链段,比如聚乙二醇链段;T链段与侧链含双硫键的碳酸酯链段(DTC单体形成的单元)组成疏水链段,T为环酯单体或者环碳酸酯单体形成的单元,比如丙交酯、己内酯、三亚甲基碳酸酯;P为阳离子片段,比如聚乙烯亚胺(PEI)、精胺(SP);y、z表示重复单元。
本发明中,所述亲水链段的分子量为3000~10000Da;疏水链段的分子量为亲水链段分子量的2.1~8.0倍;侧链含双硫键的碳酸酯链段的分子量为T链段分子量的10%~35%;阳离子片段的分子量为亲水链段分子量的5%~30%。
本发明中,STING激动剂为环二核苷酸(CDN),包括环二单磷酸鸟苷(c-di-GMP)、环二单磷酸腺苷(c-di-AMP)、2`,3`环单磷酸鸟-单磷酸腺苷酸(2`,3`-cGMAP)、3`,3`环单磷酸鸟-单磷酸腺苷酸(3`,3`-cGMAP)及其取代衍生物,比如硫、氟、氮取代环二核苷酸衍生物。
本发明中,聚合物形成囊泡,装载STING激动剂得到CPs-CDN,囊泡疏水膜中含有DTC所赋予的还原敏感的自交联结构使得CDN的装载更稳定,这样的内壳带正电荷的具有不对称膜结构的囊泡能高效装载和递送药物到肿瘤细胞内,实现了肿瘤的高效治疗,现有技术还没有过该囊泡装载环二核苷酸的研究和报道。CPs-CDN被APC摄取,通过质子海绵效应破坏溶酶体后逃离,细胞质中释放CDN,与内质网上的STING蛋白结合,启动STING通路,促进T细胞识别和杀死肿瘤细胞。本发明发现基于两种聚合物的囊泡在理化性质、细胞内吞、胞内药物释放、促进DC成熟,以及抗小鼠黑色素瘤活性方面存在差异。此外,由于X射线能使肿瘤释放肿瘤相关抗原TAA,诱导肿瘤细胞双链DNA的断裂进而激活cGAS-STING通路,本发明进一步探究了CPs-CDN与X射线联用协同增强的抗肿瘤疗效。结果表明,二者联用提高了肿瘤微环境TME中IFN-β的浓度,促进了DC细胞的成熟,提高了TME中CD8+T的比率,从而增强了对B16F10肿瘤的抑制,延长了荷瘤小鼠的生存时间。本发明公开了上述聚合物囊泡纳米STING激动剂在制备抗肿瘤药物中的应用;肿瘤优选为黑色素瘤。
本发明公开了上述聚合物囊泡纳米STING激动剂的制备方法,将STING激动剂溶液加入缓冲溶液中,再加入聚合物溶液,搅拌后透析,得到聚合物囊泡纳米STING激动剂。进一步的,STING激动剂溶液为STING激动剂水溶液;聚合物溶液为聚合物的DMF溶液;缓冲溶液为HEPES缓冲溶液。其中,STING激动剂溶液的浓度为0.1~10 mg/mL;聚合物溶液的浓度为1~100 mg/mL。
本发明设计了双硫交联的聚合物囊泡用于STING激动剂CDN的递送,并研究了其联合放疗增强抗肿瘤免疫反应。聚合物囊泡的粒径为47 nm,可高效包载CDN,并且具有高生物安全性、载药稳定性以及还原响应性,这是首次用囊泡装载ADU-S100并联合放射用于黑色素瘤的治疗,并首次比较了低剂量的X射线联合纳米STING激动剂对TME的改变以及抗肿瘤治疗的影响。与目前报道的STING激动剂治疗相比,这种新的治疗策略有以下优点:1)聚合物囊泡可实现CDN的高效包载,囊泡膜的二硫交联使其结构稳定,并在细胞内还原环境下快速释放CDN;2)聚合物囊泡的纳米级特性提高了APC细胞对STING激动剂的细胞摄取,延长了其在肿瘤部位的滞留,大大提高了STING激动剂的免疫活性,增强STING通路的激活; 3)与X射线联用,增强了STING通路的激活,促进I型IFN以及其他细胞因子的分泌,激活DC的成熟以及T细胞的活化,改善TME,诱导了强大的抗肿瘤免疫反应。4)联用的策略解决了低剂量的X射线可以避免造成组织的损伤但肿瘤抑制效果不佳的缺陷。
附图说明
图1为本发明聚合物囊泡纳米STING激动剂CPs-CDN的制备及其联合X射线用于荷黑色素瘤小鼠的抗肿瘤免疫治疗的示意图;
图2为PEG-P(TMC-DTC)-PEI 的
图3为聚合物囊泡的理化性质表征;
图4为空囊泡CPs/PEI(A)和CPs/SP(B)与DC 2.4、RAW 264.7、B16F10三种细胞共孵育12 h后的细胞存活率;
图5为Cy5-CPs/PEI-diAMP和Cy5-CPs/SP-diAMP与DC 2.4、RAW 264.7、B16F10三种细胞共孵育24 h后的细胞内吞的流式单参数直方图;
图6为DC 2.4细胞与CPs/PEI-Cy3-diAMP或CPs/SP-Cy3-diAMP共孵育2 h的CLSM图片(A)和(B)Cy3-diAMP的荧光半定量图(Cy3-diAMP浓度为300 nM)。细胞核用DAPI(蓝色)染色,溶酶/内涵体用Lysotracker deep red(红色)染色,绿色荧光为Cy3-diAMP。标尺为20 μm;
图7为体外BMDC的活化。BMDC与PBS、CPs/SP、CPs/PEI、CDN、CPs/SP-CDN或CPs/PEI-CDN共孵育24 h后的流式细胞等伪色图(A)和被激活BMDC的定量统计(B)(n = 3)。FITC-αCD11c标记BMDC细胞,APC-αCD80和PE-αCD86标记成熟的BMDC细胞;(C)使用ELISA试剂盒检测培养基中分泌的细胞因子IFN-β浓度;
图8为肿瘤组织切片CLSM图片显示瘤内注射Cy3-diAMP或Cy5-CPs/PEI-Cy3-diAMP后24 h的各荧光的分布。DAPI(蓝色):细胞核,Cy3(绿色):二核苷酸diAMP,Cy5(红色):聚合物囊泡。标尺为20 μm;
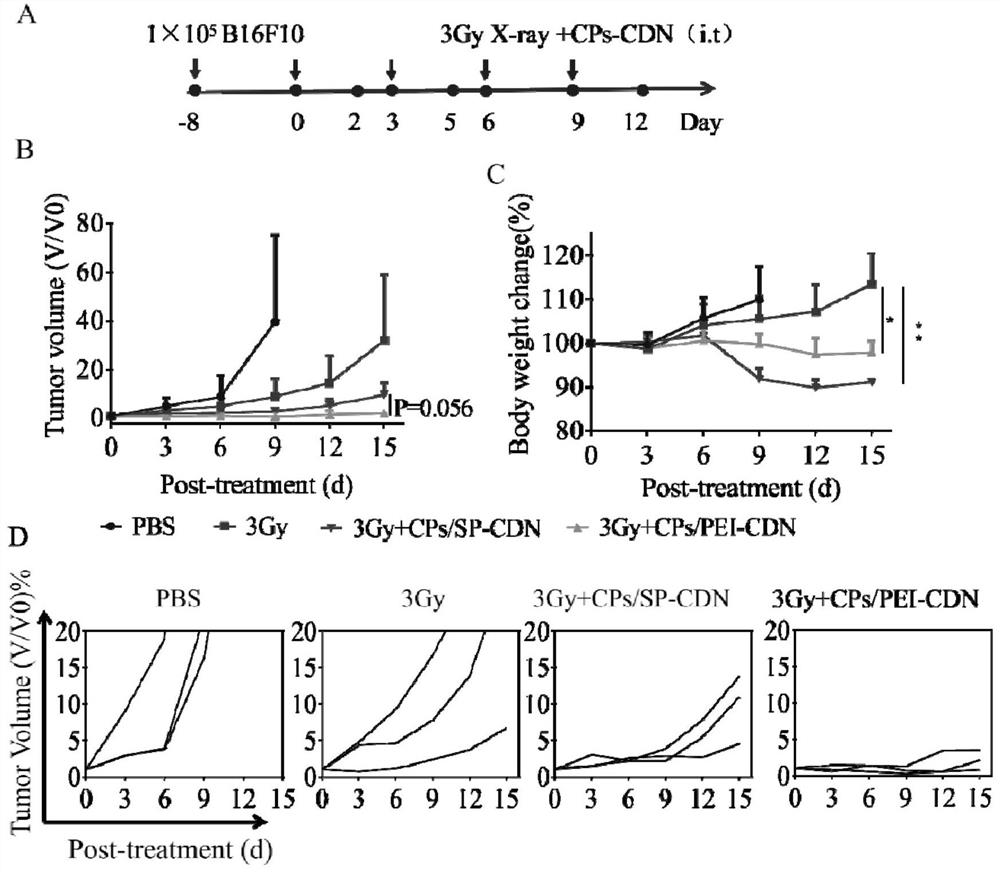
图9为CPs/PEI-CDN及其与X射线联用在荷黑色素瘤B16F10小鼠中的免疫治疗(n =3)。在第0、3、6、9天给药: 3Gy X射线、CPs/PEI-CDN+3Gy X射线、或CPs/SP-CDN+3Gy X射线,囊泡CDN通过瘤内给药,CDN剂量为20 μg /只,X射线在皮下瘤局部照射,PBS为对照组。(A)B16F10肿瘤模型的建立及给药方案;相对肿瘤体积(B)和体重(C)变化;(D)每只老鼠的相对肿瘤体积变化;
图10为3 Gy X射线与CPs/PEI-CDN、CDN联合治疗B16F10荷瘤小鼠。(A)肿瘤模型的建立以及联合瘤内给药方案;CPs/PEI-CDN治疗B16F10荷瘤小鼠的肿瘤体积(B)和(C)相对体重变化(n=7);CPs/PEI-CDN与X 射线联合治疗荷瘤小鼠的肿瘤体积(D)和(E)体重变化(n= 7);不同剂量的CDN治疗对小鼠肿瘤体积(F)和(G)小鼠体重的影响(n = 7);#表示此后有1只老鼠存活,##表示此后有2只老鼠存活;
图11为3 Gy X射线与CPs/PEI-CDN、CDN联合治疗B16F10荷瘤小鼠,开始治疗后小鼠的生存曲线(n=7);
图12为3 Gy X射线与CPs/PEI-CDN、CDN联合治疗B16F10荷瘤小鼠,每只老鼠的肿瘤体积变化图以及完全响应的小鼠数量(n=7);
图13为使用5 Gy X射线与CDN或CPs/PEI-CDN联合治疗B16F10荷瘤小鼠(n = 7)。(A)给药方案;(B)第15天的小鼠肿瘤照片;(C)小鼠肿瘤体积变化;(D)小鼠的生存曲线;(E)小鼠的相对体重变化;(F)治愈小鼠对侧接种B16F10细胞后肿瘤的生长情况;(G)单只老鼠的肿瘤体积变化以及完全响应(CR)小鼠数量;
图14为CPs/PEI-CDN与X射线联合诱导荷B16F10小鼠的特异性的抗肿瘤免疫效应。流式细胞仪分析小鼠TDLN中成熟DC的比例(A)及其定量数据统计图(n = 4)(B)。(C)肿瘤TME中CD8+T细胞的含量(n = 4)。流式细胞术分析TME中巨噬细胞表面CD206受体表达阳性的直方图(D)及其定量数据统计图(n = 4)(E)。最后一次给药6 h小鼠血清中IFN-β(F)和TNF-α(G)的浓度(n = 3)。A-E:在最后一次给药的48 h小鼠的TDLN或肿瘤分析;
图15为CPs/PEI-CDN和X射线联合治疗后小鼠肿瘤的组织切片分析。(A)H&E染色图;(B)CRT的免疫荧光染色图;(C)CD8+T细胞免疫荧光染色图。标尺:50 μm;
图16为荷B16F10黑色素瘤小鼠主要器官的H&E染色图(40´,50 μm)。a, b, c, d,e, f: PBS, 3Gy, CDN 20μg, CPs/PEI-CDN 20μg, 3Gy+CDN 20 μg, 3Gy+CPs/PEI-CDN 20μg, 5Gy+CPs/PEI-CDN 20 μg;
图17为一次瘤内注射CPs/PEI-Cy7-AMP或自由Cy7-AMP后小鼠血浆中Cy7的浓度随时间的变化(Cy7: 10 μg/只,n = 3)。
具体实施方式
高剂量的放疗会造成局部组织损伤等系统毒性,而低剂量又不能有效消除肿瘤;此外,局部放疗诱导的STING信号传导是短暂的,引起的免疫应答不足以消除肿瘤;本发明公开了聚合物囊泡纳米STING激动剂,使用STING激动剂来进一步激活低剂量放疗的肿瘤中APC的STING通路,协同放疗产生的TAA和TA,引发特异性CD8+T细胞,调节TME,诱导强大的抗肿瘤免疫应答,刺激细胞因子、T细胞募集因子的分泌,刺激DC成熟和肿瘤抗原的交叉呈递,进而启动抗肿瘤T细胞杀伤作用,增强固有和适应性免疫应答。本发明基于还原敏感可逆交联的聚合物囊泡、使用低毒的低分子量PEI(600 Da、1200Da等)和SP为阳离子片段,设计制备了两种内壳带正电的聚合物囊泡用于装载CDN形成囊泡STING激动剂(CPs-CDN),探索了其激活STING通路产生抗肿瘤免疫的效果。使用纳米载体递送CDN的策略不仅可以保护CDN免受降解,改变其生物分布;还能促进其被APC有效内吞,提高T细胞应答和抗肿瘤免疫力;还能减少用量,避免高剂量带来的潜在风险。
本发明涉及的原料都是常规产品或者市售产品;具体制备操作以及测试方法都是本领域常规方法。所有数据使用6.01版本的GraphPad Prism进行分析。使用ANOVA 单因素方差分析和t-test来确定每组的显著性差异,生存中期采用Kaplan-Meier 技术进行分析。统计学显著性建立在*p<0.05,**p<0.01,***p<0.001。
参见图1,本发明合成和表征了PEG-P(TMC-DTC)-PEI和PEG-P(TMC-DTC)-SP,它们在含有CDN的水相中自组装成具有不对称膜结构的囊泡:较长PEG链段(5 kDa)为囊泡外壳、较短PEI或SP为囊泡内壳,内壳与带负电的CDN通过静电相互作用复合,从而得到了高效载CDN的囊泡CPs-CDN。
环二核苷酸ADU-S100(99.23%)购自MCE(Master of Small Molecules);Cy3标记的线形二核苷酸(Cy3-diAMP,90%)购自上海生工生物工程。聚乙烯亚胺(PEI,
核磁共振氢谱(
小鼠黑色素瘤细胞系(B16F10)、小鼠单核巨噬细胞白血病细胞(RAW 264.7)均从中科院上海库购买。骨髓来源的树突状细胞(BMDC)从6周龄的C57BL/6J雌性小鼠的腿骨和胫骨中获取,并用含10% 胎牛血清(FBS,Gibco,美国)、1%青-链霉素(基诺生物医学技术公司,中国)以及20 ng/mL的粒细胞-巨噬细胞集落刺激因子(GM-CSF,PeproTech,美国)的RPMI-1640培养基(HyClone,美国)于6孔板中培养,48 h后更换全部培养基,之后每48 h更新一半的培养基,培养至第9天后收集未贴壁以及松散粘附在培养皿上的DC细胞,通过表面CD11c的表达确定表型。B16F10、RAW 264.7以及DC 2.4细胞均用含10% FBS、 1% 青-链霉素的DMEM培养基(Gibco,美国)培养。所有的细胞放在 37 ℃、 5% CO
C57BL/6J雌鼠(6-8周龄,18-20 g)从维通利华(北京,中国)公司购买。在25 ℃,55%湿度以及程序明暗的条件下,用无菌水和饲料培养。所有的动物实验均严格按照苏州大学动物实验中心和动物保护和使用委员会批准的方案进行。
实施例一
PEG-P(TMC-DTC)-PEI和PEG-P(TMC-DTC)-SP的合成可参见申请人已经公开的专利或者文章,具体制备方法为现有技术,比如:
第一步,开环聚合制备聚合物PEG-P(TMC-DTC)。在氮气保护的手套箱内称取MeO-PEG-OH(0.50 g,
第二步,先用N′,N′-羧基二咪唑(CDI)对PEG-P(TMC-DTC)末端的羟基进行活化,然后与PEI的伯胺进行反应。称取1.1g PEG-P(TMC-DTC)(羟基0.05 mmol)和24 mg CDI(0.15mmol)溶于DCM中,30 ℃反应24 h,然后在冰乙醚中沉淀三次,按之前方法真空干燥得到PEG-P(TMC-DTC)-CDI。接着,称取PEI(
聚合物PEG-P(TMC-DTC)-SP的合成也分为两步,第一步与上述描述相同,即先合成PEG-P(TMC-DTC),然后用CDI活化末端羟基;第二步是将活化的聚合物与SP的伯胺进行反应。简而言之,称取PEG-P(TMC-DTC)(1g,45 μmol)置于两颈烧瓶,用1mL DCM溶解,在氮气保护的环境下滴加CDI(8.8 mg,54 μmol)的DCM溶液(88 mg/mL),30 ℃活化4 h。将活化好的聚合物滴加到预冷的SP(98.2 mg,0.45 mmol)的DMF溶液中,然后置于室温继续反应4 h。反应结束后,使用冰乙醚沉淀反应物,离心,真空干燥,产率为85.2%。核磁:PEG:(δ 3.51);TMC(δ 4.24,2.03);DTC(δ 4.19,3.02);SP(δ 2.84-2.92,2.94,3.29);
三步法合成了PEG-P(TMC-DTC)-PEI和PEG-P(TMC-DTC)-SP:首先以甲氧基PEG(5000 Da)为引发剂、通过可控开环聚合TMC和DTC得到嵌段聚合物PEG-P(TMC-DTC),然后用CDI活化末端羟基、再和PEI或SP的伯胺反应得到最终聚合物,实现了装载、保护和高效递送该CDN进入APC激活STING通路。参见图2,通过
空囊泡和装载CDN的聚合物囊泡(CPs/PEI-CDN或CPs/SP-CDN)的制备。通过纳米沉淀法制备空囊泡的具体过程如下:用移液枪吸取100 μL的PEG-P(TMC-DTC)-PEI或PEG-P(TMC-DTC)-SP的DMF溶液(10 mg/mL),加入到900 μL的HEPES缓冲溶液(5 mM,pH 6.8)中。常规磁力搅拌10分钟,再用HEPES缓冲液(5 mM,pH 6.8)透析6 h后,再用PB(10 mM,pH 7.4)透析半小时,得到空囊泡。
为了研究聚合物囊泡STING激动剂的制备、性质和免疫激活作用,选用已在临床II期试验的一种CDN(ADU-S100)来研究,其瘤内注射治疗黑色素瘤的抗肿瘤治疗效果更佳,遗憾的是,该CDN的结构和性质都会限制其被APC的摄取,影响其抗肿瘤免疫活性。ADU-S100(ML RR-S2 CDA)的结构式如下:
通过纳米沉淀法制备载药囊泡的具体过程如下:将ADU-S100从-80℃冰箱取出,配置成2 mg/mL的水溶液,分装保存于-80℃冰箱,避免反复冻融。装载CDN的囊泡的制作过程与上述差别不大,区别在于将80 μL CDN溶液(0.16 mg)打入到HEPES缓冲溶液中,然后打入聚合物溶液(10 mg/mL),其余步骤一样。
实施例二 空囊泡和装载CDN的聚合物囊泡(CPs/PEI-CDN或CPs/SP-CDN)的表征
囊泡的粒径、粒径分布以及表面Zeta电位通过动态光散射(DLS)和电泳技术进行测定。通过粒径追踪,分析CPs/PEI-CDN、CPs/SP-CDN在10% FBS溶液、高倍稀释以及在4 ℃条件下长期储存的稳定性以及在10 mM GSH条件下的还原响应行为。ADU-S100的载药量(DLC)和包封率(DLE)通过NanoDrop进行测定,以等浓度、等粒径的空载体作为背景,记录260 nm处的吸收值,根据已知浓度ADU-S100的吸收值绘制的标准曲线进行计算。表征图见图3,(A)CPs/PEI和(B)CPs/SP的粒径分布、TME电镜图(标尺为50 nm),以及(C)CPs/PEI和(D)CPs/SP的SLS测试;(E)CPs/PEI-CDN和(F)CPs/SP-CDN在10% FBS中、高倍稀释以及4℃放置3周的粒径分布的变化;(G)二者在含10 mM GSH 的PB中12 h后粒径的变化;(H)装载Cy3-diAMP的两种囊泡在体外模拟细胞内还原环境(PB,10 mM,pH 7.4,10 mM GSH)和生理环境(PB,10 mM,pH 7.4)下Cy3-diAMP的累积释放(n = 3)。
PEG-P(TMC-DTC)-PEI或PEG-P(TMC-DTC)-SP的DMF溶液加入到HEPES缓冲溶液(pH6.8,5 mM)中,可自组装形成具有不对成膜结构的囊泡CPs/PEI和CPs/SP:长的PEG(5 kDa)排列在外部组成囊泡的外壳,而短PEI和SP被屏蔽到囊泡内壳。囊泡在制备过程中膜中的DTC开环自交联。CPs/PEI、CPs/SP的表征结果见表2。其TEM图显示典型的球形中空囊泡结构,参见图3A,B,由静态光散射仪(SLS)测定结果可知,CPs/PEI和CPs/SP的回旋半径(Rg)与流体力学半径(Rh)的比值分别为0.905和1.001,接近理论值1.0,证实了二者的中空的球形囊泡结构,参见图3C,D。
PEG-P(TMC-DTC)-PEI或PEG-P(TMC-DTC)-SP在含有CDN的水相中可形成高效装载CDN的囊泡,分别表示为CPs/PEI-CDN和CPs/SP-CDN,如在理论载药量为20 wt.%时,CDN的包封率分别高达86.0%和88.2%,对应载药量17.2 wt.%和17.6 wt.%。得到囊泡的粒径和空载体相比有增大,CPs/SP-CDN的粒径显著大于CPs/SP粒径,粒径分布维持较低的水平。这两个囊泡的CDN的载药量明显优于目前已报道的脂质体、水凝胶、以及基于DEAMEA的聚合物囊泡。这样高载药量要归因于CDN与囊泡内壳的PEI或SP的复合以及交联稳定的囊泡膜的保护。相比之下,由PEG-P(TMC-DTC)制备得到的囊泡装载相同CDN的载药量非常低,见表2的CPs-CDN组。实验中已经发现两种囊泡均具备优异的胶体稳定性,这两种载药囊泡在储存过程中放置3周粒径也没有变化,不仅如此,在含10%的FBS溶液中,也没有造成囊泡解离或是团聚,粒径及粒径分布变化不明显;在模拟静脉注射的极低浓度下,囊泡也没有解离成单分子,保持了粒径及粒径分布,图3E,F。而在含有10 mM GSH的溶液中,由于GSH还原了囊泡膜中的双硫交联,12 h后部分囊泡粒径明显变大,图3G。
将ADU-S100更换为另一种CDN(c-di-GMP, 环二鸟苷酸),同样的载药方法(CPs/SP为聚合物)得到的纳米粒(PS-GMP)表征如下:
实施例三 空白囊泡的细胞毒性实验
为了研究空白囊泡(CPs/PEI、CPs/SP)的体外毒性,将B16F10、DC 2.4和RAW 264.7细胞分别按2000个/孔、5000个/孔和10000个/孔的密度铺于96孔板中,孵育24 h后,加入不同浓度的空白囊泡,共同培养24 h后,每孔加入10 μL无菌的MTT溶液(5 mg/mL),放入培养箱继续孵育4 h。用移液枪慢慢地吸走培养基,每孔加入150 μL DMSO,溶解蓝紫色甲瓚结晶,用酶标仪测定每孔在570 nm 处的吸收值。通过每孔与对照组吸光度的比值计算细胞存活率。
虽然PEI在核酸药物的高效递送以及基因转染方面表现出了极大的优势,但往往因为其系统毒性限制了在活体中的应用。本发明通过MTT实验评估了空聚合物囊泡与树突状细胞(DC 2.4)、巨噬细胞(RAW 264.7)、肿瘤细胞(B16F10)共孵育12 h后的细胞毒性。在CPs/PEI和CPs/SP浓度高达400 μg/mL时,三种细胞的存活率均高于85%,图4。结果说明,CPs/PEI和CPs/SP均具有良好的生物安全性。
实施例四 CPs-CDN的体外细胞内吞以及内涵体逃逸行为研究
B16F10、RAW 264.7、DC 2.4细胞按10
使用Cy5标记的聚合物、以线性的diAMP作为模型二核苷酸,根据常规方法分别制备Cy5标记的囊泡Cy5-CPs/SP-diAMP和Cy5-CPs/PEI-diAMP,用流式细胞仪测定了这两种聚合物载药囊泡分别与DC 2.4、RAW 264.7、B16F10细胞共孵育24 h后被摄取的情况。实验结果显示,这两种囊泡的细胞摄取存在巨大差异,参见图5:在DC 2.4、RAW 264.7、B16F10三种细胞中,Cy5-CPs/PEI-diAMP的荧光强度均高于Cy5-CPs/SP-diAMP,前者分别是后者的3.6倍、4.6倍和69倍;此外,DC2.4细胞的内吞能力显著高另外两种细胞。
为了考察载药囊泡的内涵体逃逸行为,使用囊泡共同载荧光标记的二核苷酸(Cy3-diAMP)和线性的模型二核苷酸(diAMP)。将DC 2.4细胞以1×10
聚合物囊泡CPs/PEI和CPs/SP可以提高CDN在DC细胞中的摄取,但CDN必须与细胞质内质网上的STING蛋白结合才能激活免疫反应,因此囊泡从内涵体逃逸、并释放CDN到细胞质对于提高CDN的效能以及增强抗肿瘤免疫反应具有重要意义。本发明根据常规方法,用Cy3标记的diAMP(Cy3-diAMP)为模型,定性地研究载药囊泡CPs/PEI和CPs/SP中Cy3-diAMP的细胞摄取和内涵体逃逸情况,图6。CLSM实验结果显示,DC细胞在和CPs/PEI-Cy3-diAMP和CPs/SP-Cy3-diAMP孵育2 h后,均有Cy3-diAMP被递送到DC中,而CPs/PEI递送进入细胞的Cy3-diAMP的量要比CPs/SP的明显要多,ImageJ半定量表明高2.35倍,这和流式细胞仪测定的细胞摄取的结果相吻合。此外,将在DC 2.4细胞中Cy3-diAMP绿色荧光与内涵体红色荧光叠加后,发现二者不完全重合,表明两种囊泡在2小时就从内涵体逃逸。因此,载Cy3-diAMP囊泡被DC 2.4细胞摄取进入内涵体,在PEI或SP的辅助下Cy3-diAMP逃离内涵体,然后在细胞质中被还原释放出二核苷酸。
本发明的载CDN囊泡能活化小鼠的BMDC细胞和激活STING通路,通过激活STING通路,诱导I型IFN的产生,促进DC细胞的激活和功能的成熟。在抗肿瘤免疫中,DC的成熟对于抗原的交叉呈递以及T细胞的产生具有重要作用。使用FITC-αCD11c标记所有的BMDC,用APC-αCD80和PE-αCD86标记成熟的BMDC。孵育24 h后,阴性对照PBS组中成熟DC(CD80+CD86+)占总细胞数的15.8%,空囊泡CPs/PEI、CPs/SP并未诱导明显的BMDC成熟。文献报道含有胺的化合物能够激活DC,本发明的限定的囊泡没有激活。而自由CDN、CPs/SP-CDN以及CPs/PEI-CDN则显著增加了成熟BMDC(CD80+CD86+)的比例分别到59.3%、75.1%和80.5%,图7,其中CPs/PEI-CDN刺激BMDC成熟的能力最强。相比于CDN,CPs/PEI-CDN及CPs/SP-CDN通过内吞进入细胞质,大大增加了细胞内CDN的浓度,极大激活STING信号通路,显著促进了BMDC的成熟(***p)。
用ELISA试剂盒检测了BMDC培养基中CDN制剂诱导细胞分泌的IFN-β的浓度。由图7C可知,PBS和空囊泡无法诱导IFN-β的分泌,而自由CDN组有显著提升的IFN-β,说明IFN-β的分泌是CDN依赖的;其次,相比于CDN,CPs囊泡进一步促进了IFN-β的分泌,CPs/SP-CDN和CPs/PEI-CDN分别提高了1.8和2.3倍(***p),说明了囊泡增强了CDN的激活STING通路的能力。而相比于CPs/SP-CDN,CPs/PEI-CDN更显著地诱导IFN-β分泌(**p),这要归因于CPs/PEI-CDN优越的细胞摄取能力和内涵体逃逸以及细胞质有效释放的能力。STING的诱导的IFN-β不仅可以协调先天免疫应答,还在适应性免疫应答中发挥重要作用,包括促进APC功能的成熟、抗原的交叉呈递以及特异性T细胞的引发和激活;除了增强抗肿瘤免疫应答外,I型IFN还可以通过诱导凋亡和直接作用于肿瘤的抗增殖反应参与肿瘤抑制。
实施例五 CPs/PEI-CDN在肿瘤组织中的滞留实验
用Cy5标记的聚合物(Cy5-PEG-P(TMC-DTC))与PEG-P(TMC-DTC)-PEI共混制备荧光标记的聚合物囊泡并载Cy3-diAMP。当小鼠肿瘤体积~100 mm
CDN的抗肿瘤应用为瘤内给药,而CDN因分子量小以及水溶性强导致可能在局部注射后快速扩散,影响CDN在肿瘤中的滞留,降低CDN的生物利用度,这是现有技术存在的问题。本发明的纳米药物在进入肿瘤后,由于肿瘤部位淋巴引流受损,使其在肿瘤局部积累,延长了载体的滞留时间,用Cy3-diAMP为模型、Cy5标记囊泡研究Cy5-CPs/PEI-Cy3-diAMP在肿瘤组织中的分布,探究CDN和CPs/PEI-CDN在肿瘤的滞留。在荷皮下黑色素瘤B16F10小鼠中,分别瘤内注射Cy3-diAMP或Cy5-CPs/PEI- Cy3-diAMP,24 h后牺牲小鼠,分离肿瘤,并切片、染色。图8荧光成像显示,自由Cy3-diAMP在肿瘤切片中仅有微弱的绿色荧光信号,显示了Cy3-diAMP分子量小、水溶性强而快速发生了体内扩散。而Cy5-CPs/PEI-Cy3-diAMP组肿瘤处的绿色荧光很强,囊泡的红色荧光也很强,并且二者在肿瘤中分布均匀。此外,注射24小时后,Cy5的红色荧光与Cy3的绿色荧光均在肿瘤组织中,但是重叠的比例很低,在活体上证明了囊泡CPs/PEI 的递送可以延长二核苷酸在注射部位的保留,能把CDN从囊泡中释放出来。
实施例六 纳米STING激动剂对B16F10荷瘤小鼠的抗肿瘤治疗
将50 μL含有40 % Matrigel(康宁,美国)的B16F10细胞的PBS悬浮液按照10
本发明的CPs/PEI-CDN瘤内注射能在肿瘤保留较长时间,对于被肿瘤浸润的APC摄取、激活STING通路和免疫应答有利,通过外加CPs/PEI-CDN增强STING通路的激活可以提高放疗的抗肿瘤作用,不但能直接损伤DNA、杀死肿瘤细胞,改变肿瘤微环境(TME),释放肿瘤相关抗原(TAA),还能通过cGAS/STING途径增强细胞质DNA感应,诱导产生I型IFN,从而促进DC成熟和T细胞的激活,诱导适应性免疫应答。在本次初步实验中,以给药治疗当天为第0天,在第0、3、6、9天给小鼠以下治疗方案:3Gy X射线、CPs/PEI-CDN+3Gy X射线、或CPs/SP-CDN+3Gy X射线,囊泡CDN通过瘤内给药,CDN剂量为20 μg /只,X射线在皮下瘤局部照射,PBS为对照组。参见图9,从初步治疗结果发现,局部X射线治疗对于缓解疾病的进展有一定的作用,但单独使用的效果不佳,而X射线与CPs/PEI-CDN的联用可以极大程度抑制肿瘤生长、降低肿瘤尺寸。相比之下,CPs/SP-CDN联用X射线的肿瘤抑制能力明显弱于 CPs/PEI-CDN(p=0.056),说明CPs/PEI-CDN在促进细胞内吞、刺激DC细胞的成熟以及细胞因子的分泌方面显著优于CPs/SP-CDN。此外,尾静脉给CPs/PEI-CDN的疗效比瘤内给药要差;进一步的,PD-1抗体与X射线、CPs-CDN三者联用未显示出明显的治疗优势,所以在后续的实验中将重点研究X射线与STING激动剂二者联用的抗肿瘤效果。
在进一步的系统治疗研究中,每只老鼠接种1.5×10
本发明使用低剂量的X射线(3Gy或5Gy)与CPs/PEI-CDN联合系统研究了荷黑色素瘤B16F10小鼠的治疗(n = 7),避免高剂量的X射线造成DNA剪切酶的增加以及组织的损伤。参见图10至图12,当小鼠的肿瘤体积达50 mm
进一步的,将5 Gy X 射线与CDN或CPs/PEI-CDN联合,和之前的给药方案相同。参见图13,结果显示,单独使用5 Gy X射线治疗对黑色素瘤初期生长的抑制效果优于3 Gy X射线,然而这种由局部X射线照射引起的抗肿瘤免疫反应比较短暂,无法激活强大的抗肿瘤免疫反应,对于肿瘤的长期抑制以及小鼠总生存期的延长效果不显著。但是当5 Gy X射线联合CDN或CPs/PEI-CDN给药时,可显著增强肿瘤抑制效果(**p),延长小鼠的总生存期(***p)。经5 Gy X射线和CDN或CPs/PEI-CDN首次注射治疗的48 h后,个别小鼠的肿瘤部位出现红色、发炎性的结痂,第二次注射的48 h后,CPs/PEI-CDN治疗组的绝大多数老鼠(5/7)出现了大面积、烧灼性的黑色结痂,个别老鼠(2/7)为浅褐色的痂,肿瘤部分消退,而CDN组仅有两只老鼠出现结痂情况。注射部位的急性坏死与STING诱导产生的TNF-α有关。在给药的第8-12天,CPs/PEI-CDN组的实体肿瘤全部消退,但在第14、16、18、34天,各有一只小老鼠肿瘤在原位复发(结痂已掉)。此外,5 Gy X射线和CPs/PEI-CDN联合比其和CDN联合在肿瘤抑制方面类似,但是小鼠中位生存期由39天延长到54天,有3/7只小鼠最后无肿瘤。从小鼠的体重变化可发现,用5 Gy X射线单独治疗或联合治疗对小鼠体重影响不大,并未引起严重的毒副作用。
为评估局部5 Gy X射线联合CDN或CPs/PEI-CDN治疗B16F10肿瘤小鼠,并消退肿瘤后对肿瘤免疫记忆的诱导作用,在原发的第176天,在完全治愈的两组小鼠(n = 3)原先有肿瘤的对侧,皮下接种1.5×10
实施例七 流式细胞术分析肿瘤的免疫微环境的调节
B16F10荷瘤小鼠肿瘤体积~100 mm
为了评估X射线和CPs/PEI-CDN联合治疗是否能在B16F10黑色素瘤TME中激活DC触发T细胞免疫反应,在最后一次瘤内注射CPs/PEI-CDN 后6 h取血液测定细胞因子浓度,后48 h牺牲小鼠,解剖出肿瘤和肿瘤引流淋巴结(TDLN)用流式细胞术进行分析。参见图14A、B,与PBS组TDLN中成熟的DC细胞(CD11c+CD80+CD86+)相比(39.6%),仅采用3Gy X射线治疗对促进DC成熟的能力有限;而给予自由CDN以及CPs/PEI-CDN 均显著提高了DC的成熟度(***p),其中囊泡CPs/PEI-CDN组比自由CDN组更加显著(67.7% vs. 56.1%,**p),这与体外BMDC细胞实验结果一致。此外,与单独使用STING激动剂相比,CPs/PEI-CDN或CDN联合X射线的治疗诱导DC成熟的作用明显(* p),但CDN剂量的增加并没有对DC的成熟度有提高。
细胞毒性T淋巴细胞(CTL,CD3+CD4-CD8+)对肿瘤细胞的杀伤起关键作用,被认为是癌症免疫疗法中的关键效应细胞。本发明通过流式细胞术研究了CPs/PEI-CDN及其联用X射线治疗后肿瘤中浸润的CD8+T细胞比例的变化,图14C可看出,PBS组、X射线组以及瘤内注射的自由CDN组的肿瘤TME中CD8+T细胞的含量小于0.4%,而CPs/PEI-CDN大大促进了CD8+T细胞的浸润(*p),显示了囊泡纳米激动剂有利于招募CTL到TME。当其与X射线联合治疗时诱导的肿瘤浸润CD8+T细胞的进一步提高。CPs/PEI-CDN的剂量以及X射线剂量的增加对于提高TME中CD8+T细胞比例的增幅不大。聚合物囊泡装载提高了CDN在肿瘤中的滞留,促进了CDN的细胞内吞,进而促进STING通路的激活以及T细胞的活化;CPs/PEI-CDN与X射线联合进一步激活了APC的STING通路,显著提高了TME中效应T细胞的比例,增强了抗肿瘤免疫应答。
肿瘤中有不同亚型的巨噬细胞,有免疫抑制的M2型(CD11b+F4/80+CD206+)和促炎性的M1型,所以免疫治疗如果对巨噬细胞进行重新编程,使免疫抑制的M2型巨噬细胞向促炎性的M1型转变,就可能使免疫抑制性肿瘤向免疫原性的热肿瘤转变。本发明研究了CPs/PEI-CDN及其联用 X射线治疗后TME中的肿瘤相关巨噬细胞(TAM)的表型。图14D、E显示,与PBS组中M2型巨噬细胞(CD11b+F4/80+CD206+)相比,自由CDN组M2有较大下降,而囊泡CPs/PEI-CDN组的M2显著降低(*** p),说明经CPs/PEI-CDN治疗巨噬细胞重新极化或募集,免疫抑制降低。根据文献报道,STING激动剂及其纳米制剂可以对巨噬细胞进行重新编程,使免疫抑制的M2型向M1型转变,使免疫抑制性冷肿瘤向免疫原性的热肿瘤转变;然而,进一步联合X射线对巨噬细胞表型的转变无明显的促进作用。
ELISA检测:最后一次给药的6 h,眼眶取血收集小鼠血样,使用血清分离管分离血清,按照ELISA试剂盒的说明书检测小鼠血清中TNF-α以及IFN-β的表达水平。使用多功能酶标仪进行读数。
抗肿瘤免疫应答高度依赖于I型IFN的信号传导,I型IFN促进DC加工和呈递抗原,促使其向淋巴结迁移,对功能性CD8+T细胞介导的抗肿瘤免疫应答至关重要。因此,在最后一次给药6 h,取血样使用ELISA试剂盒检测小鼠血清中IFN-β和TNF-α的浓度。图14F、G显示,瘤内注射CPs/PEI-CDN导致IFN-β、TNF-α的分泌增加显著,而3 Gy X射线诱导产生的内源性细胞因子含量低,说明单独放疗对抗肿瘤免疫应答启动的效果有限。二者联合可进一步提高血清里细胞因子IFN-β的表达(** p);IFN-β的分泌与CDN的给药剂量呈正比。增加联合的X射线剂量到5 Gy,IFN-β和TNF-α的分泌都增加非常显著(*** p)。瘤内注射CDN治疗对肿瘤的控制分为两阶段,第一阶段是由TNF-α分泌引起的肿瘤早期出血性坏死,第二阶段是CD8+T细胞依赖性的复发控制。
综上所述,X射线与CPs/PEI-CDN联用可以在肿瘤部位产生强大的免疫反应。
实施例八 组织切片和免疫组化分析
为了评估治疗造成的组织毒性以及肿瘤组织的T细胞浸润情况,在最后一次给药48 h后,取出小鼠的心、肝、脾、肺、肾和肿瘤,洗涤、固定、包埋、切片,用苏木精和伊红(H&E)染色,用于病理学分析。为了对肿瘤组织进行免疫组织化学染色,肿瘤组织石蜡切片(8 μm)经脱蜡、抗原修复、血清封闭处理后用兔αCD8(1:500;Abcam)或兔αCRT抗体(1:200;Abcam)37 ℃ 孵育1 h,PBS清洗3次,用Alexa Fluor 633偶联的山羊抗兔二抗(1:500;Invitrogen)37 ℃孵育1 h,用PBS清洗后使用DAPI对细胞核进行染色,使用奥林巴斯BX41正置荧光显微镜(Olympus BX41)拍摄荧光图片。
在最后一次注射CPs/PEI-CDN 后48 h解剖小鼠取肿瘤做切片,进行免疫组化分析。图15显示,肿瘤组织切片的H&E 染色证实了X 射线与CPs/PEI-CDN联用的治疗效果。5Gy X射线和CPs/PEI-CDN联用导致整个切片上肿瘤细胞出现最大面积的坏死,有大量的炎症细胞的浸润,和前面的结果吻合。相比之下,自由CDN、X射线以及X射线和自由CDN联合组的肿瘤细胞也出现了坏死和黑色素的沉积,然而CPs/PEI的装载增强了CDN抗肿瘤效果,CPs/PEI-CDN以及3 Gy X射线和CPs/PEI-CDN联合组的肿瘤细胞核发生凋亡的程度显著增大,大量肿瘤细胞皱缩和破裂,肿瘤细胞数量明显减少,有少量的免疫细胞的浸润现象。肿瘤细胞表面CRT的暴露是造成免疫原性杀伤的必要条件。由图15可知,PBS组以及未经X射线照射的CDN制剂组均未能触发CRT的暴露,几乎观察不到红色荧光。而X射线可以诱导肿瘤细胞分泌CRT,在X射线以及X射线联合治疗组均观察到明显的红色荧光,表明CRT的分泌增加,ICD效应明显,可作为“eat-me”信号,促进DC的内吞和抗原呈递,招募CTL,诱导免疫反应,抑制肿瘤生长。此外,CD8+T细胞的免疫荧光染色结果显示,囊泡CPs/PEI-CDN组和自由CDN相比红色荧光明显增多肿瘤组织中的CD8+T细胞增多,而CPs/PEI-CDN与X射线联合组肿瘤组织中的CD8+T细胞的浸润更多,进一步增强了抗肿瘤免疫效应。单独X射线对增加肿瘤浸润CD8+T细胞的能力有限,这与流式结果相符。
在治疗结束48 h收集小鼠主要器官(心、肝、脾、肺、肾)以进行组织学分析。图16显示,H&E染色未观察到明显的毒性作用,表明该CPs/PEI-CDN及其与X射线联合治疗具有生物相容性。
实施例九 CPs/PEI-CDN在肿瘤组织中的药代动力学
为了研究瘤内注射的囊泡的药代动力学,用Cy7标记的寡聚核苷酸AMP作为模型核苷酸,一次性注射CPs/PEI-Cy7-AMP或Cy7-AMP(Cy7浓度:10 μg/只)到荷瘤小鼠的肿瘤内,在设定的时间点从小鼠眼眶取血,然后使用多功能酶标仪测定血浆中Cy7的浓度。实验结果(图17)显示,在瘤内注射后的半小时内,Cy7-AMP组小鼠血浆中Cy7的浓度均高于CPs/PEI-Cy7-AMP组。瘤内注射Cy7-AMP后,因其分子量小、水溶性强而迅速扩散到血液中,并在5分钟内达到C
本发明设计研究了高效递送小分子STING激动剂环二核苷酸(CDN)的双硫交联的内壳带正电的聚合物囊泡(CPs/PEI-CDN)及其联合低剂量X射线用于小鼠黑色素瘤的免疫治疗。囊泡由PEG-P(TMC-DTC)-PEI在水相中自组装、自交联而成,粒径小而均匀(45 nm,PDI0.16),循环稳定;其由低分子量PEI组成的带正电内壳通过静电相互作用复合带负电的CDN,不仅解决了小的核酸药物高效递送与载体毒性之间的矛盾,还可通过质子海绵效应帮助其逃逸内涵体。CPs/PEI-CDN延长了CDN的肿瘤滞留时间,增强了其胞质传递,增强了肿瘤微环境和肿瘤引流淋巴结(TDLN)中STING通路的激活,提高了CDN的疗效。在荷B16F10瘤小鼠中,低剂量X射线(3 Gy×3、5 Gy×3)与CPs/PEI-CDN联用进一步激活肿瘤浸润APC的STING通路,促进成熟DC向TDLN迁移,招募和激活CD8+T细胞,诱导适应性免疫应答,有效抑制肿瘤的生长,延长小鼠的中位生存期。
- 聚合物囊泡纳米STING激动剂及其制备方法与应用
- 甘露糖修饰的共载抗原和双免疫激动剂磷脂杂化聚合物囊泡及其制备方法与应用
