人源化或嵌合CD3抗体
文献发布时间:2023-06-19 12:13:22
本申请是以下申请的分案申请:申请日:2014年7月4日 ;申请号:201480048350.3(PCT/EP2014/064326);发明名称:同上。
发明领域
本发明涉及与人CD3结合的人源化或嵌合抗体,包含所述人源化或嵌合抗体的组合物,以及所述人源化或嵌合抗体在疾病治疗中的用途。
背景技术
分化簇3(CD3)多年来是已知的,并且因此在许多方面中是感兴趣的主题。针对CD3或其中CD3是其部分的T细胞受体复合物的特异性抗体是已知的。五种人源化OKT3效应子功能变体抗体的体外表征已得到描述[1]。
用抗CD3单克隆抗体hOKT3γ1(Ala-Ala)治疗导致在不存在连续的免疫抑制性药剂的情况下,在1型糖尿病发作后至少2年改善的C肽应答和临床参数 [2]。
改善靶向抗体疗法的有希望的方法是通过将细胞毒性细胞特异性递送至抗原表达癌细胞。使用T细胞用于有效杀伤肿瘤细胞的这个概念已得到描述[3]。然而,初始临床研究是相当令人失望的,主要是由于低功效、严重不利效应(细胞因子风暴)和双特异性抗体的免疫原性[4]。双特异性抗体的设计和应用中的进展已部分克服细胞因子风暴的初始障碍,且改善临床有效性而无剂量限制毒性[5]。
例如,其一条臂靶向肿瘤细胞上的抗原并且另一条臂靶向例如T细胞上的CD3的某些双特异性抗体,提供了通过Fc区的Fc受体结合。在结合后,形成结合抗体Fc区的T细胞、肿瘤细胞和效应细胞的复合物,导致肿瘤细胞的杀伤[4]。卡妥索单抗(catumaxomab)由小鼠IgG2a/大鼠IgG2b异源二聚体组成,并且已发现在腹膜内应用后成功用于治疗癌症相关腹水[6]。然而,小鼠/大鼠杂交物是免疫原性的[7],并且不能应用于人中的长期静脉内治疗。归于卡妥索单抗的频繁的治疗相关不利事件包括细胞因子释放相关症状(即发热、恶心、呕吐、寒战、心动过速和低血压)[8]-[9],其涉及卡妥索单抗的Fc区的效应子功能。另一种抗体是厄马索单抗(ertumaxomab)(HER2xCD3),其在具有低HER2表达的细胞系中诱导细胞毒性。厄马索单抗已处于转移性乳腺癌的II期临床开发中[10]-[11]。
与食蟹猴和/或恒河猴CD3交叉反应的CD3抗体已得到描述[12]-[13],然而,需要关于此类交叉反应性抗体的进一步改善。
发明内容
本发明的目的是提供人源化或嵌合CD3抗体。因此,在一个方面,本发明涉及与人CD3结合的人源化或嵌合抗体,其中所述抗体包含结合区,所述结合区包含分别具有如SEQID NO: 1、2和3中所示序列的重链可变(VH)区CDR1、CDR2和CDR3,以及分别具有如SEQ IDNO: 4中所示序列、序列GTN和如SEQ ID NO: 5中所示序列的轻链可变(VL)区CDR1、CDR2和CDR3。
在另一个方面,本发明涉及双特异性抗体,其包含根据本发明的抗体的第一结合区、以及结合与所述第一抗原结合区不同的靶的第二结合区。
在另一个方面,本发明涉及编码根据本发明的一种或多种氨基酸序列的核酸构建体。
在另一个方面,本发明涉及包含下述的表达载体:(i)编码根据本发明的人源化或嵌合抗体的重链序列的核酸序列,(ii) 编码根据本发明的人源化或嵌合抗体的轻链序列的核酸序列,或(iii) (i)和(ii)两者。
在另一个方面,本发明涉及包含根据本发明的表达载体的宿主细胞。
在另一个方面,本发明涉及包含根据本发明的抗体或双特异性抗体的组合物。
在另一个方面,本发明涉及包含根据本发明的抗体或双特异性抗体和药学可接受的载体的药物组合物。
在另一个方面,本发明涉及用作药剂的根据本发明的抗体或双特异性抗体、组合物或药物组合物。
在另一个方面,本发明涉及用于治疗疾病的根据本发明的抗体或双特异性抗体、组合物或药物组合物。
在另一个方面,本发明涉及疾病治疗方法,其包括给有此需要的受试者施用根据本发明的抗体或双特异性抗体、组合物或药物组合物。
在一个方面,本发明涉及诊断特征在于CD3表达细胞的参与或累积的疾病的方法,其包括给受试者施用根据本发明的人源化或嵌合抗体、组合物或药物组合物,任选地,其中所述人源化或嵌合抗体用可检测试剂进行标记。
在另一个方面,本发明涉及用于产生根据本发明的抗体或双特异性抗体的方法,其包括步骤a)培养根据本发明的宿主细胞,和b)从培养基中纯化抗体。
在另一个方面,本发明涉及包含根据本发明的抗体或双特异性抗体的诊断组合物。
在另一个方面,本发明涉及用于检测样品中的CD3抗原或表达CD3的细胞的存在的方法,其包括步骤a)在允许抗体或双特异性抗体和CD3之间的复合物形成的条件下,使样品与根据本发明的抗体或双特异性抗体接触,和b)分析是否已形成复合物。
在另一个方面,本发明涉及用于检测样品中的CD3抗原或表达CD3的细胞的存在的试剂盒,其包含i)根据本发明的抗体或双特异性抗体,和ii)试剂盒的使用说明书。
在另一个方面,本发明涉及与根据本发明的抗体结合的抗独特型抗体。
附图简要说明
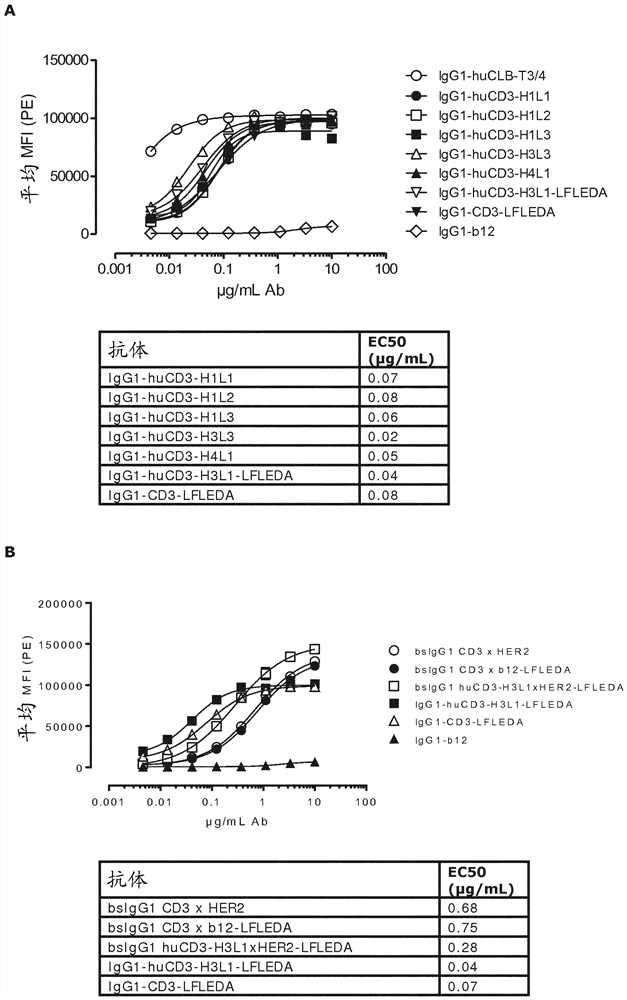
图1: 显示了(图1A) IgG1-huCD3的单特异性抗体变体和(图1B)双特异性抗体变体bsIgG1 huCD3xHER2与人T细胞系Jurkat的结合曲线。显示的数据是一个代表性实验的平均荧光强度(MFI),如实施例2中所述。该表显示了导致半最大结合(EC50)的抗体浓度(µg/mL)。
图2: 显示了(图2A) IgG1-huCD3的单特异性抗体变体和(图2B)双特异性抗体变体bsIgG1 huCD3xHER2与食蟹猴T细胞系HSC-F的结合曲线。显示的数据是一个代表性实验的平均荧光强度(MFI),如实施例2中所述。
图3: 通过IgG1-huCD3抗体变体的T细胞活化。通过FACS分析测量PBMC培养物中来自人(图3A)和食蟹猴(图3B)起源的T细胞上的CD69表达,如实施例3中所述。这些实验执行两次,并且显示了来自一次实验的代表性结果。
图4: 通过IgG1-huCD3抗体变体诱导的T细胞增殖。人(图4A)或食蟹猴(图4B)PBMC与IgG1-huCD3抗体变体一起温育3天,这之后通过细胞增殖ELISA测量增殖,如实施例4中所述。显示了来自两次独立实验的代表性结果。
图5: 如实施例5中说明的,确定通过具有非活化LFLEDA突变的huCD3抗体变体诱导的人(图5A)和食蟹猴(图5B) T细胞介导的细胞毒性。显示了来自一式两份执行的两次独立实验的代表性结果。
图6: 显示了IgG1-huCD3的非活化、单特异性抗体变体(图6A)和非活化、双特异性抗体变体bsIgG1-huCD3xHER2 (图6B)与人T细胞系Jurkat的结合曲线。显示的数据是一个代表性实验的平均荧光强度(MFI),如实施例2中所述。该表显示了导致半最大结合(EC50)的抗体浓度(µg/mL)。
图7: 显示了IgG1-huCD3的非活化、单特异性抗体变体(图7A)和非活化、双特异性抗体变体bsIgG1-huCD3xHER2 (图7B)与食蟹猴T细胞系HSC-F的结合曲线。显示的数据是一个代表性实验的平均荧光强度(MFI),如实施例2中所述。该表显示了导致半最大结合(EC50)的抗体浓度(µg/mL)。
图8: 通过非活化单特异性IgG1-huCD3(图8A和B)或非活化双特异性bsIgG1-huCD3xHER2抗体变体(图8C和D)的T细胞活化。通过FACS分析测量PBMC培养物中来自人(图8A和C)和食蟹猴(图8B和D)起源的T细胞上的CD69表达,如实施例3中所述。这些实验执行两次,并且显示了来自一次实验的代表性结果。
图9: 通过非活化单特异性IgG1-huCD3(图9A和B) 或非活化双特异性bsIgG1-huCD3xHER2抗体变体(图9C和D)诱导的T细胞增殖。T细胞增殖在人(图9A和C)或食蟹猴(图9B和D) PBMC中进行测量,所述人或食蟹猴PBMC与各种抗体变体一起温育3天,这之后通过细胞增殖ELISA测量增殖,如实施例4中所述。显示了来自两次独立实验的代表性结果。
图10: 如实施例5中说明的,确定通过具有非活化LFLEDA突变的huCD3抗体变体诱导的人(图10A)和食蟹猴(图10B) T细胞介导的细胞毒性。显示了来自一式两份执行的两次独立实验的代表性结果。
图11: 通过IgG1-huCD3抗体变体的恒河猴T细胞活化。通过FACS分析测量PBMC培养物中来自恒河猴起源的T细胞上的CD69表达,如实施例6中所述。
图12: 通过huCLB-T3/4抗体的非活化变体的T细胞活化。IgG1-huCLB-T3/4变体在PBMC上进行滴定。通过FACS分析测量PBMC培养物中的T细胞上的CD69表达,如实施例7中所述。显示了3次实验的代表性例子。
图13:通过huCLB-T3/4抗体的非活化变体的T细胞增殖。PBMC与抗体一起温育三天,这之后通过细胞增殖ELISA测量增殖,如实施例8中所述。显示了来自两次独立实验的代表性结果。
图14: 通过CD3抗体的非活化抗体变体诱导的体外T细胞介导的细胞毒性。如实施例9中说明的,确定通过抗体变体(N297Q、LFLE、LFLENQ、LFLEDA、DANQ、LFLEDANQPS [图14A-G])诱导的T细胞介导的细胞毒性。显示了来自一式两份执行的两次实验的平均值。
图15: 通过非活化huCLB-T3/4变体诱导的体外T细胞介导的细胞毒性。如实施例9中描述的,确定通过抗体变体(LFLEDA LAL [图15A-C]诱导的T细胞介导的细胞毒性。显示了来自一式两份执行的一次实验的平均值。
图16: C1q 与非活化huCLB-T3/4抗体变体的结合的评估。如实施例10中描述的,通过ELISA评估C1q与单特异性IgG1 huCLB-T3/4 (图16A-C)和bsIgG1-huCLB-T3/4xHER2(图B-D)及其非活化抗体变体的结合。曲线图中的结果代表n=2次实验。
图17: 如实施例11中描述的,非活化huCLB-T3/4抗体变体的药物代谢动力学(PK)分析与野生型IgG1-huCLB-T3/4抗体的那种相比较。人IgG1的血浆浓度针对时间进行标绘(图17A)。如实施例11中描述的,计算血浆清除率(图17B)。水平虚线代表SCID小鼠中的人IgG1抗体的平均清除率(10 mL/天/kg)。
图18: 在健康HLA分型供体中的阳性T细胞应答的频率。在增殖和IL-2分泌测定中≥1.9的SI指数视为阳性应答。人源化A33用作临床基准对照抗体,其在临床中显示高水平的免疫原性,并且在EpiScreen测定中常规诱导20-30% T细胞应答。包括KLH应答以检查PBMC质量(在解冻后)。
图19: 根据本发明的人源化CD3抗体的重链(VH)和轻链(VL)可变区的序列比对。
具体实施方式
在一个方面,本发明涉及与人CD3结合的人源化或嵌合抗体,其中所述抗体包含结合区,所述结合区包含分别具有如SEQ ID NO: 1、2和3中所示序列的重链可变(VH)区CDR1、CDR2和CDR3,以及分别具有如SEQ ID NO: 4中所示序列、序列GTN和如SEQ ID NO: 5中所示序列的轻链可变(VL)区CDR1、CDR2和CDR3。
如本文使用的,术语“抗体”意指免疫球蛋白分子、免疫球蛋白分子的片段、或其中任一的衍生物,其具有在通常的生理条件下与抗原特异性结合的能力,具有显著时间段的半衰期,例如至少约30分钟、至少约45分钟、至少约一小时、至少约两小时、至少约四小时、至少约8小时、至少约12小时、约24小时或更多、约48小时或更多、约3、4、5、6、7或更多天等,或任何其他相关的功能限定时期(例如足以诱导、促进、增强和/或调节与抗体和抗原结合相关的生理应答的时间,和/或对于抗体召募效应子活性足够的时间)。与抗原相互作用的结合区(或也可以在本文中使用的结合结构域,两个术语具有相同含义),包含免疫球蛋白分子的重和轻链两者的可变区。抗体(Ab)的恒定区可以介导免疫球蛋白与宿主组织或因子的结合,包括免疫系统的各种细胞(例如效应子细胞和T细胞)和补体系统的组分例如C1q(补体活化的经典途径中的第一种组分)。如上所示,除非上下文另有说明或明确相矛盾,否则如本文使用的术语抗体包括保留与抗原选择性相互作用(例如结合)的能力的抗体片段。已显示抗体的抗原结合功能可以通过全长抗体的片段来执行。在术语“抗体”内涵盖的结合片段的例子包括(i) Fab’或Fab片段,由V
如本文使用的,术语“免疫球蛋白重链”、“免疫球蛋白的重链”或“重链”意指免疫球蛋白链之一。重链通常包含重链可变区(本文缩写为VH)和重链恒定区(本文缩写为CH),其限定免疫球蛋白的同种型。重链恒定区通常包含三个结构域:CH1、CH2和CH3。重链恒定区可以进一步包含铰链区。如本文使用的,术语“免疫球蛋白”意指由两对多肽链组成的一类结构相关的糖蛋白:一对低分子量轻(L)链和一对重(H)链,所有四条链潜在通过二硫键互联。免疫球蛋白的结构已得到充分表征(参见例如[14])。在免疫球蛋白的结构内,两条重链在所谓的“铰链区”中经由二硫键互联。与重链同样地,每条轻链通常包含几个区;轻链可变区(本文缩写为VL)和轻链恒定区(本文缩写为CL)。轻链恒定区通常包含一个结构域:CL。此外,VH和VL区可以进一步再分成也称为互补决定区(CDR)的高变异性区域(或在序列中可以是高变和/或以结构上限定的环的形式的高变区),由称为构架区(FR)的更保守区域间隔。每个VH和VL通常由三个CDR和四个FR组成,从氨基末端到羧基末端以下述次序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4(参见[15])。CDR序列可以通过使用由IMGT [16]-[17]提供的方法确定。
如本文使用的,术语“同种型”指免疫球蛋白类别(例如IgG1、IgG2、IgG3、IgG4、IgD、IgA、IgE或IgM)或其任何同种异型例如IgG1m(za)和IgG1m(f) [SEQ ID NO:15]),其由重链恒定区基因编码。因此,在一个实施方案中,抗体包含IgG1类别的免疫球蛋白或其任何同种异型的重链。进一步地,每个重链同种型可以与kappa (κ)或lambda (λ)轻链组合。
如本文使用的,术语“嵌合抗体”指这样的抗体,其中可变区衍生自非人物种(例如衍生自啮齿类动物),并且恒定区衍生自不同种类例如人。嵌合抗体可以通过抗体工程来生成。“抗体工程”是一般用于不同种类的抗体修饰,且是技术人员众所周知的过程的术语。特别地,嵌合抗体可以通过使用如[18]中所述的标准DNA技术来生成。因此,嵌合抗体可以是遗传或酶促改造的重组抗体。生成嵌合抗体在技术人员的知识内,并且因此根据本发明的嵌合抗体的生成可以通过除本文描述外的其他方法来执行。用于治疗应用的嵌合单克隆抗体开发用于减少抗体免疫原性。它们通常可以含有对于目的抗原特异性的非人(例如鼠)可变区,以及人恒定抗体重和轻链结构域。如嵌合抗体背景下使用的术语“可变区”或“可变结构域”指包含免疫球蛋白的重和轻链两者的CDR和构架区的区域。
如本文使用的,术语“人源化抗体”指遗传改造的非人抗体,其含有人抗体恒定结构域和非人可变结构域,其经修饰为含有与人可变结构域高水平的序列同源性。这可以通过六个非人抗体互补决定区(CDR)的移植来实现,其共同形成在同源人受体构架区(FR)上的抗原结合位点(参见[19]-[20])。为了完全重构亲本抗体的结合亲和力和特异性,可能需要将来自亲本抗体(即非人抗体)的构架残基置换到人构架区内(回复突变)。结构同源性建模可以帮助鉴定构架区中的氨基酸残基,其对于抗体的结合特性是重要的。因此,人源化抗体可以包含非人CDR序列,主要是人构架区,任选包含对非人氨基酸序列的一种或多种氨基酸回复突变,以及全人恒定区。任选地,可以应用不一定是回复突变的另外的氨基酸修饰,以获得具有优选特征例如亲和力和生物化学特性的人源化抗体。
根据本发明的任何方面或实施方案的人源化或嵌合抗体可以被称为“人源化或嵌合CD3抗体”、“本发明的人源化或嵌合抗体”、“CD3抗体”或“本发明的CD3抗体”,其均具有相同含义和用途,除非上下文另有矛盾。
非人起源的抗体的氨基酸序列不同于人起源的抗体,并且因此当施用于人患者时,非人抗体是潜在免疫原性的。然而,尽管抗体的非人起源,但它的CDR区段负责抗体与其靶抗原结合的能力,并且人源化旨在维持抗体的特异性和结合亲和力。因此,执行非人治疗抗体的人源化,以使其在人中的免疫原性降到最低,同时此类人源化抗体维持非人起源的抗体的特异性和结合亲和力。
如本文使用的,术语“结合区”指能够与例如细胞、细菌或病毒粒子上存在的任何分子例如多肽结合的抗体区。
如本文使用的,术语“结合”指抗体与预定抗原或靶的结合,当使用抗原作为配体且使用抗体作为分析物,通过例如BIAcore 3000仪器中的表面等离子体共振(SPR)技术确定时,与所述预定抗原或靶的结合通常具有对应于下述K
如本文使用的,术语“人CD3”指人分化簇3蛋白质,其为T细胞共受体蛋白质复合物的部分,并且由四条不同链组成。CD3还在其他物种中发现,并且因此,术语“CD3”可以在本文中使用,并且并不限于人CD3,除非与上下文相矛盾。在哺乳动物中,复合物含有CD3γ(gamma)链(人CD3γ链Swissprot P09693、或食蟹猴CD3γ Swissprot Q95LI7)、CD3δ(delta)链(人CD3δ Swissprot P04234、或食蟹猴CD3δ Swissprot Q95LI8)、两条CD3ε(epsilon)链(人CD3ε Swissprot P07766; 或食蟹猴CD3ε Swissprot Q95LI5)、恒河猴CD3ε (Swissprot G7NCB9)、和CD3ζ-链 (zeta)链(人CD3ζ Swissprot P20963、食蟹猴CD3ζSwissprot Q09TK0)。这些链与称为T细胞受体(TCR)的分子结合,并且在T淋巴细胞中生成活化信号。TCR和CD3分子一起包含TCR复合物。
作为Swissprot编号提及的氨基酸序列包括在蛋白质翻译后去除的信号肽,这在技术人员的知识内。因此,细胞表面上存在的蛋白质例如CD3不包括信号肽。特别地,表1中列出的氨基酸序列不含此类信号肽。如表1中列出的此类蛋白质可以称为“成熟蛋白质”。因此,SEQ ID NO:14显示了成熟人CD3δ (delta)的氨基酸序列,SEQ ID NO:13显示了成熟人CD3ε (epsilon)的氨基酸序列,SEQ ID NO:21显示了成熟食蟹猴CD3ε的氨基酸序列,并且SEQ ID NO:23显示了成熟恒河猴CD3ε的氨基酸序列。因此,如本文使用的,术语“成熟的”指不含任何信号或前导序列的蛋白质。
众所周知信号肽序列同源性、长度和切割位点位置在不同蛋白质之间显著改变。信号肽可以通过不同方法确定,例如本发明的SEQ ID NO:13已根据SignalP应用程序(在http://www.cbs.dtu.dk/services/SignalP/上可获得)确定。
在一个特别的实施方案中,本发明的人源化或嵌合抗体结合CD3的ε链,例如人CD3的ε链(SEQ ID NO:13)。在还另一个特别的实施方案中,人源化或嵌合抗体结合人CD3ε(epsilon) (SEQ ID NO:13)的N末端部分的氨基酸1-27内的表位。在此类特别的实施方案中,抗体可以甚至进一步与其他非人灵长类动物物种交叉反应,所述物种例如食蟹猴(食蟹猴CD3εSEQ ID NO:21)和/或恒河猴(恒河猴CD3εSEQ ID NO:23)。
如本文使用的,术语“交叉反应”指抗体例如根据本发明的人源化或嵌合抗体结合其在不同物种上的靶的能力。特别地,在本文描述的实例中例示的人源化CD3抗体具有结合人(实施例2)、食蟹猴(实施例2)和恒河猴CD3的能力。
包含如本文定义的CDR序列、进一步包含构架区的根据本发明的抗体可以在CDR序列外的序列中不同,但仍保留与原始抗体相比较的完全结合能力。因此,本发明还涉及包含与本文描述的任何序列具有一定序列同一性的可变区的氨基酸序列的抗体。
如在本文的上下文中使用的,术语“序列同一性”指考虑到对于两个序列的最佳比对需要引入的缺口数目和每个缺口的长度,根据由序列共享的相同位置数目,在两个序列之间的同一性百分比(即,同源性% = 相同位置#/总位置# x 100)。两个核苷酸或氨基酸序列之间的同一性百分比可以例如使用E. Meyers和W. Miller [21]的算法确定。另外,两个氨基酸序列之间的同一性百分比可以使用Needleman和Wunsch算法[22]确定。多重比对优选使用Clustal W算法[23](如例如Vector NTI Advance®软件版本11.5; InvitrogenInc.中使用的) 来执行。
因此,在一个实施方案中,VH区与如选自下述的VH序列中所示的至少一种氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性:
a)如SEQ ID NO:6中所示的VH序列;
b)如SEQ ID NO:8中所示的VH序列;
c)如SEQ ID NO:7中所示的VH序列;和
d)如SEQ ID NO:9中所示的VH序列。
在一个特别的实施方案中,VH区与如选自下述的VH序列中所示的至少一种氨基酸序列具有至少96%氨基酸序列同一性:
a)如SEQ ID NO:6中所示的VH序列;
b)如SEQ ID NO:8中所示的VH序列;
c)如SEQ ID NO:7中所示的VH序列;和
d)如SEQ ID NO:9中所示的VH序列。
在一个实施方案中,VL区与如选自下述的VL序列中所示的至少一种氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性:
a)如SEQ ID NO:10中所示的VL序列;
b)如SEQ ID NO:11中所示的VL序列;和
c)如SEQ ID NO:12中所示的VL序列。
在一个特别的实施方案中,VL区与如选自下述的VL序列中所示的至少一种氨基酸序列具有至少95%氨基酸序列同一性:
a)如SEQ ID NO:10中所示的VL序列;
b)如SEQ ID NO:11中所示的VL序列;和
c)如SEQ ID NO:12中所示的VL序列。
在一个实施方案中,VH区选自:
a)如SEQ ID NO:6中所示的VH序列;
b)如SEQ ID NO:8中所示的VH序列;
c)如SEQ ID NO:7中所示的VH序列;和
d)如SEQ ID NO:9中所示的VH序列。
在一个实施方案中,VL区选自:
a)如SEQ ID NO:10中所示的VL序列;
b)如SEQ ID NO:11中所示的VL序列;和
c)如SEQ ID NO:12中所示的VL序列。
在一个实施方案中,VH或VL序列中仅一种与本文公开的序列之一100%等同,而另一种可以与本文公开的序列之一具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性的序列同一性。
在一个特别的实施方案中,VH区与如选自下述的VH序列中所示的至少一种氨基酸序列具有至少97%氨基酸序列同一性:
a)如SEQ ID NO:6中所示的VH序列;
b)如SEQ ID NO:7中所示的VH序列;
c)如SEQ ID NO:8中所示的VH序列;和
d)如SEQ ID NO:9中所示的VH序列;
并且VL序列与如选自下述的VL序列中所示的至少一种氨基酸序列具有至少95%氨基酸序列同一性:
i. 如SEQ ID NO:10中所示的VL序列;
ii. 如SEQ ID NO:11中所示的VL序列;和
iii. 如SEQ ID NO:12中所示的VL序列。
在一个实施方案中,VH和VL序列选自下述:
a)分别与SEQ ID NO:6和10;7和10;8和10; 9和10; 6和11; 7和11; 8和11; 9和11; 6和12; 7和12; 8和12;和9和12中所示的序列具有至少90%同一性的VH和VL序列;
b)分别与SEQ ID NO:6和10;7和10;8和10; 9和10; 6和11; 7和11; 8和11; 9和11; 6和12; 7和12; 8和12;和9和12中所示的序列具有至少95%同一性的VH和VL序列;
c) 分别与SEQ ID NO:6和10;7和10;8和10; 9和10; 6和11; 7和11; 8和11; 9和11; 6和12; 7和12; 8和12;和9和12中所示的序列具有至少97%同一性的VH和VL序列;
d) 分别与SEQ ID NO:6和10;7和10;8和10; 9和10; 6和11; 7和11; 8和11; 9和11; 6和12; 7和12; 8和12;和9和12中所示的序列具有至少99%同一性的VH和VL序列;
e) 分别与SEQ ID NO:6和10;7和10;8和10; 9和10; 6和11; 7和11; 8和11; 9和11; 6和12; 7和12; 8和12;和9和12中所示的序列具有至少100%同一性的VH和VL序列;
f)与SEQ ID NO:6中所示的序列具有至少90%同一性的VH序列,以及与SEQ ID NO:10、11或12中所示的序列具有至少95%同一性的VL序列;
g) 与SEQ ID NO:6中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
h) 与SEQ ID NO:6中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
i) 与SEQ ID NO:6中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
j) 与SEQ ID NO:6中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
k) 与SEQ ID NO:6中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
l) 与SEQ ID NO:6中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
m) 与SEQ ID NO:6中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
n) 与SEQ ID NO:6中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
o) 与SEQ ID NO:6中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
p) 与SEQ ID NO:6中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
q) 与SEQ ID NO:6中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
r) 与SEQ ID NO:6中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
s) 与SEQ ID NO:6中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
t) 与SEQ ID NO:6中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
u) 与SEQ ID NO:6中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
v) 与SEQ ID NO:6中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
x) 与SEQ ID NO:6中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
y) 与SEQ ID NO:6中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
z) 与SEQ ID NO:6中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
aa) 与SEQ ID NO:7中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
ab)与SEQ ID NO:7中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
ac) 与SEQ ID NO:7中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
ad) 与SEQ ID NO:7中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
ae) 与SEQ ID NO:7中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
af) 与SEQ ID NO:7中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
ag) 与SEQ ID NO:7中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
ah) 与SEQ ID NO:7中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
ai) 与SEQ ID NO:7中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
aj) 与SEQ ID NO:7中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
ak) 与SEQ ID NO:7中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
al) 与SEQ ID NO:7中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
am) 与SEQ ID NO:7中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
an) 与SEQ ID NO:7中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
ao) 与SEQ ID NO:7中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
ap) 与SEQ ID NO:7中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
aq) 与SEQ ID NO:7中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
ar) 与SEQ ID NO:7中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
as) 与SEQ ID NO:7中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
at) 与SEQ ID NO:7中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
ba) 与SEQ ID NO:8中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
bb)与SEQ ID NO:8中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
bc) 与SEQ ID NO:8中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
bd) 与SEQ ID NO:8中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
be) 与SEQ ID NO:8中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
bf) 与SEQ ID NO:8中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
bg) 与SEQ ID NO:8中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
bh) 与SEQ ID NO:8中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
bi) 与SEQ ID NO:8中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
bj) 与SEQ ID NO:8中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
bk) 与SEQ ID NO:8中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
bl) 与SEQ ID NO:8中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
bm) 与SEQ ID NO:8中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
bn) 与SEQ ID NO:8中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
bo) 与SEQ ID NO:8中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
bp) 与SEQ ID NO:8中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
bq) 与SEQ ID NO:8中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
br) 与SEQ ID NO:8中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
bs) 与SEQ ID NO:8中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
bt) 与SEQ ID NO:8中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
ca) 与SEQ ID NO:8中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
cb)与SEQ ID NO:9中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
cc) 与SEQ ID NO:9中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
cd) 与SEQ ID NO:9中所示的序列具有至少90%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
ce) 与SEQ ID NO:9中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
cf) 与SEQ ID NO:9中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
cg) 与SEQ ID NO:9中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
ch) 与SEQ ID NO:9中所示的序列具有至少95%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
ci) 与SEQ ID NO:9中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
cj) 与SEQ ID NO:9中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
ck) 与SEQ ID NO:9中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
cl) 与SEQ ID NO:9中所示的序列具有至少97%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
cm) 与SEQ ID NO:9中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
cn) 与SEQ ID NO:9中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
co) 与SEQ ID NO:9中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
cp) 与SEQ ID NO:9中所示的序列具有至少99%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少100%同一性的VL序列;
cq) 与SEQ ID NO:9中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少90%同一性的VL序列;
cr) 与SEQ ID NO:9中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少95%同一性的VL序列;
cs) 与SEQ ID NO:9中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少97%同一性的VL序列;
ct) 与SEQ ID NO:9中所示的序列具有至少100%同一性的VH序列,以及与SEQ IDNO:10、11或12中所示的序列具有至少99%同一性的VL序列;
在一个实施方案中,结合区包含选自下述的VH和VL:
a)如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;
b) 如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;
c) 如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;
d) 如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:11中所示的VL序列;
e) 如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;
f) 如SEQ ID NO:7中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;
g) 如SEQ ID NO:7中所示的VH序列,以及如SEQ ID NO:11中所示的VL序列;
h) 如SEQ ID NO:7中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;
i) 如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:11中所示的VL序列;
j) 如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;
k) 如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:11中所示的VL序列;和
l) 如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列。
在一个特别的实施方案中,结合区包含选自下述的VH序列和VL序列:
a)如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;
b) 如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;和
c) 如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列。
根据本发明的人源化抗体可以通过针对人种系可变区序列的数据库比较重和轻链可变区氨基酸序列来生成,以便鉴定具有合适同源性程度的用作人可变构架区的重和轻链人序列。一系列人源化重和轻链可变区可以通过下述进行设计:将例如鼠CDR移植到构架区(如上所述鉴定),并且需要时,通过回复突变(构架区中的人氨基酸残基中的一个或多个在特定位置处回复突变为非人氨基酸)为鉴定的残基的特异性鼠序列,其对于抗体结合效率的恢复可能是关键的。如通过应用在计算机芯片上的技术;iTope
此外,根据本发明的人源化抗体还可以是“去免疫化的”。去免疫化可以是希望的,因为在蛋白质序列内,例如根据本发明的人源化抗体,人T细胞表位的存在可以增加免疫原性危险概况,因为它们具有活化辅助T细胞的潜力。辅助T细胞的此类活化可以通过去免疫化得到避免。去免疫化可以通过将突变引入人源化抗体的氨基酸序列内来执行,以去除T细胞表位而不显著减少抗体的抗体亲和力。
因此,在本发明的一个实施方案中,人源化抗体可以通过包括下述步骤的方法产生:(i)比较非人完全可变重链序列和/或完全可变轻链序列与人种系序列的数据库,(ii)选择与非人序列具有最高同源性的人种系序列,以获得人源化序列,(iii)需要时,通过回复突变优化人源化序列,和(iv)在合适的表达系统中表达序列。
因此,根据本发明的全长抗体可以通过包括下述步骤的方法产生:(i)比较非人可变重链序列和可变轻链序列与人种系序列的数据库,(ii)选择与非人序列具有最高同源性的人种系序列,(iii)将非人CDR移植到所选人种系内,以获得人源化序列,(iv)需要时,通过回复突变优化人源化序列,(v)鉴定恒定重和轻链序列,和(vi)在合适的表达系统中表达完全重链序列和完全轻链序列。根据本发明的全长抗体因此可以如实施例1中所述产生。从CDR序列或完全可变区序列开始产生全长抗体在技术人员的知识内。因此,技术人员将知道如何生成根据本发明的全长抗体。
如本文使用的,术语“完全重链序列”指由可变重链和恒定重链序列组成的序列。
如本文使用的,术语“完全轻链序列”指由可变轻链和恒定轻链序列组成的序列。
回复突变可以通过标准DNA诱变而引入。用于DNA诱变的此类标准技术在[18]中描述。可选地,商购可得的试剂盒例如Quickchange
因此,在一个实施方案中,抗体是人源化抗体。
嵌合抗体可以通过用人起源的恒定区序列置换非人(例如鼠)抗体的所有恒定区序列来生成。因此,完全非人可变区序列在嵌合抗体中得到维持。因此,根据本发明的嵌合抗体可以通过包括下述步骤的方法产生:在合适的表达系统中表达非人可变重链(SEQ IDNO:27)、非人可变轻链序列(SEQ ID NO:28)、人恒定重链和人恒定轻链序列,并且从而生成全长嵌合抗体。可以使用可选方法。产生嵌合抗体的此类方法在技术人员的知识内,并且因此技术人员将知道如何产生根据本发明的嵌合抗体。
因此,在一个实施方案中,抗体是嵌合抗体。
在一个实施方案中,抗体是全长抗体。如本文使用的,术语“全长抗体”指这样的抗体(例如亲本或变体抗体),其含有的所有重和轻链恒定和可变结构域对应于在该同种型的野生型抗体中通常发现的那些。
在一个实施方案中,抗体包括包含第一和第二免疫球蛋白重链的Fc区。
如本文使用的,术语“Fc区”指在从N末端到C末端的方向上包含至少铰链区、CH2区和CH3区的区域。Fc区可以进一步包含在铰链区的N末端处的CH1区。
如本文使用的,术语“铰链区”指免疫球蛋白重链的铰链区。因此,例如,人IgG1抗体的铰链区对应于根据如Kabat中所示的Eu编号的氨基酸216-230。
除非上下文另有说明或相矛盾,否则恒定区序列的氨基酸在本文中根据Eu编号指数(在[27]中描述)进行编号,并且可以被称为“根据如Kabat中所示的Eu编号”、“根据Kabat的Eu编号”、或“根据Eu编号系统”。
如本文使用的,术语“CH1区”或“CH1结构域”指免疫球蛋白重链的CH1区。因此,例如人IgG1抗体的CH1区对应于根据Eu编号系统的氨基酸118-215。然而,CH1区还可以具有如本文描述的其他亚型中的任一种。
如本文使用的,术语“CH2区”或“CH2结构域”指免疫球蛋白重链的CH2区。因此,例如人IgG1抗体的CH2区对应于根据Eu编号系统的氨基酸231-340。然而,CH2区还可以具有如本文描述的其他亚型中的任一种。
如本文使用的,术语“CH3区”或“CH3结构域”指免疫球蛋白重链的CH3区。因此,例如人IgG1抗体的CH3区对应于根据Eu编号系统的氨基酸341-447。然而,CH3区还可以具有如本文描述的其他亚型中的任一种。
在一个实施方案中,免疫球蛋白重链的同种型选自IgG1、IgG2、IgG3和IgG4。免疫球蛋白重链可以是在免疫球蛋白类别各自内的任何同种异型,例如IgG1m(f) (SEQ ID NO:15)。因此,在一个特别的实施方案中,免疫球蛋白重链的同种型是IgG1或其任何同种异型,例如IgG1m(f) (SEQ ID NO:15)。
当靶向其为T细胞受体(TCR)的部分的抗原CD3时,细胞杀伤的T细胞特异性机制是期望的。其他效应子功能例如补体活化可以是不希望的,并且因此效应子功能的减少是期望的。C1q结合是补体级联中的第一步,并且因此充当抗体的补体依赖性细胞毒性(CDC)能力的指示剂。如果可以避免C1q与抗体的结合,则同样可以避免补体级联的活化。
因此,在一个实施方案中,抗体包含已这样进行修饰的Fc区,使得与野生型抗体相比较,C1q与所述抗体的结合减少至少70%、至少80%、至少90%、至少95%、至少97%、至少99%或100%,其中C1q结合通过ELISA确定。
如本文使用的,术语“经修饰的”指Fc区的氨基酸序列不等同于野生型Fc区的氨基酸序列。即,野生型Fc区的特异性位置中的氨基酸残基已进行置换、缺失或插入,以便改变例如关于C1q的结合位点、关于其他效应分子的结合位点或与Fc受体(FcR)的结合。氨基酸序列的此类修饰可以通过用保守氨基酸置换一个或多个氨基酸进行制备,或可以通过用可选氨基酸置换一个或多个氨基酸进行制备,所述可选氨基酸在物理上和/或功能上类似于野生型中存在的氨基酸。置换还可以通过用非保守氨基酸置换进行制备。
在本发明的上下文中,氨基酸可以描述为保守或非保守氨基酸,并且因此可以因此进行分类。氨基酸残基还可以分成通过可选物理和功能特性限定的类别。因此,氨基酸类别可以在下表中的一个或两个中反映:
保守种类的氨基酸残基
氨基酸残基的可选物理和功能分类
在本发明的上下文中,抗体例如人源化或嵌合抗体中的置换如下所示:
原始氨基酸 - 位置 - 置换的氨基酸;
提及公认的氨基酸命名,使用三字母代码或单字母代码,包括代码Xaa和X以指示任何氨基酸残基。因此,表示法“L234F”或“Leu234Phe”意指抗体包含在氨基酸位置234中的亮氨酸由苯丙氨酸的置换。
在给定位置处的氨基酸置换为任何其他氨基酸被称为:
原始氨基酸 - 位置;或例如“L234”。
对于其中原始氨基酸和/或置换的氨基酸可以包含多于一个,但并非全部氨基酸的修饰,多于一个氨基酸可以通过“,”或“/”分开。例如,在位置234中的亮氨酸置换为苯丙氨酸、精氨酸、亮氨酸或色氨酸为:
“Leu234Phe,Arg,Lys,Trp”或“Leu234Phe/Arg/Lys/Trp”或“L234F,R,K,W”或“L234F/R/K/W”或“L234至F, R, K或W”。
此类指定可以在本发明的上下文中互换使用,但具有相同含义和目的。
此外,术语“置换”包含置换成另外十九种天然氨基酸中的任何一种,或其他氨基酸例如非天然氨基酸。例如,在位置234中的氨基酸L的置换包括下述置换中的每种:234A、234C、234D、234E、234F、234G、234H、234I、234K、234M、234N、234Q、234R、234S、234T、234V、234W、234P和234Y。这例如等价于指定234X,其中X指定除原始氨基酸外的任何氨基酸。这些置换还可以指定为L234A、L234C等,或L234A,C等,或L234A/C/等。这同样类推应用于本文提及的每个和每一个位置,以在本文中具体包括此类置换中的任何一种。
根据本发明的抗体还可以包含氨基酸残基的缺失。此类缺失可以指示为“del”,并且包括例如书写为L234del。因此,在此类实施方案中,在位置234中的亮氨酸已从氨基酸序列中缺失。
术语“氨基酸”和“氨基酸残基”在本文中可以互换使用。
如本文使用的,当所述抗体与其抗原结合时,术语“C1q结合”指C1q与抗体的结合。如本文使用的,术语“与其抗原结合”指抗体在体内和体外与其抗原的结合。
如本文使用的,当提及C1q结合时,术语“减少”指当与C1q和野生型抗体的结合相比较时,根据本发明的抗体减少、最小化或甚至完全抑制C1q与抗体结合的能力。
如本文使用的,与根据本发明的抗体在比较测定中的使用相关,术语“野生型抗体”指这样的抗体,其等同于待测试的抗体,除了并非惰性的之外。在该上下文中,术语“惰性”指如实施例10中确定的,具有减少的或无C1q结合的经修饰的Fc区,即其中C1q结合通过ELISA确定;如实施例4中所述确定的,减少的或无Fc介导的T细胞增殖(即T细胞增殖)在基于外周血单核细胞(PBMC)的功能测定中进行测量;和/或如实施例3中所述确定的,减少的或无Fc介导的CD69表达(即Fc介导的CD69表达)在基于PBMC的功能测定中确定。因此,野生型抗体包含在免疫球蛋白重链中的天然存在的氨基酸,即不含任何氨基酸修饰的抗体,所述氨基酸修饰可能改变或减少抗体与例如C1q、Fc受体等等相互作用的能力。因此,此类野生型抗体保持为活化抗体,其能够结合例如C1q。野生型抗体和本发明的抗体可以包含除影响抗体诱导效应子功能的能力的那些外的其他氨基酸修饰,以便使得抗体成为双特异性抗体等等。
如本文使用的,术语“ELISA”指酶联免疫吸附测定,其是使用抗体和变色来鉴定物质的测试。第一特异性抗体附着至板表面。由此加入来自样品的蛋白质,其中测试与所述第一特异性抗体的结合。加入结合来自样品的抗体的第二抗体。第二抗体与酶连接,并且在最终步骤中,加入含有酶的底物的物质。后续反应产生可检测信号,最通常为底物中的变色。ELISA方法的概念是本领域众所周知的,并且执行ELISA的各种方法考虑为评估根据本发明的抗体的方法的部分。因此,这种解释不应理解为限制性的,因为可以例如实施例4中所述执行各种形式的ELISA。
具体地,根据本发明的抗体结合C1q的能力可以通过ELISA确定,所述ELISA包括下述步骤:(i)将所述抗体包被到96孔板上,(ii)加入3%血清,(iii)加入抗人C1q抗体,(iv)使板显色,和(v)测量OD
如本文使用的,术语“Fc受体”或“FcR”指在某些细胞的表面上发现的蛋白质。FcR与抗体的Fc区结合。存在几种不同类型的FcR,其基于它们识别的抗体类型进行分类。例如,Fcγ (gamma)受体与IgG类的抗体结合。
如本文使用的,术语“Fcγ受体”、“ Fc gamma受体”或“FcγR”指属于免疫球蛋白超家族的一组Fc受体,并且是用于诱导受调理作用(包被的)微生物的吞噬作用最重要的Fc受体。该家族包括几个成员:FcγRI (CD64)、FcγRIIa (CD32a)、FcγRIIb (CD32b)、FcγRIIIa (CD16a)、FcγRIIIb (CD16b) ,由于其不同的分子结构,所述成员在其抗体亲和力中不同。
Fc介导的效应子功能形成人免疫球蛋白G (IgG)分子的部分生物活性。此类效应子功能的例子包括例如抗体依赖性细胞介导的细胞毒性(ADCC)和补体依赖性细胞毒性(CDC),其通过各种效应分子与Fc区的结合得到触发。在本发明的上下文中,“Fc结合”、“Fc受体结合”、“FcR结合”和“抗体Fc区与FcR的结合”指Fc区与Fc受体(FcR)或效应分子的结合。术语“FcγR结合”和“FcγRI结合”指Fc区分别与Fc gamma受体和Fc gamma受体I的结合。当CD3抗体结合T细胞时,CD3抗体的野生型Fc区与其他细胞例如单核细胞上存在的FcR结合,这导致非特异性、Fc介导的T细胞活化。此类非特异性、Fc介导的T细胞活化可能是不希望的。T细胞还可以通过靶向或靶特异性T细胞活化进行活化。此类靶向T细胞活化可能对于一系列适应症例如癌症的治疗是高度期望的。如本文使用的,术语“靶向T细胞活化”指通过使用双特异性抗体将T细胞导向特异性细胞例如肿瘤细胞,所述双特异性抗体包含结合特异性靶例如肿瘤细胞上的肿瘤靶的第一结合区,以及结合T细胞特异性靶例如CD3的第二结合区。因此,T细胞对特异性细胞例如肿瘤细胞的靶向可以通过使用双特异性抗体得到促进,其中结合区之一结合T细胞上存在的CD3,并且另一结合区结合例如肿瘤细胞上的靶特异性抗原。尽管非特异性Fc介导的T细胞活化可能仍是可能的,并且因此此类不希望的经由Fc介导的交联的非特异性Fc介导的T细胞活化应得到避免,并且可以通过使得Fc区对于此类活性惰性而丧失能力。由此,所述惰性Fc区与Fc受体之间的相互作用得到预防。当在几种不同测定中进行测试时,即参见实施例3 - 5,本发明的人源化抗体已证明为惰性的。当在不同测定中进行测试时,即参见实施例7 - 10,包含Fc区中的氨基酸修饰的另一种测试的CD3抗体huCLB-T3/4也证明为惰性的。如实施例中所述,包含氨基酸置换L234F、L235E和D265A的根据本发明的人源化CD3抗体,显示在T细胞上低水平的CD69表达(实施例3),Fc介导的T细胞增殖的取消(实施例4),以及当以双特异性抗体的形式时的非特异性靶杀伤(实施例5)。因此,当与野生型抗体相比较时,本发明的人源化抗体在几种测定中显示优良结果。
根据本发明的抗体可以包含在Fc区中的修饰。当抗体包含此类修饰时,它可以变成惰性或非活化抗体。如本文使用的,术语“惰性”、“惰性的”或“非活化的”指Fc区,其至少不能结合任何Fcγ受体,诱导Fc介导的FcR交联,或诱导FcR介导的经由个别抗体的两个Fc区的靶抗原交联,或不能结合C1q。使用以单特异性形式的抗体,有利地测试人源化或嵌合CD3抗体的Fc区的惰性,尽管如此鉴定的惰性Fc区可以用于双特异性或者其他人源化或嵌合多特异性CD3抗体中。
可以构建几种变体以使得抗体的Fc区对于与Fc gamma受体和C1q的相互作用无活性,用于治疗抗体开发。此类变体的例子在本文中得到描述。
因此,在一个实施方案中,抗体包含已这样进行修饰的Fc区,使得与野生型抗体相比较,所述抗体介导的减少的Fc介导的T细胞增殖减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T细胞增殖在基于外周血单核细胞(PBMC)的功能测定中进行测量。
如本文使用的,术语“减少”指与对照蛋白质例如抗体相比较时的活性或表达减少。特别地,当提及T细胞增殖时,术语“减少”指当与由野生型抗体结合的T细胞增殖相比较时,根据本发明的抗体减少、最小化或甚至完全抑制T细胞增殖的能力。抗体减少T细胞增殖的能力可以通过基于PBMC的功能测定进行评估,如实施例4和实施例8中所述。在一个实施方案中,测定用人PBMC执行。在另一个实施方案中,测定用食蟹猴PBMC执行。在还另一个实施方案中,测定用恒河猴PBMC执行。因为根据本发明的抗体是交叉反应性的,所以可以用任何物种PBMC来执行如本文描述的基于PBMC的测定,以显示T细胞增殖的减少,只要使用的物种PBMC在抗体的交叉反应性谱内,例如人、食蟹猴或恒河猴。
如本文使用的,术语“基于外周血单核细胞(PBMC)的功能测定”指用于评估本发明的抗体的功能特点,例如所述抗体影响T细胞增殖或CD69表达的能力的测定,其中存在的唯一细胞是外周血单核细胞。因此,在一个实施方案中,T细胞增殖通过包括下述步骤的方法进行测量:使PBMC与1-1000 ng/mL范围内的抗体在37℃下在5% (体积/体积) CO
如本文使用的,术语“增殖”指在细胞分裂背景下的细胞生长。
如本文使用的,术语“BrdU”指5-溴-2'-脱氧尿苷,其是胸苷的同系物。当BrdU加入细胞培养物中有限时间段(例如4小时)时,它将掺入增殖细胞的DNA内。在固定细胞后,可以使用抗BrdU过氧化物酶在ELISA中执行掺入的BrdU的检测。BrdU掺入因此是增殖的量度。
在一个实施方案中,抗体包含已这样进行修饰的Fc区,使得当与野生型抗体相比较时,所述抗体使Fc介导的CD69表达减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc介导的CD69表达在基于PBMC的功能测定中确定。
如本文使用的,术语“减少”指与对照蛋白质例如抗体相比较时的活性或表达减少。特别地,当提及T细胞活化标记物CD69的表达水平时,术语“减少”指当与T细胞由野生型抗体结合时的CD69表达水平相比较时,CD69表达水平中的减少,条件是抗体的两个结合区均结合CD3。抗体减少CD69表达的能力可以通过基于PBMC的功能测定进行评估,如实施例3和实施例7中所述。因此,在一个实施方案中,CD69的表达通过包括下述步骤的方法进行测量:使PBMC与1-1000 ng/mL范围内的抗体在37℃下在5% (体积/体积) CO
如本文使用的,术语“CD69”指分化簇69,其为由
如本文使用的,术语“基于外周血单核细胞(PBMC)的功能测定”指用于评估本发明的抗体的功能特点的测定,例如所述抗体影响T细胞增殖或CD69表达的能力,其中存在的唯一细胞是外周血单核细胞。如实施例3、4、5和7中所述,基于PBMC的功能测定包括下述步骤:(i)使PBMC与抗体在37℃下在5% (体积/体积) CO
因此,在与C1q和Fc Gamma受体的相互作用中起显著作用的Fc区中的氨基酸可以是经修饰的。可以进行修饰的氨基酸位置的例子包括L234、L235和P331。其组合例如L234F/L235E/P331S可以引起与人CD64、CD32A、CD16和C1q的结合中的显著减少。
因此,在一个实施方案中,在对应于L234、L235和P331的至少一个位置中的氨基酸可以分别是A、A和S([1]、[28])。L234F和L235E氨基酸置换还可以导致Fc区与Fc Gamma受体和C1q的相互作用取消 ([29]-[30])。因此,在一个实施方案中,对应于L234和L235的位置中的氨基酸可以分别是F和E。D265A氨基酸置换可以减少与所有Fc gamma受体的结合,并且阻止ADCC ([31])。因此,在一个实施方案中,对应于D265的位置中的氨基酸可以是A。与C1q的结合可以通过使位置D270、K322、P329和P331突变得到取消。使这些位置突变为D270A或K322A或P329A或P331A可以使得抗体在CDC活性中缺陷([32])。因此,在一个实施方案中,在对应于D270、K322、P329和P331的至少一个位置中的氨基酸可以分别是A、A、A和A。
最小化Fc区与Fc gamma受体和C1q的相互作用的可选方法是通过去除抗体的糖基化位点。使位置N297突变为例如Q、A和E去除对于IgG-Fc gamma受体相互作用关键的糖基化位点。因此,在一个实施方案中,在对应于N297的位置中的氨基酸可以是G、Q、A或E ([33])。最小化Fc区与Fc gamma受体的相互作用的另一种可选方法可以通过下述突变来获得:P238A、A327Q、P329A或E233P/L234V/L235A/G236del ([31])。
可选地,尽管与Fcγ受体(Fc gamma受体)的相互作用得到报道([34]-[35]),人IgG2和IgG4亚类被视为在其与C1q和Fc gamma受体的相互作用中天然妥协的。取消这些残留相互作用的突变可以在两个同种型中进行制备,导致与FcR结合相关的不期望的副作用的减少。对于IgG2,这些包括L234A和G237A,并且对于IgG4,这些包括L235E。因此,在一个实施方案中,在人IgG2重链中对应于L234和G237的位置中的氨基酸可以分别是A和A。在一个实施方案中,在人IgG4重链中对应于L235的位置中的氨基酸可以是E。
进一步最小化IgG2抗体中与Fc gamma受体和C1q的相互作用的其他方法包括[36]和[37]中描述的那些。
抗体的铰链区还可以具有就与Fc gamma受体和补体相互作用而言的重要性([38]-[39])。因此,铰链区中的突变或缺失可以影响抗体的效应子功能。
如本文使用的,术语“交联”指经由与抗体Fc区的结合,通过荷有FcR的细胞与靶抗原结合的抗体Fab臂(单价或二价)的间接桥接。因此,结合其荷有靶抗原的细胞上的靶抗原的抗体可以与表达FcR的另一种细胞交联。
如本文使用的,术语“非特异性杀伤”指经由所述细胞的肿瘤靶抗原不依赖性活化,通过T细胞或其他效应细胞的细胞毒性功能的细胞杀伤。因此,非特异性杀伤意指荷有肿瘤靶的细胞可以通过例如细胞毒性T细胞杀伤,而不是抗体通过例如诱导CDC来结合肿瘤靶。
本发明人已显示(参见实施例3 - 5、7 - 10):非活化Fc区可以通过修饰Fc区中的至少五个特异性氨基酸位置中的一个或多个来获得。
因此,在一个实施方案中,抗体包含第一和第二免疫球蛋白重链,其中在所述第一和第二免疫球蛋白重链的至少一条中,对应于人IgG1重链中的位置L234、L235、D265、N297和P331的位置中的一个或多个氨基酸分别地不是L、L、D、N和P。
在一个实施方案中,在第一和第二免疫球蛋白重链两者中,对应于人IgG1重链中的位置L234、L235、D265、N297和P331的位置中的一个或多个氨基酸分别地不是L、L、D、N和P。
在另一个实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的一个或多个氨基酸分别地不是L、L和D,并且对应于人IgG1重链中的N297和P331的位置中的氨基酸分别是N和P。
如本文使用的,术语“对应于位置的氨基酸”指人IgG1重链中的氨基酸位置编号。除非上下文另有说明或相矛盾,否则恒定区序列的氨基酸在本文中根据Eu编号指数(在[27]中描述) 进行编号。因此,“对应于”另一个序列中的氨基酸或区段的在一个序列中的氨基酸或区段是使用标准序列比对程序例如ALIGN、ClustalW或相似程序,通常在缺省设置下,与其他氨基酸或区段比对的那种,并且与人IgG1重链具有至少50%、至少80%、至少90%或至少95%同一性。本领域视为众所周知的是如何比对序列中的序列或区段,并且由此测定序列中与根据本发明的氨基酸位置的相应位置。
在本发明的上下文中,氨基酸可以如上所述进行定义。
当提及重链中的氨基酸时,术语“氨基酸不是”或类似措辞应理解为意指氨基酸是除所述具体氨基酸外的任何其他氨基酸。例如,人IgG1重链中对应于L234的位置中的氨基酸不是L,意指氨基酸可以是除L外的其他天然或非天然存在的氨基酸中的任一种。
在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸不是D。
在一个实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的D265的位置中的氨基酸不是D,并且对应于人IgG1重链中的位置N297和P331的位置中的氨基酸分别是N和P。
在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸是疏水性或极性氨基酸。
如本文关于氨基酸残基使用的术语“疏水性的”指选自下述的氨基酸残基:A、C、F、G、H、I、L、M、R、T、V、W和Y。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自下述氨基酸:A、C、F、G、H、I、L、M、R、T、V、W和Y。
如本文关于氨基酸残基使用的术语“极性的”指选自下述的任何氨基酸残基:C、D、E、H、K、N、Q、R、S和T。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人重链中的位置D265的位置中的氨基酸选自:C、E、H、K、N、Q、R、S和T。
在另一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸是脂肪族不带电的、芳香族或酸性氨基酸。
如本文关于氨基酸残基使用的术语“脂肪族不带电的”指选自下述的任何氨基酸残基:A、G、I、L和V。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:A、G、I、L和V。
如本文关于氨基酸残基使用的术语“芳香族的”指选自下述的任何氨基酸残基:F、T和W。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:F、T和W。
如本文关于氨基酸残基使用的术语“酸性的”指选自下述的任何氨基酸残基:D和E。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:D和E。
在一个特别的实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:A、E、F、G、I、L、T、V和W。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸不是D。
在一个实施方案中,在第一和第二重链两者中,对应于人IgG1重链中的D265的位置中的氨基酸不是D,并且对应于人IgG1重链中的位置N297和P331的位置中的氨基酸分别是N和P。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸是疏水性或极性氨基酸。
如本文关于氨基酸残基使用的术语“疏水性的”指选自下述的氨基酸残基:A、C、F、G、H、I、L、M、R、T、V、W和Y。因此,在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自下述氨基酸:A、C、F、G、H、I、L、M、R、T、V、W和Y。
如本文关于氨基酸残基使用的术语“极性的”指选自下述的任何氨基酸残基:C、D、E、H、K、N、Q、R、S和T。因此,在一个实施方案中,在所述第一和第二重链两者中,对应于人重链中的位置D265的位置中的氨基酸选自:C、E、H、K、N、Q、R、S和T。在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自下述氨基酸:A、C、F、G、H、I、L、M、R、T、V、W和Y。
在一个实施方案中,在所述第一和第二重链两者中,对应于人重链中的位置D265的位置中的氨基酸选自:C、E、H、K、N、Q、R、S和T。
在另一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸是脂肪族不带电的、芳香族或酸性氨基酸。
如本文关于氨基酸残基使用的术语“脂肪族不带电的”指选自下述的任何氨基酸残基:A、G、I、L和V。因此,在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:A、G、I、L和V。
如本文关于氨基酸残基使用的术语“芳香族的”指选自下述的任何氨基酸残基:F、T和W。因此,在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:F、T和W。
如本文关于氨基酸残基使用的术语“酸性的”指选自下述的任何氨基酸残基:D和E。因此,在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:D和E。
在一个特别的实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:A、E、F、G、I、L、T、V和W。
在进一步的实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置N297的位置中的氨基酸不是N。
在一个实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的N297的位置中的氨基酸不是N,并且对应于人IgG1重链中的位置P331的位置中的氨基酸是P。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置N297的位置中的氨基酸不是N。
在一个实施方案中,在第一和第二重链两者中,对应于人IgG1重链中的N297的位置中的氨基酸不是N,并且对应于人IgG1重链中的位置P331的位置中的氨基酸是P。
在进一步实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别不是L和L。
在一个实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的L234和L235的位置中的氨基酸分别不是L和L,并且对应于人IgG1重链中的位置N297和P331的位置中的氨基酸分别是N和P。
在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的氨基酸选自:A、C、D、E、F、G、H、I、K、M、N、P、Q、R、S、T、Y、V。
在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸是疏水性或极性氨基酸。
如本文关于氨基酸残基使用的术语“疏水性的”指选自下述的氨基酸残基:A、C、F、G、H、I、L、M、R、T、V、W和Y。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、C、F、G、H、I、M、R、T、V、W和Y。
如本文关于氨基酸残基使用的术语“极性的”指选自下述的任何氨基酸残基:C、D、E、H、K、N、Q、R、S和T。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自下述氨基酸:C、D、E、H、K、N、Q、R、S和T。
在一个特别的实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、C、D、E、F、G、H、I、K、M、N、Q、R、S、T、V、W和Y。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别不是L和L。
在一个实施方案中,在第一和第二重链两者中,对应于人IgG1重链中的L234和L235的位置中的氨基酸分别不是L和L,并且对应于人IgG1重链中的位置N297和P331的位置中的氨基酸分别是N和P。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的L234和L235的位置中的氨基酸是疏水性或极性氨基酸。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、C、F、G、H、I、M、R、T、V、W和Y。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自下述氨基酸:C、D、E、H、K、N、Q、R、S和T。
在一个特别的实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、C、D、E、F、G、H、I、K、M、N、Q、R、S、T、V、W和Y。
在另一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸是脂肪族不带电的、芳香族或酸性氨基酸。
如本文关于氨基酸残基使用的术语“脂肪族不带电的”指选自下述的任何氨基酸残基:A、G、I、L和V。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、G、I和V。
如本文关于氨基酸残基使用的术语“芳香族的”指选自下述的任何氨基酸残基:F、T和W。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:F、T和W。
如本文关于氨基酸残基使用的术语“酸性的”指选自下述的任何氨基酸残基:D和E。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:D和E。
在一个特别的实施方案中,在所述第一和第二重链的至少一条中,对应于L234和L235的位置中的氨基酸各自选自:A、D、E、F、G、I、T、V和W。
在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别是F和E;或A和A。
在一个实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的L234和L235的位置中的氨基酸分别是F和E;或A和A,并且对应于人IgG1重链中的位置N297和P331的位置中的氨基酸分别是N和P。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别是F和E;或A和A。
在一个实施方案中,在第一和第二重链两者中,对应于人IgG1重链中的L234和L235的位置中的氨基酸分别是F和E;或A和A,并且对应于人IgG1重链中的位置N297和P331的位置中的氨基酸分别是N和P。
在一个特别的实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别是F和E。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别是F和E。
在一个实施方案中,在所述第一和第二重链的至少一条中,至少对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别是A和A。
在一个实施方案中,在所述第一和第二重链两者中,至少对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别是A和A。
在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别不是L、L和D 。
在一个实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的L234、L235和D265的位置中的氨基酸分别不是L、L和D,并且对应于人IgG1重链中的位置N297和P331的位置中的氨基酸分别是N和P。
在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的氨基酸选自:A、C、D、E、F、G、H、I、K、M、N、P、Q、R、S、T、Y、V和W,并且对应于位置D265的氨基酸选自:A、C、E、F、G、H、I、K、L、M、N、P、Q、R、S、T、Y、V和W。
在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸是疏水性或极性氨基酸。
如本文关于氨基酸残基使用的术语“疏水性的”指选自下述的氨基酸残基:A、C、F、G、H、I、L、M、R、T、V、W和Y。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自下述氨基酸:A、C、F、G、H、I、L、M、R、T、V、W和Y,并且对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、C、F、G、H、I、M、R、T、V、W和Y。
如本文关于氨基酸残基使用的术语“极性的”指选自下述的任何氨基酸残基:C、D、E、H、K、N、Q、R、S和T。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自下述氨基酸:C、D、E、H、K、N、Q、R、S和T,对应于人重链中的位置D265的位置中的氨基酸选自:C、E、H、K、N、Q、R、S和T。
在一个特别的实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、C、D、E、F、G、H、I、K、M、N、Q、R、S、T、V、W和Y,并且对应于人IgG1重链中的位置D265的位置中的氨基酸选自:A、C、E、F、G、H、I、K、L、M、N、Q、R、S、T、V、W和Y。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的L234、L235和D265的位置中的氨基酸是疏水性或极性氨基酸。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自下述氨基酸:A、C、F、G、H、I、L、M、R、T、V、W和Y,并且对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、C、F、G、H、I、M、R、T、V、W和Y。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自下述氨基酸:C、D、E、H、K、N、Q、R、S和T,对应于人重链中的位置D265的位置中的氨基酸选自:C、E、H、K、N、Q、R、S和T。
在一个特别的实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、C、D、E、F、G、H、I、K、M、N、Q、R、S、T、V、W和Y,并且对应于人IgG1重链中的位置D265的位置中的氨基酸选自:A、C、E、F、G、H、I、K、L、M、N、Q、R、S、T、V、W和Y。
在另一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸是脂肪族不带电的、芳香族或酸性氨基酸。
如本文关于氨基酸残基使用的术语“脂肪族不带电的”指选自下述的任何氨基酸残基:A、G、I、L和V。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:A、G、I、L和V,并且对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、G、I和V。
如本文关于氨基酸残基使用的术语“芳香族的”指选自下述的任何氨基酸残基:F、T和W。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸各自选自:F、T和W。
如本文关于氨基酸残基使用的术语“酸性的”指选自下述的任何氨基酸残基:D和E。因此,在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸各自选自:D和E。
在一个特别的实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:A、E、F、G、I、L、T、V和W,并且对应于L234和L235的位置中的氨基酸各自选自:A、D、E、F、G、I、T、V和W。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别不是L、L和D。
在一个实施方案中,在第一和第二重链两者中,对应于人IgG1重链中的L234、L235和D265的位置中的氨基酸分别不是L、L和D,并且对应于人IgG1重链中的位置N297和P331的位置中的氨基酸分别是N和P。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的L234、L235和D265的位置中的氨基酸是脂肪族不带电的、芳香族或酸性氨基酸。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:A、G、I、L和V,并且对应于人IgG1重链中的位置L234和L235的位置中的氨基酸各自选自:A、G、I和V。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸各自选自:D和E。
在一个特别的实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置D265的位置中的氨基酸选自:A、E、F、G、I、L、T、V和W,并且对应于人IgG1重链中的L234和L235的位置中的氨基酸各自选自:A、D、E、F、G、I、T、V和W。
在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;或A、A和A。
在一个实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的L234、L235和D265的位置中的氨基酸分别是F、E和A;或A、A和A,并且对应于人IgG1重链中的位置N297和P331的位置中的氨基酸分别是N和P。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;或A、A和A。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的L234、L235和D265的位置中的氨基酸分别是F、E和A;或A、A和A,并且对应于人IgG1重链中的位置N297和P331的位置中的氨基酸分别是N和P。
在一个特别的实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是A、A和A。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是A、A和A。
在另一个实施方案中,在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235、D265、N297和P331的位置中的氨基酸分别是F、E、A、Q和S。
在一个实施方案中,在所述第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235、D265、N297和P331的位置中的氨基酸分别是F、E、A、Q和S。
在一个特别的实施方案中,根据本发明的抗体包含如SEQ ID NO:8中所示的VH序列、如SEQ ID NO:10中所示的VL序列,并且在重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在另一个实施方案中,根据本发明的抗体包含如SEQ ID NO:8中所示的VH序列、如SEQ ID NO:12中所示的VL序列,并且在重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在另一个实施方案中,根据本发明的抗体包含如SEQ ID NO:6中所示的VH序列、如SEQ ID NO:10中所示的VL序列,并且在重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在另一个实施方案中,根据本发明的抗体包含如SEQ ID NO:6中所示的VH序列、如SEQ ID NO:12中所示的VL序列,并且在重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在另一个实施方案中,根据本发明的抗体包含如SEQ ID NO:9中所示的VH序列、如SEQ ID NO:10中所示的VL序列,并且在重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在另一个实施方案中,根据本发明的抗体包含如SEQ ID NO:9中所示的VH序列、如SEQ ID NO:12中所示的VL序列,并且在重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在一个方面,本发明涉及多特异性抗体,其包含根据本文描述的任何方面或实施方案的抗体的至少第一结合区,以及结合与第一结合区不同的一种或多种靶的一个或多个结合区。此类多特异性抗体可以是双特异性抗体。
因此,在一个方面,本发明涉及双特异性抗体,其包含根据本文描述的任何方面或实施方案的抗体的第一结合区,以及结合与第一结合区不同的靶的第二结合区。
术语“多特异性抗体”指对于至少两种不同、例如至少三种通常为非重叠的表位具有特异性的抗体。此类表位可以在相同或不同靶上。如果表位在不同靶上,则此类靶可以是在相同细胞或不同细胞或细胞类型上。
术语“双特异性抗体”指对于至少两种不同、通常为非重叠的表位具有特异性的抗体。此类表位可以在相同或不同靶上。如果表位在不同靶上,则此类靶可以是相同细胞或不同细胞或细胞类型上。
在一个实施方案中,双特异性抗体包含第一和第二重链。
涉及Fc区的修饰的实施方案和涉及特异性氨基酸置换的实施方案考虑为根据本发明的任何双特异性抗体的部分。因此,在一个实施方案中,第一和第二重链中的至少一条包含如本文描述的任何实施方案中限定进行修饰的一个或多个氨基酸,例如关于提供惰性Fc区描述的那些。在一个实施方案中,所述第一和第二重链两者均包含如本文描述的任何实施方案中限定进行修饰的一个或多个氨基酸,例如关于提供惰性Fc区描述的那些。因此,双特异性抗体包含根据本文描述的任何方面或实施方案进行修饰的Fc区;或所述第一和第二重链中的至少一条包含如本文描述的任何方面或实施方案中限定进行修饰的一个或多个氨基酸。
因此,在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,C1q与所述抗体的结合减少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q结合通过ELISA确定。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,C1q与所述抗体的结合减少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q结合通过ELISA确定。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,C1q与所述抗体的结合减少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q结合通过ELISA确定。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,C1q与所述抗体的结合减少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q结合通过ELISA确定。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,C1q与所述抗体的结合减少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q结合通过ELISA确定。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,C1q与所述抗体的结合减少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q结合通过ELISA确定。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,所述抗体介导的减少的Fc介导的T细胞增殖减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T细胞增殖在基于外周血单核细胞(PBMC)的功能测定中进行测量。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,所述抗体介导的减少的Fc介导的T细胞增殖减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T细胞增殖在基于外周血单核细胞(PBMC)的功能测定中进行测量。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,所述抗体介导的减少的Fc介导的T细胞增殖减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T细胞增殖在基于外周血单核细胞(PBMC)的功能测定中进行测量。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,所述抗体介导的减少的Fc介导的T细胞增殖减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T细胞增殖在基于外周血单核细胞(PBMC)的功能测定中进行测量。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,所述抗体介导的减少的Fc介导的T细胞增殖减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T细胞增殖在基于外周血单核细胞(PBMC)的功能测定中进行测量。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中Fc区已进行修饰,使得与野生型抗体相比较,所述抗体介导的减少的Fc介导的T细胞增殖减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T细胞增殖在基于外周血单核细胞(PBMC)的功能测定中进行测量。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中Fc区已进行修饰,使得当与野生型抗体相比较时,所述抗体使Fc介导的CD69表达减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc介导的CD69表达在基于PBMC的功能测定中确定。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中Fc区已进行修饰,使得当与野生型抗体相比较时,所述抗体使Fc介导的CD69表达减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc介导的CD69表达在基于PBMC的功能测定中确定。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中Fc区已进行修饰,使得当与野生型抗体相比较时,所述抗体使Fc介导的CD69表达减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc介导的CD69表达在基于PBMC的功能测定中确定。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中Fc区已进行修饰,使得当与野生型抗体相比较时,所述抗体使Fc介导的CD69表达减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc介导的CD69表达在基于PBMC的功能测定中确定。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中Fc区已进行修饰,使得当与野生型抗体相比较时,所述抗体使Fc介导的CD69表达减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc介导的CD69表达在基于PBMC的功能测定中确定。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中Fc区已进行修饰,使得当与野生型抗体相比较时,所述抗体使Fc介导的CD69表达减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc介导的CD69表达在基于PBMC的功能测定中确定。
在一个特别的实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别为F、E和A。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别为F、E和A。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别为F、E和A。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别为F、E和A。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;并且其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别为F、E和A。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;并且其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别为F、E和A。
可以用于本发明中的双特异性抗体分子的例子包含(i)具有包含不同抗原结合区的两个臂的单一抗体,(ii) 例如经由通过额外肽接头串联连接的两个scFv,对于两种不同表位具有特异性的单链抗体;(iii)双重可变结构域抗体(DVD-Ig
在一个实施方案中,本发明的双特异性抗体是双抗体、交体(cross-body)或经由控制Fab臂交换获得的双特异性抗体,例如DuoBody®(例如如[41]中描述的),如本发明中描述的那些。
不同类别的双特异性抗体的例子包括但不限于(i)具有互补CH3结构域以迫使异源二聚化的IgG样分子;(ii)重组IgG样双重靶向分子,其中分子的两侧各自含有至少两种不同抗体的Fab片段或Fab片段的部分;(iii)IgG融合分子,其中全长IgG抗体融合至额外的Fab片段或Fab片段的部分;(iv)Fc融合分子,其中单链Fv分子或稳定的双抗体融合至重链恒定结构域、Fc区或其部分;(v)Fab融合分子,其中不同的Fab片段融合在一起,融合至重链恒定结构域、Fc区或其部分;和(vi)基于ScFv和双抗体的抗体以及重链抗体(例如结构域抗体,Nanobodies®),其中不同的单链Fv分子或不同的双抗体或不同的重链抗体(例如结构域抗体,Nanobodies®)彼此融合或者融合至另一种蛋白质或载体分子,所述另一种蛋白质或载体分子融合至重链恒定结构域、Fc区或其部分。
具有互补CH3结构域的IgG样分子的例子包括但不限于Triomab® (TrionPharma/Fresenius Biotech, [42])、Knobs-into-Holes(Genentech, [43])、CrossMAbs(Roche, [44])和静电匹配的(Amgen, [45]-[46]; Chugai, [47]; Oncomed, [48])、LUZ-Y (Genentech)、DIG-体和PIG-体 (Pharmabcine)、(链交换改造的结构域体) (SEED体)(EMD Serono, [49])、Biclonics (Merus)、FcΔAdp (Regeneron, [50])、双特异性IgG1和IgG2 (Pfizer/Rinat, [51])、Azymetric支架(Zymeworks/Merck, [52])、mAb-Fv(Xencor, [53])、二价双特异性抗体 (Roche)和DuoBody®分子 (Genmab A/S, [41])。
重组IgG样双重靶向分子的例子包括但不限于双重靶向 (DT)-Ig (GSK/Domantis)、二合一抗体(Two-in-one Antibody) (Genentech)、交联Mabs (KarmanosCancer Center)、mAb2 (F-Star, [54])、Zybodies
IgG融合分子的例子包括但不限于双重可变结构域 (DVD)-Ig
Fc融合分子的例子包括但不限于ScFv/Fc融合物(Academic Institution)、SCORPION (Emergent BioSolutions/Trubion, Zymogenetics/BMS)、双重亲和力再靶向技术 (Fc-DART
Fab融合物双特异性抗体的例子包括但不限于F(ab)2 (Medarex/AMGEN)、双重作用或双Fab (Genentech)、Dock-and-Lock® (DNL) (ImmunoMedics)、二价双特异性(Biotecnol)和Fab-Fv (UCB-Celltech)。
基于ScFv、双抗体的抗体和结构域抗体的例子包括但不限于双特异性T细胞衔接子(BiTE®) (Micromet, Tandem Diabody (Tandab) (Affimed)、双重亲和力再靶向技术(DART
进一步考虑达成本文描述的测定条件的任何单特异性抗体可以构成双特异性抗体的基础。即其中结合区之一结合CD3的双特异性抗体可以源于在功能测定中测试,并且达成本文所述的要求的任何单特异性CD3抗体。此类双特异性抗体可以通过[41]中所述的方法提供,所述参考文献在此引入作为参考。
因此,在一个特别的实施方案中,所述第一和第二重链各自包含至少铰链区、CH2和CH3区,其中在所述第一重链中,对应于人IgG1重链中选自T366、L368、K370、D399、F405、Y407和K409的位置的位置中的氨基酸中的至少一个已被置换,并且在所述第二重链中,对应于人IgG1重链中选自T366、L368、K370、D399、F405、Y407和K409的位置的位置中的氨基酸中的至少一个已被置换,并且其中所述第一和所述第二重链未在相同位置中进行置换。在该上下文中,术语“置换的”指特异性氨基酸位置中的氨基酸已由另一种天然或非天然存在的氨基酸置换。因此,对应于人IgG1重链中的位置的位置中的“置换”氨基酸意指在特定位置处的氨基酸不同于IgG1重链中的天然存在的氨基酸。
在一个实施方案中,在所述第一重链中,对应于人IgG1重链中的K409的位置中的氨基酸不是K、L或M,并且任选地,对应于人IgG1重链中的F405的位置中的氨基酸是F,并且在所述第二重链中,对应于人IgG1重链中选自T366、L368、K370、D399、F405和Y407的位置的位置中的氨基酸中的至少一个已被置换。
在一个实施方案中,在所述第一重链中,对应于人IgG1重链中的K409的位置中的氨基酸不是K、L或M,并且在所述第二重链中,对应于人IgG1重链中的F405的位置中的氨基酸不是F,并且任选地,对应于人IgG1重链中的K409的位置中的氨基酸是K。
在一个实施方案中,在所述第一重链中,对应于人IgG1重链中的F405的位置中的氨基酸不是F、R和G,并且在所述第二重链中,对应于人IgG1重链中选自T366、L368、K370、D399、Y407和K409的位置的位置中的氨基酸已被置换。
在一个实施方案中,在所述第一重链中,对应于人IgG1重链中的K409的位置中的氨基酸不是K、L或M,并且对应于人IgG1重链中的F405的位置中的氨基酸不是F。
在进一步的实施方案中,在所述第一重链中,对应于人IgG1重链中的F405的位置中的氨基酸是L,并且在所述第二重链中,对应于人IgG1重链中的K409的位置中的氨基酸是R,或反之亦然。
因此,在一个实施方案中,对应于人IgG1重链中的K409的位置中的氨基酸在第一重链中是R,并且对应于人IgG1重链中的F405的位置中的氨基酸在第二重链中是L。
在进一步的实施方案中,本发明的人源化或嵌合CD3抗体在第一和第二重链的至少一条中含有如上文实施方案中的任何一个中公开的失活置换中的一个或多个,例如L234F、L235E和D265A;并且对应于F405的位置中的氨基酸不是F。在一个实施方案中,本发明的人源化或嵌合CD3抗体在第一和第二重链的至少一条中含有如上文实施方案中的任何一个中公开的失活置换中的一个或多个,例如L234F、L235E和D265A;以及在K409位置中的进一步置换,例如K409R。特别地,在一个实施方案中,本发明的人源化或嵌合CD3抗体在第一和第二重链两者中均含有如上文实施方案中的任何一个中公开的失活置换中的一个或多个,例如L234F、L235E和D265A;以及在F405位置中的置换,例如F405L。在一个实施方案中,本发明的人源化或嵌合CD3抗体在第一和第二重链两者中均含有如上文实施方案中的任何一个中公开的失活置换中的一个或多个,例如L234F、L235E和D265A;以及在K409位置中的进一步置换,例如K409R。此类抗体可用于生成双特异性抗体。
因此,在进一步的实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A,对应于人IgG1重链中的F405的位置中的氨基酸在第一重链中是L,并且对应于人IgG1重链中的K409的位置中的氨基酸在第二重链中是R。
在一个实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的L234、L235、D265、N297和P331的位置中的氨基酸分别是F、E、A、N和P,对应于人IgG1重链中的F405的位置中的氨基酸在第一重链中是L,并且对应于人IgG1重链中的K409的位置中的氨基酸在第二重链中是R。
在一个可选实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A,对应于人IgG1重链中的K409的位置中的氨基酸在第一重链中是R,并且对应于人IgG1重链中的F405的位置中的氨基酸在第二重链中是L。
在一个实施方案中,在第一和第二重链的至少一条中,对应于人IgG1重链中的L234、L235、D265、N297和P331的位置中的氨基酸分别是F、E、A、N和P,对应于人IgG1重链中的K409的位置中的氨基酸在第一重链中是R,并且对应于人IgG1重链中的F405的位置中的氨基酸在第二重链中是L。
在另一个实施方案中,在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A,对应于人IgG1重链中的F405的位置中的氨基酸在第一重链中是L,并且对应于人IgG1重链中的K409的位置中的氨基酸在第二重链中是R。
在一个实施方案中,在第一和第二重链两者中,对应于人IgG1重链中的L234、L235、D265、N297和P331的位置中的氨基酸分别是F、E、A、N和P,对应于人IgG1重链中的F405的位置中的氨基酸在第一重链中是L,并且对应于人IgG1重链中的K409的位置中的氨基酸在第二重链中是R。
在一个可选实施方案中,在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A,对应于人IgG1重链中的K409的位置中的氨基酸在第一重链中是R,并且对应于人IgG1重链中的F405的位置中的氨基酸在第二重链中是L。
在一个实施方案中,在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235、D265、N297和P331的位置中的氨基酸分别是F、E、A、N和P,对应于人IgG1重链中的K409的位置中的氨基酸在第一重链中是R,并且对应于人IgG1重链中的F405的位置中的氨基酸在第二重链中是L。
如本文描述的,T细胞召募至特异性靶细胞例如癌或肿瘤细胞提供了杀伤靶细胞的方法。本发明人已显示如实施例5中所述,在两条重链中包含特异性氨基酸置换L234F、L235E和D265A的双特异性CD3xHER2抗体能够杀伤AU565细胞。T细胞介导的杀伤可以通过双特异性抗体来获得,所述双特异性抗体用第一结合区靶向CD3且用第二结合区靶向另一种靶。因此,在一个实施方案中,第一结合区是根据本文对于人源化或嵌合CD3抗体描述的任何实施方案,并且第二结合区结合与第一结合区不同的靶。应当理解当抗体是双特异性抗体时,抗体的至少一半,即抗体的一对重和轻链是如本文描述的人源化或嵌合抗体。因此,双特异性抗体的一半是根据本发明结合CD3的人源化或嵌合抗体,并且另一半可以是结合第二种靶的人源化、嵌合、完全非人或全人的。因此,在一个实施方案中,抗体包含第一和第二重链、第一和第二轻链,其中所述第一重链和所述第一轻链是人源化或嵌合的,并且经由二硫桥连接,形成第一结合区;并且所述第二重和轻链是全人的,并且经由二硫桥连接,形成第二结合区,其中所述第一结合区根据本文描述的任何方面或实施方案,并且所述第二结合区结合不同的靶。在一个实施方案中,抗体包含第一和第二重链、第一和第二轻链,其中所述第一重链和所述第一轻链是人源化或嵌合的,并且经由二硫桥连接,形成第一结合区;并且所述第二重和轻链是人源化或嵌合的,并且经由二硫桥连接,形成第二结合区,其中所述第一结合区根据本文描述的任何方面或实施方案,并且所述第二结合区结合与所述第一结合区不同的CD3表位。
因此,在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:19中所示的VH序列,以及如SEQ ID NO:20中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
在另一个实施方案中,双特异性抗体包含第一结合区,其包含如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;第二结合区,其包含如SEQ ID NO:29中所示的VH序列,以及如SEQ ID NO:30中所示的VL序列;其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;并且其中在第一重链中,对应于人IgG1重链中的位置F405的位置中的氨基酸是L,并且在第二重链中,对应于人IgG1重链中的位置K409的位置中的氨基酸是R。
如本文使用的,术语“二硫桥”指两个半胱氨酸残基之间的共价键,即所述相互作用还可以指定为Cys-Cys相互作用。
如本文使用的,术语“靶”指根据本发明的抗体的结合区与之结合的分子,当在抗体结合的上下文中使用时,该术语包括所生成的抗体针对其的任何抗原。
在一个特别的实施方案中,第一重链和第一轻链是人源化或嵌合的,并且经由二硫桥连接,形成第一结合区;并且第二重和轻链是全人的,并且经由二硫桥连接,形成第二结合区,其中第一结合区根据本文描述的任何方面或实施方案,并且第二结合区结合不同的靶;并且其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在一个特别的实施方案中,第一重链和第一轻链是人源化或嵌合的,并且经由二硫桥连接,形成第一结合区;并且第二重和轻链是全人的,并且经由二硫桥连接,形成第二结合区,其中第一结合区根据本文描述的任何方面或实施方案,并且第二结合区结合与第一结合区不同的CD3表位;并且其中在第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在一个特别的实施方案中,第一重链和第一轻链是人源化或嵌合的,并且经由二硫桥连接,形成第一结合区;并且第二重和轻链是全人的,并且经由二硫桥连接,形成第二结合区,其中第一结合区根据本文描述的任何方面或实施方案,并且第二结合区结合不同的靶;并且其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在一个特别的实施方案中,第一重链和第一轻链是人源化或嵌合的,并且经由二硫桥连接,形成第一结合区;并且第二重和轻链是全人的,并且经由二硫桥连接,形成第二结合区,其中第一结合区根据本文描述的任何方面或实施方案,并且第二结合区结合与第一结合区不同的CD3表位;并且其中在第一和第二重链两者中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
在一个方面,本发明涉及编码表1中所示的一种或多种序列的核酸构建体。因此,本发明涉及编码SEQ ID NO: 1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25和26中所示序列中的任何一种的核酸构建体。
在进一步的方面,本发明涉及编码根据本发明的人源化或嵌合CD3抗体的序列的核酸构建体,包含根据本发明的核酸构建体的表达载体,包含此类表达载体的宿主细胞,以及通过在适当条件下培养此类宿主细胞,由此产生并且任选回收抗体来产生此类抗体的方法。人源化CD3抗体也可以表示为“huCD3”。
在一个实施方案中,本发明提供了包含下述的表达载体:(i) 编码根据本发明的人源化或嵌合抗体的重链序列的核酸序列,(ii) 编码根据本发明的人源化或嵌合抗体的轻链序列的核酸序列,(iii)(i)和(ii)两者。因此,表达载体包含根据本文描述的任何方面或实施方案的一种或多种核酸构建体或核酸序列。
在一个实施方案中,本发明的表达载体包含核酸序列,其编码选自下述的重链和轻链CDR序列中的一种或多种:SEQ ID NO.:1、2、3、4和5;以及序列GTN。
在一个实施方案中,本发明提供了包含核酸序列的表达载体,所述核酸序列编码选自SEQ ID NO: 6、7、8、9、10、11、12、19、20、27、28、29和30的一种或多种氨基酸序列,或其任何组合。在另一个实施方案中,表达载体包含编码如SEQ ID NO: 3中所示的VH CDR3氨基酸序列的核酸序列。在另一个实施方案中,表达载体包含编码选自SEQ ID NO: 6、7、8、9、19、27和29的VH氨基酸序列的核酸序列。在另一个实施方案中,表达载体包含编码选自SEQID NO: 10、11、12、20、28和30的VL氨基酸序列的核酸序列。在另一个实施方案中,表达载体包含编码人抗体轻链、人抗体重链或两者的恒定区的核酸序列。在另一个实施方案中,本发明提供了包含核酸序列的表达载体,所述核酸序列编码根据SEQ ID NO: 15、16、23、24、25和26的氨基酸序列。
在一个特别的实施方案中,表达载体包含编码上述氨基酸序列中的一种或多种的变体的核酸序列,所述变体具有至多25种氨基酸修饰,例如至多20,例如至多15、14、13、12或11种氨基酸修饰,例如10、9、8、7、6、5、4、3、2或1种氨基酸修饰,例如缺失或插入,优选置换,例如保守或非保守置换,或与所述序列中任一种的至少80%同一性,例如与上述氨基酸序列中任一种的至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。本发明还涉及这样的核酸序列,其不同于上述核酸序列,但由于遗传密码的变异,编码与本发明的抗体相同的氨基酸序列。例如,核酸序列可以变化,但导致与本文描述的任何氨基酸序列等同的氨基酸序列。本领域技术人员众所周知如何基于遗传密码来鉴定此类进一步的核酸序列。
在进一步的实施方案中,表达载体进一步包含编码抗体例如人抗体的轻链、重链或轻和重链两者的恒定区的核酸序列。
如上所述的此类表达载体可以用于本发明的抗体的重组生产。
在本发明的上下文中的表达载体可以是任何合适的载体,包括染色体、非染色体和合成核酸载体(包含表达控制元件的合适集合的核酸序列)。此类载体的例子包括SV40的衍生物、细菌质粒、噬菌体DNA、杆状病毒、酵母质粒、衍生自质粒和噬菌体DNA的组合的载体、以及病毒核酸(RNA或DNA)载体。在一个实施方案中,人源化或嵌合CD3抗体编码核酸包含在裸露DNA或RNA载体中,其包括例如线性表达元件(如例如[64]中所述),紧致核酸载体(如例如[65]和/或[66]中所述),质粒载体例如pBR322、pUC 19/18或pUC 118/119,“摇蚊(midge)”最小尺寸的核酸载体(如例如[67]中所述)、或作为沉淀的核酸载体构建体,例如CaPO
在一个实施方案中,载体适合于在细菌细胞中表达人源化或嵌合CD3抗体。此类载体的例子包括表达载体例如BlueScript (Stratagene)、pIN载体([74])、pET载体(Novagen,Madison WI)等等。
表达载体还可以或可选地是适合于在酵母系统中表达的载体。可以采用适合于在酵母系统中表达的任何载体。合适的载体包括例如包含组成型或诱导型启动子的载体,例如α因子、醇氧化酶和PGH(在[75]和[76]中综述)。
核酸构建体和/或载体还可以包含编码分泌/定位序列的核酸序列,其可以将多肽例如新生多肽链靶向周质空间或细胞培养基内。此类序列是本领域已知的,并且包括分泌前导或信号肽、细胞器靶向序列(例如核定位序列、ER保留信号、线粒体转运序列、叶绿体转运序列)、膜定位/锚定序列(例如停止转移序列、GPI锚定序列)等等,其是本领域众所周知的。
在本发明的表达载体中,人源化或嵌合CD3抗体编码核酸可以包含或结合任何合适的启动子、增强子及其他表达促进元件。此类元件的例子包括强表达启动子(例如人CMVIE启动子/增强子以及RSV、SV40、SL3-3、MMTV和HIV LTR启动子)、效应poly (A)终止序列、大肠杆菌中的质粒产物的复制起点、作为可选标记物的抗生素抗性基因、和/或方便的克隆位点(例如聚合接头)。核酸构建体和/或载体还可以包含与组成型启动子相反的诱导型启动子,例如CMV IE(技术人员将认识到此类术语实际上是在某些条件下的基因表达程度的描述词)。
在一个实施方案中,人源化或嵌合CD3抗体编码表达载体经由病毒载体置于和/或递送至宿主细胞或宿主动物。
此类表达载体可以用于人源化或嵌合CD3抗体的重组产生。
在一个方面,本发明提供了包含根据本发明的表达载体的宿主细胞。
在一个方面,本文描述的任何方面或实施方案的人源化或嵌合CD3抗体通过使用产生抗体的重组真核、重组原核或重组微生物宿主细胞提供。因此,本发明提供了重组真核、重组原核或重组微生物宿主细胞,其产生如本文定义的人源化或嵌合CD3抗体或免疫球蛋白。宿主细胞的例子包括酵母、细菌和哺乳动物细胞,例如CHO或HEK-293细胞。例如,在一个实施方案中,宿主细胞包含稳定整合到细胞基因组内的核酸序列,其包含编码本文描述的人源化或嵌合CD3抗体的表达的序列。在另一个实施方案中,宿主细胞包含非整合的核酸序列,例如质粒、粘粒、噬菌粒或线性表达元件,其包含编码本文描述的人源化或嵌合CD3抗体的表达的序列。
如本文使用的,术语“重组宿主细胞”(或简单的“宿主细胞”)意指表达载体或核酸构建体或序列已引入其内的细胞。应当理解此类术语不仅意指特定主体细胞,还意指此类细胞的后代。因为由于突变或环境影响,某些修饰可以在后续代中出现,所以此类后代可能事实上不等同于亲本细胞,但仍包括在如本文使用的术语“宿主细胞”的范围内。重组宿主细胞包括例如真核宿主细胞,例如CHO细胞、HEK-293细胞、PER.C6、NS0细胞和淋巴细胞,以及原核细胞例如大肠杆菌(
在进一步的方面,本发明涉及用于产生本发明的人源化或嵌合CD3抗体的方法,所述方法包括下述步骤:
a)培养如本文上文描述的本发明的宿主细胞,和
b)从培养基中回收和/或纯化本发明的抗体。
在进一步的方面,编码人源化或嵌合CD3抗体的核苷酸序列进一步编码第二部分,例如治疗多肽。示例性治疗多肽在本文其他地方描述。在一个实施方案中,本发明涉及用于产生人源化或嵌合CD3抗体融合蛋白的方法,所述方法包括下述步骤:
a)培养包含表达载体的宿主细胞,所述表达载体包含此类核苷酸序列,和
b)从培养基中回收和/或纯化人源化或嵌合CD3抗体融合蛋白。
在一个方面,本发明提供了包含根据本文描述的任何方面和实施方案的抗体或双特异性抗体的组合物。
在一个方面,本发明提供了药物组合物,其包含如本文描述的方面和实施方案中的任何一个中限定的抗体或双特异性抗体、以及药学可接受的载体。
药物组合物可以依照常规技术例如[77]中公开的那些,用药学可接受的载体或稀释剂以及任何其他已知的佐剂和赋形剂进行配制。
药学可接受的载体或稀释剂以及任何其他已知的佐剂和赋形剂应适合于本发明的人源化或嵌合抗体和所选择的施用模式。基于对本发明的所选化合物或药物组合物的所需生物学特性对抗原结合的显著负面影响(例如小于基本影响(10%或更少的相对抑制、5%或更少的相对抑制等)的缺乏,来确定药物组合物的载体和其他组分的适合性。
本发明的药物组合物还可以包括稀释剂、填料、盐、缓冲剂、去污剂(例如非离子型去污剂,例如Tween-20或Tween-80)、稳定剂(例如糖或无蛋白质氨基酸)、防腐剂、组织固定剂、增溶剂和/或适合于包括在药物组合物中的其他材料。
本发明的药物组合物中的活性成分的实际剂量水平可以改变,以便获得活性成分的量,其有效实现关于特定患者、组合物和施用模式的所需治疗应答,而对患者无毒。所选剂量水平取决于各种药物代谢动力学因素,包括采用的本发明的特定组合物或其酰胺的活性,施用途径,施用时间,采用的特定化合物的排泄率,治疗持续时间,其他药物,与采用的特定组合物组合使用的化合物和/或材料,待治疗患者的年龄、性别、重量、状况、一般健康和先前医疗史,以及医学领域众所周知的类似因素。
药物组合物可以通过任何途径和模式进行施用。在体内和体外施用本发明的人源化或嵌合抗体的合适途径是本领域众所周知的,并且可以通过普通技术人员进行选择。
在一个实施方案中,本发明的药物组合物进行肠胃外施用。
如本文使用的,短语“肠胃外施用”和“肠胃外施用的”意指除肠和局部施用外的施用模式,通常通过注射,并且包括表皮、静脉内、肌内、动脉内、鞘内、囊内、眼眶内、心内、皮内、腹膜内、腱内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下腔、椎管内、颅内、胸内、硬膜外和胸骨内注射和输注。
在一个实施方案中,药物组合物通过静脉内或皮下注射或输注进行施用。
药学可接受的载体包括与本发明的人源化或嵌合抗体生理学相容的任何和所有合适的溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等渗剂、抗氧化剂和吸收延迟剂等等。
可以用于本发明的药物组合物中的合适的水性和非水性载体的例子包括水、盐水、磷酸盐缓冲液、乙醇、右旋糖、多元醇(例如甘油、丙二醇、聚乙二醇等等),及其合适的混合物,植物油,例如橄榄油、玉米油、花生油、棉籽油和芝麻油,羧甲基纤维素胶体溶液,黄蓍胶和可注射有机酯,例如油酸乙酯和/或不同的缓冲剂。其他载体是药学领域众所周知的。
药学可接受的载体包括无菌水溶液或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉末。用于药学可接受的物质的此类介质和试剂的使用是本领域已知的。除非任何常规介质或试剂与活性化合物不相容,否则考虑其在本发明的药物组合物中的使用。当提及“活性化合物”时,它考虑还指根据本发明的人源化或嵌合抗体。
适当流动性可以通过下述得到维持:例如通过使用包被材料例如卵磷脂,在分散体的情况下通过维持所需粒子大小和通过使用表面活性剂。
本发明的药物组合物还可以包含药学可接受的抗氧化剂,例如(1)水溶性抗氧化剂例如抗坏血酸、盐酸半胱氨酸、硫酸氢钠、焦亚硫酸钠、亚硫酸钠等等;(2)油溶性抗氧化剂,例如抗坏血酸棕榈酸酯,丁基羟基茴香醚(BHA)、丁基羟基甲苯(BHT)、卵磷脂、没食子酸丙酯、α-生育酚等等;和(3) 金属螯合剂,例如柠檬酸、乙二胺四乙酸(EDTA)、山梨糖醇、酒石酸、磷酸等等。
本发明的药物组合物还可以在组合物中包含等渗剂,例如糖,多元醇例如甘露醇、山梨糖醇、甘油或氯化钠。
本发明的药物组合物还可以含有适合于所选施用途径的一种或多种佐剂,例如防腐剂、润湿剂、乳化剂、分散剂、防腐剂或缓冲剂,其可以增强药物组合物的贮存期限或有效性。本发明的人源化或嵌合抗体可以用载体进行制备,所述载体使化合物免于快速释放,例如控制释放制剂,包括植入物、透皮贴片和微封装递送系统。此类载体可以包括明胶,单硬脂酸甘油酯,二硬脂酸甘油酯,单独或含蜡的可生物降解、生物相容性聚合物例如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸或本领域众所周知的其他材料。用于制备此类制剂的方法是本领域技术人员一般已知的(参见例如[78])。
在一个实施方案中,本发明的人源化或嵌合抗体可以配制为确保在体内的适当分布。用于肠胃外施用的药学可接受的载体包括无菌水溶液或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉末。用于药学可接受的物质的此类介质和试剂的使用是本领域已知的。除非任何常规介质或试剂与活性化合物不相容,否则考虑其在本发明的药物组合物中的使用。其他活性或治疗化合物也可以掺入组合物内。
用于注射的药物组合物必须通常在制造和贮存条件下是无菌和稳定的。组合物可以配制为溶液、微乳剂、脂质体或适合高药物浓度的其他有序结构。载体可以是水性或非水性溶剂或分散介质,含有例如水、乙醇、多元醇(例如甘油、丙二醇、聚乙二醇等等),及其适当的混合物,植物油例如橄榄油,和可注射有机酯,例如油酸乙酯。适当流动性可以通过下述得到维持:例如通过使用包衣例如卵磷脂,在分散体的情况下通过维持所需粒子大小和通过使用表面活性剂。在许多情况下,将优选在组合物中包括等渗剂例如糖,多元醇例如甘油、甘露醇、山梨醇,或氯化钠。可注射组合物的延长吸收可以通过在组合物中包括延迟吸收的试剂来实现,所述试剂例如单硬脂酸盐和明胶。无菌可注射溶液可以通过下述进行制备:根据需要,将活性化合物以所需量掺入具有例如如上列出的成分之一或组合的合适溶剂中,随后为无菌微量过滤。一般地,通过将活性化合物掺入无菌媒介物内来制备分散体,所述无菌媒介物含有基础分散介质和例如来自上文列举的那些的所需其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,制备方法的例子是真空干燥和冷冻干燥(冻干),其获得来自其先前无菌过滤溶液的活性成分加上任何另外的所需成分的粉末。
无菌可注射溶液可以通过下述进行制备:根据需要,将活性化合物以所需量掺入具有上文列出的成分之一或组合的合适溶剂中,随后为无菌微量过滤。一般地,通过将活性化合物掺入无菌媒介物内来制备分散体,所述无菌媒介物含有基础分散介质和来自上文列举的那些的所需其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,制备方法的例子是真空干燥和冷冻干燥(冻干),其获得来自其先前无菌过滤溶液的活性成分加上任何另外的所需成分的粉末。
在另一个方面,本发明涉及如本文描述的任何方面或实施方案中限定的本发明的人源化或嵌合抗体、或药物组合物,用于用作药剂。
在另一个方面,本发明涉及如本文描述的任何方面或实施方案中限定的本发明的人源化或嵌合抗体、或药物组合物,用于疾病治疗。
本发明的人源化或嵌合抗体或药物组合物可以用于任何癌症的治疗中,在所述癌症的治疗中需要细胞毒性T细胞的效应机理。例如,人源化或嵌合抗体可以例如在体外或先体外后体内施用于培养中的细胞,或例如在体内施用于人受试者,以治疗或预防病症例如癌症、炎性或自身免疫病症。如本文使用的,术语“受试者”通常是响应人源化或嵌合抗体或药物组合物的人。受试者可以例如包括具有病症的人患者,所述病症可以通过调节靶功能或通过直接或间接导致细胞杀伤进行校正或改善。
在另一个方面,本发明提供了治疗或预防病症例如癌症的方法,其中T细胞的召募促成治疗或预防,所述方法包括给有此需要的受试者施用治疗有效量的本发明的人源化或嵌合抗体或药物组合物。该方法通常涉及给受试者施用其量有效治疗或预防病症的人源化或嵌合抗体。
在一个特定方面,本发明涉及癌症治疗方法,其包括给有此需要的受试者施用如本文描述的任何方面和实施方案中限定的本发明的人源化或嵌合抗体或药物组合物。
在另一个方面,本发明涉及如本文描述的任何方面或实施方案中限定的用途或方法,其中人源化或嵌合抗体是与CD3和癌症特异性靶特异性结合的双特异性抗体,或在癌症中过表达或与癌症相关的靶,例如HER2、CD19、EpCAM、EGFR、CD66e (或CEA、CEACAM5)、CD33、EphA2或MCSP (或HMW-MAA),并且其中疾病是癌症,例如乳腺癌、前列腺癌、非小细胞肺癌、膀胱癌、卵巢癌、胃癌、结直肠癌、食管癌和头颈部鳞状细胞癌、宫颈癌、胰腺癌、睾丸癌、恶性黑色素瘤、软组织癌(例如滑膜肉瘤)、B细胞淋巴瘤的无痛或侵袭性形式、慢性淋巴性白血病或急性淋巴细胞白血病。
人源化或嵌合抗体的有效剂量和剂量方案取决于待治疗的疾病或状况,并且可以由本领域技术人员确定。
具有本领域普通技术的医生可以容易地确定且开出所需药物组合物的有效量。例如,医生可以以低于所需那种的水平开始在药物组合物中采用的人源化或嵌合抗体的剂量,以实现所需疗效,并且逐步增加剂量直至达到所需效应。一般而言,本发明的组合物的适当剂量将是人源化或嵌合抗体的那种量,其是根据特定剂量方案有效产生疗效的最低剂量。此类有效剂量一般取决于上文描述的因素。
例如,用于治疗用途的“有效量”可以通过其稳定疾病进展的能力进行测量。化合物抑制癌症的能力可以例如在预测人肿瘤中的功效的动物模型系统中进行评估。可选地,组合物的这种特性可以通过技术人员已知的体外测定,通过检查人源化或嵌合抗体抑制细胞生长或诱导细胞毒性的能力进行评估。治疗化合物即根据本发明的治疗人源化或嵌合抗体或药物组合物的治疗有效量可以减少肿瘤大小,或以其他方式改善受试者中的症状。本领域普通技术人员能够基于此类因素如受试者的大小、受试者症状的严重性、以及所选择的特定组合物或施用途径来确定此类量。
关于本发明的人源化或嵌合抗体的治疗有效量的示例性、非限制性范围是约0.001-30 mg/kg,例如约0.001-20 mg/kg,例如约0.001-10 mg/kg,例如约0.001-5 mg/kg,例如约0.001-2 mg/kg,例如约0.001-1 mg/kg,例如约0.001、约0.01、约0.1、约1、约5、约8、约10、约12、约15、约18 mg/kg。
施用可以例如是静脉内、肌内、腹膜内或皮下,并且例如对靶部位近端施用。
调整上述治疗方法和用途中的剂量方案,以提供最佳所需应答(例如治疗应答)。例如,可以施用单一丸剂,可以随着时间过去施用几个分份剂量,或剂量可以如由治疗情况的紧急程度指示的按比例减少或增加。
在一个实施方案中,治疗功效在治疗期间例如在预定时间点进行监控。
需要时,药物组合物的有效日剂量可以作为在全天的适当间隔分开施用的两个、三个、四个、五个、六个或更多个亚剂量,任选以单位剂型施用。在另一个实施方案中,人源化或嵌合抗体、或药物组合物通过经过长时期例如超过24小时的缓慢连续输注进行施用,以便使任何不需要的副作用降到最低。
虽然本发明的人源化或嵌合抗体能够单独施用,但优选将人源化或嵌合抗体作为如上所述的药物组合物施用。
本发明的人源化或嵌合抗体的有效剂量还可以使用每周一次、每两周一次或每三周一次的给药期进行施用。给药期可以局限于例如8周、12周或直至临床进展已被确认。可选地,本发明的人源化或嵌合抗体的有效剂量可以每第二周、第三周或第四周进行施用。
在一个实施方案中,人源化或嵌合抗体可以通过按照mg/m
在一个实施方案中,当每周给予一次时,人源化或嵌合抗体可以以作为固定剂量计算的每周一次剂量施用最高达8次,例如4 - 6次。此类方案可以根据需要例如在6个月或12个月后重复一次或多次。此类固定剂量可以例如基于上文提供的mg/kg剂量,其中体重估计为70 kg。剂量可以通过例如取得生物样品,并且使用靶向本发明的人源化或嵌合抗体的结合区的抗独特型抗体,通过在施用后测量在血液中的本发明的人源化或嵌合抗体的量进行确定或调整。
在一个实施方案中,人源化或嵌合抗体可以通过维持疗法进行施用,例如每周一次共6个月或更久的时期。
人源化或嵌合抗体还可以预防施用,以便降低发展癌症的危险,延迟癌症进展中的事件发生的开始,和/或降低当癌症处于缓解时的复发危险。
肠胃外组合物可以以剂量单位形式进行配制用于容易施用和剂量的一致性。如本文使用的,剂量单位形式指适合作为用于待治疗的受试者的单位剂量的物理上不连续的单位;每个单位含有预定数量的活性化合物,其计算为与所需药学载体结合产生所需疗效。关于本发明的剂量单位形式的规格由下述指示且直接依赖于下述:(a)活性化合物的独特特征和待实现的特定疗效,和(b)用于治疗个体中的敏感性的此类活性化合物领域中固有的局限性。
人源化或嵌合抗体还可以预防施用,以便降低发展癌症的危险,延迟癌症进展中的事件发生的开始,和/或降低当癌症处于缓解时的复发危险。这在其中由于其他生物学因素而难以定位已知存在的肿瘤的患者中可以是尤其有用的。
本发明的人源化或嵌合抗体还可以用于诊断目的,使用包含如本文描述的人源化或嵌合抗体的组合物。因此,本发明提供了使用本文描述的人源化或嵌合抗体的诊断方法和组合物。此类方法和组合物可以用于纯粹的诊断目的,例如检测或鉴定疾病,以及用于监测治疗性处理的进展,监测疾病进展,评价治疗后的状态,监测疾病复发,评估疾病发展的危险等等。
在一个方面,本发明涉及诊断特征在于CD3表达细胞的参与或累积的疾病的方法,其包括给受试者施用根据本发明的人源化或嵌合抗体、根据本发明的组合物、或根据本发明的治疗组合物,任选地其中所述人源化或嵌合抗体用可检测试剂进行标记。
在一个方面,通过检测取自患者的样品中的靶水平或在其细胞表面上表达目的靶的细胞水平,本发明的人源化或嵌合抗体先体外后体内用于例如诊断疾病中,其中表达特异性目的靶并且人源化或嵌合抗体与之结合的细胞指示疾病或参与发病机理。这可以例如通过在允许抗体与靶结合的条件下,使待测试的样品任选连同对照样品与根据本发明的人源化或嵌合抗体接触来实现。随后可以检测(例如使用ELISA)复合物形成。当使用对照样品连同测试样品时,在两个样品中分析人源化或嵌合抗体或抗体-靶复合物的水平,并且在测试样品中统计上显著更高水平的人源化或嵌合抗体或抗体-靶复合物指示与对照样品相比较在测试样品中更高水平的靶。
其中可以使用本发明的人源化或嵌合抗体的常规免疫测定的例子包括但不限于ELISA、RIA、FACS测定、等离子体共振分析、层析测定、组织免疫组织化学、蛋白质印迹和/或免疫沉淀。
因此,在一个实施方案中,本发明涉及诊断特征在于CD3表达细胞的参与或累积的疾病的方法,其包括给受试者施用根据本文描述的任何方面或实施方案的抗体、双特异性抗体、组合物或药物组合物,任选地其中所述抗体用可检测标记进行标记。
在一个实施方案中,本发明涉及用于检测样品中的靶或表达靶的细胞的存在的方法,其包括:
- 在允许人源化或嵌合抗体与样品中的靶结合的条件下,使样品与本发明的人源化或嵌合抗体接触;和
- 分析是否已形成复合物。通常,样品是生物样品。
在一个实施方案中,样品是已知或怀疑含有特异性靶或表达靶的细胞的组织样品。例如,靶表达的原位检测可以通过下述来完成:从患者中取出组织学样本,并且向此类样本提供本发明的人源化或嵌合抗体。人源化或嵌合抗体可以通过将人源化或嵌合抗体应用于或覆盖至样品来提供,其随后使用合适手段进行检测。随后不仅能够确定靶或靶表达细胞的存在,还能够确定所检查组织中的靶或靶表达细胞的分布(例如在评价癌细胞传播的背景下)。使用本发明,普通技术人员容易察觉可以修改广泛多样的组织学方法中的任一种(例如染色操作),以便达到此类原位检测。
在上述测定中,人源化或嵌合抗体可以用可检测物质进行标记,以允许检测结合的抗体。可选地,结合的(初级)特异性人源化或嵌合抗体可以通过抗体进行检测,所述抗体用可检测物质进行标记,并且与初级特异性人源化或嵌合抗体结合。此外,在上述测定中,可以使用包含根据本文描述的任何方面或实施方案的抗体或双特异性抗体的诊断组合物。因此,在一个方面,本发明涉及包含根据本文描述的任何方面或实施方案的抗体或双特异性抗体的诊断组合物。
样品中的靶水平还可以通过竞争免疫测定进行评估,所述竞争免疫测定利用由可检测物质标记的靶标准品和未标记的靶特异性人源化或嵌合抗体。在这类测定中,将生物样品、标记的靶标准和靶特异性人源化或嵌合抗体组合,并且确定与未标记的靶特异性人源化或嵌合抗体结合的标记的靶标准的量。生物样品中的靶量与结合靶特异性人源化或嵌合抗体的标记的靶标准量成反比。
用于体外诊断技术中的靶特异性人源化或嵌合抗体、二级抗体和/或靶标准品的合适标记包括但不限于各种酶、辅基,荧光材料、发光材料和放射性材料。合适酶的例子包括辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶和乙酰胆碱酯酶;合适辅基复合物的例子包括链霉亲和素/生物素和生物素/亲和素;合适荧光材料的例子包括伞形酮、荧光素、异硫氰酸荧光素、若丹明、二氯三嗪基胺荧光素、丹磺酰氯和藻红蛋白;发光材料的例子包括鲁米诺;并且合适放射性材料的例子包括
在一个方面,本发明的靶特异性人源化或嵌合抗体用于靶表达组织例如肿瘤的体内成像中。对于体内方法,由于其快速分布动力学,抗体片段例如(Fab’)
体内成像可以通过任何合适的技术来执行。例如,用
通过本发明提供的体内成像和其他诊断方法在人患者中的微小转移灶的检测中是特别有用的(例如患者先前未诊断有癌症或处于来自癌症的恢复/缓解期中的患者)。
在一个实施方案中,本发明提供了体内成像方法,其中本发明的靶特异性人源化或嵌合抗体缀合至检测促进不透射线试剂,缀合的人源化或嵌合抗体例如通过注射到血流内而施用于宿主,并且测定在宿主中标记的人源化或嵌合抗体的存在和定位。通过本文提供的这种技术和任何其他诊断方法,本发明提供了用于筛选人患者或取自人患者的生物样品中的疾病相关细胞的存在,和/或在靶特异性ADC疗法之前用于评价靶特异性人源化或嵌合抗体的分布的方法。
对于诊断成像,放射性同位素可以直接或通过使用中间官能团间接结合靶特异性人源化或嵌合抗体。有用的中间官能团包括螯合剂,例如乙二胺四乙酸和二乙三胺五乙酸(参见例如[82])。
除了放射性同位素和不透射线试剂之外,诊断方法还可以使用靶特异性抗体来执行,所述靶特异性抗体缀合至染料(例如使用生物素-链霉抗生物素蛋白复合物)、造影剂、荧光化合物或分子和增强剂(例如顺磁离子)用于磁共振成像(MRI)(参见例如[83],其描述了MRI技术和缀合至MRI增强剂的抗体的制备)。此类诊断/检测试剂可以选自用于MRI中的试剂和荧光化合物。为了用放射性金属或顺磁离子装载靶特异性人源化或嵌合抗体,可能需要使其与具有长尾的试剂反应,多个螯合基团附着至所述长尾用于结合离子。此类尾部可以是聚合物例如聚赖氨酸、多糖或者另一种具有悬垂基团的衍生或可衍生的链,螯合基例如卟啉、聚胺、冠醚、双硫代缩氨基脲(bisthiosemicarbazones)、聚肟和已知可用于该用途的类似基团可与所述悬垂基团结合。螯合物可以使用标准化学品与靶特异性人源化或嵌合抗体偶联。
因此,本发明提供了诊断靶特异性人源化或嵌合抗体,其中靶特异性人源化或嵌合抗体缀合至造影剂(例如磁共振成像、计算机断层扫描术或超声造影增强剂)或放射性核素,其可以是例如γ、β、α、俄歇电子或正电子发射同位素。
在一个方面,本发明涉及包含根据本发明的抗体或双特异性抗体的诊断组合物。
在进一步的方面,本发明涉及用于检测样品中的靶抗原或表达靶的细胞的存在的试剂盒,其包含:
- 本发明的靶特异性人源化或嵌合抗体;和
- 试剂盒的使用说明书。
因此,在一个方面,本发明提供了用于检测样品中的CD3抗原或表达CD3的细胞的存在的试剂盒,其包括下述步骤:
a)在允许抗体或双特异性抗体和CD3之间的复合物形成的条件下,使样品与根据本发明的抗体或双特异性抗体接触;和
b)分析复合物是否已形成。
在一个实施方案中,本发明提供了用于诊断癌症的试剂盒,其包括包含靶特异性人源化或嵌合抗体的容器,以及用于检测靶特异性人源化或嵌合抗体与靶的结合的一种或多种试剂。试剂可以包括例如荧光标签、酶促标签或其他可检测标签。试剂还可以包括用于酶促反应的二级或三级抗体或试剂,其中酶促反应产生可以显现的产物。在一个实施方案中,本发明提供了诊断试剂盒,其包含以在合适容器中的标记或未标记形式的本发明的一种或多种靶特异性人源化或嵌合抗体,用于间接测定的用于温育的试剂,以及用于在此类测定中检测的底物或衍生试剂,取决于标记的性质。还可以包括对照试剂和使用说明书。
诊断试剂盒还可以提供用于与靶特异性人源化或嵌合抗体,例如标记的靶特异性抗体一起使用,用于检测组织样品或宿主中的靶的存在。在此类诊断试剂盒中,以及本文其他地方描述的用于治疗用途的试剂盒中,靶特异性人源化或嵌合抗体通常可以以冻干形式在容器中提供,单独或者与对于靶细胞或肽特异性的另外抗体结合。通常,还包括药学可接受的载体(例如惰性稀释剂)和/或其组分,例如Tris、磷酸盐或碳酸盐缓冲液、稳定剂、防腐剂、杀生物剂、惰性蛋白质例如血清白蛋白等等(通常在分开的容器中用于混合)和另外的试剂(通常也在分开的容器中)。在某些试剂盒中,还包括能够与靶特异性人源化或嵌合抗体结合的二级抗体,其通常存在于分开容器中。二级抗体通常缀合至标记且以类似于本发明的靶特异性人源化或嵌合抗体的方式进行配制。使用本文上文和其他地方描述的方法,靶特异性人源化或嵌合抗体可以用于限定癌症/肿瘤细胞的子集,并且表征此类细胞和相关肿瘤组织。
在进一步的方面,本发明涉及与如本文描述的本发明的人源化或嵌合抗体结合的抗独特型抗体。
抗独特型(Id)抗体是识别一般与抗体的抗原结合位点结合的独特决定簇的抗体。抗Id抗体可以通过下述进行制备:用抗Id针对其进行制备的单克隆抗体免疫与CD3单克隆抗体的来源相同物种和遗传类型的动物。免疫的动物通常可以通过产生针对这些独特型决定簇的抗体(抗Id抗体),来识别且响应免疫抗体的独特型决定簇。此类抗体在例如US 4,699,880中描述。此类抗体是本发明的进一步特点。
抗Id抗体还可以用作“免疫原”,以在还另一种动物中诱导免疫应答,产生所谓的抗抗Id抗体。抗抗Id抗体可以在表位上等同于诱导抗Id抗体的原始单克隆抗体。因此,通过使用针对单克隆抗体的独特型决定簇的抗体,能够鉴定表达具有等同特异性的抗体的其他克隆。抗Id抗体可以通过任何合适的技术加以改变(从而产生抗Id抗体变体)和/或衍生,例如本文其他地方就本发明的CD3特异性抗体而言描述的那些。例如,单克隆抗Id抗体可以与载体例如钥孔血蓝蛋白(KLH)偶联,并且用于免疫BALB/c小鼠。来自这些小鼠的血清通常含有抗抗Id抗体,其具有与原始/亲本CD3抗体相似(如果并非等同)的结合特性。
序列
本发明还涉及以下实施方案
1. 一种与人CD3结合的人源化或嵌合抗体,其中所述抗体包含结合区,所述结合区包含分别具有如SEQ ID NO: 1、2和3中所示序列的重链可变(VH)区CDR1、CDR2和CDR3,以及分别具有如SEQ ID NO: 4中所示序列、序列GTN和如SEQ ID NO: 5中所示序列的轻链可变(VL)区CDR1、CDR2和CDR3。
2. 根据实施方案1的抗体,其中所述VH区与如选自下述的VH序列中所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性:
a)如SEQ ID NO:6中所示的VH序列;
b)如SEQ ID NO:8中所示的VH序列;
c)如SEQ ID NO:7中所示的VH序列;和
d)如SEQ ID NO:9中所示的VH序列。
3. 根据前述实施方案中任一项的抗体,其中所述VL区与如选自下述的VL序列中所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性:
a)如SEQ ID NO:10中所示的VL序列;
b)如SEQ ID NO:11中所示的VL序列;和
c)如SEQ ID NO:12中所示的VL序列。
4. 根据前述实施方案中任一项的抗体,其中所述VH区选自下述:
a)如SEQ ID NO:6中所示的VH序列;
b)如SEQ ID NO:8中所示的VH序列;
c)如SEQ ID NO:7中所示的VH序列;和
d)如SEQ ID NO:9中所示的VH序列。
5. 根据前述实施方案中任一项的抗体,其中所述VL区选自下述:
a)如SEQ ID NO:10中所示的VL序列;
b)如SEQ ID NO:11中所示的VL序列;和
c)如SEQ ID NO:12中所示的VL序列。
6. 根据前述实施方案中任一项的抗体,其中所述VH和VL区选自下述:
a)如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;
b)如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;
c)如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;
d)如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:11中所示的VL序列;
e)如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;
f)如SEQ ID NO:7中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;
g)如SEQ ID NO:7中所示的VH序列,以及如SEQ ID NO:11中所示的VL序列;
h)如SEQ ID NO:7中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;
i)如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:11中所示的VL序列;
j)如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列;
k)如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:11中所示的VL序列;和
l)如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:12中所示的VL序列。
7. 根据前述实施方案中任一项的抗体,其中所述结合区包含选自下述的VH序列和VL序列:
a)如SEQ ID NO:6中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;
b)如SEQ ID NO:8中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列;和
c)如SEQ ID NO:9中所示的VH序列,以及如SEQ ID NO:10中所示的VL序列。
8. 根据前述实施方案中任一项的抗体,其中所述抗体是人源化抗体。
9. 根据实施方案1的抗体,其中所述抗体是嵌合抗体。
10. 根据前述实施方案中任一项的抗体,其中所述抗体是全长抗体。
11. 根据前述实施方案中任一项的抗体,其中所述抗体包括包含第一和第二免疫球蛋白重链的Fc区。
12. 根据前述实施方案中任一项的抗体,其中所述第一和第二重链具有选自IgG1、IgG2、IgG3和IgG4的同种型。
13. 根据前述实施方案中任一项的抗体,其中所述抗体包含已进行修饰的Fc区,使得与野生型抗体相比较,C1q与所述抗体的结合减少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q结合通过ELISA确定。
14. 根据前述实施方案中任一项的抗体,其中所述抗体包含已进行修饰的Fc区,使得所述抗体介导的与野生型抗体相比较,Fc介导的T细胞增殖减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T细胞增殖在基于外周血单核细胞(PBMC)的功能测定中进行测量。
15. 根据前述实施方案中任一项的抗体,其中所述抗体包含已进行修饰的Fc区,使得所述抗体介导的当与野生型抗体相比较时,使Fc介导的CD69表达减少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc介导的CD69表达在基于PBMC的功能测定中确定。
16. 根据前述实施方案中任一项的抗体,其中所述抗体包含第一和第二免疫球蛋白重链,其中在所述第一和第二免疫球蛋白重链的至少一条中,对应于人IgG1重链中的位置L234、L235、D265、N297和P331的位置中的一个或多个氨基酸分别地不是L、L、D、N和P。
17. 根据实施方案16的抗体,其中在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置D265的位置中的氨基酸不是D。
18. 根据实施方案16的抗体,其中在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置N297的位置中的氨基酸不是N。
19. 根据实施方案16的抗体,其中在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别不是L和L。
20. 根据实施方案16和19中任一项的抗体,其中在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别是F和E;或A和A。
21. 根据实施方案20的抗体,其中在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别是F和E。
22. 根据实施方案20的抗体,其中在所述第一和第二重链的至少一条中,至少对应于人IgG1重链中的位置L234和L235的位置中的氨基酸分别是A和A。
23. 根据实施方案1 - 16中任一项的抗体,其中在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别不是L、L和D。
24. 根据实施方案23的抗体,其中在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A;或A、A和A。
25. 根据实施方案24的抗体,其中在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是F、E和A。
26. 根据实施方案24的抗体,其中在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235和D265的位置中的氨基酸分别是A、A和A。
27. 根据实施方案16的抗体,其中在所述第一和第二重链的至少一条中,对应于人IgG1重链中的位置L234、L235、D265、N297和P331的位置中的氨基酸分别是F、E、A、Q和S。
28. 一种双特异性抗体,其包含根据实施方案1 - 12中任一项的抗体的第一结合区,以及结合与所述第一抗原结合区不同的靶的第二结合区。
29. 根据实施方案28的双特异性抗体,其中所述抗体包含第一和第二重链。
30. 根据实施方案29的双特异性抗体,其中
a)所述双特异性抗体包含根据实施方案13 - 15中任一项修饰的Fc区;或
b)所述第一和第二重链的至少一条包含如实施方案16 - 27中任一项中限定的进行修饰的一种或多种氨基酸。
31. 根据实施方案28 - 30中任一项的双特异性抗体,其中所述第一和第二重链各自包含至少铰链区、CH2和CH3区,其中在所述第一重链中,对应于人IgG1重链中选自T366、L368、K370、D399、F405、Y407和K409的位置的位置中的氨基酸中的至少一个已被置换,并且在所述第二重链中,对应于人IgG1重链中选自T366、L368、K370、D399、F405、Y407和K409的位置的位置中的氨基酸中的至少一个已被置换,并且其中所述第一和所述第二重链未在相同位置中进行置换。
32. 根据实施方案31的双特异性抗体,其中对应于人IgG1重链中的F405的位置中的氨基酸在所述第一重链中是L,并且对应于人IgG1重链中的K409的位置中的氨基酸在所述第二重链中是R,或反之亦然。
33. 根据实施方案28 - 32中任一项的双特异性抗体,其中所述第一结合区根据实施方案1 - 7中任一项,并且所述第二结合区结合与所述第一结合区不同的靶。
34. 一种核酸构建体,其编码表1中所示的一种或多种氨基酸序列。
35. 一种表达载体,其包含:
(i)编码根据实施方案1 - 33中任一项的人源化或嵌合抗体的重链序列的核酸序列;
(ii)编码根据实施方案1 - 33中任一项的人源化或嵌合抗体的轻链序列的核酸序列;或
(iii)(i)和(ii)两者。
36. 一种宿主细胞,其包含实施方案35的表达载体。
37. 根据实施方案36的宿主细胞,其中所述宿主细胞是重组真核、重组原核或重组微生物宿主细胞。
38. 一种组合物,其包含根据实施方案1 - 27中任一项的抗体或根据实施方案28- 33中任一项的双特异性抗体。
39. 一种药物组合物,其包含根据实施方案1 - 27中任一项的抗体或根据实施方案28 - 33中任一项的双特异性抗体和药学可接受的载体。
40. 根据实施方案1 - 27中任一项的抗体、根据实施方案28 - 33中任一项的所述双特异性抗体、根据实施方案38的所述组合物、或根据实施方案39的所述药物组合物,其用作药剂。
41. 根据实施方案1 - 27中任一项的抗体、根据实施方案28 - 33中任一项的所述双特异性抗体、根据实施方案38的所述组合物、或根据实施方案39的所述药物组合物,其用于疾病治疗。
42. 一种疾病治疗方法,其包括给有此需要的受试者施用根据实施方案1 - 27中任一项的所述抗体、根据实施方案28 - 33中任一项的所述双特异性抗体、根据实施方案38的所述组合物、或根据实施方案39的所述药物组合物。
43. 根据实施方案40 - 42中任一项的用途或方法,其中所述疾病是癌症、传染病或自身免疫疾病。
44. 一种诊断特征在于CD3表达细胞的参与或累积的疾病的方法,其包括给受试者施用根据实施方案1 - 27中任一项的所述抗体、根据实施方案28 - 33中任一项的所述双特异性抗体、根据实施方案38的所述组合物、或根据实施方案39的所述药物组合物,任选地其中所述抗体或所述双特异性抗体用可检测试剂进行标记。
45. 一种用于产生根据实施方案1 - 27中任一项的抗体、或根据实施方案28 -33中任一项的双特异性抗体的方法,其包括下述步骤:
a)培养根据实施方案36 - 37中任一项的宿主细胞;和
b)从培养基中纯化所述抗体。
46. 一种诊断组合物,其包含根据实施方案1 - 27中任一项的抗体、或根据实施方案28 - 33中任一项的双特异性抗体。
47. 一种用于检测样品中的CD3抗原或表达CD3的细胞的存在的方法,其包括下述步骤:
a)在允许所述抗体或双特异性抗体和CD3之间的复合物形成的条件下,使样品与根据实施方案1 - 27中任一项的抗体、或根据实施方案28 - 33中任一项的双特异性抗体接触;和
b)分析是否已形成复合物。
48. 一种用于检测样品中的CD3抗原或表达CD3的细胞的存在的试剂盒,其包含:
i)根据实施方案1 - 27中任一项的抗体、或根据实施方案28 - 33中任一项的双特异性抗体;和
ii)所述试剂盒的使用说明书。
49. 一种抗独特型抗体,其与根据实施方案1 - 27中任一项的抗体结合。
实施例
实施例1 - 人源化CD3抗体和非活化抗体变体的生成
鼠CD3抗体(US 8,236,308,本文描述为IgG1-CD3)的人源化通过Antitope(Cambridge, UK)使用其改良版本的种系人源化(CDR移植)技术(EP 0 629 240)来执行。使用这种技术,设计了4种不同的VH链(SEQ ID NO:6、7、8和9)和3种不同的VL链(SEQ ID NO:10、11和12)。通过组合这4种VH与3种VL链,生成12种不同的抗体。人源化变体在本文中描述为huCD3。因此,包含根据本发明的VH和VL的人源化变体描述为例如IgG1-huCD3-H1L1,意指所述特异性变体具有IgG1同种型,是人源化的CD3,并且包含称为“H1”且根据SEQ ID NO:6进行限定的VH氨基酸序列、以及称为“L1”且根据SEQ ID NO:10进行限定的VL氨基酸序列。因此,H1指可变重链区VH1,L1指可变轻链区VL1,以此类推。
特别地,变体IgG1-huCD3-H1L1(包含SEQ ID NO:6中所示的VH1序列和SEQ ID NO:10中所示的VL1序列的人源化CD3)、IgG1-huCD3-H1L2(包含SEQ ID NO:6中所示的VH1序列和SEQ ID NO:11中所示的VL2序列的人源化CD3)、IgG1-huCD3-H1L3(包含SEQ ID NO:6中所示的VH1序列和SEQ ID NO:12中所示的VL3序列的人源化CD3)、IgG1-huCD3-H3L3(包含SEQID NO:8中所示的VH3序列和SEQ ID NO:12中所示的VL3序列的人源化CD3)、IgG1-huCD3-H4L1(包含SEQ ID NO:9中所示的VH4序列和SEQ ID NO:10中所示的VL1序列的人源化CD3)、IgG1-huCD3-H3L1(包含SEQ ID NO:8中所示的VH3序列和SEQ ID NO:10中所示的VL1序列的人源化CD3)、IgG1-huCD3-H3L3 (包含SEQ ID NO:8中所示的VH3序列和SEQ ID NO:12中所示的VL3序列的人源化CD3)、以及IgG1-huCD3-H4L3(包含SEQ ID NO:9中所示的VH4序列和SEQ ID NO:12中所示的VL3序列的人源化CD3)已在本文描述的实施例中进行生成且测试。
在一些例子中,包含huCLB-T3/4的重和轻链可变区序列的抗体 (分别为SEQ IDNO:17和18)用作对照抗体(Labrijn等人,PNAS 2013, 110: 5145-50),并且用于验证Fc区中的不同非活化突变组合(参见实施例8 - 10)。huCBL-T3/4是鼠CD3抗体CLB-T3/4的人源化形式(Parren等人,Res Immunol. 1991, 142(9):749-63)。将两个序列(SEQ ID NO:17和18)克隆到相关pcDNA3.3 (Invitrogen)表达载体内,并且通过在HEK293F细胞中共转染进行表达。所得到的对照抗体描述为IgG1-huCLB-T3/4。
在一些例子中,包含CD20抗体7D8的重和轻链可变区序列的抗体(SEQ ID NO: 29对应于VH序列,并且SEQ ID NO:30对应于VL序列)用作阳性对照。当在阳性对照的情况下使用时,它被称为“IgG1-CD20”。
这些IgG1-CD3(即嵌合、亲本CD3抗体)、IgG1-huCD3和IgG1-huCLB-T3/4抗体以单特异性和双特异性形式使用,其中双特异性抗体如下所述生成。
在一些例子中,使用针对HER2的抗体。关于这种HER2特异性抗体的VH和VL序列(抗体169,分别为SEQ ID NO:19和20)先前得到描述(WO2012/143524 [Genmab]; Labrijn等人,PNAS 2013, 110: 5145-50)。抗体以单特异性和双特异性形式两者使用,并且命名为“IgG1-HER2”。
在一些例子中,抗体b12,gp120特异性抗体(Barbas, CF. J Mol Biol. 1993 Apr5;230(3):812-23.)用作阴性对照,并且命名为“IgG1-b12”。
抗体作为IgG1,κ或IgG1,λ进行表达,含或不含下文描述的非活化突变,并且具有在CH3结构域中的突变,允许通过下文描述的方法生成双特异性抗体:IgG1-HER2-K409R、IgG1-b12-K409R, IgG1-CD3-F405L。基本上如由制造商描述的,使用293fectin(Invitrogen, US),将编码抗体的重和轻链两者的质粒DNA混合物瞬时转染到FreestyleHEK293F细胞(Invitrogen, US)内。
培养上清液经过0.2 µm盲端过滤器进行过滤,装载到5 mL MabSelect SuRe柱(GEHealth Care)上,并且用0.1 M柠檬酸钠-NaOH,pH 3进行洗脱。洗脱物用2M Tris-HCl,pH 9立即中和,并且针对12.6 mM NaH2PO4、140 mM NaCl,pH 7.4 (B.Braun)透析过夜。可选地,在纯化后,将洗脱物装载到HiPrep Desalting柱上,并且将抗体交换到12.6 mM NaH2PO4、140 mM NaCl,pH 7.4 (B.Braun)缓冲液内。在缓冲液透析或交换后,将样品经过0.2 µm盲端过滤器进行过滤。纯度通过SDS-PAGE确定,并且浓度通过在280 nm处的吸光度进行测量。将纯化的抗体贮存于2-8℃下。
如WO 2011/147986和Labrijn等人(Labrijn等人,PNAS 2013, 110: 5145-50;Gramer等人,MAbs 2013, 5: 962-973)中所述,使用DuoBody®平台技术即2-MEA诱导的Fab臂交换,在体外生成双特异性抗体。为了允许通过这种方法产生双特异性抗体,生成携带在CH3结构域中的单一突变的IgG1分子:在一种亲本IgG1抗体中,F405L突变(即IgG1-CD3抗体),在另一种亲本IgG1抗体中,K409R突变(即HER2或b12抗体)。为了生成双特异性抗体,使这两种亲本抗体(每种抗体为0.5 mg/mL的最终浓度)与25或75 mM 2-巯基乙胺-HCl (2-MEA)一起在500 μL TE的总体积中在31℃下温育5小时。当通过使用由25 mL PBS平衡的PD-10柱(GE-healthcare, 产品#17-0851-01)去除还原剂2-MEA时,还原反应停止。在脱盐前,将2 mL PBS (B.Braun, 产品#3623140)加入样品中,以将体积调整至2.5 mL。洗脱在3.5mL PBS中完成。将样品收集到Amicon Ultra离心单元(30 kD MWCO, Millipore, 产品#UFC803096)内,并且通过在3000x
以可选方式,获得相同的双特异性抗体,为了生成双特异性抗体,将100 µg两种亲本抗体混合,并且与75 mM 2-巯基乙胺-HCl (2-MEA)一起在400 μL PBS (B.Braun, 产品#3623140)的总体积中在31℃下温育5小时。当通过使用Amicon Ultra 0.5 ml离心单元(10kD MWCO, Millipore, 产品#UFC501096),且通过在3000x
所生成的双特异性抗体在下文中描述为“K409R IgG1主链”和“F405L IgG1主链”。
生成在Fc区中具有一种或多种氨基酸置换的几种抗体变体。非活化Fc区阻止抗体与血细胞例如单核细胞上存在的Fc受体相互作用,或与C1q相互作用,以活化经典补体途径。Fc活性的减少在抗体变体中进行测试,所述抗体变体含有在Fc区中的氨基酸置换的不同组合。引入最多五种氨基酸置换,其包括突变N297Q、L234A、L235A、L234F、L235E、D265A和P331S。将这五个氨基酸位置的一个或多个中的置换引入K409R和/或F405L IgG1主链。生成huCLB-T3/4抗体的下述Fc区变体:N297Q(指的是N297Q置换,命名为IgG1-huCLB-T3/4-N297Q)、LFLE (指的是L234F/L235E置换,命名为IgG1-huCLB-T3/4-LFLE)、LALA (指的是L234A/L235A置换,命名为IgG1-huCLB-T3/4-LALA)、LFLENQ (指的是L234F/L235E/N297Q置换,命名为IgG1-huCLB-T3/4-LFLENQ)、LFLEDA (指的是L234F/L235E/D265A置换,命名为IgG1-huCLB-T3/4-LFLEDA)、DA (指的是D265A置换,命名为IgG1-huCLB-T3/4-DA)、DAPS(指的是D265A/P331S置换,命名为IgG1-huCLB-T3/4-DAPS)、DANQ (指的是D265A/N297Q置换,命名为IgG1-huCLB-T3/4-DANQ)、LFLEPS (指的是L234F/L235E/P331S置换,命名为IgG1-huCLB-T3/4-LFLEPS)和LFLEDANQPS (指的是L234F/L235E/D265A/N297Q/P331S置换,命名为IgG1-huCLB-T3/4-LFLEDANQPS)。
特别地,在IgG1-huCD3抗体变体中,将三种氨基酸置换的组合(其包括突变L234F、L235E和D265A,并且被称为LFLEDA)引入K409R和F405L IgG1主链中,以生成具有非活化Fc区的抗体。所得到的非活化抗体变体用后缀“-LFLEDA”进行命名。
实施例2 - 人源化CD3抗体及其非活化变体与表达CD3的人和食蟹猴T细胞系的结合
通过FACS分析来分析含或不含在Fc区中的LFLEDA突变的人源化CD3 (huCD3)抗体和双特异性(bs)IgG1-huCD3 x HER2分子的纯化变体与人T细胞系Jurkat (Clone E6-1,ATCC
细胞(1x10
在PBS/0.1% BSA/0.02%叠氮化物中洗涤两次后,使细胞在100 μL中与二级抗体一起在4℃下一起温育30分钟。作为二级抗体,在PBS/0.1% BSA/0.02%叠氮化物中稀释1/100的R-藻红蛋白(PE)缀合的山羊抗人IgG F(ab’)2 (109-116-098, JacksonImmunoResearch Laboratories, Inc., West Grove, PA)被用于所有实验。接下来,将细胞在PBS/0.1% BSA/0.02%叠氮化物中洗涤两次,重悬浮于150 μL PBS/0.1% BSA/0.02%叠氮化物中,并且在FACS Cantoll (BD Biosciences)上进行分析。使用GraphPad PrismV5.04软件 (GraphPad Software, San Diego, CA, USA),使用非线性回归(具有可变斜率的S形剂量应答),来分析结合曲线。
图1A显示了对于所有变体均观察到具有野生型Fc区的IgG1λ-huCD3变体IgG1-huCD3-H1L1 (分别为SEQ ID NO:6和10)、IgG1-huCD3-H1L2 (分别为SEQ ID NO:6和11)、IgG1-huCD3-H1L3 (分别为SEQ ID NO:6和12)、IgG1-huCD3-H3L3 (分别为SEQ ID NO:8和12)和IgG1-huCD3-H4L1 (分别为SEQ ID NO:9和10)与Jurkat细胞的结合,并且IgG1-CD3-LFLEDA (如实施例1中所述的具有非活化LFLEDA突变的亲本CD3抗体)和具有非活化LFLEDA突变的IgG1-huCD3-H3L1-LFLEDA的结合能力类似于具有野生型Fc区的huCD3变体。与IgG1-huCD3变体相比较,作为阳性对照包括的IgG1-huCLB-T3/4与Jurkat细胞的结合很强。对于阴性对照抗体IgG1-b12未观察到结合。
图6A显示了IgG1-CD3-LFLEDA(如实施例1中所述的具有非活化LFLEDA突变的亲本CD3抗体)、IgG1-huCD3-H3L1-LFLEDA、IgG1-huCD3-H3L3-LFLEDA、IgG1-3huCD3-H1L1-LFLEDA、IgG1-huCD3-H1L3-LFLEDA、IgG1-huCD3-H4L1-LFLEDA和具有非活化LFLEDA突变的IgG1-huCD3-H4L3-LFLEDA的结合能力类似于具有野生型Fc区的huCD3变体的结合能力。与IgG1-huCD3变体相比较,作为阳性对照包括的IgG1-huCLB-T3/4与Jurkat细胞的结合在低抗体浓度下更强,但在更高的抗体浓度下相似。总之,人源化CD3变体已维持与IgG1-CD3抗体相似的与CD3的结合能力。对于阴性对照抗体IgG1-b12未观察到结合。
图1B显示了双特异性抗体变体bsIgG1 CD3 x HER2、bsIgG1 CD3 x b12-LFLEDA和bsIgG1 huCD3-H3L1 x HER2-LFLEDA也与Jurkat细胞结合。关于这些双特异性抗体的最大结合值高于单特异性抗体的最大结合值。双特异性抗体的EC50浓度高6 - 10倍。再次,对于阴性对照抗体IgG1-b12未观察到结合。
图6B显示了双特异性非活化Fc抗体变体bsIgG1 huCD3-H3L1 x HER2-LFLEDA、bsIgG1-huCD3-H3L3 x HER2-LFLEDA、bsIgG1-huCD3-H1L1 x HER2-LFLEDA、bsIgG1-huCD3-H1L3 x HER2-LFLEDA、bsIgG1-huCD3-H4L1 x HER2-LFLEDA和bsIgG1-huCD3-H4L3 x HER2-LFLEDA也与Jurkat细胞结合。关于这些双特异性抗体的最大结合值高于单特异性抗体的最大结合值。双特异性抗体的EC50浓度高4 - 10倍。单价结合允许更多抗体在细胞表面上累积,因此,允许关于双特异性抗体的更高结合值。再次,对于阴性对照抗体IgG1-b12未观察到结合。
图2A显示了IgG1-huCD3变体IgG1-huCD3-H1L1、IgG1-huCD3-H1L2、IgG1-huCD3-H1L3、IgG1-huCD3-H3L3和具有野生型Fc区的IgG1-huCD3-H4L1和IgG1-CD3-LFLEDA、IgG1-huCD3-H3L1-LFLEDA与食蟹猴T细胞系HSC-F的结合是相似的。对于对照抗体huCLB-T3/4(其不与食蟹猴CD3交叉反应)和阴性对照抗体IgG1-b12未观察到结合。
图7A显示了IgG1-huCD3变体IgG1-CD3-LFLEDA、IgG1-huCD3-H3L1-LFLEDA、IgG1-huCD3-H3L3-LFLEDA、IgG1-huCD3-H1L1-LFLEDA、IgG1-huCD3-H1L3-LFLEDA、IgG1-huCD3-H4L1-LFLEDA和IgG1-huCD3-H4L3-LFLEDA与食蟹猴T细胞系HSC-F的结合是相似的。对于阴性对照抗体IgG1-b12未观察到结合。
图2B显示了双特异性抗体变体bsIgG1 CD3 x HER2和bsIgG1 huCD3-H3L1-LFLEDA也与HSC-F细胞结合。关于这些双特异性抗体的最大结合值高于单特异性抗CD3变体的最大结合值。双特异性抗体的EC50浓度比单特异性抗CD3抗体的那种高10 - 12倍。再次,对于阴性对照抗体IgG1-b12未观察到结合。
图7B显示了双特异性非活化Fc抗体变体bsIgG1 huCD3-H3L1 x HER2-LFLEDA、bsIgG1-huCD3-H3L3 x HER2-LFLEDA、bsIgG1-huCD3-H1L1 x HER2-LFLEDA、bsIgG1-huCD3-H1L3 x HER2-LFLEDA、bsIgG1-huCD3-H4L1 x HER2-LFLEDA和bsIgG1-huCD3-H4L3 x HER2-LFLEDA也与HSC-F细胞结合。关于这些双特异性抗体的最大结合值高于单特异性抗CD3变体的最大结合值。双特异性抗体的EC50浓度比单特异性抗huCD3抗体的那种高3 - 6倍。再次,对于阴性对照抗体IgG1-b12未观察到结合。
实施例3 –通过人源化CD3抗体变体的T细胞活化
CD69表达是T细胞活化的早期标记物。CD3抗体可以经由抗体的Fc区例如IgG1 Fc区,通过由T细胞表达的CD3和由免疫细胞表达的Fc受体的结合,来介导T细胞和免疫细胞的交联。这可以导致T细胞活化和CD69的诱导。含有非活化Fc区(LFLEDA突变)的抗体变体不结合Fc受体。因此,预料非活化CD3抗体不诱导T细胞活化和CD69表达,因为非活化Fc区不与表达Fc受体的免疫细胞结合,并且因此不能交联T细胞和免疫细胞。
在T细胞上的CD69表达通过FACS分析进行评估,以确定与Fc区中含和不含LFLEDA突变的人源化CD3(huCD3)变体一起温育后的T细胞的早期活化。除了非活化突变之外,LFLEDA变体含有如实施例1中所述的F405L或K409R突变。
使用Leucosep管(#227290; Greiner Bio-one, Alphen a/d Rijn, 荷兰),通过密度梯度分离从全血或血沉棕黄层中分离PBMC,用PBS洗涤且重悬浮于培养基中。
在培养基中制备huCD3抗体变体的剂量应答系列、阴性对照(IgG1-b12)和阳性对照(IgE-huCD3和亲本IgG1-CD3)(在10倍稀释中范围为0.1 - 1,000 ng/mL),并且加入含有人或食蟹猴PBMC的96孔圆底板的孔中。在16-24小时温育后,通过离心使细胞形成团块,并且收集上清液(含有细胞因子),并且贮存于-20℃下。细胞随后用PBS/0.1% BSA/0.02%叠氮化物进行洗涤,并且在4℃下用小鼠抗人CD28-PE (854.222.010; Sanquin, Amsterdam,荷兰;T细胞标记物)和小鼠抗人CD69-APC抗体(340560; BD Biosciences, FranklinLakes, NJ)染色30分钟,其分别与食蟹猴CD28和CD69交叉反应。未结合的抗体通过用PBS/0.1% BSA/0.02%叠氮化物洗涤两次进行去除。细胞以150 µL/孔重悬浮,并且在FACS CantoII (BD Biosciences)上测量在CD28阳性细胞上的CD69表达。
图3显示了IgG1-CD3(如实施例1中所述)和具有野生型IgG1 Fc区的人源化IgG1-huCD3变体诱导来自人(图3A)和食蟹猴(图3B)起源的T细胞上的相似水平的CD69表达。非活化(LFLEDA) IgG1-CD3-LFLEDA和IgG1-huCD3-H3L1变体诱导在人T细胞中低水平的CD69表达。在食蟹猴T细胞中通过非活化IgG1-huCD3变体未诱导CD69的表达。对照抗体IgG1-b12在人或食蟹猴T细胞中也不诱导CD69的表达。
图8显示了非活化(LFLEDA) IgG1-huCD3-H3L1-LFLEDA、IgG1-huCD3-H3L3-LFLEDA、IgG1-3huCD3-H1L1-LFLEDA、IgG1-huCD3-H1L3-LFLEDA、IgG1-huCD3-H4L1-LFLEDA和IgG1-huCD3-H4L3-LFLEDA变体在人T细胞中诱导低水平的CD69表达。图8A和8B显示了在来自食蟹猴的T细胞上的CD69表达的诱导。通过观察到的非活化变体的微小活化可能是由于CD3分子通过CD3抗体的二价结合的交联。此类说明通过下述观察得到支持:活化在其中抗体结合是单价的最高浓度下是减少的。对照抗体IgG1-b12在人或食蟹猴T细胞中也不诱导CD69的表达。
图8C和8D显示了非活化双特异性抗体变体bsIgG1-huCD3-H3L1 x HER2-LFLEDA、bsIgG1-huCD3-H3L3 x HER2-LFLEDA、bsIgG1-huCD3-H1L1 x HER2-LFLEDA、bsIgG1-huCD3-H1L3 x HER2-LFLEDA、bsIgG1-huCD3-H4L1 x HER2-LFLEDA和bsIgG1-huCD3-H4L3 x HER2-LFLEDA在来自人(图8C)或食蟹猴(图8D)的T细胞中不诱导CD69的表达。然而,在更高的抗体浓度下,观察到CD69表达的一些诱导。
实施例4 –通过人源化CD3抗体变体诱导的T细胞增殖。
通过来自Roche Applied Science (Cell Proliferation ELISA, BrdU kit, #11647229001; Roche Applied Science, Mannheim, 德国)的细胞增殖ELISA试剂盒(其根据制造商的说明书来执行),评估人源化CD3 (huCD3)抗体变体(实施例1中所述)对人和食蟹猴T细胞的增殖的作用。
从全血或血沉棕黄层中分离的人或食蟹猴PBMC在96孔培养板中与IgG1 huCD3抗体变体的稀释系列(在10倍稀释中范围为0.1 - 1,000 ng/mL)一起温育。包括IgE-CD3和IgG1-huCLB-T3/4作为阳性对照,并且包括IgG1-b12作为阴性对照。在与抗体的3天温育后,将BrdU (Roche Applied Science, Mannheim, 德国)加入培养基中,并且将板温育5小时。细胞随后通过离心形成团块,并且收集上清液且贮存于-20℃下。将板干燥且贮存于4℃下直至执行ELISA时。
根据制造商的说明书(Roche Applied Science),通过ELISA确定DNA中的BrdU掺入。其中在板在RT下与抗BrdU抗体一起温育90分钟后,将细胞固定至板,所述抗BrdU抗体与过氧化物酶缀合。将板用PBST进行洗涤,并且使用ABTS缓冲液(代替与试剂盒一起提供的TMB溶液)检测结合。通过将2%草酸加入孔中,在30分钟后停止显色。随后在EL808 ELISA阅读器上测量OD405 nm。
图4显示了即使在极低浓度的抗体下,PBMC与亲本IgG1-CD3和具有野生型IgG1 Fc区的人源化IgG1-huCD3变体一起温育也诱导人(图4A)和食蟹猴(图4B) T细胞的显著增殖。与IgG1-huCD3抗体的非活化LFLEDA变体一起温育不诱导人T细胞(图4A和9A)或食蟹猴T细胞(图4B和9B)的增殖。因此,尽管IgG1-huCD3抗体的非活化变体在人T细胞中诱导低水平的CD69表达(如实施例3中所示),但通过这些非活化IgG1-huCD3变体未诱导人T细胞的增殖。
图9C和9D显示了非活化双特异性抗体变体bsIgG1-huCD3-H3L1 x HER2-LFLEDA、bsIgG1-huCD3-H3L3 x HER2-LFLEDA、bsIgG1-huCD3-H1L1 x HER2-LFLEDA、bsIgG1-huCD3-H1L3 x HER2-LFLEDA、bsIgG1-huCD3-H4L1 x HER2-LFLEDA和bsIgG1-huCD3-H4L3 x HER2-LFLEDA不诱导从人(图9C)或食蟹猴(图9D)中分离的T细胞的增殖。
实施例5 –通过人源化CD3抗体变体诱导的体外T细胞介导的细胞毒性
肿瘤特异性T细胞毒性可以通过双特异性抗体进行介导,所述双特异性抗体以一个臂与CD3结合并且另一个臂与肿瘤特异性靶例如HER2结合。双特异性抗体与T细胞和肿瘤细胞两者的同时结合将导致T细胞活化和肿瘤细胞特异性细胞毒性。在这个实施例中,使用针对CD3(人源化变体)和HER2的双特异性抗体,来评估T细胞介导的针对HER2阳性肿瘤细胞的细胞毒性。
因此,AU565(人乳腺癌)细胞在RPMI 1640中进行培养,所述RPMI 1640补充有10%(体积/体积)热灭活的CCS、1.5 g/L碳酸氢钠(Lonza)、1 mM丙酮酸钠、4.5 g/L葡萄糖(Sigma)、50 IU/mL青霉素和50 μg/mL链霉素。细胞系维持在37℃下在5% (体积/体积) CO
从全血或血沉棕黄层中分离人或食蟹猴PBMC。分离的PBMC用PBS进行洗涤,重悬浮于培养基中,并且以1:1比加入96孔板中的AU565肿瘤细胞中。使用小鼠抗人CD3-PerCP(BD, #345766)抗体(用于染色T细胞),通过FACS分析测量PBMC中存在的T细胞百分比,其与食蟹猴CD3交叉反应。所使用的PBMC的群体中的T细胞含量通常为50 - 60%。
在培养基中制备双特异性抗体变体bsIgG1 CD3 x HER2-LFLEDA、bsIgG1 CD3 xb12-LFLEDA、bsIgG1 huCD3-H3L1 x HER2-LFLEDA、bsIgG1-huCD3-H3L3 x HER2-LFLEDA、bsIgG1-huCD3-H1L1 x HER2-LFLEDA、bsIgG1-huCD3-H1L3 x HER2-LFLEDA、bsIgG1-huCD3-H4L1 x HER2-LFLEDA和bsIgG1-huCD3-H4L3 x HER2-LFLEDA的稀释系列(最终浓度范围从0.001至多达10,000 ng/mL),并且加入板中。包括IgG1-HER2-LFLEDA和IgG1-b12作为对照。除了非活化突变之外,LFLEDA抗体变体含有F405L或K409R突变用于以双特异性形式制备(参见实施例1)。板在37℃、5% CO
双特异性CD3xHER2-LFLEDA抗体变体(bsIgG1-huCLB-T3/4xHER2-LFLEDA和bsIgG1-CD3xHER2-LFLEDA) 在低浓度下诱导AU565细胞的杀伤,使用人效应细胞(图5A)或食蟹猴效应细胞(图5B)。当使用人PBMC时(图5A) , CD3双特异性对照抗体huCLB-T3/4xHER2-LFLEDA(其未显示与食蟹猴CD3的交叉反应性)仅诱导AU565细胞的杀伤。因此,当在测定中使用食蟹猴效应细胞时,未观察到靶细胞的杀伤。与单特异性IGG1-b12或IgG1-HER2-LFLEDA或bsIgG1-CD3xb12-LFLEDA抗体一起温育不诱导靶细胞的非特异性杀伤。
双特异性抗体变体bsIgG1 huCD3-H3L1 x HER2-LFLEDA、bsIgG1-huCD3-H3L3 xHER2-LFLEDA、bsIgG1-huCD3-H1L1 x HER2-LFLEDA、bsIgG1-huCD3-H1L3 x HER2-LFLEDA、bsIgG1-huCD3-H4L1 x HER2-LFLEDA和bsIgG1-huCD3-H4L3 x HER2-LFLEDA在低浓度下诱导AU565细胞的杀伤,使用人效应细胞(图10A)或食蟹猴效应细胞(图10B)。与单特异性IgG1-b12或IgG1-HER2-LFLEDA抗体一起温育不诱导非特异性靶细胞杀伤(图10A和B)。因此,包含非活化Fc区的人源化CD3变体不诱导非特异性靶细胞杀伤,其指示包含非活化Fc区的变体可以用于确保靶向T细胞活化,并且因此避免非靶向T细胞活化。
实施例6 –通过人源化CD3抗体变体的恒河猴T细胞活化
评估在恒河猴T细胞上的CD69表达,以确定在与具有野生型IgG1 Fc区的人源化CD3 (huCD3)抗体变体一起温育后的T细胞的早期活化。如实施例3中所述执行恒河猴PBMC分离和通过流式细胞术的CD69表达评估。
图11显示了人源化CD3抗体变体IgG1-huCD3-H1L1、IgG1-huCD3-H1L2、IgG1-huCD3-H1L3、IgG1-huCD3-H3L3和IgG1-huCD3-H4L1诱导来自恒河猴起源的T细胞上的CD69表达至与IgG1-CD3相似的水平(如实施例1中所述)。阴性对照抗体IgG1-b12在恒河猴T细胞中不诱导CD69的表达。因此,根据本发明的huCD3变体可以用于涉及恒河猴CD3的实验中。huCD3变体与恒河猴CD3是交叉反应的。
实施例7 - 通过huCLB-T3/4的非活化变体的T细胞活化
在T细胞上的CD69表达通过FACS分析进行评估,以确定与Fc区中具有突变的IgG1-huCLB-T3/4变体一起温育后的T细胞的早期活化(参见实施例1)。
使用Leucosep管(#227290; Greiner Bio-one, Alphen a/d Rijn, 荷兰),通过密度梯度分离从全血或血沉棕黄层中分离PBMC,用PBS洗涤且重悬浮于培养基中。
在培养基中制备IgG1-huCLB-T3/4变体的剂量应答系列、阴性对照(IgG1-huCLB-T3/4-Fab)和阳性对照(IgE-huCLB-T3/4)(在3倍稀释中范围为1 - 1000 ng/mL),并且加入含有PBMC的96孔圆底板的孔中。在16-24小时温育后,通过离心使细胞形成团块,并且收集上清液(含有细胞因子),并且贮存于-20℃下。细胞随后用PBS/0.1% BSA/0.02%叠氮化物进行洗涤,并且在4℃下用小鼠抗人CD28-PE (854.222.010; Sanquin, Amsterdam, 荷兰;T细胞标记物)和小鼠抗人CD69-APC抗体(340560; BD Biosciences, Franklin Lakes, NJ)染色30分钟。未结合的抗体通过用PBS/0.1% BSA/0.02%叠氮化物洗涤两次进行去除。细胞以150 µL/孔重悬浮,并且在FACS Canto II (BD Biosciences)上测量在CD28阳性细胞上的CD69表达。
图12A显示了CD69表达在与IgE-huCLB-T3/4、IgG1-huCLB-T3/4、IgG1-huCLB-T3/4-DA和IgG1-huCLB-T3/4-DAPS一起温育的细胞上很高。与IgG1-huCLB-T3/4-N297Q一起温育诱导与野生型IgG1-huCLB-T3/4相比较略微更低的CD69表达水平,并且与IgG1-huCLB-T3/4-LFLE和IgG1-huCLB-T3/4-LFLEPS一起温育诱导CD69至较低程度。PBMC与IgG1-CD3Fab、IgG1-huCLB-T3/4-LFLEDA、IgG1-huCLB-T3/4-LFLENQ、IgG1-huCLB-T3/4-DANQ和IgG1-huCLB-T3/4-LFLEDANQPS抗体一起温育不诱导在T细胞上的任何CD69表达。
图12B显示了CD69表达在与IgE-huCLB-T3/4和IgG1-huCLB-T3/4一起温育的细胞上很高。与IgG1-huCLB-T3/4-LALA一起温育诱导与野生型IgG1-huCLB-T3/4相比较略微更低的CD69表达水平,并且与IgG1-huCLB-T3/4-LFLEDA和IgG1-b12(阴性对照)一起温育不诱导在T细胞上的任何CD69表达。
实施例8 –通过huCLB-T3/4的非活化变体的T细胞增殖
通过来自Roche Applied Science (Cell Proliferation ELISA, BrdU kit, #11647229001; Roche Applied Science, Mannheim, 德国)的细胞增殖ELISA试剂盒(其根据制造商的说明书来执行),评估huCLB-T3/4变体(实施例1中所述)对T细胞的增殖的作用。
从全血或血沉棕黄层中分离的PBMC在96孔培养板中与IgG1-CD3变体的稀释系列(范围为0.1 - 1000 ng/mL)一起温育。包括IgE-CD3和IgG1-CD3作为阳性对照,并且包括IgG1-b12(具有K409R突变用于生成双特异性抗体)作为阴性对照。在与抗体的3天温育后,将BrdU (Roche Applied Science, Mannheim, 德国)加入培养基中,并且将板温育5小时。细胞随后通过离心形成团块,并且收集上清液且贮存于-20℃下。将板干燥且贮存于4℃下直至执行ELISA。
根据制造商的说明书(Cell Proliferation ELISA, BrdU kit, #11647229001;Roche Applied Science),通过ELISA确定DNA中的BrdU掺入。其中在板在室温(RT)下与抗BrdU抗体一起温育90分钟后,将细胞固定至板,所述抗BrdU抗体与过氧化物酶缀合。将板用PBST进行洗涤,并且使用ABTS缓冲液(代替与试剂盒一起提供的TMB溶液)检测结合。通过将2%草酸加入孔中,在30分钟后停止显色。随后在EL808 ELISA阅读器上测量OD405 nm。
图13A显示了即使在极低浓度的抗体下,PBMC与IgG1-huCLB-T3/4、IgG1-huCLB-T3/4-DA和IgG1- huCLB-T3/4-DAPS一起温育也诱导T细胞的显著增殖。与IgG1-huCLB-T3/4-N297Q一起温育诱导剂量依赖性增殖,其与IgE-huCLB-T3/4阳性对照可比较。PBMC与IgG1-huCLB-T3/4-Fab、IgG1-b12-N297Q、IgG1-huCLB-T3/4-LFLE、IgG1-huCLB-T3/4-LFLEDA、IgG1-huCLB-T3/4-LFLENQ、IgG1-huCLB-T3/4-LFLEPS、IgG1-huCLB-T3/4-DANQ和IgG1-huCLB-T3/4-LFLEDANQPS抗体一起温育不诱导T细胞的增殖。
图13B显示了即使在极低浓度的抗体下,PBMC与IgG1-huCLB-T3/4一起温育也诱导T细胞的显著增殖。与IgE-huCLB-T3/4(阳性对照)和IgG1-huCLB-T3/4-LALA一起温育诱导剂量依赖性增殖。PBMC与IgG1-huCLB-T3/4-LFLEDA一起温育不诱导T细胞的增殖。
基于来自实施例7和8的结果,对视为最不活化的突变体子集实施进一步分析。
实施例9 –通过非活化抗体变体huCLB-T3/4诱导的体外T细胞介导的细胞毒性
AU565(人乳腺癌)细胞在RPMI 1640中进行培养,所述RPMI 1640补充有10%(体积/体积)热灭活的CCS、1.5 g/L碳酸氢钠(Lonza)、1 mM丙酮酸钠、4.5 g/L葡萄糖(Sigma)、50IU/mL青霉素和50 μg/mL链霉素。细胞系维持在37℃下在5% (体积/体积) CO
根据制造商的方案(Greiner Bio-one),使用Leucosep 30 mL管,从来自健康志愿者的血液中分离外周血单核细胞(PBMC)。分离的PBMC用PBS进行洗涤,重悬浮于培养基中,并且以1:1比加入96孔板中的AU565肿瘤细胞中。使用小鼠抗人CD3-PerCP (BD, #345766)抗体(用于染色T细胞),通过FACS分析测量PBMC中存在的T细胞百分比。所使用的PBMC的群体中的T细胞含量通常为50 - 60%。
在培养基中制备作为不同Fc变体、野生型、N297Q、LFLE、LALA、LFLENQ、LFLEDA、DANQ和LFLEDENQPS表达的IgG1-b12、IgG1-huCLB-T3/4、IgG1-HER2和双特异性huCLB-T3/4xb12和huCLB-T3/4xHER2抗体的稀释系列(最终浓度范围为0.004 - 1000 ng/mL),并且加入板中。板在37℃、5% CO
使用来自不同供体的PBMC执行两次实验。在第一次实验中,测试Fc变体N297Q、LFLE、LFLENQ、LFLEDA、DANQ和LFLEDANQPS (图14A-G)。在第二次实验中,测试Fc变体LFLEDA和LALA(图15A-C)。在两次实验中包括具有野生型Fc结构域的抗体作为参考。与野生型单特异性IgG1-huCLB-T3/4或双特异性huCLB-T3/4xb12抗体一起温育诱导靶细胞的非特异性杀伤(图14A-G和15A-C)。单特异性IgG1-huCLB-T3/4和bsIgG1-huCLB-T3/4xb12变体N297Q(图14A-G)和LALA (图15A-C)仍诱导一些非特异性靶细胞杀伤,尽管至比相同实验中测试的野生型抗体更少的程度。非特异性靶细胞杀伤未通过其他测试的具有非活化突变的IgG1-huCLB-T3/4或bsIgG1-huCLB-T3/4xb12抗体中的任一种诱导(图14A-G和15A-C)。
所有双特异性huCLB-T3/4xHER2抗体均诱导AU565细胞的剂量依赖性杀伤,具有与不含非活化突变的野生型双特异性huCLB-T3/4xHER2抗体相比较至少可比较的功效(图14A-G和15A-C)。最大杀伤在极低浓度下发生。
通过单特异性b12或HER2抗体的野生型或非活化变体未诱导细胞毒性,这如预期的。
实施例10 – C1q与huCLB-T3/4的非活化抗体变体的结合的评估
C1q与结合靶细胞的抗体的相互作用是补体活化的经典途径中的第一步。因为野生型IgG1具有关于C1q的相互作用位点,所以通过ELISA评估C1q与这些非活化IgG1变体的相互作用。
将IgG1-huCLB-T3/4、bsIgG1-huCLB-T3/4xHER2和IgG1-CD20(阳性对照)和如上文实施例1中所述的其非活化抗体变体的稀释系列(在4倍稀释中范围7-30,000 ng/mL)包被到96孔Microlon ELISA板(Greiner, 德国)在4℃下过夜。将板用补充有0.025% Tween 20和0.1%明胶的PBS进行且阻断。伴随在温育之间的洗涤,使板顺次与3%混合人血清(Sanquin, 产品# M0008)一起在37℃下温育1小时,与100 μL/孔兔抗人C1q (DAKO, 产品#A0136, 1/4,000)一起在RT下温育1小时,并且与100 μL/孔作为检测抗体的猪抗兔IgG-HRP(DAKO, P0399, 1:10,000)一起在RT下温育1小时。检测通过添加1 mg/mL 2,2’-连氮基双(3-乙基-苯并噻唑啉-6-磺酸)(ABTS; Roche, Mannheim, 德国)执行约30分钟。反应通过添加100 μL 2%草酸得到停止。吸光度在酶标仪(Biotek, Winooski, VT)中在405 nm处进行测量。通过使用GraphPad Prism软件,用可变斜率拟合S形应答曲线来分析对数转化的数据。
图16A显示了具有野生型IgG1 Fc区的抗体IgG1-CD20和IgG1-huCLB-T3/4显示C1q结合。在具有非活化突变(N297Q、LFLE、LFLENQ、LFLEDA、DA、DAPS、DANQ、LFLEPS、LFLEDANQPS、LALA)的所有评估的抗体变体上未检测到C1q的结合。
图16B显示了具有野生型IgG1 Fc区的抗体bsIgG1-huCLB-T3/4xHER2显示C1q结合。在具有非活化突变(N297Q、LFLE、LFLENQ、LFLEDA、DA、DAPS、DANQ、LFLEPS、LFLEDANQPS、LALA)的所有评估的抗体变体上未检测到C1q的结合。
图16C和图16D显示了具有野生型IgG1 Fc区的抗体IgG1-CD20、IgG1-huCLB-T3/4和bsIgG1-huCLB-T3/4xHER2显示C1q结合。在具有非活化突变(LFLEDA和LALA)的抗体变体上未检测到C1q的结合。
实施例11 –非活化抗体变体的药物代谢动力学(PK)分析
将该研究中的小鼠饲养在Central Laboratory Animal Facility (Utrecht, 荷兰)的屏障单位中,并且保持在滤盖笼中,其中水和食物任意提供。所有实验均得到UtrechtUniversity动物伦理委员会批准。将7-10周龄C.B-17 SCID小鼠(C.B-17/Icr-Prkdc
使用总hIgG夹心ELISA确定人IgG浓度。对于该测定,以2 μg/mL的浓度包被至96孔Microlon ELISA板的小鼠mAb抗人IgGκ克隆MH16 (#M1268, CLB Sanquin, 荷兰)用作捕获抗体。在用补充有0.2%牛血清白蛋白的PBS封闭板后,加入样品,用ELISA缓冲液(补充有0.05% Tween 20和0.2%牛血清白蛋白的PBS)系列稀释,并且在板振荡器上在室温(RT)下温育1小时。板随后与山羊抗人IgG免疫球蛋白(#109-035-098, Jackson, West Grace, PA)一起温育,并且用2,2'-联氮基-双(3-乙基苯并噻唑啉-6-磺酸)(ABTS; Roche, Mannheim,德国)显色。在30分钟后通过将2%草酸加入孔中来停止反应。在酶标仪(Biotek, Winooski,VT)中测量在405 nm处的吸光度。
根据下述等式,基于曲线下面积(AUC)计算血浆清除率(mL/天/kg):
使用Graphpad prism软件执行数据分析。
图17A显示了当与野生型抗体相比较时,血浆人IgG浓度对于抗体变体N297Q、DANQ、LFLENQ和LFLEDANQPS更低,提示更快的清除。关于抗体变体LFLEDA和LALA在血浆中的人IgG浓度类似于野生型抗体的那些。
图17B显示了抗体变体N297Q、DANQ和LFLENQ的血浆清除率比野生型抗体的那种高2 - 3倍。抗体变体LFLEDANQPS的清除率比野生型抗体的那种高3-5倍。抗体变体LFLEDA和LALA的血浆清除率类似于野生型抗体的那种。
实施例12 – IgG1-LFLEDA主链的体外免疫原性评价
为了确定IgG1-LFLEDA-K409R主链的临床免疫原性的潜力,将Antitope’sEpiScreen™平台应用于IgG1-HER2-LFLEDA。简言之,从代表欧洲和北美群体的50个HLA分型的健康个体的队列中分离PBMC。在CD8+ T细胞耗尽后,将PBMC制剂个别冷冻且贮存。随后将解冻的PBMC培养,并且与IgG1-HER2-LFLEDA-K409R或对照样品之一(IgG1-HER2或IgG1-HER2-LFLE-K409R)一起温育5 - 8天。通过测量细胞增殖([3
EpiScreen™分析显示对于IgG1-HER2-LFLEDA,4个供体(8%)显示阳性CD4+ T细胞应答,其分别与IgG1-HER2和IgG1-HER2-LFLE的4 (8%)和3 (6%)个阳性应答可比较(图18)。因此,IgG1-HER2-LFLEDA-K409R (以及IgG1-HER2和IgG1-HER2-LFLE-K409R)显示关于免疫原性的低潜力,其中应答的频率低于10%。阳性对照人源化A33 (例如[84])用作临床基准对照抗体,其在临床中显示高水平的免疫原性,并且照常规在EpiScreen测定中诱导20-30% T细胞应答。
参考文献列表
[1] Xu等人,2000, Cell Immunol. 200(1):16-26
[2] Herold等人,2005, Diabetes, 54(6):1763-9
[3] Staerz等人,1985, Nature 314:628-631
[4] Muller和Kontermann, 2010, BioDrugs 24: 89-98
[5] Lum和Thakur, 2011, BioDrugs 25: 365-379
[6] Linke等人,2010, MAbs 2: 129-136
[7] Ruf等人,2010, Br J Clin Pharmacol 69: 617-625
[8] Bokemeyer等人,2009, J Clin Oncol (Meeting Abstracts), 3036
[9] Heiss等人,2010, Int J Cancer 127: 2209-2221
[10] Jones等人,2009, Lancet Oncol 10:1179-1187
[11] Kiewe等人,2006, Clin Cancer Res 12:3085-3091
[12] WO 2012/162067
[13] WO 2008/119567
[14] Fundamental Immunology Ch. 7, Paul, W.,编辑,第2版,Raven Press,N.Y. (1989)
[15] Lefranc MP,等人,2003, Dev Comp Immunol. Jan;27(1):55-77
[16] Brochet, X.等人,2008, Nucl.Acids Res. 36, W503-508
[17] Giudicelli, V., Brochet, X, Lefranc, M.-P., 2011, Cold SpringHarb Protoc. Jun 1;2011(6)
[18] Sambrook等人,1989, Molecular Cloning: A laboratory Manual, NewYork: Cold Spring Harbor Laboratory Press, Ch. 15
[19] WO92/22653
[20] EP 0 629 240
[21] E. Meyers和W. Miller, 1988, Comput. Appl. Biosci
[22] Needleman和Wunsch, 1970, J. Mol. Biol.
[23] Clustal W algorithm, Thompson, 1994
[24] T cell Epitope Database from e.g. http://www.iedb.org/
[25] Perry等人,2008 Drugs R D 9 (6):385-396
[26] Bryson等人,2010, Biodrugs 24 (1):1-8
[27] Kabat, E.A.等人,1991, Sequences of proteins of immunologicalinterest. 5th Edition - US Department of Health and Human Services, NIH公开号91-3242, 第662,680,689页
[28] Oganesyan等人,2008, Acta Cryst. (D64):700-4
[29] Canfield等人,1991, J. Exp.Med. (173):1483-91
[30] Duncan等人,1988, Nature (332):738-40
[31] Shields等人,2001, J. Biol. Chem. (276):6591-604
[32] Idusogie EE,等人,2000, J Immunol. 164: 4178-84
[33] Leabman等人,2013, MAbs; 5(6):896-903
[34] Parren等人,1992, J. Clin Invest. 90: 1537-1546
[35] Bruhns
[36] WO 2011/066501
[37] Lightle, S.,等人,2010, Protein Science (19):753-62
[38] Brekke等人,2006, J Immunol 177:1129-1138
[39] Dall’Acqua WF,等人,2006, J Immunol 177:1129-1138
[40] Wu等人,2010, Generation and Characterization of a Dual VariableDomain Immunoglobulin (DVD-Ig™) Molecule, In: Antibody Engineering, SpringerBerlin Heidelberg
[41] WO 2011/131746
[42] WO 2002/020039
[43] WO 98/050431
[44] WO 2011/117329
[45] EP 1 870 459
[46] WO 2009/089004
[47] US 2010 00155133
[48] WO 2010/129304
[49] WO 2007/110205
[50] WO 2010/015792
[51] WO 2011/143545
[52] WO 2012/058768
[53] WO 2011/028952
[54] WO 2008/003116
[55] US 7,262,028
[56] US 7,612,181
[57] WO 2010/0226923
[58] US 7,951,918
[59] CN 102250246
[60] WO 2012/025525
[61] WO 2012/025530
[62] WO 2008/157379
[63] WO 2010/080538
[64] Sykes和Johnston, 1997, Nat Biotech
[65] US 6,077,835
[66] WO 2000/70087
[67] Schakowski等人,2001, Mol Ther
[68] WO 2000/46147
[69] Benvenisty和Reshef, 1986, PNAS USA
[70] Wigler等人,1978, Cell
[71] Coraro和Pearson, 1981, Somatic Cell Genetics 7, 603
[72] US 5,589,466
[73] US 5,973,972
[74] Van Heeke & Schuster, 1989, J Biol Chem 264, 5503-5509
[75] F. Ausubel等人,1987, 编辑Current Protocols in Molecular Biology,Greene Publishing and Wiley InterScience New York
[76] Grant等人,1987, Methods in Enzymol 153, 516-544
[77] Remington: The Science and Practice of Pharmacy, 19th Edition,Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995
[78] Sustained and Controlled Release Drug Delivery Systems, J.R.Robinson, 编辑,Marcel Dekker, Inc., New York, 1978
[79] Srivastava (编辑.), Radiolabeled Monoclonal Antibodies ForImaging And Therapy, Plenum Press 1988
[80] Chase, "Medical Applications of Radioisotopes," in Remington'sPharmaceutical Sciences, 第18版,Gennaro等人,(编辑), 第624-652页, MackPublishing Co., 1990
[81] Brown, "Clinical Use of Monoclonal Antibodies," in BiotechnologyAnd Pharmacy 227-49, Pezzuto等人,(编辑), Chapman & Hall 1993
[82] US 5,057,313
[83] US 6,331,175
[84] Ritter G等人;2001, Cancer Res., 61:6851-9。
序列表
<110> 根马布股份公司
<120> 人源化或嵌合CD3抗体
<130> P/0082-WO
<160> 30
<170> PatentIn version 3.5
<210> 1
<211> 8
<212> PRT
<213> 智人
<400> 1
Gly Phe Thr Phe Asn Thr Tyr Ala
1 5
<210> 2
<211> 10
<212> PRT
<213> 智人
<400> 2
Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr
1 5 10
<210> 3
<211> 16
<212> PRT
<213> 智人
<400> 3
Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1 5 10 15
<210> 4
<211> 9
<212> PRT
<213> 智人
<400> 4
Thr Gly Ala Val Thr Thr Ser Asn Tyr
1 5
<210> 5
<211> 9
<212> PRT
<213> 智人
<400> 5
Ala Leu Trp Tyr Ser Asn Leu Trp Val
1 5
<210> 6
<211> 125
<212> PRT
<213> 智人
<400> 6
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Met Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 7
<211> 125
<212> PRT
<213> 智人
<400> 7
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Met Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 8
<211> 125
<212> PRT
<213> 智人
<400> 8
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Met Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 9
<211> 125
<212> PRT
<213> 智人
<400> 9
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Met Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120 125
<210> 10
<211> 109
<212> PRT
<213> 智人
<400> 10
Gln Ala Val Val Thr Gln Glu Pro Ser Phe Ser Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Thr Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Ile Gly Asp Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Asp Asp Glu Ser Ile Tyr Phe Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 11
<211> 109
<212> PRT
<213> 智人
<400> 11
Gln Ala Val Val Thr Gln Glu Pro Ser Phe Ser Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Thr Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Ile Leu Gly Asn Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Asp Asp Glu Ser Ile Tyr Phe Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 12
<211> 109
<212> PRT
<213> 智人
<400> 12
Gln Ala Val Val Thr Gln Glu Pro Ser Phe Ser Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Thr Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Ile Leu Gly Asn Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Asp Asp Glu Ser Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 13
<211> 186
<212> PRT
<213> 智人
<400> 13
Gln Asp Gly Asn Glu Glu Met Gly Gly Ile Thr Gln Thr Pro Tyr Lys
1 5 10 15
Val Ser Ile Ser Gly Thr Thr Val Ile Leu Thr Cys Pro Gln Tyr Pro
20 25 30
Gly Ser Glu Ile Leu Trp Gln His Asn Asp Lys Asn Ile Gly Gly Asp
35 40 45
Glu Asp Asp Lys Asn Ile Gly Ser Asp Glu Asp His Leu Ser Leu Lys
50 55 60
Glu Phe Ser Glu Leu Glu Gln Ser Gly Tyr Tyr Val Cys Tyr Pro Arg
65 70 75 80
Gly Ser Lys Pro Glu Asp Ala Asn Phe Tyr Leu Tyr Leu Arg Ala Arg
85 90 95
Val Cys Glu Asn Cys Met Glu Met Asp Val Met Ser Val Ala Thr Ile
100 105 110
Val Ile Val Asp Ile Cys Ile Thr Gly Gly Leu Leu Leu Leu Val Tyr
115 120 125
Tyr Trp Ser Lys Asn Arg Lys Ala Lys Ala Lys Pro Val Thr Arg Gly
130 135 140
Ala Gly Ala Gly Gly Arg Gln Arg Gly Gln Asn Lys Glu Arg Pro Pro
145 150 155 160
Pro Val Pro Asn Pro Asp Tyr Glu Pro Ile Arg Lys Gly Gln Arg Asp
165 170 175
Leu Tyr Ser Gly Leu Asn Gln Arg Arg Ile
180 185
<210> 14
<211> 150
<212> PRT
<213> 智人
<400> 14
Phe Lys Ile Pro Ile Glu Glu Leu Glu Asp Arg Val Phe Val Asn Cys
1 5 10 15
Asn Thr Ser Ile Thr Trp Val Glu Gly Thr Val Gly Thr Leu Leu Ser
20 25 30
Asp Ile Thr Arg Leu Asp Leu Gly Lys Arg Ile Leu Asp Pro Arg Gly
35 40 45
Ile Tyr Arg Cys Asn Gly Thr Asp Ile Tyr Lys Asp Lys Glu Ser Thr
50 55 60
Val Gln Val His Tyr Arg Met Cys Gln Ser Cys Val Glu Leu Asp Pro
65 70 75 80
Ala Thr Val Ala Gly Ile Ile Val Thr Asp Val Ile Ala Thr Leu Leu
85 90 95
Leu Ala Leu Gly Val Phe Cys Phe Ala Gly His Glu Thr Gly Arg Leu
100 105 110
Ser Gly Ala Ala Asp Thr Gln Ala Leu Leu Arg Asn Asp Gln Val Tyr
115 120 125
Gln Pro Leu Arg Asp Arg Asp Asp Ala Gln Tyr Ser His Leu Gly Gly
130 135 140
Asn Trp Ala Arg Asn Lys
145 150
<210> 15
<211> 330
<212> PRT
<213> 智人
<400> 15
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 16
<211> 330
<212> PRT
<213> 智人
<400> 16
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Ala Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 17
<211> 119
<212> PRT
<213> 智人
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Phe Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Arg Tyr Ser Arg Tyr Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Pro Leu Tyr Gly Ser Ser Pro Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 18
<211> 106
<212> PRT
<213> 智人
<400> 18
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Ser Ala Ser Ser Ser Val Thr Tyr Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Phe Gln Gly Ser Gly Tyr Pro Leu Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Met Arg
100 105
<210> 19
<211> 121
<212> PRT
<213> 智人
<400> 19
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Leu Ser Ala Tyr Ser Gly Asn Thr Ile Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Ile Val Val Arg Pro Asp Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 20
<211> 107
<212> PRT
<213> 智人
<400> 20
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 21
<211> 177
<212> PRT
<213> 智人
<400> 21
Gln Asp Gly Asn Glu Glu Met Gly Ser Ile Thr Gln Thr Pro Tyr Gln
1 5 10 15
Val Ser Ile Ser Gly Thr Thr Val Ile Leu Thr Cys Ser Gln His Leu
20 25 30
Gly Ser Glu Ala Gln Trp Gln His Asn Gly Lys Asn Lys Glu Asp Ser
35 40 45
Gly Asp Arg Leu Phe Leu Pro Glu Phe Ser Glu Met Glu Gln Ser Gly
50 55 60
Tyr Tyr Val Cys Tyr Pro Arg Gly Ser Asn Pro Glu Asp Ala Ser His
65 70 75 80
His Leu Tyr Leu Lys Ala Arg Val Cys Glu Asn Cys Met Glu Met Asp
85 90 95
Val Met Ala Val Ala Thr Ile Val Ile Val Asp Ile Cys Ile Thr Leu
100 105 110
Gly Leu Leu Leu Leu Val Tyr Tyr Trp Ser Lys Asn Arg Lys Ala Lys
115 120 125
Ala Lys Pro Val Thr Arg Gly Ala Gly Ala Gly Gly Arg Gln Arg Gly
130 135 140
Gln Asn Lys Glu Arg Pro Pro Pro Val Pro Asn Pro Asp Tyr Glu Pro
145 150 155 160
Ile Arg Lys Gly Gln Gln Asp Leu Tyr Ser Gly Leu Asn Gln Arg Arg
165 170 175
Ile
<210> 22
<211> 177
<212> PRT
<213> 智人
<400> 22
Gln Asp Gly Asn Glu Glu Met Gly Ser Ile Thr Gln Thr Pro Tyr His
1 5 10 15
Val Ser Ile Ser Gly Thr Thr Val Ile Leu Thr Cys Ser Gln His Leu
20 25 30
Gly Ser Glu Val Gln Trp Gln His Asn Gly Lys Asn Lys Glu Asp Ser
35 40 45
Gly Asp Arg Leu Phe Leu Pro Glu Phe Ser Glu Met Glu Gln Ser Gly
50 55 60
Tyr Tyr Val Cys Tyr Pro Arg Gly Ser Asn Pro Glu Asp Ala Ser His
65 70 75 80
His Leu Tyr Leu Lys Ala Arg Val Cys Glu Asn Cys Met Glu Met Asp
85 90 95
Val Met Ala Val Ala Thr Ile Val Ile Val Asp Ile Cys Ile Thr Leu
100 105 110
Gly Leu Leu Leu Leu Val Tyr Tyr Trp Ser Lys Asn Arg Lys Ala Lys
115 120 125
Ala Lys Pro Val Thr Arg Gly Ala Gly Ala Gly Gly Arg Gln Arg Gly
130 135 140
Gln Asn Lys Glu Arg Pro Pro Pro Val Pro Asn Pro Asp Tyr Glu Pro
145 150 155 160
Ile Arg Lys Gly Gln Gln Asp Leu Tyr Ser Gly Leu Asn Gln Arg Arg
165 170 175
Ile
<210> 23
<211> 330
<212> PRT
<213> 智人
<400> 23
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Leu
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 24
<211> 330
<212> PRT
<213> 智人
<400> 24
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 25
<211> 330
<212> PRT
<213> 智人
<400> 25
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Ala Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Leu
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 26
<211> 330
<212> PRT
<213> 智人
<400> 26
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Ala Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 27
<211> 125
<212> PRT
<213> 智人
<400> 27
Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Lys Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Met Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala
115 120 125
<210> 28
<211> 109
<212> PRT
<213> 智人
<400> 28
Gln Ala Val Val Thr Gln Glu Ser Ala Leu Thr Thr Ser Pro Gly Glu
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Asp His Leu Phe Thr Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Ile Gly Asp Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Thr Glu Asp Glu Ala Ile Tyr Phe Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 29
<211> 122
<212> PRT
<213> 智人
<400> 29
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Asp Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe His Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Trp Asn Ser Gly Thr Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 30
<211> 107
<212> PRT
<213> 智人
<400> 30
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
- 人源化或嵌合CD3抗体
- 人源化或嵌合CD3抗体
