用于检测通过聚合酶而掺入核苷酸的方法
文献发布时间:2023-06-19 12:16:29
相关申请的交叉引用
本申请要求2019年8月21日提交的名称为“Method for Detecting PolymeraseIncorporation of Nucleotides”的美国专利申请第62/890,064号的权益,该专利申请的全部内容以引用方式并入本文。
序列表
本专利申请包含已以ASCII格式电子提交的序列表,该序列表据此全文以引用方式并入。所述ASCII副本创建于2020年8月7日,命名为IP-1854-PCT_SL.txt,大小为715字节。
背景技术
大多数当前的测序平台使用“边合成边测序”(SBS)技术和基于荧光的检测方法。在一种方法中,基底或表面包括一个或多个与其直接或间接附接的引物群体,这些引物具有已知的核苷酸序列。可向基底或表面添加包含待测序的多核苷酸的文库或样品,文库内的多核苷酸包含与附接到基底的引物互补从而可与其杂交的核苷酸片段。
可加入具有单个游离核苷酸的聚合酶,以便使用杂交的样品多核苷酸作为模板,使附接到表面或基底的那些固定化引物延伸。在一系列步骤中,模板、样品多核苷酸的拷贝作为从固定在表面或基底上的引物的游离末端中延伸出来的拷贝从而被添加到基底。在后续步骤中,可反复重复此类复制和延伸来产生从最初为固定化引物的样品模板多核苷酸中延伸出的样品模板多核苷酸的多个或大量拷贝。在后续步骤中,新生链可再次使用与此类样品模板核苷酸相关联的聚合酶生成,现在在荧光标记的核苷酸存在下,在可观察到将这些荧光标记的核苷酸添加到新生链以便发信号通知所掺入的给定核苷酸的种类的条件下,允许检测新生链的序列并且最终对样品多核苷酸进行测序。
在一些示例中,在执行前述的杂交、聚合和测序之前可确定附接到基底的一种或多种引物的给定序列的量,以提供关于存在于在测序中使用的基底或表面上的条件的信息。此类信息可用于解释结果并且由生成的原始数据组装序列。考虑到空间位阻或其他可能影响酶活性的效应,同样有益的可以是检测聚合酶可能能够在引物附接到基底的位置附近对引物执行聚合的程度或效率的方法。然而,根据在与荧光核苷酸的聚合反应中延伸固定化引物末端并且检测对固定化引物的荧光添加的操作来进行该方法,会修饰引物,潜在地改变与其序列待测的测试样品多核苷酸的后续杂交、聚合和测序。本公开包括提供一种用于测量固定在表面上的一个或多个引物的通过聚合酶进行的表面上延伸的方法,该方法无需对固定化引物进行共价修饰,从而允许随后用于SBS方法。
发明内容
在一个方面,提供了一种方法,该方法包括:使测试引物与固定化引物杂交,其中这些固定化引物包含预先确定的核苷酸序列并且通过它们的5'末端而附接到基底,各个测试引物与这些固定化引物中的至少一些固定化引物的一部分互补,并且不超过一个测试引物分子与固定化引物分子杂交;根据模板,使用聚合酶和一个核苷酸,来使这些测试引物中的至少一些测试引物延伸,其中所述模板包括与这些测试引物中的所述至少一些测试引物杂交的固定化引物,并且通过该延伸而掺入到这些测试引物中的所述至少一些测试引物中的核苷酸包含多个荧光标签中的一个荧光标签;以及检测荧光测试引物的量。
在一个示例中,第一多个固定化引物的核苷酸序列不同于第二多个固定化引物的核苷酸序列。在另一个示例中,第一多个测试引物与第一多个固定化引物的一部分互补,并且第二多个测试引物与第二多个固定化引物的一部分互补。在另一个示例中,掺入到第一多个测试引物中的第一核苷酸包含多个荧光标签中的第一荧光标签,掺入到第二多个测试引物中的第二核苷酸包含多个荧光标签中的第二荧光标签,并且由该多个荧光标签中的第一荧光标签发射的荧光不同于由该多个荧光标签中的第二荧光标签发射的荧光。
在另一个示例中,基底包括金属氧化物。在另一个示例中,基底包括金属氧化物,并且该金属氧化物选自二氧化硅、熔融的二氧化硅、五氧化二钽、二氧化钛、氧化铝、氧化铪和氧化石墨烯。在另一个示例中,基底还包括聚合物。在另一个示例中,固定化引物中的至少一些固定化引物附接到该聚合物。在一个示例中,该聚合物为选自下列的杂聚物:
其中x和y为表示单体数目的整数,并且x:y的比率可为约15:85至约1:99,例如约10:90至约1:99,例如约10:90至约5:99;以及
其中x、y和z为表示单体数目的整数,并且(x:y):z的比率可为约(85):15至约(95):5,并且其中每个R
在另一个示例中,聚合酶选自Klenow片段和Phi29聚合酶。在另一个示例中,聚合酶附接到基底。在另一个示例中,聚合酶未附接到基底。在一个示例中,聚合酶选自Klenow片段和Phi29聚合酶。在另一个示例中,聚合酶附接到聚合物。在另一个示例中,聚合酶未附接到聚合物。
在另一个示例中,检测包括测量测试引物响应于刺激而发射的荧光。在另一个示例中,在测量期间使测试引物与固定化引物杂交。另一个示例包括在测量前使测试引物与固定化引物去杂交(dehybridize)。
在一个示例中,检测包括测量测试引物发射的荧光。例如,在测量期间可使测试引物与固定化引物杂交。另一个示例包括在测量前使测试引物与固定化引物去杂交。另一个示例包括将多个荧光标签中的第一荧光标签的检测量与多个荧光标签中的第二荧光标签的检测量进行比较。
在一个示例中,测试引物中的至少一些测试引物的5'末端未悬突于固定化引物的3'末端。在另一个示例中,测试引物中的至少一些测试引物的5'末端包含具有5'端荧光标签光谱的5'端荧光标签,该5'端荧光光谱不同于通过延伸而掺入到测试引物中的核苷酸的荧光标签的荧光光谱,并且检测包括检测5'端荧光标签的量和核苷酸荧光标签的量。
在另一个示例中,测试引物中的至少一些测试引物包括与被悬突的固定化引物互补的悬突的测试引物,其中悬突的测试引物的5'末端当在延伸前悬突的测试引物与被悬突的固定化引物杂交时悬突于被悬突的固定化引物的3'末端,方法还包括使用一个核苷酸来使被悬突的固定化引物延伸,其中通过该延伸而掺入到被悬突的固定化引物中的核苷酸包含被悬突的荧光标签,该被悬突的荧光标签具有的发射光谱可检测地不同于通过该延伸而掺入到悬突的测试引物中的多个荧光标签中的一个荧光标签的发射光谱,检测荧光固定化引物的量,以及将荧光测试引物的量与该荧光固定化引物的量进行比较。
在另一个示例中,测试引物中的至少一些测试引物包括与被悬突的固定化引物互补的悬突的测试引物,其中悬突的测试引物的5'末端当在延伸前悬突的测试引物与被悬突的固定化引物杂交时悬突于被悬突的固定化引物的3'末端并且包含测试引物5'端荧光标签,方法还包括使用一个核苷酸来使被悬突的固定化引物延伸,其中通过该延伸而掺入到被悬突的固定化引物中的核苷酸包含被悬突的荧光标签,当在被悬突的固定化引物延伸后悬突的测试引物与被悬突的固定化引物杂交时,测试引物5'端荧光标签和被悬突的荧光标签包括荧光标签对,并且由该荧光标签对发射的组合荧光不同于由该测试引物5'端荧光标签发射的荧光和由被悬突的荧光标签发射的荧光。在另一个示例中,检测荧光测试引物的量包括检测由荧光标签对发射的组合荧光。
应当理解,前述概念和下文更详细讨论的附加概念(假设此类概念不相互矛盾)的所有组合都被设想为是本文所公开的发明主题的一部分并且贡献如本文所述的优点和有益效果。
附图说明
当参考附图阅读以下详细描述时将更好地理解本公开的这些和其他特征、方面和优点,其中:
图1示出了根据本公开的各方面的方法的示例的流程图。
图2示出了根据本公开的各方面的方法的示例的流程图。
图3是如通过量化与其杂交的带荧光标签的测试引物的量来评估的、附接到表面的两种不同引物(P5和P7)中每一种引物的量(y轴)作为在将引物接枝到表面的反应中包括的P5引物与P7引物的比率(x轴)的函数的图形表示,该图形表示针对在将引物接枝到表面的反应中使用的引物的三种总浓度中的每一种总浓度(左分图、中分图和右分图)。
图4是如通过量化与P5引物杂交的带荧光标签的测试引物的量和与P7引物杂交的带荧光标签的测试引物的量的比率来评估的、附接到表面的两种不同引物(P5和P7)的量的测量结果(y轴)作为在将引物接枝到表面的反应中包括的P5引物与P7引物的比率(x轴)的函数的图形表示,该图形表示针对在将引物接枝到表面的反应中使用的引物的三种总浓度中的每一种总浓度。
图5是如通过量化掺入到根据本公开的各方面的此类测试引物中的荧光的量来评估的、其多核苷酸通过聚合酶延伸的、与附接到表面的引物(P5和P7)互补的两种不同多核苷酸中每一种多核苷酸的量(y轴)作为在将引物接枝到表面的反应中包括的P5引物与P7引物的比率(x轴)的函数的图形表示,该图形表示针对在将引物接枝到表面的反应中使用的引物的三种总浓度中的每一种总浓度(左分图、中分图和右分图)。
图6是如通过量化与P5引物杂交的带荧光标签的测试引物的量和与P7引物杂交的带荧光标签的测试引物的量的比率来评估的、与附接到表面的引物(P5和P7)互补的两种多核苷酸的量的测量结果(y轴)作为在将引物接枝到表面的反应中包括的P5引物与P7引物的比率(x轴)的函数的图形表示,该图形表示针对在将引物接枝到表面的反应中使用的引物的三种总浓度中的每一种总浓度。
图7描绘了根据本公开的各方面的、具有相关聚合酶活性的、可杂交固定化多核苷酸的百分比。
图8A、图8B和图8C描绘了根据本公开的方法的示例,其中通过聚合酶将荧光核苷酸添加到与附接到表面的引物互补的多核苷酸上。
具体实施方式
本发明提供了用于评估附接到或固定在表面或基底上的多核苷酸引物的聚合酶活性的可用性的方法。当前的SBS及相关技术采用多种此类引物来充当聚合酶反应的起始点,以确定施加到所述表面的样品中的多核苷酸的核苷酸序列。此类方法的一部分包括样品寡核苷酸与表面固定化引物的杂交。有利的是,可确定对可用于与样品寡核苷酸杂交的引物的总量的理解。此类信息可用于确定在SBS或与此类表面相关的方法中在使用此类服务时采用的参数。此类方法还可用于评估具有固定化引物、或给定的聚合酶、或附接到表面的不同引物序列、或前述的任何组合的表面的不同特征是否影响在此类引物处的聚合,诸如用于SBS或相关方法。
SBS方法还可包括与表面杂交的不同种类的引物,这些引物用于与施加到表面上的样品多核苷酸的不同部分杂交。在一个示例中,获取自样品(诸如组织样品或其他来源的多核苷酸)的多核苷酸可能已在其末端进行修饰以包含用于与已知引物序列杂交的已知序列。例如,此类多核苷酸可具有附加到可与第一引物序列杂交的一个末端的核苷酸序列和附加到可与第二引物序列杂交的另一末端的核苷酸序列。此外,用于SBS或相关方法的表面可具有附连到其上的两个引物群体,包括第一引物序列和第二引物序列,其序列可与具有上述修饰的样品多核苷酸的一个末端或另一末端杂交。因此,此类样品多核苷酸可与一种或另一种固定化引物杂交,或在一些情况下与两者杂交。在一些示例中,表面可具有附连到其上的超过两个的引物群体,并且样品多核苷酸可具有与引物群体互补的附连到一个或另一末端中的每个末端上的超过两个的核苷酸序列,诸如用于与此类表面附连的引物杂交。在其他示例中,样品中的各个多核苷酸可具有附加在每个末端上的彼此相同的序列而不是具有附加在每个末端处的彼此不同的序列,因此每个多核苷酸都与附连到表面的相同种类的引物杂交。在其他示例中,样品可包含:其中一些多核苷酸具有附加在末端上的彼此相同的序列而其他多核苷酸具有附加在末端上的彼此不同的序列的多核苷酸,其中附加在末端上的序列与样品中附加在末端上的序列或一些其他多核苷酸不同的多核苷酸,或前述的不同组合。
为了在其上已附连例如两种或更多种此类引物的群体的表面上执行SBS或相关方法,可有利地确定每个群体相对于附连到表面的另一个群体的相对量。例如,期望产生或使用已附连有等比例的第一引物和第二引物的表面。例如,期望经修饰以包含在第一末端和第二末端处的第一序列和第二序列的样品多核苷酸通过一个末端或另一末端与表面附连的引物杂交的可能性相等。或者,期望在此类样品中的多核苷酸与表面上的一种引物杂交的程度比与另一种引物杂交的程度更高,或反之亦然。此外,样品中的多核苷酸分子可具有不等比例的附加在末端上的核苷酸序列,这将影响给定的多核苷酸分子与一种或另一种表面固定化引物杂交的可能性。在将与表面固定化引物的多核苷酸杂交用于SBS或用于使用聚合酶催化延长核苷酸链的类似或其他方法的情况下,控制和/或确定附连到表面的不同的引物的总量和相对量的能力可能是有益的。
在一些情况下,令人惊讶的是,如本文所公开的,附连到表面的引物的总量、或一种或多种引物的总量、或引物的相对量或比率虽然是有用的信息,但相对于固定在表面上的此类引物,可能不是聚合酶活性的完美的活性预测因子。在一些情况下,例如,可能相对于与同一表面杂交的另一种引物序列,给定的引物能够充当聚合酶反应的更有效的起始点。在另一个示例中,向引物所附连到的表面引入不同的变型可导致给定的引物相对于另一种引物的聚合酶活性不成比例地增加或减少。在其他示例中,相对于不同序列的表面固定化引物,当从给定的表面固定化引物引发聚合时,一个聚合酶分子可能更有效或更易加工。在其他示例中,引物从其所附连到的表面或修饰表面延伸的距离,或引物的与聚合酶相互作用以引发聚合反应的那一部分的距离,可影响引发聚合反应的可能性,并且这种影响对于一种引物序列和另一种引物序列可能是不成比例的。对于所有前述示例和其他示例,影响可以是引物序列特异性的,这意味着改变一个变量或另一个变量可影响聚合酶如何或是否或如何有效地引发与一个序列的表面附连引物相关的聚合反应,这可不同于对不同序列的表面附连引物的类似影响。
在此类情况下,有利的是,不能简单确定附连到表面的一种引物与另一种引物的量或相对比例。在一些示例中,一种引物与另一种引物的给定比率可能与在给定引物处可引发多少聚合酶活性没有一一对应关系。在聚合引发概率、效率、可加工性或其他参数因引物序列不同而不同,或表面上的引物种类之间的其他差异(诸如可能是引物从表面延伸的距离,或与聚合酶结合以引发聚合反应的部分从表面延伸的距离)的情况下,仅仅确定附连到表面的引物的相对量可能不能准确地反映在每种引物处引发的相对聚合。
在附连到表面的引物处的聚合可通过执行测试聚合反应来确定,其中一个或多个核苷酸通过聚合酶附接到引物的远侧末端、远离其近侧末端取向并附接到表面。然而,此类方法涉及共价修饰表面附连引物,即将核苷酸共价附接到游离末端。在一些示例中,如本公开中所提供的,期望测量在表面固定化引物处引发的聚合而不包括对表面固定化引物进行共价修饰。例如,期望在SBS方法或类似方法中使用此类表面之前,测试或确认附连到表面的一种或多种引物的聚合酶活性的水平或相对水平。或者,可期望在具有附连到其上的引物的给定表面上进行系列测定并且直接将此类系列测定的输出相互比较,而不会因已通过一个或多个系列测定对引物进行的共价修饰而混淆。
多核苷酸具有所谓的3'和5'末端,指的是在链的每个末端处的核苷酸糖环上的带编号的碳,而不是通过这种碳直接附接到序列中的相邻核苷酸。聚合酶在生长链的5'端至3'端方向上添加核苷酸。即,通过由聚合酶催化的反应,游离核苷酸的糖的5'端碳通过居间的磷酸基团附接到多核苷酸的所谓3'末端上的核苷酸的3'端糖。在用于执行SBS或其他相关方法的已附连有引物的表面的一些示例中,引物可被附接到或固定在基底上,并且取向为其5'末端朝向表面或基底并位于其近侧,而其3'末端位于表面或基底远侧并且是游离的。在此类示例中,样品多核苷酸可与此类引物杂交。在多核苷酸和游离核苷酸的存在下,使用杂交的样品多核苷酸作为模板,从将核苷酸添加到游离的3'末端开始,因此引物可得以延伸。聚合可随着从表面附连引物的初始游离3'末端延伸的新生核苷酸的延伸而继续。常规SBS和相关技术可采用此类方法作为最终确定样品多核苷酸序列的过程的一部分。
如上所述,在一些情况下,可能有利的是量化附连到表面的给定引物种类的存在量或不同引物种类的相对量。常规地,这样做的一种方式是执行第一测试,将多核苷酸添加到具有表面附连引物的表面上,其中这些多核苷酸与这些引物或这些引物中的一些引物的一部分或其内的序列互补。此类多核苷酸可包含允许对其检测的标记物。常规地,例如,可将长度为例如10至60个核苷酸、与附连到表面的引物的一部分或其内的序列互补的短多核苷酸添加到表面上以使其与引物杂交。可诸如通过包含荧光探针或分子来修饰多核苷酸。在将超过一种引物(诸如两种引物)附连到表面的情况下,可将两种不同的多核苷酸(一种核苷酸可与一种引物杂交,另一种核苷酸可与另一种引物杂交)添加到表面上并且与表面一起温育。
每种多核苷酸可包含荧光团并且每个荧光团可以能够区分一种荧光团与另一种荧光团的方式(诸如通过具有互不相同的发射光谱)发射荧光。在将此类多核苷酸与表面一起温育以允许它们与相应的互补引物杂交之后,可洗掉未杂交的多核苷酸并且将荧光团保留在表面上,反映出存在的一种或另一种或两种多核苷酸的量并且因此反映出附连到表面的互补引物的量。然后可使杂交的荧光多核苷酸与表面附连引物去杂交,从而导致表面回到在与荧光多核苷酸杂交之前的没有共价修饰的状态,同时已经获得关于与荧光多核苷酸杂交的引物的量和/或相对量和/或引物的不同种类的信息以供将来参考。
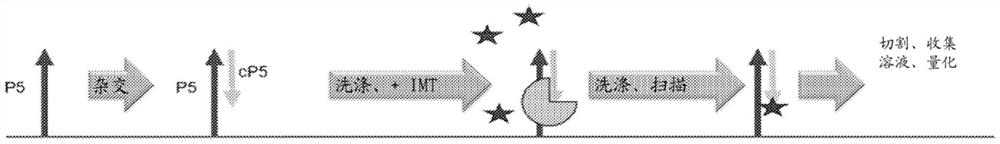
根据本文所公开的方面,可以采用不同的或另外的方法来确定附连到表面的引物上潜在的聚合酶活性和/或引物的种类,在一些示例中不共价修饰附连到表面的引物。图1中描绘了一个示例。在该示例中,固定化引物被附连到表面。在该示例中,固定化引物被标识为P5,其中如箭头指示的其3'末端位于表面远侧,并且其5'末端位于固定化引物所附连或固定到的表面或基底近侧并且朝向其取向。固定化引物的序列是已知的或预先确定的,或者其至少一部分是已知的或预先确定的,使得可将多核苷酸设计成具有与其互补的核苷酸序列,从而使得该多核苷酸可与该引物或该引物的至少一部分杂交。此外,引物的核苷酸或部分的序列因此可为已知的,使得多核苷酸不能与之直接杂交,但与互补核苷酸可与之杂交的固定化引物核苷酸相隔一个或多个核苷酸的同类核苷酸也是已知的。
再次参考图1,进行杂交,包括将测试引物添加到表面(诸如在杂交溶液中),其中此类测试引物可以和与其互补的固定化引物的部分杂交。在图1所示的示例中,显示与P5固定化引物互补的多核苷酸(用cP5表示)与P5固定化引物的一部分杂交。在该示例中,cP5多核苷酸上的箭头指示cP5测试引物的3'末端。而P5固定化引物的5'末端在表面近侧,根据碱基配对互补性,当互补的cP5引物与固定化P5引物杂交时,互补的cP5多核苷酸的3'末端在表面近侧并且其5'末端在表面远侧。此外,在该示例中,互补的cP5引物的5'末端未悬突于P5固定化引物的3'末端。即,P5固定化引物的3'末端与互补的cP5多核苷酸的核苷酸互补并且杂交。
在该构型中,聚合酶可将核苷酸添加到互补的cP5多核苷酸上但不添加到P5固定化引物上。即,聚合酶使用未杂交的核苷酸(与待通过聚合酶延伸的多核苷酸杂交的模板多核苷酸的5'最末端核苷酸的5'端)作为模板用于添加待通过延伸添加的下一个核苷酸。在图1所示的示例中,互补的cP5多核苷酸中不存在此类5'端核苷酸。即,互补的cP5多核苷酸的5'最末端核苷酸与P5固定化引物的核苷酸杂交。因此,互补的cP5多核苷酸中不存在可用作模板来通过聚合酶将另一种核苷酸添加到固定化引物的3'末端上的核苷酸。然而,互补的cP5多核苷酸可通过聚合酶延伸。与互补的cP5引物的3'最末端核苷酸杂交的P5固定化引物的核苷酸相邻的5'端是未与互补的cP5多核苷酸中的核苷酸杂交的P5固定化引物的核苷酸。与杂交的P5固定化引物和互补的cP5多核苷酸接触的聚合酶可使互补的cP5核苷酸的3'末端延伸至少一个核苷酸,这一个核苷酸与P5固定化引物的核苷酸互补,该P5固定化引物的核苷酸为与互补的cP5多核苷酸的3'末端杂交的P5引物的核苷酸5'端的一个核苷酸。在该示例中,仅一个互补的cP5多核苷酸与给定的P5固定化引物杂交。
继续参考图1,在互补的cP5核苷酸与P5固定化引物杂交后,可洗掉未杂交的互补cP5多核苷酸。接下来可使表面与聚合酶接触,诸如在聚合溶液中。根据上文所述,该溶液中还可包含可通过聚合酶添加到互补的cP5多核苷酸的3'末端上的核苷酸。在一个示例中,仅聚合溶液中所包含的多核苷酸可与P5固定化引物的下一个5'端的非杂交核苷酸互补,使得聚合酶可催化使用P5固定化引物作为模板来将多核苷酸添加到互补的cP5多核苷酸的3'末端上。在一些示例中,已知下述P5固定化引物的5'端核苷酸不同于充当向互补cP5多核苷酸的3'末端添加核苷酸的模板的P5核苷酸。在此类示例中,当聚合溶液中仅包含一种核苷酸(通过聚合酶使用P5固定化引物作为模板可附接到与其互补的cP5多核苷酸的3'末端上)时,仅一个核苷酸相应地附接到互补的cP5多核苷酸上。
在图1所示的示例中,杂交聚合过程显示为彼此分开进行的。然而,在其他示例中,与固定化引物互补的测试多核苷酸、聚合酶以及通过聚合酶掺入的核苷酸,可全部在单一溶液中添加到表面上以用于在相同溶液中发生杂交和聚合。
在其他示例中,可对聚合反应中的核苷酸进行修饰使得在不存在进一步干预的情况下,可将仅一个核苷酸添加到聚合反应中的新生链。例如,在核苷酸或相关分子的3'末端的修饰可防止一旦核苷酸已通过聚合酶添加到生长链的3'末端便向其添加另一核苷酸的能力。例如,核苷酸可在其3'端碳处具有化学修饰,诸如添加叠氮甲基或在添加所述核苷酸后可防止链进一步延伸的其他基团。在其他示例中,聚合溶液中的核苷酸可以是双脱氧核苷酸(在3-碳上缺少羟基,因此缺少用于下一个核苷酸的5'端磷酸碳的附接位点)。在其他示例中,可将仅两个、仅三个、仅四个、仅五个、仅六个、仅七个、仅八个、仅九个、仅十个、仅十一个、仅十二个、仅十三个、仅十四个、仅十五个、仅十五个至二十个或更多个核苷酸添加到互补的cP5多核苷酸的3'末端上。可通过控制聚合反应中包括的核苷酸种类来控制此类添加的核苷酸的量,诸如通过包括与可用模板P5固定化引物的核苷酸互补的所有核苷酸,除了P5固定化引物中旨在充当cP5多核苷酸的3'末端延伸模板的最后一个P5固定化引物5'端的一个核苷酸。或者根据上述或其他示例,可修饰用于添加到互补的cP5多核苷酸的延伸的3'末端上的最后一个核苷酸来防止从其进一步延伸。
在另一个示例中,可将超过一种固定化引物附接到表面或基底,该超过一种固定化引物具有彼此不同的序列。此外,可将不同种类的测试引物与表面或基底一起温育,以允许与一种固定化引物互补的该种测试引物与该种固定化引物杂交,以及允许与第二种测试引物互补的多核苷酸与所述第二种固定化引物杂交。在一个示例中,一种或每种测试引物仅可与一种固定化引物杂交,并且其他种类或另一种测试引物仅与另一种固定化引物互补,使得仅一种测试引物将与给定种类的固定化引物杂交。在另一个示例中,测试引物的种类可与附连到基底或表面上的固定化引物中的两种或所有种类杂交。
在另一个示例中,无论与表面一起温育的一种或多种测试引物是否可与仅一种或超过一种的表面固定化引物杂交,测试引物都可被设计成使得只有一种核苷酸可通过聚合酶添加到与一种测试引物杂交的测试引物的3'末端上并且只有另一种核苷酸可通过聚合酶添加到与另一种固定化引物杂交的另一种测试引物的3'末端上。例如,在任一种或两种情况下,每种固定化引物的下一个5'端核苷酸(直接位于与其所杂交到的测试引物的3'末端杂交的5'最末端固定化引物核苷酸的5'端)可与其他种类或另一种(如果总共超过两种)固定化引物的可比核苷酸不同。在这种情况下,聚合酶可催化将一种互补的核苷酸添加到与一种固定化引物杂交的一种测试引物的3'末端,并且催化将另一种互补的核苷酸添加到与另一种固定化引物杂交的另一种测试引物的3'末端。
因此,可将不同的核苷酸添加到与不同的固定化引物杂交的测试引物。在一个示例中,不同种类的核苷酸可以允许区分不同的核苷酸的方式识别。例如,不同种类的核苷酸可具有与其共价附接的不同的标记物。在一个示例中,核苷酸可具有通过荧光成像可观察的荧光标记物。两种核苷酸可具有两种不同种类的荧光团,每种荧光团具有与另一种荧光团不同的发射光谱,例如与另一种荧光团相比,可被不同波长的光或其他电磁辐射激发,和/或在激发时发射可检测地不同于另一种荧光团的波长。多种荧光团用于相关领域中以区分不同的核苷酸,包括用于SBS和相关方法的各种示例中。根据该示例,其中不同种类的核苷酸被添加到与附连到表面的不同种类的固定化引物互补的测试引物上并且不同的荧光团例如附接到不同的核苷酸上,可确定与不同种类的固定化引物相关的聚合酶活性。可在测试引物与固定化引物杂交的表面上检测一种荧光标记物或其他标记物。
测试引物和固定化引物被设计成使得在存在核苷酸和聚合酶的情况下当给定测试引物与固定化引物杂交时可添加到给定测试引物中的该种核苷酸存在于聚合溶液中,并且标记物(诸如附连到不同种类的核苷酸上的荧光团)的检测特性也是已知的,则给定标记物的检测可指示聚合酶在哪种引物处催化聚合反应。当根据所公开的方法使用超过一种固定化引物和/或超过一种测试引物来评估固定在基底上的引物处的聚合酶活性时,可将两种不同种类的测试引物同时与固定在表面上的固定化引物一起温育并且杂交,并且这两种测试引物在彼此相同的聚合反应期间同时被延伸。在其他示例中,一次可以温育一种测试引物,并且/或者当测试引物与多个固定化引物中的仅一个固定化引物杂交时可添加到测试引物中的一种核苷酸可存在于给定的聚合酶反应中。随后,可进行与该种或另一种测试引物的第二温育过程,并且/或者当测试引物与第二种固定化引物杂交时可进行与可附接到多核苷酸的一种核苷酸的另一种聚合反应。
在一个示例中,可检测通过一个或多个聚合反应掺入的核苷酸的种类,同时可检测已通过添加本文所公开的可检测核苷酸延伸的测试引物,此时该测试引物保持与固定化引物杂交。例如,参见图1,通过用核苷酸(表示为星形)和聚合酶(表示为四分之三的圆形)温育与固定化引物杂交的测试引物指示聚合反应。在该示例中,聚合酶显示为在溶液中。但是,在另一个示例中,聚合酶可结合到基底。在聚合反应之后,未结合的聚合酶、未结合的测试引物和/或游离的核苷酸在允许测试引物继续与固定化引物杂交的杂交条件下可被洗掉。然后可根据已知的方法扫描表面,用于检测表面上的可检测核苷酸。在从表面洗去未掺入的核苷酸和未杂交的测试引物后存在的每种核苷酸的位置和/或总量指示了发生在给定的固定化引物处的聚合。在一些示例中,对所掺入的核苷酸的检测、测量或定量可在聚合反应期间延伸的测试引物已与固定化引物去杂交后(诸如在再杂交溶液中进行后续温育时)进行。在此类示例中,当延伸的测试引物保持与固定化引物杂交时不测量掺入的核苷酸量和/或位置或在进行这种测量之后,在例如包含延伸的测试引物的去杂交溶液(该延伸的测试引物在聚合酶催化核苷酸掺入后与该固定化引物去杂交)中可测量该掺入的核苷酸的量。
图1所示的示例仅仅是一个非限制性示例。在本公开中还包括对图1所示的示例的许多修改或变型,包括诸如前述段落中所述的许多修改或变型。此外,图1中描绘了仅一种固定化引物、仅一种测试引物和仅一种可检测核苷酸。与上述示例一致,一个示例可包括多种固定化引物。一个示例可包括多种测试引物。一个示例可包括用于通过聚合酶掺入到测试引物中的多种标记的可检测核苷酸。如可进一步理解的,一种或多种固定化测试引物的多个拷贝可附接到表面上,拷贝数为大约数千或数十万或数百万或数千万或更多,包括表面上大约至多1×10
在一个示例中,可与一种固定化引物杂交的一种测试引物可对应于在样品中的核苷酸末端处的序列或添加到样品中的核苷酸末端的序列,样品中的该序列将使用本文所公开的方法所用于的表面在SBS运行中确定。可与另一种固定化引物杂交的另一种测试引物可对应于在样品中的核苷酸的另一末端处的序列或添加到样品中的核苷酸的另一末端的序列,样品中的该序列将使用本文所公开的方法所用于的表面在SBS运行中确定。因此,例如,固定化引物(诸如P5引物和P7引物)可以是表面上的固定化引物。此外,在本文所公开的方法中使用的测试引物可具有与P5和P7固定化引物互补的序列,并且在使用该表面或基底的后续SBS运行期间其序列待询问的样品多核苷酸可具有与添加到该样品多核苷酸的一个末端和/或另一末端的这种测试引物对应的序列,作为此类后续SBS或类似处理的一部分。
在一个示例中,当所用的一个或多个测试引物序列对应于添加到样品多核苷酸末端的多核苷酸序列时,则根据本文所公开的方法确定的聚合酶活性可提供关于此类样品多核苷酸与此类固定化引物的杂交和/或将在此杂交点处预测的聚合酶活性的预测信息。更一般地,与在已使用本文所公开的方法的基底上执行的任何后续SBS或相关方法无关,使用本文所公开的方法获得的信息指示了在表面处的聚合酶活性以及根据给定固定化引物的潜在地可区分的聚合酶活性。令人惊讶的是,如本文所公开的,仅对测试引物能够与之杂交的固定化引物进行量化与在不同的固定化引物位点处的聚合没有一一对应关系。
在图2中描绘了根据本公开的用于对通过聚合酶反应掺入的核苷酸进行量化的方法的非限制性示例。如上文在一些示例中所公开的,可检测(例如,可通过已知的荧光发射光谱检测的)掺入的核苷酸的量,此时在聚合反应期间核苷酸所掺入到的测试引物仍然与附接到表面上的固定化引物杂交,如图2中的左侧的板1上所示。在另一个示例中,与掺入的核苷酸相关的标记物可从固定化引物中释放出来。例如,与固定化引物杂交并且包含具有可检测标记物(诸如荧光团)的掺入的核苷酸的测试引物可与该固定化引物去杂交。或者,可将可检测标记物(诸如荧光团)从测试引物中化学切割下来从而释放到溶液中。在任一种情况下,可检测溶液中相关的荧光团或其他标记物标记,而不是在标记物从固定化引物中释放之前对表面进行检测(或对表面进行检测之后再进行检测)。在图2中的中心板1分图中示出了此类示例。
在另一个示例中,可将含有从固定化引物中释放的荧光团或其他标记物的溶液从表面上的溶液中移除并且转移到另一种用于测量不同的标记物(诸如荧光标记物)的检测容器、检测系统或设备中。在图2的右分图中示出了此类示例,其中来自板1的溶液中的一些溶液已被移除并且在该示例中被放置在板2中。然而,用于测量的第二容器无需为板,而是可为用于检测的任何已知的设备或系统或方法。在一个示例中,凝胶电泳可用于分离并随后显现测试引物,在所述聚合酶反应中已向该测试引物添加了附接有标记物的核苷酸。在凝胶电泳用于解析测试引物(包括如本文所公开的在聚合酶反应中掺入的核苷酸)的其他示例中,与一种固定化引物-测试引物杂交对和另一种固定化引物-测试引物杂交对相关联的聚合酶活性之间的差异可基于聚合酶催化核苷酸掺入后相应测试引物长度的差异。例如,一种测试引物可长于另一种测试引物,然而可将相同量的核苷酸添加到每种测试引物(诸如一种测试引物)或在任何情况下可将一定量的核苷酸添加到每种测试引物,使得在聚合酶催化的核苷酸添加后每种测试引物的总长度可充分不同以允许通过凝胶电泳来分离。即使掺入到每种测试引物中的核苷酸不包括可检测地彼此区分的标记物,这也是可能的。在一些示例中,在可使用凝胶电泳或其他基于尺寸的解析方法的情况下,掺入的核苷酸或其中之一可能完全缺乏可独立检测到的标记物。
令人惊讶的是,并且如本文所公开的,测量测试引物与固定化引物的杂交可能无法指示在不同种类的固定化引物-测试引物的杂交对处的聚合酶活性是否等效,或者如果不等效,它们有多大差别。图3至图6可能不一定反映此类聚合酶活性的可能差异的示例。图3示出了与表面上的固定化引物杂交的测试引物的量(Y轴),以每孔的链的量表示,其中链指示根据检测到的荧光量外推的固定化引物的量,并且孔指示从其进行测量的表面的一部分。荧光是从包含荧光团的测试引物中检测到的荧光。在该示例中,使用了两种固定化引物P5和P7,并且因此使用了与其互补的两种测试引物cP5和cP7。cP5和cP7包含可被检测到彼此具有差异的荧光标记物。示出了三个分图。每个分图反映了反应中使用的引物的不同的总浓度,其中根据已知的方法将引物附接到表面或基底以成为固定化引物。从左分图到右分图的总浓度以μM(0.5μM、1μM和2μM)表示。x轴指示了在反应中包括的P5引物与P7引物的相对比率,在该反应中,引物根据已知的方法附接到表面或基底以成为固定化引物。因此,图3证明了对于在将引物附连到表面上的反应中所包括的引物的不同的总浓度而言,以及对于给定此类总引物浓度下每种引物的不同的相对浓度而言,有多少固定化引物可与被设计成与其杂交的互补测试引物杂交。
图4中以另一种格式表示了这些数据。在图4中,x轴(如图3中的x轴)是在反应中包括的P5引物与P7引物的相对比率,在该反应中,引物根据已知的方法附接到表面或基底以成为固定化引物。测定在对应于P5和P7固定化引物中的每一者的表面上检测到的荧光量(参考图3的y轴),并且针对将固定化引物附连到基底的固定化引物的固定反应中包括的P5与P7的每个相对比率,计算P5相关荧光与P7相关荧光的比率。图4的y轴上给出了P5相关荧光与P7相关荧光的该比率。三条曲线指示根据已知的方法将引物附接到表面或基底以成为固定化引物的反应中使用的引物的三种不同的总浓度(0.5μM、1μM和2μM,如在图3所示的三个分图中)。1:1对应线显示为当将引物固定到表面上导致等摩尔量的荧光测试引物与表面杂交时,在反应中使用等摩尔浓度的引物可预期的曲线的预测。然而,如图所示,实际值低于预测的1:1线。换句话讲,在这些总浓度下,固定反应中P5与P7的比率增加不对应于可用于通过测试引物杂交的P5固定化引物的量相对于P7固定化引物的量的同等增加(例如,小于成比例的接枝到表面上的P5与P7之比)。
图5和图6与图3和图4相当,除了y轴不是报告与固定化引物杂交的荧光测试引物的量,而是示出了根据本文所公开的方法(例如,参见图1)附接到与P5或P7互补的多核苷酸的3'末端上的荧光核苷酸的量。图3和图4的其他方面适用于图5和图6。图5中的三个分图对应于当将引物固定到表面上时所用的引物的总浓度,并且x轴指示了在所述反应中P5与P7的相对浓度。在图6中,x轴如图4中所述。y轴与图4中所述的y轴类似,不同之处在于该比率不是P5与P7杂交的比率而是P5与P7相关的聚合酶活性的比率。再次,绘制1:1曲线图,该图指示如果在引物固定到表面上的反应中P5与P7的相对浓度增加,导致与P5固定化引物相关联的聚合反应相对于与P7固定化引物相关联的聚合反应相应增加,则结果可能会下降。
在这种情况下,令人惊讶的是,增加P5相对浓度确实导致P5相关的聚合酶活性的相应增加。然而,注意,如图4所示,增加P5的相对浓度不会导致P5与测试引物的杂交的相应增加。换句话讲,图4和图6以组合的方式示出与P5引物相关联的聚合酶活性可增加至超过且高于P5杂交可用性的测量本身可能导致的预测程度。相反,出乎意料的并且如本文中令人惊讶地公开的,P5:P7比率成比例地增加导致P5:P7相关的聚合酶活性也增加,尽管在P5:P7杂交可用性中的增加不太成比例。图6中示出了这些差异。图6示出了对于在将引物固定到表面上的反应中使用的P5引物与P7引物的三种不同的相对浓度,聚合酶可及的引物相对于杂交可及的引物(例如,接枝的引物)的总量的百分比。可以看出,在该示例中,相对于P7引物,更高百分比的P5引物具有可及的聚合酶活性。
此类信息可能是有益的。其可用于确定在接枝反应中应用的条件,在该反应中引物被固定到表面上以达到预先确定的杂交可及性和聚合酶活性可及性。在其他示例中,可测定具有任何所需序列的不同引物的可比聚合酶可及性。可测定不同长度的引物。可测试表面上的不同浓度的固定化引物。可测定测试引物。可测定不同的聚合酶以及不同的基底。在一些示例中,基底的表面可具有不同的表面修饰。如本文所公开的方法可用于测定表面的不同变型以及它们对不同固定化引物的聚合酶活性可用性可能具有的影响。
多种聚合酶中的任一种聚合酶均可用于本文所述的方法中,包括例如从生物系统中分离的基于蛋白质的酶及其功能变体。除非另外指明,否则提及特定聚合酶(诸如下文所例示的那些特定聚合酶)时应理解为包括其功能变体。聚合酶特别有用的功能是使用现有核酸作为模板来催化核酸链的聚合。其他有用的功能在本文其他地方有所描述。可用的聚合酶的示例包括DNA聚合酶和RNA聚合酶、它们的功能片段以及包括它们的重组融合肽。示例性DNA聚合酶包括那些已按结构同源性分类成标识为A、B、C、D、X、Y和RT家族的聚合酶。家族A中的DNA聚合酶包括,例如,T7 DNA聚合酶、真核线粒体DNA聚合酶γ、大肠杆菌(E.coli)DNA Pol I(包括Klenow片段)、水生栖热菌(Thermus aquaticus)Pol I和嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)Pol I。家族B中的DNA聚合酶包括,例如,真核DNA聚合酶a、6和E;DNA聚合酶C;T4 DNA聚合酶、Phi29 DNA聚合酶、超嗜热古菌(Thermococcus sp.)9°N-7古细菌聚合酶(也称为9°N
术语“表面”或“基底”是指测试引物可附接到其上的载体或基底。表面可以是晶片、面板、矩形片材、管芯或任何其他合适的构型。表面通常可以是刚性的并且不溶于水性液体。合适的表面的示例包括:环氧硅氧烷、玻璃和改性的或官能化的玻璃、多面体低聚倍半硅氧烷(POSS)及其衍生物、塑料(包括丙烯酸、聚苯乙烯以及苯乙烯和其他材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯、聚四氟乙烯(诸如得自Chemours的
固定化引物序列和测试引物序列可以是根据上述公开的任何合适的序列。在一个示例中,如本文所公开的P5固定化引物的序列由SEQ ID NO:1(CAAGCAGAAGACGGCATACGAGAT)表示,如本文所公开的P7固定化引物的序列由SEQ ID NO:2(AATGATACGGCGACCACCGAGATCTACAC)表示。用于杂交的测试引物可以是与这些序列的部分互补的序列。
可通过任何合适的方法检测荧光。例如,可使用已知的光学荧光检测方法在表面上检测荧光,其中在杂交的多核苷酸保持与模板杂交的表面上引出荧光并且从该表面检测荧光。在另一个示例中,杂交的测试引物可与固定化引物去杂交并在溶液中被洗脱,因而在所述洗脱溶液中而不是在表面上检测到荧光。可在表面上、在溶液中或其他地方采用用于测量通常附接到用于本文所公开方法的核苷酸上的荧光团的各种已知方法中的任一种方法。
可通过任何合适的方法进行检测,包括荧光光谱法或其他光学手段。荧光标记可以是在吸收能量后发射限定波长的辐射的荧光团。许多合适的荧光标记是已知的。例如,Welch等人,(Chem.Eur:J.5(3):951-960,1999)公开了可用于本发明的丹酰官能化荧光部分;Cockroft等人,(Cytometry 28:206-211,1997)描述了荧光标记Cy3和Cy5的使用,其也可根据本公开的各方面使用。适用的标记也公开于以下参考文献中:Prober等人,(Science238:336-341,1987);Connell等人,(BioTechniques5(4):342-384,1987);Ansorge等人,(Nucl.Acids Res,15(11):4593-4602,1987);以及Smith等人,(Nature 321:674,1986)。其他可商购获得的荧光标记包括但不限于荧光素、罗丹明(包括TMR、Texas red和Rox)、alexa、bodipy、吖啶、香豆素、芘、苯并蒽和花青素。可采用对前述任何内容的任何合适的修改以用于本文所公开的方法中并且根据本文所公开的方法使用。例如,荧光核苷酸可包含此类附接。可根据本公开使用可商购获得的带荧光标签的核苷酸。荧光核苷酸的非限制性一般化示例可描述如下:
如本文所用,术语“核苷酸”旨在包括天然核苷酸及其类似物、核糖核苷酸、脱氧核糖核苷酸、双脱氧核糖核苷酸以及被称为核苷酸的其他分子。该术语可用于指存在于聚合物中的单体单元,例如用于识别存在于DNA或RNA链中的亚基。该术语还可用于指不一定存在于聚合物中的分子,例如能够通过聚合酶以依赖于模板的方式掺入到多核苷酸中的分子。该术语可指例如在5′碳上具有0、1、2、3个或更多个磷酸基团的核苷单元。例如,核苷四磷酸、核苷五磷酸和核苷六磷酸可以是特别有用的,在5′碳上具有超过6个磷酸基团(诸如7、8、9、10或更多个磷酸基团)的核苷酸也可以是特别有用的。示例性天然核苷酸包括但不限于ATP、UTP、CTP和GTP(统称NTP),和ADP、UDP、CDP和GDP(统称NDP),或AMP、UMP、CMP或GMP(统称NMP),或dATP、dTTP、dCTP和dGTP(统称dNTP),和dADP、dTDP、dCDP和dGDP(统称dNDP),和dAMP、dTMP、dCMP和dGMP(dNMP)。示例性核苷酸可包括但不限于任何NMP、dNMP、NDP、dNDP、NTP、dNTP以及其他NXP和dNXP,其中X表示2至10的数(统称NPP)。
非天然核苷酸在本文中也被称为核苷酸类似物,包括不存在于天然生物系统中或基本上不通过聚合酶在其天然环境下(例如在表达聚合酶的非重组细胞中)掺入到多核苷酸中的那些核苷酸。特别有用的非天然核苷酸包括那些通过聚合酶以一种速率掺入到多核苷酸链中的那些非天然核苷酸,该速率显著快于或慢于另一种核苷酸(诸如具有与相同Watson-Crick互补碱基进行碱基配对的天然核苷酸)通过聚合酶掺入到链中的速率。例如,当与天然核苷酸的掺入速率相比时,非天然核苷酸可以至少2倍不同的速率掺入—例如,至少5倍不同、10倍不同、25倍不同、50倍不同、100倍不同、1000倍不同、10000倍不同或更多。将非天然核苷酸掺入到多核苷酸中后能够被进一步延伸。示例包括具有3'羟基的核苷酸类似物或在3'位置具有可逆终止子部分的核苷酸类似物,该核苷酸类似物可被移除以允许掺入了该核苷酸类似物的多核苷酸进一步延伸。可使用的可逆终止子部分的示例在例如美国专利第7,427,673号;第7,414,116号;和第7,057,026号以及PCT公布WO 91/06678和WO 07/123744中有所描述。应当理解,在一些示例中,具有3'终止子部分或缺乏3'羟基的核苷酸类似物(诸如双脱氧核苷酸类似物)可在已掺入核苷酸类似物的多核苷酸不被进一步延伸的条件下使用。在一些示例中,核苷酸可不包含可逆终止子部分,或该核苷酸将不包含不可逆终止子部分,或该核苷酸将根本不包含任何终止子部分。在5'位置具有修饰的核苷酸类似物也是可用的。
“引物”被定义为单链核酸序列(例如,单链DNA或单链RNA),其充当DNA或RNA合成的起点,或就固定化引物而言充当用于延伸测试引物的模板。可修饰用于附连到表面上的引物的5'末端,以允许其与表面上的官能化层或官能化聚合物层进行偶联反应。引物长度可以是任何数目的碱基长度并且可包括多种非天然核苷酸。在一个示例中,引物为短链,范围为20至40个碱基或10至20个碱基。
在一些示例中,固定化引物可直接附接到表面或基底或基底的官能化表面上。在其他示例中,可通过添加附接到表面或基底的聚合物和经由与此类聚合物的附接将固定化引物附接到表面或基底来对表面或基底进行进一步修饰。此类聚合物可以是无规、嵌段、直链和/或支链的共聚物,其包含两个或更多个以任意顺序或构型重复出现的单体单元,并且可以是直链、交联或支链的或它们的组合。在一个示例中,使用的聚合物可包括诸如聚(N-(5-叠氮基乙酰胺基戊基)丙烯酰胺-共-丙烯酰胺)(也称为PAZAM)的示例。在一个示例中,该聚合物可为杂聚物并且该杂聚物可包含丙烯酰胺单体,诸如
在一个示例中,聚合物为杂聚物并且还可包含含叠氮基的丙烯酰胺单体。在一些方面,该杂聚物包括:
在一些方面,该杂聚物可包括以下结构:
其中每个R
其中每个R
“杂聚物”是至少两种不同的重复亚基(单体)组成的大分子。“丙烯酰胺单体”是具有结构
在一些示例中,期望在如本文所公开的方法中测量一种或多种在基底上的可杂交的固定化引物以及聚合酶可及的固定化引物的量。图8A中简要描绘了此类方法的示例。此处示出了其3'末端从与其共价附接的表面朝远侧延伸的固定化引物。还示出了互补的与其杂交的测试引物。在该示例中,显示在测试引物的5'末端的一种荧光团(用深色星号表示)并且显示在测试引物的3'末端的另一种荧光团(用较浅色星号表示)。在该示例中,当在温育和杂交期间被添加到表面上时,测试引物具有5'端荧光团。此时,该方法类似于用于测量杂交可及的固定化引物的常规方法。通过测量与此类测试引物一起温育的表面发射出的荧光可确定杂交可及的固定引物,此类测试引物具有先前附接到其5'末端上的荧光团。
然而,此外,在该示例中,将测试引物-固定化引物对与聚合酶和具有附接的荧光团的核苷酸一起进一步温育,其中带荧光标签的核苷酸可通过聚合酶使用固定化引物作为模板附接到测试引物的3'末端上,如上所述。结果是图8A所示的测试引物-固定化引物对。此处,显示测试引物具有最初与其附接的5'端荧光团,以及通过聚合酶与其附接的3'端荧光团。通过测量第一荧光团的量,可确定存在于表面上的杂交可及的固定化引物的量。但是测量存在多少附接到3'最末端核苷酸上的荧光团(根据如上文所公开的示例),可确定聚合酶可及的固定化引物的量。通过在根据该示例的一个测定中组合两个测量值,可更有效地获得更多信息。在该示例中,通过聚合酶添加的5'端荧光团和3'端荧光团可检测为彼此不同。
上文所公开的示例包括其中固定化引物未被共价修饰的方法的示例。在例如具有固定化引物的基底旨在根据本文所公开的方法完成测定后使用,并且不需要对固定化引物进行共价修饰的情况下,此类示例可能特别有用。然而,在其他示例中,如本文所公开的方法可包括对固定化引物的共价修饰。图8B和图8C示出了三个此类示例。在图8B中,显示测试引物具有5'突出端,该突出端不仅可充当根据上述公开的测试引物在其3'末端延伸的模板,而且现在可充当固定化引物的在表面远侧的3'末端延伸的模板。在此类示例中,可设计测试引物和固定化引物使得可将可检测为不同的核苷酸掺入到每种引物的3'末端。
在另一个示例中,诸如图8C中所示,测试引物的5'末端可包含荧光标记的核苷酸。此类荧光标记的核苷酸可悬突于固定化引物从而充当其延伸的模板。在该示例中,使用测试引物的5'突出端作为模板而附接到测试引物的5'末端的荧光团和附接到添加到固定化引物的3'末端上的核苷酸的荧光团可检测为彼此不同。在一些示例中,这两种荧光团彼此接近可影响荧光输出。例如,根据荧光猝灭,可选择荧光团使得当荧光团彼此接近时,来自荧光团对中的任一个或两个荧光团的发射因为猝灭而减弱,当使用测试引物作为模板将标记的核苷酸添加到固定化引物的3'末端上时,可能发生这种情况。
在这种情况下,例如在3'端添加的荧光核苷酸淬灭了来自测试引物的5'端所附接的荧光团的荧光发射的情况下,从测试引物5'端的荧光团所发射的荧光的减少可被视为指示已将核苷酸(诸如通过聚合酶)添加到固定化引物的3'末端上。另选地,在测试引物去杂交时测得来自固定化引物的荧光发射增加可表明,聚合酶已催化将荧光核苷酸添加到固定化引物的3'末端上。另选地,可选择该示例中的荧光团来进行荧光共振能量转移,使得当它们彼此如此接近时,一个荧光团充当另一个荧光团的供体来激发荧光,当聚合酶催化将带荧光标签的核苷酸添加到固定化引物的3'末端上时,可能发生这种情况。在这种情况下,对荧光团之间发生荧光共振能量转移的发射特性的检测可表明,通过聚合酶已将核苷酸添加到固定化引物的3'末端上。另选地,在测试引物去杂交时失去此类发射可表明,通过聚合酶已将核苷酸添加到固定化引物上。包括检测由一对荧光核苷酸发射的组合荧光的检测荧光测试引物的量的示例包括其中检测包括检测猝灭或荧光共振能量转移的此类示例。
上述示例的其他变型、组合或修改也在本公开的范围内。上述示例旨在示出本公开的示例,但绝不旨在限制其范围。尽管本文已详细描绘和描述了示例,但显而易见的是,对于相关领域的技术人员在不脱离本公开的精神的情况下可以作出各种修改、添加、替换等,因此这些修改、添加、替换等被视为在本公开的范围内。
- 用于检测通过聚合酶而掺入核苷酸的方法
- 用于核苷酸类似物的改善的掺入的经修饰的聚合酶
