用于检测深海鱼油中掺杂异源油脂的引物探针、试剂盒及方法
文献发布时间:2023-06-19 12:18:04
技术领域
本发明涉及生物学检测技术领域,特别涉及一种用于检测深海鱼油中掺杂异源油脂的引物探针、试剂盒及方法。
背景技术
深海鱼油一般是指从大洋深处的硬骨鱼纲(Osteichthyes)鱼类提炼出来的不饱和脂肪酸Omega-3,其主要成分是EPA(二十碳五烯酸)和DHA(二十二碳六烯酸),是人体不可缺少的重要营养成分。近年来,深海鱼油在保健品市场异军突起,被视为调节血脂、软化血管、清理血管垃圾的必备品,年销售量在1亿瓶左右,年增长率高达30%。其中最优质的深海鱼油是来自北欧和法国大西洋海岸的大西洋鲑鱼(三文鱼)提炼而成。但国内深海鱼油产品存在的问题非常多,其中最严重的就是造假和掺杂。很多没用道德底线的厂商为了谋取暴利,大肆采用浅海或者部分非优质的鱼类作为原材料,粗制滥造地提取,然后打着深海鱼油的口号来获取较高的利润,甚至有的用猪皮、鸡皮进行提炼或者直接掺杂色拉油等植物油脂。这些产品的质量堪忧,危害大,肉眼难辨,将会为消费者的健康埋下了严重的隐患。
由此可见,面对国内庞大的鱼油保健品市场,深海鱼油的来源成分鉴定变得尤为重要。目前鱼油鉴定常用方法主要以色谱、光谱、质谱技术为主,但灵敏度不高,其他如核磁共振技术又存在着成本过高的问题。二基于实时荧光PCR以特定基因作为靶标的分子生物学技术可以针对多种成分的保守基因进行扩增,已经在食品深加工产品原材料痕量检测领域渐渐崭露头角,可以达到一次性识别多种复合油脂的高通量精准检测的目标。
公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
发明内容
本发明的目的在于提供一种用于检测深海鱼油中掺杂异源油脂的引物探针、试剂盒及方法,解决现有深海鱼油检测技术灵敏度、一次性识别多种混合油脂的技术问题。
本发明的另一个目的在于,建立三重实时荧光PCR稳定反应体系,针对海洋鱼类设计一重引物探针;针对三文鱼设计一重引物探针;针对油料植物设计一重引物探针。整体多重实时荧光PCR检测体系可以精准、快速、高通量对深海鱼油进行品质分级及掺假鉴定。
为实现上述目的,本发明提供了一种用于检测深海鱼油中掺杂异源油脂的引物探针,包括以下组合探针中的至少一种、两种或三种:
用于检测海洋鱼类成分的引物探针组1,所述引物探针组1包括引物1-2和探针1,其中,所述引物1-2的核苷酸序列分别如SEQ ID NO.1-2所示,所述探针1的核苷酸序列如SEQ ID NO.3所示;
用于检测三文鱼成分的引物探针组2,所述引物探针组2包括引物4-5和探针2,其中,所述引物4-5的核苷酸序列分别如SEQ ID NO.4-5所示,所述探针2的核苷酸序列如SEQID NO.6所示;
用于检测植物成分的引物探针组3,所述引物探针组3包括引物7-8和探针3,其中,所述引物7-8的核苷酸序列分别如SEQ ID NO.7-8所示,所述探针3的核苷酸序列如SEQ IDNO.9所示。
优选地,上述技术方案中,所述的用于检测深海鱼油中掺杂异源油脂的引物探针,所述探针1、所述探针2和所述探针3的5’端设有报告荧光基团,所述探针1、所述探针2和所述探针3的3’端设有淬灭荧光基团。
优选地,上述技术方案中,所述的用于检测深海鱼油中掺杂异源油脂的引物探针,所述探针1、探针2和探针3的5’端用报告荧光基团为FAM、Hex、Tet、Joe、Vic、Fite、Cy3和Cy5其中的一种标记;所述探针1、探针2和探针3的3’端用淬灭荧光基团MGBNFQ、Tamra、Rox、Dabcy、Bhq1和Bhq2其中的一种标记。
优选地,上述技术方案中,所述的用于检测深海鱼油中掺杂异源油脂的引物探针,各引物应用于PCR反应中的终浓度为0.6umol/L;各探针应用于PCR反应中的终浓度为0.2umol/L。
一种上述引物探针在检测深海鱼油中掺杂异源油酯的应用。
一种上述引物探针在制备检测深海鱼油中掺杂异源油酯的试剂或试剂盒中的应用。
一种用于检测深海鱼油中掺杂异源油脂的试剂盒,所述试剂盒上述的引物探针。
优选地,上述技术方案中,所述用于检测深海鱼油中掺杂异源油脂的试剂盒,所述试剂盒还包括荧光定量PCR反应的其他试剂。
优选地,上述技术方案中,所述用于检测深海鱼油中掺杂异源油脂的试剂盒,所述试剂盒还包括阳性对照、阴性对照、空白对照;所述阳性对照为以三文鱼和植物作为样本DNA,用权利要求1所述的引物进行扩增,并用权利要求1所述的探针检测混合的DNA片段或基因组,DNA的浓度为≥5ng/μl,小于等于100ng/μl;所述阴性对照为以非海洋鱼类及植物源性DNA或双蒸水;所述空白对照包括两个,一为DNA提取后承载DNA介质的空白对照,二是PCR反应过程中的双蒸水空白对照。
一种检测深海鱼油中掺杂异源油脂的方法,包括以下步骤:
(1)从鱼油中提取DNA;
(2)以18SrRNA作为内参基因,进行扩增;
(3)采用上述用于检测深海鱼油中掺杂异源油脂的试剂盒构建反应体系,反应条件为:50℃预热20-40min;95℃变性5-15min;95℃10-20s、58℃0.5-2min,共45个循环;收集荧光信号,反应完成后,根据扩增循环数进行鱼油转基因成分,分析反应结果。
优选地,上述技术方案中,所述检测深海鱼油中掺杂异源油酯的方法,结果判定的条件包括:
①质控标准:阳性对照的FAM、VIC、HEX荧光信号有荧光对数增长,且Ct值≤30.0;阴性对照和空白对照无荧光对数增长或Ct值≥40.0;
②阳性样品:当①成立时,FAM或/和VIC或/和HEX有荧光对数增长,且Ct值≤35.0,表明该样品检出海洋鱼类成分或/和三文鱼成分或/和植物成分;
③阴性样品:当①成立时,FAM或/和VIC或/和HEX无荧光对数增长,Ct值≥40.0,表明该样品未检出海洋鱼类成分或/和三文鱼成分或/和植物成分;
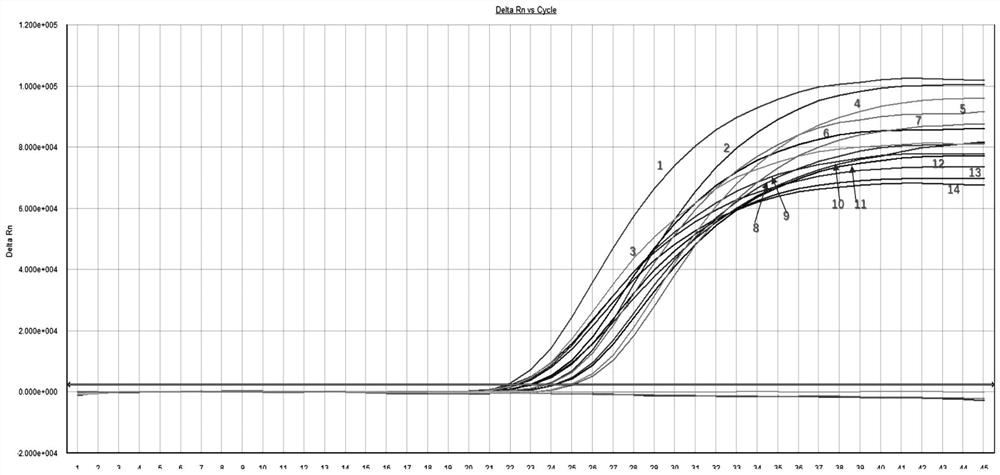
④疑似样品:当①成立时,FAM或/和VIC或/和HEX有荧光对数增长,且35.0 本发明用于检测深海鱼油中掺杂异源油脂的引物探针、试剂盒及方法的工作原理是: 本发明所用TaqMan荧光探针是一种寡核苷酸探针,荧光基团连接在探针的5’末端,而淬灭剂则在3’末端。PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5'-3'外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。通过这种方法,就能够检测到样品中是否有海洋鱼类成分或/和三文鱼或/和油料植物成分。 与现有技术相比,本发明具有如下有益效果: (1)本发明用于检测深海鱼油中掺杂异源油脂的引物探针,应用于制备试剂盒,并用于检测以鉴定深海鱼油中是否掺杂异源油脂。相对于多重PCR方法具有高特异性和精确性、检测时间更短、产生有毒有害物质更少的优点;相对荧光PCR方法具有同时检测多个靶标基因、节约试剂成本的优点;相对普通PCR方法,兼具上述两种优点。 (2)本发明的方法,建立三重实时荧光PCR稳定反应体系,针对海洋鱼类设计一重引物探针;针对三文鱼设计一重引物探针;针对油料植物设计一重引物探针。整体多重实时荧光PCR检测体系可以精准、快速、高通量对深海鱼油进行品质分级及掺假鉴定,其中:第一,可有效识别商品鱼油是否为海洋鱼类油脂;第二,可有效识别商品鱼油是否为三文鱼油脂;第三,可同时有效识别商品鱼油里掺杂0.01%浓度的大豆油、0.1%浓度的菜籽油、0.01%浓度的玉米油、0.01%浓度的棕榈油、0.1%浓度的色拉油;第四,可间接识别商品鱼油不含任何海洋鱼类油脂和植物油脂。 附图说明 图1是以鸡、鸭、猪、牛、羊、草鱼(淡水鱼)、青鱼(淡水鱼)、鲢鱼(淡水鱼)、鳙鱼(淡水鱼)、鳕鱼(海鱼)、三文鱼(海鱼)11个种类来源DNA为模板、18SrRNA为内参,进行三重实时荧光PCR扩增体系特异性检测实时荧光PCR图; 图中标识:1、横坐标Cycle Number-扩增循环数;2;纵坐标Delta Rn-荧光强度;3、18SrRNA荧光扩增信号:①-鸡、②-鸭、③-猪、④-牛、⑤-羊、⑥-草鱼(淡水鱼)、⑦-青鱼(淡水鱼)、⑧-鲢鱼(淡水鱼)、⑨-鳙鱼(淡水鱼)、⑩-鳕鱼(海鱼)、 图2是三文鱼+大豆DNA样本;三文鱼+油菜DNA样本;三文鱼+玉米DNA样本;三文鱼+棕榈DNA样品进行三重实时荧光PCR扩增体系特异性检测实时荧光PCR图; 图中标识:1、横坐标Cycle Number-扩增循环数;2;纵坐标Delta Rn-荧光强度;3、三文鱼荧光扩增信号:①-④-四个混合样本中三文鱼DNA;4、海洋鱼类荧光扩增信号:⑧⑨ 图3是实施例1,验证海洋鱼类、三文鱼、植物三重实时荧光PCR扩增体系在动植物油脂中的特异性检测实时荧光PCR图; 图中标识:1、横坐标Cycle Number-扩增循环数;2;纵坐标Delta Rn-荧光强度;3、18SrRNA荧光扩增信号:①-三文鱼(海鱼)油、②-鸡油、⑤-鸭油、⑥-猪油、⑦-牛油、⑧-羊油、⑨-鳕鱼(海鱼)油、 图4是实施例2,样本1-5,进行三重实时荧光PCR扩增体系特异性检测实时荧光PCR图; 图中标识:1、横坐标Cycle Number-扩增循环数;2;纵坐标Delta Rn-荧光强度;3、三文鱼荧光信号:①-样本1、②-样本2、③-样本3、④-样本4;4、海洋鱼类荧光扩增信号:⑤-样本1、⑥-样本2、⑦-样本3、⑧-样本4;5、植物荧光扩增信号:⑨-样本5、⑩-样本4、 图5是实施例2,样本6-10,进行三重实时荧光PCR扩增体系特异性检测实时荧光PCR图; 图中标识:1、横坐标Cycle Number-扩增循环数;2;纵坐标Delta Rn-荧光强度;3、三文鱼荧光信号:①-样本6、②-样本7、③-样本8、④-样本9;4、海洋鱼类荧光扩增信号:⑤-样本6、⑥-样本7、⑦-样本8、⑧-样本9;5、植物荧光扩增信号:⑨-样本10、⑩-样本9、 图6是实施例2,样本11-15,进行三重实时荧光PCR扩增体系特异性检测实时荧光PCR图; 图中标识:1、横坐标Cycle Number-扩增循环数;2;纵坐标Delta Rn-荧光强度;3、三文鱼荧光信号:①-样本11、②-样本12、③-样本13、④-样本14;4、海洋鱼类荧光扩增信号:⑤-样本11、⑥-样本12、⑦-样本13、⑧-样本14;5、植物荧光扩增信号:⑨-样本15、⑩-样本14、 图7是实施例2,样本16-20,进行三重实时荧光PCR扩增体系特异性检测实时荧光PCR图; 图中标识:1、横坐标Cycle Number-扩增循环数;2;纵坐标Delta Rn-荧光强度;3、三文鱼荧光信号:①-样本16、②-样本17、③-样本18、④-样本19;4、海洋鱼类荧光扩增信号:⑤-样本16、⑥-样本17、⑦-样本18、⑧-样本19;5、植物荧光扩增信号:⑨-样本20、⑩-样本19、 图8是实施例2,样本21-25,进行三重实时荧光PCR扩增体系特异性检测实时荧光PCR图; 图中标识:1、横坐标Cycle Number-扩增循环数;2;纵坐标Delta Rn-荧光强度;3、三文鱼荧光信号:①-样本21、②-样本22、③-样本23、④-样本24;4、海洋鱼类荧光扩增信号:⑤-样本21、⑥-样本22、⑦-样本23、⑧-样本24;5、植物荧光扩增信号:⑨-样本25、⑩-样本23、 具体实施方式 下面结合附图,对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。 除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。 检测深海鱼油中掺杂异源油脂的方法 本发明的方法包括油酯DNA提取、引物探针设计、PCR检测体系建立、PCR扩增产物的检测,结果判定和实际盒组成。具体包括以下步骤: 一、鱼油(可能含有其他源性油酯)DNA提取 (1)将100mL样品(约220-250粒成品包装鱼油),110mL正己烷加入灭菌洁净容器中磁力搅拌混匀3.5h,转子速度不宜过快,防止起泡; (2)向其中加入85mL 5%CTAB(5%CTAB,0.8M NaCl,50mM Trise HCl,1mM EDTA),磁力搅拌3h; (3)12000g,4℃离心15min; (4)将水相转移到灭菌洁净50mL管中,12000g离心10分钟,然后将水相转移到一个新的灭菌洁净50mL管中。 (5)将样品与等体积异丙醇、1/10体积NaAc(3M;PH5.2)和千分之一体积酵母tRNA(10mg/mL),-20℃过夜; (6)转移到2ml离心管,15000g 4℃离心25min,弃上清。 (7)每个2ml离心管加入预热的900ul TE(10mM Tris-HCl 1mM EDTA PH8.0)以及等体积加入苯酚/氯仿/异淀粉(25:24:1) (8)12000g,4℃离心10min,接着,将800ul左右上清液转移到新管中,并添加等体积异丙醇、1/10体积NaAc(3M;PH5.2)。-20℃,2-3h; (9)15000g 4℃离心25min。丢弃上清液,并用1ml 70%乙醇洗涤残余物2min,仅清洗一遍; (10)15000g 4℃离心10min,去除乙醇,并在室温下,超净工作台干燥。 (11)用60ul TE溶液溶解沉淀。并放置于-20℃保存。 二、引物和探针设计 本发明选择海洋鱼类12s rRNA基因、三文鱼COI线粒体保守序列以及植物(大豆、油菜、玉米、棕榈等)trnl基因进行序列分析及比对,并对引物、探针的2级结构等影响多重反应因素进行综合考虑,运用设计软件用Primer5.0获得一些候选引物,根据各组引物探针的评价结果,选择最优组合,最后筛选出3对针对海洋鱼类、三文鱼、植物的实时荧光检测的PCR引物和TaqMan探针。引物探针1为海洋鱼类,引物探针组2为三文鱼,引物探针组3为植物类。如表1所示。 表1 3对引物和探针核苷酸序列表
引物设计参照序列,所述引物预扩增片段序列为: 海洋鱼类预扩增序列长度84bp,海洋鱼类模板序列如下: {AAGAGGGCCGGTAAAACTCGTGCCAGCCACCGCGGTTATACGAGAGGCCCXAXTTGATXXXXAXCGGCGTAAAGXGTGGTTAXG} 三文鱼预扩增序列长度115bp,三文鱼模板序列如下: {TGAGCTGTATTAGTCACTGCCGTCCTTTTATTACTCTCCCTCCCTGTTCTAGCAGCAGGCATTACCATACTACTTACAGACCGAAATCTA AATACCACTTTCTTTGACCC GGCAG} 植物预扩增序列长度88bp {ATTGAGCCTTGGTATGGAAACCTXCTAAGTGXTAACTTXCAAATTCAGAG AAACCCTGGAATXAAXAATG GGCAATCCTG AGCCAAAT} 所述的探针5’端用报告荧光基团FAM、Hex、Tet、Joe、Vic、Fite、Cy3和Cy5其中的一种标记,3’端用淬灭荧光基团MGBNFQ、Tamra、Rox、Dabcy、Bhq1和Bhq2其中的一种标记。 三、多重实时荧光PCR反应体系建立 反应体系配置,每个待检测标本反应液的组成如表2所示。 表2反应体系组分表
四、多重实时荧光PCR反应程序 实时荧光PCR反应条件为50℃预热30min;95℃变性10min;95℃15s、58℃1min,共45个循环。在实时荧光PCR仪上设置测探针的荧光标记信号。反应完成后,分析反应结果。 五、结果判定条件 按判定条件进行结果判定;所述判定条件包括: ①质控标准:阳性对照的FAM、VIC、HEX荧光信号有荧光对数增长,且Ct值≤30.0;阴性对照和空白对照无荧光对数增长或Ct值≥40.0。 ②阳性样品:当①成立时,FAM或/和VIC或/和HEX有荧光对数增长,且Ct值≤35.0,表明该样品检出海洋鱼类成分或/和三文鱼成分或/和植物成分。 ③阴性样品:当①成立时,FAM或/和VIC或/和HEX无荧光对数增长,Ct值≥40.0,表明该样品未检出海洋鱼类成分或/和三文鱼成分或/和植物成分。 ④疑似样品:当①成立时,FAM或/和VIC或/和HEX有荧光对数增长,且35.0 六、PCR扩增产物的检测 三重实时荧光PCR扩增体系特异性检测: ①以鸡、鸭、猪、牛、羊、草鱼(淡水鱼)、青鱼(淡水鱼)、鲢鱼(淡水鱼)、鳙鱼(淡水鱼)、鳕鱼(海鱼)、三文鱼(海鱼)11个种类来源DNA为模板、18SrRNA为内参,进行三重实时荧光PCR扩增体系特异性检测。 检测结果如图1所示,11个种类来源DNA,18SrRNA内参均有扩增信号;三重实时荧光引物探针在鸡、鸭、猪、牛、羊、草鱼(淡水鱼)、青鱼(淡水鱼)、鲢鱼(淡水鱼)、鳙鱼(淡水鱼)源性DNA样本上没有扩增信号;鳕鱼源性DNA样本,在三重实时荧光引物探针中的海洋鱼类出现特异性扩增信号;三文鱼源性DNA样本,在三重实时荧光引物探针中的海洋鱼类和三文鱼均出现特异性扩增信号。 ②以三文鱼+大豆DNA样本;三文鱼+油菜DNA样本;三文鱼+玉米DNA样本;三文鱼+棕榈DNA样品进行三重实时荧光PCR扩增体系特异性检测; 检测结果如图2所示,三重特异性引物探针可同时在海洋鱼类、三文鱼、以及植物DNA样品上有扩增信号,同时互相没有交叉反应。 七、试剂盒成分构成 上述海洋鱼类、三文鱼、油料植物三重荧光PCR试剂盒成分如下所示: ①引物溶液:包括序列SEQ ID NO.1、SEQ ID NO.2、SEQ ID NO.4、SEQ ID NO.5、SEQ ID NO.7、SEQ ID NO.8所示引物,浓度均为20μmol/L,使用1.5mLEP管封装; ②探针溶液:包括序列SEQ ID NO.3、SEQ ID NO.6、SEQ ID NO.9所示探针,浓度均为10μmol/L,使用1.5mL棕色不透光1.5mLEP管封装; ③实时荧光PCR缓冲液(包含酶、dNTP、Mg2+):已验证的可稳定适配三重荧光PCR引物体系的试剂套装(外购),主要包括预混液、ROX、ddH2O;上述反应液配制参照“(2)多重实时荧光PCR反应体系建立”所述 注1:当荧光PCR仪器需要ROX染料校准时加入相应浓度,否则不应添加,具体要求见荧光PCR仪说明书。 试剂盒在选用适于三重荧光PCR引物体系的外购的试剂套装时,选择带热敏Taq抗体的型号,抑制低温条件下由引物的非特异性退火或引物二聚体引起的非特异性扩增,延长试剂盒保存时间、允许更多的冻融次数;外购的试剂套装中包括ROX染料,对于需要ROX染料的多重荧光PCR仪可提升检测准确性。 注2:阳性对照:考虑①本发明为定性检测,并非定量检测,对阳性质控要求不高;②三文鱼以及大豆、油菜等植物样本DNA,很容易在市面上得到;③阳性质控涉及到均匀度和稳定度的测试,试剂盒的制作成本会较大幅度提升。综上,客户需自备阳性质控,仅需要将三文鱼和植物的DNA浓度控制在5ng以上,100ng以内,即可作为本试剂盒阳性质控。 阴性对照:为非海洋鱼类及植物源性DNA或双蒸水,空白对照分为两个,一为DNA提取后承载DNA介质的空白对照,二是PCR反应过程中的双蒸水空白对照。 注3:方法检测还涉及18SrRNA基因的扩增,参照“SN/T 1204-2016植物及其加工产品中转基因成分实时荧光PCR定性检验方法”中的序列,用户自行合成即可。 本发明方法的工作原理如下: 本发明所用TaqMan荧光探针是一种寡核苷酸探针,荧光基团连接在探针的5’末端,而淬灭剂则在3’末端。PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5'-3'外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。通过这种方法,就能够检测到样品中是否有海洋鱼类成分或/和三文鱼或/和油料植物成分。 实施例1 本实施例为验证海洋鱼类、三文鱼、植物三重实时荧光PCR扩增体系在动植物油脂中的特异性检测 1、多途径分别从菜市场、超市、网上购置鸡、鸭、猪、牛、羊、草鱼(淡水鱼)、鲢鱼(淡水鱼)、鳙鱼(淡水鱼)来源的油脂各100ml;色拉油100ml;从实体专卖店和网上购置原料为鳕鱼的深海鱼油正品100ml约230粒、原料为三文鱼的深海鱼油正品100ml约200粒。 2、分别按照步骤一所述鱼油(可能含有其他源性油酯)DNA提取的方法提取11个样本DNA,并与-20℃保存。 3、引物探针溶液为上述的试剂盒主要成分,并以18SrRNA和本发明设计多重实时荧光PCR检测体系扩增11种样本DNA;阴性对照均为TE缓冲液,空白对照均为双蒸水。PCR反应体系为参照步骤三所述的多重实时荧光PCR反应体系建立;实时荧光PCR反应条件参照步骤四所述的多重实时荧光PCR反应程序上机检测。其中,ABI荧光PCR仪,型号为7500。 4、检测结果如图3所示。 ①所有样本在18SrRNA基因上都有扩增信号,且Ct值≤35.0,证明油脂DNA提取方法有效 ②深海鱼油(鳕鱼)和深海鱼油(三文鱼)样本,FAM有荧光对数增长,且Ct值≤35.0,表明该两种样品检出海洋鱼类的DNA。 ③深海鱼油(三文鱼)样本,VIC有荧光对数增长,且Ct值≤35.0,表明该样品检出三文鱼的DNA。 ④色拉油样本,HEX有荧光对数增长,且Ct值≤35.0,表明该样品检出植物的DNA。 实施例2 本实施例为验证海洋鱼类、三文鱼、植物三重实时荧光PCR扩增体系在三文鱼油掺杂植物油脂后的特异性检测 1、与实施例1相同购买渠道购置相关油脂。 样本制备1-5:三文鱼油脂样品中分别以体积比0.01%、0.1%、1%、10%、100%比例掺入大豆油,终体积100ml。 样本制备6-10:三文鱼油脂样品中分别以体积比0.01%、0.1%、1%、10%、100%比例掺入菜籽油,终体积100ml。 样本制备11-15:三文鱼油脂样品中分别以体积比0.01%、0.1%、1%、10%、100%比例掺入棕榈油,终体积100ml。 样本制备16-20:三文鱼油脂样品中分别以体积比0.01%、0.1%、1%、10%、100%比例掺入玉米油,终体积100ml。 样本制备21-25:三文鱼油脂样品中分别以体积比0.01%、0.1%、1%、10%、100%比例掺入色拉油,终体积100ml。 2、分别按照步骤一所述鱼油(可能含有其他源性油酯)DNA提取的方法提取25个样本DNA,并于-20℃保存。 3、引物探针溶液为上述的试剂盒主要成分,并以本发明设计多重实时荧光PCR检测体系扩增25种样本DNA;阴性对照均为TE缓冲液,空白对照均为双蒸水。PCR反应体系为参照步骤三所述的多重实时荧光PCR反应体系建立;实时荧光PCR反应条件参照步骤四所述的多重实时荧光PCR反应程序上机检测。其中,ABI荧光PCR仪,型号为7500。 检测结果从图4-8可见: 如图4所示:样本1-5,HEX均有荧光对数增长,其中样本1(35.0 如图5所示:样本6-10,HEX均有荧光对数增长,其中样本6(Ct值≥40),样品7-8(35.0 如图6所示:样本11-15,HEX均有荧光对数增长,其中样本11-12(35.0 如图7所示:样本16-20,HEX均有荧光对数增长,其中样本16-17(35.0 如图8所示:样本22-25,HEX均有荧光对数增长,其中样本22-24(35.0 根据步骤五的条件判定,由于本实施列为多次实验的稳定结果,故Ct值在35.0与40.0之间的扩增结果不再二次验证。该实施例表明,本发明设计的三重实时荧光PCR检测体系可同时有效识别商品鱼油里掺杂0.01%浓度的大豆油、0.1%浓度的菜籽油、0.01%浓度的玉米油、0.01%浓度的棕榈油、0.1%浓度的色拉油。 前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。 序列表 <110> 南宁海关技术中心 <120> 用于检测深海鱼油中掺杂异源油脂的引物探针、试剂盒及方法 <141> 2021-07-13 <160> 9 <170> SIPOSequenceListing 1.0 <210> 1 <211> 20 <212> DNA <213> 人工序列(Artificial Sequence) <400> 1 aagagggccg gtaaaactcg 20 <210> 2 <211> 20 <212> DNA <213> 人工序列(Artificial Sequence) <400> 2 cdtaaccack ctttacgccg 20 <210> 3 <211> 21 <212> DNA <213> 人工序列(Artificial Sequence) <400> 3 agccaccgcg gttatacgag a 21 <210> 4 <211> 22 <212> DNA <213> 人工序列(Artificial Sequence) <400> 4 tgagctgtat tagtcactgc cg 22 <210> 5 <211> 20 <212> DNA <213> 人工序列(Artificial Sequence) <400> 5 ctgccgggtc aaagaaagtg 20 <210> 6 <211> 22 <212> DNA <213> 人工序列(Artificial Sequence) <400> 6 cctccctgtt ctagcagcag gc 22 <210> 7 <211> 21 <212> DNA <213> 人工序列(Artificial Sequence) <400> 7 attgagcctt ggtatggaaa c 21 <210> 8 <211> 22 <212> DNA <213> 人工序列(Artificial Sequence) <400> 8 gatttggctc aggattgccc at 22 <210> 9 <211> 23 <212> DNA <213> 人工序列(Artificial Sequence) <400> 9 caaattcaga gaaaccctgg aat 23
- 用于检测深海鱼油中掺杂异源油脂的引物探针、试剂盒及方法
- 用于检测深海鱼油中掺杂异源油脂的引物探针、试剂盒及方法
